-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diferenciální diagnostika nenádorových onemocnění žaludku
Pattern-based approach to gastritis and gastropathy
Histological investigation of non-neoplastic endoscopic biopsies of gastric mucosa is one of the most common tasks most pathologists have to face on daily basis. Although the most common clinical question is still being whether Helicobacter organisms are found, pathologists have to bear in mind the whole spectrum of causes and associated morphological patterns of gastritides and gastropathies, governed by characteristic combinations of various types of inflammatory infiltrate, alterative and reactive changes of epithelial component, vascular response, and variability of stromal composition. The association of histopathologic pattern with supposed etiology can be sometimes proved by direct detection of the cause of morphologic changes in the investigated endoscopic sample.
Keywords:
endoscopy – Biopsy – Stomach – Gastritis – gastropathy – pattern
Autori: Ondřej Daum 1,2
; Magdaléna Daumová 1,2; Marián Švajdler 1,2
Pôsobisko autorov: Šiklův ústav patologie LF UK a FN Plzeň 1; Bioptická laboratoř s. r. o., Plzeň 2
Vyšlo v časopise: Čes.-slov. Patol., 58, 2022, No. 2, p. 77-87
Kategória: Přehledový článek
Súhrn
Histologické vyšetření nenádorových biopsií žaludku patří mezi rutinní činnosti patologa. Většinu těchto biopsií představují gastritidy a gastropatie. Ačkoli základním klinickým požadavkem je dosud v těchto případech potvrzení či vyloučení přítomnosti helicobacterové infekce, patolog musí mít na paměti celé spektrum příčin a asociovaných morfologických obrazů. Ty sestávají z kombinací zánětlivé infiltrace různého charakteru, alterace a reaktivních změn epitelové komponenty, odpovědi vaskulárního aparátu a odlišností ve složení slizničního stromatu. Asociaci histopatologického obrazu s předpokládanou příčinou změn lze někdy podpořit i přímým průkazem etiologického agens ve vyšetřovaném endoskopickém vzorku.
Klíčová slova:
endoskopie – Biopsie – žaludek – gastritida – gastropatie – histologický obraz
PRAKTICKÝ PŘÍSTUP K HODNOCENÍ NENÁDOROVÝCH BIOPSIÍ ŽALUDKU
Základem mikroskopického vyšetření endoskopických biopsií žaludeční sliznice je (jako ostatně v celé histopatologické diagnostice) postupné „ponořování se“ do vzorku, od malého zvětšení, informujícího nás o hrubých abnormalitách sliznice a jejich fokální nebo difúzní distribuci, po střední až velké zvětšení, které umožňuje analyzovat typ zánětlivého infiltrátu, jeho topiku, poškození a reaktivní změny epitelu, depozici různých substancí ve sliznici, případně i detekovat příčinu změn (obr. 1).
Obr. 1. Přístup k hodnocení nenádorových biopsií žaludku 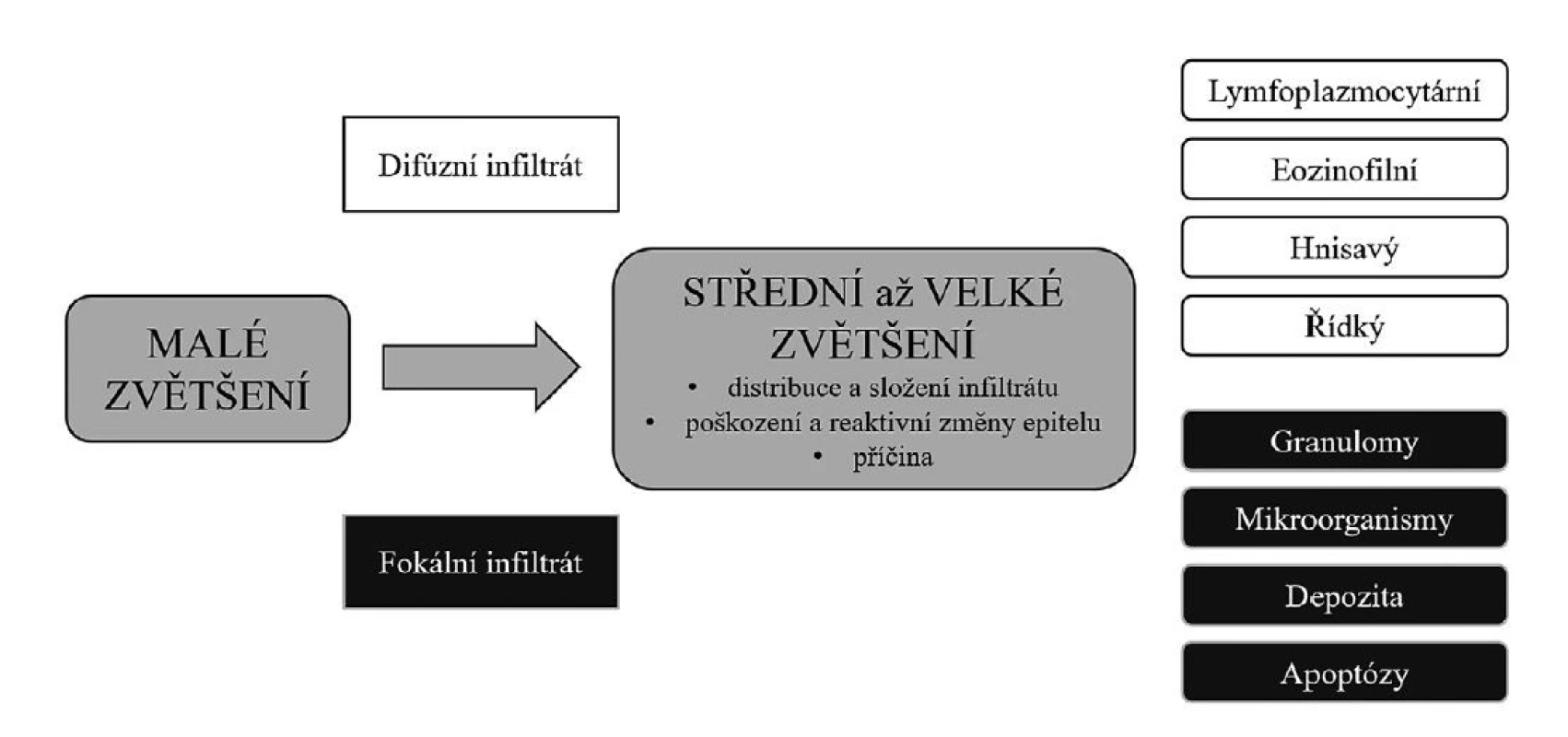
Malé zvětšení v prvé řadě slouží k přehlednému srovnání vzhledu jednotlivých endoskopických vzorků, je-li jich více v jednom preparátu. V jednotlivých vzorcích potom lze hodnotit především absenci/přítomnost zánětlivého infiltrátu a jeho difúzní či fokální distribuci, případně i hrubé narušení architektury (těžká atrofie, eroze/vředy).
Střední až velké zvětšení pak umožňuje jednak specifikovat typ infiltrátu podle jeho složení, blíže určit jeho lokalizaci ve sliznici (povrchový, hluboký), dále hodnotit morfologické změny epitelu svědčící pro jeho poškození (oploštění epitelových buněk a deplece mucinu) nebo reaktivní změny. V některých případech může být mikroskopicky zastiženo i etiologické agens.Jedním z nejdůležitějších znaků hodnocených při vyšetřování nenádorových endoskopických biopsií žaludku je zánětlivý infiltrát. Kromě prosté konstatace přítomnosti / absence zánětlivé infiltrace má význam její distribuce v rámci vyšetřovaného vzorku (fokální / difúzní), vertikální lokalizace (superficiální / hluboká) a buněčné složení infiltrátu.
1. DOMINUJÍCÍ LYMFOPLAZMOCYTÁRNÍ INFILTRÁT
a. Difúzní lymfoplazmocytární zánětlivý infiltrát
Jedná se o nejčastější typ zánětlivého infiltrátu u gastritid. Často bývá doprovázen další minoritní buněčnou komponentou, která může blíže poukazovat na pravděpodobnou etiologii zánětu.
Helicobacterová gastritida
Prototypem gastritidy s dominujícím lymfoplazmocelulárním infiltrátem je helicobacterová gastritida. Jejím charakteristickým histologickým obrazem bývá antrální superficiální aktivní chronická gastritida, často s tvorbou lymfoidních foliklů v hlubší vrstvě sliznice. Přítomnost plazmatických buněk je znakem chronicity zánětu, příměs neutrofilních granulocytů je markerem jeho aktivity (obr. 2). Vzhledem k tomu, že jde o obecně dobře známý typ gastritidy popsaný v mnoha obecných literárních zdrojích, včetně současné celostátní učebnice (1), zaměříme se v dalším textu pouze na diagnostická úskalí a sporné otázky týkající se diagnostiky a managementu helicobacterové gastritidy.
Obr. 2. Helicobacterová gastritida 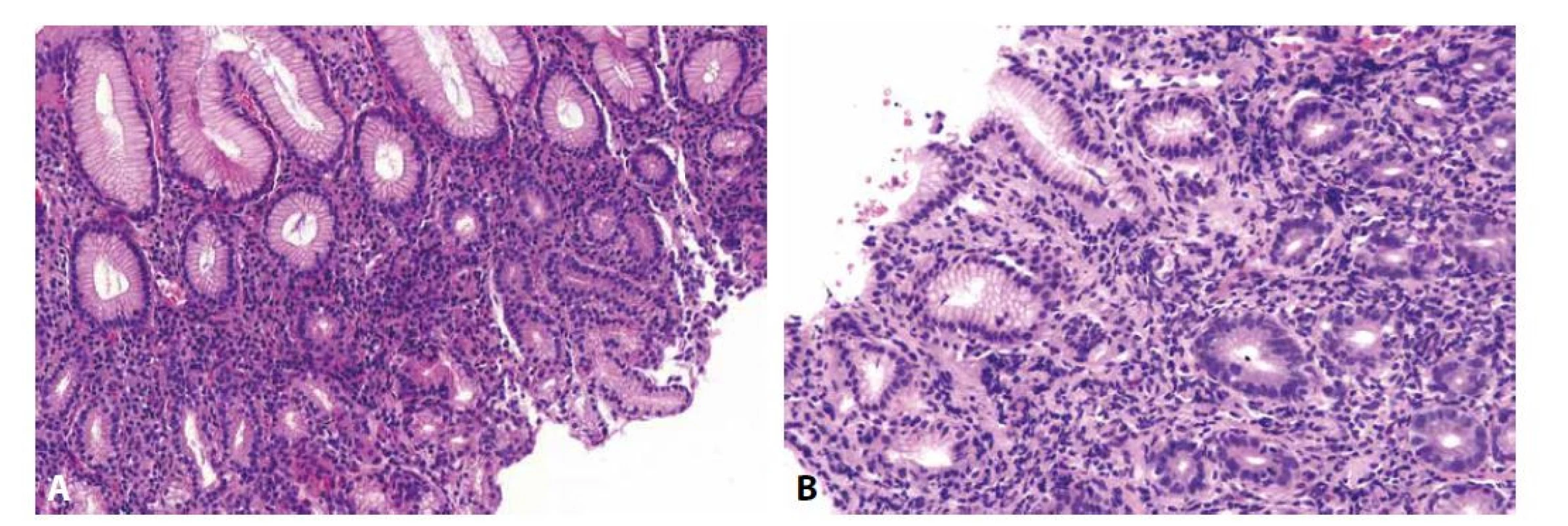
Difúzní lymfoplazmocytární zánětlivá celulizace proprie (A; HE, 100x) s příměsí neutrofilů patrnou ve větším zvětšení zejména v zóně krčků (B; HE, 200x). Negativní průkaz Helicobactera v terénu „histologicky jasného obrazu helicobacterové gastritidy“ může mít (v případě „skutečné“ helicobacterové gastritidy) několik příčin. V prvé řadě je nutné vyloučit možnost selhání použité barvící techniky. Podobně jako tento „staining error“ může být příčinou falešné negativity i „sampling error“. Kolonizace sliznice Helicobacterem samozřejmě nemusí být kontinuálně difúzní, což při běžné gastroenterologické praxi odběru jediného vzorku během gastroskopie snižuje pravděpodobnost jeho detekce (2,3). V okolí erozí a ulcerací, podobně jako v případech, kdy je již onemocnění ve fázi atrofie a intestinální metaplazie sliznice, je v postižených oblastech absence Helicobactera běžná, jelikož takto alterovaná sliznice pro něj představuje nepříznivé mikroprostředí a vede k jeho migraci do zachovalejších oblastí antrální sliznice, případně i do těla a fundu žaludku, které jsou gastroenterology bohužel při biopsii často opomíjeny. Podobný efekt má za následek užívání inhibitorů protonové pumpy (PPI), které je v naší populaci velmi rozšířené. Vzestup pH žaludeční šťávy způsobený užíváním PPI taktéž vede k „úniku Helicobactera z nehostinného prostředí“ antra do oxyntické žaludeční sliznice, kde je žaludeční šťáva kyselejší. Při těžké hypochlorhydrii Helicobacter mnohdy vstupuje i do kanalikulárního systému parietálních buněk (4-7). A konečně může být příčinou „neviditelnosti“ Helicobactera i antibiotická terapie. Kromě toho, že jde samozřejmě o požadovaný efekt terapie helicobacterové gastritidy, může jít i o následek užívání antibiotik z jiného důvodu, při němž představuje redukce populace Helicobactera vedlejší účinek (navíc z hlediska patologa neočekávaný, protože informace o antibiotické terapii nesouvisející s léčbou helicobacterové gastritidy na žádance pravidelně chybí). Spirálovité druhy Helicobactera (tedy Helicobacter heilmannii, Helicobacter felis, Helicobacter bizzozeronii, Helicobacter salomonis a Helicobacter suis, které jsou navzájem morfologicky neodlišitelné, a proto souhrnně označované jako Helicobacter heilmannii sensu lato), tvořené spirálovitými tyčkami přibližně dvakrát delšími než Helicobacter pylori (obr. 3), mohou i přes typicky mírnější obraz gastritidy způsobovat stejné spektrum komplikací jako HP-asociovaná gastritida, nicméně jejich distribuce bývá řidší a častěji fokální, což opět může vést k falešné negativitě jejich detekce (8,9).
Obr. 3. Helicobacter pylori a Helicobacter heilmannii 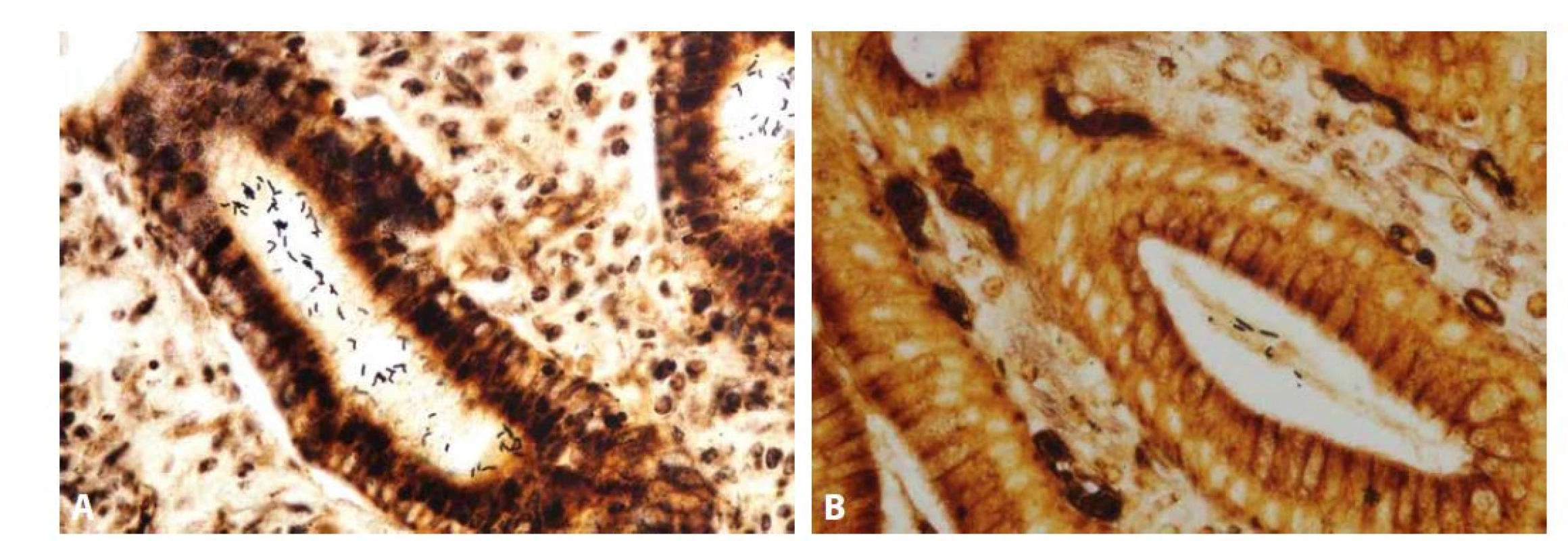
Helicobacter pylori je tvořen dvěma tyčkami stýkajícími se v tupém úhlu, což mu dodává tvar letícího racka (A; Warthin-Starry, 400x), zatímco Helicobacter heilmannii je tvořen jednou nezaúhlenou tyčkou asi dvojnásobné délky než Helicobacter pylori, s patrným spirálovitým vinutím ve velkém zvětšení (B; Warthin-Starry, 400x). Mandatornost detekce Helicobactera je konfliktním tématem jak mezi gastroenterology a patology, tak mezi různými regiony. Přestože prestižní Společnost gastrointestinální patologie Rodgera C. Haggitta doporučuje aplikaci speciálních barvení pouze v případech s odpovídajícím histologickým (zejména přítomnost gastritidy nebo suspektní průkaz Helicobactera již v základním barvení) a/nebo klinickým kontextem, na mnoha pracovištích se tato barvení provádějí rutinně na všechny žaludeční biopsie, a to často v důsledku tlaku gastroenterologů (10-13). Představa o nutnosti univerzálního reflexního „barvení na HP“, založená na tezi „Mrtvý Helicobacter – dobrý Helicobacter“ přežívající z minulého století, totiž naráží nejen na zvýšené pracovní zatížení a navýšení provozních nákladů laboratoře, ale i na moderní poznatky evoluční biologie. Ačkoli infekce Helicobacterem postihuje asi polovinu světové populace, naprostá většina jeho nositelů je asymptomatická. Tento fakt, v asociaci s dokumentací velmi dlouhého soužití lidského rodu s rodem Helicobacter, svědčí pro možnost symbiózy mezi bakterií a jejím hostitelem. Přínosem tohoto soužití by pro hostitele mohla být transformace žaludku v imunitní orgán (což se v očích patologa manifestuje jako MALT, „mucosa-associated lymphoid tissue“), který se podílí na celkové modulaci funkce imunitního systému a udržování střevního mikrobiomu (14). Tuto tezi podporují studie dokumentující inverzní asociaci infekce HP s eozinofilní ezofagitidou (15,16), gastroezofageálním refluxem (17-20), idiopatickým střevním zánětem (ISZ; „inflammatory bowel disease“, IBD) (21-24), ale i s bronchiálním astmatem (25). Klinicky závažné formy infekce Helicobacterem jsou pravděpodobně důsledkem „genetického nesouladu“ mezi ním a jeho hostitelem, např. v případě infekce typem Helicobactera fylogeneticky náležejícím k jiné lidské komunitě geneticky příbuzných jedinců (26). Je tedy možné, že z širšího epidemiologického hlediska převažují výhody symbiózy s Helicobacterem nad cíli snah o jeho globální eradikaci.
Multiparametrické semikvantitativní hodnocení podle (updateovaného) Sydneyského systému se samozřejmě netýká pouze helicobacterové gastritidy, ale vzhledem k výše zmíněné „válce s Helicobacterem“ lze při této diagnóze odpovídající klinický požadavek nejspíše očekávat. A to i přes to, že Sydneyský systém (respektive jeho komponenta představující semikvantitativní hodnocení 6 parametrů), ač potenciálně užitečný pro účely vědecké studie, nemá praktický význam v rutinní diagnostické praxi. Gastroenterologové zejména opomíjejí vstupní podmínku, tedy standardizovaný odběr vzorků podle Sydneyského systému (1 vzorek z malé kurvatury distální části žaludečního antra, 1 z velké kurvatury distální části antra, 1 z incisura angularis a po jednom vzorku z velké a malé kurvatury těla žaludku z oblasti přibližně 8 cm pod kardií; každý vzorek samozřejmě zaslaný separátně a adekvátně označený), jejíž nesplnění znemožňuje detailní hodnocení podle Sydneyského systému, protože za těchto okolností může být nejen nepřínosné, ale dokonce zavádějící. Vzhledem k výše uvedeným vstupním kritériím můžeme tedy v našich podmínkách považovat multiparametrickou kvantifikaci za uzavřenou kapitolu (27).
Autoimunitní gastritida
Lymfoplazmocytární infiltrát u autoimunitní gastritidy je charakteristický akcentací v hluboké vrstvě sliznice (zatímco u helicobacterové je jeho intenzita výraznější v zóně foveol a krčků). V současné době se rozeznávají dva základní typy autoimunitního zánětu žaludeční sliznice:
Autoimunitní metaplastická atrofická gastritida (AMAG) je nejčastější a představuje klasickou autoimunitní gastritidu asociovanou s autoprotilátkami proti různým antigenům parietálních buněk. Kromě výše popsaného typu chronického zánětlivého infiltrátu je charakterizována absencí aktivity typické pro helicobacterovou gastritidu (tedy přítomností neutrofilů v oblasti krčků žlázek) a omezením na oblast těla a fundu žaludku (v antru bývají jen nepříznačné změny charakteru minimální neaktivní chronické gastritidy či reaktivní gastropatie). V průběhu onemocnění dochází postupně k rozvoji atrofie oxyntické žaludeční sliznice s (pseudo)hypertrofií parietálních buněk a pseudopylorickou, pankreatickou acinární a intestinální metaplazií (28,29). Ve floridním stádiu má AMAG vzhled charakteristický již v malém zvětšení. Jsou-li vzorky z antrální a korporální sliznice zaslány separátně, je evidentní minimální nález ve vzorku z antra a obraz chronické neaktivní gastritidy ve vzorku z těla (či fundu) žaludku, který „nevypadá jako by byl z těla“, protože kvůli rozsáhlým metaplastickým změnám připomíná spíše antrální sliznici (většinou také již s fokální intestinální metaplazií). Při zaslání vzorků z obou lokalizací v jedné nádobce zase upoutá pozornost výrazná heterogenita mezi jednotlivými vzorky „domněle antrální“ sliznice. Ve skutečnosti jde o směs antrální sliznice bez zánětu (nebo jen s minimálními zánětlivými změnami) a výrazně lymfoplazmocytárně infiltrované původně oxyntické žaludeční sliznice korporálního origa, která již prodělala rozsáhlé metaplastické změny. Topické rozlišení lze v takovém případě provést průkazem neuroendokrinních G buněk v antrální sliznici. To je možné i v základním barvení hematoxylinem a eozinem, ve kterém mají G buňky vzhled „smažených vajec“ rozptýlených mezi epitelovými buňkami oblasti krčků žlázek (30). Jejich nález v základním barvení lze ověřit imunohistochemicky pomocí protilátky proti gastrinu. V korporální sliznici naopak G buňky chybí. Místo nich lze pozorovat lineární hyperplazii neuroendokrinních ECL buněk („enterochromaffine-like“ buněk produkujících histamin) v důsledku hypergastrinémie indukované hypochlorhydrií. V základním barvení se jeví jako druhá (spodní) řada jader při dně žlázek (obr. 4). K imunohistochemickému ověření ECL buněk slouží pozitivní imunohistochemický průkaz chromograninu a negativní průkaz gastrinu. Je však třeba mít na paměti, že hyperplazie ECL buněk musí být doprovázena dalšími histologickými (a klinickými) znaky AMAG, protože může být způsobena i jinými příčinami hypergastrinémie (např. užíváním PPI). Konečně je třeba zohlednit, že přítomnost Helicobactera nevylučuje možnost autoimunitní gastritidy. Kromě toho, že se předpokládá možnost iniciační role Helicobactera v některých případech AMAG, je také možná koincidence autoimunitní a helicobacterové gastritidy (31,32).
Obr. 4. Autoimunitní gastritida 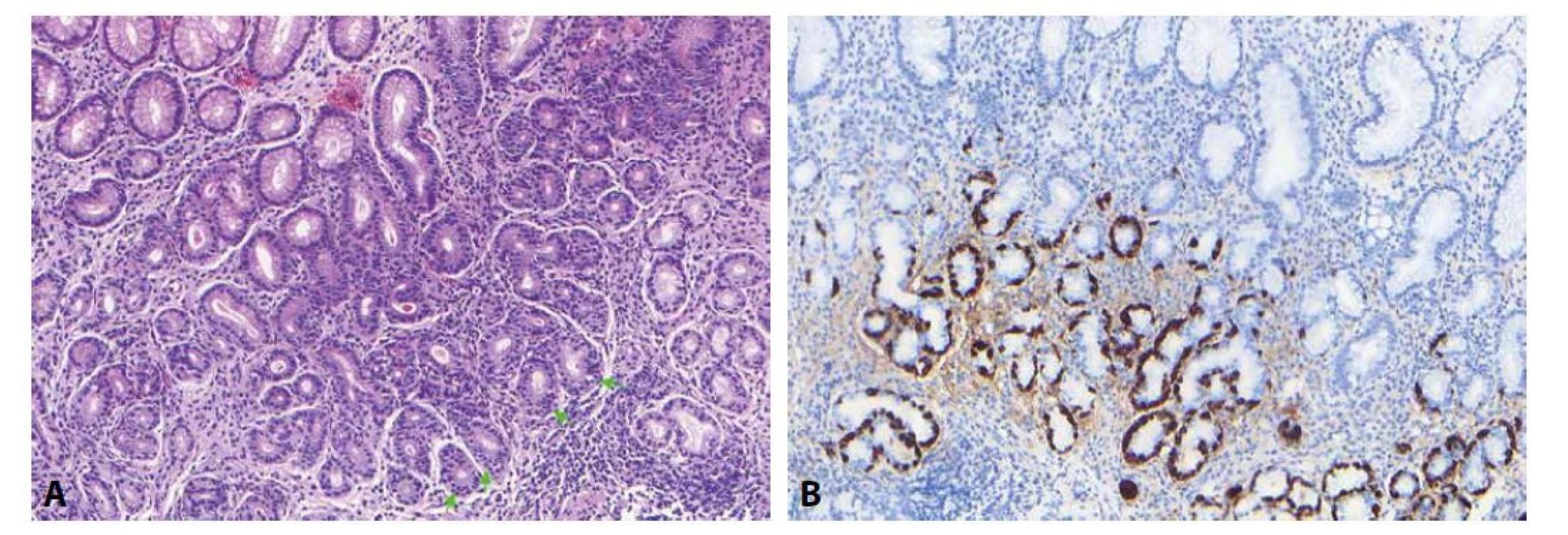
Pro autoimunitní gastritidu je typické, že vzorek pocházející z těla žaludku kvůli rozsáhlé pseudopylorické metaplázii často „vypadá jako antrum“, při žlázkách lze však i v barvení HE zastihnout druhou vrstvu jader (zelené šipky) představující lineární hyperplázii ECL buněk (A; 100x), což lze ověřit imunohistochemickým průkazem chromograninu (B; 100x). Atrofická autoimunitní pangastritida (AAP) je vzácnějším typem autoimunitní gastritidy. Přestože je také charakterizována lymfoplazmocytárním zánětlivým infiltrátem s vyšší mírou intenzity v hluboké zóně sliznice, od AMAG ji odlišuje postižení antra, signifikantní příměs neutrofilů, apoptotická aktivita, intraepiteliální lymfocytóza a absence hyperplazie ECL buněk. Klinicky je doprovázena dramatickými gastrointestinálními projevy, často se vyskytuje v asociaci s různými systémovými autoimunitními onemocněními (33,34). Obrazem připomínajícím AAP se může v žaludku manifestovat i autoimunitní enteropatie (AIE), nelze ani vyloučit, že jde o součást spektra tohoto onemocnění (35).
Žaludeční prezentace idiopatického střevního zánětu (inflammatory bowel disease, IBD)
Ačkoli je IBD v žaludku asociována především s obrazem fokálně akcentované gastritidy (FEG), někdy se prezentuje i jako aktivní superficiální chronická gastritida. V případě obrazu imponujícího jako helicobacterová gastritida, ale s negativním průkazem Helicobactera, je tedy vhodné zvážit i možnost IBD (36,37).
EBV-gastritida
Infekce virem Epsteina a Barrové (EBV) může být vzácně doprovázena těžkou gastritidou charakterizovanou difúzním atypickým lymfoidním infiltrátem s erozemi/ulceracemi, případně i s fokálními lymfoepiteliálními lézemi, který může věrně imitovat lymfom (38,39).
Syfilitická gastritida
Bohužel je stále nutné myslet i na možnost zánětlivých změn žaludku při syfilidě, zejména v jejím druhém stádiu. Obraz není specifický. Dominuje mu denzní lymfoplazmocytární infiltrát. Doprovodné znaky blíže poukazující na možnost syfilitické etiologie, jako nápadně významné zastoupení plazmatických buněk v zánětlivém infiltrátu, destrukce žlázek, proliferativní endarteritida a granulomy, mohou zcela chybět (40-42). Vzhledem k tomu je vhodné zvažovat možnost syfilitické gastritidy v každém případě nálezu denzní lymfoplazmocytární infiltrace žaludku bez asociace s helicobacterovou infekcí a bez znaků autoimunitní gastritidy, zejména s výraznější klinicko-endoskopickou symptomatologií. Přestože lze Treponemu pallidum identifikovat i v impregnační metodě Warthin-Starry, spolehlivější je imunohistochemický nebo molekulárně genetický průkaz.
b. Difúzní lymfoplazmocytární zánětlivý infiltrát + intraepiteliální lymfocytóza
Lymfocytární gastritida není nozologickou jednotkou, ale morfologickým obrazem definovaným počtem intraepiteliálních lymfocytů převyšujícím 25 lymfocytů / 100 epitelií. V praxi však není nutné lymfocyty skutečně počítat, protože zvýšení počtu lymfocytů bývá markantní a doprovázené oploštěním epitelu s deplecí mucinu. Endoskopický obraz může odpovídat erozivní gastritidě, hypertrofické gastropatii, nebo být bez signifikantních změn.
Mezi kauzální asociace lymfocytární gastritidy patří helicobacterová infekce, která je přítomná u 1/3 pacientů s lymfocytární gastritidou (přičemž 4 % pacientů s helicobacterovou infekcí vykazují obraz lymfocytární gastritidy) (43), imunopatologická onemocnění (nejčastěji celiakie, méně často CVID) (44), nádory žaludku (lymfomy i karcinomy) a léky (PPI, nesteroidní antirevmatika, sartany, ticlopidin nebo inhibitory TNF-α užívané mimo jiné při léčbě IBD) (45-47).
c. Difúzní lymfoplazmocytární zánětlivý infiltrát + intraepiteliální lymfocytóza + subepiteliální kolagenní pruh
Kolagenní gastritida je definována přítomností ztluštělého pruhu kolagenu pod bazální membránou na pozadí chronické lymfoplazmocytární zánětlivé celulizace proprie (často s příměsí eozinofilů) a intraepiteliální lymfocytózy. Kromě toho také bývá přítomna alterace epitelových buněk (oploštění, deplece mucinu), ložiskově i denudace epitelu (48-50). Tloušťka subepiteliálního pruhu kolagenu by sice podle definice měla být > 10 μm, v praxi však samozřejmě měření na mikrometrové úrovni naráží na technické obtíže, které mohou být dále potencovány šikmou orientací vzorku. Užitečnější se proto jeví kvalitativní znaky ztluštělého kolagenního pruhu, jako nepravidelnost jeho hranice, jeho infiltrace zánětlivými buňkami a zavzetí kapilár do jeho hmoty. Počet intraepiteliálních lymfocytů bývá nižší než při lymfocytární gastritidě, navíc s heterogennější distribucí. Také tloušťka kolagenního pruhu bývá kolísavá a může mít fokální distribuci, takže v některých vzorcích může obraz odpovídat spíše lymfocytární gastritidě (51). Ačkoli se dříve předpokládalo, že kolagenní gastritida v dětském a dospělém věku představuje dvě klinicky i etiopatogeneticky odlišné jednotky (52), ve větším souboru pacientů byl zjištěn signifikantní klinicko-patologický překryv mezi oběma věkovými skupinami (53).
Podobně jako lymfocytární gastritida, je i kolagenní gastritida pouze histopatologickým obrazem, nikoli nozologickou jednotkou. Mezi známé stavy asociované s kolagenní gastritidou patří imunopatologická onemocnění, jmenovitě celiakie (zejména tzv. kolagenní sprue), CVID, deficit IgA, systémový lupus erythematodes a další autoimunitní choroby (49,51,54-57), dále užívání některých léků (PPI, sartany, antidepresiva) (53), v některých případech nelze vyloučit ani možnou infekční etiologii. Hlavně při těžké klinické symptomatologii, zejména v asociaci s vodnatými průjmy, je nutné myslet i na možnost difúznějšího postižení gastrointestinálního traktu ve formě kolagenní gastroenterokolitidy (45,58,59).
2. DOMINUJÍCÍ EOZINOFILNÍ ZÁNĚTLIVÝ INFILTRÁT
Eozinofilní granulocyty jsou do určité míry běžnou součástí zánětlivého infiltrátu při různých gastritidách a gastropatiích (např. helicobacterové, autoimunitní, kolagenní, reaktivní) (60,61). Samostatný význam má však eozinofilní komponenta pouze tehdy, jestliže je výrazně dominující a se znaky svědčícími pro aktivaci eozinofilů (degranulace, tvorba eozinofilních mikroabscesů, infiltrace epitelu eozinofily). V opačném případě nemají eozinofily diagnostický význam a zmiňování jejich přítomnosti v zánětlivém infiltrátu je kontraproduktivní. Agilní gastroenterolog totiž může kvůli takové nevýznamné zmínce zcela pozbýt duševní rovnováhy a začít požadovat bizarní diagnostické výkony, z nichž „počítání eozinofilů“ je ten nejméně hrozný. Následné vysvětlování patologa, že „to s těmi eozinofily vlastně tak nemyslel“, už pak nemůže zvrátit vývoj situace vymykající se jeho kontrole.
Eozinofilní gastritida jako histologický obraz má tedy kritéria spíše subjektivně kvalitativní než striktně kvantitativní. Kromě výše zmíněné „výraznosti a dominantnosti“ eozinofilní zánětlivé infiltrace, infiltrace epitelu, degranulace eozinofilů a tvorby eozinofilních mikroabscesů byl na podkladě několika studií navržen horní práh normálního počtu eozinofilů v žaludeční sliznici na hodnotu 126 eozinofilů/mm2 (což odpovídá asi 30 eozinofilům/HPF) a dolní práh symptomatické „histologické“ eozinofilní gastritidy v rozmezí 50-70 eozinofilů/HPF, což samo o sobě poskytuje dobrou představu o přesnosti takové kvantitativní diagnostiky (62-66). Sekundární eozinofilní gastritida (ať už izolovaná, nebo vyskytující se v rámci eozinofilní gastroenteritidy) je asociovaná se známou příčinou. Vedlejší účinky užívání léků se v žaludku projevují signifikantní eozinofilií podstatně vzácněji než v distální části trávicí trubice (67). Z infekčních příčin se sice vyšší počty eozinofilů v zánětlivém infiltrátu nejčastěji vyskytují při helicobacterové gastritidě, pouze vzácně však v tomto případě dosahují stupně eozinofilní gastritidy. Skutečně intenzivní zánětlivý infiltrát lze tedy spíše zastihnout za u nás vzácnějších infekcí parazitárních (např. anizakiáza), případně mykotických, kdy často bývá mikroskopicky detekovatelné i etiologické agens. Z imunopatologických onemocnění asociovaných s obrazem eozinofilní gastritidy jde především o vaskulitidy (zejména eozinofilní granulomatóza s polyangiitidou), žaludeční prezentaci IBD (významněji při Crohnově chorobě než při ulcerózní kolitidě) a systémových onemocněních pojiva, která se mohou manifestovat i postižením hlubších vrstev žaludeční stěny, jež nemusí být v endoskopické biopsii zastiženy (68). Konečně je nutné vyloučit možnost eozinofilní infiltrace asociované s nádorem, ať již přímo nádorovou proliferací eozinofilů, nebo jinými nádory, typicky systémovou mastocytózou, méně často různými lymfomy, ale i karcinomy. Teprve po vyloučení známé kauzální asociace, které většinou vyžaduje rozsáhlý multidisciplinární diagnostický management pacienta, je možné stanovit diagnózu primární eozinofilní gastritidy, resp. gastroenteritidy.
3. HNISAVÝ ZÁNĚTLIVÝ INFILTRÁT
Neutrofilní granulocyty jsou běžnou minoritní komponentou zánětlivého infiltrátu jiného typu (typicky např. v případě helicobacterové aktivní chronické gastritidy), případně se mohou vyskytovat ložiskově v oblasti erozí či ulcerací, aniž by měly přímou souvislost s příčinou těchto slizničních defektů. Do specifické kategorie biopsií definovaných hnisavým zánětlivým infiltrátem však patří pouze vzácné případy, kdy je tento infiltrát dominující, denzní a difúzní, takže nabývá charakteru flegmóny.
Flegmonózní gastritida je onemocnění vzácné a v endoskopických biopsiích zcela raritní. Častěji ji lze spatřit při pitvě, protože jde o velmi závažné onemocnění, typicky probíhající pod obrazem náhlé příhody břišní, zejména přidruží-li se k flegmóně gangréna stěny žaludku, při kterém endoskopické vyšetření s biopsií nepatří mezi procedury první volby (69,70). Predispozicí pro pomnožení pyogenních mikroorganismů, ať již místního původu, nebo při bakteriémii, může být achlorhydrie, jaterní cirhóza či imunodeficience, ale asi v polovině případů nejsou známy žádné predisponující faktory (71-74).
4. FOKÁLNÍ ZÁNĚTLIVÝ INFILTRÁT
Ložiska akumulace zánětlivých buněk v terénu jinak prostém zánětlivé celulizace, případně na pozadí mírné difúzní zánětlivé infiltrace signifikantně nižší intenzity, než jsou fokální zánětlivé infiltráty, mohou být bez vztahu k etiologii změn (např. reaktivní infiltráty neutrofilů v okolí erozí nebo ulcerací), pravděpodobně bez klinického významu (ojedinělé kolekce lymfocytů bez zárodečných center a bez vazby na rozsáhlejší zánětlivý infiltrát lokalizované při bazi sliznice), anebo mohou být morfologickým projevem určitého onemocnění (nebo spíše skupiny onemocnění). Do této poslední kategorie patří zejména:
Fokálně akcentovaná gastritida (focally enhanced gastritis, FEG)
FEG je charakterizována přítomností lézí akcentované zánětlivé infiltrace tvořené lymfocyty (především CD3+), makrofágy a neutrofily soustředěné na oblast žaludeční foveoly/žlázky nebo jejich skupiny, s různě vyjádřenými alteracemi epitelových struktur (obr. 5). Mohou být přítomny i plazmatické buňky a eozinofily (75). Od počátku byl tento obraz asociován hlavně s Crohnovou chorobou (75-77), ale později bylo prokázáno, že i ulcerózní kolitida se v žaludku může manifestovat obrazem FEG, i když méně často než Crohnova choroba (78-81). Asociace s IBD je významná hlavně v dětské populaci, zatímco u dospělých nepřevažuje nad jinou etiologií, zejména léčenou helicobacterovou gastritidou nebo transplantací hemopoetických kmenových buněk (36). U dětí zase byla popsána možná asociace s autismem (82).
Obr. 5. Fokálně akcentovaná gastritida (FEG) 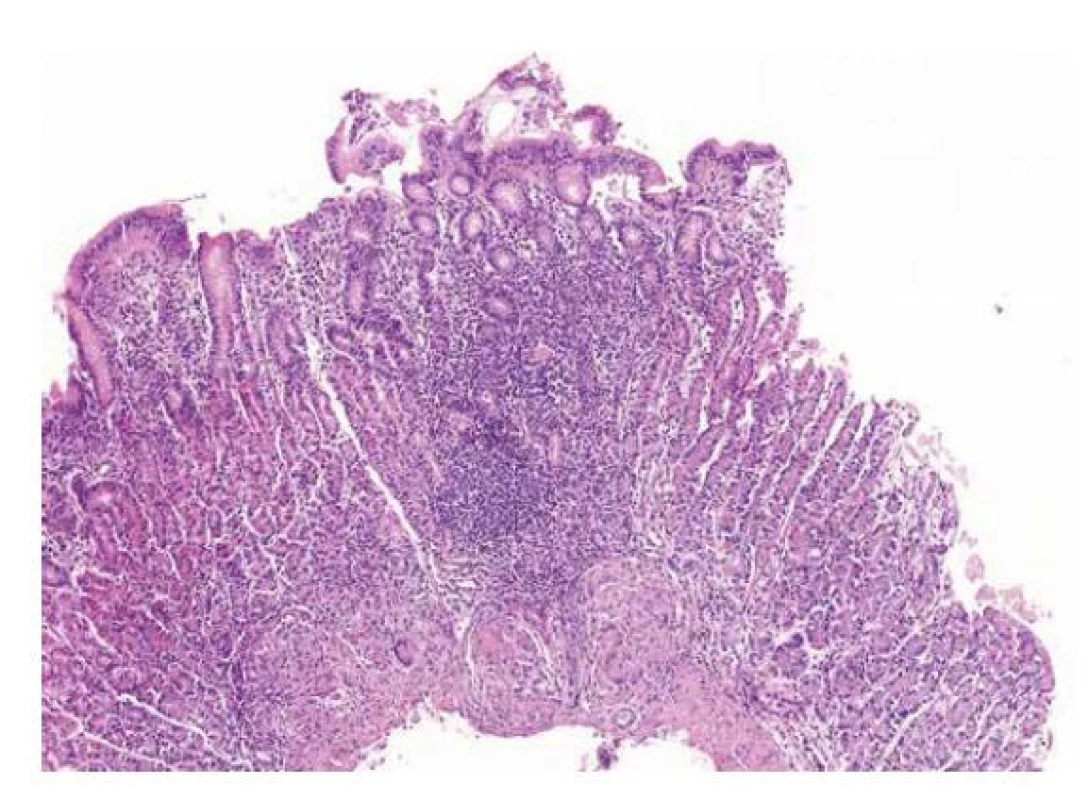
V terénu bez signifikantní zánětlivé celulizace sliznice je v centrální oblasti vzorku přítomno nepravidelné a neostře ohraničené ložisko smíšené zánětlivé infiltrace obklopující několik žlázek, které navíc vykazují regresivní změny. Přítomnost granulomů ve spodině pak dále podporuje podezření na Crohnovu chorobu (HE, 40x). Granulomy a granulomatózní gastritida
Granulomy se mohou v žaludku vyskytovat buď izolovaně, nebo v asociaci se zánětlivým infiltrátem (v tomto případě je termín granulomatózní gastritida případný). Granulomy mohou být buď „typu z cizích těles“ (tvořené obrovskými mnohojadernými buňkami, která mají jádra většinou náhodně uspořádána), epitelioidní (sestávající převážně z jednojaderných histiocytů s objemnou eozinofilní cytoplazmou), supurativní (tedy s centrální hnisavou kolekcí) a nekrotizující (centrální nekróza může nebo nemusí mít charakter kaseózní nekrózy). Sarkoidní granulomy (dobře ohraničené, bez nekrózy, bez lymfoidního lemu) a mikrogranulomy (složené z < 20 histiocytů) jsou podtypy epitelioidních granulomů (83). Typ granulomu spolu s charakterem doprovodného zánětlivého infiltrátu a dalších případných změn může zúžit diferenciální diagnózu.
Epitelioidní granulomy, zejména sarkoidního subtypu nebo mikrogranulomy, jsou tradičně spojovány především s diagnózou Crohnovy choroby, a to hlavně tehdy, jsou-li doprovázeny obrazem FEG nebo HP-negativní aktivní chronické gastritidy. Nález v žaludku je však nutno korelovat s nálezem v typických lokalizacích Crohnovy choroby (především ileum) a s klinickým obrazem (84). Sarkoidní granulomy bez doprovodné zánětlivé infiltrace sliznice poukazují na možnost sarkoidózy, mohou se však také vyskytovat v inaktivních fokusech Crohnovy choroby. Nekrotizující granulomy svědčí převážně pro infekční etiologii, v rámci Crohnovy choroby se vyskytují spíše výjimečně. Granulomy typu z cizích těles nemusí obklopovat pouze cizorodý nebiologický materiál, ale i parazitární struktury, proto by měl být příslušný blok vždy hluboce prokrájen, aby byl zastižen i obsah granulomu. Granulomy s doprovodným signifikantním eozinofilním zánětlivým infiltrátem se vyskytují nejen při parazitárních infekcích, ale i při vaskulitidách, zejména při eozinofilní granulomatóze s polyangiitidou. Granulomy s doprovodnými tkáňovými nekrózami bývají přítomné při intravaskulárně se šířících mykotických infekcích, ale také při granulomatóze s polyangiitidou. Žádný z výše uvedených morfologických obrazů však není specifický pro konkrétní nozologickou jednotku, takže stanovení diagnózy často vyžaduje komplexní vyšetření pacienta, zahrnující kromě histologického obrazu i zobrazovací, mikrobiologická, serologická a imunologická vyšetření. Jestliže ani mezioborový a široce zaměřený diagnostický proces neodhalí příčinu tvorby granulomů, je na místě diagnóza idiopatické (izolované) granulomatózní gastritidy. Nepřímé důkazy naznačují, že část těchto případů by mohla být indukována helicobacterovou infekcí (84-89).
5. ŘÍDKÝ AŽ ŽÁDNÝ ZÁNĚTLIVÝ INFILTRÁT
Do této kategorie se řadí gastropatie, které zcela postrádají zánětlivý infiltrát, případně je jen minimální, anebo nesouvisí přímo se samotnou gastropatií (např. fokální infiltrace neutrofily v okolí slizničních erozí). Obrazu dominují v různé intenzitě změny epitelového kompartmentu, hladké svaloviny a cév.
Reaktivní gastropatie
Tento termín patří mezi dnes nejužívanější označení skupiny gastropatií, která zahrnuje hlavně jednak tzv. „refluxní gastritidu“ způsobenou duodenogastrickým refluxem (90,91), jednak tzv. „chemickou gastritidou“, popsanou původně v souvislosti s užíváním nesteroidních antirevmatik (NSAR), která má identický obraz jako změny refluxní etiologie (92). Vzhledem k absenci signifikantní zánětlivé infiltrace se dnes nedoporučuje používat v tomto kontextu termín „gastritida“. Kromě námi preferovaného názvu „reaktivní gastropatie“ je ještě často používáno označení „chemická gastropatie“, které bylo doporučeno updateovaným Sydneyským systém, jenž je ale, jak už bylo zmíněno výše, všeobecně ignorován.
V akutní fázi jsou změny nespecifické, sdílené s dalšími příčinami (např. s alkoholem, bifosfonáty, tetracyklinovými antibiotiky nebo selektivními inhibitory zpětného vychytávání serotoninu, ale i s časnou fází infekce Helicobacter pylori). Obrazu dominují známky poškození epitelu zahrnující depleci mucinu, oploštění epitelií, eroze až vředy a slizniční edém. Eroze mohou být doprovázený fokálním neutrofilním zánětlivým infiltrátem (93,94). Charakterističtější se obraz stává v chronické fázi, kdy se již rozvíjejí vlastní reaktivní změny. Patří mezi ně hyperplázie foveol, profil jejich lumin je pak přirovnáván k „vývrtce“ na korkové zátky, hyperplázie hladkosvalových buněk v proprii, dilatace a hyperémie kapilár mezi foveolami a různě intenzivní edém proprie (obr. 6). Přetrvávat mohou samozřejmě alterativní změny z akutní fáze. Naopak by neměla být přítomna výraznější zánětlivá infiltrace (mimo oblast erozí) ani rozsáhlejší intestinální metaplázie (95-98).
Obr. 6. Reaktivní gastropatie 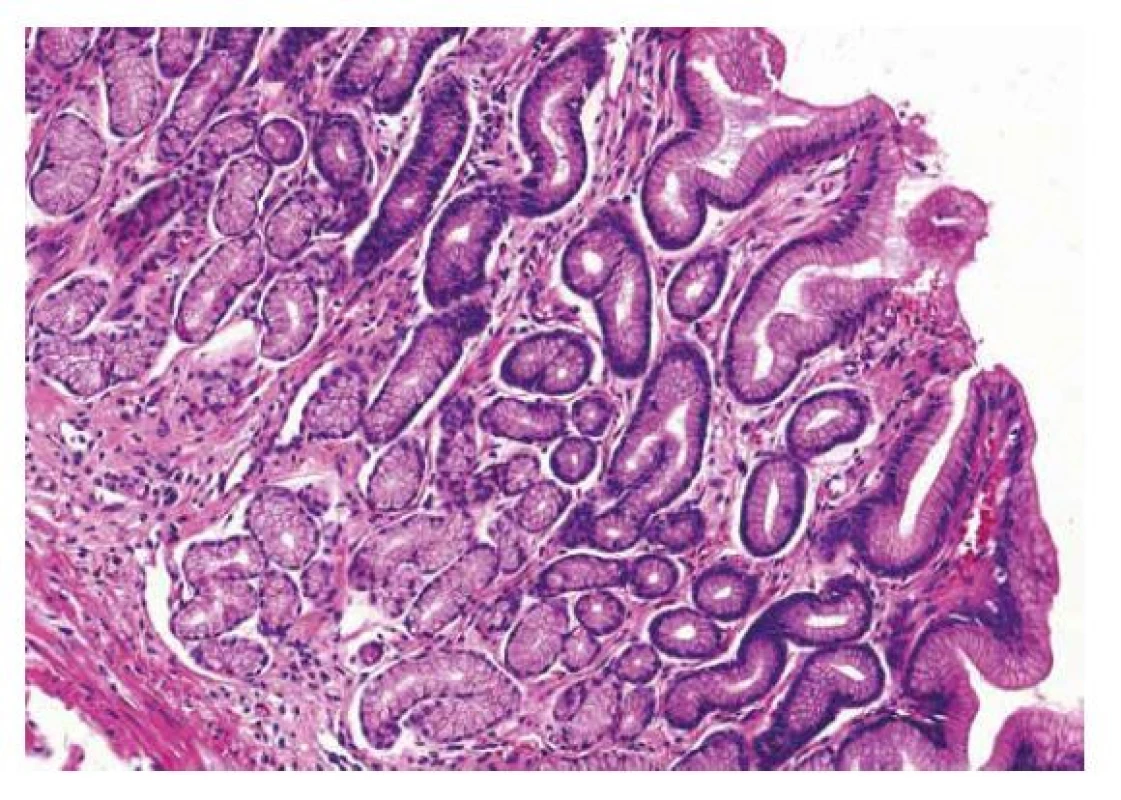
Reaktivní gastropatii charakterizuje narušení architektoniky foveol, hyperémie proprie a vyzařování hladkosvalových buněk lamina muscularis mucosae mezi žaludeční žlázky a foveoly (HE, 200x). Kongestivní gastropatie (portální hypertenzivní gastropatie)
Charakteristickým znakem této gastropatie, vznikající typicky při jaterní cirhóze, je ektázie cév, která je patrná zejména v submukóze, zatímco ve sliznici přítomná mírná dilatace lumina venul a kapilár se zvýrazněním vystýlajících endotelií může někdy působit spíše dojmem chronického zánětlivého infiltrátu (99,100). Může však být patrná i výraznější hyperplázie foveol připomínající reaktivní gastropatii (obr. 7).
Obr. 7. Kongestivní gastropatie 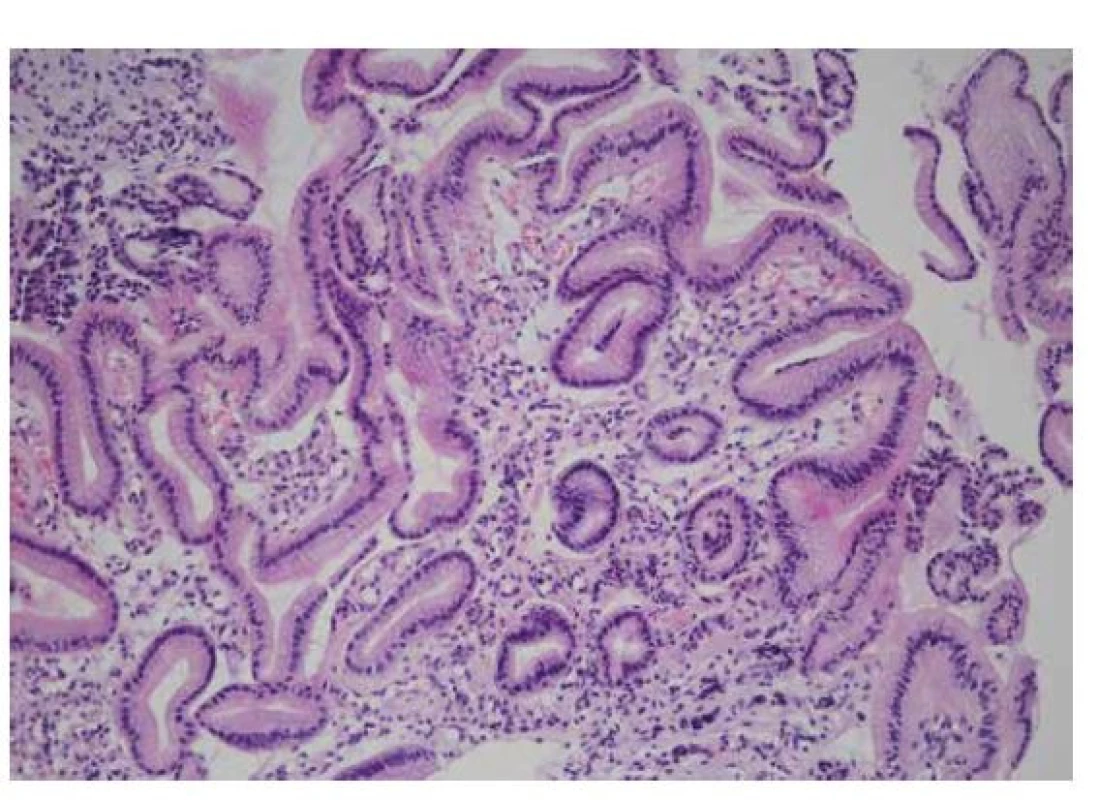
Kongestivní gastropatie se projevuje především dilatací drobných cév ve sliznici těla žaludku. Někdy se přidružuje i mírné narušení architektoniky foveol, které může připomínat reaktivní gastropatii (HE, 200x). Žaludeční antrální vaskulární ektázie (gastric antral vascular ectasia, GAVE)
Etiopatogeneze GAVE je nejasná. Předpokládá se její asociace s abnormální motilitou antra, zejména v souvislosti se slizničním prolapsem, narušením regulace cévní motility, ve kterém mohou hrát roli peptidové hormony, gastrin či prostaglandin E; autoimunitními chorobami, ale i s cirhózou, což poněkud komplikuje odlišení od kongestivní gastropatie. Jako charakteristické histologické znaky GAVE jsou uváděny foveolární hyperplázie, hyperplázie hladké svaloviny v proprii, ektázie slizničních cév a přítomnost trombů (které lze zvýraznit imunohistochemickým průkazem CD61) v jejich luminech (obr. 8) (100).
Obr. 8. Žaludeční antrální vaskulární ektázie (GAVE) 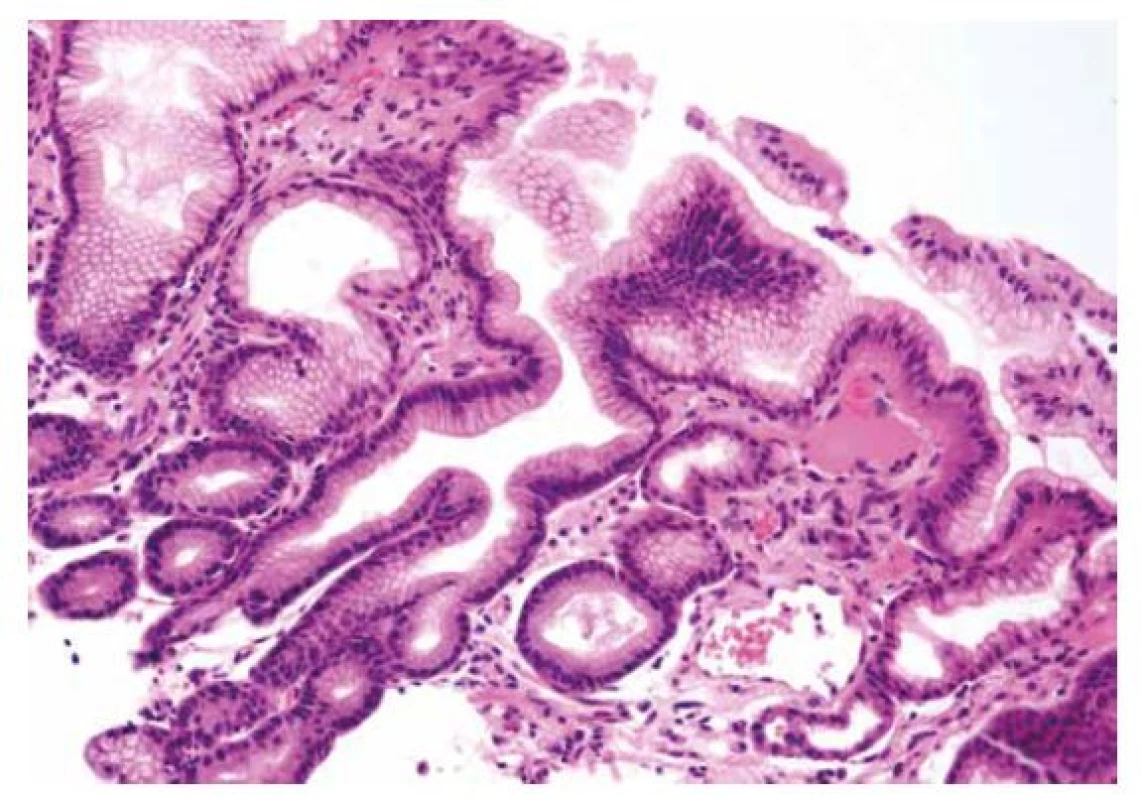
Histologickými znaky GAVE jsou foveolární hyperplázie, dilatace slizničních cév a přítomnost trombů, které však ve vyšetřeném rozsahu nemusí být zastiženy (HE, 200x). Diferenciální diagnóza mezi těmito třemi jednotkami bohužel není vždy jednoduchá. Ve všech třech může histologický obraz vykazovat známky foveolární hyperplázie, hyperplázie hladké svaloviny v proprii a hyperémii. Tromby charakterizující GAVE jsou sice specifickým znakem, který má ale omezenou senzitivitu (až v 50 % případů GAVE nemusí být v rozsahu biopsie tromby zastiženy). Nápomocný může být endoskopický vzhled sliznice. V typických případech GAVE slizniční povrch připomíná růžovo - -červenou variaci na povrch melounu, pro kongestivní gastropatii je zase charakteristický mozaikovitý vzhled sliznice, který je někdy přirovnáván k hadí kůži. Při těžké portální hypertenzi však není výjimkou ani difúzní hyperémie sliznice, podobně jako při koincidenci GAVE a jaterní cirhózy. Tehdy je dalším pomocným kritériem lokalizace – jak z názvu vyplývá, GAVE postihuje zejména antrum, zatímco kongestivní gastropatie tělo žaludku. Konečně může pomoci pátrání po etiologických faktorech (např. užívání NSAR svědčí pro reaktivní gastropatii, cirhóza jater pro kongestivní gastropatii a autoimunitní systémové onemocnění pro GAVE), nicméně i zde je nutné počítat s etiologickými překryvy (např. již zmíněná asociace GAVE s jaterní cirhózou) (101).
6. APOPTOTICKÁ AKTIVITA
Tato skupina onemocnění žaludku je zcela umělá. Zahrnuje nejen různé etiopatogenetické jednotky, ale i rozličné morfologické obrazy, jejichž společným znakem je pouze zvýšená míra apoptotického zániku epitelových buněk žaludku. Bohužel neexistuje obecně přijaté kvantitativní kritérium abnormálního počtu apoptóz v žaludeční sliznici. Je však známo, že v kontrolních vzorcích žaludeční sliznice bez známek onemocnění je 1,5 apotózy na 1 foveolu/žlázku, zatímco ve vzorcích helicobacterové gastritidy je tento počet přibližně dvojnásobný (a při běžném hodnocení stále nikterak výrazný). Navíc, zatímco za normálního stavu jsou apoptózy v povrchovém epitelu a v povrchové zóně foveol, za patologických stavů se apoptózy „posouvají“ hlouběji a lze je nalézt zejména v oblasti proliferativní zóny, tedy krčků a přilehlé oblasti žlázek (102). Do skupiny onemocnění žaludku se zvýšenou apoptotickou aktivitou lze tedy zařadit ty stavy, při nichž je v preparátu obarveném konvenčním histologickým barvením jasně a zřetelně patrná přítomnost apoptóz v oblasti krčků.
Signifikantní apoptotická aktivita žaludečního epitelu je obecně asociována hlavně s některými imunopatologickými stavy a s farmakoterapií. Nejčastější asociaci představují NSAR, nicméně je třeba přiznat, že v tomto případě apoptotická aktivita většinou nedominuje základnímu histologickému obrazu reaktivní gastropatie. Ačkoli je žaludeční sliznice biopticky při podezření na reakci štěpu proti hostiteli („graft versus host disease“, GvHD) vyšetřována méně často než sliznice tlustého střeva, i v ní lze zastihnout obdobný obraz, tedy apoptózy v zóně krčků a dilataci foveol/žlázek bez signifikantní doprovodné zánětlivé celulizace, vzácně i vymizení žlázek a fibrózu proprie (103,104). Samozřejmě je u těchto pacientů také nutné vyloučit možnost CMV infekce/reaktivace a efekt cytoreduktivní chemo/radioterapie. Změny vyvolané cytoredukční terapií by neměly přetrvávat 3 týdny po indukci (105). V současné době je také možné se u pacientů po transplantaci solidních orgánů i kostní dřeně setkat s toxicitou vyvolanou mycofenolátem, která se kromě apoptotické aktivity projevuje morfologickým obrazem odpovídajícím reaktivní gastropatii a příměsí eozinofilů (106). Zvýšenou apoptotickou aktivitu lze také očekávat jako projev toxicity cyclosporinu A a antimetabolitů (metotrexát, capecitabin), podobně jako při užívání inhibitorů imunitních checkpointů, jejichž indikační spektrum v imunoterapii nádorů se v současnosti stále rozšiřuje. Aktuálně se jedná o protilátky proti proteinu 4 asociovanému s cytotoxickými T lymfocyty („cytotoxic T-lymphocyte-associated protein-4“, CTLA-4), např. ipilimumab; a o protilátky zasahující na úrovni interakce receptoru smrti a jeho ligandu („programmed cell death protein 1/programmed death-ligand 1“, PD-1/PD-L1), jako např. nivolumab nebo pembrolizumab. Zvýšená apoptotická aktivita bývá v těchto případech doprovázena obrazem aktivní chronické gastritidy s intraepiteliální lymfocytózou nebo fokálně akcentované gastritidy, případně i s přítomností granulomů (107,108). Zvláštním obrazem je charakterizováno užívání taxanů a intoxikace kolchicinem. Zvýšení míry apoptotického zániku epitelových buněk je zde doprovázeno tzv. „mitotickým arestem“ v metafázi, často dokonce s tvorbou prsténčitých mitóz (109-111).
7. CIZORODÁ DEPOZITA
Konečně lze v žaludečních biopsiích pozorovat i nebiologické cizorodé útvary, které mohou (podobně jako výše uvedené bakterie a virové inkluze) být vodítkem k etiologické diagnóze. Poměrně často lze zastihnout depozita železa ve formě rezavě hnědého pigmentu, který nabývá modrého zbarvení v Perlsově barvení. Příčinou může být buď topické poškození sliznice tabletami obsahujícími železo, kdy jsou depozita lokalizována v povrchové proprii a doprovázena obrazem reaktivní gastropatie (obr. 9), anebo celková hemosideróza, při níž depozice železitých iontů dominuje v epitelu při bazi žlázek (112-114). Jemnější hnědá granula v makrofázích, případně v obrovských mnohojaderných buňkách v žaludeční sliznici dialyzovaných pacientů se vyskytují při terapii hyperfosfatémie hydrátem uhličitanu lanthanitého (Fosrenol) (115). Kalcinóza sliznice žaludku může mít metastatický charakter (nejčastěji při renální insuficienci, případně při primárním hyperparathyroidismu) (116), může také být podmíněna akumulací fosforečnanu hlinitého při dlouhodobém užívání léčiv obsahujících hliník (některá antacida, sukralfát) (117). V terénu charakteru reaktivní gastropatie jsou pak v povrchové proprii přítomna modrá až fialová světlolomná depozita pozitivní v barvení podle von Kossy a Alizarin Red. Velmi podobný obraz může vyvolat i fosforečnan sodný (Osmoprep užívaný k přípravě střeva před endoskopickým vyšetřením), jehož depozita jsou sice také pozitivní v reakci podle von Kossy, ale negativní v barvení Alizarin Red (protože neobsahují kalcium) (118).
Obr. 9. Gastropatie vyvolaná tabletami obsahujícími železo 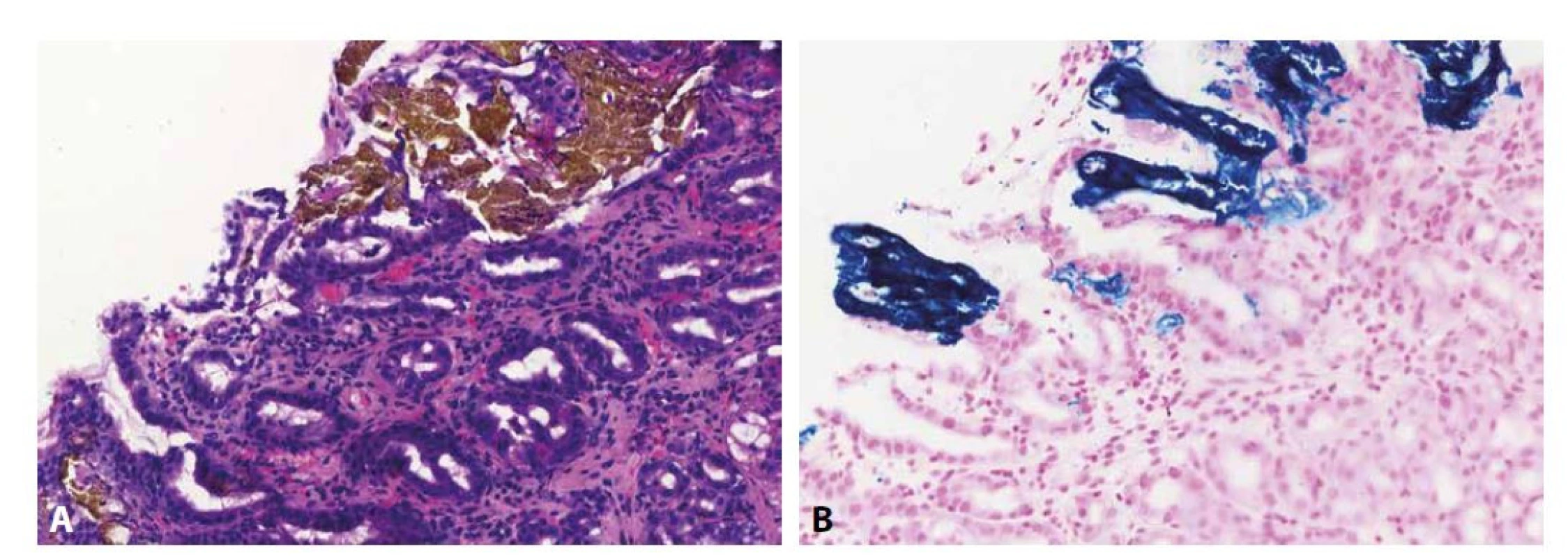
Při kontaktním poškození sliznice žaludku v důsledku perorální suplementace železa se v subepiteliálním stromatu ukládá pigment rezavo-hnědé barvy v barvení HE (A; 200x), který získává modré zbarvení v Perlsově reakci (B; 200x). Lékařské pryskyřice mají nepravidelně hranatý tvar, různě výrazně vyjádřenou „šupinatost“ řezné plochy a značnou variabilitu barvy v histologických preparátech. Lékařské pryskyřice lze rozdělit do 3 skupin: sekvestranty žlučových kyselin (colesevelam, colestipol a cholestyramin) používané hlavně k léčbě průjmů; iontoměniče používané k terapii hyperkalémie (polystyren-sulfonát sodný a polystyren-sulfonát vápenatý, resp. Kayexalate a Resonium); a sevelamer používaný k terapii hyperfosfatémie. Přestože je v literatuře popsán charakteristický vzhled jednotlivých pryskyřic, ve skutečnosti není morfologie pryskyřičných depozit specifická, jelikož závisí na zevních faktorech, takže (podobně jako ve výše uvedených stavech) je diagnóza závislá na klinicko-patologické konzultaci s pečlivou anamnézou (119).
ZÁVĚR
Ačkoli diferenciální diagnostice gastritid a gastropatií dominuje problematika helicobacterové gastritidy a reaktivní gastropatie, nezanedbatelné množství morfologických obrazů je asociováno se vzácnějšími příčinami poškození žaludeční sliznice, jejichž rozpoznání vyžaduje komplexnější a někdy i multioborový přístup. Druhou stranu mince pak představuje často opomíjený fakt, že ne každá endoskopická biopsie žaludku musí pocházet od pacienta skutečně postiženého onemocněním žaludeční sliznice. Jinými slovy, diagnóza „normální žaludeční sliznice“ bez nálezu gastritidy či gastropatie není žádnou hanbou pro patologa ani pro pacienta.
PODĚKOVÁNÍ
Tento výstup vznikl v rámci projektu Specifického vysokoškolského výzkumu 2020-2022 č. 260 539.
ACKNOWLEDGEMENT
The work was supported by the grant SVV–2020-2022 No 260 539.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
prof. MUDr. Ondřej Daum, Ph.D.
Šiklův ústav patologie LF UK a FN Plzeň
Edvarda Beneše 1128/13, 305 99 Plzeň
tel.: 377 402 523
fax.: 377 402 634
email: DAUM@fnplzen.cz
Zdroje
1. Daum O. Patologie GIT. In: Zámečník J, ed. Patologie (1. vydání). Prague: LD, s.r.o. - PRAGER PUBLISHING; 2019 : 461-526.
2. El-Zimaity HM, Al-Assi MT, Genta RM, Graham DY. Confirmation of successful therapy of Helicobacter pylori infection: number and site of biopsies or a rapid urease test. Am J Gastroenterol 1995; 90(11): 1962-1964.
3. El-Zimaity HM, Graham DY. Evaluation of gastric mucosal biopsy site and number for identification of Helicobacter pylori or intestinal metaplasia: role of the Sydney System. Hum Pathol 1999; 30(1): 72-77.
4. Kuipers EJ, Uyterlinde AM, Pena AS, et al. Increase of Helicobacter pylori-associated corpus gastritis during acid suppressive therapy: implications for long-term safety. Am J Gastroenterol 1995; 90(9): 1401-1406.
5. Kuipers EJ, Lundell L, Klinkenberg-Knol EC, et al. Atrophic gastritis and Helicobacter pylori infection in patients with reflux esophagitis treated with omeprazole or fundoplication. N Engl J Med 1996; 334(16): 1018-1022.
6. Graham DY, Opekun AR, Yamaoka Y, Osato MS, El-Zimaity HM. Early events in proton pump inhibitor-associated exacerbation of corpus gastritis. Aliment Pharmacol Ther 2003; 17(2): 193-200.
7. Genta RM, Rindi G, Fiocca R, et al. Effects of 6-12 months of esomeprazole treatment on the gastric mucosa. Am J Gastroenterol 2003; 98(6): 1257-1265.
8. Stolte M, Kroher G, Meining A, et al. A comparison of Helicobacter pylori and H. heilmannii gastritis. A matched control study involving 404 patients. Scand J Gastroenterol 1997; 32(1): 28-33.
9. Priestnall SL, Wiinberg B, Spohr A, et al. Evaluation of “Helicobacter heilmannii” subtypes in the gastric mucosas of cats and dogs. J Clin Microbiol 2004; 42(5): 2144-2151.
10. Batts KP, Ketover S, Kakar S, et al. Appropriate use of special stains for identifying Helicobacter pylori: recommendations from the Rodger C. Haggitt Gastrointestinal Pathology Society. Am J Surg Pathol 2013; 37(11): e12-22.
11. Panarelli NC, Ross DS, Bernheim OE, et al. Utility of ancillary stains for Helicobacter pylori in near-normal gastric biopsies. Hum Pathol 2015; 46(3): 397-403.
12. Chitkara Y. Upfront special staining for Helicobacter pylori in gastric biopsy specimens is not indicated. Am J Clin Pathol 2015; 143(1): 84-88.
13. Pittman ME, Khararjian A, Wood LD, Montgomery EA, Voltaggio L. Prospective identification of Helicobacter pylori in routine gastric biopsies without reflex ancillary stains is cost-efficient for our health care system. Hum Pathol 2016; 58 : 90-96.
14. Jessurun J. Helicobacter pylori: an evolutionary perspective. Histopathology 2021; 78(1): 39-47.
15. Dellon ES, Peery AF, Shaheen NJ, et al. Inverse association of esophageal eosinophilia with Helicobacter pylori based on analysis of a US pathology database. Gastroenterology 2011; 141(5): 1586-1592.
16. Shah SC, Tepler A, Peek RM, Jr., et al. Association between Helicobacter pylori exposure and decreased odds of eosinophilic esophagitis. A systematic review and meta-analysis. Clin Gastroenterol Hepatol 2019; 17(11): 2185 - 2198.
17. Raghunath A, Hungin AP, Wooff D, Childs S. Prevalence of Helicobacter pylori in patients with gastro-oesophageal reflux disease: systematic review. BMJ 2003; 326(7392): 737.
18. Mou WL, Feng MY, Hu LH. Eradication of Helicobacter pylori infections and GERD: A systematic review and meta-analysis. Turk J Gastroenterol 2020; 31(12): 853-859.
19. Zhao Y, Li Y, Hu J, et al. The effect of Helicobacter pylori eradication in patients with gastroesophageal reflux disease: A meta-analysis of randomized controlled studies. Dig Dis 2020; 38(4): 261-268.
20. Quach DT, Pham QTT, Tran TLT, et al. Clinical characteristics and risk factors of gastroesophageal reflux disease in Vietnamese patients with upper gastrointestinal symptoms undergoing esophagogastroduodenoscopy. JGH Open 2021; 5(5): 580-584.
21. Molodecky NA, Soon IS, Rabi DM, et al. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review. Gastroenterology 2012; 142(1): 46-54.
22. Castano-Rodriguez N, Kaakoush NO, Lee WS, Mitchell HM. Dual role of Helicobacter and Campylobacter species in IBD: a systematic review and meta-analysis. Gut 2017; 66(2): 235-249.
23. Pellicano R, Ianiro G, Fagoonee S, Settanni CR, Gasbarrini A. Review: Extragastric diseases and Helicobacter pylori. Helicobacter 2020; 25 (Suppl. 1): e12741.
24. Ding ZH, Xu XP, Wang TR, et al. The prevalence of Helicobacter pylori infection in inflammatory bowel disease in China: A case-control study. PloS One 2021; 16(3): e0248427.
25. Chen C, Xun P, Tsinovoi C, He K. Accumulated evidence on Helicobacter pylori infection and the risk of asthma: A meta-analysis. Ann Allergy Asthma Immunol 2017; 119(2): 137 - 145.
26. Sheh A, Chaturvedi R, Merrell DS, et al. Phylogeographic origin of Helicobacter pylori determines host-adaptive responses upon coculture with gastric epithelial cells. Infect Immun 2013; 81(7): 2468-2477.
27. Dixon MF, Genta RM, Yardley JH, Correa P. Classification and grading of gastritis. The updated Sydney System. International Workshop on the Histopathology of Gastritis, Houston 1994. Am J Surg Pathol 1996; 20(10): 1161-1181.
28. Jhala NC, Montemor M, Jhala D, et al. Pancreatic acinar cell metaplasia in autoimmune gastritis. Arch Pathol Lab Med 2003; 127(7): 854-857.
29. Pittman ME, Voltaggio L, Bhaijee F, Robertson SA, Montgomery EA. Autoimmune metaplastic atrophic gastritis: recognizing precursor lesions for appropriate patient evaluation. Am J Surg Pathol 2015; 39(12): 1611-1620.
30. Lewin KJ, Dowling F, Wright JP, Taylor KB. Gastric morphology and serum gastrin levels in pernicious anaemia. Gut 1976; 17(7): 551 - 560.
31. Appelmelk BJ, Faller G, Claeys D, Kirchner T, Vandenbroucke-Grauls CM. Bugs on trial: the case of Helicobacter pylori and autoimmunity. Immunol Today 1998; 19(7): 296-299.
32. Minalyan A, Benhammou JN, Artashesyan A, Lewis MS, Pisegna JR. Autoimmune atrophic gastritis: current perspectives. Clin Exp Gastroenterol 2017; 10 : 19-27.
33. Jevremovic D, Torbenson M, Murray JA, Burgart LJ, Abraham SC. Atrophic autoimmune pangastritis: A distinctive form of antral and fundic gastritis associated with systemic autoimmune disease. Am J Surg Pathol 2006; 30(11): 1412-1419.
34. Speck O, Appelman HD, Owens SR. Midand deep-zone gastritis: a histologic pattern associated with autoimmune disease but distinct from autoimmune atrophic gastritis. Am J Clin Pathol 2018; 150(4): 364-374.
35. Mitomi H, Tanabe S, Igarashi M, et al. Autoimmune enteropathy with severe atrophic gastritis and colitis in an adult: proposal of a generalized autoimmune disorder of the alimentary tract. Scand J Gastroenterol 1998; 33(7): 716-720.
36. Xin W, Greenson JK. The clinical significance of focally enhanced gastritis. Am J Surg Pathol 2004; 28(10): 1347-1351.
37. Horjus Talabur Horje CS, Meijer J, Rovers L, et al. Prevalence of upper gastrointestinal lesions at primary diagnosis in adults with inflammatory bowel disease. Inflamm Bowel Dis 2016; 22(8): 1896-1901.
38. Zhang Y, Molot R. Severe gastritis secondary to Epstein-Barr viral infection. Unusual presentation of infectious mononucleosis and associated diffuse lymphoid hyperplasia in gastric mucosa. Arch Pathol Lab Med 2003; 127(4): 478-480.
39. Chen ZM, Shah R, Zuckerman GR, Wang HL. Epstein-Barr virus gastritis: an underrecognized form of severe gastritis simulating gastric lymphoma. Am J Surg Pathol 2007; 31(9): 1446-1451.
40. Greenstein DB, Wilcox CM, Schwartz DA. Gastric syphilis. Report of seven cases and review of the literature. J Clin Gastroenterol 1994; 18(1): 4-9.
41. Long BW, Johnston JH, Wetzel W, Flowers RH, 3rd, Haick A. Gastric syphilis: endoscopic and histological features mimicking lymphoma. Am J Gastroenterol 1995; 90(9): 1504 - 1507.
42. Mylona EE, Baraboutis IG, Papastamopoulos V, et al. Gastric syphilis: a systematic review of published cases of the last 50 years. Sex Transm Dis 2010; 37(3): 177-183.
43. Wu TT, Hamilton SR. Lymphocytic gastritis: association with etiology and topology. Am J Surg Pathol 1999; 23(2): 153-158.
44. Feeley KM, Heneghan MA, Stevens FM, Mc - Carthy CF. Lymphocytic gastritis and coeliac disease: evidence of a positive association. J Clin Pathol 1998; 51(3): 207-210.
45. Rubio-Tapia A, Herman ML, Ludvigsson JF, et al. Severe spruelike enteropathy associated with olmesartan. Mayo Clin Proc 2012; 87(8): 732-738.
46. Ruget O, Burtin P, Cerez H, Cales P, Boyer J. Diarrhee chronique associee a une atrophie villositaire et une gastrite lymphocytaire, imputable a la ticlopidine. Gastroenterol Clin Biol 1992; 16(3): 290.
47. Muir A, Surrey L, Kriegermeier A, Shaikhkalil A, Piccoli DA. Severe eosinophilic gastroenteritis in a Crohn’s disease patient treated with infliximab and adalimumab. Am J Gastroenterol 2016; 111(3): 437-438.
48. Colletti RB, Trainer TD. Collagenous gastritis. Gastroenterology 1989; 97(6): 1552-1555.
49. Vesoulis Z, Lozanski G, Ravichandran P, Esber E. Collagenous gastritis: a case report, morphologic evaluation, and review. Mod Pathol 2000; 13(5): 591-596.
50. Arnason T, Brown IS, Goldsmith JD, et al. Collagenous gastritis: a morphologic and immunohistochemical study of 40 patients. Mod Pathol 2015; 28(4): 533-544.
51. Stancu M, De Petris G, Palumbo TP, Lev R. Collagenous gastritis associated with lymphocytic gastritis and celiac disease. Arch Pathol Lab Med 2001; 125(12): 1579-1584.
52. Lagorce-Pages C, Fabiani B, Bouvier R, et al. Collagenous gastritis: a report of six cases. Am J Surg Pathol 2001; 25(9): 1174-1179.
53. Ma C, Park JY, Montgomery EA, et al. A comparative clinicopathologic study of collagenous gastritis in children and adults: the same disorder with associated immune-mediated diseases. Am J Surg Pathol 2015; 39(6): 802-812.
54. Mandaliya R, Burkart AL, DiMarino AJ, Rattan S, Cohen S. Association between common variable immunodeficiency and collagenous infiltrative disorders of the gastrointestinal tract: A series of four patients. Indian J Gastroenterol 2016; 35(2): 133-138.
55. Anwar MS, Aamar A, Marhaba A, Sidhu JS. Collagenous gastritis in a young female with IgA deficiency. Gastroenterology Res 2017; 10(2): 126-127.
56. Al-Kandari A, Al-Alardati H, Sayadi H, Al-Judaibi B, Mawardi M. An unusual case of collagenous gastritis in a middle-aged woman with systemic lupus erythromatosus: a case report. J Med Case Rep 2014; 8 : 278.
57. Leung ST, Chandan VS, Murray JA, Wu TT. Collagenous gastritis: histopathologic features and association with other gastrointestinal diseases. Am J Surg Pathol 2009; 33(5): 788-798.
58. Castellano VM, Munoz MT, Colina F, et al. Collagenous gastrobulbitis and collagenous colitis. Case report and review of the literature. Scand J Gastroenterol 1999; 34(6): 632-638.
59. Pulimood AB, Ramakrishna BS, Mathan MM. Collagenous gastritis and collagenous colitis: a report with sequential histological and ultrastructural findings. Gut 1999; 44(6): 881-885.
60. Genta RM, Lew GM, Graham DY. Changes in the gastric mucosa following eradication of Helicobacter pylori. Mod Pathol 1993; 6(3): 281-289.
61. Pusztaszeri MP, Genta RM, Cryer BL. Drug-induced injury in the gastrointestinal tract: clinical and pathologic considerations. Nat Clin Pract Gastroenterol Hepatol 2007; 4(8): 442-453.
62. DeBrosse CW, Case JW, Putnam PE, Collins MH, Rothenberg ME. Quantity and distribution of eosinophils in the gastrointestinal tract of children. Pediatr Dev Pathol 2006; 9(3): 210-218.
63. Talley NJ, Walker MM, Aro P, et al. Non-ulcer dyspepsia and duodenal eosinophilia: an adult endoscopic population-based case-control study. Clin Gastroenterol Hepatol 2007; 5(10): 1175-1183.
64. Lwin T, Melton SD, Genta RM. Eosinophilic gastritis: histopathological characterization and quantification of the normal gastric eosinophil content. Mod Pathol 2011; 24(4): 556 - 563.
65. Ko HM, Morotti RA, Yershov O, Chehade M. Eosinophilic gastritis in children: clinicopathological correlation, disease course, and response to therapy. Am J Gastroenterol 2014; 109(8): 1277-1285.
66. Matsushita T, Maruyama R, Ishikawa N, et al. The number and distribution of eosinophils in the adult human gastrointestinal tract: a study and comparison of racial and environmental factors. Am J Surg Pathol 2015; 39(4): 521-527.
67. Barak N, Hart J, Sitrin MD. Enalapril-induced eosinophilic gastroenteritis. J Clin Gastroenterol 2001; 33(2): 157-158.
68. Barbie DA, Mangi AA, Lauwers GY. Eosinophilic gastroenteritis associated with systemic lupus erythematosus. J Clin Gastroenterol 2004; 38(10): 883-886.
69. Miller AI, Smith B, Rogers AI. Phlegmonous gastritis. Gastroenterology 1975; 68(2): 231 - 238.
70. Schultz MJ, van der Hulst RW, Tytgat GN. Acute phlegmonous gastritis. Gastrointest Endosc 1996; 44(1): 80-83.
71. Lifton LJ, Schlossberg D. Phlegmonous gastritis after endoscopic polypectomy. Ann Intern Med 1982; 97(3): 373-375.
72. Mittleman RE, Suarez RV. Phlegmonous gastritis associated with the acquired immunodeficiency syndrome/pre-acquired immunodeficiency syndrome. Arch Pathol Lab Med 1985; 109(8): 765-767.
73. Stein LB, Greenberg RE, Ilardi CF, Kurtz L, Bank S. Acute necrotizing gastritis in a patient with peptic ulcer disease. Am J Gastroenterol 1989; 84(12): 1552-1554.
74. Kim GY, Ward J, Henessey B, et al. Phlegmonous gastritis: case report and review. Gastrointest Endosc 2005; 61(1): 168-174.
75. Oberhuber G, Puspok A, Oesterreicher C, et al. Focally enhanced gastritis: a frequent type of gastritis in patients with Crohn’s disease. Gastroenterology 1997; 112(3): 698-706.
76. Meining A, Bayerdorffer E, Bastlein E, et al. Focal inflammatory infiltrations in gastric biopsy specimens are suggestive of Crohn’s disease. Crohn’s Disease Study Group, Germany. Scand J Gastroenterol 1997; 32(8): 813-818.
77. Oberhuber G, Hirsch M, Stolte M. High incidence of upper gastrointestinal tract involvement in Crohn’s disease. Virchows Arch 1998; 432(1): 49-52.
78. Sharif F, McDermott M, Dillon M, et al. Focally enhanced gastritis in children with Crohn’s disease and ulcerative colitis. Am J Gastroenterol 2002; 97(6): 1415-1420.
79. Kundhal PS, Stormon MO, Zachos M, et al. Gastral antral biopsy in the differentiation of pediatric colitides. Am J Gastroenterol 2003; 98(3): 557-561.
80. Lin J, McKenna BJ, Appelman HD. Morphologic findings in upper gastrointestinal biopsies of patients with ulcerative colitis: a controlled study. Am J Surg Pathol 2010; 34(11): 1672-1677.
81. Ushiku T, Moran CJ, Lauwers GY. Focally enhanced gastritis in newly diagnosed pediatric inflammatory bowel disease. Am J Surg Pathol 2013; 37(12): 1882-1888.
82. Torrente F, Anthony A, Heuschkel RB, et al. Focal-enhanced gastritis in regressive autism with features distinct from Crohn’s and Helicobacter pylori gastritis. Am J Gastroenterol 2004; 99(4): 598-605.
83. Brown I, Kumarasinghe MP. Granulomas in the gastrointestinal tract: deciphering the Pandora’s box. Virchows Arch 2018; 472(1): 3-14.
84. Ectors NL, Dixon MF, Geboes KJ, et al. Granulomatous gastritis: a morphological and diagnostic approach. Histopathology 1993; 23(1): 55-61.
85. Dhillon AP, Sawyerr A. Granulomatous gastritis associated with Campylobacter pylori. APMIS 1989; 97(8): 723-727.
86. Shapiro JL, Goldblum JR, Petras RE. A clinicopathologic study of 42 patients with granulomatous gastritis. Is there really an “idiopathic” granulomatous gastritis? Am J Surg Pathol 1996; 20(4): 462-470.
87. Miyamoto M, Haruma K, Yoshihara M, et al. Isolated granulomatous gastritis successfully treated by Helicobacter pylori eradication: a possible association between granulomatous gastritis and Helicobacter pylori. J Gastroenterol 2003; 38(4): 371-375.
88. Maeng L, Lee A, Choi K, Kang CS, Kim KM. Granulomatous gastritis: a clinicopathologic analysis of 18 biopsy cases. Am J Surg Pathol 2004; 28(7): 941-945.
89. Sandmeier D, Bouzourene H. Does idiopathic granulomatous gastritis exist? Histopathology 2005; 46(3): 352-353.
90. Dewar EP, Dixon MF, Johnston D. Bile reflux and degree of gastritis after highly selective vagotomy, truncal vagotomy, and partial gastrectomy for duodenal ulcer. World J Surg 1983; 7(6): 743-750.
91. Dixon MF, O’Connor HJ, Axon AT, King RF, Johnston D. Reflux gastritis: distinct histopathological entity? J Clin Pathol 1986; 39(5): 524-530.
92. Graham DY, Smith JL. Gastroduodenal complications of chronic NSAID therapy. Am J Gastroenterol 1988; 83(10): 1081-1084.
93. Sobala GM, King RF, Axon AT, Dixon MF. Reflux gastritis in the intact stomach. J Clin Pathol 1990; 43(4): 303-306.
94. Hawkey CJ. Nonsteroidal anti-inflammatory drug gastropathy. Gastroenterology 2000; 119(2): 521-535.
95. Dixon MF. Reflux gastritis. Acta Gastroenterol Belg 1989; 52(3-4): 292-296.
96. Quinn CM, Bjarnason I, Price AB. Gastritis in patients on non-steroidal anti-inflammatory drugs. Histopathology 1993; 23(4): 341-348.
97. El-Zimaity HM, Genta RM, Graham DY. Histological features do not define NSAID-induced gastritis. Hum Pathol 1996; 27(12): 1348-1354.
98. Vieth M, Muller H, Stolte M. Can the diagnosis of NSAID-induced or HP-associated gastric ulceration be predicted from histology? Z Gastroenterol 2002; 40(9): 783-788.
99. McCormack TT, Sims J, Eyre-Brook I, et al. Gastric lesions in portal hypertension: inflammatory gastritis or congestive gastropathy? Gut 1985; 26(11): 1226-1232.
100. Quintero E, Pique JM, Bombi JA, et al. Gastric mucosal vascular ectasias causing bleeding in cirrhosis. A distinct entity associated with hypergastrinemia and low serum levels of pepsinogen I. Gastroenterology 1987; 93(5): 1054-1061.
101. Zhou Y, Chen G, Chen H, et al. Portal hypertensive gastropathy or gastric antral vascular ectasia: is an accurate diagnosis possible on histology? Mod Pathol 2016; 29(Suppl. 2): 211A.
102. Moss SF, Sordillo EM, Abdalla AM, et al. Increased gastric epithelial cell apoptosis associated with colonization with cagA + Helicobacter pylori strains. Cancer Res 2001; 61(4): 1406-1411.
103. Snover DC, Weisdorf SA, Vercellotti GM, et al. A histopathologic study of gastric and small intestinal graft-versus-host disease following allogeneic bone marrow transplantation. Hum Pathol 1985; 16(4): 387-392.
104. Washington K, Bentley RC, Green A, et al. Gastric graft-versus-host disease: a blinded histologic study. Am J Surg Pathol 1997; 21(9): 1037-1046.
105. Epstein RJ, McDonald GB, Sale GE, Shulman HM, Thomas ED. The diagnostic accuracy of the rectal biopsy in acute graft-versus-host disease: a prospective study of thirteen patients. Gastroenterology 1980; 78(4): 764-771.
106. Parfitt JR, Jayakumar S, Driman DK. Mycophenolate mofetil-related gastrointestinal mucosal injury: variable injury patterns, including graft-versus-host disease-like changes. Am J Surg Pathol 2008; 32(9): 1367-1372.
107. Johncilla M, Grover S, Zhang X, Jain D, Srivastava A. Morphological spectrum of immune check-point inhibitor therapy-associated gastritis. Histopathology 2020; 76(4): 531-539.
108. Zhang ML, Neyaz A, Patil D, et al. Immune - related adverse events in the gastrointestinal tract: diagnostic utility of upper gastrointestinal biopsies. Histopathology 2020; 76(2): 233-243.
109. Iacobuzio-Donahue CA, Lee EL, Abraham SC, Yardley JH, Wu TT. Colchicine toxicity: distinct morphologic findings in gastrointestinal biopsies. Am J Surg Pathol 2001; 25(8): 1067-1073.
110. Langner C, Ott A. Possible pitfall in diagnosis: mitotic arrest of gastric epithelium after docetaxel therapy for hormone-refractory prostatic cancer. Histopathology 2007; 51(1): 111-113.
111. Parfitt JR, Driman DK. Pathological effects of drugs on the gastrointestinal tract: a review. Hum Pathol 2007; 38(4): 527-536.
112. Abraham SC, Yardley JH, Wu TT. Erosive injury to the upper gastrointestinal tract in patients receiving iron medication: an underrecognized entity. Am J Surg Pathol 1999; 23(10): 1241-1247.
113. Haig A, Driman DK. Iron-induced mucosal injury to the upper gastrointestinal tract. Histopathology 2006; 48(7): 808-812.
114. Marginean EC, Bennick M, Cyczk J, Robert ME, Jain D. Gastric siderosis: patterns and significance. Am J Surg Pathol 2006; 30(4): 514 - 520.
115. Makino M, Kawaguchi K, Shimojo H, et al. Extensive lanthanum deposition in the gastric mucosa: the first histopathological report. Pathol Int 2015; 65(1): 33-37.
116. Gorospe M, Fadare O. Gastric mucosal calcinosis: clinicopathologic considerations. Adv Anat Pathol 2007; 14(3): 224-228.
117. Greenson JK, Trinidad SB, Pfeil SA, et al. Gastric mucosal calcinosis. Calcified aluminum phosphate deposits secondary to aluminum - containing antacids or sucralfate therapy in organ transplant patients. Am J Surg Pathol 1993; 17(1): 45-50.
118. Matsukuma K, Gui D, Olson KA, et al. Osmo - Prep-associated gastritis: a histopathologic mimic of iron pill gastritis and mucosal calcinosis. Am J Surg Pathol 2016; 40(11): 1550 - 1556.
119. Gonzalez RS, Lagana SM, Szeto O, Arnold CA. Challenges in diagnosing medication resins in surgical pathology specimens: a crystal-clear review guide. Arch Pathol Lab Med 2017; 141(9): 1276-1282.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek 'PULMOPATOLOGIEČlánek 'PATOLOGIE ORL OBLASTIČlánek 'UROPATOLOGIEČlánek 'PATOLOGIE GITČlánek 'PATOLOGIE CNSČlánek 'GYNEKOPATOLOGIEČlánek 'KARDIOPATOLOGIEČlánek 'HEPATOPATOLOGIEČlánek 'ORTOPEDICKÁ PATOLOGIEČlánek 'CYTODIAGNOSTIKAČlánek 'PATOLOGIE GITČlánek 'HISTORIE PATOLOGIEČlánek 'HEMATOPATOLOGIEČlánek Jaká je vaše diagnóza?
Článok vyšiel v časopiseČesko-slovenská patologie

2022 Číslo 2-
Všetky články tohto čísla
- Histopatologická diagnostika nenádorových onemocnění trávicího traktu – 2. část
- Rozhodnutí stát se patoložkou nelituji
- 'PULMOPATOLOGIE
- 'PATOLOGIE ORL OBLASTI
- 'UROPATOLOGIE
- 'PATOLOGIE GIT
- 'PATOLOGIE CNS
- 'GYNEKOPATOLOGIE
- 'KARDIOPATOLOGIE
- 'HEPATOPATOLOGIE
- 'ORTOPEDICKÁ PATOLOGIE
- 'CYTODIAGNOSTIKA
- 'PATOLOGIE GIT
- 'HISTORIE PATOLOGIE
- 'HEMATOPATOLOGIE
- Diferenciální diagnostika nenádorových onemocnění žaludku
- Diferenciální diagnostika nenádorových onemocnění duodena
- Endoskopická diagnostika nejčastějších nenádorových onemocnění gastrointestinálního traktu v pediatrii
- Kribriformně – morulární tyreoidální karcinom: vzácná jednotka
- Jaká je vaše diagnóza?
- Je obezita rizikovým faktorem aterosklerózy?
- Jaká je vaše diagnóza? Odpověď: Metastáza benigního pleomorfního adenomu příušní slinné žlázy do jater
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Diferenciální diagnostika nenádorových onemocnění duodena
- Diferenciální diagnostika nenádorových onemocnění žaludku
- Kribriformně – morulární tyreoidální karcinom: vzácná jednotka
- Endoskopická diagnostika nejčastějších nenádorových onemocnění gastrointestinálního traktu v pediatrii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



