-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Endoskopická diagnostika nejčastějších nenádorových onemocnění gastrointestinálního traktu v pediatrii
The role of endoscopy in non-oncologic gastrointestinal disorders in pediatric patients
Gastrointestinal (GIT) diseases represent an important part of pediatric health disorders. The recent years have brought not only significant improvement of digestive endoscopy technologies and a new equipment suitable for pediatric age but also progress in management of diagnostic approach and treatment of the pediatric GIT diseases. In contrast to adult patients, endoscopic examination in pediatrics is in most cases performed for diagnostic, not therapeutical purposes. The histological assessment of biopsy specimens taken during endoscopy therefore forms an integral part of the endoscopic examination and in most cases the diagnosis cannot be concluded without their evaluation. In particular, the clinical gastroenterologist expects from the pathologist a description that will help confirm or contradict the diagnosis considered after the macroscopic examination. In this review, we would like to highlight the most common endoscopic findings of the gastrointestinal tract in pediatric population and the role of histology in determining the correct diagnosis.
Keywords:
endoscopy – Celiac disease – IBD – GIT diseases – gastrointestinal reflux disease – eosinophilic inflammation
Autori: Lucie Gonsorčíková 1; Silvie Netvalová 1; Radim Vyhnánek 1; David Bauer 1; Ondřej Fabián 2,3
Pôsobisko autorov: Pediatrická klinika 1. lékařské fakulty UK a Fakultní Thomayerovy nemocnice, Praha 1; Pracoviště klinické a transplantační patologie, Institut klinické a experimentální medicíny, Praha 2; Ústav patologie a molekulární medicíny 3. LF UK a FTN, Fakultní Thomayerova nemocnice, Praha 3
Vyšlo v časopise: Čes.-slov. Patol., 58, 2022, No. 2, p. 100-106
Kategória: Přehledový článek
Súhrn
Onemocnění gastrointestinálního traktu (GIT) tvoří značnou část zdravotních problémů v pediatrické populaci. Endoskopická diagnostika u dětí zaznamenala v uplynulém desetiletí významný vzestup nejen na poli rozvoje techniky jako takové, jako je vylepšení instrumentárií vhodných pro pediatrický věk, ale i v posunu mezinárodních doporučených postupů nutných ke správné diagnostice a léčbě jednotlivých onemocnění. Na rozdíl od dospělých pacientů je v pediatrii endoskopické vyšetření prováděno ve většině případů za účelem diagnostickým, nikoli terapeutickým. Histologický popis bioptických vzorků odebíraných při endoskopii proto tvoří nedílnou součást endoskopického vyšetření a ve většině případů nelze bez jejich hodnocení diagnózu uzavřít. Klinický gastroenterolog od patologa očekává zejména popis, který pomůže potvrdit nebo naopak rozporovat diagnózu zvažovanou po makroskopickém vyšetření. V následujícím článku bychom se rádi věnovali nejčastějším endoskopickým nálezům v oblasti gastrointestinálního traktu v dětském věku a přínosu histologie při určování správné diagnózy.
Klíčová slova:
endoskopie – celiakie – onemocnění GIT – IBD – refluxní nemoc – eosinofilní záněty
Endoskopické vyšetření tvoří nedílnou součást diagnostiky onemocnění trávicího traktu (GIT) u dětí i dospělých. V pediatrické populaci se častěji setkáváme s nenádorovými patologickými nálezy. V následujícím textu se věnujeme nejčastějším diagnózám, se kterými se v dětském věku v oblasti GIT setkáváme a kde je endoskopické zhodnocení stavu sliznice na makroskopické i mikroskopické úrovni klíčové ke správnému stanovení diagnózy a následného léčebného postupu.
REFLUXNÍ ONEMOCNĚNÍ JÍCNU (GERD)
Na rozdíl od gastroezofageálního refluxu (GER), kterým je myšlen návrat žaludečního obsahu do jícnu a je do určité míry fyziologickým jevem, o GERD mluvíme v případě, kdy opakované refluxní epizody vedou k obtěžujícím subjektivním symptomům (např. pálení žáhy, dysfagie, odynofagie, hmotnostní neprospívání apod.) nebo k objektivním klinickým příznakům (hemateméza, hmotnostní neprospívání v kombinaci s příznaky GERD, nevysvětlitelná anémie či opakované pneumonie) (1).
V pediatrii je GERD definováno na základě těchto výše uvedených symptomů. Esofagogastroduodenoskopie (EGDS) v tomto případě neslouží k potvrzení diagnózy, ale pro pátrání po přítomnosti komplikací GERD, jako je erozivní ezofagitida, striktura či Barrettův jícen, anatomických abnormit, které predisponují ke vzniku GERD (např. hiátová hernie), nebo pokud v diferenciální diagnóze pomýšlíme na jiná onemocnění, zejména eosinofilní ezofagitidu, uvíznutí cizího tělesa, zánětlivá střevní onemocnění (IBD) či infekční nebo léky indukované záněty jícnu. EGDS indikujeme tehdy, když přetrvávají subjektivní obtíže navzdory adekvátní terapii inhibitory protonové pumpy (PPI) nebo při klinických příznacích.
Není dostatek dat, na základě kterých by bylo možné doporučit k potvrzení diagnózy GERD v pediatrii pH metrii. Užití klasické pH metrie je v posledních letech limitována. Pokud lze, je lepší použít pH-MII (multikanálová intraluminální impedance), která na rozdíl od klasické pH metrie umožňuje identifikovat refluxní epizody bez ohledu na pH (včetně refluxu vzduchu). Role tohoto vyšetření by měla být vyhrazena pro případy, kdy chceme posoudit korelaci refluxních epizod se subjektivními obtížemi a určit pacienty s diagnózou např. funkčních obtíží či neerozivní refluxní nemoci (NERD).
Erozivní ezofagitida je definována přítomností defektů sliznice jícnu. Je však důležité si uvědomit, že makroskopický a mikroskopický popis u dětí spolu špatně koreluje a nepřítomnost makroskopických či mikroskopických změn neznamená automaticky vyloučení GERD (2). Nálezy je proto třeba vždy hodnotit v celkovém kontextu klinického obrazu. K objektivizaci závažnosti nálezu refluxní ezofagitidy při endoskopii se využívají různé klasifikační systémy (Savary-Miller, MUSE), nejčastěji je v praxi využívána klasifikace Losangelská (3). Hodnotí se při ní rozsah slizničních lézí nad gastroezofageální junkcí. Makroskopicky vídáme při EGDS změny různého rozsahu - od mírného zarudnutí sliznice až po viditelné hlubší slizniční poškození, ulcerace (obr. 1) a rozvoj striktury. Pokud nejsou makroskopicky zánětlivé změny na sliznici viditelné, ale jsou popsány histologicky, mluvíme o mikroskopické ezofagitidě. Histologické změny asociované s refluxní ezofagitidou bez přítomnosti makroskopických změn byly poprvé popsány v roce 1970 v práci autorů Ismuil-Beigi et.al. (4) Při histologickém vyšetření od patologa zejména očekáváme, zda změny svědčí spíše pro GERD, anebo jestli by se diferenciálně diagnosticky mohlo jednat i o jiné onemocnění, např. eosinofilní ezofagitidu. Důležité je i posouzení přítomnosti intestinální metaplázie z důvodu délky léčby a určení frekvence kontrolních vyšetření. Při prvním endoskopickém vyšetření u dítěte s podezřením na refluxní ezofagitidu je doporučeno odebírat 2-4 vzorky z proximálního i distálního jícnu (5). Před EGDS je vhodné vysazení medikamentózní terapie PPI z důvodu možného zkreslení nálezu. Kontrolní endoskopie není ve většině případů po nasazení léčby nutná, indikujeme ji u závažnějších stupňů refluxní ezofagitidy, při nedostatečné odpovědi na terapii anebo při rozvoji pozánětlivé striktury jícnu.
Obr. 1. Refluxní ezofagitida. 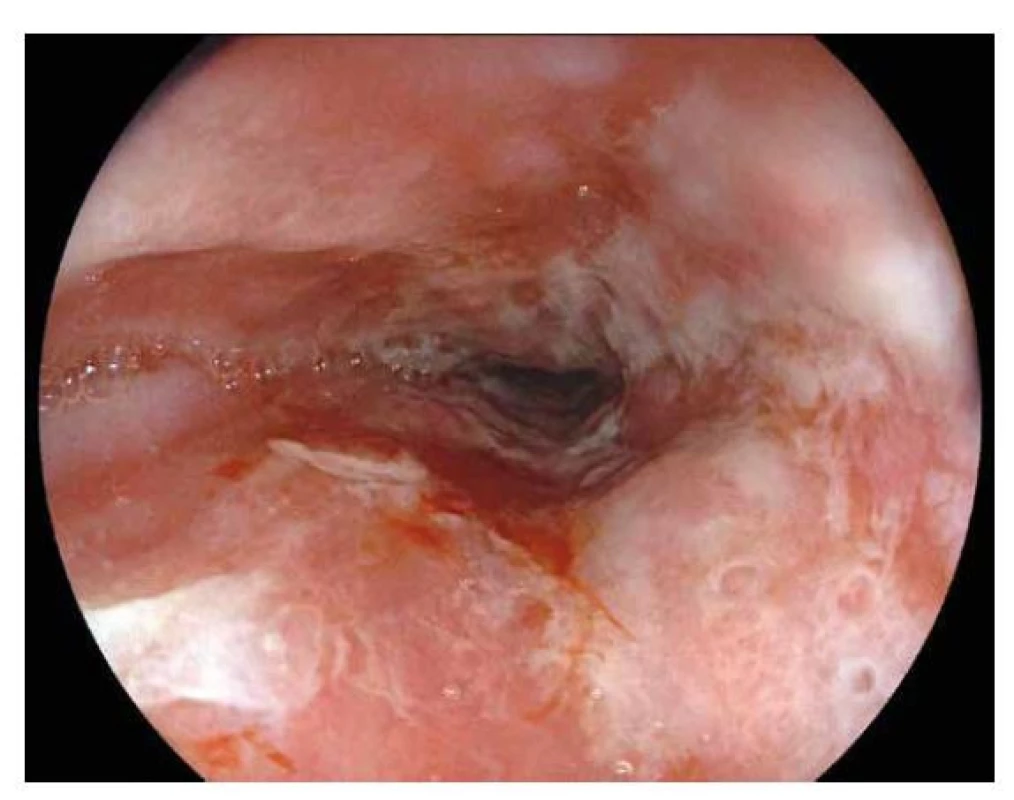
Endoskopický obraz křehké, zarudlé sliznice jícnu s erozemi a pablánami tvořenými fibrinovým exsudátem. BARRETTŮV JÍCEN (BJ)
BJ je stav hodnocený jako prekanceróza, při které dochází k makroskopicky viditelným metaplastickým změnám na sliznici jícnu, kdy je původní dlaždicový epitel nahrazen orálně od gastroezofageální junkce intestinálním cylindrickým epitelem. (6) Vidíme neostrou Z-linii a plaménkovitě vybíhající okrsky metaplasticky změněné erytematózní sliznice do bledší, fyziologické sliznice jícnu. Změny lze lépe vizualizovat přístrojem s nastavitelnou vlnovou délkou světla, například Narrow Band Imaging (NBI), který umožní detekovat povrchové změny sliznice s výraznějším kontrastem. Odebírány jsou kvadrantové biopsie v 1-2 cm úsecích v délce viditelného postižení jícnu. U dětí s těžkou chronickou ezofagitidou je prevalence BJ přibližně 5-10 %, u dětí s GERD obecně 0,3-4,8 % (7). Pro klinického lékaře je velmi důležité, aby histopatolog dobře zhodnotil eventuální přítomnost a stupeň dysplázie, podle kterého se pak odvíjí frekvence doporučených kontrolních endoskopií a terapeutický přístup. Diagnóza BJ je potvrzena přítomností viditelných makroskopických změn v kombinaci s histologickým nálezem.
EOSINOFILNÍ ONEMOCNĚNÍ GIT (EGID)
Jedná se o onemocnění, které je charakterizováno infiltrací eosinofilních granulocytů ve tkáních GIT vedoucích k funkčním a morfologickým změnám. Podle místa výskytu se dělí na eosinofilní ezofagitidu (EoE), gastritidu, enteritidu či kolitidu. Patogeneze těchto onemocnění dosud nebyla jednoznačně popsána. Zvažuje se vliv nadměrné exprese Th2 lymfocytů, v jícnu též expozice sliznice nízkému pH při frekventovaných refluxních epizodách, které zvyšují permeabilitu sliznice a umožňují průnik potravinových i inhalačních alergenů subepiteliálně, což ve svém důsledku vede k chronické eosinofilní infiltraci (8).
EoE patří mezi nejčastější eosinofilní postižení GIT, odhadem postihuje 29.5/100 000 dětí celosvětově (9). Podle současných doporučení je diagnóza EoE splněna, pokud má pacient klinické symptomy (nejčastěji dysfagie a pocit uvízlého sousta v jícnu) společně s histologickým průkazem eosinofilní infiltrace (10).
Endoskopické změny typické pro EoE jsou edém s vymizelou cévní kresbou, bělavý exsudát (tvořený agregáty eosinofilních granulocytů) na povrchu sliznice, podélné rýhování (furrowing), koncentricky naznačené prstence (tzv. tracheizace jícnu), v pokročilém stadiu i rozvoj striktury (obr. 2). Až u 33 % pacientů však může být na sliznici makroskopický nález normální a diagnózu potvrdí až histologický nález (11). Zatímco exsudát, rýhování a edém jsou považovány za změny zánětlivé, prstence a tvorba striktur jsou důsledkem fibrotizace a remodelace stěny jícnu při pokročilém onemocnění, jejich incidence roste s věkem a jsou vidět spíše u dospělých než pediatrických pacientů. K potvrzení diagnózy je nutné histologické vyšetření bioptických vzorků sliznice, které při podezření na EoE odebíráme z důvodu co nejvyšší záchytnosti ze tří etáží jícnu: proximálně, mediálně a v distální části jícnu, přičemž se snažíme o odběr z viditelně postižených částí.
Obr. 2. Eosinofilní ezofagitida. 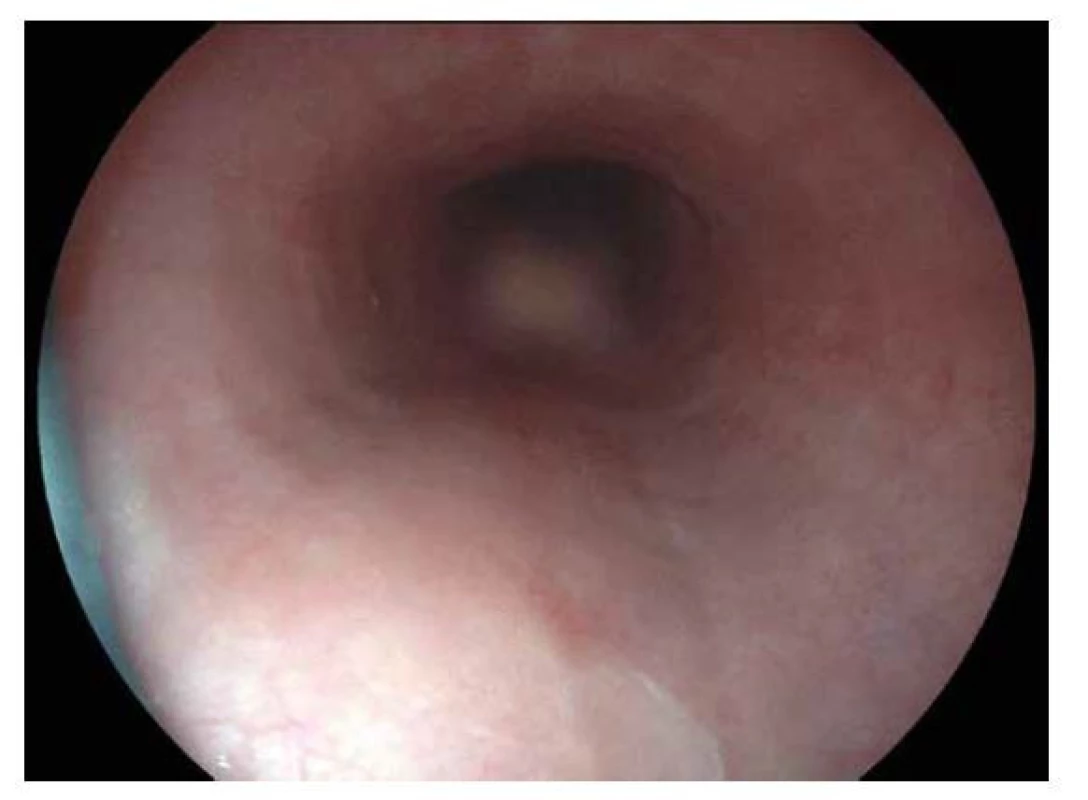
Endoskopický obraz zarudlé edematózní sliznice jícnu se známkami tracheizace (koncentricky naznačené prstence). Histologicky je pro klinika důležité stanovení typické intraepiteliální přítomnosti eosinofilních granulocytů, které by u této dg. mělo být rovno nebo více než 15 na zorné pole mikroskopu s velkým zvětšením (HPF) (12). Optimálně by měl být tento počet přesně vyjádřen. Tato příměs může být patrná ve vzorku z kterékoli etáže jícnu, nejčastěji však bývá přítomna distálně. Vzhledem k tomu, že komplikací EoE je i fibrotizace lamina propria, je pro klinika důležité i její zhodnocení, které nejenže svědčí pro dg. EoE, ale svědčí i pro pokročilejší rozsah poškození (13). Oproti EoE nejsou eosinofilní záněty dalších částí GIT jednoznačně diagnosticky definovány. Klinické příznaky při EGID nejčastěji zrcadlí oblast, která je u daného pacienta zánětlivě změněna a patří k nim bolesti břicha, zvracení či průjmy. Až u 50 % pacientů se podobně jako u EoE vyskytují přidružené diagnózy jako je atopický ekzém či astma bronchiale. Laboratorně ale na rozdíl od EoE bývá nápadná zvýšená eosinofilie v periferní krvi, často provázená elevací CRP, hypoalbuminémií nebo anémií (8). Endoskopické změny při EGID jsou nepříznačné a často je nelze makroskopicky odlišit od jiných patologických stavů v oblasti GIT. Patří k nim edém a zarudnutí sliznice, eroze nebo ulcerace. Z důvodu této makroskopické nespecifity je histologické zhodnocení velmi důležité, zejména v rámci diferenciální diagnostiky a odlišení především IBD. Pro klinika je důležité histologické zhodnocení počtu eosinofilních granulocytů. Hustota eosinofilní infiltrace se totiž v jednotlivých segmentech GIT liší. Stoupá směrem od žaludku do tenkého střeva, svého maxima dosahuje v terminálním ileu a céku, dále opět klesá a v rektu již dosahuje opět minimálních hodnot. Přítomnost 15 eosinofilů/HPF zde proto nemůžeme považovat za patognomickou, suspektní jsou hodnoty nad 30 eosinofilů/HPF v žaludku, nad 50 eosinofilů/ HPF v ileu, 50-100 eosinofilů/HPF v terminálním ileu a pravostranném kolon a dále nad 50 eosinofilů/HPF v distálních částech kolon a rektu (14). Při hodnocení eosinofilní příměsi v distálnějších úsecích GIT je vhodné vyšetřit i přítomnost eosinofilů z biopsií v jícnu, jejichž přítomnost zde i navzdory negativnímu klinickému a endoskopickému obrazu podporuje diagnózu eosinofilního zánětu. Vzhledem k nepravidelné, kolísavé hustotě eosinofilní inflitrace je třeba při podezření na EGID odebírat větší množství bioptických vzorků. Vždy je třeba pátrat po sekundárních příčinách eosinofilie, jako je např. parazitární infekce. Při určení diagnózy je třeba se řídit komplexním obrazem klinickým, endoskopickým a histologickým, event. v případě nejistoty vyšetření zopakovat s časovým odstupem.
CELIAKIE
Při celiakii dochází u geneticky predisponovaných jedinců ke ztrátě imunitní tolerance vůči gliadinu a dalším prolaminům. Výsledkem je imunopatologická reakce, která vede k poškození sliznice střevní stěny a více či méně rozvinutým známkám malabsorpčního syndromu. Celiakie zůstává nezřídka poddiagnostikována a ne všichni pacienti, včetně pediatrických, jeví v době diagnózy klinické příznaky. Z tohoto důvodu byla v poslední době vydána nová doporučení pro diagnostiku celiakie s cílem celý diagnostický proces usnadnit. Zatímco v uplynulých letech bylo nutné pro potvrzení diagnózy provést enterobiopsii, dle nových revidovaných doporučení Evropské společnosti pro dětskou gastroenterologii, hepatologii a výživu (ESPGHAN) z roku 2020 (15) je možné diagnózu stanovit i na základě non-biopsy kritérií, mezi které patří vzestup sérových protilátek proti tkáňové transglutamináze ve třídě IgA více než desetinásobně při současné pozitivitě EMA IgA alespoň ve dvou různých vzorcích. Zároveň je třeba vyloučit hypogamaglobulinémii ve třídě IgA. Tam, kde tyto podmínky nejsou splněny, je třeba pro potvrzení diagnózy provedení enterobiopsie, která se provádí při EGDS. Odebíráme minimálně čtyři vzorky z duodena distálně od Vaterské papily a jeden vzorek z bulbu. Makroskopicky je někdy patrné vyhlazení slizničních řas duodena nebo vícečetné fisury na jejich okrajích, edém, políčkování či nodularity sliznice (obr. 3). Mikroskopicky se vyhodnocuje stav sliznice podle Marsh-Oberhuberovy klasifikace, pro klinickou diagnózu celiakie svědčí nález Marsh grade 2 a výše. Léčbou je zahájení celoživotní bezlepkové diety, přičemž terapeutický přístup se u jednotlivých stupňů klasifikace dle Marshe neliší. U zhodnocení nálezu jako Marsh 1 nelze diagnózu celiakie stanovit a bezlepkovou dietu nezahajujeme. Při přetrvávání klinického podezření je vhodné zopakovat sérologii, event. enterobiopsii s časovým odstupem. V době diagnózy je nutná plná zátěž lepkem. Odběr enzymů kartáčového lemu není rutinní součástí enterobiopsie a přistupujeme k němu tehdy, pokud máme podezření ještě na jiná malabsorpční onemocnění.
Obr. 3. Celiakie. 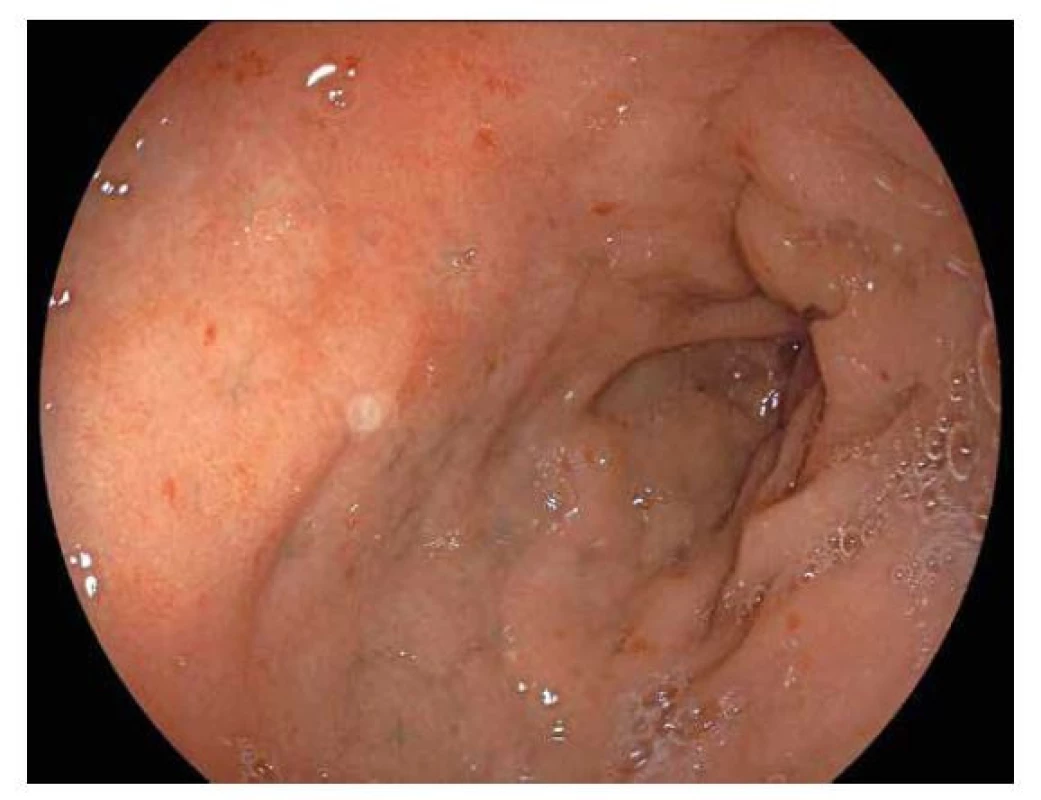
Diskrétní endoskopický nález u pacienta s céliakií. V duodenu vidíme pouze mírné ložiskové zarudnutí slizničního povrchu. VŘEDOVÁ CHOROBA GASTRODUODENA A HELICOBACTER PYLORI (HP)
Vředová choroba gastroduodena bývá považována za onemocnění spíše dospělého věku, nicméně i u dětí je její výskyt signifikantní. Neléčená gastritida může vyústit v rozvoj peptického vředu a jeho komplikacím, jako je krvácení, striktura či perforace. Jako gastritidu označujeme stav, kdy dochází k zánětlivé infiltraci žaludeční stěny, jako gastropatii situaci, kdy dochází k poškození epitelu bez jednoznačné přítomnosti zánětlivých buněk. U peptického vředu dochází k hlubšímu poškození sliznice. Někteří autoři označují všechny tyto situace za různá stadia téže choroby. K rozvoji onemocnění dochází, pokud nad protektivními faktory (produkce hlenové vrstvy na povrchu žaludeční sliznice, pH neutrální pufrovací zóna bikarbonátu produkovaná epiteliálními buňkami a bohaté prokrvení sliznice) převáží faktory škodlivé (excesivní produkce gastrinu a histaminu vedoucí k hypersekreci kyselé žaludeční šťávy). Mezi nejčastější etiologické spouštěče vředové choroby patří infekce (Helicobacter pylori, méně často EBV, CMV, mykotické či parazitární infekce), léky (např. nesteroidní antiflogistika, železo), stres a trauma, méně často se v etiologii uplatňují hypersekreční stavy (Zolinger-Ellisonův syndrom), endokrinopatie jako je např. hyperparathyreóza, systémová mastocytóza nebo chronické selhání ledvin (16). Vždy, když nalezneme u dítěte či dospívajícího vředovou chorobu žaludku bez průkazu etiologie HP, je nutné další pečlivé vyšetření, protože někdy může jít o součást závažného onemocnění (např. syndrom MEN Ia), kdy je včasné stanovení diagnózy pro další osud pacienta zcela zásadní. Klinicky se vředová choroba může manifestovat různými symptomy, od mírnějších, jako je bolest v epigastriu, zejména po jídle, úbytek hmotnosti a chronická anémie až po závažné, jako je náhle vzniklé krvácení do GIT s rozvojem hemoragického šoku či známky náhlé příhody břišní. Při podezření je metodou volby gastroskopie, kdy je potřeba prohlédnout celou oblast žaludku a duodena a cíleně pátrat po přítomnosti lézí.
HP infekce je nejčastějším etiologickým faktorem při rozvoji vředové choroby gastroduodena u dětí. V biopsii pacientů s prokázaným peptickým vředem je přítomnost HP prokázána až v 90,6 % případů (17), proto je při nálezu vředu u dítěte při gastroskopii vždy indikováno HP vyloučit. Na druhou stranu, rozvoj vředové choroby je v celkovém počtu infikovaných nízký a stoupá s věkem - pouze v 5 % u dětí do 12 let a v 10 % u adolescentů (17). Pro potvrzení infekce HP u dětí je endoskopie nutná, ostatní metody (jako je serologický průkaz protilátek proti HP či dechové testy) nejsou pro průkaz infekce a k rozhodnutí o následující terapii vhodné. Gastroskopii bychom měli indikovat jedině tehdy, pokud má dítě klinické symptomy, nikoli k samotnému zjištění přítomnosti HP. Při gastroskopii nacházíme nejčastěji změny odpovídající chronické gastritidě (event. duodenitidě), jako je přítomnost mnohočetných slizničních nodulů, hypertrofie, edém a překrvení žaludečních řas či políčkování sliznice. Jako rychlý průkaz infekce může posloužit rychlý ureázový test, kdy díky přítomnosti ureázy produkované HP dochází ke změně barvy testovacího roztoku po vložení vzorku odebraného při endoskopii. Tento test má sice nižší výpovědní hodnotu než přímý průkaz HP z histologického vzorku, nicméně při klinickém podezření při jeho pozitivitě pacienta přeléčujeme. K definitivnímu potvrzení diagnózy však slouží mikroskopický průkaz HP v bioptickém vzorku, který má 100% specificitu. Sledování antigenu HP ve stolici má význam pouze pro sledování úspěšnosti eradikace.
ZÁNĚTLIVÁ STŘEVNÍ ONEMOCNĚNÍ (IBD)
IBD jsou chronická, relabující onemocnění gastrointestinálního traktu, která zahrnují Crohnovu nemoc (CN), ulcerózní kolitidu (UC) a neklasifikované zánětlivé střevní onemocnění (IBDU). Až 25 % IBD se projeví v dětském věku, incidence těchto onemocnění (hlavně CN) v rozvinutých zemích stále roste – v ČR je incidence CN v dětském věku 5,2/100 000, u UC 3,4/100 000 ročně. (18).
Diagnostika IBD je komplexní proces, který kromě anamnézy, klinické symptomatologie a laboratorních metod (zánětlivé parametry, sérologie) zahrnuje hlavně endoskopickou, zobrazovací a histologickou diagnostiku.
Endoskopické vyšetření je zásadní nejen pro stanovení diagnózy IBD a jejího rozsahu, ale též pro detekci komplikací s možností jejich následné terapie (např. dilatace striktur, zavedení trasovací ligatury píštělí atd.). Důležitou roli pak hraje též ke sledování efektu terapie, v dospělém věku při v dlouhodobé dispenzarizaci pacientů pro nebezpečí vzniku dysplázie a rozvoje karcinomu střeva. V pediatrické populaci je v souladu s tzv. Portskými kritérii při diagnostice IBD na rozdíl od dospělého věku nutné vždy provést nejen kolonoskopii s intubací terminálního ilea, ale též ezofagogastroduodenoskopii s odběrem etážových biopsií ze všech vyšetřovaných i makroskopicky normálních úseků gastrointestinální sliznice a dále vyšetřit tenké střevo pomocí MRI enterografie (19). Doplňkově lze při přetrvávající nejistotě ohledně diagnózy použít kapslovou endoskopii. Hlavní nevýhodou této metody je riziko retence kapsle a nemožnost získat bioptický materiál.
Histologický popis je pro klinika nedílnou součástí diagnostického procesu stanovení IBD. I tehdy, pokud je makroskopický nález “jednoznačný”, je pro stanovení definitivní diagnózy velmi přínosné, když je mikroskopicky popis v souladu s klinicky zvažovanou diagnózu. Řada jiných onemocnění totiž může svým endoskopickým obrazem IBD imitovat. Např. ne zcela zhojený infekční zánět (např. po prodělané Campylobakterové či Salmonelové enteritidě) může mít neodlišitelný makroskopický obraz. I když se snažíme po zjevně proběhlé infekci při přetrvávajícím klinickém podezření dělat endoskopii s dostatečným časovým odstupem, někdy může vzácně dojít k nálezům, kdy zánětlivé změny na sliznici přetrvávají. Pak je obtížné makroskopicky určit, zda se jedná o reziduální postinfekční změny, anebo zda infekce indukovala jiný, např. autoimunní zánět (příkladem může být enteropatie doprovázející reaktivní artritidu po prodělané Campylobacterové infekci) a popis histologie je v těch případech velmi nápomocný. Makroskopicky může podobně jako IBD vypadat i střevní zánět, který je součástí jiného systémového autoimunního onemocnění, jako je např. systémový lupus erytematodes nebo některé vaskulitidy (např. granulomatóza s polyangiitidou). Léčba je zde zcela odlišná a správné určení diagnózy je někdy možné jen na základě histologického nálezu. Naprosto zásadní je histologické zhodnocení v situacích, kdy makroskopický nález není příznačný směrem ke konkrétní diagnóze (UC nebo CN). Histologický popis tak bývá často určující pro zvolení vhodného léčebného postupu.
Samostatnou kapitolou je histologické vyšetření u pacientů již pro IBD léčených. Indikací ke kontrolní endoskopii bývá buď zhoršení klinického stavu a laboratorních nálezů, nebo delší časový odstup od vstupní endoskopie, kdy chceme zhodnotit aktuální stav např. před předáním do péče pro dospělé pacienty. Zde je role histologa opět nezastupitelná, kdy i při makroskopicky příznivém nálezu mikroskopická aktivita zánětu svědčí pro inkompletní navození remise a je pro klinika signálem, že by měl intenzifikovat či dokonce změnit terapii. Tato rozhodnutí se většinou dělají v kontextu dalších, zejména klinických a laboratorních nálezů.
Ulcerózní kolitida (UC)
UC je hemoragicko-katarální zánět sliznice tlustého střeva šířící se kontinuálně z rekta orálním směrem a stejně jako u CN se jedná o chronické relabující onemocnění.
Toto onemocnění typicky postihuje rektum a různě dlouhý úsek kolon. Dle rozsahu postižení kolon rozdělujeme UC do 4 forem: proktitida, proktosigmoiditida, levostranná kolitida (postižení po lienální flexuru) a pankolitida. V dětském věku se až v 80 % případů jedná o pankolitidu. Endoskopický obraz není pro UC patognomonický, ale je do určité míry charakteristický. Mění se dle stupně zánětlivých změn. Při mírné zánětlivé aktivitě je typický lehký otok sliznice vedoucí ke ztrátě cévní slizniční kresby, s narůstáním intenzity zánětu dochází k většímu prosáknutí sliznice se vznikem drobných nerovností vyvolávajících její granulární vzhled. K výraznějším zánětlivým změnám patří fenomén křehké sliznice s kontaktním krvácením (obr. 4), dále se mohou objevit drobné slizniční defekty (eroze) a na sliznici může být větší množství hlenu. Při pokročilém zánětu sliznice krvácí spontánně a mohou se objevit ulcerace, které jsou jen výjimečně hluboké nebo splývající. Hluboké a splývající vředy nacházíme při fulminantním průběhu UC, který hrozí komplikacemi jako je toxické megakolon nebo spontánní perforace tlustého střeva. U ohraničených forem UC je přechod v normální sliznici relativně ostrý. U pacientů s levostranným postižením může být patrné zarudnutí a prosáknutí v oblasti ústí appendixu (cekální patch). U pacientů s pankolitidou se mohou podobné zánětlivé změny vyskytnout na sliznici terminálního ilea v rozsahu cca do 10 cm (tzv. backwash ileitida). V některých případech bývá krátký úsek rekta nepostižen (rectal sparing), což může vést k diagnostickým rozpakům. Při déletrvajícím a těžším průběhu UC se mohou v tlustém střevě nacházet změny způsobené destrukcí a následnou regenerací střevní sliznice. Jedná se o zánětlivé pseudopolypy, jenž jsou tvořeny regeneráty sliznice, granulační tkání a zánětlivou infiltrací (obr. 5).
Obr. 4. Ulcerózní kolitida. 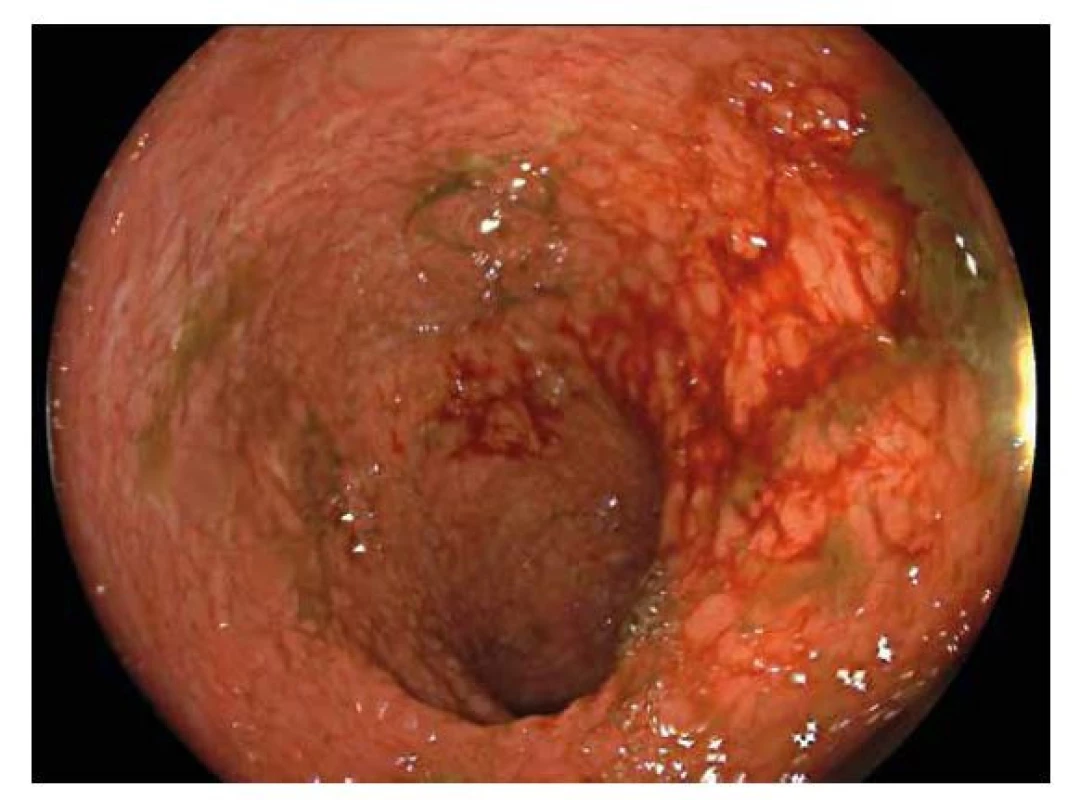
Endoskopický obraz difuzně zarudlé edematózní sliznice tlustého střeva, s vymizelou cévní kresbou. Sliznice je křehká, kontaktně krvácející. Haustrace jsou vyhlazené. Obr. 5. Ulcerózní kolitida. 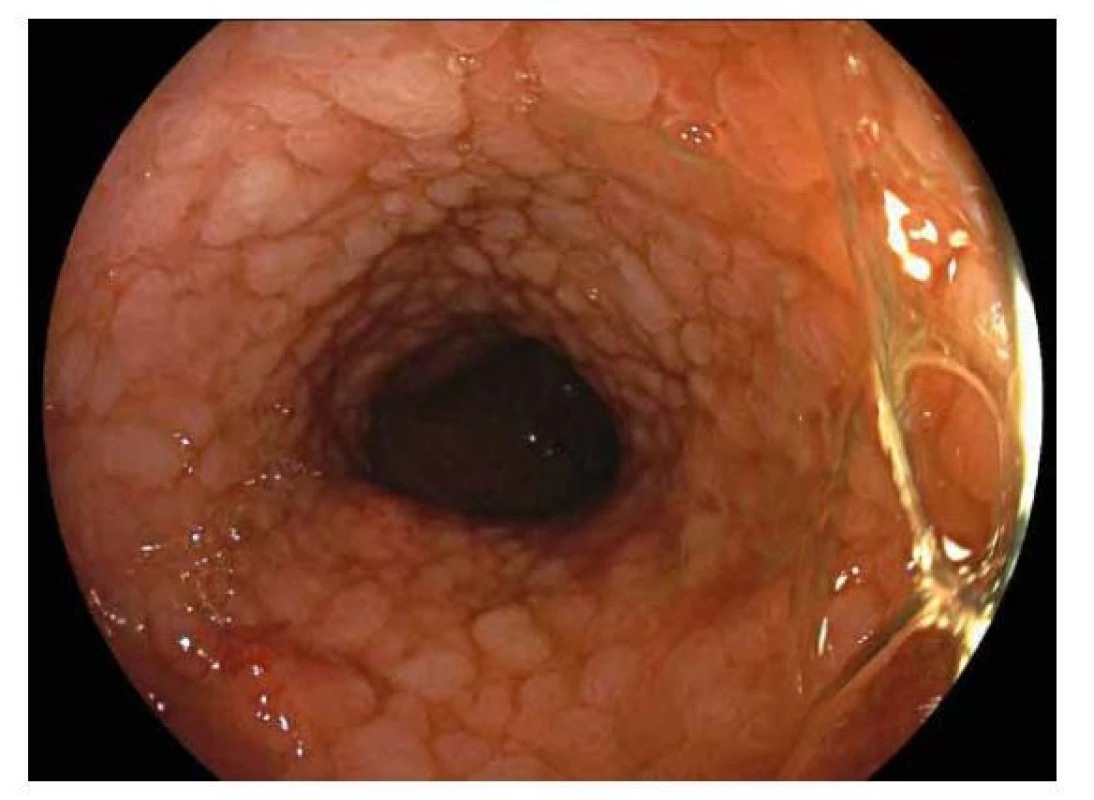
Endoskopický obraz difuzně zánětlivě změněné sliznice tlustého střeva připomínající vzhledem až pseudopolypózní charakter. Vyhlazené haustrace. Crohnova nemoc (CN)
CN je transmurální zánět postihující diskontinuálně jakoukoliv část GIT a často vykazující granulomatózní rysy. Probíhá chronicky, kdy se období relapsů střídá s obdobím remisí.
Hlavní odlišností v endoskopickém obraze je distribuce zánětlivých změn, která je u CN segmentální a fokální, tedy úseky postižené sliznice se střídají s úseky intaktní sliznice (skip lesions). Lokalizována může být kdekoliv v průběhu gastrointestinálního traktu. Typickou lokalizací v dětském věku je terminální ileum, které může být postižené samostatně nebo častěji společně s tlustým střevem. Typickým nálezem u CN jsou aftoidní léze charakteru terčíku s centrální bělavou nekrózou ohraničenou červeným lemem mírně prominující nad okolní sliznici, pokročilejším nálezem pak je větší slizniční eroze (5-8 mm), obvykle s bílou spodinou (obr. 6,7). Histologicky jde o defekt zasahující hluboko do sliznice, ale nepronikající přechodovou vrstvou hladké svaloviny do submukózy (20). Pokročilou endoskopickou změnou jsou pak hluboké, tzv. serpiginózní vředy, které jsou orientované v podélné ose střeva, často zasahují nejen do vlastní svaloviny tlustého nebo tenkého střeva, ale až na serózu, nebo dokonce penetrují mimo stěnu a dávají tak vznik vnitřním píštělím, abscesům nebo zánětlivým infiltrátům. Mnohočetné hluboké fisurální vředy edematózní sliznice dávají vznik obrazu dlažebních kostek (tzv. cobblestone pattern). Vzácně se může při endoskopickém vyšetření zachytit vnitřní ústí píštěle, a to hlavně v oblasti anorektální junkce. Přítomnost píštěle je typická pro CN a prakticky vylučuje UC.
Obr. 6. Crohnova nemoc. 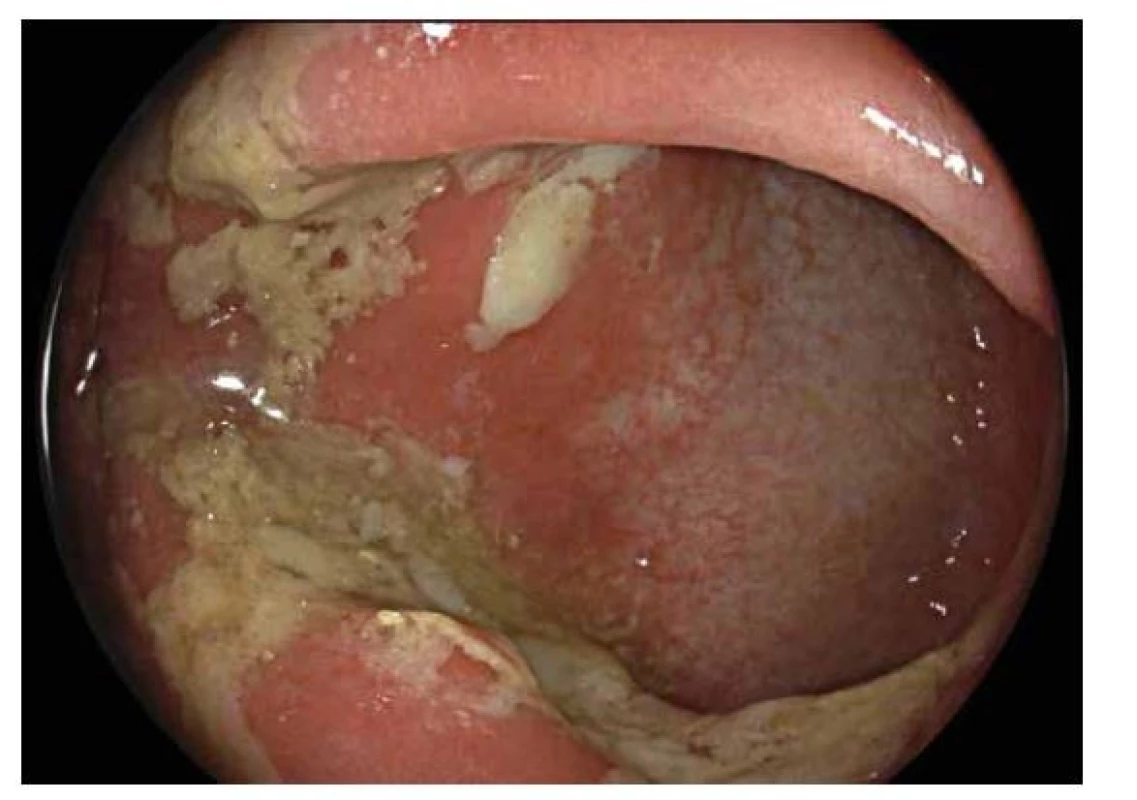
Endoskopický obraz segmentálního postižení tlustého střeva projevující se erozemi s bílou spodinou tvořenou fibrinem se zarudlým okolím. V okolí intaktní sliznice. Obr. 7. Crohnova nemoc. 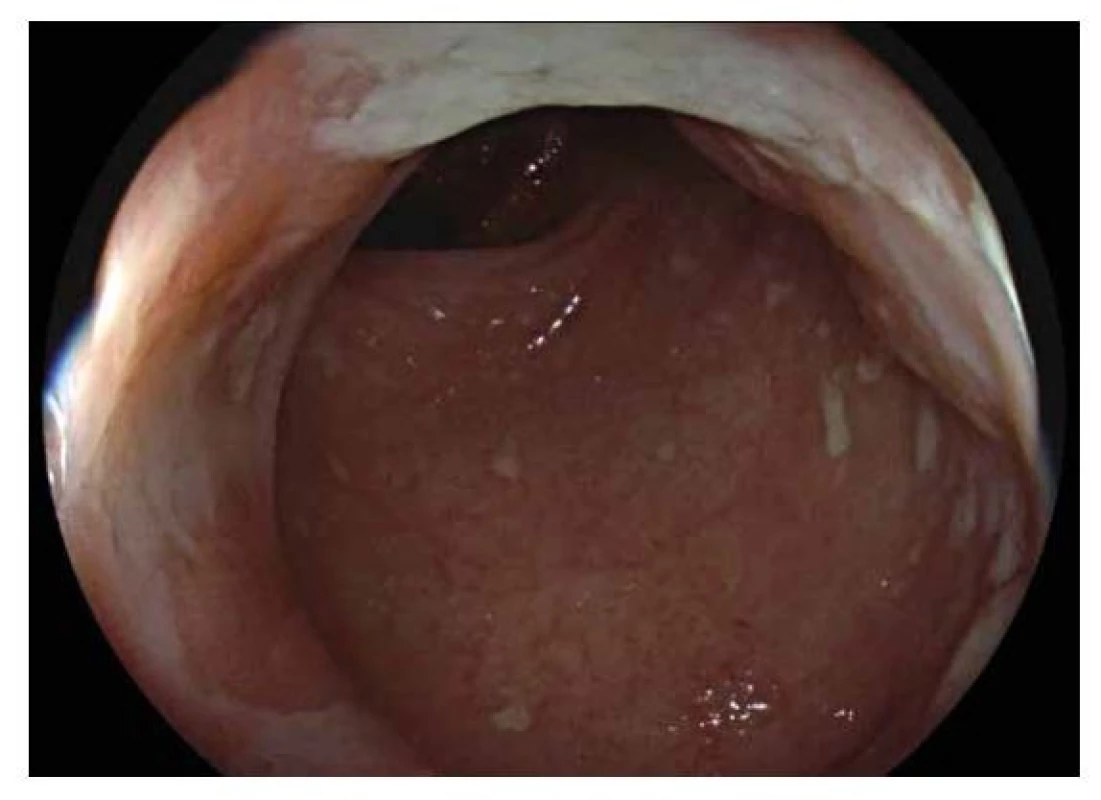
Endoskopický obraz segmentálního postižení tlustého střeva projevující se aftoidními lézemi (menší, kulovité) a většími erozemi s bílou spodinou. Neklasifikované zánětlivé střevní onemocnění je onemocnění omezené na kolon, u kterého se ani po absolvování celého diagnostického procesu nepodaří jednoznačně rozlišit, zda se jedná o UC nebo CN. Část skupiny těchto pacientů se v čase vyvine směrem k UC (častěji) nebo CN.
POLYPÓZNÍ ONEMOCNĚNÍ
Solitární juvenilní polyp (SJP)
Jedná se o nejčastější (90 %) polypózní afekci v dětském věku (21). Typicky se vyskytuje u dětí předškolního věku a manifestuje se zpravidla krvácením z konečníku. Ojediněle se může vyskytnout i v počtu větším než jeden, pokud by se ovšem při endoskopii našlo více než pět polypů, je vždy potřeba vyloučit diagnózu juvenilních polypózních syndromů. SJP se nejčastěji vyskytuje v levostranném kolon, ale až u 30 % případů se může vyskytnout i ve vyšší etáži, proto je třeba provést endoskopii vždy celého tlustého střeva. SJP může být přisedlý, nebo pendulující, někdy dosahující velikosti i několika centimetrů (obr. 8), mnohdy bývá sliznice na povrchu s erozemi či kontaktně krvácí. Polyp bývá většinou odstraněn během kolonoskopie polypektomickou kličkou. U SJP je riziko malignizace minimální, dysplastické změny jsou popisovány pouze raritně (22). Pokud není důvod, nemusí pacient se SJP podstupovat po odstranění polypu kontrolní kolonoskopii.
Obr. 8. Solitární juvenilní polyp. 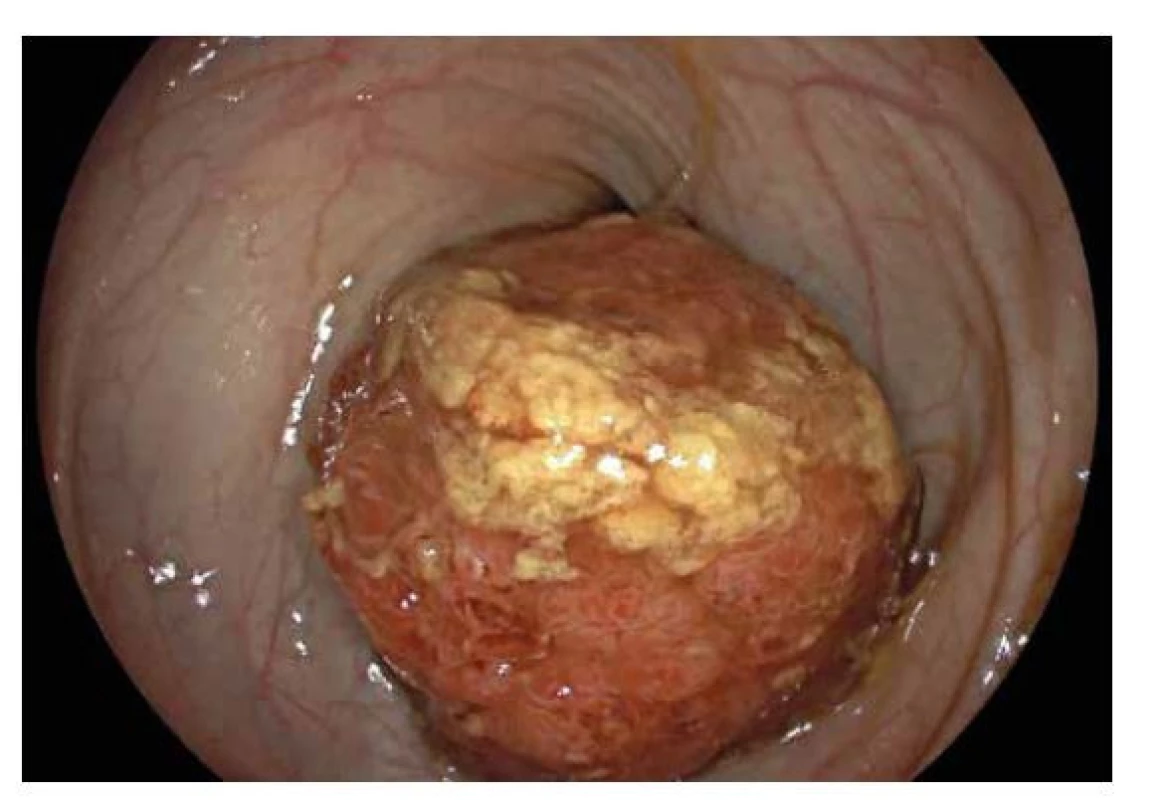
Endoskopický obraz objemného pendulujícího polypu v tlustém střevě se zánětlivě změněnou a kontaktně krvácející sliznicí. Juvenilní polypózní syndromy (JPS)
JPS jsou vzácná, autosomálně dominantní onemocnění s výskytem 1 : 100 000 – 1 : 160 000 obyvatel. Jsou charakterizována rozvojem mnohočetných hamartomatózních polypů v průběhu GIT, nejčastěji kolon, které představují významné riziko maligního zvratu v pozdějším průběhu života. (23) JPS je třeba zvažovat tehdy, pokud v průběhu kolon nalezneme více než pět juvenilních polypů, prokážeme polypy i v horní části GIT či pokud nalezneme i solitární polyp u pacienta s pozitivní rodinnou anamnézou. U 40-60 % pacientů bývá identifikována mutace v genu SMAD4 (18q21.1) anebo BMPR1A ((10q23.2). Až ve 25 % se jedná o mutaci vzniklou de novo. Ve stejné chromozomální oblasti genu BMPR1A se nachází tumor supresorový gen PTEN (10q22–23). Pacienti s popsanou delecí obou těchto genů jsou predisponováni k agresivnějšímu fenotypu tohoto onemocnění - juvenile polyposis of infancy (JPI), který se může projevit závažnými průjmy, krvácením, anémií, protein-losing enteropatií, intususcepcí či prolapsem rekta. Zároveň zde může být přítomna celá řada extraintestinálních manifestací (zejména kardiologické, neurologické, endokrinní), proto je při průkazu mutací JPI nutný i cílený orgánový screening k vyloučení těchto komplikací. Pacienti s mutací v genu SMAD4 mají ve většině případů překryvný výskyt s hereditární hemoragickou teleangiektázií, pro kterou je typický výskyt mukokutánních teleangiektázií a orgánových arterio-venosních malformací zejména v plicích, játrech a mozku, kde mohou být život ohrožující. Děti s rizikem rozvoje JPS by měly podstoupit genetické testování a endoskopický screening mezi 12-15 rokem života. (24) Pokud dítě nejeví symptomy postižení horní části GIT, stačí v tomto věku pouze provedení kolonoskopie. Endoskopicky nacházíme množství (desítky až stovky) polypů velikosti 5-50 mm, přičemž polypy velikosti nad 1 cm jsou indikovány k endoskopickému odstranění. Termínem juvenilní polyp se v tomto případě nemyslí věk pacienta, ale stupeň vývoje polypu. Méně často v dětském věku nalezneme dysplázii a pokud ano, svědčí to pro závažnější fenotyp s nutností časnější profylaktické kolektomie. Tvarem mohou být polypy podobně jako SJP přisedlé, sférické nebo pendulující, mnohdy s povrchovou erozí. Při maligním zvratu se mluví o tzv. “landscapers mechanism”, u kterého se popisuje, že v abnormálním prostředí polypového stromatu dochází k neoplastické transformaci přilehlého epitelu, který ve svém důsledku vede ke vzniku invazivního karcinomu. Imunohistochemicky lze prokázat absenci SMAD4 proteinu u nositelů zárodečné mutace v tomto genu. Pacienti se závažnou rodinnou anamnézou a vícečetnou detekcí polypů by měli podstoupit endoskopickou surveillance každý rok, u dětí s menším počtem odstranitelných polypů a bez rodinné zátěže lze frekvenci endoskopií prodloužit až na pět let. Zároveň by u JPS měli být geneticky vyšetřeni všichni prvostupňoví příbuzní pacienta.
Peutz-Jeghersův syndrom (PJS)
PJS je geneticky podmíněné, autosomálně dědičné onemocnění asociované s mutací v genu STK11 (LKB1). Je spojené se vznikem mnohočetných hamartomatózních polypů v GIT, asociovaných s mukokutánní hyperpigmentací. Tato hyperpigmentace se objevuje až u 95 % pacientů, typická je lokalizace kolem úst včetně bukální sliznice, ale může se vyskytnout též kolem nostril, v perianální oblasti, na prstech a volárních i dorsálních částech končetin. Pro polypy je charakteristický květákovitý (vějířovitý) vzhled. Mohou být lokalizovány kdekoli v průběhu GIT i extraintestinálně, např. v močovém měchýři, žlučníku či uvnitř bronchů. Pacienti s PJS mají zvýšené riziko maligního zvratu, a to nejen v oblasti GIT, ale též v celé řadě dalších orgánů. Doporučeno je provést endoskopický screening nejpozději do 8. roku života, v případě klinických obtíží kdykoli dříve, pravidelné kontroly je vhodné provést po dvou, nejpozději po třech letech. Endoskopicky je vhodné odstranit polypy větší než 5 mm, často je nutno provést chirurgickou resekci z důvodu komplikací, jako je intususcepce či ileosní stav. (25)
ZÁVĚR
V posledních letech přibývá počet endoskopických výkonů u dětských pacientů. Důvodem je jak navyšování incidence jednotlivých onemocnění postihující zažívací trakt u dětí, tak větší dostupnost tohoto vyšetření a nabývání klinických zkušeností jednotlivých gastroenterologických pracovišť. Diferenciální diagnostika zůstává často široká a pro klinického lékaře je histologické zhodnocení endoskopických nálezů klíčové při rozhodování v diagnosticko-terapeutickém procesu. S přibýváním léčebných možností zejména na poli IBD je trendem postupovat v léčbě co nejvíce “na míru” konkrétnímu pacientovi. Nezřídka se stává, že jeden typ onemocnění se může projevovat velmi rozdílně u dvou různých pacientů a od toho se pak odvíjí i prognóza a odpověď na terapii. Histopatolog tak může být velmi nápomocen nejen při určení správné diagnózy, ale též při rozhodování o správné léčebné modalitě. Jako kliničtí lékaři oceníme nejen interpretaci mikroanatomie slizničního nálezu, ale též diferenciálně diagnostickou rozvahu histopatologa s ohledem na individuální situaci daného pacienta. Velmi užitečné jsou například víceoborové semináře, kdy dochází k diskuzi mezi gastroenterologem, histopatologem a dalšími specialisty, jako je např. chirurg či radiolog a jednotlivé nálezy jsou hodnoceny ve společném kontextu.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Lucie Gonsorčíková, Ph.D.
Pediatrická klinika 1. lékařské fakulty UK
a Fakultní Thomayerovy nemocnice
Vídeňská 800, Praha 4, 140 00
tel.: 26108 2328
email: lucie.gonsorcikova@ftn.cz
Zdroje
1. Rosen R, Vandenplas Y, Singendonk M et al. Pediatric Gastroesophageal Reflux Clinical Practice Guidelines: Joint Recommendations of the North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition and the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition. J Pediatr Gastroenterol Nutr 2018; 66(3): 516-554.
2. Arasu TS, Wyllie R, Fitzgerald JF et al. Gastroesophageal reflux in infants and children comparative accuracy of diagnostic methods. J Pediatr 1980; 96(5): 798-803.
3. Lundell LR, Dent J, Bennett JR et al. Endoscopic assessment of oesophagitis: clinical and functional correlates and further validation of the Los Angeles classification. Gut 1999; 45(2): 172-180.
4. Ismuil-Beigi F, Horton PF. Pope CE II. Histological consequences of gastroesophageal reflux in man. Gastroenterology 1970; 58 : 163 - 174.
5. Hradský O, Bajerová K, Bronský J et al. Diagnostika a léčba refluxního onemocnění u dětí: český sjednocený doporučený postup z pohledu gastroenterologa, pneumologa, ORL lékaře, neonatologa a chirurga. Čes-slov Pediat 2016; 71 (1): 5-6.
6. Jeurnink SM, van Herwaarden-Lindeboom MY, Siersema PD, Fischer K, Houwen RH, van der Zee DC. Barrett‘s esophagus in children: does it need more attention? Dig Liver Dis 2011; 43(9) :682-687.
7. Kinoshita Y, Oouchi S, Fujisawa T. Eosinophilic gastrointestinal diseases - Pathogenesis, diagnosis, and treatment. Allergol Int 2019; 68(4): 420-429.
8. Molodecky NA, Soon IS, Rabi DM, Ghali WA et al. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review. Gastroenterology 2012; 142(1): 46-54.e42
9. Dellon ES, Liacouras CA, Molina-Infante J, Furuta GT et al. Updated International Consensus Diagnostic Criteria for Eosinophilic Esophagitis: Proceedings of the AGREE Conference. Gastroenterology 2018; 155(4): 1022 - 1033.
10. Bolton SM, Kagalwalla AF, Wechsler JB. Eosinophilic Esophagitis in Children: Endoscopic Findings at Diagnosis and Post-intervention. Curr Gastroenterol Rep 2018; 20(1): 4.
11. Liacouras CA, Furuta GT, Hirano I et al. Eosinophilic esophagitis: updated consensus recommendations for children and adults. J Allergy Clin Immunol 2011; 128(1): 3-20.e6; quiz 21-2.
12. Dellon ES, Kim HP, Sperry SL, Rybnicek DA, Woosley JT, Shaheen NJ. A phenotypic analysis shows that eosinophilic esophagitis is a progressive fibrostenotic disease. Gastrointest Endosc 2014; 79(4): 577-85.e4.
13. Collins MH, Capocelli K, Yang GY. Eosinophilic Gastrointestinal Disorders Pathology. Front Med (Lausanne) 2018; 4 : 261.
14. Husby S, Koletzko S, Korponay-Szabó I, Kurppa et al. European Society Paediatric Gastroenterology, Hepatology and Nutrition Guidelines for Diagnosing Coeliac Disease 2020. J Pediatr Gastroenterol Nutr 2020; 70(1): 141-156.
15. Sierra D, Wood M, Kolli S, Felipez LM. Pediatric Gastritis, Gastropathy, and Peptic Ulcer Disease. Pediatr Rev 2018; 39(11): 542-549.
16. Koletzko S, Richy F, Bontems P, Crone J et al. Prospective multicentre study on antibiotic resistance of Helicobacter pylori strains obtained from children living in Europe. Gut 2006; 55(12): 1711-1716.
17. Jones NL, Koletzko S, Goodman K et al. ESPGHAN, NASPGHAN. Joint ESPGHAN/NASPGHAN Guidelines for the Management of Helicobacter pylori in Children and Adolescents (Update 2016). J Pediatr Gastroenterol Nutr 2017; 64(6): 991-1003.
18. Jabandziev P, Pinkasova T, Kunovsky L et al. Regional Incidence of Inflammatory Bowel Disease in a Czech Pediatric Population: 16 Years of Experience(2002-2017). J Pediatr Gastroenterol Nutr 2020; 70(5): 586-592.
19. Levine A, Koletzko S, Turner D, Escher JC et al. European Society of Pediatric Gastroenterology, Hepatology, and Nutrition. ESPGHAN revised porto criteria for the diagnosis of inflammatory bowel disease in children and adolescents. J Pediatr Gastroenterol Nutr 2014; 58(6): 795-806.
20. Lukáš M. Postavení koloskopie u idiopatických střevních zánětů. Endoskopie 2010; 19(3 a 4): 105-111.
21. Adolph VR, Bernabe K. Polyps in children. Clin Colon Rectal Surg 2008; 21(4): 280-285.
22. Giardiello FM, Hamilton SR, Kern SE, et al. Colorectal neoplasia in juvenile polyposis or juvenile polyps. Arch Dis Child 1991; 66(8): 971 - 975.
23. Brosens LA, Langeveld D, van Hattem WA, Giardiello FM, Offerhaus GJ. Juvenile polyposis syndrome. World J Gastroenterol 2011; 17(44): 4839-4844.
24. Cohen S, Hyer W, Mas E, et al. Management of Juvenile Polyposis Syndrome in Children and Adolescents: A Position Paper From the ESPGHAN Polyposis Working Group. J Pediatr Gastroenterol Nutr 2019; 68(3): 453-462.
25. Choi HS, Park YJ, Park JG. Peutz-Jeghers syndrome: a new understanding. J Korean Med Sci 1999; 14(1): 2-7.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek 'PULMOPATOLOGIEČlánek 'PATOLOGIE ORL OBLASTIČlánek 'UROPATOLOGIEČlánek 'PATOLOGIE GITČlánek 'PATOLOGIE CNSČlánek 'GYNEKOPATOLOGIEČlánek 'KARDIOPATOLOGIEČlánek 'HEPATOPATOLOGIEČlánek 'ORTOPEDICKÁ PATOLOGIEČlánek 'CYTODIAGNOSTIKAČlánek 'PATOLOGIE GITČlánek 'HISTORIE PATOLOGIEČlánek 'HEMATOPATOLOGIEČlánek Jaká je vaše diagnóza?
Článok vyšiel v časopiseČesko-slovenská patologie

2022 Číslo 2-
Všetky články tohto čísla
- Histopatologická diagnostika nenádorových onemocnění trávicího traktu – 2. část
- Rozhodnutí stát se patoložkou nelituji
- 'PULMOPATOLOGIE
- 'PATOLOGIE ORL OBLASTI
- 'UROPATOLOGIE
- 'PATOLOGIE GIT
- 'PATOLOGIE CNS
- 'GYNEKOPATOLOGIE
- 'KARDIOPATOLOGIE
- 'HEPATOPATOLOGIE
- 'ORTOPEDICKÁ PATOLOGIE
- 'CYTODIAGNOSTIKA
- 'PATOLOGIE GIT
- 'HISTORIE PATOLOGIE
- 'HEMATOPATOLOGIE
- Diferenciální diagnostika nenádorových onemocnění žaludku
- Diferenciální diagnostika nenádorových onemocnění duodena
- Endoskopická diagnostika nejčastějších nenádorových onemocnění gastrointestinálního traktu v pediatrii
- Kribriformně – morulární tyreoidální karcinom: vzácná jednotka
- Jaká je vaše diagnóza?
- Je obezita rizikovým faktorem aterosklerózy?
- Jaká je vaše diagnóza? Odpověď: Metastáza benigního pleomorfního adenomu příušní slinné žlázy do jater
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Diferenciální diagnostika nenádorových onemocnění duodena
- Diferenciální diagnostika nenádorových onemocnění žaludku
- Kribriformně – morulární tyreoidální karcinom: vzácná jednotka
- Endoskopická diagnostika nejčastějších nenádorových onemocnění gastrointestinálního traktu v pediatrii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



