-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kazuistika: Akutní poškození ledvin s progresí do chronicity u starší pacientky
A case report: Acute kidney injury with progression to chronicity in an eldery woman
Acute renal failure in elderly patients can be caused by a wide spectrum of diseases that usually have a cause outside the kidney. The most common causes include renal impairment as part of ANCA vasculitis, another category includes clonal plasmatic cell disease with light chain cast nephropathy; and there also exists an increasing number of drug-induced tubulointerstial damage. We present a case of iatrogenic less common form of acute failure in a 73-year-old woman, who did not suffer from any serious disease until then. Although the biopsy helped to determine the cause of the failure and thus affect subsequent therapy, the function did not return to the previous state and the patient progressed to CKD G3bA1 with serum creatinine values of around 170-140 μmol/l.
Keywords:
statins – drug toxicity – rhabdomyolysis – acute kidney injury – renal biopsy – renal intratubular casts
Autori: Olga Snížková 1; Karolína Krátká 2; Martin Havrda 2; Ivan Rychlík 2; Mayara Elisa Knížek Bonatto 2; Eva Honsová 1
Pôsobisko autorov: Aeskulab Patologie, k. s., Praha 1; Interní klinika 3. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady, Praha 2
Vyšlo v časopise: Čes.-slov. Patol., 59, 2023, No. 2, p. 80-84
Kategória: Původní práce
Súhrn
Náhle vzniklé akutní selhání ledvin u pacientů ve vyšším věku může být způsobeno širokým spektrem chorob, které mají obvykle příčinu mimo ledviny. Mezi nejčastější patří postižení ledvin jako součást ANCA vaskulitid, další kategorie zahrnuje klonální onemocnění plasmatických buněk s nadprodukcí lehkých řetězců (light chain cast nephropathy, tzv. myelomová ledvina) a také stále narůstající počet polékových poškození tubulointersticia ledvin. Prezentujeme případ iatrogenní, méně obvyklé formy akutního selhání u 73 leté ženy, která do té doby netrpěla žádným závažným onemocněním. I když biopsie napomohla určit příčinu selhání a tím ovlivnit následující terapii, funkce ledvin se do předchozího stavu nevrátila a pacientka progredovala do CKD G3bA1 s hodnotami sérového kreatininu kolem 170-140 μmol/l.
Klíčová slova:
statiny – léková toxicita – rabdomyolýza – akutní poškození ledvin – renální biopsie – tubulární válce
Akutní poškození ledvin (acute kidney injury, AKI) je klinický termín obecně definovaný jako náhle vzniklý, potencionálně reverzibilní pokles renálních funkcí podmíněný rychlým poklesem glomerulární filtrace u pacientů s nebo bez předchozího chronického ledvinného onemocnění. Jde o závažný stav spojený s vysokou morbiditou i mortalitou, projevující se zvýšenou hladinou sérového kreatinitu (S-Cr) nebo snížením diurézy až anurickým stavem (1,2). Incidence AKI je nejvyšší ve skupině starších pacientů se zvýšeným rizikem přechodu do chronického onemocnění ledvin. Jedná se o častou komplikaci hospitalizace především u kriticky nemocných pacientů s přidruženými komorbiditami, u kterých je etiologie AKI multifaktoriální s významným podílem ischémie. Vedle těchto stavů spadají do kategorie akutního selhání ledvin také glomerulární onemocnění (především ANCA pozitivní GN) a také onemocnění způsobená nadprodukcí lehkých řetězců (light chain cast nephropathy, tzv. myelomová ledvina) a stále narůstající počet polékových poškození tubulointersticia ledvin (3). Většina pacientů hospitalizovaných na jednotkách intenzivní péče nevyžaduje provedení biopsie ledvin, protože důvod akutního poškození spadá do kategorie tzv. „šokové ledviny“. V některých případech má ale biopsie stále nezastupitelné místo, protože umožní určit příčinu selhání a tím významnou měrou ovlivnit následující terapii.
POPIS PŘÍPADU
73 letá pacientka s anamnézou dlouhodobě dobře kompenzované arteriální hypertenze a diabetu mellitu (DM) 2. typu na dietě bez komplikací byla hospitalizována pro cca týden trvající progresivní slabost dolních končetin s bolestí lýtek, neschopností chůze, nechutenstvím a sníženou diurézou. Laboratorně bylo patrné akutní poškození ledvin s výrazně zvýšenými vstupními hodnotami S-Cr (832 μmol/l, norma 60-100 μmol/l) a urey (36,5 μmol/l, norma 3,5-7,2 μmol/l). Markantně zvýšené byly hodnoty aminotransferáz ALT (15,11 μkal/l, norma 0,1-0,78 μkat/l) a AST (17,62 μkal/l, norma 0,05-0,75 μkat/l), mírně zvýšená byla také hladina C-reaktivního proteinu (17,5 mg/l, norma do 5 mg/l). Imunologie zahrnující detekci ANCA a anti-GBM protilátek byla negativní. Současně pacientka vyvinula těžkou oligurii až anurii s výraznou proteinurií a hematurií, která při vyšetření ve fázovém kontrastu nebyla glomerulárního původu. Sonograficky byly ledviny lehce zvětšené, bez ložiskových změn a bez městnání v kalicho-pánvičkovém systému.
Diferenciální diagnóza na základě klinických údajů
Provedení cílené diferenciálně diagnostické rozvahy je nezbytnou součástí postupu již při rozdělování nativního materiálu do 3 různých technik zpracování, protože umožní preferovat postup, který s největší pravděpodobností povede ke stanovení diagnózy (4). Důvodem je fakt, že ne vždy je biopsie dostatečně velká nebo s dostatečným počtem nezaniklých glomerulů, aby bylo možné vzorek rozdělit do všech 3 metod.
Příčiny akutního selhání ledvin u starší ženy, která se dosud s ničím významným neléčila, zahrnují především ANCA pozitivní vaskulitidu, tubulointersticiální nefritidu (často polékovou, např. po ATB) a light chain cast nefropatii u myelomu. Dále se v této skupině může vyskytovat raritní anti-GBM GN a některé další vzácné diagnózy. O ANCA vaskulitidu se při známé negativitě protilátek s velkou pravděpodobností jednat nebude (případy ANCA negativních GN se srpky jsou extrémně vzácné). Stejně tak nepůjde téměř s jistotou o anti-GBM GN. Hypertenze je dobře korigovaná, nepůjde tedy ani o selhání ledvin při maligní hypertenzi nebo sklerodermii (které přicházejí obvykle v mladším věku). O postižení intersticia v rámci klonálních nemocí plasmatických buněk (MGUS, MGRS: monoklonální gamapatie renálního významu) by se jednat mohlo. Různé varianty chorob ledvin doprovázejících klonální expanzi plazmatických buněk (od amyloidu, proximální tubulopatii s krystaly nebo bez krystalů, ukládání lehkých nebo těžkých řetězců, proliferativní GN s monoklonálními depozity až po tzv. myelomovou ledvinu s válci z lehkých řetězců) se obvykle projeví ve vyšším věku a incidence těchto onemocnění v poledních letech narůstá. Často jsou klinicky skryté a mají nespecifické a velmi variabilní projevy, včetně snížení funkce ledvin a akutního selhání. I o další varianty tubulointerstiální nefritidy by se jednat mohlo (3,5). Závěr na základě klinických dat Jako nejpravděpodobnějším důvodem selhání se zdá postižení intersticia ledvin, které může mít velmi rozdílnou etiologii. Stejně uvažoval i klinik a indikoval provedení biopsie ledviny. Současně vzhledem k nízkým zánětlivým parametrům byla doplněna především toxická/léková anamnéza a další laboratorní vyšetření. Extrémních hodnot dosahovala hladina sérového myoglobinu (>20 000 μg/l, norma 28-72 μg/l). Anamnesticky byla u pacientky zjištěna eskalace terapie statiny – recentně byla provedena změna léčebné dávky pacientkou dlouhodobě užívaného statinovového přípravku v množství 10 mg /den na jiný přípravek ze skupiny statinů v množství 40 mg /den. Současně byla vyloučena intoxikace metforminem při perorální léčbě DM. Také jiná prerenální etiologie krom snížené hydratace se jevila jako nepravděpodobná, postrenální příčiny selhání byly vyloučeny. Mikroskopické vyšetření a stanovení diagnózy Obdrželi jsme 2 punkce ledviny, jedna z nich pro světelnou mikroskopii byla 8 mm dlouhá; druhá pro byla určena pro další imunofluorescenci a elektronovou mikroskopii. Ve vzorku pro imunofluorescenci bylo zastiženo 8-12 glomerulů. Průkazy imunoglobulinů (IgG, IgA, IgM), frakcí komplementu (C3 a C1q), dále lehkých řetězců kappa a lambda; a AA amyloidu byly negativní. Ve vzorku pro světelnou mikroskopii bylo zastiženo 12-14 glomerulů, z toho byl 1 zaniklý. Glomeruly byly normální velikosti nebo lehce zvětšené s normální mezangiální a endokapilární buněčností (obr. 1). Glomeruly byly bez srpků a bez sklerotizací, glomerulární bazální membrány (GBM) byly bez dvojkontur. V intersticiu byl edém, řídká tvořící se fibróza a fokálně smíšená zánětlivá celulizace. Většina kanálků měla oploštělou výstelku a morfologii akutního tubulárního poškození. V proximálních tubulech byly v luminech vločkovité PAS pozitivní válce (obr. 2). Cévy měly přiměřenou morfologii vaskulárních změn doprovázejících stárnutí. Doplnili jsme imunohistochemický průkaz myoglobinu, který byl pozitivní (obr. 3). Morfologie odpovídala akutnímu tubulárnímu poškození s myoglobinovými válci. Současně smíšená zánětlivá celulizace v intersticiu přesahovala morfologii reaktivního zánětu a byla hodnocena jako součást tubulointersticiální nefritidy.
Obr. 1. Glomerulus s normální buněčností, bez proliferace. Přilehlé okolí s rozšířeným intersticiem s mírným zánětem a kanálky s oploštělou výstelkou. Barveno hematoxylinem eosinem (zvětšení 200x). 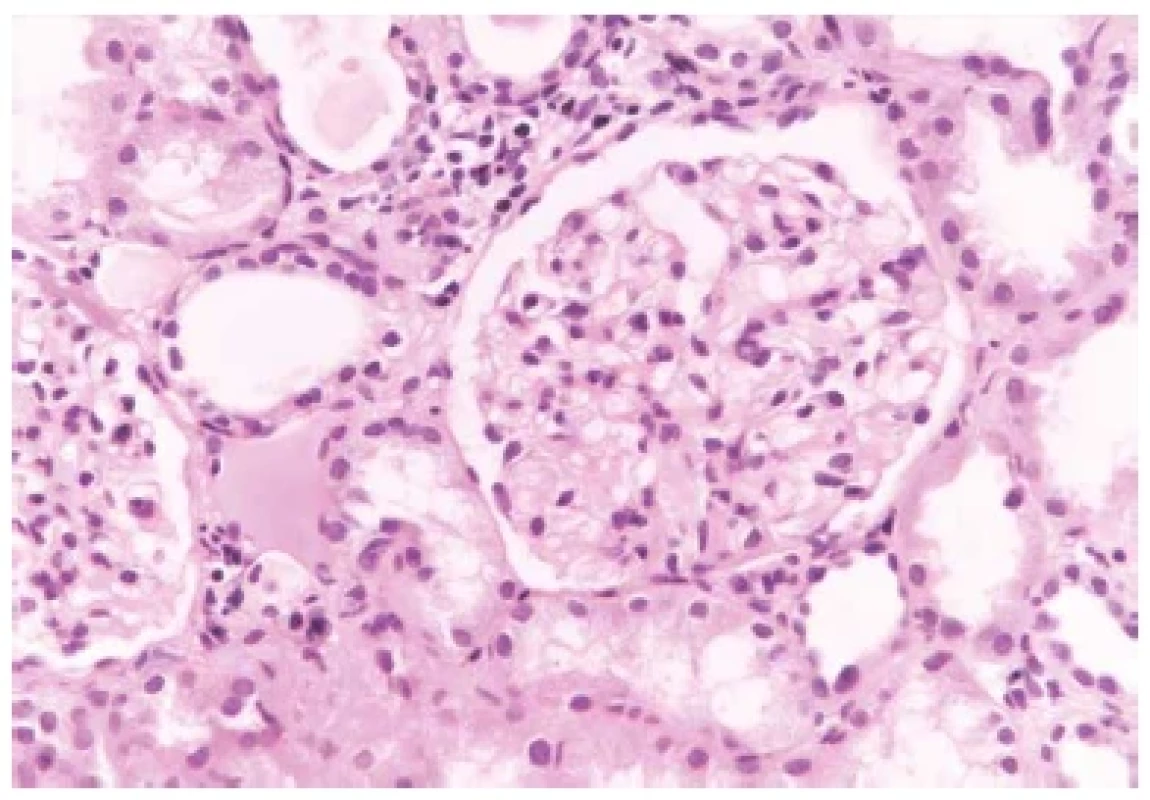
Obr. 2. Přiměřené glomeruly a skupina kanálků s PAS pozitivními vločkovitými válci s mírným zánětem v okolí. Barveno PASem (zvětšení 200x). 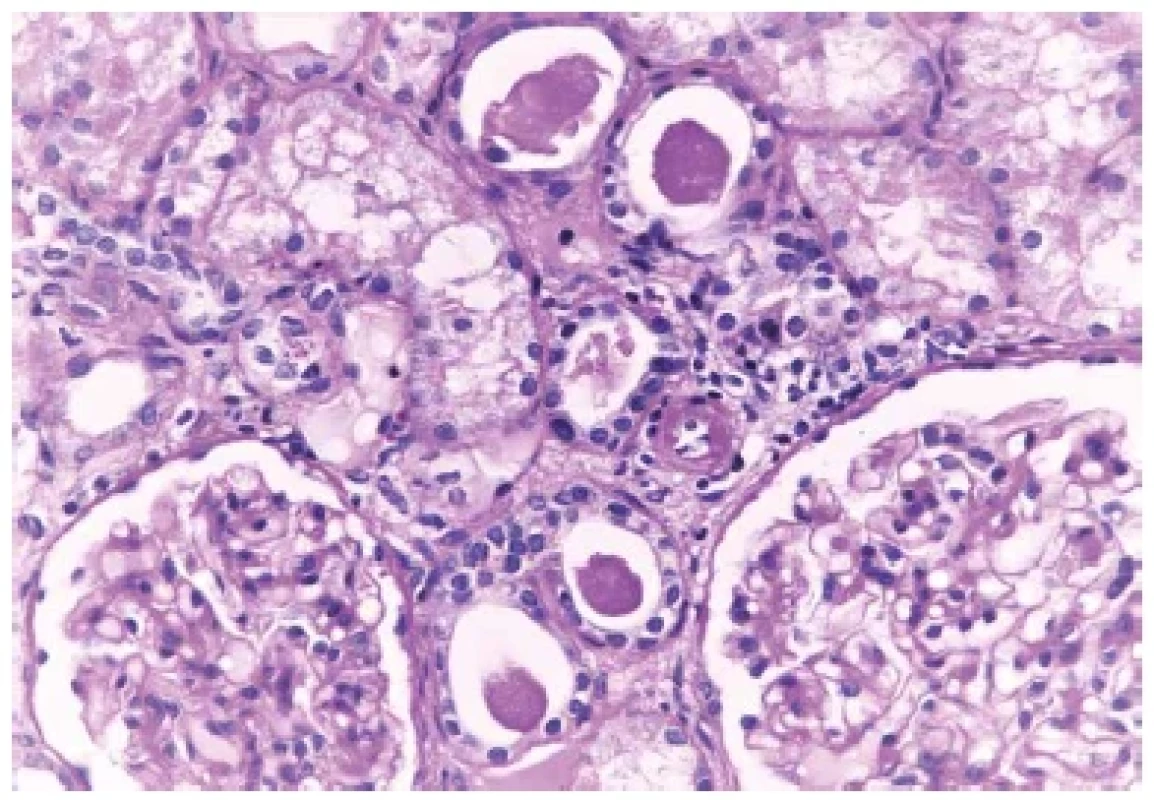
Obr. 3. Imunohistochemický průkaz myoglobinu ve vločkovitém válci v luminu tubulu (zvětšení 400x). 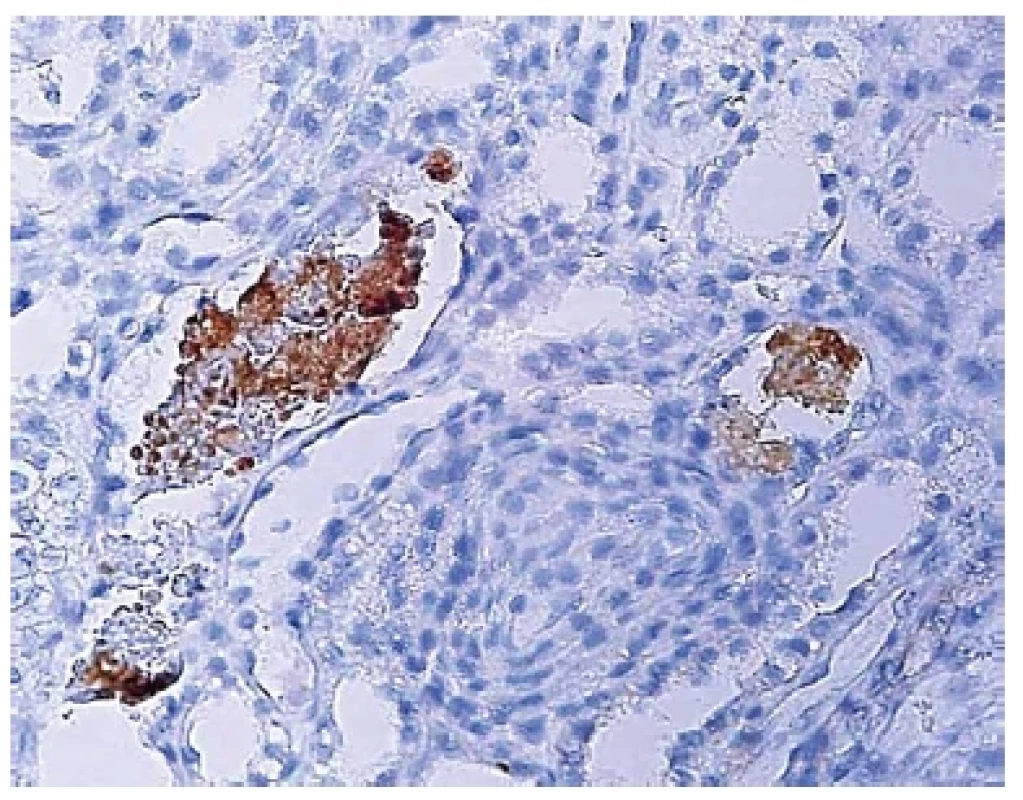
Vzhledem k doplněným anamnestickým a laboratorním údajům je nepochybně poškození ledvin součástí toxického efektu léčby statiny s rhabdomyolýzou a myoglobinurií.
Léčba zahrnovala akutní hemodialýzu. Při dialyzační strategii byl navozen uspokojivý pokles hladin svalových enzymů a renálních parametrů. Po rehydrataci došlo rovněž k obnovení diurézy s následným rozvojem polyurické fáze AKI. V dalším průběhu hospitalizace byla snaha o udržení vyrovnané bilance, hodnoty kreatininu se ustálily mezi 300-350 μmol/l. Pacientka začala plně rehabilitovat a na nastavené antihypertenzní terapii byl krevní tlak v uspokojivých mezích. Hodnoty glykémie byly uspokojivé pouze na diabetické dietě.
Z nefrologického hlediska se stav postupně stabilizoval, k obnovení renálních funkcí tak, jak byly před onemocněním, nedošlo. Při pomalé a postupné reparaci odpovídá funkce ledvin chronickému onemocnění ledvin CKD G3bA1 s hodnotami sérového kreatininu kolem 170-140 μmol/l.
DISKUZE
Rabdomyolýza je charakterizovaná rozpadem skeletálních svalů, což vede k uvolnění intracelulárních složek svalových buněk a jejich úniku do krve – jedná se především o myoglobin, kreatinkinázu (CK) a aminotransferázy ALT a AST, z elektrolytů pak hlavně draslík, fosfáty a uráty.
Klinicky se rabdomyolýza projevuje klasickou triádou symptomů: slabostí, lokalizovanou nebo generalizovanou bolestí svalů a myoglobinurií (která způsobuje zbarvení moči přirovnávané k barvě tmavého čaje). Tyto symptomy se však nemusí vždy plně projevit. Mezi život ohrožující komplikace patří akutní selhání ledvin, dysbalance elektrolytů (především hyperkalémie může vyvolat srdeční arytmii nebo přímo srdeční zástavu) a mezi vzácné život ohrožující komplikace v případě rozsáhlé rabdomyolýzy patří i diseminovaná intravaskulární koagulace. Prolongovaná ischemie svalů v kombinaci s edémem nebo krvácením vede k rozvoji tzv. kompartment syndromu. U části pacientů s rabdomyolýzou jsou také známky jaterní dysfunkce způsobené proteázami uvolněnými z poškozených myocytů (5-7).
Příčiny rabdomyolýzy jsou rozdílné a zahrnují různorodé situace, které vedou k destrukci svalů. Z obecného hlediska je můžeme rozdělit na hereditární a získané, které pak dále můžeme klasifikovat na traumatické a netraumatické. Z traumatických příčin je nejznámější ischemie a přímé poškození při tzv. crush syndromu, podobně ale působí ischemie při jakékoli kompresi (např. při ležení na tvrdé podložce s nemožností pohybu). Mezi netraumatické příčiny lze zahrnout křeče, hypertermii, popáleniny nebo toxiny (hadí jed). Dobře doložená je také rabdomyolýza jako následek nadměrné zátěže s extrémním svalovým výkonem zvl. u netrénovaných jedinců, ale i u vrcholových sportovců se zaměřením na vytrvalostní sporty (cyklistika, ultramaratony) především v oblastech s tropickými klimatickými podmínkami zahrnujícími vysokou teplotu a vlhkost vzduchu (5,7,8).
Také mnoho virových, bakteriálních i mykotických infekcí včetně těžkého akutního respiračního syndromu vyvolaného virem SARS-CoV-2 může být komplikováno rabdomyolýzou. Mechanismus poškození je zde pravděpodobně multifaktoriální a podílí se na něm přímý cytopatický efekt viru a silná imunitní odpověď provázená cytokinovou bouří (6,9).
Zatímco traumata, septické stavy a lékové poškození je původcem většiny případů rabdomyolýzy v dospělé populaci, u dětí (především do 12 let věku) se nejčastěji uplatňují virové myozitidy doprovázející zvl. chřipku typu A a B nebo infekci coxackie viry. Případy poškození ledvin v důsledku rabdomyolýzy u dětí jsou naštěstí velmi vzácné (10).
Méně často se setkáme s autoimunitními onemocněními svalů a mezi vzácné příčiny patří metabolické vady s vrozenými deficity svalových enzymů (mitochondriální poruchy a poruchy metabolismu mastných kyselin), které se mohou projevit v dětství i u mladých dospělých (11).
V poslední době jsou stále častěji v diferenciální diagnostice příčin rhabdomyolýzy účinky drog (především kokain, metamfetamin nebo kanabioidy) a nežádoucí účinky některých léků, zvl. statinů.
Statiny jsou široce používanou medikací ke snižování hodnot sérového cholesterolu a od jejich schválení v 1987 se staly v USA nejčastěji předepisovaným lékem (7,12). Statiny snižují hladinu cholesterolu v krvi inhibicí enzymu: 3-hydroxy-3-metyl-glutaryl - coenzym A (HMG-CoA) reduktázy. Současně mají statiny potenciál zapříčinit mnoho různorodých komplikací, jsou prokazatelně diabetogenní a mezi další méně časté vedlejší účinky lze uvést poškození jater, proteinurii s dysfunkcí ledvin a také poruchy paměti. Mezi nejběžnější vedlejší účinky léčby statiny patři myalgie a rabdomyolýza, které jsou dobře literárně doložené. Ne všechny typy statinů působí u pacientů závažné svalové obtíže, dokumentovaný je cerivastatin, který byl stažen z trhu, protože jeho užívání doprovázel zvýšený výskyt rabdomyolýzy a 52 úmrtí na selhání ledvin (13). Mezi rizikové faktory pro rozvoj statiny indukované rabdomyolýzy patří vysoké terapeutické dávky statinů, vyšší věk (nad 65 let, související pravděpodobně s pomalejším metabolismem), ženské pohlaví, nízká hmotnost, renální nebo jaterní dysfunkce, poruchy štítné žlázy (především hypothyreóza) a DM (7,14,15). V našem případě celkem zdravá starší žena splňovala několik rizikových faktorů, především věk, pohlaví, vysokou terapeutickou dávku a DM.
Navzdory prokázané toxicitě statinů pro svalovou tkáň, je rozvoj významné rhabdomyolýzy při jejich užívání poměrně vzácný. Předpokládá se tak mnoho endogenních i exogenních faktorů, které mohou přispívat k rozvoji svalových obtíží, jako jsou např. další léky, které jsou metabolizovány v játrech cestami ovlivňujícími cytochrom P450. Tyto široce užívané preparáty, mezi které patří např. cyklosporin, amiodaron, warfarin, kolchicin, fibráty a mnoho dalších, ale také alkohol, ovlivňují stejný cytochrom a působí jako jeho inhibitory (7). Vedou tak k signifikantně vyšším plazmatickým hladinám statinů spojených s vyšším rizikem toxicity.
Vedle rabdomyolýzy mohou statiny vést k autoimunní nekrotizující myopatii s tvorbou protilátek proti HMG-CoA reduktáze (16). Autoimunní etiologie se delší dobu předpokládala a doložená je od r. 2010 (17). U naší pacientky tyto protilátky nebyly prokázané.
Patofyziologická podstata akutního poškození ledvin v případě rozsáhlé rabdomyolýzy není zcela objasněna. Uvolnění velkého množství myoglobinu z poškozených myocytů do systémové cirkulace vede k naplnění kapacity vazebních proteinů, především haptoglobinu. Volný myoglobin je pak filtrován glomeruly a způsobuje akutní tubulární poškození, na kterém se spolupodílí vazokonstrikce, hypovolémie, formování myoglobinových válců v luminech renálních tubulů a přímý cytotoxický účinek myoglobinu na epitelové buňky ledvinných kanálků (5,6,18).
V případě rhabdomyolýzy indukované statiny bylo patofyziologii věnováno mnoho studií s cílem odhalit mechanismus působení statinů a event. nalézt strategii, která by mohla závažný vedlejší účinek blokovat. Bylo objeveno mnoho metabolických vlivů, které se na rozvoji rhabdomyolýzy mohou účastnit. Důležitou roli může hrát deplece cholesterolu v bazálních membránách myocytů, což vede k destabilizaci cytoskeletu a také k ovlivnění iontových kanálů (19,20). Statiny blokují syntézu mevalonátu a tím snižují hladinu koenzymu Q10, který je nezbytnou součástí pro energetický metabolismus mitochondrií (21), což je důvodem únavy a také doporučení podávat koenzym Q10 během léčby statiny. V neposlední řadě statiny ovlivňují přímo subcelulární struktury, mohou ovlivňovat integritu cytoskeletu, buněčné adheze a viabilitu buněk (22). Myopatie indukovaná statiny je častější u fyzicky aktivních jedinců (7,23,24).
Charakteristickým znakem rabdomyolýzy v renální biopsii je akutní tubulární poškození projevující se ztrátou kartáčového lemu, oploštěním až denudací epitelu tubulů a formováním jemně granulárních nebo vločkovitých válců (6,25).
Nález různě formovaných a různě přibarvených válců v renálních tubulech může provázet řadu etiologicky různorodých onemocnění a do diferenciálně diagnostické rozvahy musíme zahrnout kromě myoglobinových válců i válce hemoglobinové a erytrocytární (3,25). Dále také všechny významné příčiny ischemie vedoucí k poškození tubulů spojených s přítomností detritu a bílkovinných válců v luminech kanálků. Největší problém v morfologii představuje odlišení myoglobinových a hemoglobinových válců. V diferenciální diagnostice se používá imunohistochemická detekce, která obě kategorie spolehlivě rozliší.
Vznik hemoglobinových válců provází intravaskulární hemolýzu, kdy je volný hemoglobin uvolněný z rozpadlých erytrocytů filtrován glomeruly do primárního ultrafiltrátu. Akutní intravaskulární hemolýza provází pestrou škálu hemolytických anémií, ať již autoimunitních, polékových nebo hereditárních (spojených s enzymopatií nebo poruchou struktury erytrocytu), přes komplikace infekčních onemocnění, až po hemolytické potransfúzní reakce (25). Uvolnění velkého množství hemoglobinu z rozpadlých erytrocytů může vést k akutnímu renálnímu poškození obdobným mechanismem jako myoglobin. Vzniklé hemoglobinové válce lokalizované převážně v proximálních ledvinných tubulech jsou histologicky neodlišitelné od válců myoglobinových a k jejich rozlišení je nutné imunohistochemické vyšetření (25,26).
Erytrocytární válce se vyskytují při hematurických syndromech. Jejich podstatou je glomerulární hematurie, která provází především glomerulonefritidy (např. IgA nefropatie) a vaskulitidy nebo se může jednat např. o komplikaci antikoagulační terapie (tzv. warfarinová nefropatie). Erytrocytární válce lze identifikovat, protože i v případě že jsou tvořeny lyzovanými červenými krvinkami obsahují reziduálních fragmenty nebo stíny erytrocytů (red cell ghosts) (25). Naproti tomu hemoglobinové válce jsou tvořené pouze hemoglobinem, protože fragmenty rozpadlých erytrocytů jsou odstraněné již v cirkulaci a nejsou filtrovány glomeruly.
V některých případech mohou být v dif. dg. také bílkovinné válce a to především válce, které jsou součástí light chain cast nefropatie. Lehké řetězce tvořené v rámci onemocnění plasmatických buněk jsou extrémně variabilní. To způsobuje problémy s detekcí, protože rozhodně neplatí, že jsou ve fluorescenci vždy monoklonální (tj. pozitivní je buď pouze kappa nebo pouze lambda). Bílkovinné válce u tzv. myelomové ledviny způsobují intrarenální obstrukci v hlubokých partiích nefronu a mohou proto být na povrchu obaleny Tamm-Horsfalovým proteinem (26). Ten se zde tvoří a při obstrukci spojenou se změnou intratubulárního tlaku stoupá do vyšších částí nefronu. Navíc, přestože má pacient akutní selhání ledvin, vysoký počet válců je v hlubokých partiích nefronu ve dřeni. Naproti tomu biopsie obsahuje kůru a počet válců v biopsii kůry je obvykle velmi malý a válce tak nemusí být ve vzorku pro IF zastiženy. K tomu je třeba přidat fakt, že variabilita ve tvorbě lehkých řetězců je doprovázená extrémní variabilitou v morfologii, včetně morfologie v elektronové mikroskopii. Válce mohou tvořit krystaly s ostrými hranami, ale i vločkovité struktury, které dokáží myoglobinové válce napodobit (obr. 4). Klíčem k diagnóze je posouzení všech kompartmentů ledviny, znalost lokality primární precipitace válců u jednotlivých příčin, a tam kde je to možné také imunohistochemická detekce.
Obr. 4. Detail vločkovitých bílkovinných válců v případě tzv. myelomové ledviny. Barveno hematoxylinem eosinem (zvětšení 400x). 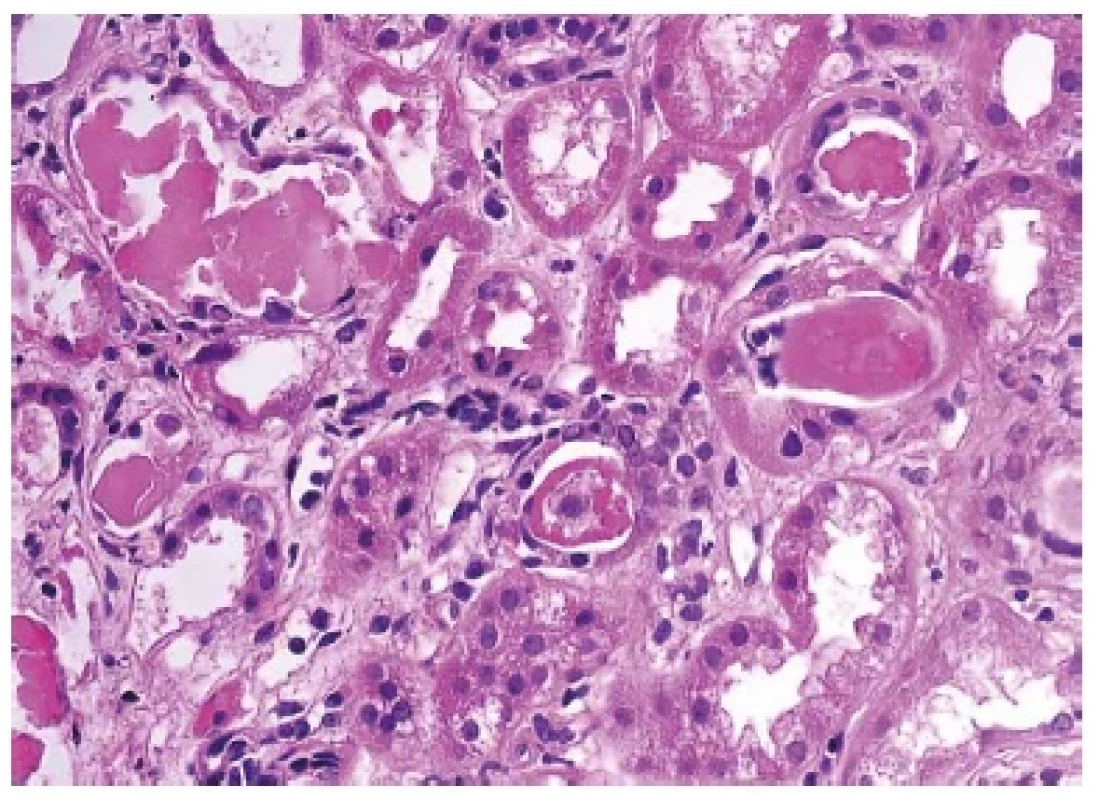
Z klinického pohledu představuje protrahované poškození epitelu tubulů jakékoli etiologie ohrožení funkce ledvin v budoucnosti. Jeho významné poškození obvykle neumožní reparaci do původního stavu. Poškozený epitel kanálků také spouští proapoptotické stimuly, které poškozují endotel přilehlých peritubulárních kapilár. Alterovaný endotel umožní únik tekutiny a vznik edému a následně dojde k aktivaci reaktivní zánětlivé celulizace. Zánět přispívá k udržení a progresi fibrogeneze, což ještě zhorší stav peritubulárních kapilár a postupně dojde k jejich úbytku. Výsledkem je chronická hypoxie tkáně, která poškozuje epitel tubulů a tím nastartuje začarovaný kruh poškození s rozvojem progresivní tubulointersticiální fibrózy, kterou v současné době nelze úspěšně terapeuticky ovlivnit (27). Také u naší pacientky došlo k reparaci a pomalému návratu funkce ledvin, ale její plné obnovy nebylo dosaženo. V současnosti je pacientka bez dialýzy s chronickým onemocněním ledvin středního stupně (CKD G3bA1), s hodnotami sérového kreatininu kolem 170-140 μmol/l.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Olga Snížková
AeskuLab, patologie, k.s.
Evropská 2589/33b, 160 00, Praha
tel: 225 755 292
e-mail: snizkova.olga@aeskulab.czCesk Patol 2023; 59(2): 80–84
Zdroje
1. Vachek J, Zakiyanov O, Bandúr Š, Tesař V. Akutní poškození ledvin. Kardiol Rev Int Med 2014; 16(1): 57-61.
2. Thomas ME, Blaine C, Dawnay A, et al. The definition of acute kidney injury and its use in practice. Kidney Int 2015; 87 : 62-73.
3. Gaut JP, Liapis H. Acute kidney injury pathology and pathophysiology: A retrospective review. Clin Kidney J 2020 Oct 10; 14(2): 526-536.
4. Nickeleit V. Biopsie renálních štěpů: Průvodce spletitými detaily pro získání nejlepších výsledků. Čes.-slov. Patol., 51, 2015, No. 4 : 181-186.
5. Vanholder R, Sever MS, Erek E, Lameire N. Rhabdomyolysis. J Am Soc Nephrol 2000 Aug; 11(8): 1553-1561.
6. Gupta A, Thorson P, Penmatsa KR, Gupta P. Rhabdomyolysis: Revisited. Ulster Med J 2021; 90(2): 61-69
7. Torres PA, Helmstetter JA, Kayne AM, Kayne AD. Rhabdomyolysis: Pathogenesis, Diagnosis, and Treatment. Ochsner J. 2015 Spring; 15(1): 58–69.
8. Rojas-Valverde D, Sánchez - Ureña B, Crowe J, Timón R, Olcina GJ. Exertional Rhabdomyolysis and acute kidney injury in endurance sports: A systematic review. Eur J Sport Sci 2021; 21(2): 261-274.
9. Haroun MW, Dieiev V, Kang J, et al. Rhabdomyolysis in COVID-19 Patients: A Retrospective Observational Study. Cureus 2021;13(1): e12552.
10. Kuok CI, Yu Chan WK. Acute kidney injury in pediatric non-traumatic rhabdomyolysis. Pediatr Nephrol 2021; 36(10): 3251-3257.
11. Kruijt N, van den Bersselaar LR, Kamsteeg EJ, et al. The etiology of rhabdomyolysis: an interaction between genetic susceptibility and external triggers. Eur J Neurol 2021; 28(2): 647-659.
12. Huda SA, Yadava S, Kahlown S, Farookqi MS, Bryant S, Russo R. Statin-induced necrotizing autoimmune myopathy, Proc (Bayl Univ Med Cent) 2021; 34(1): 185–186.
13. Furberg CD, Pitt B. Withdrawal of cerivastatin from the world market. Curr Control Trials Cardiovasc Med 2001; 2(5): 205–207.
14. Lima RA, Bezzera da Silva Junior GB, Liborio AB, Daher ED. Acute kidney injury due to Rhabdomyolysis. Saudi J Kidney Dis Transpl 2008; 19(5): 721-729.
15. Huerta-Alardín AL, Varon J, Marik PE. Bench-to-bedside review: Rhabdomyolysis - an overview for clinicians. Crit Care 2005; 9(2): 158-169.
16. Tiniakou E. Statin-Associated Autoimmune Myopathy: Current Perspectives. Ther Clin Risk Manag 2020; 16 : 483–492.
17. Christopher-Stine L, Casciola-Rosen LA, Hong G, Chung T, Corse AM, Mammen AL. A novel autoantibody recognizing 200-kd and 100-kd proteins is associated with an immune-mediated necrotizing myopathy. Arthritis Rheum 2010; 62(9): 2757–2766.
18. Zager RA. Rhabdomyolysis and myohemoglobinuric acute renal failure. Kidney Int 1996; 49(2): 314-326
19. Rosenson RS. Current overview of statin-induced myopathy. Am J Med 2004 Mar 15; 116(6): 408-416.
20. Vaughan CJ, Gotto AM Jr. Update on statins. Circulation 2004; 110 : 886–892.
21. Reidenberg MM. Statins, lack of energy and ubiquinone. Br J Clin Pharmacol 2005; 59(5): 606–607.
22. Copaja M, Venegas D, Aranguiz P, et al. Simvastatin disrupts cytoskeleton and decreases cardiac fibroblast adhesion, migration and viability. Toxicology 2012; 294(1): 42-49
23. Noyes AM, Thompson PD. The effects of statins on exercise and physical activity. J Clin Lipidol 2017; 11(5): 1134-1144.
24. Camerino GN, Tarantino N, Canfora I, De Bellis N, Musumeci O, Pierno S. Statin-Induced Myopathy: Translational Studies from Preclinical to Clinical Evidence. Int J Mol Sci 2021; 22(4): 2070.
25. Dvanajscak Z, Walker PD, Cossey LN, et al. Hemolysis-associated hemoglobin cast nephropathy results from a range of clinicopathologic disorders. Kidney Int 2019; 96(6): 1400-1407.
26. Mahmud S, Dernell C, Bal N, et al. Hemoglobin Cast Nephropathy. Kidney Int Rep 2020; 5(9): 1581-1585.
27. Finkel KW, Cohen EP, Shirali A, Abudayyeh A. Paraprotein-Related Kidney Disease: Evaluation and Treatment of Myeloma Cast Nephropathy. Clin J Am Soc Nephrol 2016; 11(12): 2273-2279.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článok vyšiel v časopiseČesko-slovenská patologie

2023 Číslo 2-
Všetky články tohto čísla
- Mola či nemola, toť otázka
- Na patologii mě baví, jak to dohromady pasuje a když nepasuje, tak člověk musí přemýšlet proč
- Monitor aneb nemělo by vám uniknout, že...
- Mola hydatidosa
- Krvácení po porodu / potratu – praktické poznámky k vyšetření bioptického materiálu
- Spontánní potrat v prvním trimestru gravidity
- Molekulární diagnostika kompletní a parciální hydatidózní moly
- Kostní dysplázie: přehled problematiky a deset let zkušeností s diagnostikou u plodů a novorozenců
- Kazuistika: Akutní poškození ledvin s progresí do chronicity u starší pacientky
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Mola hydatidosa
- Spontánní potrat v prvním trimestru gravidity
- Kostní dysplázie: přehled problematiky a deset let zkušeností s diagnostikou u plodů a novorozenců
- Molekulární diagnostika kompletní a parciální hydatidózní moly
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



