-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Role průtokové cytometrie při vyšetřování vzorků lymfatických uzlin a extranodálních tkání
The role of flow cytometry in the investigation of lymph node and extranodal lymphatic tissue specimen
Although flow cytometry examination of lymphoproliferation in lymph nodes provides minimal morphological information, apart from indicative determination of cell size and granularity, and completely loses topographical information. However, the great advantage of this method is the speed of determining and combination of investigated antigens, where the expression intensities of individual markers are no less important. This is absolutely crucial for hematological malignancies, where different diseases can look very similar at the morphological level and variations in the appearance of tumour cells can be minimal. When diagnosing lymphomas, the combination of histology and immunohistochemistry with flow cytometry provides a more comprehensive view for the interpretation of individual findings. The aim of this article is to provide basic information about the examination of lymph nodes and extranodal tissue by flow cytometry as a starting point for the collaboration of the pathologist and the cytometrist.
Keywords:
Flow cytometry – lymph node – Lymphoproliferative disorder
Autori: Tomáš Zajíc 1; Jana Včeláková 2; Vít Campr 2; Tomáš Jirásek 3
Pôsobisko autorov: Oddělení klinické mikrobiologie a imunologie, Centrum laboratorní medicíny, Krajská nemocnice Liberec a. s. 1; Ústav patologie a molekulární medicíny 2. LF UK a Fakultní nemocnice Motol, Praha 2; Oddělení patologie, Centrum PATOS, Krajská nemocnice Liberec, a. s. 3
Vyšlo v časopise: Čes.-slov. Patol., 59, 2023, No. 4, p. 168-176
Kategória: Přehledový článek
Súhrn
Vyšetření lymfoproliferací v lymfatických uzlinách průtokovou cytometrií poskytuje pouze minimální informace o morfologii (orientační stanovení velikosti a granularity buněk), a zcela postrádá informace topografické. Nicméně velkou výhodou této metody je především rychlost stanovení a hodnocení kombinace vyšetřovaných antigenů, kde neméně důležité jsou i intenzity exprese jednotlivých znaků. Toto je zcela zásadní pro hematologické malignity, kdy se různá onemocnění mohou na morfologické úrovni velmi podobat a odchylky vzhledu buněk mohou být minimální. Při diagnostice lymfomů korelace histologie a imunohistochemie s průtokovou cytometrií poskytuje komplexnější pohled pro interpretaci jednotlivých nálezů. Cílem tohoto článku je poskytnout základní informace o vyšetření lymfatických uzlin a biopsií extranodálních tkání průtokovou cytometrií se zaměřením na lymfoproliferativní onemocnění a vytvořit odrazový můstek pro spolupráci mezi patologem a cytometristou.
Klíčová slova:
průtoková cytometrie – Lymfoproliferace – Lymfatická uzlina
Metoda průtokové cytometrie je velice jednoduchá a efektivní. Její princip je založen na průchodu částic suspenze přes laserový paprsek. Přístroj detekuje světlo rozptýlené od těchto částic, kde snímá rozptyl světla v malém úhlu (tzv.forward scatter“ FSC), tato hodnota je úměrná velikosti buněk a dále zaznamenává boční rozptyl světla (tzv. „side scatter“ SSC), který je ovlivněn hlavně granularitou částic a členitostí jádra. Dále je vybaven fotodetektory, které zachycují vybrané části světelného spektra emitovaných fluorescenčními molekulami. Díky tomu je možné použít vícenásobné značení analyzovaných částic pomocí fluorochromů odlišných ve svých emisních spektrech. Nejčastěji se používá navázání fluorescenční značky na monoklonální protilátku. Základní a stručný postup cytometrického vyšetření spočívá v přidání monoklonálních protilátek značených fluorochromem k suspenzi částic našeho zájmu. Protilátka se během krátké inkubace naváže na antigen. Ve většině případů je třeba optimalizovat postup značení, ať již promytím vzorku před přidáním protilátek (pro odstranění volných imunoglobulinů), použitím přísady pro snížení nespecifické vazby protilátek, promytí vzorku po barvení pro snížení pozadí, či cytolýza erytrocytů. Můžeme detekovat jak povrchové, tak intracelulární antigeny. Na trhu je již k dispozici celá řada komerčních souprav, které i tyto postupy významně zjednodušují.
Od publikace článku „Imunofenotypizace průtokovou cytometrií v patologii“ v Česko-slovenské patologii z roku 2013 ke skokovému pokroku na poli průtokové cytometrie nedošlo. Nové slibné metody se zatím příliš nerozšířily do rutinní diagnostiky, ačkoli na některých pracovištích věnujících se souběžně i výzkumné činnosti se pomalu zabydlují. Jedná se v prvé řadě o spektrální průtokovou cytometrii (s rozšířením počtu detekčních kanálů), hmotnostní cytometrii (se značením protilátek konjugovaných s multiatomovými značkami izotopů kovů místo fluorescenčního) a zobrazovací cytometrii (ta kombinuje cytologický obraz s fluorescenčním značením). Výraznějších pokroků však bylo dosaženo v oblasti dostupnosti průtokových cytometrů, dále pak zejména v nabídce značených monoklonálních protilátek, eventuálně i hotových protilátkových koktejlů. Tím pádem je možné metodiky zavést i v laboratořích, které je dosud nevyužívaly (1-6).
Standardizace v průtokové cytometrii je samostatná a náročná kapitola. Je k dispozici velké množství protilátek, celá řada fluorochromů a v současnosti je na trhu také široké spektrum přístrojů. Díky pokrokům v použití výpočetní techniky je stále snadnější zpracovávat větší objemy dat, ale pouze za předpokladu, že jsou tato data porovnatelná v rámci standardizace. V tom případě je možné, a někdy je to dokonce součástí standardizovaného postupu, použít automatické vyhodnocení na základě počítačových algoritmů (7,8).
VYŠETŘOVANÝ MATERIÁL
Vyšetření tkáně lymfatických uzlin má řadu nesporných výhod, vždy je však třeba mít na paměti i její omezení. V prvé řadě je to metoda, která pracuje se suspenzí částic, nejčastěji buněk. To znamená nutnost převedení solidních tkání do buněčné suspenze a z toho vyplývá omezení pro vzorky s buňkami pevně lpícími k sobě, nebo s významným podílem vazivové tkáně. Další limitací je viabilita vyšetřovaných buněk. Buňky nekrotické či podléhající apoptóze často nespecificky váží protilátky, či samotné fluorochromy, případně vykazují jistou míru autofluorescence, čímž se mohou objevovat „nesmyslné“ kombinace antigenů vyvolávající dojem abnormální populace. K odlišení neviabilních elementů proto slouží specifické barvení, kdy se nejčastěji využívá vlastnosti fluorescenčních molekul nepřestupovat přes intaktní buněčnou membránu anebo být aktivně vypuzovány z buňky. Existují i další možné postupy.
Při podezření na lymfoproliferaci je důležitý výběr samotné uzliny vhodné pro vyšetření. Nejčastěji na základě klinického vyšetření společně s některou ze zobrazovacích metod (USG, CT). Je-li lymfadenopatie generalizovaná, je vhodnější vyšetřit uzliny krční, pak axilární. Nejméně vhodné jsou uzliny tříselné. Při odběru uzliny je nutné minimalizovat riziko poškození tkáně, včetně termického. Následně je třeba vzorek rychle transportovat do laboratoře bez použití fixačních roztoků a naopak pro zabránění vyschnutí vzorku doplnit vhodné transportní medium. Dle doby transportu lze použít obyčejný fyziologický roztok, lépe fosfátový pufr (PBS), ideálně pak kultivační medium (např. RPMI 1640). Materiál větších rozměrů (např. velká uzlina) zejména při transportu na větší vzdálenost je vhodné zabalit do mulu navlhčeného fyziologickým roztokem, aby na povrchu neosychal.
Příprava lymfatické uzliny či biopsie pro vyšetření průtokovou cytometrií spočívá v převedení solidní tkáně na suspenzi jednotlivých buněk. Lze využít čistě manuální postup, nejčastěji pomocí skalpelu nebo disociace vzorku pístovým homogenizátorem, ale je možné i přístrojové zpracování. Pro hematologické malignity je manuální příprava postačující (při vědomí limitovaného uvolnění nádorových buněk do suspenze z fibrotických vzorků), pro jiné materiály nikoli. V takovém případě je nutné použít enzymatické disociace, které však mají určité nevýhody, zejména změny v konformacích detekovaných epitopů, či může dojít až k jejich úplné ztrátě. Další nevýhodou použití enzymů je navýšení ceny vyšetření (9–12).
VYUŽITÍ METODY V PATOLOGII
Vyšetření lymfatických uzlin průtokovou cytometrií je zaměřeno na detekci lymfomů, kromě Hodgkinovy choroby, z následujících důvodů.
Nádory pocházející z buněk mimo hematopoetickou řadu vyžadují složitější přípravu tkáně, takže při jednoduchém mechanickém zpracování nejsou cytometricky detekovatelné. Různé varianty Hodgkinova lymfomu jsou pro tuto metodu také velmi obtížně zjistitelné. Diagnostických buněk je málo, nemají jednoznačný a specifický imunofenotyp, v některých případech je vyšší podíl vaziva ve vzorku a v neposlední řadě mají buňky tendenci se shlukovat. Existují sice práce, které popisují úspěšnou cytometrickou detekci, ale v běžné praxi se cytometricky Hodgkinův lymfom nevyšetřuje (13,14).
Prekurzorové hematologické neoplazie se v lymfatických uzlinách nalézají velmi vzácně, snad s výjimkou T lymfoblastického lymfomu, což ale také není častá diagnóza.
Pro rozlišení různých typů zánětlivých reakcí nejsou dosud definovány charakteristické imunofenotypy buněčných populací, které by měly dostatečný diagnostický význam. V těchto situacích je stěžejní nález histologický v kombinaci s dalšími vyšetřeními (imunohistochemie, molekulární biologie, sérologie).
Mezi nejčastěji se vyskytující lymfoproliferace patří B lymfomy, kterými se dále budeme více zabývat, mezi vzácné pak patří T/NK lymfomy. Další jednotky jsou zcela raritní a při běžném vyšetření se s nimi nejspíše nesetkáme.
Pro průkaz nádorové proliferace lymfocytů je nejdůležitější stanovení klonálního původu buněčné populace. K identifikaci B lymfocytů slouží antigeny, které jsou přítomny na všech fyziologických buňkách (např. CD19, CD20, CD22, CD79b). Pro lymfomy vycházející z B buněk se používá vyšetření exprese dvou variant lehkých imunoglobulinových řetězců kappa a lambda. Při běžném vývoji B lymfocytů dochází k náhodnému výběru jedné varianty, takže jejich rozdělení by mělo být přibližně 1 : 1 (teoreticky). V praxi je však jejich poměr mnohem více variabilní. V případě klonální proliferace dochází k výrazné převaze jedné varianty daného řetězce nad druhým. Jako přesvědčivý průkaz přítomnosti B lymfomu je pro lymfatické uzliny uváděn poměr K:L mimo rozmezí 0,3 – 3,0. Vždy je vhodné zohlednit všechny vyšetřené parametry, neboť v případě přítomnosti méně početného patologického klonu nemusí být poměr exprese variant lehkých řetězců výrazněji odchýlen. I absence exprese povrchových imunoglobulinů je diagnosticky cenná. Základní rozdělení B lymfoproliferací spočívá ve stanovení exprese molekul CD5 a CD10. Ač existují výjimky, toto schéma je relativně spolehlivé. Skupina CD5+/CD10lymfomů zahrnuje lymfom z buněk pláště (MCL), chronickou lymfocytární leukemii/malobuněčný B lymfom (CLL/SLL) a některé velkobuněčné B lymfomy. Exprese CD5-/CD10+ je charakteristická pro folikulární lymfom (FL), Burkittův lymfom (BL) a část velkobuněčných B lymfomů. Do poslední skupiny spadají ostatní lymfomy, které typicky neexprimují ani CD5 ani CD10. Např. skupina lymfomů marginální zóny, lymfoplazmocytární lymfom, skupina splenických lymfomů, opět některé z velkobuněčných B lymfomů apod. Další znaky slouží k podrobnějšímu rozdělení patologických B lymfocytů v rámci výše uvedených skupin či stanovení prognózy (např. CD23, CD38, CD43, CD44,CD71, CD200). Některé lymfomy vykazují víceméně specifický imunofenotyp (např. CLL/SLL), některé nelze pouze na základě cytometrického obrazu v podstatě odlišit (zejména skupina CD5-/CD10-). To záleží také na dostupném rozsahu vyšetřovaných antigenů (1-6, 15-18).
Pro T lymfomy se dosud používala detekce aberantních imunofenotypů, která spočívá v průkazu negativity znaků, které běžně exprimují všechny T lymfocyty (jako CD2, CD3, CD5, CD7), anebo naopak exprese antigenů, které by se na T lymfocytech vyskytovat neměly (např. CD10, CD13, CD33). V současnosti je však navíc k dispozici protilátka proti konstantní části beta řetězce T buněčného receptoru (TRBC1), která existuje ve dvou variantách, s obdobným významem jako rozlišení lehkých řetězců kappa a lambda u B lymfocytů. Týká se to těch T lymfomů, které mají přítomen T receptor alfa/beta. Při použití detekce exprese varianty TRBC1 může docházet k nálezu zřetelné klonální proliferace, avšak pouze v minimálním počtu. V tom případě se označuje jako T lymfocytární klon nejasného významu (TCUS). Podrobnější rozdělení lymfomů vycházející z T či NK řady většinou vyžaduje stanovení exprese dalších antigenů. Vzhledem k tomu, že se jedná o poměrně vzácné diagnózy, řada laboratoří detailnější typizaci neprovádí (1-6,19-23).
Význam průtokové cytometrie v diagnostice onemocnění vycházejících z proliferace plazmatických buněk je přehledně popsáno v článku popisujícím úlohu průtokové cytometrie při vyšetření kostní dřeně v tomto čísle časopisu a popis zde nebudeme znovu opakovat.
PŘÍKLADY NEJČASTĚJŠÍCH B LYMFOMŮ S UKÁZKAMI ZOBRAZENÍ DAT Z PRŮTOKOVÉHO CYTOMETRU
Chronická lymfocytární leukémie/malobuněčný B lymfom (chronic lymphocytic leukaemia/small lymphocytic lymphoma, CLL/SLL)
Nádorové buňky v typickém případě exprimují znaky B lymfocytů (CD19, CD20, CD79b, sIg (povrchový imunoglobulin)), často je však intenzita snížená až negativní oproti benigním B lymfocytům. Nejčastěji je to CD79b, dále CD20, či sIg. Dále bývají typicky pozitivní znaky CD5, jako jeden ze základních diskriminačních znaků, CD23, CD200 a CD43. Ty jsou důležité pro odlišení lymfomu z buněk pláště. Naopak antigeny FMC7 a CD10 jsou typicky u CLL/SLL negativní. Exprese CD81 bývá snížená až negativní. Vzhledem k variabilitě detekovaných imunofenotypů CLL (stejně jako u ostatních lymfomů) existují skórovací systémy pro stanovení pravděpodobnosti správného zařazení patologické populace, např. „Matutes score“. Přesto patří tato lymfoproliferace mezi poměrně dobře popsané a se specifickým imunofenotypem. Znaky CD38 a ZAP-70 patří mezi prognostické znaky, zvažovány jsou ale i další (18) (obr. 1).
Obr. 1. Malobuněčný B lymfom. Průtoková cytometrie. Gate na lymfocyty. Buňky CLL červeně, ostatní B lymfocyty modře, T lymfocyty a NK buňky zeleně. A - CLL s monoklonální expresí povrchových lehkých imunoglobulinových řetězců lambda (slaběji), B - CLL s expresí CD19 a CD5, C - CLL s velmi slabou expresí CD79b, D - CLL se silnou pozitivitou CD23 a CD200. 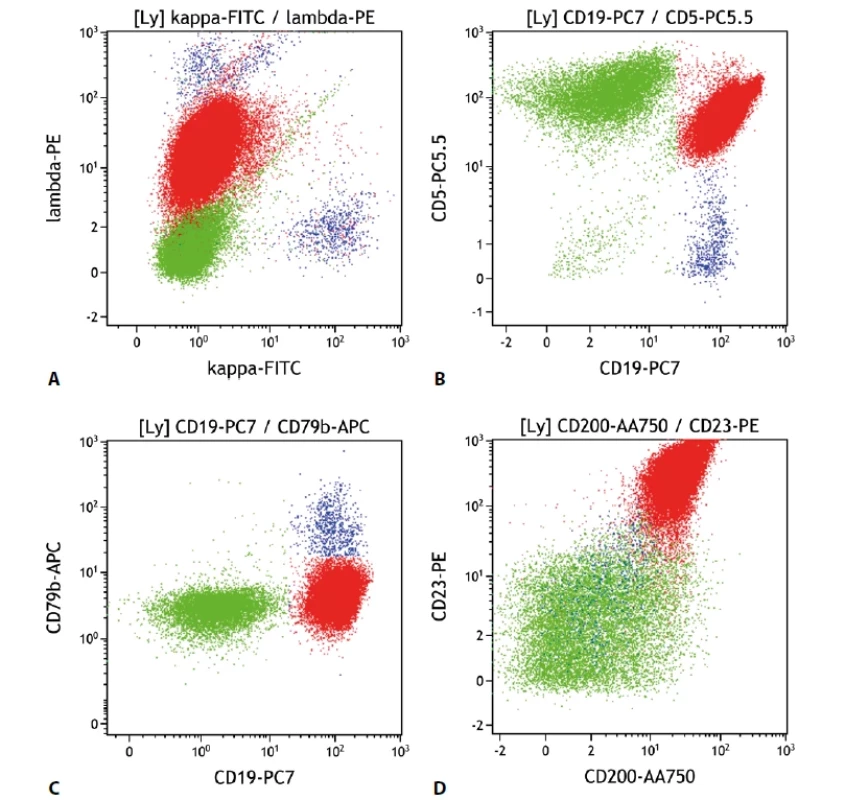
Lymfom marginální zóny (marginal zone lymphoma, MZL) a jeho varianty včetně extranodálního lymfomu ze slizniční lymfoidní tkáně (mucosa associated lymphoid tissue MALT)
Patří mezi lymfomy s nespecifickým imunofenotypem, což znamená, že neexprimuje CD5 ani CD10, a neexprimuje další znak, který by byl charakteristický výhradně pro tento lymfom. Odlišení od dalších lymfoproliferací je tedy obtížnější, často bývá nutné zohlednit i klinické nálezy a výsledky dalších pomocných vyšetření. Samotný nález průtokové cytometrie tedy spíše vymezuje oblast pravděpodobné diagnózy. Typicky jsou pozitivní znaky B buněk CD19, CD22, CD79b, negativní CD5, CD10, CD103. Někdy jsou pozitivní i CD11c, CD21, CD25, CD27, CD35, CD39, CD43, sIgD (povrchový imunoglobulin D), CD23 je většinou negativní. Některé kombinace znaků činí diagnózu pravděpodobnější, nicméně dosud není známa žádná, která by byla dostatečně spolehlivá. Další důležitým momentem je skutečnost, že imunofenotypicky nelze odlišit lymfoplazmocytární lymfom (LPL) (obr. 2).
Obr. 2. Lymfom marginální zóny. Průtoková cytometrie. Gate na lymfocyty. Buňky MZL červeně, ostatní B lymfocyty modře, T lymfocyty a NK buňky zeleně. A - monoklonální populace MZL s expresí povrchových lehkých imunoglobulinových řetězců lambda, B - MZL exprimuje CD19 a CD5 je negativní, C - MZL neexprimuje CD10, D - negativita CD23 na buňkách MZL. 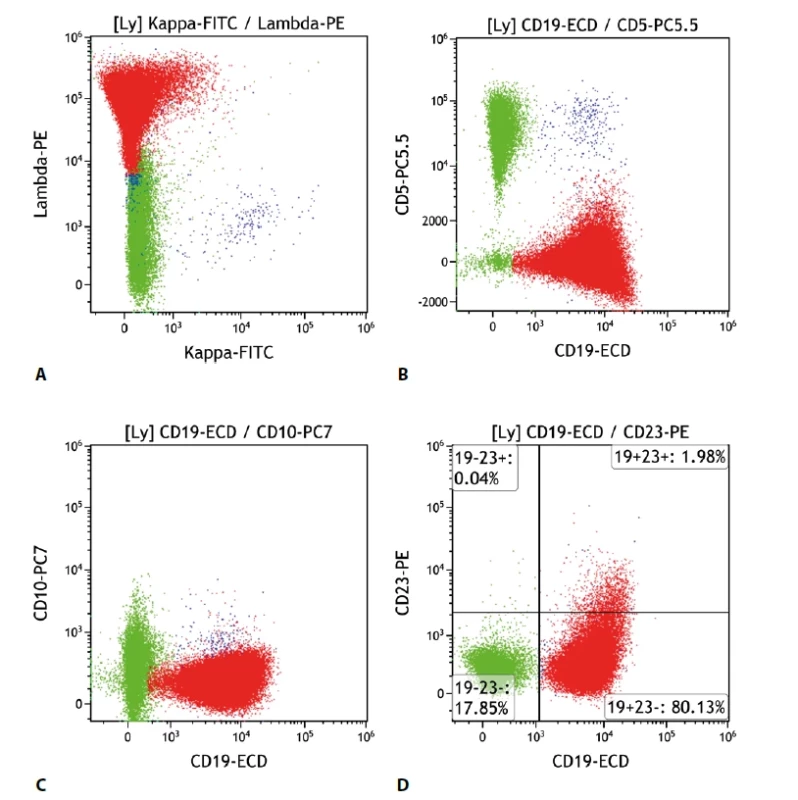
Folikulární lymfom (FL)
Folikulární lymfom v typických případech exprimuje CD10, buňky bývají malé až středně velké a častou je i snížená exprese CD19, méně často může být snížená i exprese CD20 a CD22. CD79b bývá exprimován v obvyklé intenzitě. Většinou jsou pozitivní CD21, IgM; negativní je CD43. CD5 je pak typicky negativní. V některých případech je popisována diskrepance mezi imunohistochemickým barvením a nálezem průtokové cytometrie. Problematické bývá odlišení buněk zárodečného centra, které mívají obdobný imunofenotyp jako buňky FL, většinou je ale vídáme bez exprese lehkých povrchových řetězců. U středně až velkobuněčných forem CD10+ B lymfomů je také třeba korelace s histologií pro přesné zařazení, zda se jedná o FL vyššího stupně či variantu difuzního velkobuněčného lymfomu (DLBCL). Při vyšetření kostní dřeně v rámci stagingu je nutné mít na paměti, že část FL může při infiltraci dřeně ztrácet expresi molekuly CD10 (obr. 3).
Obr. 3. Folikulární lymfom. Průtoková cytometrie. Gate na lymfocyty. Buňky FL červeně, ostatní B lymfocyty modře, T lymfocyty a NK buňky zeleně. A - FL exprimuje slaběji CD19 oproti benigním B lymfocytům, je patrná monoklonální exprese povrchových lehkých imunoglobulinových řetězců kappa, B - FL se slabší expresí CD19 neexprimuje CD5, C - FL s pozitivní expresí CD10 a mírně sníženou expresí CD22, D - FL s pozitivní expresí CD10 a negativní expresí povrchových lehkých imunoglobulinových řetězců lambda (pozitivní je kappa řetězec). 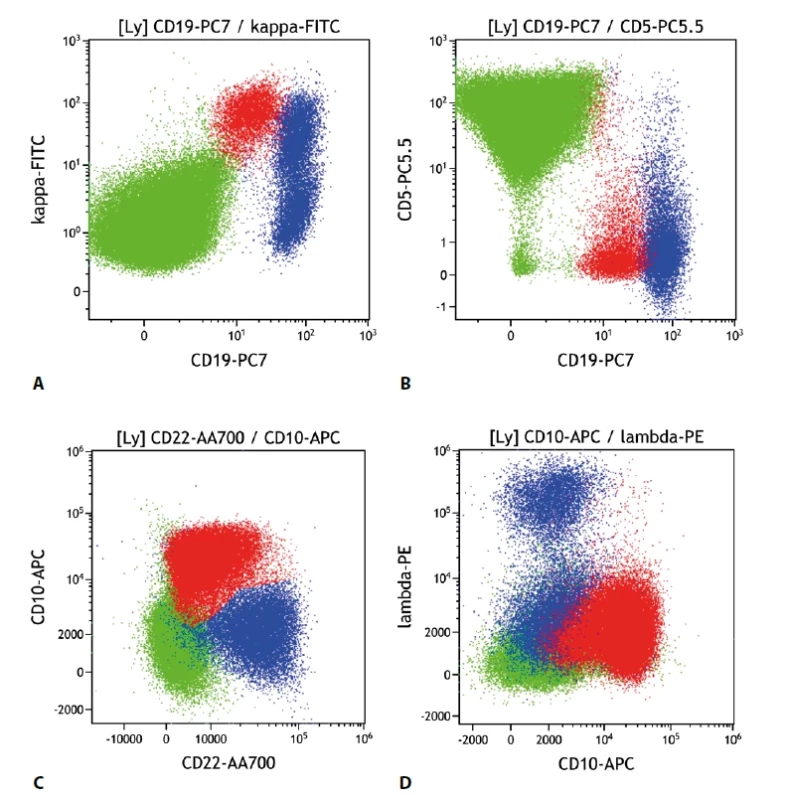
Lymfom z buněk pláště (mantle cell lymphoma, MCL)
Tento lymfom vycházející z plášťových buněk lymfatické uzliny většinou exprimuje v obvyklé intenzitě B buněčné znaky – CD19, CD20, CD22, CD79b. Typicky je přítomna molekula CD5. Důležité je proto odlišení od ostatních CD5 pozitivních lymfoproliferací, nejčastěji CLL/SLL. MCL tedy na rozdíl od CLL obvykle neexprimuje CD23, CD200 a většinou ani CD43. Naopak pozitivní by měl být antigen FMC7 a CD81. Pozitivními znaky mohou být i CD11c, CD38. Antigen CD71 je většinou negativní (obr. 4).
Obr. 4. Lymfom z buněk pláště. Průtoková cytometrie. Gate na lymfocyty. Buňky MCL červeně, ostatní B lymfocyty modře, T lymfocyty a NK buňky zeleně. A - MCL s negativní epresí CD10 a pozitivní CD5, B - MCL s negativní expresí CD23, C - MCL s negativní expresí CD200, D - MCL se slabě pozitivní expresí antigenu FMC7. 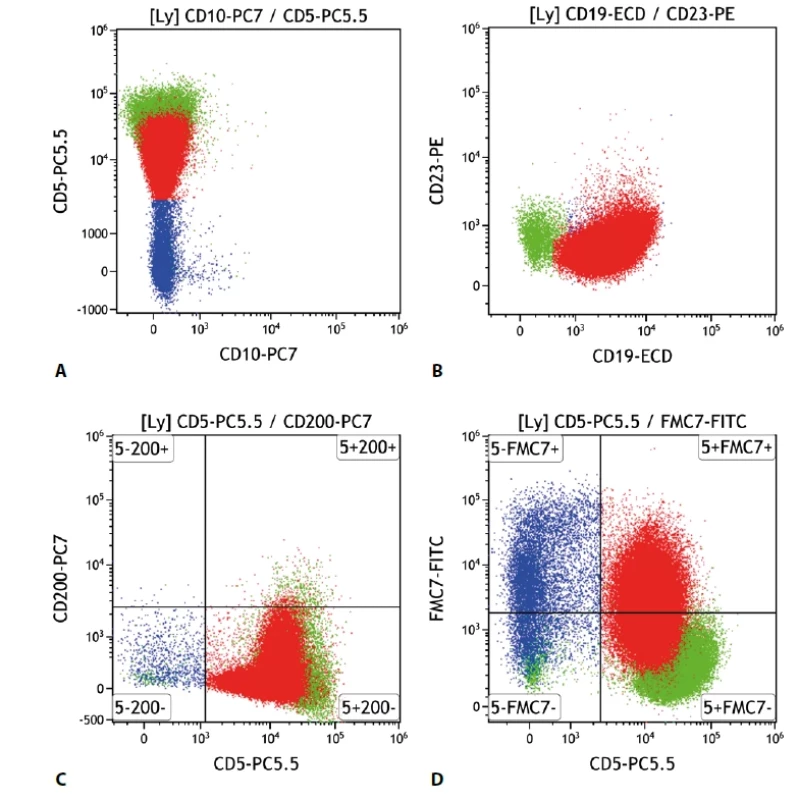
Difuzní velkobuněčný B lymfom (diffuse large B-cell lymphoma, DLBCL)
Difuzní velkobuněčný B lymfom stále zůstává heterogenní skupinou, která zahrnuje různé typy morfologických, genetických i imunofenotypových variant. Charakteristicky je zastoupen velkými buňkami (avšak ve variabilním poměru). V cytometrickém obraze tak bývají výrazné odchylky morfologických parametrů (velikost a granularita buněk). U části je patrná exprese CD10. Další pozitivní znak bývá CD71. Poměrně vzácně je pozitivní průkaz CD56. CD23 je většinou negativní, CD5 je častěji negativní, ale může být i pozitivní a to jak „de novo“, tak i v rámci transformace lymfomů nižších stupňů malignity (obr. 5).
Obr. 5. Difuzní velkobuněčný lymfom. Průtoková cytometrie. Gate na lymfocyty. Buňky DLBCL červeně, ostatní B lymfocyty modře, T lymfocyty a NK buňky zeleně. A - DLBCL s pozitivní expresí CD10 větší velikostí buněk (parametr „FS INT“ na ose x), B - DLBCL se sníženou expresí CD19 oproti benigním B lymfocytům, nápadná vyšší granularita buněk (parametr „SS INT“ na ose y), C - DLBCL s negativní expresí CD5 i CD10, D - DLBCL s částečnou pozitivitou CD71. 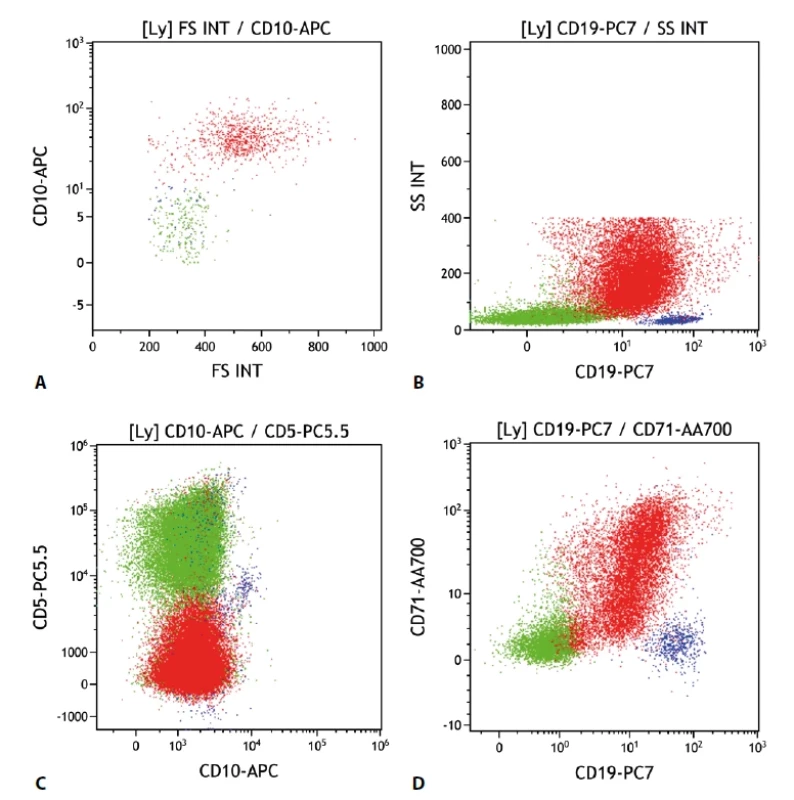
Periferní T lymfom, blíže neurčený (peripheral T-cell lymphoma, not otherwise specified PTCL, NOS)
Jedná se o skupinu lymfoproliferací vycházející z T buněk, které není možné klasifikovat jako některé z ostatních jednoznačně definovaných T lymfomů (např. angioimunoblastický T lymfom, hepatosplenický T lymfom atd.) Již z toho je zřejmé, že se nejedná o homogenní diagnostickou jednotku. Navíc je nutné odlišit i další T lymfomy, u nichž některá kritéria nebyla splněna pro limitace vyšetřovacího rozsahu (obecně je vhodnější mluvit o zralých T lymfomech) (obr. 6).
Obr. 6. Periferní T buněčný lymfom. Průtoková cytometrie. Buňky PTCL červeně, B lymfocyty modře, ostatní T lymfocyty a NK buňky zeleně. A - patologická populace T lymfocytů s chybějící membránovou expresí CD3 a zachovalou expresí CD2, B - PTCL se zachovalou expresí CD5, C - PTCL se zachovalou expresí CD7, D - PTCL s pozitivní expresí CD4 a negativní CD8. 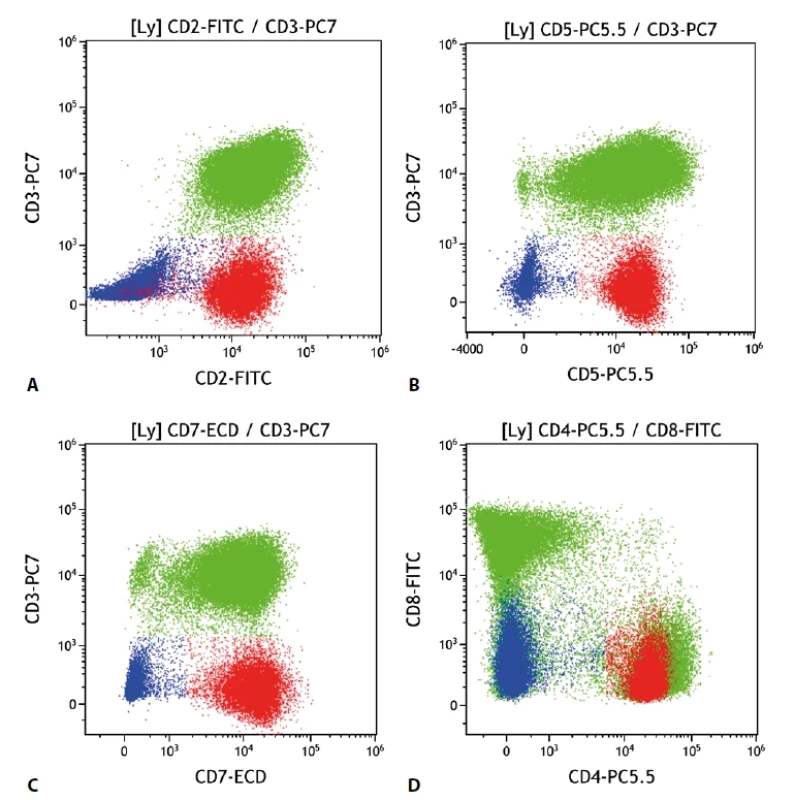
ZÁVĚR
Závěrem je nutné zdůraznit, že těžiště diagnostiky lymfoproliferativních onemocnění spočívá na histologickém a imunohistochemickém vyšetření. Tyto metody mají na druhou stranu svá omezení, je žádoucí tyto nedostatky vhodným způsobem kompenzovat a korelovat výsledky z více metodik. Jednou z možností je právě vyšetření tkáně průtokovou cytometrií, kde obrovská výhoda je rychlost této metody a již během několika hodin můžete svými výstupy upřesnit diagnózu a rozšířit pohled patologa. To s sebou ale nese nutnost zajistit k vyšetření nativní nefixovanou tkáň uzliny, dále její rychlý transport z místa chirurgického odběru na pracoviště patologie a v neposlední řadě dostupnost metody průtokové cytometrie v místě. Teprve souhra všech těchto podmínek umožní vyšetření efektivně provést. Počty zdravotnických zařízení, která disponují dostupným průtokovým cytometrem, postupně narůstají. Výše předložený text by měl nově začínajícím laboratořím usnadnit orientaci v této, dle názoru autorů, pro diagnostiku velmi užitečné metodě.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů
Adresa pro korespondenci:
MUDr. Tomáš Zajíc
Krajská nemocnice Liberec,
Oddělení klinické mikrobiologie a imunologie
Husova 357/10, 460 63, Liberec
e-mail: tomas.zajic@nemlib.cz
Zdroje
- Manďáková P, Čandová J. Imunofenotypizace průtokovou cytometrií v patologii. Cesk Patol 2013; 49(4): 126–130.
- Gorczyca W. Flow cytometry in neoplastic hematology: Morphologic--immunophenotypic correlation (2nd ed.). Informa Healthcare. London. 2010.
- Alaggio R, Amador C, Anagnostopoulos I, et al.The 5th edition of the World Health Organization classification of haematolymphoid tumours: Lymphoid neoplasms. Leukemia 2022; 36 : 1720–1748.
- Craig FE, Foon KA. Flow cytometric immunophenotyping for hematologic neoplasms. Blood 2008; 111 : 3941–3967.
- Seegmiller AC, Hsi ED, Craig FE. The current role of clinical flow cytometry in the evaluation of mature B-cell neoplasms. Cytometry B Clin Cytom 2019; 96 : 20–29.
- Debord C, Wuilleme S, Eveillard M, et al. Flow cytometry in the diagnosis of mature B‐cell lymphoproliferative disorders. Int J Lab Hematol 2020; 42 : 113–120.
- Costa ES, Pedreira CE, Barrena S, et al. Automated pattern-guided principal component analysis vs expert-based immunophenotypic classification of B-cell chronic lymphoproliferative disorders: a step forward in the standardization of clinical immunophenotyping. Leukemia 2010; 24(11): 1927-33.
- van Dongen JJ, Lhermitte L, Böttcher S, et al. EuroFlow antibody panels for standardized n-dimensional flow cytometric immunophenotyping of normal, reactive and malignant leukocytes. Leukemia 2012; 26(9): 1908-75.
- Schwock J, Geddie WR. Diagnosis of B-cell non-hodgkin lymphomas with small-/intermediate-sized cells in cytopathology. Patholog Res Int 2012; 2012 : 164934.
- Scott GD, Lau HD, Kurzer JH, Kong CS, Gratzinger DA. Flow immunophenotyping of benign lymph nodes sampled by FNA: Representative with diagnostic pitfalls. Cancer Cytopathol 2018; 126(9): 797-808.
- Chi, P-D, Freed, NS, Wake L, et al.A simple and effective method for flow cytometric study of lymphoid malignancies using needle core biopsy specimens. Cytometry B Clin Cytom 2018; 94 : 793–799.
- Barroca H, Marques C. A basic approach to lymph node and flow cytometry fine-needle cytology. Acta Cytologica 2016; 60(4): 284–301.
- Martig DS, Fromm JR. A comparison and review of the flow cytometric findings in classic Hodgkin lymphoma, nodular lymphocyte predominant Hodgkin lymphoma, T cell/histiocyte rich large B cell lymphoma, and primary mediastinal large B cell lymphoma. Cytometry B Clin Cytom 2022; 102(1): 14–25.
- Grewal RK, Chetty M, Abayomi EA, Tomuleasa C, Fromm, JR. Use of flow cytometry in the phenotypic diagnosis of hodgkin‘s lymphoma. Cytometry B Clin Cytom 2019; 96 : 116–127.
- Rawstron AC, Kreuzer KA, Soosapilla A, et al. Reproducible diagnosis of chronic lymphocytic leukemia by flow cytometry: An European Research Initiative on CLL (ERIC) & European Society for Clinical Cell Analysis (ESCCA) Harmonisation project. Cytometry B Clin Cytom 2018;94 : 121–128.
- Hedley BD, Cheng G, Keeney M, et al. A multicenter study evaluation of the ClearLLab 10C panels. Cytometry B Clin Cytom 2021; 100 : 225–234.
- Hoffmann J, Rother M, Kaiser U, et al. Determination of CD43 and CD200 surface expression improves accuracy of B-cell lymphoma immunophenotyping. Cytometry B Clin Cytom 2020; 98 : 476–482.
- Berg H, Otteson GE, Corley H, et al. Flow cytometric evaluation of TRBC1 expression in tissue specimens and body fluids is a novel and specific method for assessment of T-cell clonality and diagnosis of T-cell neoplasms. Cytometry B Clin Cytom 2021; 100 : 361–369.
- Shi M, Jevremovic D, Otteson GE, Timm MM, Olteanu H, Horna P. Single antibody detection of T-cell receptor αβ clonality by flow cytometry rapidly identifies mature T-cell neoplasms and monotypic small CD8-positive subsets of uncertain significance. Cytometry B Clin Cytom 2020; 98 : 99–107.
- Muñoz-García N, Lima M, Villamor N, et al. Anti-TRBC1 antibody-based flow cytometric detection of T-cell clonality: Standardization of sample preparation and diagnostic implementation. Cancers (Basel) 2021; 13(17): 4379.
- Cardoso CC, Auat M, Santos-Pirath IM, et al. The importance of CD39, CD43, CD81, andCD95 expression for differentiating B cell lymphoma by flow cytometry. Cytometry B Clin Cytom 2018; 94 : 451–458.
- Novikov ND, Griffin GK, Dudley G, et al. Utility of a simple and robust flow cytometry assay for rapid clonality testing in mature peripheral T-cell lymphomas. Am J Clin Pathol. 2019; 151 : 494–503.
- Jevremovic D, Olteanu H. Flow cytometry applications in the diagnosis of T/NK-cell lymphoproliferative disorders. Cytometry B Clin Cytom 2019; 96 : 99–115.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článok vyšiel v časopiseČesko-slovenská patologie

2023 Číslo 4-
Všetky články tohto čísla
- Lymfom, či nelymfom, toť otázka
- … od svých vrstevníků jsem se lišil při řezání žížal žiletkou - oni příčně, já podélně …
- MONITOR aneb nemělo by vám uniknout, že
- Úloha průtokové cytometrie v diagnostice hematologických a imunologických onemocnění u dětí
- Imunofenotypizační vyšetření punktátů kostní dřeně v diagnostice hematoonkologických onemocnění
- Role průtokové cytometrie při vyšetřování vzorků lymfatických uzlin a extranodálních tkání
- Kompozitní folikulární lymfom a in situ mantle cell neoplázie lymfatické uzliny: identifikace na základě vyšetření průtokovou cytometrií
- Post mortem vyšetření případů náhlé srdeční smrti. Česká zkušenost a možnost zapojení patologů do multidisciplinárního procesu
- Nízkotučná varianta vřetenobuněčného lipomu: kazuistika
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Imunofenotypizační vyšetření punktátů kostní dřeně v diagnostice hematoonkologických onemocnění
- Role průtokové cytometrie při vyšetřování vzorků lymfatických uzlin a extranodálních tkání
- Nízkotučná varianta vřetenobuněčného lipomu: kazuistika
- Úloha průtokové cytometrie v diagnostice hematologických a imunologických onemocnění u dětí
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



