-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diabetes mellitus
Autoři: J. Lebl; S. Koloušková; Z. Šumník; M. Šnajderová
Působiště autorů: Pediatrická klinika UK 2. LF a FN Motol, Praha
Vyšlo v časopise: Čes-slov Pediat 2011; 66 (1): 34-41.
Kategorie: Vybrané kapitoly z nové učebnice Klinická pediatrie
Pojem diabetes mellitus označuje příznakový soubor, který je společný několika nozologickým jednotkám. Tento příznakový soubor zahrnuje
- hyperglykémii
- glykosurii
- absolutní nebo relativní nedostatek inzulinu
- riziko pozdních komplikací vlivem chronické hyperglykémie
Diagnostická kritéria diabetu shrnuje tabulka 1.
Tab. 1. Diagnostická kritéria diabetes mellitus podle ADA (Americké diabetologické asociace) a WHO (Světové zdravotnické organizace). Hodnoty glykémie se rozumějí v žilní krvi. 
Mírnější forma poruchy se označuje jako porušená glukózová tolerance (IGT; glykémie ve 120. minutě oGTT mezi 7,8 a 11,0 mmol/l), resp. jako zvýšená glykémie nalačno (IFG; glykémie nalačno mezi 5,6 a 6,9 mmol/l).
Převážná většina dětí, dospívajících a mladých dospělých má diabetes mellitus 1. typu. Tato nejzávažnější forma diabetu je způsobena autoimunitní destrukcí beta-buněk a je životně závislá na léčbě inzulinem. Před objevem inzulinu v roce 1921 byla prognóza diabetu 1. typu beznadějná.
Diabetes mellitus 2. typu je typickým onemocněním dospělého a staršího věku. Je spojen s nadváhou a stoupající inzulinovou rezistencí, kterou nedokáže vlastní sekrece inzulinu překonat. Epidemie dětské obezity v některých částech světa vede k výskytu diabetu 2. typu při těžké obezitě již v adolescenci.
Oba tyto typy diabetu patří mezi polygenně podmíněná onemocnění s výrazným podílem faktorů prostředí.
Monogenně podmíněné typy diabetu jsou méně časté. Patří mezi ně řada podtypů diabetu MODY (maturity-onset diabetes of the young), většina případů novorozeneckého diabetu a skupina tzv. diabetických syndromů, u kterých je diabetes jednou součástí komplexního zdravotního problému (obr. 1). K této skupině patří také diabetes mellitus spojený s cystickou fibrózou (CFRD; cystic fibrosis related diabetes).
Obr. 1. Typy diabetu u dětí a dospívajících. Řada pacientů s monogenním diabetem je mylně klasifikována jako diabetes mellitus 1. typu, případně 2. typu, protože tyto typy diabetu jsou známější. Správné zařazení typu diabetu pomáhá určit optimální terapii i dlouhodobou prognózu nemoci. T1DM – diabetes mellitus 1. typu T2DM – diabetes mellitus 2. typu MODY – maturity-onset diabetes of the young 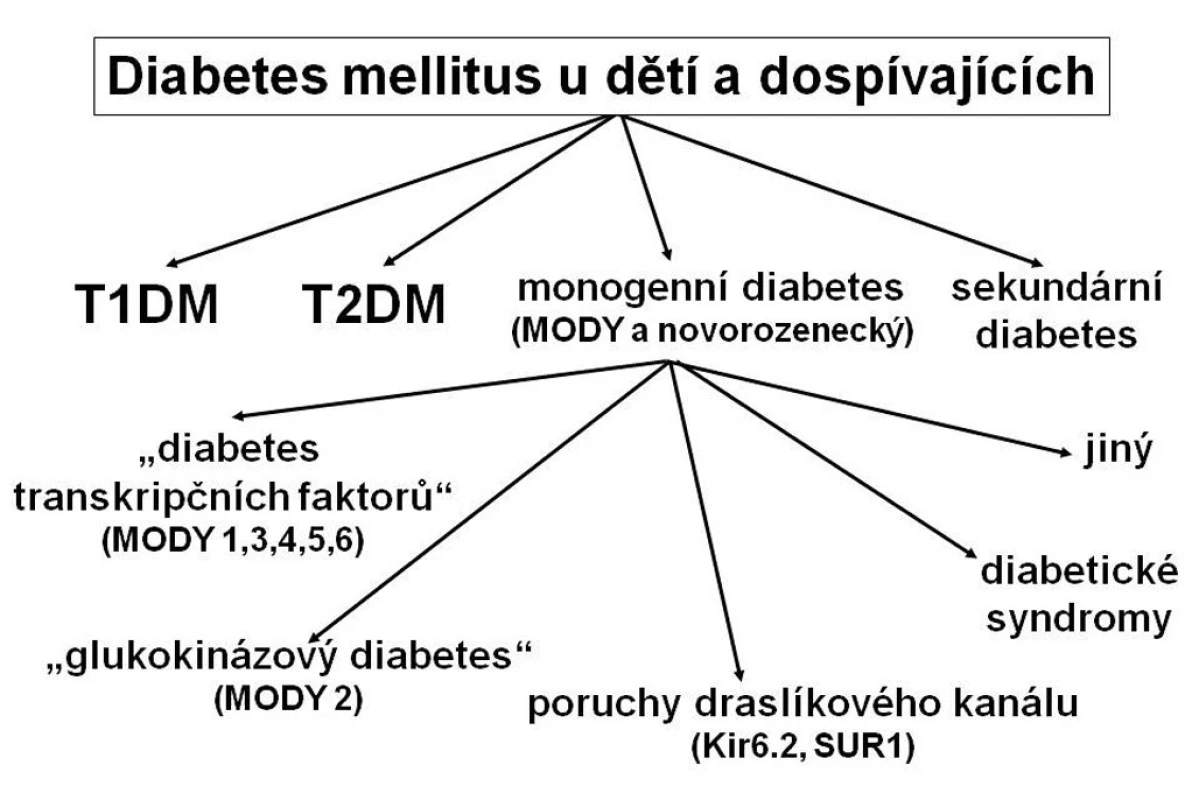
Sekundární diabetes je způsoben nadprodukcí některých hormonů nebo farmaky. V dětském věku je vzácný.
1. DIABETES MELLITUS 1. TYPU
Incidence diabetes mellitus 1. typu dětí se významně liší mezi jednotlivými zeměmi i etnickými skupinami. Nejnápadnější je tento rozdíl v Evropě, kde incidence kolísá od 3,6 nově zjištěných případů nemoci na 100 000 dětí za rok v Makedonii do 65 případů na 100 000 dětí za rok ve Finsku. Česká republika má v rámci Evropy střední incidenci – 18,5 případů na 100 000 dětí za rok. Během posledních 20 let incidence u nás stoupla na více než dvojnásobek, nejvíce u nejmenších dětí do 4 let věku.
I když rozdílná incidence v jednotlivých zemích má zřejmě zejména příčiny genetické, rychlý nárůst incidence v určité zemi musí být vyvolán faktory prostředí, které však zatím nedokážeme spolehlivě identifikovat.
Od prvního léčebného podání inzulinu a záchrany života prvního dítěte s diabetem 1. typu uplynulo již bezmála celé století. Za tuto dobu se léčba zdokonalovala, řada nevyřešených problémů však zůstává. I proto jsou atraktivní úvahy o prevenci diabetu 1. typu. I když v posledních 20 letech proběhla řada mezinárodních intervenčních studií u rizikových skupin založených na pokusu o imunomodulaci autoimunitního procesu, spolehlivou metodu pro prevenci diabetu zatím neznáme. Výzkum v tomto směru pokračuje.
Diabetes 1. typu patří ve vyspělých zemích mezi prioritní zdravotnické problémy. Proto se hledají cesty k jeho definitivnímu vyléčení. Pracuje se jak na metodě technické („umělá beta-buňka“ s uzavřenou zpětnou vazbou mezi glykémií a dodávkou inzulinu – nejspíše stabilní glykemický senzor spojený s inzulinovou pumpou), tak i biologické (transplantace beta-buněk). Oba postupy však zatím nejsou využitelné v rutinní klinické praxi.
Pacienti s diabetem 1. typu jsou tedy zatím odkázáni na inzulinovou léčbu spojenou s monitorováním glykémií a určitými úpravami životního stylu.
1.1. Klinické příznaky diabetu 1. typu
Většina dětí s nově manifestovaným diabetem 1. typu vyhledá lékaře pro osmotické příznaky (polyurii, polydipsii) spojené s úbytky hmotnosti. U menších dětí se asi v polovině případů přidružuje sekundární noční enuréza. Tyto příznaky trvají asi 2–4 týdny před stanovením diagnózy a často navazují na prodělaný interkurentní infekt. Ten nebyl vyvolávajícím faktorem diabetu (destrukce beta-buněk probíhá měsíce či léta), ale zvýšil nároky na inzulinovou sekreci u dítěte s hraničním deficitem inzulinu, což vyvolalo hyperglykémii, glykosurii a osmotickou diurézu. Výskyt nových případů kulminuje v únoru a březnu a v září a říjnu, v sezoně respiračních infektů. Diabetes se klinicky projeví v době, kdy již bylo autoimunitním procesem zničeno 80–85 % z původního počtu beta-buněk (obr. 2).
Obr. 2. Přirozený průběh autoimunitní inzulitidy ve schematickém vyjádření. Jedinec se rodí s genetickou predispozicí pro možný vznik diabetu 1. typu. Autoimunitní destrukce beta-buněk (inzulitida) začíná vlivem spouštěcího faktoru ze zevního prostředí. Postupně ubývá masy beta-buněk a klesá celková kapacita sekrece inzulinu. Po určité době lze prokázat pokles sekrece inzulinu (intravenózním glukózovým tolerančním testem), později i poruchu glukózové tolerance (orálním glukózovým tolerančním testem). Toto vyšetření se však zpravidla neprovádí, protože jedinec je asymptomatický. Klesne-li kapacita betabuněk na 10–15 % původního množství, rozvine se trvalá hyperglykémie a klinické příznaky diabetu. Je diagnostikován diabetes a zahájeno léčení (podle Kateřiny Štechové a Lenky Petruželkové). 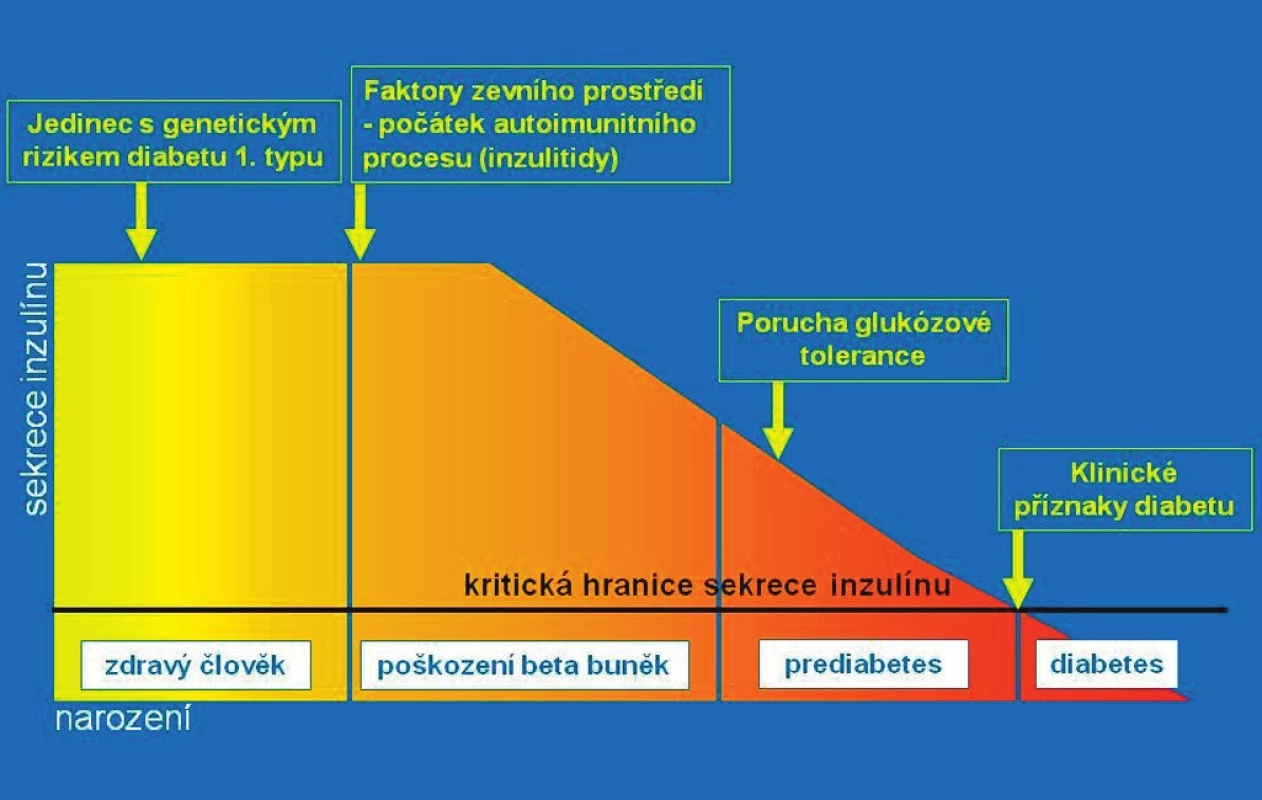
Nejsou-li osmotické příznaky včas rozpoznány, rozvine se diabetická ketoacidóza. Projeví se zvracením, extrémní žízní, dehydratací, bolestmi břicha, acetonemickým foetorem ex ore a Kussmaulovým acidotickým dýcháním. Může vyústit do diabetického kómatu s poruchou vědomí a bezprostředním ohrožením života.
Definitivní diagnóza diabetu je založena na laboratorním vyšetření. Pokud jsou přítomny klinické příznaky a glykémie kdykoliv během dne je rovna nebo vyšší než 11,1 mmol/l (viz tab. 1), jedná se jistě o diabetes mellitus. Pokud máme pochybnosti, monitorujeme po dobu 24 hodin preprandiální a postprandiální glykémie a potom v případě potřeby provádíme zátěžový test s glukózou (oGTT – orální glukózový toleranční test a/nebo ivGTT – intravenózní glukózový toleranční test). V některých případech zjistíme u dítěte diabetes mellitus náhodně před klinickými projevy při vyšetření glykosurie nebo glykémie při preventivní prohlídce.
1.2. Principy léčení diabetu 1. typu
Základem léčení je dlouhodobá aplikace inzulinu s cílem
- dosáhnout glykémií co nejbližších fyziologickým hodnotám a zabránit tak rozvoji chronických komplikací diabetu;
- zajistit fyziologický růst a vývoj dítěte;
- předejít těžším hypoglykémiím a zabránit tak poškození mozku.
Potřebné dávky inzulinu a způsob podávání inzulinu (injekčními pery nebo inzulinovou pumpou) závisejí na věku, na zbytkové endogenní sekreci inzulinu a na individuální energetické potřebě pro růst, vývoj a fyzickou aktivitu. Lepší metabolická kontrola zejména v adolescenci snižuje četnost a oddaluje nástup cévních komplikací diabetu (ve studii DCCT dlouhodobé snížení hladiny HbA1c o 2 % snížilo riziko mikroangiopatií o 50 až 70 %), ale u menších dětí a u dětí v obtížnějších sociálních podmínkách hledáme kompromis mezi optimální hladinou HbA1c a zvýšeným rizikem těžkých hypoglykémií.
Základním předpokladem pro úspěšné léčení diabetického dítěte a adolescenta je edukace rodiny a pacienta samotného. Během několika dní se z laiků stanou specialisté na dlouhodobé domácí léčení diabetu, kteří dokážou úspěšně zvládnout cukrovku za nejrůznějších, často nepředvídatelných životních okolností. Plán úvodní edukace po zjištění diagnózy shrnuje tabulka 2.
Tab. 2. Program úvodní edukace rodiny diabetického dítěte po stanovení diagnózy. 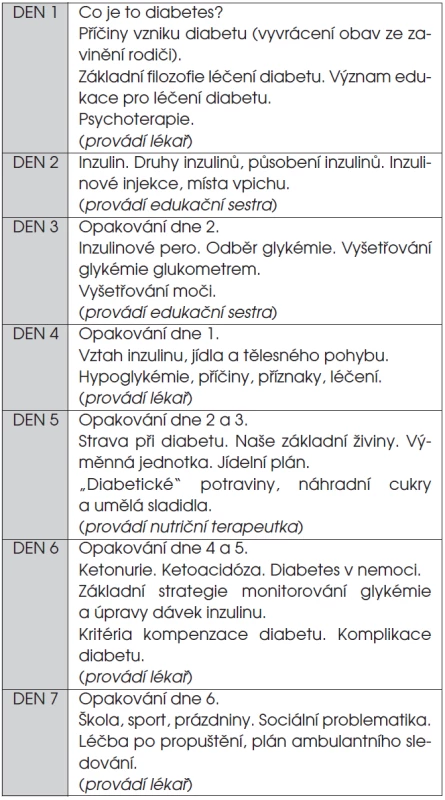
Rozšířená edukace při následných kontrolách v ambulanci je zaměřena na věkově specifické problémové okruhy, např. na problematiku nejmenších dětí, školy, adolescence, partnerských vztahů, antikoncepce a podobně. Cílem je poskytnout sumu aktivních znalostí a dovedností, ale také motivovat k optimální metabolické kontrole, a to při zachování kvality života dítěte a dospívajícího srovnatelné s jeho zdravými vrstevníky. Motivaci zvyšuje osobní účast na léčbě. Proto by se malý pacient měl na léčbě od počátku podílet úměrně svému věku.
1.3. Diabetická ketoacidóza u dětí
Diabetická ketoacidóza je nejzávažnější akutní komplikací diabetu, která může bezprostředně ohrozit život. Její mortalita ve vyspělých zemích je 1–2 %.
Diabetická ketoacidóza je definována jako pH pod 7,30 nebo sérový bikarbonát pod 15 mmol/l ve spojení s hyperglykémií nad 12–15 mmol/l, ketonémií/ketonurií a glykosurií. Výjimečně nemusí být při diabetické ketoacidóze po dlouhodobém nedostatečném příjmu sacharidů přítomna hyperglykémie.
Příčinou diabetické ketoacidózy je relativní nebo absolutní nedostatek inzulinu. Může být prvním projevem dosud neléčeného diabetu nebo vzniká u již léčených diabetických pacientů. V těchto případech může být příčinou vynechání inzulinových dávek či akutní stresová situace – trauma či vážnější infekce.
1.3.1. Patogeneze a rizika diabetické ketoacidózy
V patogenezi diabetické ketoacidózy jsou nejzávažnější tyto čtyři faktory:
- hyperglykémie – při nedostatku inzulinu klesá periferní utilizace glukózy a stoupá hepatální produkce glukózy;
- metabolická acidóza (ketoacidóza) – hromadí se produkty utilizace mastných kyselin (ketonémie) jako náhradního energetického zdroje. Acidóza je částečně, ale nedostatečně respiračně kompenzovaná, což se projevuje Kussmaulovým acidotickým dýcháním a nízkým pCO2);
- dehydratace – přispívá k ní zvracení a vystupňovaná osmotická diuréza;
- iontové změny:
- draslík – dochází k depleci intracelulárního i celkového tělesného kalia vlivem selhání aktivního transportu na buněčných membránách, vyplavením kalia z buněk a následně jeho ztrátami do moči. Hladina kalia v krvi přitom může být normální nebo zvýšená;
- sodík – dochází jednak k distribučním změnám, jednak k depleci celkového tělesného natria. Natrium uniká z extracelulárního do intracelulárního prostoru výměnou za kalium, podle koncentračního gradientu (selhává aktivní transport). Nadměrné jsou i ztráty natria močí při polyurii. Hladina natria v krvi přitom může být snížená, normální i zvýšená, podle toho, převažuje-li deplece natria nebo dehydratace s hemokoncentrací.
Život dítěte s diabetickou ketoacidózou ohrožuje
- oběhové selhání s prerenálním selháním ledvin – před zahájením léčby
- ireverzibilní metabolické selhání – před zahájením léčby nebo při nesprávně vedené dodávce inzulinu
- srdeční zástava v důsledku deplece kalia – za 6–24 hodin po zahájení léčby
- edém mozku při rychlém poklesu sérové osmolality – v prvních 24 hodinách po zahájení léčby
- iatrogenní alkalóza po nadměrném podání bikarbonátu – v prvních 24 hodinách po zahájení léčby.
1.3.2. Principy léčení diabetické ketoacidózy
Při léčbě diabetické ketoacidózy je zapotřebí současně řešit dehydrataci, metabolickou acidózu, deficit kalia, správně podávat inzulin k potlačení ketogeneze a zabránit komplikacím léčby, zejména edému mozku.
Rehydratace
Míru dehydratace lze odvodit z úbytku tělesné hmotnosti, v praxi je to ale obtížné – na úbytku hmotnosti se spolupodílí i úbytek tukové a svalové tkáně, navíc anamnestický údaj o hmotnosti často chybí. Rehydrataci zahajujeme co nejrychleji. U šokového stavu podáváme v první fázi 10–20 ml 1/1 fyziologického roztoku/kg tělesné hmotnosti během 1–2 hodin. Již do tohoto roztoku přidáváme koncentrát kalia (viz dále). Množství tekutin a kalia upravujeme u pacientů s porušenou funkcí ledvin (oligurií). Potřebu tekutin a iontů pro druhou fázi léčení diabetické ketoacidózy shrnuje tabulka 3.
Tab. 3. Potřeba tekutin a iontů pro druhou fázi léčení diabetické ketoacidózy. 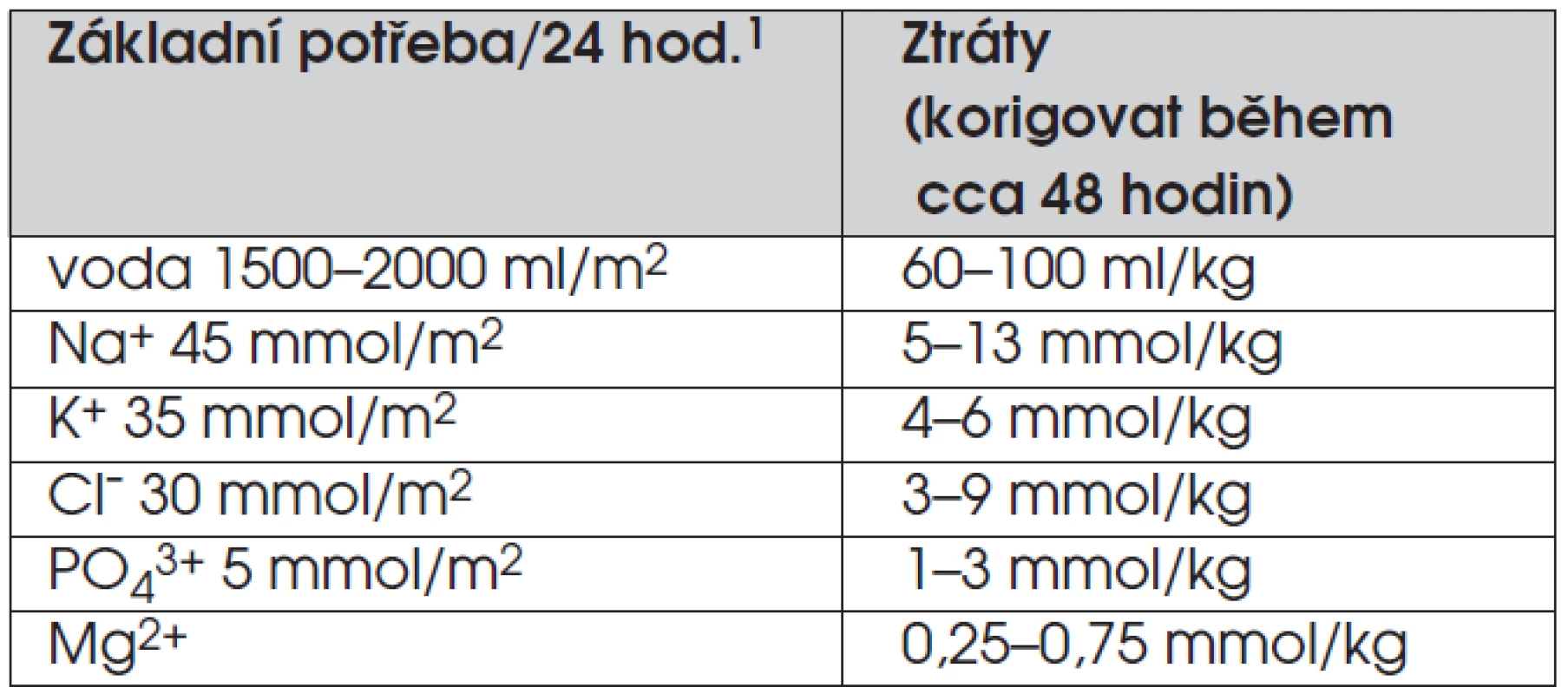
11 m2 odpovídá u zdravých osob v průměru 28 kg tělesné hmotnosti. Metabolická acidóza
Kauzální léčbou metabolické acidózy je kontinuální i.v. infuze inzulinu (viz dále). Acetoacetát i beta-hydroxybutyrát, hlavní složky ketolátek, jsou metabolizovatelné anionty a při léčbě inzulinem proto dojde k úpravě acidózy bez podání alkalinizačních roztoků. Podání roztoku bikarbonátu při diabetické ketoacidóze je vyhrazeno pro pacienty s pH 6,9 a méně a/nebo s hladinou bikarbonátu pod 5 mmol/l. Podáváme jen 20–25 % dávky bikarbonátu vypočítané z obvyklého vzorce pro jeho deficit. Podání ukončujeme při vzestupu pH k 7,0. Acidobazickou rovnováhu kontrolujeme při léčbě diabetické ketoacidózy nejméně každé tři hodiny v úvodu léčení a dále po 6 hodinách do zvládnutí ketoacidózy.
Hypokalémie
Kalémie neodpovídá celkovému tělesnému kaliu. O intracelulární hladině kalia se přesvědčíme z křivky EKG. Pokud ale během léčby ketoacidózy kalémie klesá, svědčí to o celkové depleci kalia. Kalémii kontrolujeme v úvodu léčení ketoacidózy nejméně každé 3 hodiny, dále po 6 hodinách do zvládnutí ketoacidózy. S výjimkou pacientů s porušenou funkcí ledvin (oligurií) přidáváme molární koncentráty kalia do infuzních roztoků od počátku infuzní léčby s cílem korigovat kaliový deficit. Doporučuje se podávat 1/2 až 2/3 kalia jako molární roztok 7,5% KCl a 1/3 až 1/2 jako molární roztok 13,6% KH2PO4.
Inzulinová léčba
Inzulinová léčba je kauzální léčbou diabetické ketoacidózy. Podáváme rychle působící inzulin v kontinuální i.v. infuzi lineárním dávkovačem (perfuzorem). Zahajujeme ji hned nebo nejdéle za 1–2 hodiny po potvrzení diagnózy, nejlépe současně se zahájením rehydratační infuze. Inzulin ředíme z původní koncentrace 100 I.U./ml 1/1 fyziologickým roztokem zpravidla na koncentraci 1 I.U./ml. Počáteční rychlost infuze inzulinu se pohybuje mezi 0,05 a 0,1 I.U./kg/hod, výjimečně až 0,15 I.U./kg/hod, ale během léčby ketoacidózy nemá klesnout pod 0,05 I.U./kg/hod (minimální množství nezbytné k potlačení ketogeneze). Účinek inzulinu posuzujeme z rychlosti poklesu glykémie. Cílem léčení diabetické ketoacidózy však není normalizovat glykémii, ale zvládnout acidózu (potlačit ketogenezi a normalizovat acidobazickou rovnováhu). Ketolátky vyšetřujeme proužkem z každé porce moči. Lze použít i speciální proužek na bed-side stanovení hladiny beta-hydroxybutyrátu z krve. Správně léčená diabetická ketoacidóza ustupuje do 24 hodin. Glykémie při léčbě diabetické ketoacidózy kontrolujeme po 1 hodině. Optimální rychlost poklesu glykémie je do 6 mmol/hod. Podle dynamiky glykémie řídíme rychlost infuze inzulinu, případně i typ infuzních roztoků. Při prvním poklesu glykémie pod 14 mmol/l přecházíme z plného solného roztoku na roztok 10% glukózy s přídavky iontových koncentrátů.
Při léčení diabetické ketoacidózy se vyhýbáme hypoglykémii, abychom zajistili dostatečný přísun glukózy buňkám a zabránili rozvoji edému mozku. Glykémie by neměla klesnout pod 6 mmol/l.
Během 3–4 hodin správně vedené infuzní léčby se projeví zlepšení metabolických parametrů i celkového klinického stavu. Pokud k němu nedochází, může to být vinou nedostatečné hydratace, nízké dávky inzulinu, infekčního ložiska nebo jiné sdružené nemoci. Po zlepšení metabolického stavu nabízíme per os čiré tekutiny. Pokud pacient nezvrací, nemá nauzeu, má-li slyšitelnou peristaltiku a cítí-li hlad, je možné podat jídlo per os 4 až 24 hodin od počátku léčení ketoacidózy. Infuzní léčbu obvykle končíme po 24–48 hodinách a přecházíme na s.c. podání inzulinu.
1.4. Dlouhodobá inzulinová léčba
Fyziologickou substitucí inzulinu je tzv. systém bazal-bolus. Podává se buď inzulinovými pery s 3–4 injekcemi inzulinu denně, nebo inzulinovou pumpou (kontinuální podkožní infuzí inzulinu s programovatelnou rychlostí).
Při léčbě injekcemi zajišťuje základní (“bazální”) hladinu inzulinu dlouhodobě působící inzulin podávaný večer a případně i ráno – depotní NPH inzulin nebo dlouhodobý inzulinový analog. Nárazové dávky inzulinu (“bolusy”) podáváme ve formě rychle působícího inzulinu nebo rychle působícího inzulinového analogu před hlavními jídly.
Inzulinová pumpa s kanylkou zavedenou trvale do podkoží na břiše obsahuje rychle působící inzulinový analog. Samostatně se programuje trvalá infuze bazální dávky inzulinu a odděleně se podávají „bolusy“ na jednotlivá jídla. Některá pracoviště používají inzulinovou pumpu i u dětí s čerstvou manifestací diabetu, pro kvalitní metabolickou kontrolu to ale nebývá potřebné.
Celková denní dávka inzulinu je individuální a zjistí se empiricky – tak, aby dítě bylo téměř normoglykemické při běžném jídle a obvyklé pohybové aktivitě. Děti bez endogenní sekrece inzulinu potřebují v průměru 0,6–0,8 I.U./kg/den, v pubertě v době růstového výšvihu 1,0–1,5 I.U./kg/den, po pubertě opět méně. Při zachované endogenní sekreci inzulinu (během „postiniciální remise“, tj. v prvních měsících až letech po manifestaci diabetu) může denní dávka klesnout pod 0,5 I.U./kg/den.
1.5. Hypoglykémie
Hypoglykémie je častým průvodním jevem při léčbě diabetu inzulinem. Vzniká vlivem momentálního relativního nadbytku inzulinu z těchto příčin:
- vynechané/málo vydatné jídlo,
- neobvyklá fyzická námaha,
- vědomě či nevědomě podaná nadměrná dávka inzulinu,
- alkohol.
Zkušený pacient s diabetem dokáže riziko hypoglykémie předvídat a naučí se mu většinou předcházet. Běžné mírnější hypoglykémie zvládne pomocí běžného jídla s obsahem škrobu, případně sladkým nápojem (plechovkou sladké limonády, malou krabičkou džusu), který má mít stále při sobě. Pro menší děti je včasné rozpoznání hypoglykémie prvním úkolem, který mají zvládnout v péči o svůj diabetes (tab. 4).
Tab. 4. Nejčastější příznaky hypoglykémie, jak je popsali děti a dospívající s diabetem. 
Těžká hypoglykémie s poruchou vědomí a/nebo křečemi je při pravidelném domácím monitorování glykémií vzácná. Laickou první pomocí je s.c. nebo i.m. podání injekce glukagonu (Glucagen Hypo-Kit). Lékař podá jako první pomoc rychle i.v. roztok 40% glukózy v dávce 0,5 až 1 ml/kg tělesné hmotnosti dítěte.
Přetrvává-li po hypoglykémii porucha vědomí, křeče nebo bolesti hlavy se zvracením, jedná se o posthypoglykemický edém mozku. Zvládneme jej i.v. kortikoidy (methylprednisolonem), případně i infuzí Mannitolu. Souběžná infuzní léčba roztokem 10% glukózy s iontovými koncentráty zabrání opakování hypoglykémie. Do léčby brzy doplníme kontinuální infuzi inzulinu k prevenci posthypoglykemické hyperglykémie.
1.6. Domácí monitorování
Domácí monitorování je průběžnou kontrolou inzulinové léčby. Každé diabetické dítě má osobní glukometr a každý den si měří glykémie 3–4krát denně (před snídaní, před obědem, před 1. večeří a před spaním) a dále ve všech naléhavých situacích – např. při podezření na hypoglykémii a při zvracení. Měření glykémií umožní nejen posoudit okamžitou situaci, ale hlavně zlepšovat strategii inzulinové léčby, odhadovat riziko hypoglykémie a lépe porozumět vlivu životního rytmu (stravy, fyzické aktivity) na glykémie.
Kontinuální monitory glykémie otevírají novou éru v léčení diabetu. V současné době jsou již stabilní a spolehlivé po dobu několika dní, jsou však poměrně nákladné. Jsou zejména příslibem pro budoucí vytvoření uzavřeného okruhu s kontinuální dodávkou inzulinu podle měřené glykémie.
Ketolátky v moči se měří proužkem každý den ráno. Malé množství ketolátek při normoglykémii umožní detekovat skrytou noční hypoglykémii. Dále je potřebné měřit ketolátky v moči při každé glykémii nad 13 mmol/l k včasnému zachycení počínající ketoacidózy.
1.7. Regulovaná strava
Liberální koncept stravy při dětském diabetu je založen na minimu zákazů, ale na detailním porozumění stravy z hlediska jejího složení a množství. Proto dětská diabetologie používá pojem „regulovaná strava“ namísto pojmu „diabetická dieta“. Právě přemýšlení o stravě, která je každému dítěti blízká, má šanci posilovat spolupráci diabetického dítěte při léčení diabetu.
Vyloučení sacharózy ze stravy diabetického dítěte je obsolentní. Řada studií prokázala, že sacharóza jako součást smíšeného jídla („mixed meal“) neovlivňuje nepříznivě ani krátkodobý průběh glykémií, ani dlouhodobou metabolickou kontrolu. Množství jídla vyjadřujeme ve výměnných jednotkách, které jsou ekvivalentem obsahu sacharidů (výměnná jednotka odpovídá 12 g sacharidů, v některých systémech 10 g sacharidů). Příklady výměnných jednotek v některých jídlech shrnuje tabulka 5.
Tab. 5. Příklady ekvivalentu jedné výměnné jednotky (12 g sacharidů) v běžné stravě. Tatomnožství jídla lze v jídelním plánu diabetického dítěte volně „vyměňovat“ při zachování stejného vlivu na glykémii. Jídla, která obsahují jen bílkoviny, tuky, vodu a/nebo vlákninu, se do jídelního plánu nezapočítávají (maso, tuky, zelenina). 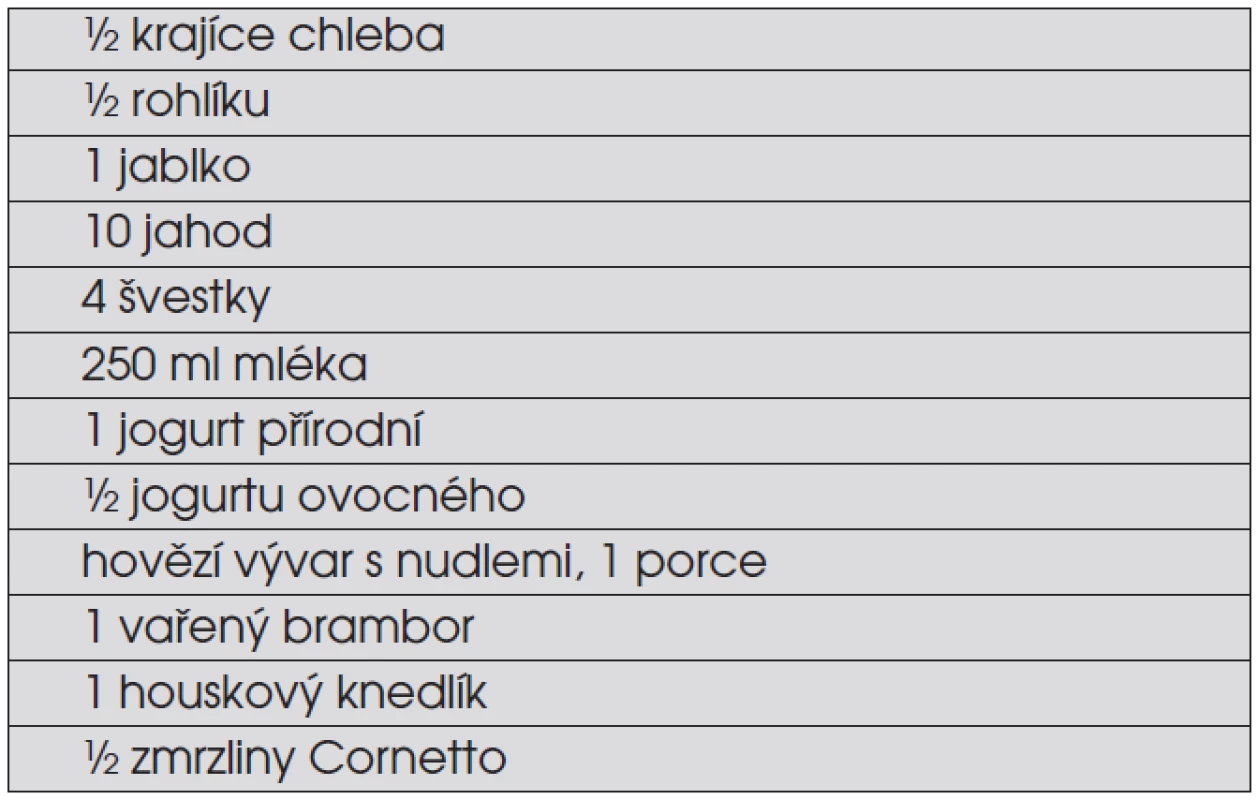
Sestava výměnných jednotek v jednotlivých jídlech se označuje jako jídelní plán. Jídelní plán sestavuje rodina společně s nutriční terapeutkou tak, aby bylo možné zachovat stravovací zvyklosti rodiny, uspokojit energetické potřeby dítěte a vytvořit předpoklady pro stabilní kompenzaci diabetu.
1.8. Dlouhodobé sledování diabetického dítěte
Diabetické dítě kontrolujeme v ambulanci zpravidla jednou za tři měsíce. Základním ukazatelem dlouhodobé kompenzace diabetu je glykosylovaný hemoglobin HbA1c. Sledujeme fyziologický růst, vývoj a pubertální zrání dítěte a jeho krevní tlak.
S cílem zachytit včas první známky diabetických komplikací sledujeme dvakrát ročně albuminurii a od 10–12 let věku jednou ročně oční vyšetření, které má provádět oční lékař se zkušeností v detekci časných fází retinopatie. Jednou za rok stanovíme TSH, protilátky proti tyreoidální peroxidáze a proti tyreoglobulinu a protilátky proti endomyziu a tkáňové transglutamináze, protože autoimunitní onemocnění štítné žlázy a celiakie jsou nejčastějšími sdruženými autoimunitními poruchami.
2. DIABETES MELLITUS 2. TYPU
Diabetes mellitus 2. typu byl donedávna považován za onemocnění dospělého věku. Pandemie obezity v USA od 90. let 20. století způsobila, že v některých amerických centrech tvoří diabetes 2. typu až čtvrtinu nově diagnostikovaných případů diabetu ve věkové skupině 10–17letých. Podobné zprávy přicházejí z některých dalších zemí. Většina případů je asymptomatických, některé se však manifestují osmotickými příznaky, vzácně i ketoacidózou. Typické jsou projevy acanthosis nigricans (obr. 3).
Obr. 3. Acanthosis nigricans v axile u 14leté dívky s diabetes mellitus 2. typu. Ložiska acanthosis nigricans – tmavé kůže s hyperkeratózou a hrubým reliéfem – jsou typická pro mladistvé s diabetem 2. typu. Nacházíme je nejčastěji na zátylku, v axilách a u pacientů s morbidní obezitou na vnitřních stranách stehen. 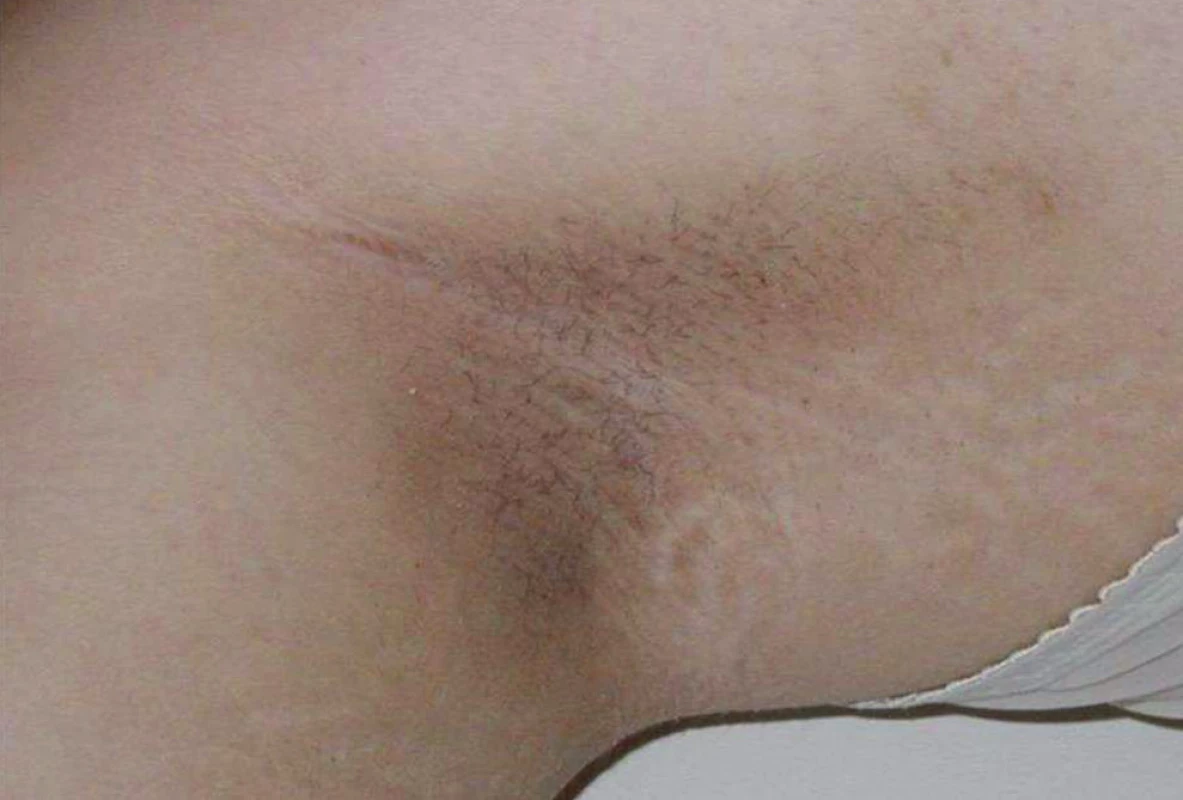
Odlišení obou základních typů diabetu může být u dětí obtížné. Pro diabetes 2. typu je typická obezita, pozitivní rodinná anamnéza, laboratorní a klinické projevy inzulinové rezistence, případně negativita ostrůvkových autoprotilátek. V řadě zemí je diabetes 2. typu častější u etnických minorit (tab. 6). V některých případech může být zpočátku potřebná inzulinová léčba, poté je však výhodné přejít na léčbu metforminem, což usnadní snížení hmotnosti při přísném redukčním režimu (tab. 7). Postižení pacienti mají bohužel vysoké riziko časného rozvoje chronických komplikací diabetu.
Tab. 6. Praktická diferenciální diagnostika příčin hyperglykémie u dětí a dospívajících. 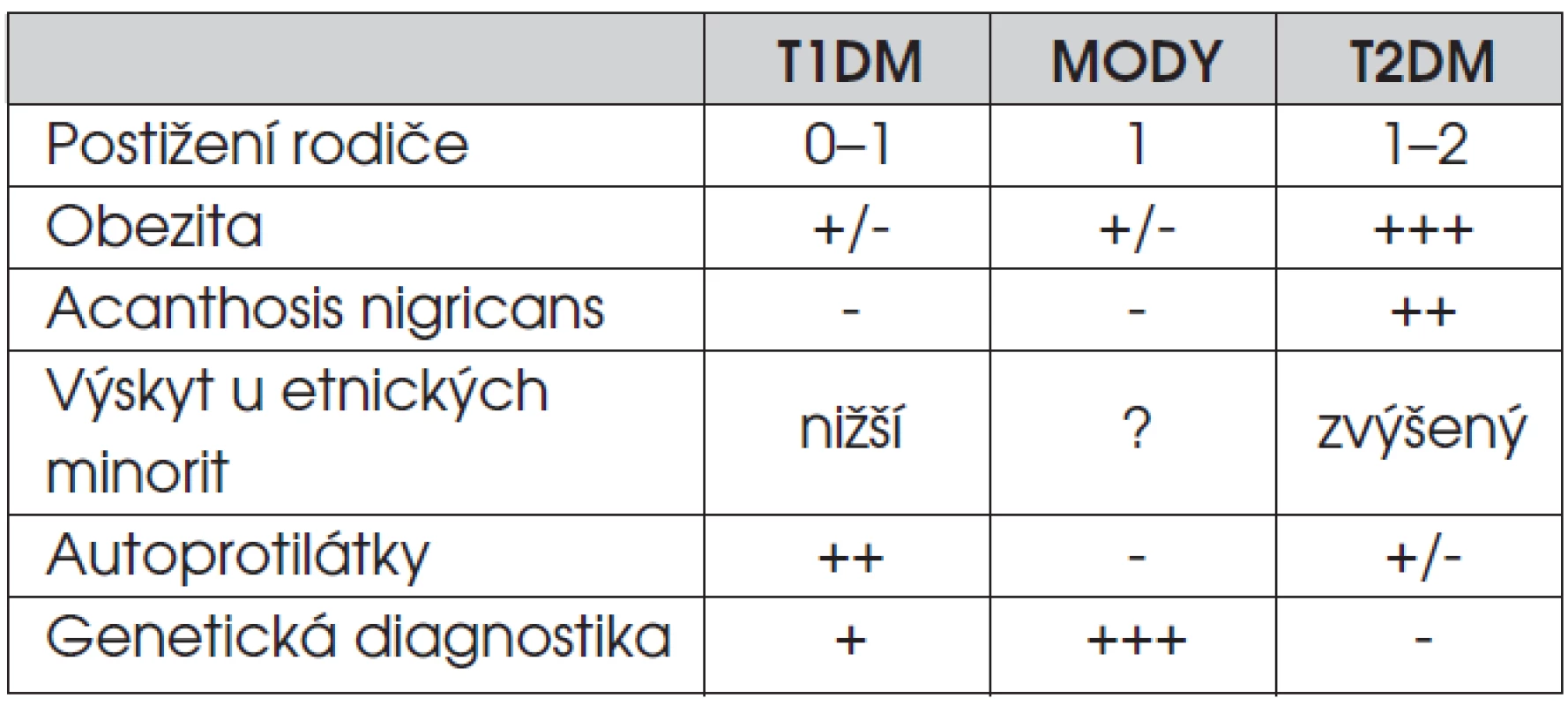
MODY – Maturity-onset diabetes of the young (monogenně podmíněné formy diabetu, které se v rodinách dědí autozomálně dominantně) T1DM – diabetes mellitus 1. typu T2DM – diabetes mellitus 2. typu Tab. 7. Rámcové cíle léčby diabetes mellitus 2. typu u dospívajících. 
3. MONOGENNĚ PODMÍNĚNÉ TYPY DIABETU
Od 90. let 20. století byly postupně objeveny více než dvě desítky genů, jejichž mutace mohou způsobit poruchu funkce beta-buňky, která se projeví hyperglykémií. Podle odhadů může být monogenní porucha zodpovědná za 3–5 % všech případů diabetu, je tedy poměrně častá. Většina pacientů s monogenním diabetem však zatím není správně diagnostikována a je označena jako diabetes mellitus 1. nebo 2. typu, případně o své poruše zatím neví. Správné určení typu monogenního diabetu je pro pacienta důležité (viz tab. 6), protože umožňuje navrhnout optimální terapii (žádná potřebná léčba – deriváty sulfonylurey – inzulin).
Molekulárně genetické vyšetření je vhodné v těchto případech:
- novorozenecký diabetes (diabetes diagnostikovaný během prvních 6 měsíců života);
- diabetes, který se vyskytuje v rodině také u jednoho (nebo obou) rodičů;
- trvale mírně zvýšená glykémie nalačno mezi 5 a 8 mmol/l v jakémkoliv věku, ale zejména u mladých lidí;
- diabetes spojený s poruchou funkce jiného orgánu, která není způsobena dlouhodobými komplikacemi diabetu.
3.1. MODY diabetes
MODY (Maturity-onset diabetes of the young; zralá forma cukrovky vznikající v mládí) je skupina monogenních poruch funkce beta-buňky, která se dědí autozomálně dominantně.
3.1.1. Glukokinázový diabetes (MODY2)
Glukokináza funguje jako senzor beta-buňky pro glukózu (obr. 4). Zatímco „zdravé“ beta-buňky rozpoznávají jako normální glykémii mezi 3,5 a 5,5 mmol/l, beta-buňky osob s poruchou glukokinázy považují za normální glykémii poněkud vyšší – mezi 5 a 8 mmol/l.
Obr. 4. Schéma beta-buňky s vyznačením příčin monogenního diabetu. Beta-buňka je jedna z nejdokonalejších buněk lidského těla. Dokáže trvale sledovat glykémii, vyrábět inzulin do zásoby a vydávat jej do krve s cílem udržovat glykémii v normálním rozmezí a umožnit optimální využití glukózy. Každá betabuňka dokáže za minutu vyrobit až jeden milion molekul inzulinu. Glukóza vstupuje do beta-buňky v závislosti na okolní koncentraci glukózy. V beta-buňce se glukózy ujímá enzym glukokináza (GCK), označovaný jako senzor beta-buňky pro glukózu. Další zpracování glukózy probíhá v mitochondriích a vede ke změně poměru ATP:ADP. To je podnětem pro změnu prostupnosti draslíkového kanálu. Ten má dvě podjednotky – Kir6.2 a SUR1 (tzv. sulfonylureový receptor). Výstup draslíkových iontů z buňky změní membránový potenciál a tím otevře vápníkový kanál. Zvýšení koncentrace vápníkových iontů v beta-buňce je podnětem pro exocytózu inzulinu. Přepis klíčových genů v jádře beta-buňky je kontrolován transkripční regulační sítí. Porucha některého jejího článku může způsobit tzv. diabetes transkripčních faktorů. Příčinou diabetu může být i porucha inzulinového genu (podle Štěpánky Průhové). 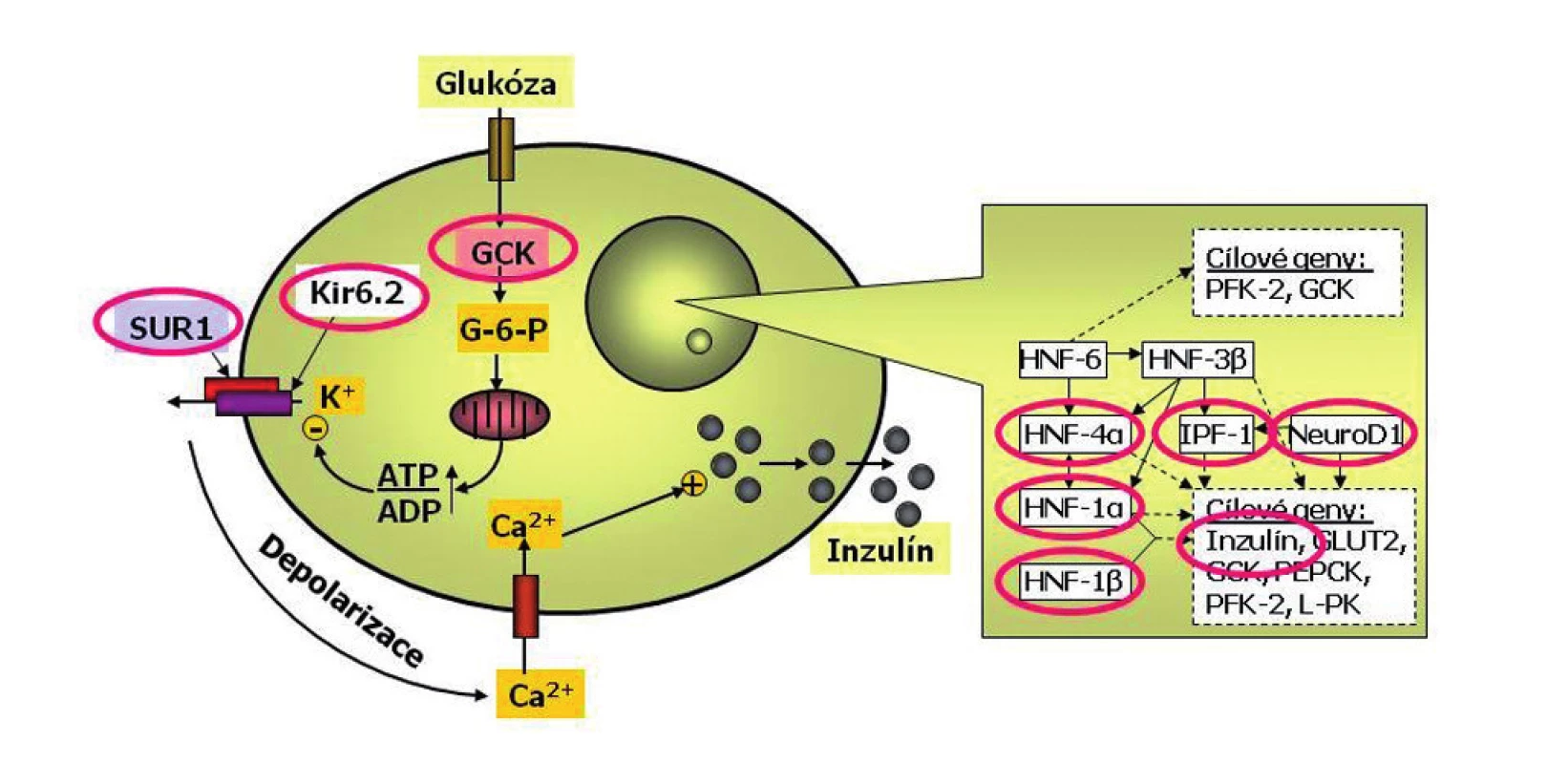
Porucha glukokinázy trvá od narození do stáří a během života se významně nemění. Glykémie o 2 až 3 mmol/l vyšší v běžném životě nevadí a dosavadní nálezy naznačují, že nezatěžuje svého nositele rizikem vzniku pozdních komplikací diabetu. Kromě těhotenství tedy nevyžaduje léčení.
3.1.2. HNF1A-diabetes (MODY3)
HNF1A-diabetes (diabetes způsobený defektem hepatocytárního nukleárního faktoru 1-alfa) je nejčastější ze skupiny „diabetu transkripčních faktorů“ – poruch molekul, které řídí genovou transkripci v jádře beta-buňky. Postihuje zřejmě 1–2 % ze všech pacientů s diabetem – to znamená, že v České republice může žít 7000–14 000 nositelů této poruchy.
Porucha genu pro HNF1A je sice vrozená, ale novorozenci a malé děti s touto poruchou nemají glykémii zvýšenou. Teprve v dětství, dospívání nebo mladé dospělosti ztrácejí beta-buňky postupně schopnost vyrábět dostatečná množství inzulinu. To vede k hyperglykémii a glykosurii, což se projeví polyurií, polydipsií a úbytky váhy. Tyto příznaky se velmi podobají diabetes mellitus 1. typu. Při HNF1A-diabetu se však nerozvíjí diabetická ketoacidóza.
HNF1A-diabetes lze léčit perorálními antidiabetiky ze skupiny derivátů sulfonylurey. Nositelé diabetu HNF1A reagují na tyto léky lépe než lidé s diabetem 2. typu a při této léčbě mohou dosáhnout lepší kompenzace než při léčbě inzulinem. Naopak nedokonalá kontrola glykémií při HNF1A diabetu vede k cévním komplikacím diabetu a k předčasným úmrtím.
Deriváty sulfonylurey se vážou přímo na SUR1 podjednotku draslíkového kanálu beta-buňky (obr. 4). Díky tomu se promptně obnovuje výroba inzulinu a jeho výdej do krve.
3.1.3. Jiné formy MODY
Jiné formy MODY diabetu jsou vzácné. Některé jsou spojeny s poruchou struktury či funkce dalších orgánů – např. HNF1B-diabetes (MODY5) s cystami ledvin či CEL-diabetes s poruchou zevní sekrece pankreatu. Jako MODY X označujeme rodiny, u kterých se diabetes mellitus dědí autozomálně dominantně, ale zatím se nepodařilo objevit poruchu v žádném ze známých genů.
3.2. Novorozenecký diabetes
Jako novorozenecký diabetes označujeme cukrovku diagnostikovanou během prvních šesti měsíců života. V některých případech se jedná o těžkou poruchu vedoucí k závažnému stavu již v prvních dnech života, jindy může být zvýšená glykémie náhodným nálezem.
Novorozenecký diabetes může být dočasný (hyperglykémie během dní až týdnů vymizí, aby se vrátila po desítkách let), nebo permanentní – hyperglykémie přetrvává.
Permanentní novorozenecký diabetes je zpravidla monogenně podmíněný. Nejčastější z příčin jsou mutace genů, které kódují podjednotky draslíkového kanálu beta-buňky – Kir6.2 (gen KCNJ11) nebo SUR1 (gen ABCC8) (viz obr. 4) a mutace genu pro inzulin. Mohou se dědit autozomálně dominantně, ale častěji se jedná o nově vzniklé mutace.
Klasickou léčbou novorozeneckého diabetu je inzulin. Některé děti s novorozeneckým diabetem se však daří převést z injekcí inzulinu na léčbu tabletami ze skupiny derivátů sulfonylurey. Převedení na tablety lze provést i mnoho let po diagnóze, jak bylo prokázáno u dospělých pacientů.
3.3. Diabetické syndromy
U „diabetických syndromů“ je cukrovka jen jednou součástí komplexního zdravotního problému. Jedná se o skupinu vzácných onemocnění, která jsou geneticky podmíněná.
DIDMOAD (Wolframův syndrom) zahrnuje diabetes insipidus, diabetes mellitus, optickou atrofii a hluchotu (deafness), jak naznačuje jeho název. Postižení předčasně umírají na progresivní neurologickou deterioraci.
MELAS syndrom je způsoben poruchou mitochondriální DNA. Vedle diabetes mellitus se projevuje mitochondriální encefalomyopatie, laktátová acidóza a stroke-like epizody.
3.4. Diabetes mellitus spojený s cystickou fibrózou
Prodloužení průměrné délky života u pacientů s cystickou fibrózou vede k tomu, že u řady nemocných se od druhého decenia projeví porucha sekrece inzulinu, hyperglykémie a diabetes. Tento stav se označuje jako diabetes mellitus spojený s cystickou fibrózou (CFRD; cystic fibrosis related diabetes).
Příčinou je postupný pokles funkce beta-buněk při destrukci tkáně pankreatu základním onemocněním.
Poruchu je třeba včas diagnostikovat a léčit inzulinem, protože katabolický stav při inzulinopénii přispívá ke zhoršování plicních funkcí a celkového stavu nemocných.
4. SEKUNDÁRNÍ DIABETES
Nejčastější příčinou sekundárního diabetu u dětí je steroidní diabetes při dlouhodobé léčbě farmakologickými dávkami kortikoidů, např. v rámci onkologických a hematoonkologických léčebných protokolů. V zájmu prevence katabolického stavu u postižených dětí je třeba jej léčit inzulinem. Steroidní diabetes je zpravidla přechodný a po skončení steroidní terapie ustupuje.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek Editorial
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2011 Číslo 1- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
-
Všetky články tohto čísla
- Chuť první cigarety: ovlivňuje vývoj kuřáckého chování?
- Poruchy kŕmenia v detskom veku
- Autoimunitní onemocnění jater v dětském věku – část II
- Editorial
- Diabetes mellitus
- Prof. MUDr. Jan Janda, CSc. – sedmdesátiletý, stále mladý
- Vybraná onemocnění červené krevní řady
- Očkování proti pneumokokům u dětí v ČR v letech 2010–2011
- Screening nutričního stavu při přijetí dětského pacienta k hospitalizaci
- Seznam čtenářů se správnou odpovědí na kontrolní otázky k doškolovacímu článku z č. 10/2010 Hamanová J., Csémy L.: Prenatální účinky alkoholu
- Výsledky pětileté činnosti dětské obezitologické ambulance Dětské polikliniky FN Motol a UK 2. LF, Praha
- Diskusia k článku „Hospitalizácie detí pre bronchiolitídu na Slovensku v rokoch 1996–2006”
- Postrehy z XXI. Izakovičovho memoriálu
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vybraná onemocnění červené krevní řady
- Poruchy kŕmenia v detskom veku
- Autoimunitní onemocnění jater v dětském věku – část II
- Diabetes mellitus
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



