-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diagnostika a terapie neurogenního měchýře u dětí
Diagnostics and therapy of neurogenic bladder in children
Neurogenic bladder in children is a serious dysfunction of lower urinary tract originating due to inborn or acquired disease of spinal cord and spinal nerves. It is a part of multiple defects and belongs to chronic pathological conditions, which is difficult to solve. The chief aim in the care of children with neurogenic bladder is to prevent infections and deterioration of the function of upper urinary tract as well as to reach urinary and fecal continence at the older age. In order to reach these goals, repeated examinations are required as well as lifelong follow-up and correctly timed therapy.
The basic examinations include, besides ultrasound, urodynamic studies and a clean intermittent catheterization of urinary bladder is the basic therapeutic procedure, if need be supplemented administration of anticholinergics. The recent knowledge of pediatricians and children urologists recommends the first urodynamic examination of patients with inborn defect, which is responsible for development of neurogenic bladder, as early as at the suckling age. The training of the clean intermittent catheterization is recommended differently, from the newborn to preschool age, but there is a general tendency to start with the catheterization much earlier than the practice was in the seventies to nineties. The early introduction of intermittent catheterization makes it an obvious constituent of everyday routine and it also significantly decreases the need of bladder augmentation at the older age. Even so a small part of patients which are refractory to conservative treatment the surgery becomes necessary. In most cases in is the augmentation urinary bladder, so called formation of low-pressure and large capacity urinary reservoir or a surgery resulting in improvement of incontinence. Some interventions, for instance the establishment of continent vesicostomy, may be indicated even to meet the patient’s wishes.Key words:
neurogenic bladder, urodynamic examination, clean intermittent catheterization, oxybutynin, bladder augmentation, incontinence, continent vesicotomy
Autori: J. Trachta; J. Kříž
Pôsobisko autorov: Klinika dětské chirurgie UK 2. LF a FN Motol, Subkatedra dětské chirurgie IPVZ, Praha přednosta prof. MUDr. J. Šnajdauf, CSc.
Vyšlo v časopise: Čes-slov Pediat 2012; 67 (6): 394-401.
Kategória: Přehledový článek
Súhrn
Neurogenní měchýř u dětí je závažná dysfunkce dolních močových cest, která vzniká v důsledku vrozeného nebo získaného onemocnění míchy a míšních nervů. Je součástí vícečetného postižení a patří mezi chronické, obtížně řešitelné patologické stavy. Hlavním cílem péče o děti s neurogenním měchýřem je jednak zabránit infekcím a deterioraci funkce horních cest močových a jednak dosažení kontinence moči a stolice v pozdějším věku. K dosažení těchto cílů je nutné opakované vyšetřování, celoživotní sledování a správně načasovaná terapie.
Základním vyšetřením je vedle ultrazvuku urodynamická studie a základním terapeutickým postupem čistá intermitentní katetrizace močového měchýře, event. doplněná podáváním anticholinergik. Podle posledních poznatků pediatrů a dětských urologů se doporučuje první urodynamické vyšetření pacientů s vrozenou vadou, která vede ke vzniku neurogenního měchýře, již v kojeneckém věku. Nácvik čisté intermitentní katetrizace je doporučován různě od novorozeneckého do předškolního věku, obecně je ovšem trend začít s katetrizací mnohem dříve, než bylo v sedmdesátých až devadesátých letech zvykem. Časné zavedení intermitentní katetrizace z ní jednak činí samozřejmou součást každodenní rutiny a jednak výrazně snižuje nutnost augmentace měchýře v pozdějším věku. I tak je ovšem u malé části pacientů refrakterních na konzervativní léčbu nutná operace. Nejčastěji jde o augmentaci močového měchýře, tzn. vytvoření nízkotlakého a velkokapacitního rezervoáru moči, a nebo o operace vedoucí ke zlepšení inkontinence. Některé výkony, například založení kontinentní vezikostomie, je možné indikovat i na přání pacienta.Klíčová slova:
neurogenní měchýř, urodynamické vyšetření, čistá intermitentní katetrizace, oxybutynin, augmentace měchýře, inkontinence, kontinentní vezikostomieÚVOD
Neurogenní měchýř (NM) vzniká v důsledku celé řady vrozených nebo získaných onemocnění, postihujících nervový systém. Nejčastější vrozenou vadou vedoucí k NM je meningomyelokéla, mezi nejčastější získané příčiny patří infekce CNS, míšní léze nádorové a traumatické nebo chirurgické výkony v malé pánvi. NM se projevuje dysfunkcí mikce, a to s převažující složkou retence nebo inkontinence. Právě neurologická příčina odlišuje NM od jiných dysfunkcí dolních močových cest, u nichž je příčina nejasná. NM vzniká v důsledku patologické inervace dvou nejdůležitějších funkčních jednotek dolních močových cest – detruzoru a svěračového komplexu uretry. Pro míru a typ dysfunkce je určující patologická hyper - nebo hypoaktivita těchto dvou jednotek a porucha jejich koordinace při mikčním aktu.
U dětí, na rozdíl od dospělých se získaným NM, pozorujeme dvě zásadní odlišnosti. Za prvé se dysfunkce neurogenního měchýře v čase vyvíjí a dětským pacientům, kteří nejsou pravidelně sledováni a vyšetřováni, hrozí trvalé poškození dolních a následně horních močových cest. Za druhé u dětí nekoreluje přesně výše a rozsah míšní léze s mírou postižení dolních močových cest. To jednak znamená, že není přesným pravidlem „vyšší míšní léze = těžší dysfunkce dolních močových cest“, i když je to pravděpodobné, a jednak, že u dvou dětí s podobnou výší a rozsahem míšní léze se může vyvinout jiný urodynamický obraz dysfunkce.
K monitorování změn dysfunkce je vhodné provádět opakované urodynamické studie a u pacientů s NM začít včas s čistou intermitentní katetrizací (ČIK) jako prevencí přestavby NM v rigidní nízkokapacitní, vysokotlakou veziku s vezikoureterálním refluxem a hrozícím renálním selháním. Při nedostatečném urodynamickém sledování a otálení se zavedením ČIK pacient často dospěje k nutnosti augmentace močového měchýře. Předkládaný článek je zamýšlen především jako teoretická studie shrnující nejnovější poznatky a možnosti v diagnostice a léčbě neurogenního měchýře, důraz je kladen na terapii konzervativní.
FYZIOLOGICKÉ POZNÁMKY
Pro pochopení dysfunkce NM je důležité zamyslet se nad několika anatomickým a funkčními poznámkami. Močový měchýř se formuje od 5. do 12. týdne embryonálního vývoje z urogenitálního sinu a je inervován vlákny sympatiku, parasympatiku a senzitivními zakončeními aferentních drah míšních nervů. Sympatikus inervuje hladkou svalovinu měchýře a proximální uretry přes α a β receptory, neuromediátorem přenosu je noradrenalin. Parasympatikus inervuje m. detruzor, čili tělo měchýře, přes M receptory a neuromediátorem je tu acetylcholin (odtud užití anticholinergik v léčbě). Bohatá senzitivní zakončení aferentních vláken míšních nervů se zakládají v mukóze a submukóze a vedou informaci o náplni měchýře k míše. Eferentní motorická vlákna z míšních segmentů S2 až S4 inervují cestou n. pudendus pouze zevní svěrač uretry a umožňují tak volní kontrolu mikce [1]. Samotný mikční akt je spouštěn a koordinován na více úrovních CNS (mikční centra ve frontální kůře, pontu a sakrální míše S2 až S4). Schopnost frontálního laloku plně kontrolovat pontinní mikční centrum je v prvních letech života otázkou vyzrávání nervových drah. K jejich plné koordinaci dochází až ve věku mezi 3. a 4. rokem [2].
Samotné dolní cesty močové jsou po většinu času – v plnící fázi měchýře – pod vlivem sympatiku. Stimulací sympatických β receptorů v těle a hrdle je hladká svalovina měchýře udržována v relaxovaném stavu. Stimulací sympatických α receptorů v hrdle a proximální uretře (vnitřní svěrač) je naopak udržován tonus této svaloviny a je tak zabezpečena kontinence. Při náplni měchýře, kdy dochází k prvnímu nutkání na močení, se zapojuje i volní mechanismus kontinence – n. pudendus inervující příčně pruhovaný m. sphincter urethrae externus a diaphragma urogenitale. Po naplnění funkční kapacity měchýře nastává evakuační fáze. Při ní hraje zásadní roli parasympatikus jednak kontrahující m. detrusor a jednak tlumící současně aktivitu sympatických α a β receptorů. Měchýř a uretra tak působí funkčně jako jeden koordinovaný celek [3]. Urodynamické vyšetření pacientů s NM může ukázat všechny možné kombinace hypo - a hyperaktivity detruzoru a svěračového komplexu, tak jak je to přehledně zobrazeno na obrázku 1. Podle urodynamického nálezu se také pacienti s NM klasifikují a následně léčí. Jaký obraz u jaké neurogenní léze se u daného pacienta vyvine, nelze předvídat, i když některé typy lézí jsou spojené s jedním převažujícím typem dysfunkce [4].
Obr. 1. Klasifikace urodynamických nálezů u neurogenního měchýře podle Madersbachera. 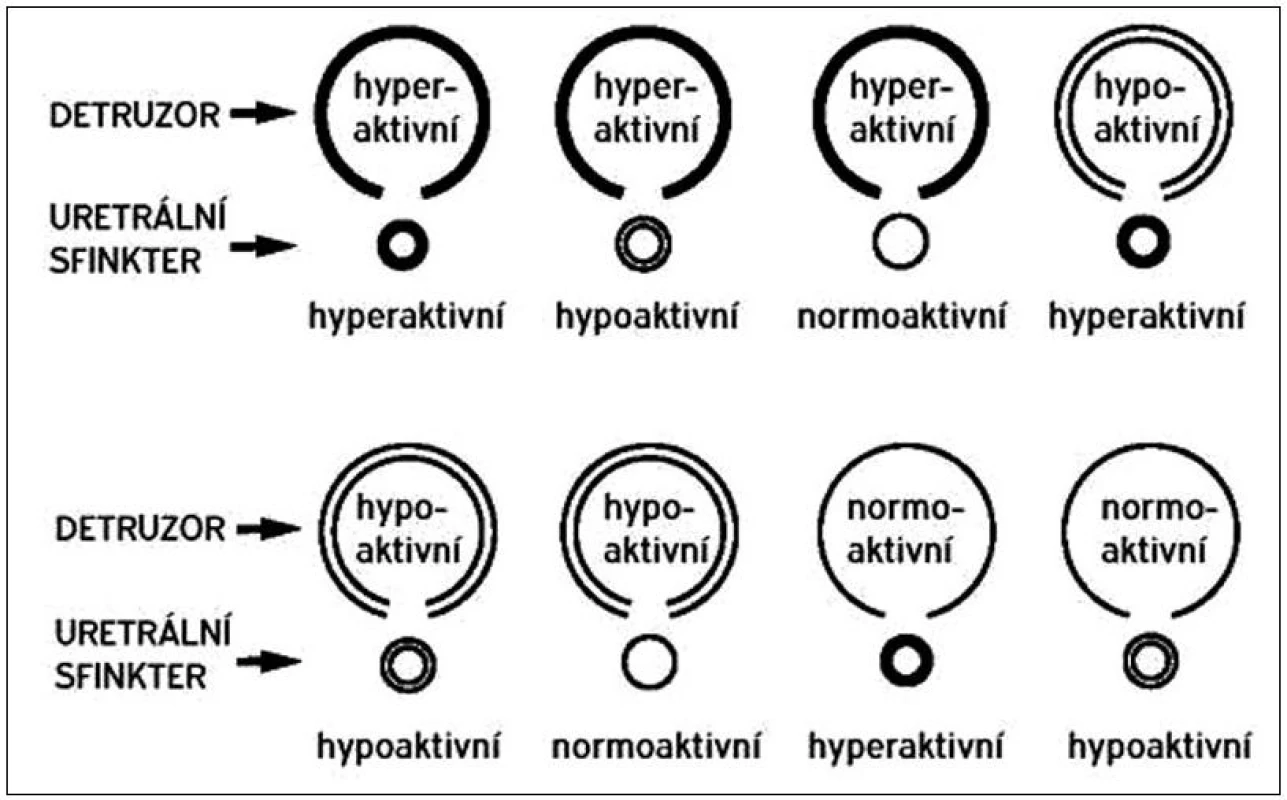
ETIOLOGIE
Neurologická onemocnění, která mohou vést ke vzniku NM, jsou shrnuta v tabulce 1. Nejčastější vrozenou příčinou NM je meningomyelokéla, která patří do skupiny vrozených rozštěpových vad páteře a míchy – spina bifida, a to mezi defekty nekryté, tzv. spina bifida aperta, resp. cystica. Jde o herniaci obalů a rozštěpené části míchy nebo kaudy equiny skrze nespojené obratlové oblouky jakékoliv části páteře, nejčastěji ovšem páteře lumbosakrální (75 %) – viz obrázek 2.
Tab. 1. Příčiny vzniku neurogenního měchýře. 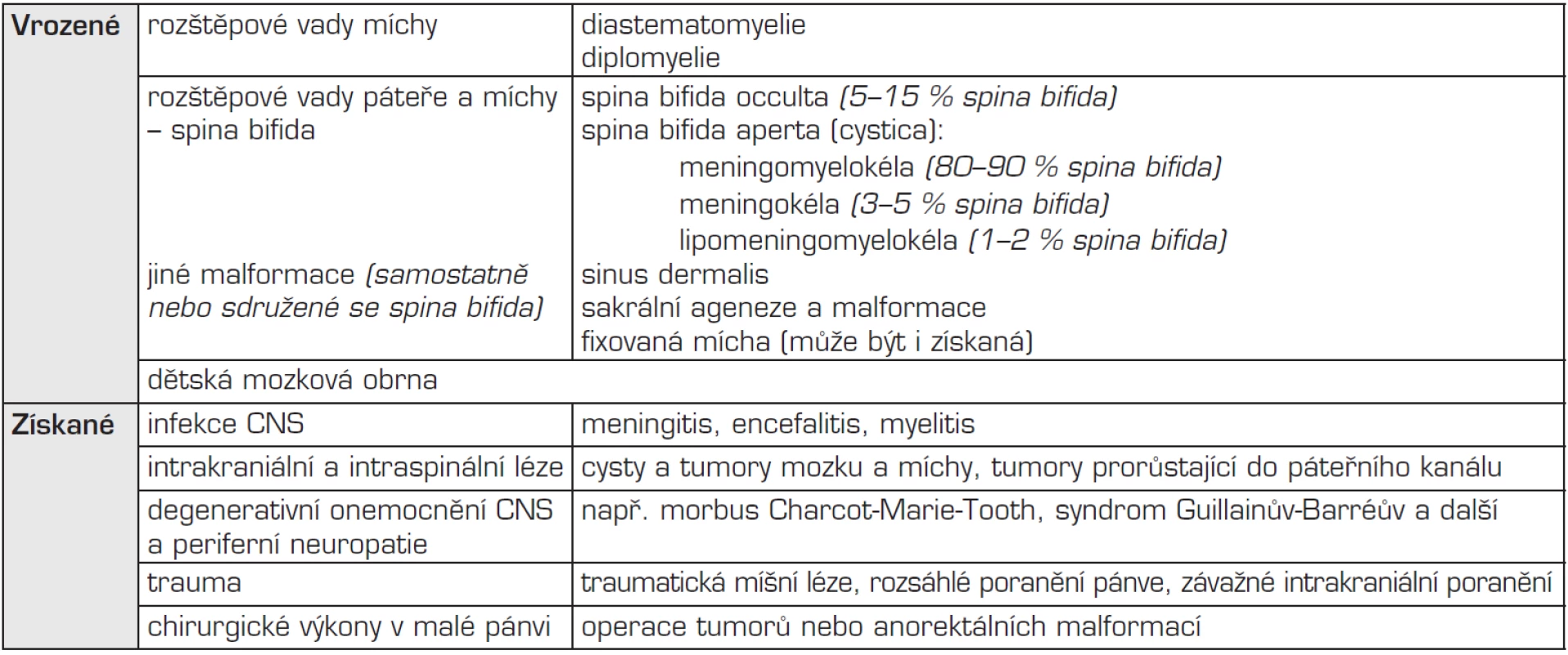
Obr. 2. Meningomyelokéla před operací. Fig. 2. Meningomyelocele before surgery. 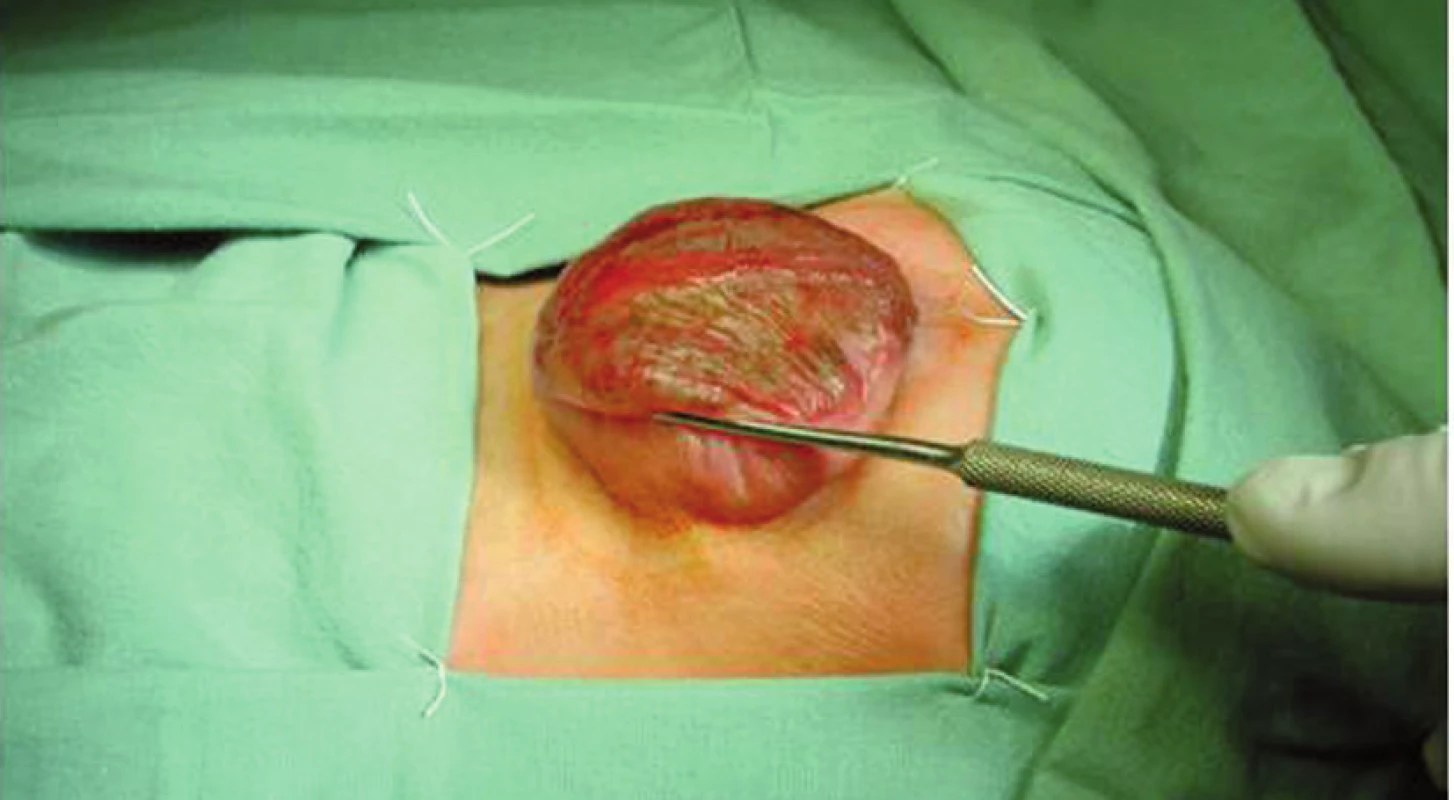
U 80 % pacientů se sdružuje s protruzí mozečkových tonzil do foramen magnum a následným obstrukčním hydrocefalem, vyžadujícím zkratovou operaci (ventrikuloperitoneální shunt) – syndrom Chiari II [5]. Vzhledem ke zlepšující se prenatální diagnostice je stále více těhotenství pro tuto vadu ukončeno předčasně. V průběhu deseti let od roku 1998 do roku 2008 bylo v ČR prenatálně diagnostikováno 25 plodů se spina bifida ročně a narodilo se jich v průměru 13 ročně [6]. Meningokéla tvoří 80 až 90 % vad spina bifida a u naprosté většiny dětí se vyvine NM. Prognóza zůstává přes veškerou odbornou péči vážná, před dosažením dospělosti a během ní zemře 10 až 25 % těchto pacientů v důsledku plicních, urologických a neurochirurgických komplikací [7]. U dětí po operaci meningomyelokély je třeba v průběhu sledování myslet na riziko vzniku fixované míchy (obr. 3), která se manifestuje progredující poruchou sfinkterů, různě vyjádřenou parézou dolních končetin a změnou ve šlachových reflexech. Nezbytnou terapií je neurochirurgické uvolnění fixovaného conus medullaris. Předoperačně se vyšetřuje EMG a evokované potenciály na dolních končetinách – jejich zhoršení předchází manifestní paréze.
Obr. 3. Jizva po operaci meningomyelokély u čtyřleté pacientky – riziko vzniku fixované míchy. Fig. 3. Cicatrice after operation on meningomyelocele in a four-year girl – the risk of origin of fixed spinal cord. 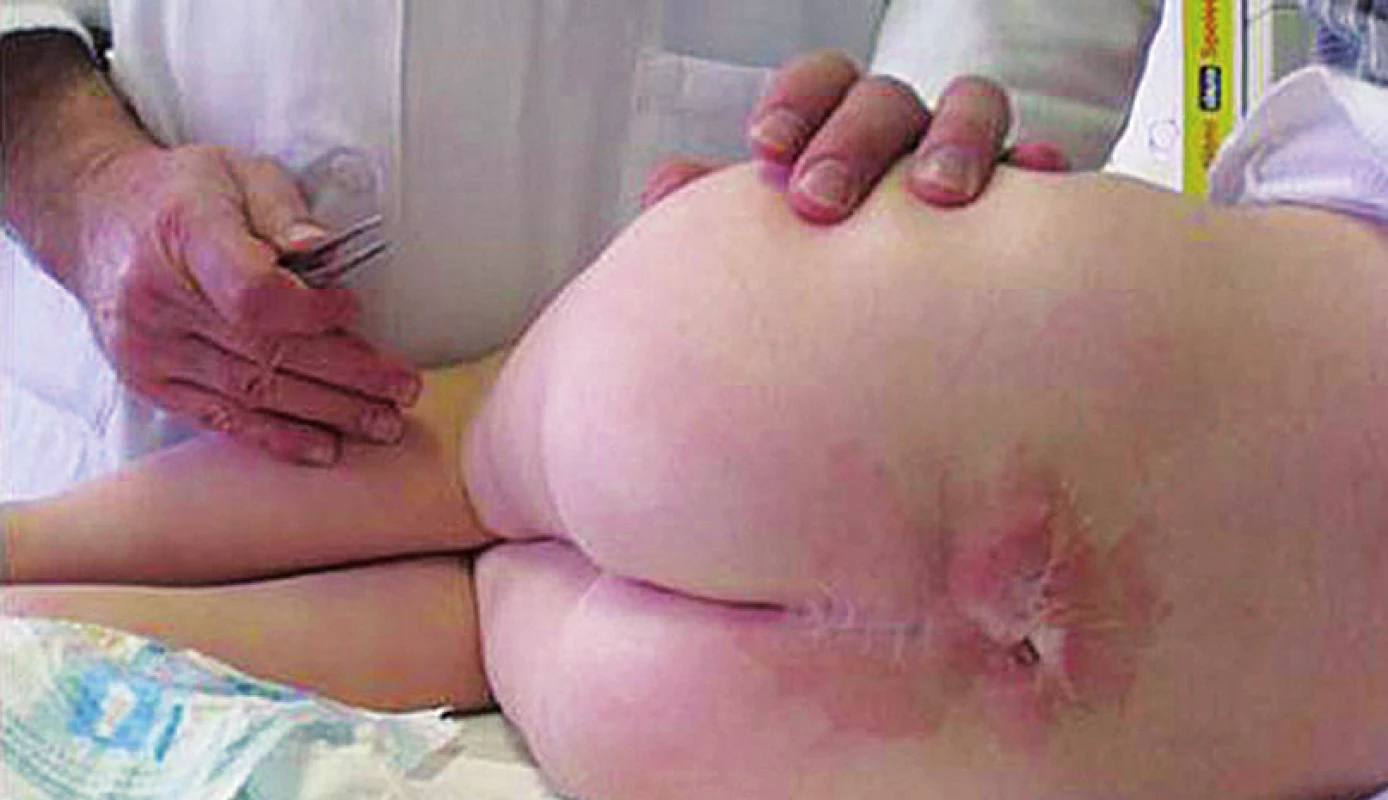
DIAGNOSTIKA
Jak a kdy pacienty s NM vyšetřovat? Narodí-li se novorozenec s meningomyelokélou, je po vyšetření neonatologem, neurologem, ultrazvukem a magnetickou rezonancí indikován k neurochirurgickému uzávěru defektu během prvních 48 hodin života. Urodynamické vyšetření u dětí po operaci meningomyelokély je zcela zásadní a mělo by být provedeno kolem 3. měsíce věku [8, 9]. Někteří dětští nefrologové a urologové dokonce provádějí první urodynamickou studii již v 6. týdnu života, ale vzhledem k tomu, že se jednak urodynamický obraz po operaci meningomyelokély může v průběhu prvních dvou měsíců dramaticky změnit (možná změna hypotonického nebo atonického pánevního dna a zevního svěrače na hypertonické [9]) a stejně tak v tomto období nastává první akcelerace růstu kapacity měchýře, zdá se nám jako nejvhodnější věk k vyšetření právě 3. měsíc. U starších dětí je vhodné provést urodynamickou studii, jakmile je poprvé vysloveno podezření na NM [10, 11]. Co zahrnuje komplexní vyšetření pacienta s NM, zachycuje tabulka 2, v praxi modifikována s ohledem na věk dítěte.
Tab. 2. Vyšetření pacienta s neurogenním měchýřem. 
První urodynamickou studii provádíme nejlépe s elektromyografií pánevního dna. Získáme tak informaci o svalové aktivitě pánevního dna a zevního svěrače uretry. Při plnící cystometrii sledujeme maximální kapacitu měchýře, intraabdominální tlak, intravezikální tlak během plnící fáze, intravezikální tlak při prvním úniku moči (angl. leak-point pressure) a přítomnost neinhibovaných kontrakcí detruzoru. Mikční cystometrie nás informuje o intra-vezikálním tlaku v průběhu močení a o stupni koordinace detruzoru a svěračového komplexu. U dětí starších 4 let připojujeme i opakovanou uroflowmetrii. Za rizikovou patologickou hodnotu intravezikálního tlaku ke konci plnění považujeme 30 cm vodního sloupce [4].
Patologická hodnota maximální kapacity měchýře je odvozena z odhadu fyziologické kapacity, kterou lze u starších dětí odhadnout podle vzorce:
30 + 30 × věk dítěte v letech = kapacita v ml
U novorozenců a kojenců uvedený vzorec nepostačuje a ke správnému odhadu je třeba vědět, že maximální kapacita měchýře nenarůstá lineárně. Její zvětšování probíhá ve dvou akcelerovaných skocích. První nastává v prvních 3 měsících života (ve švédské studii v průměru z 12 na 52 ml), druhý v průběhu 3. roku (z 68 na 123 ml) [12]. Od počátku 2. do počátku 3. roku naroste kapacita v průměru pouze o jediný mililitr (v průměru z 67 na 68 ml). Arbitrární hranicí, kterou si švédští autoři stanovili pro patologicky malou kapacitu MM, je méně než 65 % maximální kapacity odpovídající věku a jako patologicky velkou více než 150 % obvyklé maximální kapacity. Fyziologické maximální kapacitě odpovídá ranní porce moči nebo maximální náplň při cystometrii, zatímco přes den se spouští mikční akt i při signifikantně menší náplni a mluvíme o mikčním objemu.
Novorozenci a kojenci se nevyprazdňují s každou porcí moči beze zbytku, ale v průměru 1krát za 4 hodiny k jednomu úplnému vyprázdnění dojde. Obvyklé fyziologické reziduum v této věkové kategorii je 4 až 5 ml po většině dokončených mikcí. Situace se opět změní v průběhu 3. roku, kdy se děti začnou vyprazdňovat s každou mikcí s nulovým reziduem. Při sledování mikce pacientů se suspektní dysfunkcí dolních močových cest u novorozenců, kojenců, batolat a inkontinentních pacientů vážíme pleny, u starších dětí zakládáme mikční kartu, kde zaznamenáváme čas a objem mikce, p.o. příjem tekutin a potravin. Ideálně rodiče pacienta zaznamenávají do mikční karty i defekaci, protože dysfunkce mikce a defekace bývají často sdruženy (obvykle mají pacienti současně zácpu). Zhoršování úniku moči u inkontinentních nebo částečně kontinentních pacientů může znamenat nediagnostikovaný nebo v důsledku jizvení se tvořící syndrom fixované míchy [11, 12].
Nejčastějším a také nejzávažnějším urodynamickým nálezem, který ohrožuje pacienta rychlou deteriorací funkce horních močových cest a následným renálním selháním, je kombinace hyperaktivního detruzoru a hyperaktivního sfinkteru – tzv. detruzorosfinkterická dyssynergie (DSD). DSD má cca 50 % dětí se spina bifida aperta (cystica) a 25 % dětí se spina bifida occulta [9]. Hyperaktivní detruzor tlačí moč přes uzavřený sfinkter, čímž dochází ke zvýšení intravezikálního tlaku na patologické hodnoty nad 30 cm vodního sloupce, progredujícímu vezikoureterálnímu refluxu (VUR), intrarenálnímu refluxu, poškození parenchymu a renálnímu selhání (obr. 4).
Obr. 4. Fyziologický mikční akt a detruzorosfinkterická dyssynergie (DSD). Fig. 4. Physiological miction act and detrusor sphincter dyssynergia (DSD). 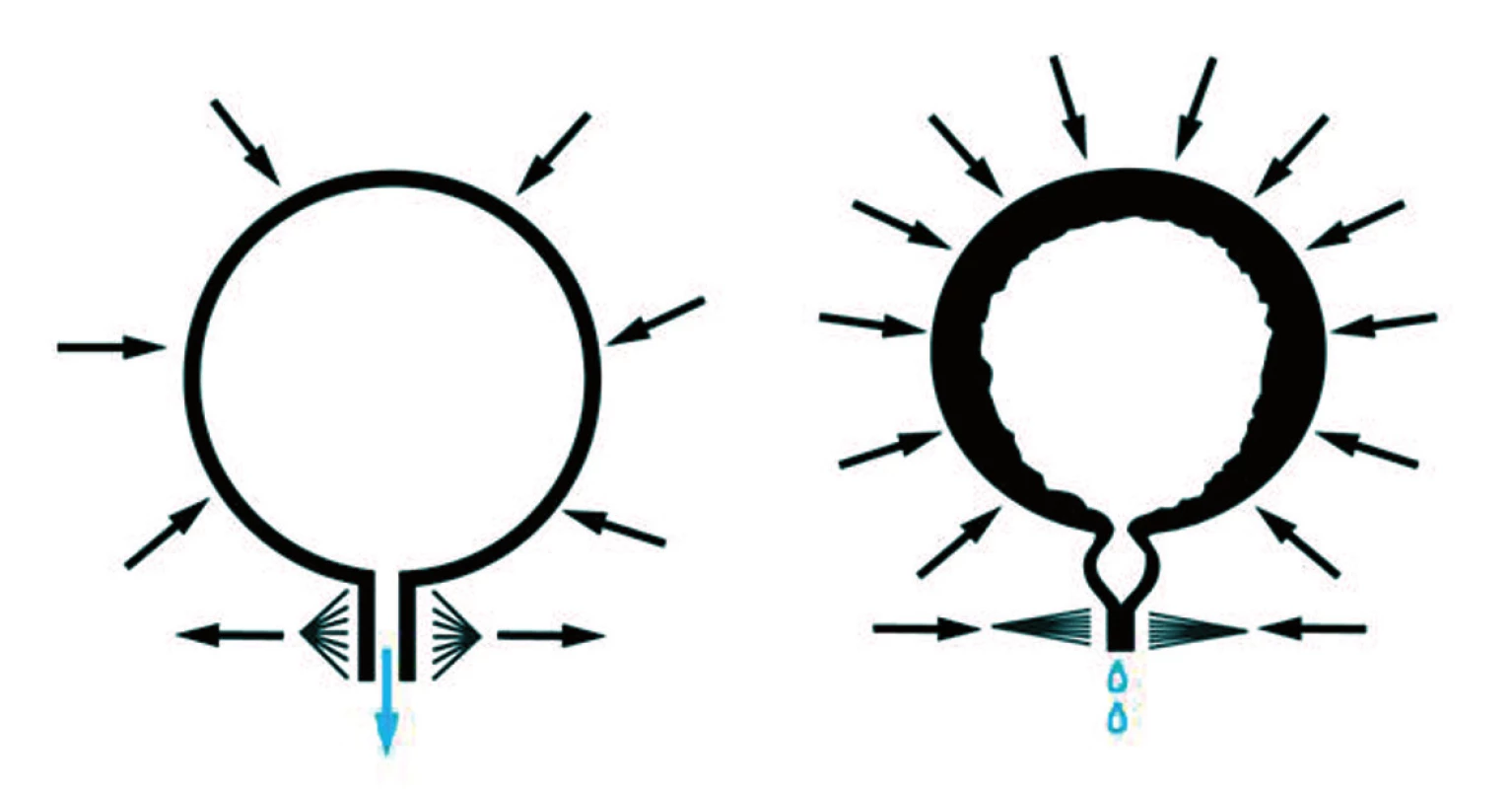
Celá situace je zhoršována vysokým rizikem infekce močového rezidua. Dlouhodobá DSD vede k přestavbě stěny močového měchýře, dochází k jeho fibrotizaci a tedy snížení compliance, kontraktility a kapacity. Výsledkem je po delší době kraniokaudálně protáhlý – vertikalizovaný, trabekulizovaný, téměř nefunkční měchýř, event. s divertikly sliznice, zobrazující se při MCG jako zasněžený vánoční stromek (obr. 5).
Obr. 5. Vertikalizovaný, trabekulizovaný NM u osmiletého pacienta s DSD. Fig. 5. Vertizalized, trabeculized NM in an eight-year boy with DSD. 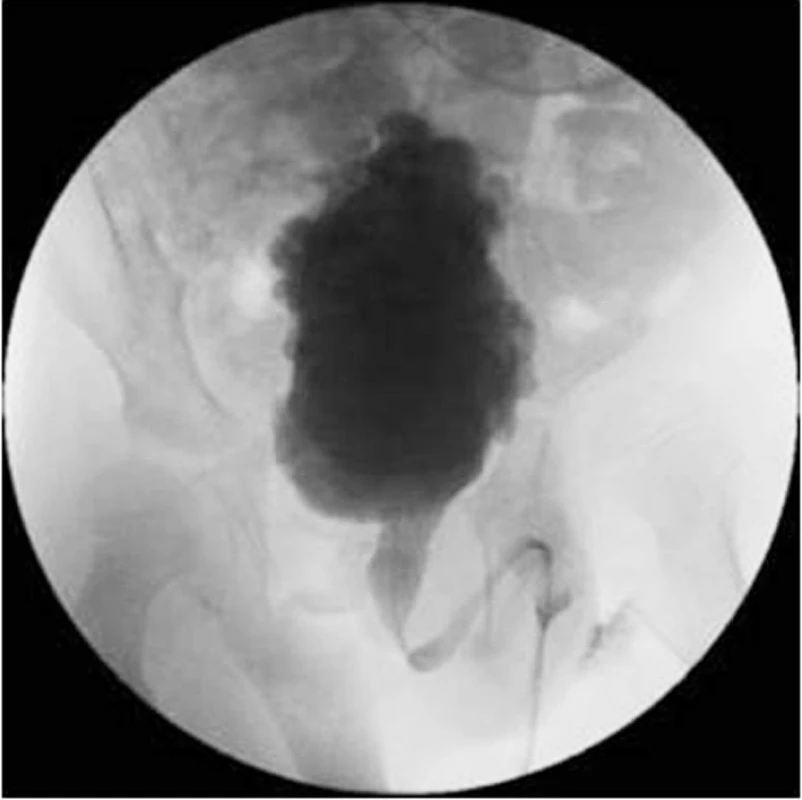
Zevní sfinkter se stane trvale spastickým. Bez léčby k takto poškozenému měchýři dospělo před zavedením ČIK a anticholinergik přes 70 % dětí s DSD, spontánní zlepšení nebylo nikdy pozorováno [13]. Klasické urodynamické vyšetření je možné kombinovat se skiaskopií v tzv. videourodynamické vyšetření. Měchýř a uretra se plní nikoli fyziologickým roztokem, ale kontrastní látkou a sleduje se jejich tvar a chování během plnící a vylučovací fáze. Lze tak znázornit i VUR stejně dobře jako při MCG nebo hypertonický sfinkter a DSD.
TERAPIE
Základním konzervativním léčebným postupem u pacientů s NM je ČIK. Většina pacientů s NM se nedokáže spontánně vyprázdnit. Zavedení ČIK bylo zcela zásadním předělem v jejich celoživotní léčbě. V roce 1972 zavedl Lapides užívání čistých, ale nesterilních katétrů přes kritiku svých kolegů u všech svých dospělých pacientů a zjistil, že výskyt infekcí močových cest se tak nezvýšil. U nás ČIK poprvé popsal Hanuš v roce 1983 [14]. Původní gumové cévky byly postupně nahrazeny silikonovými na jedno použití, které se musejí potírat lubrikačním gelem. V posledních letech se rozšiřují prelubrikované cévky na jedno použití, které jsou obaleny hydrofilním polymerem a krystalky NaCl a mají stejnou osmolaritu jako buňky urotelu.
Celosvětově se změnil i přístup v otázce, kdy s ČIK u pacientů s neurogenním měchýřem začít. Z pouhého neurologického vyšetření perinea a sfinkterových reflexů lze usoudit na aktivitu pánevního dna a zevního svěrače uretry. U všech novorozenců s hyperaktivitou zevního svěrače by měla být zavedena ČIK 8F nebo 6F katétry ihned. Po prvním urodynamickém vyšetření a potvrzení hyperaktivity detruzoru a DSD je vhodné nasadit anticholinergika (oxybutynin). De Jong et al. doporučují nejen nasazení oxybutyninu, ale současně profylaktické podávání trimethoprimu v dávce 2 mg/kg a den paušálně u všech novorozenců po uzávěru spina bifida a zavedení ČIK, a to po dobu minimálně prvního roku věku [15]. Inkontinentní pacienti s insuficientním sfinkterem se sice mohou po narození začít vyprazdňovat pouhým tlakem na podbřišek (Credého manévr), ale jestliže je po 5. roce věku čeká operace zlepšující kontinenci s nutnou ČIK buď uretrou nebo skrze kontinentní stoma, je pro předškolní a starší děti velmi traumatizující učit se autokatetrizaci a zvyknout si na její nutnost každé 3 hodiny. Pacienti s DSD by se Credého manévrem vyprazdňovat vůbec neměli, dochází tak k poškozování horních močových cest a infekcím močového rezidua. Z těchto důvodů doporučuje i ESPU (European Society for Paediatric Urology) začít s ČIK již po narození u všech pacientů s NM bez rozdílu po 3 hodinách, u dětí bez DSD event. alespoň 2krát denně a zbylé vyprázdnění realizovat Credého manévrem, aby si jak rodiče, tak pacient osvojili a udrželi návyk na ČIK [9, 11].
Komplikace ČIK jsou mnohem častější u chlapců a patří mezi ně občasná hematurie, která obvykle spontánně odezní, striktura uretry, prostatitida nebo epididymitida. Výskyt infekce močových cest ČIK prokazatelně snižuje, ale minimálně u poloviny pravidelně sledovaných pacientů bývá asymptomatická bakteriurie. Pacienti bez VUR, kteří se dokážou katétrem vyprázdnit beze zbytku, profylaktickou léčbu nevyžadují. Jestliže rodiče nebo pacient hlásí moč silně zapáchající nebo zkalenou, lze doporučit zvýšení příjmu tekutin p.o., častější katetrizaci a aplikaci antibiotik na 7 dní (nitrofurantoin nebo ciprofloxacin, event. amoxicillin + gentamicin i.v. až do výsledků kultivace a citlivosti). Jestliže se taková epizoda vyskytuje častěji než 3krát za rok, je třeba pacienta podrobně přešetřit (UZ, MCG, urodynamika, uretrocystoskopie) a probrat s rodiči detailně všechny technické aspekty domácího cévkování. Přítomnost horeček, lumbalgie, známek pyelonefritidy na UZ nebo nemožnost katetrizace vyžaduje přijetí na lůžko. Přes možné komplikace ovšem stále platí, že ČIK ovlivnila zásadním způsobem léčbu pacientů s neurogenním měchýřem, což dokládá například fakt, že u pacientů s DSD snížila ČIK spolu s podáváním anticholinergik nutnost augmentace měchýře z 90 na 5 % [9].
U dětí s NM je převážně užívaným anticholinergikem oxybutynin. Má selektivní afinitu k receptorům M3 a M1 a velmi dobré myorelaxační a částečně anestetické účinky na hladkou svalovinu. Bohužel jedna třetina pacientů trpí dříve nebo později vedlejšími účinky, převážně suchostí v ústech, zácpou a nesnášenlivostí tepla. Jestliže jeho metabolit N-desethyl-oxybutynin přestoupí hematoencefalickou bariéru, mohou se po čase objevit i změny chování a osobnosti. Publikovány byly případy dětí s NM, kterým se po vysazení léčby oxybutyninem významně zlepšily školní výsledky [16]. Ke zmenšení nežádoucích účinků se doporučuje podávání oxybutyninu v tabletách p.o. s retardovaným uvolňováním účinné látky, nebo intravezikálně zavedeným katétrem při ČIK v dávce 0,1–0,15 mg/kg/dávku 2krát denně po rozpuštění 5mg tablety ve 30 ml fyziologického roztoku, event. ve formě určené k transdermální aplikaci 1krát denně. Dalšími anticholinergiky užívanými v poslední době v některých zemích u dětí jsou tolterodine nebo solifenacin, které mají mít nižší vedlejší účinky. Podávání alfa mimetik ke zvýšení suficience hrdla měchýře se u inkontinentních dětí s neurogenním měchýřem neosvědčilo, stejně tak jako podávání beta mimetik při hyperaktivním detruzoru [16].
Jestliže pacient špatně odpovídá nebo snáší léčbu anticholinergiky, existuje varianta v léčbě hyperaktivního detruzoru v podobě intravezikálních injekcí botulotoxinu A. Botulotoxin A se injikuje pod cystoskopickou kontrolou mezi vlákna detruzoru do 20 až 30 míst celé stěny měchýře v dávce 5 až 10 IU/kg hmotnosti pacienta (do max. celkové dávky 300 IU), neopichuje se pouze svalovina trigona a hrdla, neboť tak hrozí vznik VUR, respektive insuficience vnitřního svěrače. Takto injikovaný botulotoxin zvyšuje compliance detruzoru a snižuje intravezikální tlak. Léčba botulotoxinem má sice pouze dočasný efekt přetrvávající maximálně 6 až 9 měsíců, ale zdá se, že ji lze opakovat bez poškození svaloviny detruzoru a negativního dopadu na compliance měchýře několikrát po sobě. Pro její celoživotní využití chybí dostatek klinických studií, v současné době je brána jako druhá volba při selhání léčby ČIK a anticholinergiky [17].
Na hranici mezi léčbou konzervativní a léčbou chirurgickou je tzv. stimulace sakrálního nervu (též sakrální neuromodulace), která je známá a studovaná již od šedesátých let, používá se úspěšně u dospělých a poslední desetiletí je opatrně zaváděna i u dětí. Jde o malý chirurgický výkon – zavedení stimulační elektrody do foramen sacrale ke kořeni nervu S3 a neurostimulátoru do podkoží. Neurostimulátor, který připomíná tvarem i funkcí kardiostimulátor, generuje impulzy a je ho možné v případě selhání léčby nebo technických komplikací bez větších následků odstranit. Stimulace sakrálního nervu vede v případě úspěšné léčby ke zlepšení kontinence nejen močové, ale i fekální [18].
Po vyčerpání možností konzervativní terapie pacientů s neurogenním měchýřem, u nichž progreduje dysfunkce močových cest a hrozí přerůst v renální selhání nebo kteří trpí osobně či sociálně nepřijatelnou inkontinencí, nezbývá než přistoupit k chirurgické léčbě. Operace lze rozdělit do dvou velkých skupin, podle dvou základních cílů terapie neurogenního měchýře – operace vedoucí k posílení kontinentního mechanismu a operace směřující k vytvoření nízkotlakého a vysokokapacitního rezervoáru moči, tzn. augmentace měchýře. Obě kategorie výkonů mohou být sdruženy v jedné nebo ve dvou dobách. Každá operace kontinentního mechanismu hrozí následně obtížnou nebo nemožnou ČIK uretrou, proto velká část urologů zakládá současně katetrizovatelné kontinentní stoma vytvořené z apendixu (apendikovezikostomie podle Mitrofanoffa) nebo z ileálního segmentu na cévní stopce (ileální konduit podle Montiho). Stoma lze založit na augmentovaném nebo objemném hypotonickém měchýři a jeho kutánní konec vyvést pupkem, event. v podbřišku. Takovým stomatem pak může pacient upoutaný na vozík nebo trpící skoliózou provádět pravidelnou ČIK snadněji. Operace NM lze provést v jakémkoliv věku. Operace na hrdle měchýře vedoucí k úpravě kontinence lze doporučit kolem 5. roku a augmentace v období puberty a po ní [15].
Mezi nejjednodušší výkony posilující kontinenci pacientů s NM patří endoskopická instilace volumexpanzivní látky (např. Urodex) do hrdla měchýře. Nevýhodou jsou proměnlivé výsledky a omezená indikace. Indikujeme pouze pacienty s dobrým intravezikálním tlakem a compliance měchýře, u nichž je zachována alespoň částečná aktivita vnitřního a zevního svěrače. Princip závěsných operací hrdla spočívá v provlečení pruhu fascie uvolněné z m. rectus abdominis (umělé materiály se u dětí neosvědčily) pod hrdlo měchýře a jeho ukotvení k symfýze, čímž vzniká smyčka „přiškrcující“ hrdlo a proximální uretru. Složitější operace kontinentního mechanismu jsou zatíženy větším množstvím komplikací, častými reoperacemi, následnými obtížemi s ČIK a nutností připojit augmentaci měchýře. Jde o rekonstrukční výkony na hrdle měchýře a o implantace umělých sfinkterů [19].
Nejčastějším operačním výkonem u pacientů s NM zůstává augmentace močového měchýře. Používáme exkludovaný úsek terminálního ilea, sigmoidea, u pacientů s chronickým renálním selháním event. i část žaludku. Ačkoliv je augmentace měchýře střevem dlouho známá operace, teprve rutinní zavedení ČIK v sedmdesátých letech znamenalo efektivní způsob, jak malfunkční měchýř pravidelně vyprazdňovat. Augmentace má celou řadu dlouhodobých komplikací. V důsledku nefyziologického kontaktu střevní sliznice části ilea nebo sigmoidea s močí dochází v různé míře k metabolickým změnám v celém organismu. Jde především o hyperchloremickou metabolickou acidózu způsobenou nadměrnou resorpcí amoniových, chloridových a vodíkových iontů z moči zpět do oběhu, dále reabsorpce vody a sodíku a vylučování draslíku a bikarbonátu střevní sliznicí. Vážnějšími komplikacemi jsou produkce hlenu střevní sliznicí a tvorba kamenů nejen v měchýři, ale i v dutém systému ledvin. Výskyt závažných močových infekcí (akutních pyelonefritid) u pacientů s augmentovaným měchýřem je významně nižší ve srovnání se stavem před operací. ATB léčbu vyžadují pouze infekce symptomatické. Vážnou komplikací je perforace neoveziky, k níž dochází v průměru u 5 až 10 % pacientů [20, 21]. Riziko vzniku malignity není přesně známo, etiologicky hrají nejspíš roli chronické záněty a karcinogenní látky v moči, zejména nitrosaminy produkované gramnegativními bakteriemi a růstové faktory. Naopak žádnou roli pravděpodobně nehraje k plastice zvolený úsek trávicího traktu. Nejčastějším typem maligního tumoru v dospělém věku je adenokarcinom, různé studie uvádějí prevalenci od 1,2 do 4,5 % [22]. Vhodné je proto sledovat pacienty s augmentovaným měchýřem i cystoskopicky. A konečně stále narůstající komplikací je v době rozšiřování latexových pomůcek ve zdravotnictví alergie na latex [23].
Vedle muskuloskeletálních deformit, jejichž léčba a sledování patří do rukou ortopeda, trápí pacienty s NM i porucha defekace. Téměř všichni trpí zácpou v důsledku poruchy inervace tlustého střeva, která je dále zhoršována podáváním anticholinergik. Konzervativní opatření, která lze pacientovi a jeho rodině navrhnout, se liší podle úpornosti zácpy. Hlavní problém spočívá v tom, že cokoli změkčí stolici a zmenší zácpu, paradoxně zvýší její nežádoucí únik. Lze podávat retrográdní klyzmata zakoupeným setem nebo stolici mechanicky vybavit pomocí velkého katétru s nafukovacím balonkem na konci. Jinou variantou, preferovanou staršími pacienty, je antegrádní klyzma kontinentní cékostomií vyšitou v pravém hypogastriu nebo sigmoideostomií v levém hypogastriu [24]. K dlouhodobým následkům u pacientů s neurologickým deficitem, mezi něž nemocní s NM patří, jsou i poruchy sexuálních funkcí. Řada psychologických studií posledních 20 let prokázala, že většina těchto dětí řeší sexuální otázky stejně jako jejich vrstevníci a většina by chtěla mít jednoho dne rodinu. Pro pacienta je zcela zásadní, aby lékař tyto otázky neignoroval, zodpověděl je rodině alespoň z medicínského pohledu a snažil se doporučit v této problematice erudovaného psychologa nebo sexuologa [25].
ZÁVĚR
Závěrem by bylo ideální navrhnout jasný algoritmus diagnostického a terapeutického postupu u pacientů s NM. Vzhledem k rozmanitosti neurologických příčin, neurologického postižení a jeho proměnlivosti během vývoje dětského pacienta takový algoritmus neexistuje, nicméně stále více pracovišť po celém světě respektuje tendenci převádět všechny děti s NM na ČIK již od novorozeneckého věku, první urodynamickou studii provést ve věku kojeneckém a dále pak pravidelně v rámci sledování jednou za rok nebo za dva roky až do dosažení puberty, kdy frekvence vyšetřování klesá podle stavu pacienta.
Neurologický deficit vedoucí k NM je celoživotní břemeno jak pro pacienta, tak jeho rodinu. Diagnostika, terapie a sledování těchto pacientů vyžaduje dobrou spolupráci celé řady pediatrických odborníků a trpělivý a motivující přístup, který pacientům dává šanci prožít smysluplný život.
Článek vznikl s podporou VZ MZO 00064203/6310.
Došlo: 1. 12. 2011
Přijato: 9. 8. 2012
MUDr. Jan Trachta
Parléřova 11
169 00 Praha 6
e-mail: honzatrachta@hotmail.com
Zdroje
1. Mrázková O. Orgány močového ústrojí. In: Dylevský I, Druga R, Mrázková O. Funkční anatomie člověka. Praha: Grada, 2000 : 361–381.
2. Raymond R, Sandip PV, Farzeen F. Neurogenic bladder. eMedicine 2009: http://emedicine.medscape.com/article/453539-overview.
3. MacLellan LD, Bauer SB. Phy-siology of the lower urinary tract. In: Esposito C, Guys JM, Gough D, et al. Pediatric Neurogenic Bladder Dysfunction. Springer, 2006 : 13–20.
4. Cerruto MA, Artibani W. Urodynamics. In: Esposito C, Guys JM, Gough D, et al. Pediatric Neurogenic Bladder Dysfunction. Springer, 2006 : 133–146.
5. Tichý M. Neurochirurgie. In: Šnajdauf J, Škába R, et al. Dětská chirurgie. Praha: Galén, 2005 : 87–117.
6. Gregor V, Šípek A, Horáček J, et al. Prenatální diagnostika vrozených vad v České republice – aktuální data. Prakt Lék 2011; 91 (2): 85–90.
7. Lee H, Albanese CT. Fetal surgery for myelomeningocele. In: Esposito C, Guys JM, Gough D, et al. Pediatric Neurogenic Bladder Dysfunction. Springer, 2006 : 285–287.
8. Stein R, Weisner Ch, Beetz R, et al. Urinary diversion in children and adolescents wit In: European Society of Paediatric Urology, Update on Paediatric Urology. Madrid, 2009 : 113–123.
10. Aigrain Y, El Ghoneimi A. Neurogenic bladder. In: Puri P, et al. Pediatric Surgery. Springer, 2009 : 881–889.
11. Tekgül S, Riedmiller H, Gerharz E, et al. Managment of neurogenic bladder in children. In: European Society for Paediatric Urology, Guidelines on Paediatric Urology, 2009 : 31–41.
12. Sillén U, Abrahamsson K. The voiding diary. In: Esposito C, Guys JM, Gough D, et al. Pediatric Neurogenic Bladder Dysfunction. Springer, 2006 : 109–116.
13. Favazza TF, Koo HP. Myelodysplasia and neurogenic bladder dysfunction. eMedicine 2010: http://emedicine.medscape.com/article/1015695-overview.
14. Hanuš T. Intermitentní katetrizace močového měchýře. Čas Lék čes 1983; 122 (37): 1135–1137.
15. De Jong TPV, Chrzan R, Klijn AJ, et al. Treatment of the neurogenic bladder in spina bifida. Pediatr Nephrol 2008; 23 (6): 889–896 (http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2335291/?tool=pubmed).
16. Pereira PL, Urrutia MJM, Jaureguizar E. Pharmacological therapy in neuropathic bladder. In: Esposito C, Guys JM, Gough D, et al. Pediatric Neurogenic Bladder Dysfunction. Springer, 2006 : 169–183.
17. Schurch B, Karsenty G, Corcos J. Botulinum toxin injections to treat neurogenic bladder – sphincter dysfunction in pediatric patients. In: Esposito C, Guys JM, Gough D, et al. Pediatric Neurogenic Bladder Dysfunction. Springer, 2006 : 199–202.
18. Signorelli F, Lavano A, Volpentesta G. Neurosurgical treatment of neurogenic bladder dysfunction. In: Esposito C, Guys JM, Gough D, et al. Pediatric Neurogenic Bladder Dysfunction. Springer, 2006 : 271–276.
19. Dvořáček J, et al. Augmentace močového měchýře. Urologie 2006; III: 1611–1629.
20. Pereira PL. Bladder augmentation. In: European Society of Paediatric Urology, Update on Paediatric Urology. Madrid, 2009 : 123–127.
21. Landau EH, Jayanthi VR, Khoury AE, et al. Bladder augmentation: ureterocystoplasty versus ileocystoplasty. J Urol 1994; 152 (2Pt2): 716–719.
22. Esposito C, De Fazio C, Svanelli A. Neurogenic bladder dysfunction: A condition at increased risk of bladder malignancy? In: Esposito C, Guys JM, Gough D, et al. Pediatric Neurogenic Bladder Dysfunction. Springer, 2006 : 305–309.
23. Esposito C, Savanelli C, Leggio S, et al. Latex allergy in children with spina bifida. In: Esposito C, Guys JM, Gough D, et al. Pediatric Neurogenic Bladder Dysfunction. Springer, 2006 : 329–339.
24. Liard A, Elbaz F, Bachy B. Managment of constipation in neurogenic bladder dysfunction. In: Esposito C, Guys JM, Gough D, et al. Pediatric Neurogenic Bladder Dysfunction. Springer, 2006 : 257–262.
25. Farrant B, Sawyer SM. Sexuality in young people with neurogenic bladder dysfunction. In: Esposito C, Guys JM, Gough D, et al. Pediatric Neurogenic Bladder Dysfunction. Springer, 2006 : 317–323.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek Obsah a věcný rejstříkČlánek Takzvaně problémový pacient
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2012 Číslo 6- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Obsah a věcný rejstřík
- Vyššie riziko terminálneho zlyhania obličiek u rómskych detí – dáta z pediatrického registra Slovenska
- Kvalita života a nemocnost dětí po operaci vrozené brániční kýly
- Kvalita života osob pečujících o dítě s dědičným metabolickým onemocněním
- Akutní diseminovaná encefalomyelitida
- Úskalí prenatální diagnostiky trizomie 20 a její mozaiky
- Diagnostika a terapie neurogenního měchýře u dětí
- Vývin črevného nervového systému a patogenéza Hirschsprungovej choroby
- Hygienické požadavky na mikrobiologickou bezpečnost odstříkaného mateřského mléka ve výživě nedonošených novorozenců
- Takzvaně problémový pacient
- Prim. MUDr. Tomáš Valoušek – 90 let
- Profesor Jiří Nevoral sedmdesátiletý
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Kvalita života a nemocnost dětí po operaci vrozené brániční kýly
- Úskalí prenatální diagnostiky trizomie 20 a její mozaiky
- Akutní diseminovaná encefalomyelitida
- Diagnostika a terapie neurogenního měchýře u dětí
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



