-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Antropometrické, hormonálne a metabolické zmeny u prepubertálnych detí, narodených ako SGA, so zníženým rastom, liečených rastovým hormónom, po prvom roku liečby
Anthropometric, hormonal and metabolic changes in prepubertal children born as SGA (small for gestational age), with decreased growth, treated with the growth hormone, after the first year of therapy
Objective:
The aim of the work was to evaluate selected anthropometric, hormonal and metabolic parameters in SGA children, having been treated with the growth hormone and evaluated after the first year of therapy. The extent of success and risk of the treatment were to be evaluated.Methods:
In SGA-born children, having been treated with the growth hormone in the endocrinology out-patient of the 2nd Children Clinic, Children Faculty Hospital (DFNsP) and Medical Faculty, Komensky University (LFUK) in Bratislava, the authors recorded and evaluated retrospectively their stature, BMI, blood sugar, fT4, TSH and IGF-1 just before the therapy and after one year of treatment with the growth hormone.Results:
The study encompassed 45 prepubertal children (15 girls, mean age 9.1±3.1 year and 30 boys, mean age 8.9±3.6 years). The stature improved in boys on the average from -2.80±0.34 SDS to -2.27±0.45 SDS, p<0.001 in girls and from -2.92±0.48 SDS to -2.45±0.76 SDS, p<0.001 in boys. The BMI values remains without significant change. In both sexes, the levels of IGF-1 increased significantly (p<0.001), to a three-fold levels. The changes in the mean values of glucose, fT4 and TSH were not statistically significant.Conclusion:
The positive influence of the therapy with growth hormone on stature and IGF-1 has been unequivocally proved in the treated children. The authors also conclude that the growth hormone has not significantly influenced the blood sugar and thyroid hormones in blood. All children included in the study proved to tolerate the therapy well and no side effects of the treatment were observed.Key words:
SGA, growth hormone, hormonal and metabolic changes
Autori: Ľ. Košťálová 1; I. Lacková 2; Z. Pribilincová 1; Z. Blusková 1
Pôsobisko autorov: 2. detská klinika LFUK a DFNsP Bratislavaprednosta prof. MUDr. L. Kovács, DrSc., MPH 1; Detsko-dojčenské oddelenie NsP, Myjava 2
Vyšlo v časopise: Čes-slov Pediat 2014; 69 (2): 106-113.
Kategória: Původní práce
Súhrn
Cieľ:
Cieľom práce bolo vyhodnotiť vybrané antropometrické, hormonálne a metabolické parametre u detí narodených malých vzhľadom na gestačný vek (SGA, z. angl. small for gestational age), liečených rastovým hormónom, po prvom roku liečby, s následným posúdením miery úspešnosti a rizík tejto liečby.Metódy:
U detí, narodených SGA, liečených rastovým hormónom v endokrinologickej ambulancii 2. detskej kliniky DFNsP a LFUK v Bratislave, sme retrospektívne zaznamenali a vyhodnotili ich výšku, BMI, glykémiu, fT4, TSH a IGF-1 tesne pred začiatkom liečby a po roku liečby rastovým hormónom.Výsledky:
Do štúdie bolo zahrnutých 45 prepubertálnych detí (15 dievčat, priemerný vek 9,1 ± 3,1 roka a 30 chlapcov, priemerný vek 8,9 ± 3,6). Výška detí sa zlepšila v priemere z -2,80 ± 0,34 SDS na -2,27 ± 0,45 SDS, p <0,001 u dievčat a z -2,92 ± 0,48 SDS na -2,45 ± 0,76 SDS, p <0,001 u chlapcov. Hodnoty BMI boli bez signifikantnej zmeny. U oboch pohlaví významne stúpli hladiny IGF-1 (p <0,001), a to trojnásobne. Zmeny v priemerných hodnotách hladiny glukózy, fT4 a TSH neboli štatisticky významné.Záver:
Jednoznačne sme preukázali pozitívny vplyv liečby rastovým hormónom na výšku a hladiny IGF-1 u SGA liečených detí. Tiež sme dospeli k záveru, že rastový hormón neovplyvnil významne hladiny glykémie a tyroidálnych hormónov. Všetky deti zahrnuté do štúdie liečbu dobre tolerovali a neboli pozorované žiadne vedľajšie nežiaduce účinky liečby.Kľúčové slová:
SGA, rastový hormón, výška, hormonálne a metabolické zmenyÚvod
Ako small for gestational age (SGA) (z angl., malý vzhľadom na gestačný vek) definujeme dieťa, ktorého pôrodná hmotnosť a/alebo dĺžka je menšia ako 2 smerodajné odchýlky (SDS) vzhľadom na gestačný vek a pohlavie. Podľa niektorých prác je SGA tiež definované ako hmotnosť a/alebo dĺžka pod 3., alebo pod 10. percentil pre daný gestačný vek [1]. Podľa dostupných údajov sa odhaduje, že 2,3–10 % všetkých detí sa narodilo ako SGA [2]. V etiológii SGA sa uplatňuje pôsobenie rizikových faktorov zo strany matky, plodu i placenty. Veľkosť novorodenca však determinuje aj pohlavie, parita, etnicita, materská pôrodná hmotnosť a ďalšie. SGA novorodenec môže byť teda aj konštitučne malý [1, 2]. Častokrát sa príčina vzniku SGA nezistí.
Asi 90 % SGA detí dobehne svojich rovesníkov v raste v priebehu prvých dvoch rokov života prostredníctvom rastového výšvihu (catch-up rast) [2], definovaného ako rastová rýchlosť (cm/rok) väčšia ako medián pre daný chronologický vek a pohlavie [3]. V klinickej praxi to znamená, že sa dieťa rastom dostane nad úroveň -2 SDS pre daný vek a pohlavie. Avšak dieťa narodené ako SGA a staršie ako 3 roky, ktoré má stále nízku postavu, pravdepodobne už rastový výšvih mať nebude [4].
Okrem nízkej výšky majú tieto deti aj zvýšené riziko rozvoja endokrino-metabolických zmien s metabolickým syndrómom a srdcovocievnymi ochoreniami v dospelosti [5]. Nepriaznivé zmeny pozorujeme aj z pohľadu psychosociálneho statusu.
Deti, ktorých výška je -2,5 SDS a menej pre daný vek a pohlavie a dosiahli vek 4 rokov, sú indikované k liečbe rastovým hormónom [6]. Táto môže okrem účinku na rast ovplyvniť aj niektoré endokrinné a metabolické parametre liečených detí.
Cieľom našej práce bolo vyhodnotiť vplyv liečby rastovým hormónom na výšku, BMI a vybrané hormonálne a metabolické parametre u prepubertálnych detí narodených ako SGA. Zamerali sme sa na obdobie prvého roka liečby, ktoré považujeme za kľúčové pri posudzovaní jednotlivých parametrov z hľadiska odpovede na podávaný rastový hormón.
Metódy
Vstupné dáta a všetky sledované parametre sme získali zo zdravotnej dokumentácie endokrinologickej ambulancie 2. detskej kliniky LFUK a DFNsP v Bratislave. Do štúdie bolo zahrnutých 45 prepubertálnych detí (15 dievčat, priemerný vek 9,1 ± 3,1 rokov a 30 chlapcov, priemerný vek 8,9 ± 3,6), narodených ako SGA, ktoré do konca marca 2013 absolvovali aspoň 1 rok liečby rastovým hormónom. Sledovaní pacienti mali zaznamenané údaje o ich výške a body mass indexe (BMI) pred začatím a po roku liečby rastovým hormónom.
Do štúdie neboli zaradené dievčatá s Turnerovým syndrómom, deti so vstupnou poruchou metabolizmu cukrov a s ochorením štítnej žľazy, pečene a obličiek.
Okrem antropometrických ukazovateľov sme zaznamenávali informácie o poradí a priebehu gravidity, spôsobe vedenia a termíne pôrodu, pôrodnej hmotnosti a dĺžke, ako i o prípadnej syndrómovej symptomatike dieťaťa. Zamerali sme sa tiež na informácie o prítomnosti intrauterinnej rastovej retardácie (IUGR) u dieťaťa, potvrdenej minimálne dvoma ultrasonografickými vyšetreniami v priebehu gravidity. (IUGR a SGA nie sú synonymá, hoci sa tak často používajú. Termín SGA popisuje len veľkosť dieťaťa pri narodení, nevyjadruje sa k vnútromaternicovému rastu. SGA narodené deti mohli (a často prešli), no nemuseli prejsť fázou IUGR, a naopak, plod môže prejsť fázou IUGR, pričom sa môže narodiť ako novorodenec s adekvátnou dĺžkou a hmotnosťou (AGA) [5].)
Z laboratórnych parametrov sme sledovali hodnoty inzulínu podobného rastového faktora 1 (IGF-1), glykémie, tyreotropného hormónu (TSH) a voľného tyroxínu (fT4) pred začiatkom a po roku liečby. Za normálne boli považované nasledovné hodnoty: glykémia 4–5,5 mmol/l, TSH 0,4–4,67 mIU/l, fT4 12–22 pmol/l. Vzhľadom na rozdielny vek sme získané údaje o výške a BMI štandardizovali na smerodajné odchýlky (SDS). Pri výpočtoch boli použité normy z antropometrického prieskumu v SR z roku 2001 [7]. Dáta sú spracované Studentovým t-testom, uvádzané ako aritmetický priemer ± smerodajná odchýlka. Pracovali sme s hladinou významnosti p <0,05.
Výsledky
Sledované deti pochádzali z rôzneho poradia gravidity, najčastejšie z prvej a druhej. Intrauterinná rastová retardácia bola diagnostikovaná len u 4 chlapcov (13,3 %) a u žiadneho dievčaťa. V priebehu gravidity boli u matiek SGA narodených detí zistené nasledovné komplikácie: 1 matka (2,2 %) mala diagnostikovaný gestačný diabetes, 1 matka (2,2 %) mala hypertenziu, 2 matky (4,4 %) prekonali v priebehu gravidity infekčné ochorenie, 1 matka (2,2 %) mala prítomný myóm maternice, 3 matky (6,7 %) mali prítomnú patológiu placenty, 1 matka (2,2 %) užívala v priebehu gravidity antiepileptiká.
Osem (26,7 %) pôrodov chlapcov a 7 (46,7 %) dievčat bolo ukončených cisárskym rezom. Nízka pôrodná hmotnosť bola prítomná u 16 (53,3 %) chlapcov a 5 (33,3 %) dievčat, nízka pôrodná dĺžka u 27 (90 %) chlapcov a 12 (80 %) dievčat. Charakteristické údaje detí z perinatálneho obdobia sú zhrnuté v tabuľke 1.
Tab. 1. Perinatálne údaje o SGA narodených deťoch, liečených rastovým hormónom. 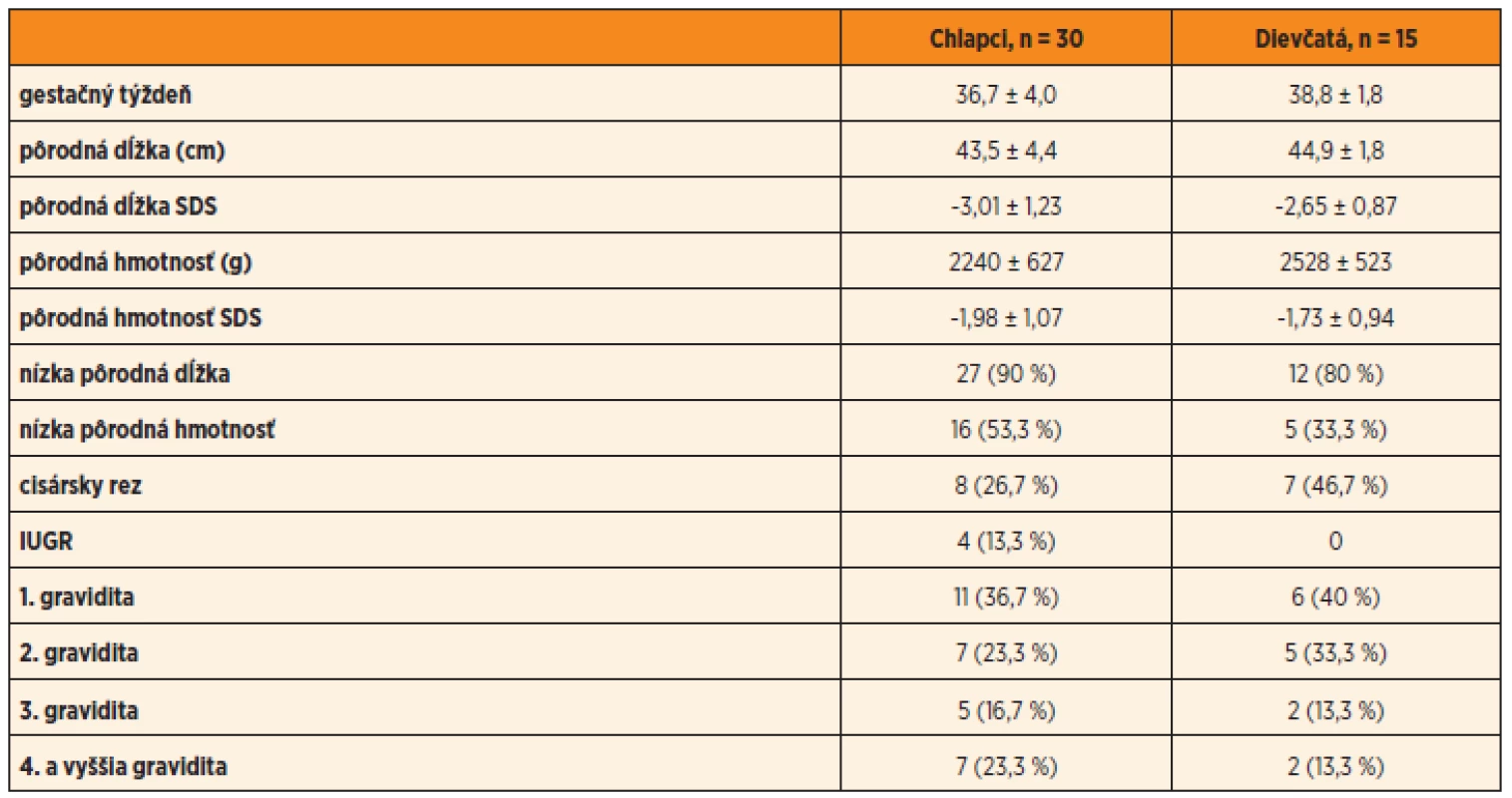
Priemerná výška u dievčat sa zlepšila z -2,80 ± 0,34 SDS na -2,27 ± 0,45 SDS, p <0,001, rastový prírastok bol 0,53 SDS. V skupine chlapcov sa výška zlepšila z -2,92 ± 0,48 SDS na -2,45 ± 0,76 SDS, p <0,001, rastový prírastok bol 0,47 SDS (graf 1).
Graf 1. Výška SGA narodených detí pred liečbou a po roku liečby rastovým hormónom. 
U 9 dievčat (60 %) došlo počas liečby rastovým hormónom k vzostupu BMI SDS, u 6 (40 %) k poklesu BMI SDS. U 16 chlapcov (53,3 %) došlo k vzostupu BMI SDS, u 14 chlapcov (46,7 %) k poklesu BMI SDS. Celková hodnota BMI u dievčat poklesla z -0,29 ± 0,88 SDS na -0,33 ± 0,81 SDS, u chlapcov BMI pokleslo z -0,65 ± 0,79 SDS na-0,69 ± 0,68 SDS, v oboch prípadoch bola hladina významnosti nesignifikantná.
IGF-1 sme vyhodnotili celkom u 14 dievčat a 28 chlapcov, glykémiu u 10 dievčat a 27 chlap-cov, TSH u 13 dievčat a 27 chlapcov, fT4 u 13 dievčat a 26 chlapcov. U ostatných detí boli konkrétne parametre vyšetrené v inom časovom období.
Hladina IGF-1 sa u dievčat zlepšila z počia-točných 134,1 ± 60,5 ng/ml na 387,2 ± 253,0 ng/ml, p <0,001. Podobne v skupine chlapcov hladina IGF-1 vzrástla v priemere zo 159,3 ± 142,2 ng/ml na 303,8 ± 206,6 ng/ml, p <0,001.
Priemerná hodnota glykémie bola u dievčat 4,5 ± 0,3 mmol/l a u chlapcov 4,7 ± 0,6 mmol/l. Po roku liečby tieto hodnoty nevýznamne u dievčat klesli na 4,2 ± 0,6 mmol/l a u chlapcov vzrástli na 4,8 ± 0,5 mmol/l. Všetky deti boli pred i počas liečby euglykemické. Hladiny inzulinémie nalačno sme nevyhodnotili, lebo boli odoberané až počas liečby rastovým hormónom.
Ani v jednej skupine nedošlo po roku liečby k signifikantným zmenám počas liečby v hladine TSH a fT4 (tab. 2, 3). Hladiny fT4 a TSH zostali počas liečby v referenčnom rozmedzí, len u jedného chlapca došlo k vzostupu TSH nad normu.
Tab. 2. Laboratórne parametre u SGA narodených chlapcov. 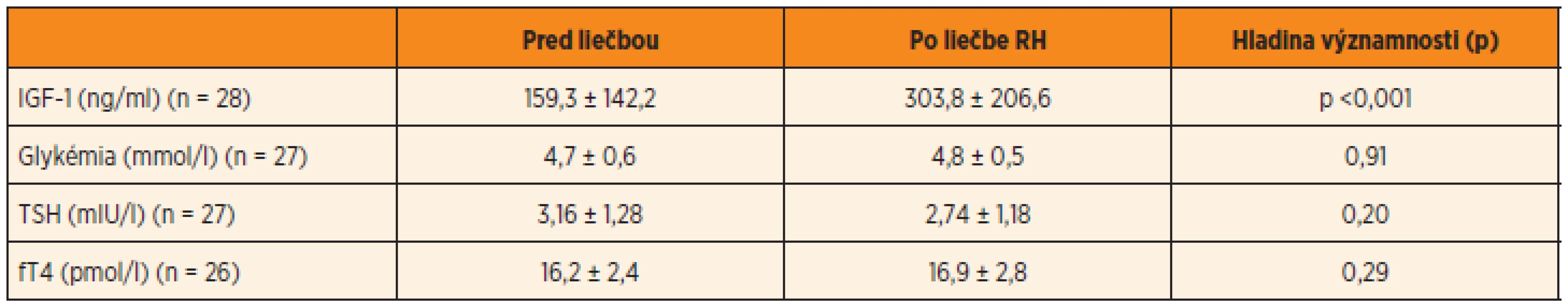
RH – rastový hormón, IGF-1 – inzulínu podobný rastový faktor 1, TSH – tyreostimulačný hormón, fT4 – voľný tyroxín Tab. 3. Laboratórne parametre u SGA narodených dievčat. 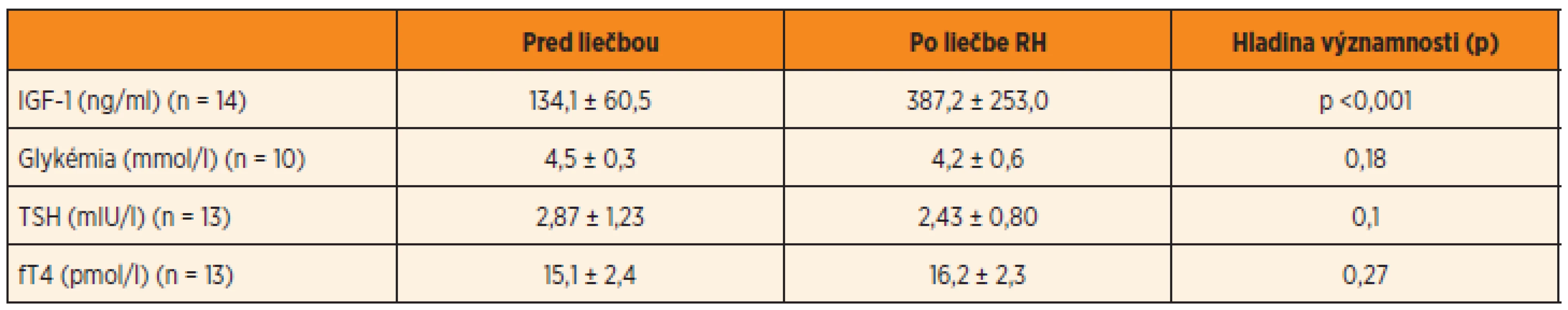
RH – rastový hormón, IGF-1 – inzulínu podobný rastový faktor 1, TSH – tyreostimulačný hormón, fT4 – voľný tyroxín Diskusia
Zistené komplikácie počas gravidity, ktoré napomáhajú vzniku SGA, sú všeobecne známe a ich výskyt u detí našej sledovanej skupiny sa nelíšil od ostatných literárnych údajov [8, 9].
Priemerná hodnota výšky u dievčat aj chlapcov sa po roku liečby rastovým hormónom zlepšila v oboch skupinách takmer zhodne o 0,53 SDS u dievčat, p <0,001, a o 0,47 SDS u chlapcov, p <0,001. Na základe týchto výsledkov môžeme hodnotiť liečbu za úspešnú. Boguszewski a kol. [10] rovnako prezentujú zlepšenie výšky o približne 0,50 SDS za rok u predpubertálnych SGA detí liečených rastovým hormónom, zahrnutých v multicentrickej štúdii, v ktorej boli zastúpené severské štáty, Švédsko, Fínsko, Dánsko a Nórsko. Rast bol úmerný podanej dávke RH a deti, liečené vyššími dávkami, dosiahli už po 3 rokoch liečby cieľovú výšku. Lee a kol. [11] popisujú po 2 rokoch liečby RH u SGA detí zlepšenie výšky o 1,03 SDS. Sas a kol. [12] dospeli k výsledkom, ktoré po 5 rokoch liečby rastovým hormónom ukázali vzostup výšky u takmer všetkých SGA detí taktiež až do normálnych pásiem, pričom rozdiel v raste v závislosti od podanej dávky pozorovali len u predpubertálnych detí. Van Pareren a kol. [13] zaznamenali signifikantný nárast výšky po dlhotrvajúcej kontinuálnej liečbe rastovým hormónom u SGA detí. Výsledky ich meraní ukazujú významné zlepšenie po 2. aj 5. roku liečby rastovým hormónom. Už po 2. roku liečby nastal posun detí do normálneho výškového pásma, v ktorom tieto deti zotrvávali aj v dospelom veku. Rozdiel v závislosti od podanej dávky rastového hormónu nepozorovali.
De Zegher a kol. [14] popisujú nárast BMI u SGA liečených detí po 6 rokoch trvania liečby o 0,8 SDS voči norme. Sas a kol. [12] a Van Dijk a kol. [15] podobne uvádzajú signifikantný vzostup BMI počas liečby rastovým hormónom. Naproti tomu Argente a kol. [16] vo svojej štúdii uviedli, že nedošlo k žiadnym signifikantným zmenám BMI počas liečby a zaznamenaný iniciálny vzostup hodnôt sa po 12 mesiacoch opäť normalizoval.
V prezentovaných výsledkoch sme vzostup v BMI SDS nezaznamenali, dokonca bol prítomný minimálny nesignifikantný úbytok priemerného BMI SDS u oboch pohlaví. Tieto výsledky si vysvetľujeme jednak veľkým vekovým rozpätím u sledovaných detí, jednak širokým rozsahom nameraných hodnôt BMI SDS v zmysle plus/mínus. U 60 % dievčat a 53,3 % chlapcov však došlo k nárastu BMI SDS.
Liečba rastovým hormónom u SGA narodených detí môže významným spôsobom zasiahnuť do ich endokrinného systému a metabolizmu. Počas liečby RH dochádza k vzostupu hladiny IGF-1 [10, 15, 16] a zmena hladiny IGF-1 a IGFBP koreluje s rastovou odpoveďou na terapiu detí [10]. Taktiež v prezentovanej štúdii sme zaznamenali významný vzostup hladiny IGF-1 u oboch pohlaví (p <0,001).
Účinok rastového hormónu na inzulínovú signálnu dráhu môže viesť k poruche metabolizmu cukrov u SGA liečených detí. Vo viacerých štúdiách bolo počas liečby popísané zníženie inzulínovej senzitivity [17, 18] a nárast hladiny inzulínu [10, 19, 20]. Podľa Lébla a kol. [19] sa však na vyšších nameraných hladinách inzulínu môže spolupodieľať akútny efekt podanej dávky a teda, ak by hladiny inzulínu boli merané neskôr v priebehu dňa, boli by nižšie. Kým Cutfield a kol. [18] pozorovali pretrvávanie zvýšených hladín inzulínu po 3 mesiacoch po prerušení liečby, podľa Willemsena [21] a van Parerena [20] došlo po 6 mesiacoch po prerušení liečby k normalizácii hladiny inzulínu a inzulínovej senzitivity. Van Dijk a kol. [15] zaznamenali reverzibilné zvýšenie hladín inzulínu nalačno so znížením hladiny glukózy. Guemes a kol. [22] popísali progresívny nárast glykémie nalačno, glykovaného hemoglobínu, bazálneho inzulínu a HOMA indexu po 3 rokoch liečby. Vo väčšine štúdií však nedošlo k signifikantným zmenám v hladine glykémie [10, 16], čo je konzistentné s našimi výsledkami. Po roku liečby rastovým hormónom boli zmeny v hladine glykémie u nami sledovaných detí nesignifikantné a u všetkých detí bola prítomná pred i počas liečby euglykémia. Celkovo teda liečbu rastovým hormónom z hľadiska metabolizmu cukrov považujeme za bezpečnú.
Existujú údaje o možnom už primárnom narušení hypotalamo-pituitárnej-tyroidálnej osi u SGA narodených detí, bez ohľadu na liečbu [23].
Liečba RH môže ešte navyše zasiahnuť do metabolizmu tyroidálnych hormónov. Rastový hormón zvyšuje extra-tyroidálnu konverziu T4 na T3, preto u detí liečených rastovým hormónom v dôsledku hypopituitarizmu dochádza k biochemickému odmaskovaniu subklinickej centrálnej hypotyreózy [24]. RH teda indukuje zmeny v periférnom tyroidálnom metabolizme.
Lem a kol. [25] zistili, že neliečené SGA deti, ktoré boli bez catch-up rastu, mali vyššie hladiny TSH ako ostatná populácia, ale väčšinou v referenčnom rozmedzí, ďalej mali podobné hladiny fT4 a T4, ale významne vyššie hladiny T3, rT3 a T4-viažuceho globulínu ako ostatná populácia. Počas puberty a liečby RH hladina fT4 a rT3 významne poklesla, kým T3 významne vzrástlo. Hladina TSH zostala u prepubertálnych i pubertálnych detí nezmenená. Zmeny v prospech viac biologicky aktívneho T3 sú pravdepodobne sprostredkované IGF-1. Toto pozorovanie potvrdili aj deKort a kol. [26], keď u SGA detí liečených RH došlo počas prvých 6 mesiacov liečby k signifikantnému poklesu fT4, hoci zostal v normálnom rozmedzí a hladina TSH zostala bez zmeny.
V prezentovanej štúdii sme zmeny v tyroidálnom metabolizme nepozorovali a hladiny TSH a fT4 pred a po liečbe boli porovnateľné (bez signifikantných zmien) a počas liečby pretrvávali v normálnom rozmedzí v oboch skupinách, s výnimkou 1 chlapca, u ktorého došlo k vzostupu TSH nad normu.
Všetky deti zahrnuté v našom výskume liečbu rastovým hormónom dobre tolerovali.
Záver
Na základe výsledkov môžeme povedať, že liečba RH bola úspešná a neovplyvnila významne hladinu glykémie ani hormónov štítnej žľazy a teda z hľadiska týchto parametrov môžeme liečbu rastovým hormónom u SGA detí považovať za bezpečnú.
Došlo: 23. 9. 2013
Přijato: 14. 2. 2014
Kontaktná osoba pre korešpondenciu:
MUDr. Zuzana Blusková
2. detská klinika DFNsP a LFUK
Limbová 1, 833 40 Bratislava, Slovenská republika
e-mail: zuzana.bluskova@gmail.com
Zdroje
1. Clayton PE, Cianfarani S, Czernichow P, et al. Management of the child born small for gestational age through to adulthood: a consensus statement of the International Societies of Pediatric Endocrinology and the Growth Hormone Research Society. J Clin Endocrinol Metab 2007; 92 : 804–810.
2. Saenger P, Czernichov P, Hughes I, et al. Small for gestational age: Short stature and beyond. J Clin Endocrinol Metab 2007; 28 : 219–257.
3. Lee PA, Chernausek SD, Hokken-Koelega AC, et al. International small for gestational age advisory board consensus development conference statement: management of short children born small for gestational age. Pediatrics 2003; 111 : 1253–1261.
4. Kytnarová J, Zlatohlávková B, Fedorová M, et al. Intrauterinní růstová retardace a fetální původ chorob v dospělosti. Čes-slov Pediat 2008; 63 : 320–326.
5. Blusková Z, Košťálová Ľ. Prenatálne a neonatálne prostredie a ich dôsledky na vývoj dieťaťa. Čes-slov Pediat 2012; 67 : 253–259.
6. Košťálová Ľ. Liečba rastovým hormónom v detskom veku. Pediatr Prax 2008; 4 : 207–211.
7. Kolektív autorov: Telesný vývoj detí a mládeže v SR. Výsledky VI. Celoštátneho prieskumu v roku 2001. Bratislava: Úrad verejného zdravotníctva SR, 2004.
8. Jancevska A, Tasic V, Damcevski N, et al. Children born small for gestational age (SGA). Prilozi 2012; 33 : 47–58.
9. Bryan SM, Hindmarsh PC. Normal and abnormal fetal growth. Horm Res 2006; 65 : 19–27.
10. Boguszewski M, Albertsson-Wikland K, Aronsson S, et al. Growth hormone treatment of short children born small-for-gestational-age: the Nordic Multicentre Trial. Acta Paediatr 1998; 87 : 257–263.
11. Lee PA, Sävendahl L, Oliver I, et al. Comparison of response to 2-years‘ growth hormone treatment in children with isolated growth hormone deficiency, born small for gestational age, idiopathic short stature, or multiple pituitary hormone deficiency: combined results from two large observational studies. Int J Pediatr Endocrinol 2012; 1 : 22.
12. Sas T, De Waal W, Mulder P, et al. Growth hormone treatment in children with short stature born small for gestational age: 5-year results of a randomized, double-blind, dose-response trial. J Clin Endocrinol Metab 1999; 84 : 3064–3069.
13. Van Pareren Y, Mulder P, Houdijk M, et al. Adult height after long-term, continuous growth hormone (GH) treatment in short children born small for gestational age: Results of randomized, double-blind, dose-response GH trial. J Clin Endocrinol Metab 2003; 88 : 3584–3590.
14. De Zegher F, Albertsson-Wikland K, Wollmann HA, et al. Growth hormone treatment of short children born small for gestational age: Growth responses with continuous and discontinuous regimens over 6 years. J Clin Endocrinol Metab 2000; 85 : 2816–2820.
15. Van Dijk M, Bannink EMN, Van Pareren YK, et al. Risk factors for diabetes mellitus type 2 and metabolic syndrome are comparable for previously growth hormone-treated young adults born small for gestational age (SGA) and untreated short SGA controls. J Clin Endocrinol Metab 2007; 92 : 160–165.
16. Argente J, Gracia R, Ibáñez L, et al. Improvement in growth after two years of growth hormone therapy in very young children born small for gestational age an without spontaneous catch-up growth: Results of a multicenter, controllen, randomized, open clinical trial. J Clin Endocrinol Metab 2010; 92 : 3095–3101.
17. Bachmann S, Bechtold S, Bonfig W, et al. Insulin sensitivity decreases in short children born small for gestational age treated with growth hormone. J Pediatr 2009; 154 : 509–513.
18. Cutfield WS, Jackson WE, Jefferies C, et al. Reduced insulin sensitivity during growth hormone therapy for short children born small for gestational age. J Pediatr 2003; 142 : 113.
19. Lebl J, Lebenthal Y, Kolouskova S, et al. Metabolic impact of growth hormone treatment in short children born small for gestational age. Horm Res Paediatr 2011; 76 : 254–261.
20. van Pareren Y, Mulder P, Houdijk M, et al. Effect of discontinuation of growth hormone treatment on risk factors for cardiovascular disease in adolescents born small for gestational age. J Clin Endocrinol Metab 2003; 88 : 347–353.
21. Willemsen RH, Willemsen SP, Hokken-Koelega AC. Longitudinal changes in insulin sensitivity and body composition of small-for-gestational-age adolescents after cessation of growth hormone treatment. J Clin Endocrinol Metab 2008; 93 : 3449–3454.
22. Güemes Hidalgo M, Fernández de Larrea Baz N, Muñoz Calvo MT, Argente J. Response to 3 years of growth hormone therapy in small for gestational age children: clinical, hormonal and metabolic parameters. An Pediatr (Barc) 2013; 78 : 288–296.
23. Radetti G, Renzullo L, Gottardi E, et al. Altered thyroid and adrenal function in children born at term and preterm, small for gestational age. J Clin Endocrinol Metab 2004; 89 : 6320–6324.
24. Jørgensen JO, Ovesen P, Juul A, et al. Impact of growth hormone administration on other hormonal axes. Horm Res 1999; 51 : 121–126.
25. Lem AJ, de Rijke YB, van Toor H, et al. Serum thyroid hormone levels in healthy children from birth to adulthood and in short children born small for gestational age. J Clin Endocrinol Metab 2012; 97 : 3170–3178.
26. de Kort SW, Willemsen RH, van der Kaay DC, et al. Thyroid function in short children born small-for-gestational age (SGA) before and during GH treatment. Clin Endocrinol (Oxf) 2008; 69 : 318–322.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek MikropenisČlánek Antonín Mrskoš
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2014 Číslo 2- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
-
Všetky články tohto čísla
- Antropometrické, hormonálne a metabolické zmeny u prepubertálnych detí, narodených ako SGA, so zníženým rastom, liečených rastovým hormónom, po prvom roku liečby
- Osteogenesis imperfecta asociovaná s izolovaným deficitom rastového hormónu
- Polohové anomálie varlat a kryptorchismus v prvním roce života
- Mikropenis
- 11. Český pediatrický kongres s mezinárodní účastí
- „EVIDENCE BASED PHARMACOTHERAPY IN NEWBORNS AND CHILDREN“
- Odešel prof. Dr. med. Dr. med. h. c. mult. Theodor Hellbrügge
- Antonín Mrskoš
- Vzťah medzi obezitou a závažnosťou hypertenzie u detí a adolescentov
- Výsledky rozšířeného novorozeneckého screeningu v České republice
- Etické aspekty rozšiřování novorozeneckého screeningu dědičných metabolických poruch
- Chirurgická liečba hydrocefalu a jej komplikácie
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Mikropenis
- Chirurgická liečba hydrocefalu a jej komplikácie
- Polohové anomálie varlat a kryptorchismus v prvním roce života
- Výsledky rozšířeného novorozeneckého screeningu v České republice
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



