-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nemoc ze střádání esterů cholesterolu (CESD): klinická, laboratorní a histologická charakteristika šesti pacientů
Cholesteryl Ester Storage Disease (CESD): clinical, laboratory and histological characteristics in 6 patients
Introduction:
Cholesteryl Ester Storage Disease (CESD), an inherited deficiency of lysosomal acid lipase (LAL), leads to the accumulation of cholesteryl esters and triglycerides in the lysosomes of many tissues. The disease manifests usually in preschool age with hepatosplenomegaly, hepatopathy and hyperlipidemia with the possibility of progression into hepatic fibrosis and cirrhosis. In adulthood premature atherosclerosis may develop. More severe lethal variant is Wolman disease with zero LAL activity. CESD is panethnic with estimated incidence of 1 : 40 000.Aims:
In the Czech Republic between the years 1975–2013 19 patients with CESD and 1 patient with Wolman disease were diagnosed. Here we present the clinical and laboratory data of 6 patients with CESD (age 15.5±4.5 years).Results:
Calculated prevalence of CESD in the Czech Republic is 1 : 322 000. The disease in our 6 patients manifested on average in 5.5 years of age with hepatosplenomegaly, hepatopathy (ALT 1.9±0.4, AST 1.6±0.5 μkat/l) and hyperlipidemia (cholesterol 7±1.5 mmol/l, triglycerides 2.8±1.5 mmol/l). In all four patients with representative sample of liver tissue, liver fibrosis was detected, in one patient with progression into cirrhosis. In all patients the diagnosis of CESD was established enzymatically by the significantly decreased activity of LAL in leukocytes (3–19.5% of average control levels) and by typical histological findings in all liver biopsies with microvesicular steatosis with intralysosomal neutral lipid accumulation. Therapy with intravenous application of recombinant enzyme in two-week intervals is now performed as clinical study in all our six patients.Conclusion:
Prevalence of CESD in the Czech Republic contrasts with the estimated prevalence and indicates significant underdiagnosis. The existence of a new treatment option requires early intervention and centralization of care for patients with CESD.Key words:
hepatopathy, hepatosplenomegaly, microvesicular liver steatosis, hyperlipidemia, cholesteryl ester storage disease, lysosomal disease
Autoři: S. Mazurová 1; H. Poupětová 2; H. Hůlková 2; L. Ťoukálková 3; Z. Urbanová 1; J. Zeman 1; V. Smolka 4; V. Malinová 1; T. Honzík 1
Působiště autorů: Klinika dětského a dorostového lékařství UK 1. LF a VFN, Prahapřednosta prof. MUDr. J. Zeman, DrSc. 1; Ústav dědičných metabolických poruch UK 1. LF a VFN, Prahapřednosta prof. MUDr. V. Kožich, CSc. 2; Dětské oddělení, Krajská nemocnice T. Bati, a. s., Zlínpřednosta MUDr. P. Pešák 3; Dětská klinika FN a LF Univerzity Palackého, Olomoucpřednosta prof. MUDr. Vladimír Mihál, CSc. 4
Vyšlo v časopise: Čes-slov Pediat 2014; 69 (3): 148-160.
Kategorie: Kazuistika
Souhrn
Úvod:
Nemoc ze střádání esterů cholesterolu (CESD) je způsobena poruchou lysosomálního enzymu kyselé lipázy (LAL), která štěpí LDL derivované cholesteryl estery na neesterifikovaný cholesterol. Onemocnění se projevuje nejčastěji v předškolním věku hepatosplenomegalií, hepatopatií a hyperlipidemií, s možností rozvinutí jaterní fibrózy a cirhózy. Závažnější letální formou onemocnění je Wolmanova nemoc. Výskyt CESD je panetnický a odhaduje se na 1 : 40 000.Cíle:
V ČR bylo za období 1975–2013 diagnostikováno 19 pacientů s CESD a 1 pacient s Wolmanovou nemocí. Prezentujeme klinické projevy a laboratorní data 6 pacientů s CESD (věk 15,5 ± 4,5 let).Výsledky:
Vypočtená prevalence CESD v ČR je 1 : 322 000. Onemocnění se u našich 6 pacientů manifestovalo v průměru v 5,5 letech věku hepatosplenomegalií, hepatopatií, (ALT 1,9 ± 0,4, AST 1,6 ± 0,5μkat/l) a hyperlipidemií (cholesterol 7 ± 1,5 mmol/l, triacylglyceroly 2,8 ± 1,5 mmol/l). U všech čtyř pacientů s reprezentativním vzorkem jaterní tkáně byla v době jaterní biopsie detekována fibróza, u jedné pacientky s přechodem do cirhózy. U všech pacientů byla diagnóza CESD stanovena na enzymatické úrovni průkazem výrazně snížené aktivity LAL v leukocytech (3–19,5 % průměru hodnot u kontrol) a u všech bioptovaných také typickým histologickým nálezem v jaterní biopsii s obrazem mikrovezikulární steatózy s intralysosomálním střádáním neutrálních lipidů. Léčba intravenózní aplikací rekombinantního enzymu ve dvoutýdenním intervalu probíhá zatím formou klinické studie u všech šesti pacientů.Závěr:
Vypočtená prevalence CESD v ČR kontrastuje s odhadovaným výskytem CESD a ukazuje na významnou poddiagnostikovanost. Přitom existence nové možnosti léčby vyžaduje včasnou diagnostiku a centralizaci péče o pacienty s CESD.Klíčová slova:
hepatopatie, hepatosplenomegalie, mikrovezikulární steatóza jater, hyperlipidemie, nemoc ze střádání esterů cholesterolu, lysosomální onemocněníÚvod
Cholesteryl Ester Storage Disease (neboli CESD) je onemocnění s autozomálně recesivním typem dědičnosti, jehož příčinou je mutace v genu LIPA. V důsledku mutace dojde k různě hlubokému deficitu lysosomálního enzymu kyselé lipázy (LAL), jehož funkcí ve zdravém organismu je intralysosomální degradace triacylglycerolů a esterů cholesterolu. LAL štěpí LDL derivovaný ester cholesterolu na neesterifikovaný cholesterol [1]. Neesterifikovaný cholesterol má významnou roli v řízení endogenní syntézy cholesterolu. Estery cholesterolu při deficitu LAL se akumulují v lysosomálním systému především v makrofázích jater a sleziny [2, 3], dále též v hepatocytech a v buňkách kůry nadledvin. Onemocnění CESD se projevuje v předškolním a školním věku hepatosplenomegalií, hepatopatií a hyperlipidemií s možností progrese jaterního onemocnění do fibrózy až cirhózy. V dospělosti se rozvíjí předčasná ateroskleróza. Závažnější letální forma onemocnění s nulovou aktivitou kyselé lipázy a generalizovaným lysosomálním střádáním esterů cholesterolu a triacylglycerolů, označovaná jako Wolmanova nemoc, se projevuje již v průběhu prvního roku života neprospíváním, hepatosplenomegalií, enteropatií se steatorheou a rychle progredujícím jaterním selháním [4] s fatálním koncem. Při laboratorním vyšetření u CESD typicky prokazujeme hyperlipidemii s významnou hypercholesterolemií a mírnou hypertriacylglycerolemií. LDL frakce cholesterolu je zvýšená, zatímco frakce HDL je snížená [5, 6]. Příznačný je histologický nález v jaterní biopsii, kterému dominuje mikrovezikulární panlobulární steatóza lysosomálního původu a lysosomální střádání neutrálních lipidů a ceroidu v portálních i sinusoidálních makrofázích. Charakteristický je vývoj fibrózy eventuelně s progresí do cirhózy [7].
V tomto sdělení prezentujeme klinické projevy a laboratorní data 6 pacientů, kteří zůstali v péči pražského a olomouckého pracoviště. Doposud neexistovala kauzální terapie a pacienti byli převážně léčeni dietoterapií a hypolipidemiky, což dále vedlo k pomalé progresi onemocnění. Nově je však k dispozici léčba intravenózní aplikací rekombinantního enzymu, zatím ve formě klinické studie. Existující nové možnosti léčby vyžadují včasnou diagnostiku a centralizaci péče o pacienty s CESD.
Materiál a metody
Kazuistiky
Pacient č. 1
Jedná se o dívku s nekomplikovanou perinatální i postnatální anamnézou. Elevace jaterních transamináz (ALT 2,27 mkat/l; AST 1,62 mkat/l; kontroly do 0,72 mkat/l) a hypercholesterolemie (celkový cholesterol (celk. chol.) 10 mmol/l; kontroly do 4,8 mmol/l) byla poprvé zjištěna ve věku 8 let. Byla zavedena nízkotučná a nízkocholesterolová dieta a léčba statiny (atorvastatin), ale pro výrazné zhoršení hepatopatie byla léčba nakonec po roce užívání vysazena. V jaterní biopsii provedené v 10 letech věku byla nalezena malokapénková steatóza jater a těžká septální fibróza. Revize histologických preparátů z jaterní biopsie prokázala dále střádající makrofágy ve fibrózních septech a portálních polích a expanzi lysosomálního systému v hepatocytech pomocí imunohistochemického průkazu lysosomálního proteinu kathepsinu D. Enzymatické vyšetření prokázalo deficit aktivity LAL v leukocytech (pacientka 10,3 nmol/mg/hod; kontroly 190–650 nmol/mg/hod). Aktivita chitotriosidázy v plazmě byla na horní hranici rozmezí kontrol (87,7 nmol/ml/hod; kontroly 4,4–89 nmol/ml/hod). I přes dodržovanou dietu, při níž došlo ke stabilizaci jaterních testů a které jsou nyní pouze lehce nad normu, stále přetrvává smíšená hyperlipidemie (celk. chol. 9,48 mmol/l; triacylglyceroly (TAG) 2,13 mmol/l, kontroly 1,0–1,64 mmol/l; HDL--chol. 1,11 mmol/l, kontroly 1,0–1,17 mmol/l; LDL-chol. výpočet 7,41 mmol/l, kontroly 1,8–3,3 mmol/l). Pacientka byla zařazena do studie s podáváním ERT (enzymatic replacement therapy), t. č. po 7 aplikacích rekombinantního enzymu ve 2týdenním intervalu.
Pacient č. 2
Jedná se o 18letého chlapce s negativními perinatálními daty. Chlapec byl bez jakýchkoli obtíží do věku 7 let, kdy byl hospitalizován pro traumatickou perforaci tenkého střeva, pro kterou byla indikována operační revize břicha. Laboratorně byla zjištěna hepatopatie (ALT 1,05 mkat/l; AST 0,9 mkat/l) a smíšená hyperlipidemie (hladina celk. chol. 6,6 mmol/l, LDL-chol. 5,3 mmol/l, TAG 1,4 mmol/l, HDL--chol. 0,66 mmol/l), sonografické vyšetření ukázalo hepatomegalii a peroperačně byla popsána steatóza jater. Byla nasazena nízkotučná dieta a terapie pryskyřicí (Colestid), která byla následně změněna na statiny, kterými je chlapec léčen dosud. Při této terapii došlo ke snížení hypercholesterolemie a hypertriacylglycerolemie (celk. chol. 5,01 mmol/l; TAG 1,94 mmol/l; HDL-chol. 0,81 mmol/l; LDL-chol. 3,33 mmol/l), ale hepatopatie přetrvávala. Ve věku 15 let po návštěvě metabolické ambulance byla potvrzena diagnóza CESD na základě stanoveného deficitu aktivity LAL v leukocytech (pacient 29,8 nmol/mg/hod; kontroly 190–650 nmol//mg/hod). Aktivita chitotriosidázy v plazmě byla nad horní hranicí rozmezí kontrol (pacient 148 nmol/ml/hod; kontroly 4,4–89 nmol//ml/hod). Diagnóza byla podpořena revizí bioptického vzorku s typickým obrazem CESD s mikrovezikulární steatózou, lysosomální akumulací lipidů a perilobulární i intralobulární infiltrací střádajícími makrofágy. Byla přítomna periportální fibróza. Sonograficky i klinicky byla u chlapce potvrzena hepatomegalie s mírně vyšší echogenitou parenchymu jater a hyperechogenním parenchymem sleziny (index of liver size (ILS) 150 ccm, kontroly <89; spleen volume (SV) 300 ccm, kontroly <93) bez nepřímých známek portální hypertenze. Chlapec je od 18 let zařazen do studie s podáváním rekombinantní kyselé lipázy.
Pacient č. 3
Třiadvacetiletý muž je z 2. nekomplikované gravidity, s normálními perinatálními daty. Starší bratr pacienta je zcela zdráv. U mladšího bratra byla potvrzena stejná diagnóza (pacient č. 4). Chlapec byl poprvé vyšetřován pro zvýšenou únavnost, elevaci jaterních testů (ALT 2 mkat/l, AST 1 mkat/l) a mírnou hyperlipidemii (celk. chol. 5,4 mmol/l, TAG 2,21 mmol/l) ve věku 10 let. Byla provedena jaterní biopsie, při které bylo nalezeno výrazné zduření hepatocytů a výskyt velkých pěnitých makrofágů. Imunohistochemické vyšetření lysosomálních markerů ve vzorku jaterní tkáně potvrdilo steatózu lysosomálního původu a střádání v makrofázích. Stupeň fibrózy nebylo ve zbytkovém materiálu dodaném k revizi možné posoudit. Diagnóza CESD byla potvrzena stanovením deficitu aktivity kyselé lipázy v leukocytech (pacient 19 nmol/mg/hod; kontroly 190–650 nmol/mg//hod). Aktivita chitotriosidázy v plazmě byla nad horní hranicí rozmezí kontrol (pacient 199 nmol/ml/hod; kontroly 4,4–89 nmol/ml//hod). Při nasazené nízkotučné dietě se lipidogram téměř normalizoval. V průběhu sledování se objevila systémová hypertenze 1. stupně bez nutnosti antihypertenzní terapie. Subjektivně udával vyšší únavnost, při fyzické aktivitě je však bez limitací. Chlapec byl ve 21 letech věku zařazen do klinické studie s aplikací rekombinantní kyselé lipázy (ERT), v současné době je již po 53 aplikacích ve 2týdenním intervalu. Lipidogram u tohoto pacienta vykázal po zahájení léčby ERT jednoznačné zlepšení. Při poslední kontrole byly sledované parametry v normě (celk. chol. 4,53 mmol/l; TAG 2,34 mmol/l; HDL-chol. 1,28 mmol/l; LDL-chol. 2,2 mmol/l), hepatopatie nebyla přítomna. Sonografické vyšetření břicha ve věku 21 let ukázalo mírnou hepatosplenomegalii (ILS 156 ccm; SV 312 ccm), s podezřením na počínající periportální fibrózu, zatím bez patrných nepřímých známek portální hypertenze. Dieta s omezením tuků byla ponechána. Subjektivně udává pacient od začátku léčby snížení únavnosti.
Pacient č. 4
Jedná se o bratra pacienta č. 3, nyní 14letého. Chlapec je ze 3. fyziologické gravidity s nevýznamnou osobní anamnézou. Diagnóza CESD byla u něho potvrzena na enzymatické úrovni na základě stanoveného deficitu aktivity LAL (pacient 20,3 nmol/mg/hod, kontroly 190–650 nmol/mg/hod) ve věku necelých 4 let po stanovení této diagnózy u staršího bratra. Při diagnóze nebyla jaterní biopsie indikována. Klinický nález je u chlapce zcela v normě, první vyšetření jaterních testů a lipidogramu proběhlo ve věku 4 let (ALT 1,8 mkat/l, AST 1,64 mkat/l, celk. chol. 7,02 mmol/l; TAG 2,19 mmol/l). Ve 13,5 letech během poslední kontroly si chlapec stěžoval na občasnou zvýšenou únavnost, jinak je bez obtíží, dobře prospívá. Po zavedení diety s nízkým obsahem tuků došlo ke snížení hladin lipidů, proto nebyla nasazována terapie hypolipidemiky. Při poslední kontrole u chlapce je laboratorně přítomná pouze hraniční hepatopatie (ALT 0,83 mkat/l; AST 0,65 mkat/l), hypercholesterolemie, hypertriacylglycerolemie přítomná není, HDL-chol. je trvale mírně snížen (celk. chol. 4,86 mmol/l; TAG 1,52 mmol/l; HDL-chol. 0,85 mmol/l; LDL-chol. 3,33 mmol/l), chitotriosidáza v plazmě byla zvýšená (pa-cient 702 nmol/ml/hod; kontroly 4,4–89 nmol//ml/hod). Sonograficky je patrná mírná hepatosplenomegalie bez nepřímých známek portální hypertenze (ILS 169 ccm; SV 202 ccm). Chlapec je také zařazen do programu podávání ERT (enzymatic replacement therapy) rekombinantní kyselou lipázou, nyní je po 3 dávkách.
Pacient č. 5
Jde o 15,5letou dívku s nekomplikovanou perinatální a nevýznamnou rodinnou anamnézou. V roce věku dívka neprospívala (váha 7,8 kg; <1 percentil). Podrobněji vyšetřena však byla až ve věku 23 měsíců, kdy byla zaznamenána hepatomegalie (játra palpačně +4 cm pod žeberní oblouk). Laboratorní vyšetření ukázalo hepatopatii (ALT 1,69 mkat/l; AST 1,5 mkat/l) a smíšenou hyperlipidemii (celk. chol. 7,5 mmol/l; TAG 6,1 mmol/l, HDL-chol. 0,67 mmol/l; LDL-chol. 6 mmol/l). Sonograficky byla přítomna hepatosplenomegalie s vyšší echogenitou jaterního parenchymu. Následovalo provedení jaterní biopsie, kde byla popsána mikrovakuolizace hepatocytů, množství makrofágů s cytoplazmou voštinovitého vzhledu obsahujících materiál typu ceroidu a periportální fibróza. Diagnóza CESD byla potvrzena enzymaticky na základě stanoveného deficitu aktivity LAL v leukocytech (pacient 21,6 nmol/mg/hod; kontroly 190–650 nmol/mg/hod). U dívky byla zavedena nízkotučná dieta a farmakoterapie statiny (Lovastatin 20 mg/den). Při této léčbě došlo k poklesu hodnot lipidogramu (pokles celk. chol. o 30 %), přetrvávala nízká hladina HDL--chol. a elevace transamináz. Upravilo se neprospívání, po 5 letech léčby se váha i výška pohybovaly kolem 50. percentilu. Dívka je subjektivně bez obtíží, stále na terapii statiny a dále i kyselinou ursodeoxycholovou. Přetrvává elevace jaterních transamináz (ALT 1,77 mkat/l; AST 2,01 mkat/l), lipidogram byl při poslední kontrole v 15 letech zcela v mezích normy (celk. chol. 3,94 mmol/l; TAG 0,71 mmol/l; HDL-chol. 1,17 mmol/l; LDL-chol. 2,45 mmol/l). Významná je však progrese jaterního onemocnění s rozvojem portální hypertenze. Hypersplenismus je příčinou trombocytopenie, která byla u dívky poprvé zaznamenána v 11 letech. Později se objevila i leukopenie a koagulopatie s prodloužením aPTT a sníženými hodnotami faktorů XI, XII, přechodně i IX. V klinickém obraze byl popsán nález venektazií charakteru pavoučkových névů a hemangiomu na ruce. Dívka byla zařazena do studie s léčbou rekombinantním enzymem.
Pacient č. 6
Jedná se o nyní 10letého chlapce z fyziologické gravidity, perinatálně i postnatálně bez komplikací. Do první hospitalizace k provedení jaterní biopsie ve 3,5 letech byl 3krát ambulantně vyšetřen pro hepatopatii nejasné etiologie, nasazen byl Sylimarin. Při fyzikálním vyšetření byla popsána hepatomegalie, která byla potvrzena i sonograficky se změněnou echogenitou jater a přítomností splenomegalie. Laboratorní výsledky prokázaly elevaci jaterních transamináz (ALT 1,24 mkat/l; AST 1,21 mkat/l) a mírnou hyperlipidemii (celk. chol. 5,95 mmol/l; TAG 0,71 mmol/l; HDL--chol. 1,02 mmol/l; LDL-chol. 4,61 mmol/l). V provedené jaterní biopsii dominovala uniformní mikrovakuolizace cytoplazmy hepatocytů a v dif. dg. bylo pomýšleno nejprve na glykogenózu. Stanovením aktivity LAL v leukocytech však byla potvrzena dg. CESD, aktivita LAL byla snížena na 19,5 % průměru hodnot u kontrol (pacient 66,2 nmol/mg/hod; kontroly 190–650 nmol/mg/hod). Při revizi histologického nálezu byl v jaterním vzorku potvrzen obraz lysosomálního střádání v hepatocytech a makrofázích typický pro CESD. Byla přítomna mírná portální fibróza. Terapeuticky byly nasazeny statiny v dávce 10 mg/den a byla zahájena dieta s omezením tuků. Při této léčbě se hladiny cholesterolu upravily (celk. chol. 4,74 mmol/l; TAG 0,81 mmol/l; HDL-chol. 0,81 mmol/l; LDL-chol. 3,57 mmol/l). V dalším průběhu jsme zaznamenali přechodné zhoršení hepatopatie (ALT 2,28 mkat/l; AST 2,23 mkat/l), stále ale přetrvává zvýšení transamináz. Chlapec je bez subjektivních obtíží. Při poslední kontrole ve věku 10 let byly u chlapce zaznamenány větší hmotnostní přírůstky 46,8 kg (proporčně k výšce 97. percentil), 145 cm (70. percentil), BMI 22 (98. percentil). Na doporučené redukční dietě se podařilo normalizovat tělesnou hmotnost. V současné době je chlapec zařazen do studie s podáváním rekombinantní kyselé lipázy.
Metody
Izolace leukocytů a příprava vzorku na stanovení aktivity LAL
Leukocyty byly izolovány z periferní krve odebrané do zkumavek s EDTA metodou dextranové sedimentace [8]. Homogenát leukocytů byl ve vodě připraven pomocí ponorného ultrazvukového homogenizátoru za chlazení v ledové drti. Koncentrace proteinu byla stanovena metodou podle Hartree [9].
Stanovení aktivity LAL (EC 3.1.1.13)
Aktivita lysosomální kyselé lipázy v leukocytech byla stanovena použitím arteficiálního fluorogenního substrátu 4-methylumbelliferyl-palmitátu (Sigma M 7259) [10]. Roztok substrátu (0,3 mM) v reakčním pufru (0,8 M acetátový pufr, pH 4) se inkuboval s homogenátem leukocytů (4 µg proteinu) 20 minut při 37 °C. Aktivní LAL odštěpuje z fluorogenního substrátu esterickou vazbou vázaný palmitát a současně tím uvolní fluorogen 4-methylumbelliferon. Fluorescence kalibrační křivky a enzymovou reakcí uvolněného 4-methylumbelliferonu (4-MU) byla měřena na fluorimetru Perkin-Elmer LS55 při excitační vlnové délce 365 nm a emisní vlnové délce 448 nm. Specifická aktivita enzymu je vyjádřena v nmol 4-MU uvolněného ze substrátu 1 mg proteinu za 1 hodinu.
Výsledky
V ČR bylo diagnostikováno za období 1975–2013 19 pacientů s CESD a 1 pacient s Wolmanovou nemocí. Vypočtená prevalence CESD v ČR je 1 : 322 000. Pacient s Wolmanovou nemocí zemřel ve věku 1 měsíce. U tohoto pacienta byla původní dg. Niemannovy-Pickovy nemoci typu A revidována na základě analýzy autoptického materiálu po 25 letech od jeho úmrtí [11].
Do této studie bylo zařazeno 6 pacientů, kteří zůstali v péči pražského a olomouckého pracoviště. Kazuistika pacientky č. 5 již byla publikována [12]. Sledovaný soubor byl srovnán se dvěma největšími dosud popsanými soubory pacientů s CESD ve světě (206 případů) [6, 13]. Oba soubory se však s největší pravděpodobností překrývají, menší soubor obsahuje pouze pacienty dětského věku. Výsledky klinických i laboratorních dat jsou shrnuty v tabulce 1.
Tab. 1. Srovnání klinických a laboratorních projevů 6 českých a 206 zahraničních pacientů s CESD. 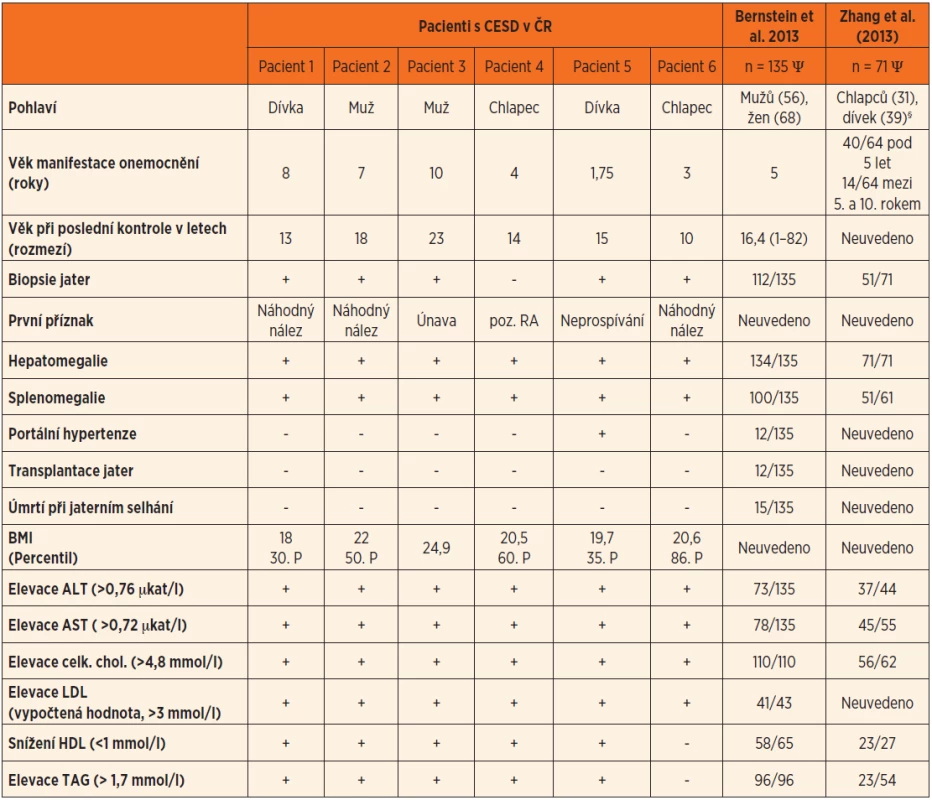
Zkratky: § – u 1 pacienta pohlaví nebylo uvedeno; AST – aspartát aminotransferáza; ALT – alanin aminotransferáza; TAG – triacylglycerol; HDL – high density cholesterol; LDL – low density cholesterol; Ψ – celkový počet pacientů je 206, pacienti z obou souborů se s největší pravděpodobností překrývají, menší soubor je složen z dětských pacientů Průměrný věk našich pacientů je nyní 15,5 ± 4,5 let. Onemocnění se manifestovalo v průměru v 5,5 letech hepatosplenomegalií, hepatopatií (zvýšeným ALT i AST, průměrně 2krát a 1,7krát nad horní hranici normy, resp.) a hypercholesterolemií (1,3krát nad normu) se zvýšením triacylglycerolů a LDL - a sníženým HDL-cholesterolem. Klinický stav pa-cientů je stacionární, u jedné pacientky jsou biochemické, klinické a sonografické známky portální hypertenze s hypersplenismem. Histologicky je onemocnění u poloviny pacientů jen mírně progredující, u 3 pacientů je však již rozvinutá jaterní fibróza, u jedné pacientky (10 let) až s přechodem do cirhózy. U všech pacientů byla diagnóza CESD stanovena na enzymatické úrovni průkazem výrazně snížené aktivity LAL v izolovaných leukocytech (rozmezí aktivit LAL u pacientů je 10,3––66,2 nmol/mg/hod, kontroly 190–650 nmol//mg/hod) a typickým histologickým obrazem ve vzorku jaterní biopsie. Reziduální aktivita LAL v našem souboru byla v rozmezí 3–19,5 % průměru kontrolních hodnot. Zbytková aktivita LAL však nekorelovala s tíží kliniky či histologie. Zařazení do studie k léčbě intravenózní aplikací rekombinantního enzymu (ERT) ve dvoutýdenním intervalu probíhá již u všech 6 pacientů. Terapie ERT vedla u prvního nejdéle léčeného pacienta k normalizaci lipidogramu i hepatopatie. U ostatních pacientů je délka léčby k hodnocení úspěšnosti velmi krátká.
Diskuse
Za období téměř 40 let bylo diagnostikováno v ČR pouhých 20 pacientů. U jednoho chlapce se jednalo o letální Wolmanovu nemoc, u 19 pacientů o fenotyp CESD. Vypočtená prevalence CESD v ČR (1 : 322 000) [14] kontrastuje s prediktivní prevalencí 1 : 40 000 v kavkazské populaci odhadované na základě výskytu prevalentní mutace E8SJM (Exon 8 Splice Junction Mutation) v genu LIPA. Deficit LAL (CESD a Wolmanova choroba) v populaci by měl tudíž dosahovat téměř stejného výskytu jako například Wilsonova nemoc [15]. Jedná se tedy o onemocnění nejen v ČR silně poddiagnostikované. V tomto článku předkládáme klinická, laboratorní i histologická data 6 pacientů (nyní ve věku 10–23 let) s diagnózou CESD a porovnáváme jejich fenotyp s největšími dosud publikovanými soubory pacientů [6, 13]. Onemocnění se manifestovalo u našich pacientů v průměru v 5,5 (± 3,2) letech, což je v souladu s literaturou. Manifestace choroby v dospělosti je spíše vzácným jevem [13], velmi často se jedná spíše o atenuované či oligosymptomatické formy. Podle dostupné literatury se v průběhu adolescence či dospělosti manifestuje pouze zhruba 10 % případů. Toto procento může být vzhledem ke snížené diagnostice v ČR vyšší, ojediněle je diagnóza stanovena i post mortem. U všech našich pacientů se objevily příznaky typické pro toto onemocnění, nejčastěji kombinace hepatopatosplenomegalie a smíšené hyperlipidemie (obraz hyperlipidemie typ II). Další v literatuře popisované příznaky především gastrointestinální (zvracení, průjem, bolesti břicha, malabsorpce, krvácení do gastrointestinálního traktu nebo onemocnění žlučníku) či jiné (renální nebo adrenální kalcifikace, anemie) nebyly u našich pacientů přítomny [6, 13].
Postižení jater
Postižení jater je vedoucím a obvykle prvním příznakem CESD. Klinickým projevem je hepatomegalie, která se objevuje téměř ve 100 % případů. Typickým laboratorním projevem je elevace transamináz (ALT, AST) vyskytující se u všech postižených. Nejčastěji je v literatuře pozorováno zvýšení hodnot cca 1,5krát nad normu, někdy i dvojnásobné zvýšení AST oproti ALT [6]. V našem souboru pozorujeme stejné navýšení hodnot jaterních transamináz (ALT 1,9 ± 0,4, AST 1,6 ± 0,5 mkat/l) bez popisovaného vyššího poměru AST oproti ALT (ALT v průměru 2krát nad normu, AST 1,7krát nad normu). Toto navýšení nemusí být konstantní, někdy pozorujeme hodnoty odpovídající více než stonásobku normy, často však hodnoty kolísají v čase i k normálním hodnotám [13]. Hepatomegalie a elevace transamináz se vyskytly u 100 % našich pacientů (u 99,3 % a 100 % pacientů v největších souborech, Bernstein et al. 2013; Zhang et al. 2013 resp.) [6, 13], z nichž u 4 (67 %) byly manifestními znaky. Hepatomegalie a hepatopatie vzniklá na podkladě akumulace esterů cholesterolu a triacylglycerolů v jaterním parenchymu zvolna vede k jaternímu selhávání a progreduje do obrazu jaterní fibrózy až cirhózy. Frekvence komplikací, jako je portální hypertenze a progrese do cirhózy s nutností transplantace jater, je u postižených okolo 9 % [13]. V téměř stejné míře dochází i k úmrtí v důsledku jaterního selhání. Transplantace je indikována u pacientů často již od předškolního věku, úmrtí v důsledku jaterního selhání se vyskytlo od dětství až po dospělost, v 50 % došlo k úmrtí do 21. roku života [13]. Žádný z našich pacientů není v současné době zařazen do transplantačního programu. Pouze u jedné dívky byla verifikována rozvinutá portální hypertenze s koagulopatií již ve věku 11 let, přesto v současné době nesplňuje indikační kritéria pro zařazení do čekací listiny k transplantaci jater. Byly popsány pouze dva případy nálezu hepatocelulárního karcinomu u pacientů s CESD, v jednom případě byla diagnóza CESD takto náhodně stanovena [16, 17]. Tíže hepatopatie nekoreluje s mírou enzymatické aktivity kyselé lipázy a běžně používaná terapie hypolipidemiky nemá z dlouhodobého prognostického hlediska žádný vliv na progresi jaterního selhání [3, 13, 16]. V širší diferenciální diagnostice hepatosplenomegalie je nutné pomýšlet i na jiná střádavá lysosomální onemocnění. U naprosté většiny lysosomálních onemocnění vede akumulace nedegradovatelného materiálu k hepatopatii, ne však až k obrazu cirhózy, která je typická pro CESD [16, 18]. Ke správné diagnóze přispívá i typický histologický obraz.
Histologický obraz jater při CESD
Diagnóza CESD může být s vysokou mírou spolehlivosti potvrzena na základě typického histologického obrazu (obr. 1). Makroskopicky mají játra žlutavý či oranžový vzhled, což bylo pozorováno i u našeho pacienta, kde byla provedena otevřená jaterní biopsie. Histologicky je typickým nálezem malokapénková (mikrovezikulární) steatóza postihující rovnoměrně celý jaterní lobulus. Steatóza mikrovezikulárního typu je méně častá než makrovezikulární (velkokapénková), která je charakteristickým nálezem např. při nealkoholické steatóze jater (NAFLD) u obézních dětí, jejichž počet v populaci neustále narůstá. Mikrovezikulární steatóza se naproti tomu vyskytuje např. u dědičných poruch beta-oxidace mastných kyselin nebo poruch mitochondriálního energetického metabolismu. Intralysosomální lokalizace střádaných neutrálních lipidů v hepatocytech u CESD, v běžných histologických barveních neodlišitelná od cytosolické mikrovezikulární steatózy, je prokazatelná pomocí imunohistochemické detekce markerů lysosomálního systému, jako jsou LAMP1, LAMP2 nebo kathepsin D [7]. Diagnózu CESD dále podporuje nález pěnitých makrofágů obsahujících autofluorescentní, PAS pozitivní ceroidní materiál. Lysosomální lokalizace střádaných lipidů u CESD je patrná rovněž při vyšetření pomocí elektronové mikroskopie, kde nalézáme kolem tukových kapének jednoduchou limitující membránu. V kryostatických řezech je možné prokázat akumulaci esterů cholesterolu v makrofázích a hepatocytech pomocí dvojlomu polarizovaného světla, které tyto krystaly vykazují. Nález mikrovezikulární steatózy se u CESD vyskytuje již v dětském věku, postupně se zvyšuje množství střádavých makrofágů a hepatopatie progreduje do fibrózy, méně často s přechodem až do jaterní cirhózy [6, 7, 19]. Lysosomální střádání lipidů pak vede k elevaci chitotriosidázy. Rozsah a závažnost histologického nálezu nekoreluje s věkem ani genotypem pacienta [20]. Bez kauzální terapie je onemocnění i jeho korelace v histologickém obraze trvale progresivní [21]. U všech našich bioptovaných pacientů byly v histologickém obraze přítomny výše uvedené patognomonické znaky. Na základě histologie byla u jedné pacientky ve věku 10 let diagnostikována již rozvinutá jaterní fibróza 3. stupně. U pa-cientky s fibrózou 2. stupně, které byly v době tohoto bioptického nálezu 2 roky, klinický nález v dalších letech progredoval a vyvinul se obraz portální hypertenze.
Obr. 1. Typický nález jaterní biopsie u 2leté dívky s diagnózou CESD. (A) Mikrovezikulární uniformní steatóza hepatocytů. Masivní infiltrace portálního pole střádajícími makrofágy a portální fibróza. Barvení HE, zvětšení 20x. (B) Imunohistochemická detekce lysosomálního markeru LAMP2 demonstrující výraznou expanzi lysosomálního systému hepatocytů a intralysosomální lokalizaci střádaných kapének neutrálních lipidů. Zvětšení 20x. Fig. 1. Fig. 1. Typical finding of liver biopsy in a 2-year girl with CESD diagnosis. (A) Microvesicular uniform steatosis of hypatocytes. Massive infiltration of the portal field by storing macrophages and signs of portal fibrosis are apparent. HE staining, objective 20-fold. (B) Immunohistochemical detection of lysosomal marker LAMP2 demonstrating a marked expansion of the hepatocyte lysosomal system and intralysosomal localization of the stored droplets of neutral lipids. Objective 20-fold. 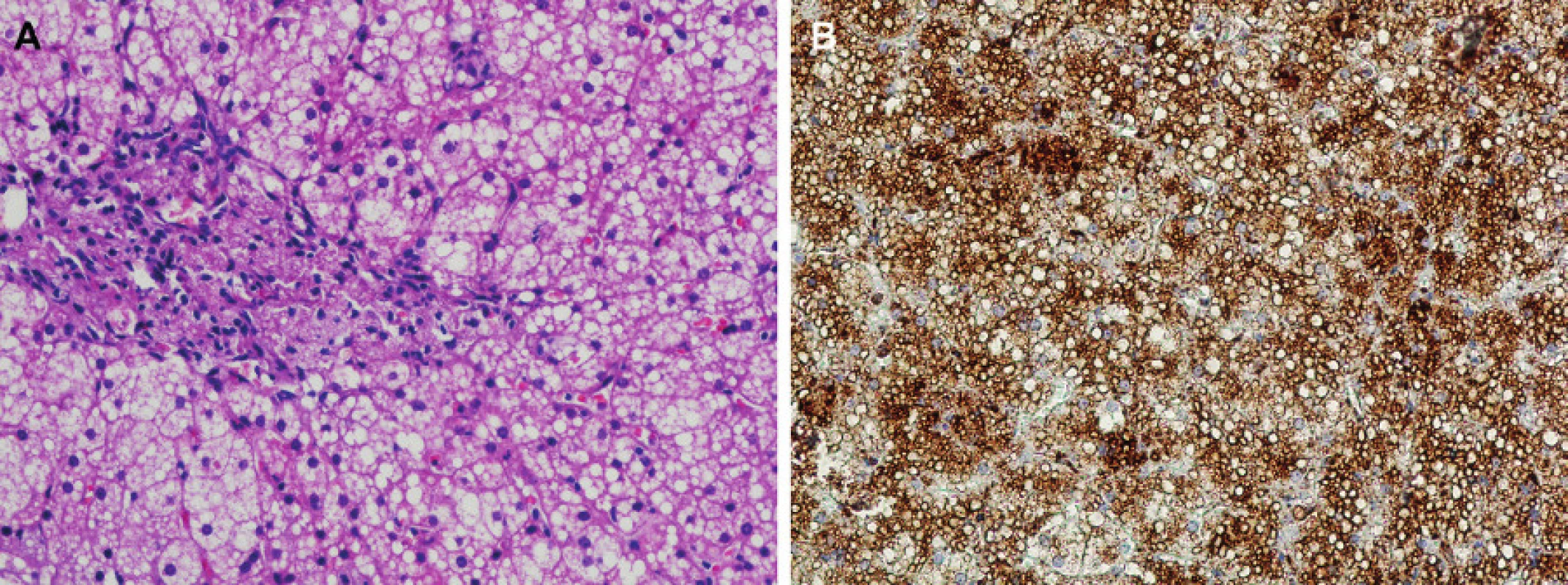
Hyperlipidemie/dyslipidemie
Jak bylo již zmíněno výše, CESD je onemocnění způsobené deficitem LAL, enzymu hydrolyzujícího estery cholesterolu a triacylglyceroly. Vzniká tak cholesterol neesterifikovaný, který je dále zpracováván zejména jaterní buňkou. Nedostatek volného (neesterifikovaného) cholesterolu způsobuje elevaci jeho endogenní syntézy a vede k hypercholesterolemii [2, 3, 5]. Zbytková aktivita LAL pak sice do určité míry stačí k vytvoření dostatku neesterifikovaného cholesterolu pro potřeby organismu, nezabrání však akumulaci esterů cholesterolu a triacylglycerolů v buňkách a tkáních [22]. Typickým projevem CESD je smíšená hyperlipidemie (hypercholesterolemie, hypertriacylglycerolemie a zvýšení LDL-cholesterolu), která byla dříve klasifikována podle Fredricksona jako typ II. Poměrně charakteristické je u CESD snížení HDL-cholesterolu, ke kterému dochází v důsledku nedostatku membránového transportéru lipidů (ABCA1 transportér, tj. ATP – binding cassette transporter A1). Ten je suprimován díky nadbytku cholesterolu v buňce, především intralysosomálně [23]. Stejné nálezy v lipidogramu byly pozorovány i u našich sledovaných pacientů. Ve 100 % případů byla nalezena hypercholesterolemie, jednalo se o zvýšení v průměru 1,3krát nad normu, maximální naměřená hodnota celkového cholesterolu byla 2,2krát vyšší než norma, zvýšení může být ale až 4násobné [6]. Průměrné hodnoty celk. chol. a TAG dosahovaly u našich pacientů 7 ± 1,5 mmol/l a 2,8 ± 1,5 mmol/l, resp. Během sledování u 5 ze 6 pacientů hodnota klesla k normě, jen u pacientky č. 1 přetrvává výraznější perzistentní hypercholesterolemie (terapie hypolipidemiky byla pro nežádoucí výraznou elevaci transamináz vysazena, ani v průběhu terapie však k významnému poklesu nedocházelo). Ve všech případech byla zaznamenána i zvýšená LDL frakce cholesterolu (rozmezí 1,83–8,86, kontroly <3,3 mmol/l). Elevace triacylglycerolu a snížená hladina HDL byla přítomná u 83 % pacientů v našem souboru. Perzistující nízké hladiny HDL-cholesterolu (<1 mmol/l) byly v souboru pacientů zaznamenány pouze u jednoho pacienta, u zbylých byla alespoň 1krát naměřena hladina v mezích normy.
Předčasná ateroskleróza
Je obecně známo, že proaterogenní profil lipidů u pacientů s deficitem LAL je příčinou předčasné aterosklerózy a z toho rezultující vyšší incidence myokardiálních a cerebrálních ischemií. V dětském věku není předčasná ateroskleróza ještě plně rozvinuta, proto se v naprosté většině případů diagnostika týká pacientů spíše ve vyšším věku, nezřídka se takto může choroba manifestovat u oligo-symptomatických forem. Existují i důkazy o tom, že polymorfismy v genu pro kyselou lipázu mají přímou souvislost s předčasnou aterosklerózou a jinými komplikacemi v rámci tzv. metabolického syndromu u non-CESD pacientů [24]. K dispozici jsou však pouze omezená data týkající se vlivu hypolipidemické terapie na rozvoj předčasné atrosklerózy a zabránění vzniku koronární vaskulární choroby [2, 16]. U jednoho z našich pacientů se vyvinula arteriální hypertenze 1. stupně, která je zatím ponechána bez farmakoterapie.
Terapie hypolipidemiky a ERT
Dietou s omezením tuků a cholesterolu jsou léčeni všichni pacienti v našem souboru, polovina z nich je léčena dlouhodobě statiny. Hypolipidemická terapie statiny není kauzální a nemá vliv na progresi jaterního postižení ani regresi hepatomegalie. Vliv na snížení proaterogenních hladin lipidogramu se ukázal jako významný (dlouhodobá terapie statinem prokázala cca 13% snížení hladiny celkového cholesterolu), dále potencovaný kombinací s ezetimibem (další cca 9% snížení hladiny celkového cholesterolu) [3]. Monoterapie statiny je aplikována u poloviny našich pacientů (u další pacientky byla terapie krátce po zahájení vysazena pro výraznou elevaci transamináz), u jiného pacienta naopak s velmi dobrým efektem a normalizací lipidogramu po zavedení léčby, u dalších dvou pouze s parciálním efektem, se stále kolísajícími hladinami lipidů v krvi bez trvalé normalizace. Kauzální metodou léčby je intravenózní aplikace rekombinantního enzymu (sebelipáza alfa) ve dvoutýdenním intervalu. Zatím tato léčba probíhá formou klinické studie, do které je zařazeno 6 našich pacientů. Nejdéle léčeným nemocným je pacient č. 3 po 53 aplikacích rekombinantního enzymu s velmi dobrým efektem jak na normalizaci lipidogramu, tak na regresi hepatopatie. U dalších pacientů byla léčba rekombinantním enzymem v nedávné době zahájena, zatím bez možnosti hodnotit efekt terapie. Tolerance terapie je podle prvotních výsledků velmi dobrá, bez závažných vedlejších účinků či rozvoje specifických protilátek proti rekombinantnímu enzymu. Obdobné výsledky byly pozorovány u dalších 8 zahraničních pacientů. Hepatopatie se upravila u všech pacientů. K normalizaci hladin tuků v krvi došlo po prvotním navýšení podílu sérových lipidů, v důsledku jejich vyplavení do řečiště z jaterního parenchymu [25].
Diagnostika CESD
U všech pacientů byla dg. CESD stanovena enzymaticky průkazem výrazně snížené aktivity LAL v izolovaných leukocytech (aktivita LAL v našem souboru byla v rozmezí 10,3–66,2 nmol/mg/hod, průměrná aktivita LAL u pacientů byla 27,86 nmol/mg/hod, kontroly 190–650 nmol/mg/hod) a typickým nálezem ve vzorku jaterní biopsie (obr. 1).
Reziduální aktivita LAL v leukocytech pacientů byla v rozmezí 3,0–19,5 % průměru kontrolních hodnot, průměrná reziduální aktivita v souboru pacientů byla 8,2 %. Pro usnadnění diagnostiky se v současné době připravuje screeningová metoda na stanovení aktivity LAL v suché krevní kapce [26]. V této metodě se však používá komerčně zatím nedostupný specifický inhibitor LAL Lalistat 2, který poskytla firma Synageva BioPharma Corp. V budoucnu bude využití metody závislé na dostupnosti tohoto inhibitoru.
Závěr
Nedostatečný záchyt a pozdní rozpoznání klinických příznaků této choroby vedou k pozdní diagnostice, k její progresi a nevratným změnám v důsledku nemožnosti včasného zahájení potenciálně efektivní léčby pacientů s CESD, tj. aplikací ERT (enzymatické substituční terapie) rekombinantní kyselou lipázou.
Použité zkratky:
CESD – Cholesterol Ester Storage Disease (nemoc ze střádání esterů cholestrolu)
LAL – lysosomální kyselá lipáza
celk. chol. – celkový cholesterol
TAG – triacylglyceroly
LDL-chol. – lipoproteiny s nízkou denzitou (Low Density Lipoprotein cholesterol)
HDL-chol. – lipoproteiny s vysokou denzitou (High Density Lipoprotein cholesterol)
ERT – Enzyme Replacement Therapy (ezymatická substituční terapie)
Poděkování
Práce vznikla s podporou projektu RVO-VFN64165/2012 VFN a PRVOUK-P24/LF1/3 v Praze.
Došlo: 24. 2. 2014
Přijato: 9. 4. 2014
Doc. MUDr. Tomáš Honzík, Ph.D.
Klinika dětského a dorostového
lékařství UK 1. LF a VFN
Ke Karlovu 2
128 08 Praha 2
e-mail: tomas.honzik@vfn.cz
Zdroje
1. Sloan RH, Fredrickson DS. Enzyme deficiency in cholesteryl ester storage idisease. J Clin Invest 1972 Jul; 51 (7): 1923–1926.
2. Fouchier SW, Defesche JC. Lysosomal acid lipase A and the hypercholesterolaemic phenotype. Curr Opin Lipidol 2013; 24 (4): 332–338.
3. Tadiboyina VT, Liu DM, Miskie BA, et al. Treatment of dyslipidemia with lovastatin and ezetimibe in an adolescent with cholesterol ester storage disease. Lipids Health Dis 2005; 4 : 26.
4. Hoeg JM, Demosky SJ Jr, Pescovitz OH, et al. Cholesteryl ester storage disease and Wolman disease: phenotypic variants of lysosomal acid cholesteryl ester hydrolase deficiency. Am J Hum Genet 1984 Nov; 36 (6): 1190–1203.
5. Cummings MH, Watts GE. Increased hepatic secretion of very-lowdensity lipoprotein apolipoprotein B-100 in cholesteryl ester storage disease. Clin Chem 1995; 41 : 1114.
6. Zhang B, Porto AF. Cholesteryl Ester Storage Disease: Protean presentations of lysosomal acid lipase deficiency. Hepatology and Nutrition 2013; 56 : 682–685.
7. Hulkova H, Elleder M. Distinctive histopathological features that support a diagnosis of cholesterol ester storage disease in liver biopsy specimens. Histopathology 2012; 60 (7): 1107–1113.
8. Skoog WA, Beck WS. Studies on the fibrinogen, dextran and phytohemagglutinin methods of isolating leukocytes. Blood 1956; 11 : 436–454.
9. Hartree EF. Determination of protein: A modification of the lowry method that gives a linear photometric response. Analytical Biochemistry 1972; 48 : 422–427.
10. Guy GJ, Butterworth J. Acid esterase activity in cultured skin fibroblasts and amniotic fluid cells using 4-methylumbelliferyl palmitate. Clin Chim Acta 1978; 84 : 361–371.
11. Elleder M, Poupĕtová H, Ledvinová J, et al. Lysosomal acid lipase deficiency. Overview of Czech patients. Čas Lék čes 1999 Nov 29; 138 (23): 719–724.
12. Smolka V. Nemoc ze střádání esterů cholesterolu – efekt dlouhodobé léčby lovastatinem. Čes a Slov Gastroent a Hepatol 2007; 61 (1): 30–33
13. Bernstein DL, Hulkova H, Bialer MG, et al. Cholesteryl ester storage disease: review of the findings in 135 reported patients with an underdiagnosed disease. J Hepatol 2013; 58 : 1230–1243.
14. Poupětová H., Ledvinová J., Berná L, et al. The birth prevalence of lysosomal storage disorders in the Czech Republic: comparison with data in different populations. J Inherit Metab Dis 2010 Aug; 33 (4): 387–396.
15. Olivarez L, Caggana M, Pass KA, et al. Estimate of the frequency of Wilson’s disease in the US Caucasian population: a mutation analysis approach. Ann Hum Genet 2001; 65 : 459–463.
16. Elleder M, Chlumská A, Hyánek J, et al. Subclinical course of cholesteryl ester storage disease in an adult with hypercholesterolemia, accelerated atherosclerosis, and liver cancer. J Hepatol 2000; 32 : 528–534.
17. Riva S, Spada M, Sciveres M, et al. Hepatocarcinoma in a child with cholesterol ester storage disease. Dig Liver Dis 2008 Sep; 40 (9): 784.
18. vom Dahl S, Mengel E. Lysosomal storage diseases as differential diagnosis of hepatosplenomegaly. Best Pract Res Clin Gastroenterol 2010 Oct; 24 (5): 619–628.
19. Tylki-Szymańska A, Rujner J, Lugowska A, et al. Clinical, biochemical and histological analysis of seven patients with cholesteryl ester storage disease. Acta Paediatr Jpn 1997; 39 : 643–646.
20. Elleder M, Ledvinová J, Cieslar P. Subclinical course of cholesterol ester storage disease (CESD) diagnosed in adulthood. Report on two cases with remarks on the nature of the liver storage process. Virchows Arch A Pathol Anat Histopathol 1990; 416 : 357–365.
21. Lohse P, Maas S, Lohse P, et al. Compound heterozygosity for a Wolman mutation is frequent among patients with cholesteryl ester storage disease. J Lipid Res 2000 Jan; 41 (1): 23–31.
22. Fasano T, Pisciotta L, Bocchi L, et al. Lysosomal lipase deficiency: molecular characterization of eleven patients with Wolman or cholesteryl ester storage disease. Mol Genet Metab 2012; 105 (3): 450–456.
23. Bowden KL, Bilbey NJ, Bilawchuk LM, et al. Lysosomal acid lipase deficiency impairs regulation of ABCA1 gene and formation of high density lipoproteins in cholesteryl ester storage disease. J Biol Chem 2011 Sep 2; 286 (35): 30624–30635.
24. Guénard F, Houde A, Bouchard L, et al. Association of LIPA gene polymorphisms with obesity-related metabolic complications among severely obese patients. Obesity 2012 Oct; 20 (10): 2075–2082.
25. Balwani M, Breen C, Enns GM, et al. Clinical effect and safety profile of recombinant human lysosomal acid lipase in patients with cholesteryl ester storage disease. Hepatology 2013; 58 (3): 950–957.
26. Hamilton J, Jones I, Srivastava R, et al. A new method for the measurement of lysosomal acid lipase in dried blood spots using inhibitor Lalistat 2. Clin Chim Acta 2012; 413 : 1207–1210.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek Opožděné dospívání u chlapce
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2014 Číslo 3- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Monitorovanie diagnostiky a epidemiológia RSV infekcií na Slovensku
- Výskyt anemie a význam měření hladiny hepcidinu metodou ELISA u dětí s nespecifickými střevními záněty
- Nemoc ze střádání esterů cholesterolu (CESD): klinická, laboratorní a histologická charakteristika šesti pacientů
-
Za doc. MUDr. Evou Pařízkovou, CSc.
29. 3. 1942 – 27. 6. 2014 - 70 let methotrexátu v léčbě autoimunitních a nádorových onemocnění
- Asymptomatická hyperurikémia pri hypertenzii u mladistvých
- Prehľad a návrh klasifikácie vrodených anomálií týmusu u detí
- Předčasný vývoj genitálu u chlapce
- Opožděné dospívání u chlapce
- Gynekomastie (zduření prsní žlázy u chlapce)
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Gynekomastie (zduření prsní žlázy u chlapce)
- Opožděné dospívání u chlapce
- Prehľad a návrh klasifikácie vrodených anomálií týmusu u detí
- 70 let methotrexátu v léčbě autoimunitních a nádorových onemocnění
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



