-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Akutní a pozdní nežádoucí účinky léčby septických nedonošených novorozenců gentamicinem v prvním týdnu života - otevřená prospektivní studie (část II)
Acute and delayed adverse effects of gentamicin in the treatment of premature neonates with sepsis during the first postnatal week – an open prospective study (part II)
Aim:
To evaluate the adverse effects of an aminoglycoside antibiotic gentamicin in the treatment of premature neonates with sepsis during the first postnatal week and their relationship to pharmacokinetics and clinical characteristics of neonates.Methods:
Neonates were stratified according to gestational age (GA) into the groups of very preterm (the group S1, GA=25–33 weeks, N=32) and preterm (the group S2, GA=34–38 weeks, N=22). Each of the two groups was further divided in two subgroups of neonates with and without persistent ductus arteriosus (PDA, 18 in S1 a 4 in S2). Biochemical markers of an acute glomerular and tubular dysfunction were evaluated before the initiation of pharmacotherapy with Ge and thereafter. The follow-up investigations performed during the first year and between the 2nd and 5th year of age included the examinations for cochlear ototoxicity using transient otoacoustic emission and nephrocalcinosis with the help of ultrasonography.Results:
The proportion of neonates with glomerular dysfunction was higher in the group S1 than S2 (16/32 vs. 4/22; p<0.05). Serum concentrations of creatinine and urea and fractional sodium excretion in urine raised with decreasing GA (P<0.001), whereas PDA exerted no influence. In all four groups, pharmacotherapy with Ge resulted in the elevation of the ratio of calcium to creatinine urinary concentrations and of the fractional urinary excretion of magnesium (2 - to7-fold, P<0.01). The correlation between the biochemical parameters under the study and Ge concentrations were weak. Nephrocalcinosis was detected in two out of 46 children undergoing sonography and cochlear toxicity was absent.Conclusions:
Acute renal dysfunction is relatively modest and transient in most of premature neonates treated in the intensive care unit. Pharmacotherapy with Ge results, among other effects, in the increase of calcium excretion in urine. This hypercalciuric adverse effect contributes to other risk factors for nephrocalcinosis. Long-term follow-up of kidney function seems warranted because chronic renal dysfunction can develop in a minority of children.Key words:
preterm neonate, sepsis, gentamicin, renal dysfunction, nephrocalcinosis, perzistent ductus arteriosus P.
Autoři: P. Pokorná 1; J. Záhora 3; V. Vobruba 1; O. Černá 1; P. Srnský 1; D. Lorenčík 1; P. Klement 1; L. Blažková 4; J. Martinková 2; J. Chládek 2
Působiště autorů: Jednotka intenzivní a resuscitační péče Kliniky dětského a dorostového lékařství UK 1. LF a VFN, Prahapřednosta prof. MUDr. J. Zeman, DrSc. 1; Ústav farmakologie, Lékařská fakulta Univerzity Karlovy, Hradec Královépřednosta doc. MUDr. S. Mičuda, Ph. D. 2; Ústav lékařské biofyziky, Lékařská fakulta Univerzity Karlovy, Hradec Královépřednosta doc. ing. J. Hanuš, Ph. D. 3; StatSoft CR s. r. o., Praha 4
Vyšlo v časopise: Čes-slov Pediat 2014; 69 (4): 213-227.
Kategorie: Původní práce
Souhrn
Účel studie:
Zhodnotit nežádoucí účinky léčby septických nedonošených novorozenců v prvním týdnu života aminoglykosidovým antibiotikem gentamicinem (Ge) a analyzovat jejich vztah k farmakokinetice a klinickým charakteristikám.Metody:
Novorozenci byli rozděleni do skupin podle gestačního věku na velmi nedonošené (skupina S1, GA = 25–33 týdnů, n = 32) a mírně nedonošené (skupina S2, GA = 34–38 týdnů, n = 22) a dále na podskupiny podle přítomnosti perzistujícího ductus arteriosus (PDA, 18 v S1 a 4 v S2). Před a po zahájení podávání Ge byly vyšetřovány biochemické ukazatele glomerulární a tubulární dysfunkce. Kochleární ototoxicita byla zjišťována metodou tranzientní otoakustické emise a nefrokalcinóza sonografickým vyšetřením ledvin v 1. až 5. roce věku.Výsledky:
Výskyt glomerulární dysfunkce byl vyšší ve skupině S1 ve srovnání se skupinou S2 do 7. dne od zahájení léčby (16/32 vs. 4/22; p <0,05). Koncentrace kreatininu a močoviny a frakční exkrece sodíku se zvyšovaly s klesajícím GA (p <0,001), zatímco PDA je neovlivnil. Během podávání Ge došlo ke zvýšení poměru koncentrací vápníku a kreatininu v moči a frakční exkrece hořčíku (2 až 7krát, p <0,01) ve všech skupinách. Korelace mezi sledovanými parametry a koncentrací GE byly netěsné. Nefrokalcinóza byla prokázána pouze u 2 ze 46 vyšetřených dětí a kochleární toxicita se nevyskytla.Závěry:
Renální dysfunkce nedonošených novorozenců je většinou relativně mírného stupně a přechodná. Vlivem Ge dochází k vzestupu exkrece vápníku do moči, což se spolu s dalšími faktory podílí na zvýšeném riziku nefrokalcinózy. Periodické vyšetřování parametrů renální funkce je u předčasně narozených dětí důležité, protože u některých se může rozvinout chronické poškození ledvin.Klíčová slova:
nezralý novorozenec, sepse, gentamicin, renální dysfunkce, nefrokalcinóza, perzistující ductus arteriosusÚVOD
Gentamicin (Ge) je aminoglykosidové baktericidní antibiotikum používané u novorozenců v léčbě sepse v kombinaci s betalaktamovými antibiotiky [1–3]. Výhodou Ge je rychlá baktericidie zejména gramnegativních bakterií a nízká pořizovací cena [4]. Podává se 30minutovou i.v. infuzí. Léčivo rychle proniká extravaskulárně především do intersticiální tekutiny a vylučuje se v metabolicky nezměněné formě převážně ledvinami [5]. Nevýhodou Ge je riziko nefrotoxicity a ototoxicity. Nefrotoxicita postihuje glomeruly a/nebo tubuly. Tubulární toxicita se rozvíjí v důsledku kumulace léčiva v buňkách proximálního tubulu [6]. Mechanismy, které se podílejí na časné nefrotoxicitě, jsou závislé na dávce [7]. Dochází k různě závažné renální dysfunkci až k akutnímu renálnímu selhání. Protože buňky proximálního tubulu mají dobrou regenerační schopnost, je nefrotoxicita v akutní fázi reverzibilní.
Pozdní toxicita se manifestuje jako nefrokalcinóza a chronická dysfunkce ledvin. Základní mechanimus vzniku nefrokalcinózy spočívá v poruše vylučování vápníku a hořčíku vedoucí k hyperkalciurii a hypomagnezemii. Příčiny nefrokalcinózy jsou u nezralých novorozenců multifaktoriální [8]. Ototoxita má složku vestibulární a kochleární a je dána přítomností AMG v endolymfě a perilymfě vnitřního ucha. Koncentrace antibiotika v endolymfě je srovnatelná s plazmatickou, ale déle zde přetrvává [9]. Kumulace AMG vede k apopotóze vestibulárních a kochleárních buněk. Vláskové buňky jsou přitom více citlivé k toxickému postižení než buňky vnitřního ucha. Predispozice k ototoxicitě je popsána při idiosynkrazii, u některých genetických mitochondriálních odchylek na úrovni RNA a u dětí se závažnou komorbiditou. Poškození statoakustického aparátu bývá přibližně v 50 % ireverzibilní. Riziko toxicity se zvyšuje s opakovanou expozicí, prodlužováním doby terapie (>10 dnů) a kombinací s neurotoxickými léčivy [9, 10].
Účinnost a bezpečnost léčby AMG je možné zvýšit terapeutickým monitorováním léčiva (TDM), které spočívá ve vyšetření plazmatické koncentrace a farmakokinetické predikci individuálně vhodné dávky [11]. Cílové terapeutické koncentrace Ge v plazmě jsou definovány následovně: pravděpodobnost baktericidie zvyšuje vrcholová koncentrace (Cpeak) v rozsahu 5–10 mg/l a riziko toxicity snižuje údolní koncentrace (Ctrough) <2 mg/l. Přechodně zvýšená hodnota Cpeak >12 mg/l riziko toxicity pravděpodobně nezvyšuje [2]. U novorozenců jsou plazmatické koncentrace Ge ovlivněny faktory maturačními a patofyziologickými. Tyto faktory plní funkci kovariát, tj. proměnných ovlivňujících hodnoty farmakokinetických parametrů, které je možné využít při individualizaci dávkování.
Předcházející studie organizovaná na našich pracovištích se zaměřila na farmakokinetiku Ge u septických novorozenců v kritickém stavu léčených Ge v prvním týdnu života [12, 13]. Popsala metodu TDM a analyzovala, jak kovariáty gestační věk, sepse a perzistující ductus arteriosus (PDA) ovlivňují kinetiku Ge. Předložená práce má charakter pilotní studie, která hodnotí akutní a pozdní nežádoucí účinky Ge u novorozenců v podmínkách TDM.
Metody
Plán studie a metodika TDM byly podrobně popsány v dřívější publikaci v tomto časopise [13]. Do prospektivní studie (leden 2006 – prosinec 2009) byli zařazeni nedonošení novorozenci hospitalizovaní na Jednotce intenzivní a resuscitační péče (JIRP) KDDL VFN a UK 1. LF Praha, kteří byli léčeni Ge v prvním týdnu života pro suspektní nebo prokázanou sepsi nebo bakteriální pneumonii. Protokol studie byl schválen Etickou komisí Fakultní nemocnice v Hradci Králové a Etickou komisí Všeobecné fakultní nemocnice a UK 1. LF v Praze. Novorozenci byli zařazeni do studie vždy po získání písemného informovaného souhlasu od jednoho rodiče a svědka (zdravotní sestra). Vstupní kritéria pro přijetí do studie byla: prokázaná sepse, suspektní sepse a bakteriální pneumonie. Vylučující kritéria pro přijetí do studie byla: vrozená vada neslučitelná se životem a akutní renální selhání definované jako vstupní hodnota sérové krea-tininemie (S-kreatinin) ≥133 µmol/l s oligurií (výdej moči <1 ml/kg/h) až anurií (výdej moči <0,5 ml/kg/h) [14]. Trvání antibiotické léčby záviselo na klinických známkách a laboratorních parametrech infekce včetně vymizení pozitivní bakteriemie u novorozenců s prokázanou sepsí.
Farmakoterapie
Gentamicin (Gentamicin inj, 40 mg/2 ml, Sandoz) byl podáván 30minutovou infuzí periferní žílou (infuzní pumpa Alaris GS/GH/ /CC; Cardinal Health, Rolle, Švýcarsko). Dvě iniciální standardní dávky a první dávkovací interval byly odvozeny z porodní tělesné hmotnosti (PH) a gestačního věku (GV) [15]. Gentamicin byl kombinován s ampicilinem 50 mg/kg i.v. nebo ampicilinem//sulbactamem 75 mg/kg.den-1 i.v. každých 12 hodin. Vankomycin hydrochlorid (Edicin inj, 1 g/20 mg, Sandoz), pokud byl iniciálně kombinován s gentamicinem, byl podáván v dávce 10 mg/kg každých 12 hodin 60minutovou i.v. infuzí. Pokud byla indikována změna původní empirické antibiotické léčby pro pozdní sepsi, byl podán vankomycin v dávce 10 mg/kg každých 8 hodin v 60minutové i.v. infuzi. Při oběhovém selhání (tachykardie >160/min, systémová arteriální hypotenze, tj. střední arteriální tlak <30 mmHg, výdej moči <1 ml/kg/h, koncentrace laktátu v krvi ≥2,5 mmol/l) byla prováděna titrovaná farmakoterapie (dopamin v dávce 5 µg/kg/min, dobutamin a noradrenalin) po předchozí volumoexpanzi (≥10 ml/kg). Při retenci tekutin byl podáván furosemid.
Klinické a laboratorní charakteristiky a jejich hodnocení
Perzistující ductus arteriosus (PDA) byl klinicky a echokardiograficky diagnostikován podle doporučených kritérií [16]. Pokud byl indikován farmakologický uzávěr PDA, byl podáván ibuprofen lysin v 15minutové i.v. infuzi (Arfen inj., 400 mg/3 ml, Lisapharma) ve třech dávkách každých 24 hodin následovně: první dávka 10 mg/kg, druhá a třetí dávka 5 mg/kg podle porodní hmotnosti a postnatálního věku.
Základními monitorovanými parametry byly srdeční frekvence (SF/min), systémový arteriální krevní tlak (TK/mmHg systolický, diastolický), příjem všech tekutin (ml//kg.den-1), výdej moči (ml/kg.h-1) a rozdíl příjmu a výdeje tekutin (ml/kg.den-1). Arteriální TK byl monitorován buď invazivně cestou periferní arterie, centrálně umbilikální arterií, nebo neinvazivně oscilometricky. Střední systémový arteriální krevní tlak (TKstř) byl vypočítán podle vzorce: diastolický TK + {(systolický TK – diastolický TK)/3} a zaznamenán v následujících intervalech: před podáním první dávky gentamicinu Ge1 (-24hGe1), v intervalu 24 h po podání Ge1 (Ge1+24h), 24 h až 48 h po podání Ge1 (Ge1+24–48h), dále 24 h po podání druhé dávky Ge2 (Ge2+24h) a 24 h až 48 h po podání Ge2 (Ge 2+24–48h). Průměrné hodnoty TKstř byly počítány u každého novorozence z minimálního počtu alespoň devíti měření. SF byla kontinuálně monitorována pomocí EKG a pulzní oxymetrie. Hodnoty TKstř byly zaznamenány do protokolu v intervalech: a) 24 hodin před startem první infuze gentamicinu, b) v intervalu mezi první a druhou infuzí tj. –1 h, 0 h, 0,5 h, 1 h, 6 h, 12 h, 24 h, 36 h nebo 48 h, c) v intervalu mezi druhou a třetí infuzí (-1 h, 0 h, 0,5 h, 1 h, 6 h, 12 h, 24 h, 36 h nebo 48 h).
Renální funkce v časné fázi byla hodnocena I/ podle kritérií syndromu multiorgánové dysfunkce v sepsi [14] a II/ podle kritérií pro akutní renální dysfunkci a akutní renální selhání (pediatrické skóre RIFLE). Vzhledem k podávání Ge bylo sledování prováděno ve fázích I, II a III definovaných následovně: fáze I (-24hGe1): interval 24 h před podáním první dávky gentamicinu Ge1; fáze II (Ge1–Ge4): ve dnech mezi první Ge1 a čtvrtou dávkou Ge4; fáze III (>Ge4): po podání čtvrté dávky Ge4 (konec antibiotické léčby). Kritéria pro glomerulární dysfunkci: oligurie (výdej moči <1 ml/kg/h) nebo anurie (výdej moči <0,5 ml//kg/h) a současně kreatinin v séru (S-krea) ≥88 µmol/l nebo dvojnásobný a větší vzestup S-krea nad iniciální hodnotu. Akutní renální selhání indikovala hodnota S-krea ≥133 µmol/l. Kritériem pro tubulární dysfunkci byla koncentrace močoviny v séru (S-urea). Dále byla vyšetřována frakční exkrece sodíku FE-Na a hořčíku FE-Mg a poměr koncentrace vápníku a kreatininu v moči (U-Ca/U-krea) [14, 17, 18]. K zajištění sběru moči byl zaveden močový katétr.
Screening nefrokalcinózy v pozdní fázi byl prováděn pomocí sonografie ledvin během prvního a druhého roku dítěte a později ve věku 2 až 5 let. Sonografie ledvin se prováděla na přístroji Acuson Aspen (Siemens, s.r.o., Praha, Česká republika) na Klinice dětského a dorostového lékařství VFN a UK 1. LF Praha. Při podezření na nefrokalcinózu bylo sonografické vyšetření ledvin opakováno až do úpravy nálezu.
K vyšetření sluchu v pozdní fázi byla použita metoda tranzientní evokované otoakustické emise (TOAE) [9]. Jedno vyšetření bylo provedeno v Ústavu péče o matku a dítě v Praze pomocí přístroje Audiometer Echo-screen TDA (Widex Line, Praha, Česká republika) v období do ukončení prvního roku věku. Opakováno bylo ve dvou letech. Při podezření na poruchu sluchu bylo doplněno vyšetření sluchových evokovaných potenciálů a případně provedena korekce poruchy (sluchadla nebo sluchový implantát). Schéma sledování charakteristik časné renální dysfunkce a pozdní toxicity Ge je uvedeno v tabulce 1.
Tab. 1. Algoritmus sledování časné a pozdní toxicity gentamicinu. 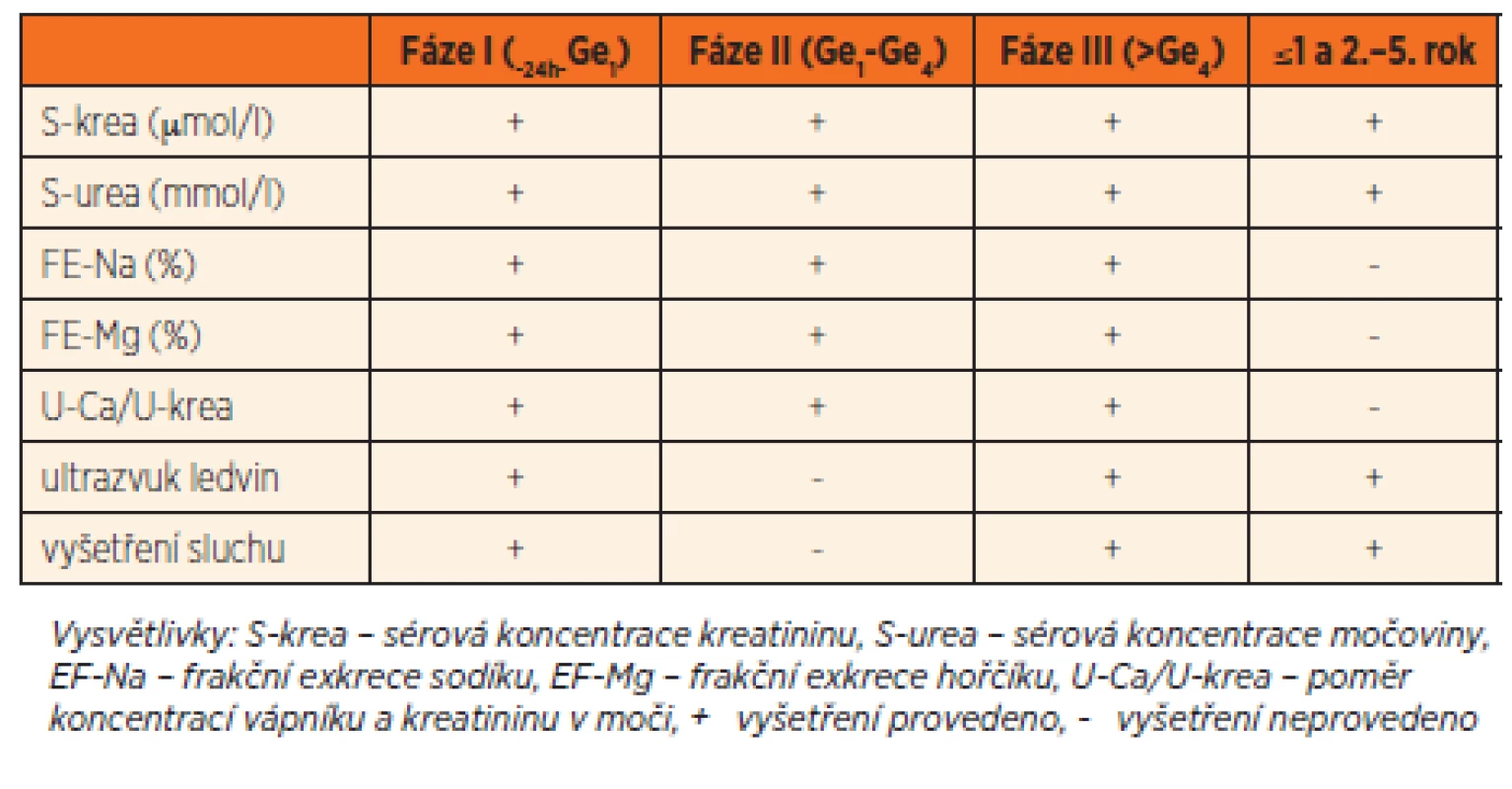
Statistická analýza
Pro vyhodnocení dat byly použity standardní statistické metody. Výpočty byly prováděny Statistica 9.0 (StatSoft StatSoft CR, s.r.o., Praha, Česká republika) a GraphPad Prism 6 for Windows (GraphPad Software, Inc., Palo Alto, Kalifornie, USA). Jako popisné statistické charakteristiky byly zvoleny aritmetický průměr, výběrová směrodatná odchylka a nejmenší a největší hodnota. Předpoklad o normálním rozložení dat byl ověřován pomocí D’Agostinova testu. Pro hodnocení výsledků byly použity t-test, analýza rozptylu pro opakovaná měření ANOVA (změny uvnitř skupin v závislosti na fázi sledování), analýza kovariance ANCOVA (vliv GA a PDA) a Spearmanův korelační koeficient. Pro porovnání průměrné úrovně sledovaných parametrů ve skupinách S1 a S2, případně PDA a nonPDA, byl použit dvouvýběrový t-test. V případě, že data podle Leveneova testu nesplnila předpoklad homogenity rozptylu, byla použita varianta t-testu s vlastním odhadem rozptylů. Pro testování byla zvolena hladina významnosti 5 %.
VÝSLEDKY
Demografické a klinické charakteristiky souboru
Do studie bylo zařazeno 54 nedonošených novorozenců. Z tohoto počtu bylo 32 velmi nedonošených nedonošenců (GV 25–33 týdnů, skupina S1) s průměrným GV 29,9 (SD 0,43) týdnů a PH 1,5 (SD 0,4) kg. Druhou skupinu tvořilo 22 mírně nedonošených novorozenců (GV 34–38 týdnů, skupina S2) s průměrným GV 35,8 (SD 1,1) týdnů a PH 2,75 (SD 0,50) kg.
Komorbidity byly významně častější ve skupině S1 než S2: respirační selhání léčené vysokofrekvenční oscilační ventilací (HFOV) (10/32 vs. 1/22, p = 0,020), oběhové selhání (30/32 vs. 16/22, p = 0,051) a perzistující ductus arteriosus (PDA) (18/32 vs. 4/22, p = 0,010). Perzistující ductus arteriosus (PDA) byl farmakologicky uzavřen třemi dávkami ibuprofenu (kumulativní dávka 21 mg/kg) s výjimkou jednoho extrémně nedonošeného novorozence, u něhož bylo nutné podávání ibuprofenu opakovat, a jednoho mírně nedonošeného, jemuž byly podány jen dvě dávky. Výskyt časné asfyxie (6/32 v S1 a 5/22 v S2), perinatální asfyxie (0/32 v S1 a 1/22 v S2) a intrauterinní růstové restrikce (1/32 v S1 a 0/22 v S2) byl v obou skupinách shodně nízký.
Oběhové selhání vyžadující podání dopaminu se projevilo u všech nedonošených ze skupiny S1 (32/32, 18 s PDA a 14 bez PDA) a u většiny ze skupiny S2 (18/22, z toho 4 s PDA a 14 bez PDA). Kumulativní dávka dopaminu byla ve skupinách S1 a S2 srovnatelná jak ve fázi sledování II [4,5 (SD 6,4) a 4,7 (SD 4,3) mg/kg], tak ve fázi III [18,9 (SD 15,7) a 18,6 (SD 11,1) mg/kg]. Retence tekutin s následným podáním furosemidu byla častější ve skupině S1 (22/32, 14 s PDA a 8 bez PDA) než S2 (6/22, 3 s PDA a 3 bez PDA) (p <0,01). Ve fázi I byl furosemid podán 6 novorozencům ve skupině S1 (5 S1-PDA a 1 S1-nonPDA) a kumulativní dávka furosemidu <1 mg/kg byla podána všem novorozencům (0,64 mg/kg) s výjimkou jednoho ze skupiny S1-nonPDA (15,4 mg/kg). Ve fázi II byl furosemid podán 22 novorozencům S1 (14 S1-PDA a 8 S1-nonPDA) a 6 novorozencům S2 (3 S2-PDA a 3 S2-nonPDA). Kumulativní dávka furosemidu byla vyšší ve skupině S1 [6,2 (SD 6,3) mg/kg] než S2 [0,7 (SD 0,5) mg//kg, p <0,01). Ve fázi III dostalo furosemid 7 novorozenců S1-PDA, 2 S1-nonPDA a 1 S2-PDA. Kumulativní dávka furosemidu byla ve fázi III u většiny novorozenců <1 mg/kg s výjimkou třech novorozenců ze skupiny S1-PDA (1,9 mg//kg; 4,2 mg/kg a 9,6 mg/kg).
Ve skupině S1 byly před prvním podáním Ge epizody systémové hypotenze (TKstř ≤30 mmHg) významně častější u novorozenců s PDA: S1-PDA 18/18 vs. 10/14 S1-nonPDA (p = 0,004). Tento rozdíl přetrvával jak v intervalu 24 h po podání (13/18 vs. 7/14; p = 0,003), tak v intervalu 24 až 48 h po podání (7/18 vs. 3/14 v S1-nonPDA, p <0,05). Průměrné hodnoty TKstř (mmHg) v intervalech a, b a c (viz část metody) byly ve skupinách S1-PDA a S1-nonPDA srovnatelné 27,6 (6,7) vs. 26,7 (7,8), 30,7 (4,9) vs. 29,6 (5,0) a 33,8 (5,1) vs. 33,5 (5,6) mmHg. Ve skupinách S2-PDA a S2-nonPDA se při současné léčbě oběhového selhání epizody významné systémové hypotenze ve sledovaném intervalu nevyskytly.
Farmakokinetika gentamicinu
Farmakokinetice a terapeutickému monitorování Ge ve studovaném souboru se podrobně věnuje dříve publikovaná práce [13]. Důsledkem individualizace první a druhé dávky podle GA a následujících dávek podle TDM bylo, že nedošlo ke kumulaci Ge v plazmě. Údolní koncentrace po první dávce (tj. před druhou dávkou) Ctrough,1 byla u všech novorozenců nižší než cílová hodnota 2 mg/l a údolní koncentrace před čtvrtou dávkou (Ctrough,3) překročila cílovou hodnotu jen u dvou novorozenců ze skupiny S1-PDA. Přesto byla pozorována negativní korelace mezi Ctrough,3 a GA (rs = -0,33, p = 0,015). Koncentrace Ctrough,3 nekorelovala s CL Ge vyšetřenou po první dávce (rs = -0,19, p = 0,17). Vliv GA (skupiny S1 a S2) a PDA na koncentrace Cpeak a Ctrough umožňuje posoudit obrázek 1. Vrcholová koncentrace po 4. dávce byla v průměru nižší o 1,7 mg/L než po dávce první (p <0,05), zatímco údolní koncentrace po 1. a 3. dávce se nelišily. Rozdíly koncentrací mezi skupinami nebyly významné s výjimkou koncentrace Ctrough,3 ve skupině S1--PDA, která byla vyšší ve srovnání se skupinou S2-nonPDA. Hodnoty plochy pod křivkou plazmatická koncentrace-čas (AUC) v intervalu mezi první a druhou dávkou Ge byly nejvyšší ve skupině S1-PDA, jak ukazuje obrázek 2. Jelikož v obou skupinách s PDA byl pozorován trend k nárůstu koncentrace Ctrough mezi 1. a 3. dávkou a ve skupinách non-PDA byl trend k poklesu, byly vyhodnoceny a porovnány rozdíly koncentrací (Ctrough,3 – Ctrough,1) pro všechny novorozence s PDA a bez PDA. Výsledky se nelišily (-0,03 vs. 0,3 mg/l, p = 0,14).
Obr. 1. Vrcholová (C<sub>peak</sub>) a údolní (C<sub>trough</sub>) koncentrace gentamicinu v plazmě (C<sub>pl</sub>) ve skupinách novorozenců S<sub>1</sub> (gestační věk <34 týdnů) a S<sub>2</sub> (gestační věk 34–38 týdnů) dále rozdělených na podskupiny podle přítomnosti perzistujícího ductus arteriosus (ano: PDA, ne: nonPDA). <em>Číselné indexy 1, 3 a 4 označují pořadové číslo dávky gentamicinu. Rozdíly mezi skupinami: **p <0,01 S<sub>1</sub>-PDA vs. S<sub>2</sub>-nonPDA.</em> 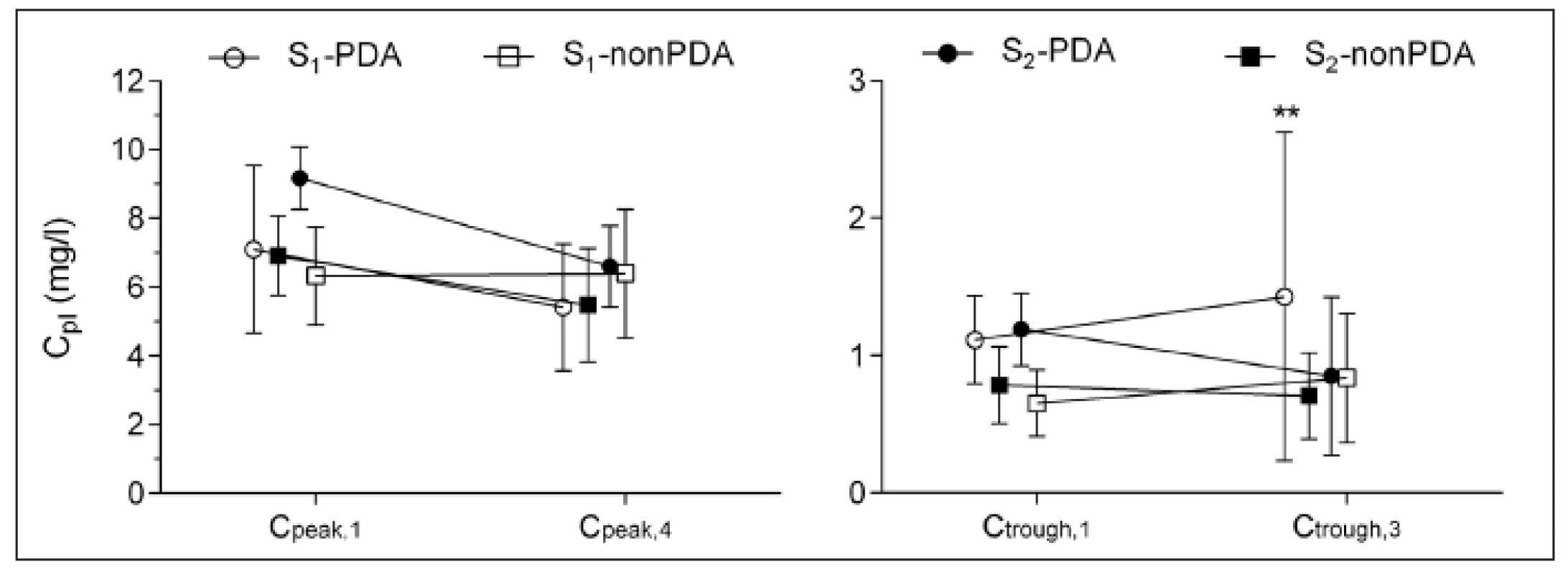
Obr. 2. Hodnoty plochy pod křivkou plazmatická koncentrace-čas (AUC) v intervalu mezi první a druhou dávkou gentamicinu ve skupinách novorozenců S<sub>1</sub> (gestační věk <34 týdnů) a S<sub>2</sub> (gestační věk 34–38 týdnů) dále rozdělených na podskupiny podle přítomnosti perzistujícího ductus arteriosus (ano: PDA, ne: nonPDA). <em>Úsečky znázorňují mediány. Rozdíly mezi skupinami: *p <0,05, **p <0,01.</em> 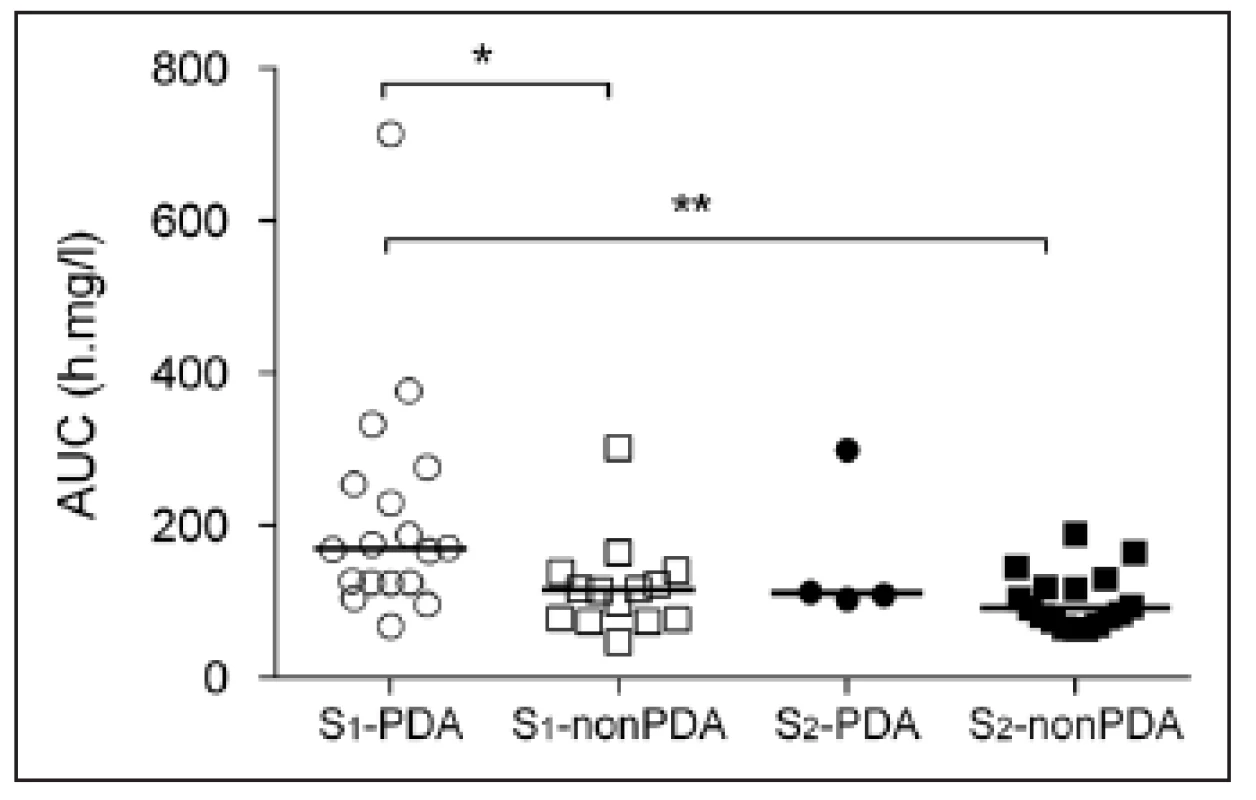
Známky časného poškození ledvin
Glomerulární dysfunkce
K oligurii nedošlo u žádného z novorozenců. Koncentrace S-krea ≥133 µmol/l ukazující na akutní renální selhání byla zaznamenána pouze u jednoho novorozence ze skupiny S1--PDA ve fázi sledování II i III. Četnost výskytu glomerulární dysfunkce byla vyšší ve skupině S1 ve srovnání se skupinou S2 jak do 7. dne od zahájení léčby (16/32 vs. 4/22; p = 0,023), tak po jejím ukončení (7/32 vs. 0/22; p = 0,033). Podrobné údaje o vývoji hodnot S-krea v jednotlivých skupinách a fázích studie uvádí tabulka 2. Ve fázi I byla hodnota S-krea ve všech skupinách srovnatelná. Na rozdíl od ostatních skupin došlo ve skupině S2-nonPDA k signifikantnímu poklesu S-krea a ve fázích II a III byla hodnota významně nižší než ve skupině S1-PDA. Také ve skupině S2-PDA byla ve fázi III hodnota S-krea nižší než ve skupině S1-PDA. Procenta nemocných novorozenců se zvýšenou hodnotu S-krea (≥88 μmol/l) ukazuje obrázek 3. Nejvíce jich bylo ve skupině S1--PDA. Rozdíl mezi skupinami dosáhl statistické významnosti ve fázi II. Analýza kovariance (ANCOVA) provedená s cílem současně posoudit vliv dvou faktorů GA a PDA na logaritmicky transformované hodnoty S-krea ve fázi II ukázala, že vliv GA je statisticky velmi významný (p <0,0001) na rozdíl od PDA (p = 0,90). Ve fázi III byl závěr podobný. Koncentrace S-krea ve fázích II a III korelovala s koncentrací Ge Ctrough,3 (fáze II: rs = 0,43, p <0,01, fáze III: rs = 0,62, p <0,001). Byla pozorována netěsná korelace mezi S-krea ve fázi I a AUC Ge (rs = 0,32, p <0,05). Ve fázích II a III podobná korelace nebyla zaznamenána.
Tab. 2. Koncentrace kreatininu (S-krea) a močoviny (S-urea) v séru ve skupinách velmi nedonošených (S1, n = 32, 18 s PDA, 14 bez PDA) a mírně nedonošených novorozenců (S2, n = 22, 4 s PDA, 18 bez PDA). 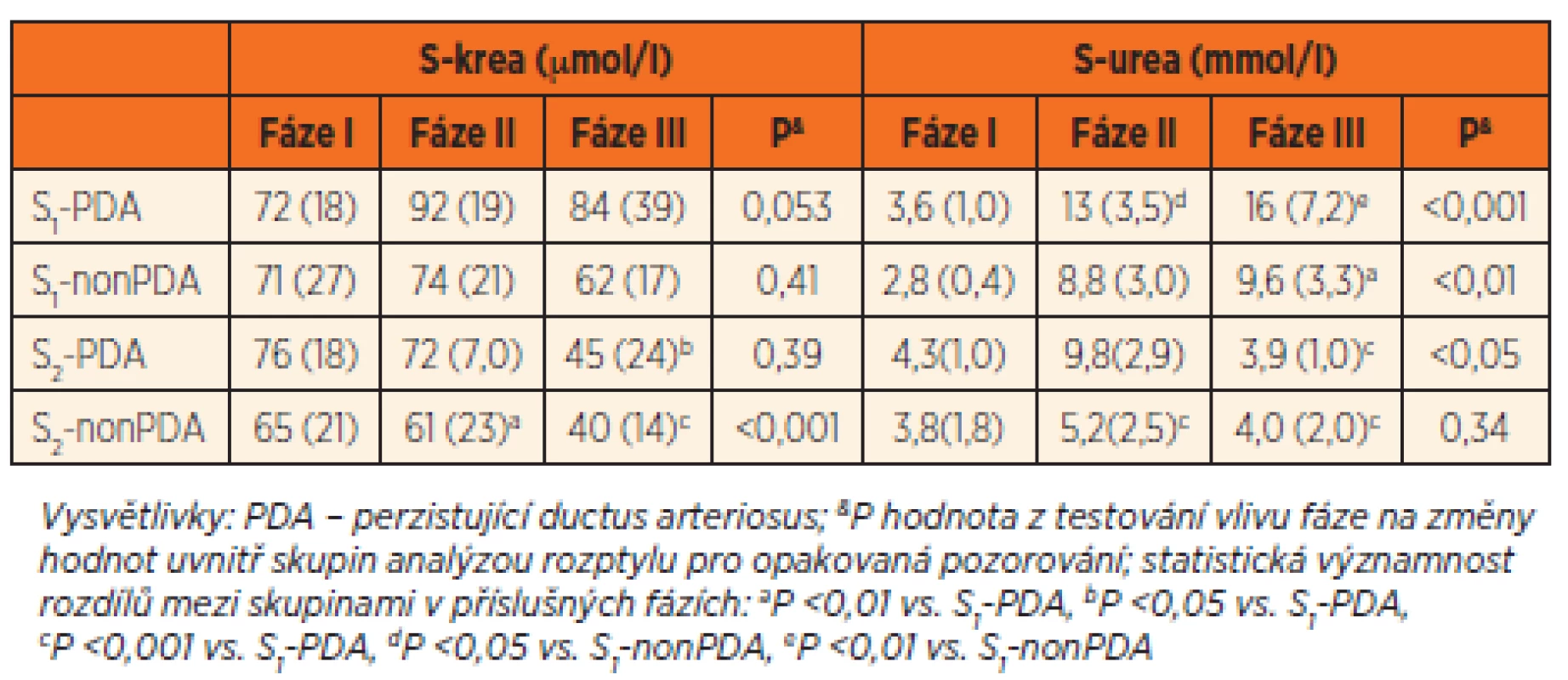
Obr. 3. Procenta nemocných novorozenců se zvýšenými hodnotami koncentrací kreatininu v séru (S-krea ≥88 <sub>μ</sub>mol/l). Novorozenci byli rozděleni do skupin S<sub>1</sub> (gestační věk <34 týdnů) a S<sub>2</sub> (gestační věk 34–38 týdnů) a dále na podskupiny podle přítomnosti perzistujícího ductus arteriosus (ano: PDA, ne: nonPDA). Vyznačena je statistická významnost rozdílů mezi skupinami v jednotlivých fázích studie FI, FII a FIII. 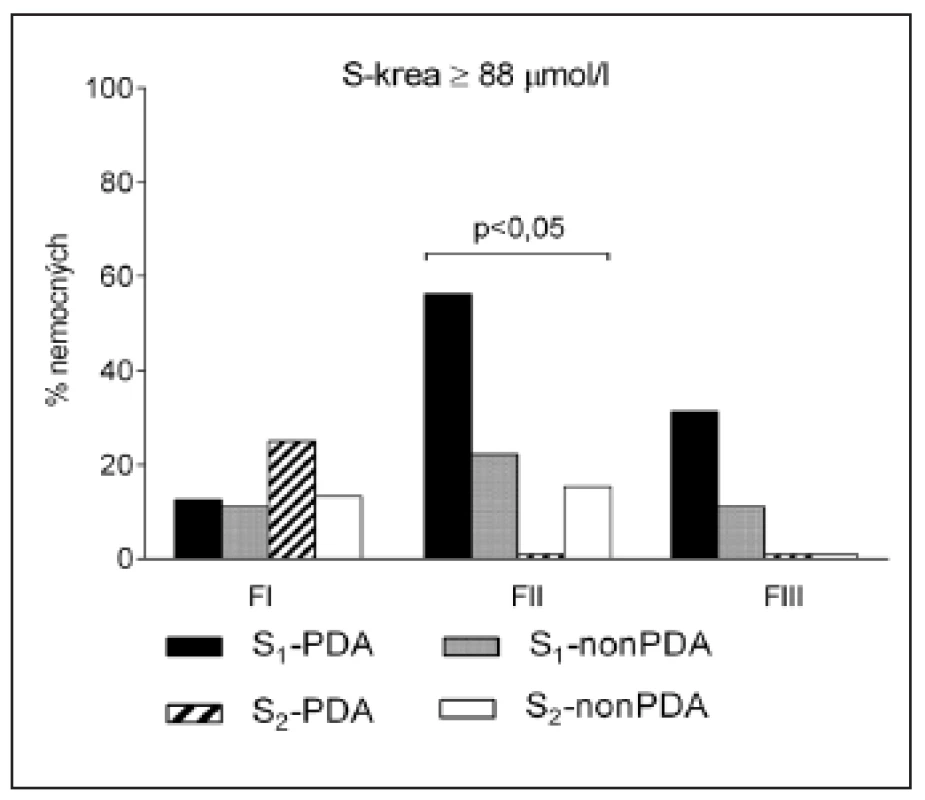
Tubulární dysfunkce
Koncentrace močoviny v séru (S-urea) byla ve fázi I ve všech skupinách srovnatelná. Ve skupinách S1--PDA a S1-nonPDA došlo ve fázích II a III k jejímu zvýšení. Ve skupině S2-nonPDA se S-urea nezměnila a ve skupině S2-PDA došlo k přechodnému zvýšení ve fázi II (tab. 2). Dvoufaktorová ANCOVA ukázala, že GA má statisticky velmi významný vliv na S-urea ve fázích II i III (p <0,0001) na rozdíl od PDA (p >0,90). Koncentrace S-urea korelovala s Ctrough,3 pouze ve fázi III (rs = 0,44, p <0,01). Koncentrace S-urea netěsně korelovala s AUC Ge pouze ve fázi 1 (rs = 0,34, p <0,05).
Frakční exkreci sodíku a hořčíku uvádí tabulka 3. Poměr koncentrací vápníku a kreatininu v moči (U-Ca/U-krea) ukazuje obrázek 4. V celém souboru novorozenců poměrně těsně korelovaly FE-Mg s FE--Na, poměr U-Ca/U-krea s FE-Na a U-Ca//U-krea s FE-Mg jak ve fázi II, tak III (data pro fázi II: rs = 0,68, p <0,0001; rs = 0,46, p <0,001 a rs = 0,58, p <0,0001). Hodnota FE-Na se s postupující fází sledování zvyšovala pouze ve skupině S1-PDA. V obou skupinách mírně nedonošených novorozenců (S2) byly hodnoty nižší než ve skupině S1--PDA, a to ve fázi II i III. Skupiny S1-PDA a S1--nonPDA měly signifikantně odlišné hodnoty FE-Na ve fázi III (tab. 3). Dvoufaktorová ANCOVA ukázala, že GA má statisticky významný vliv na FE-Na ve fázi II i III (p <0,01) na rozdíl od PDA (p >0,16). Hodnoty FE-Na korelovaly s Ctrough,3 ve fázi II a III (fáze II: rs = 0,42, p <0,002, fáze III: rs = 0,45, p <0,001). Korelace mezi FE-Na a AUC nebyla pozorována.
Tab. 3. Výsledky biochemických analýz moči. Hodnocení frakční exkrece sodíku (FE-Na) a hořčíku (FE-Mg) ve skupinách velmi nedonošených (S1, n = 32, 18 s PDA, 14 bez PDA) a mírně nedonošených novorozenců (S2, n = 22, 4 s PDA, 18 bez PDA). 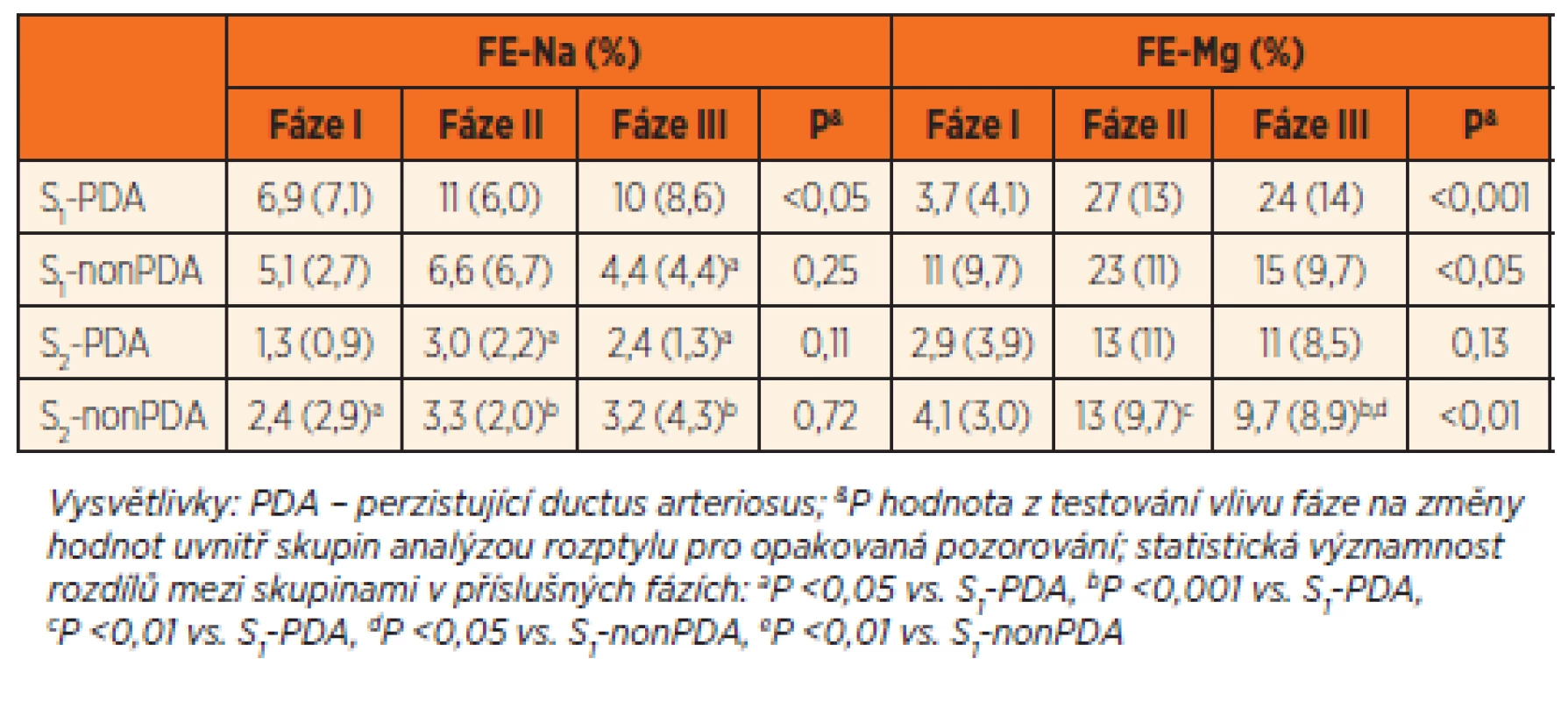
Obr. 4. Poměr koncentrací vápníku a kreatininu v moči. Novorozenci byli rozděleni do skupin S<sub>1</sub> (gestační věk <34 týdnů) a S<sub>2</sub> (gestační věk 34–38 týdnů) a dále na podskupiny podle přítomnosti perzistujícího ductus arteriosus (ano: PDA, ne: nonPDA). <em>Rozdíly mezi skupinami: ***p <0,001 S<sub>1</sub>-PDA vs. S<sub>2</sub>-nonPDA ve fázi III.</em> 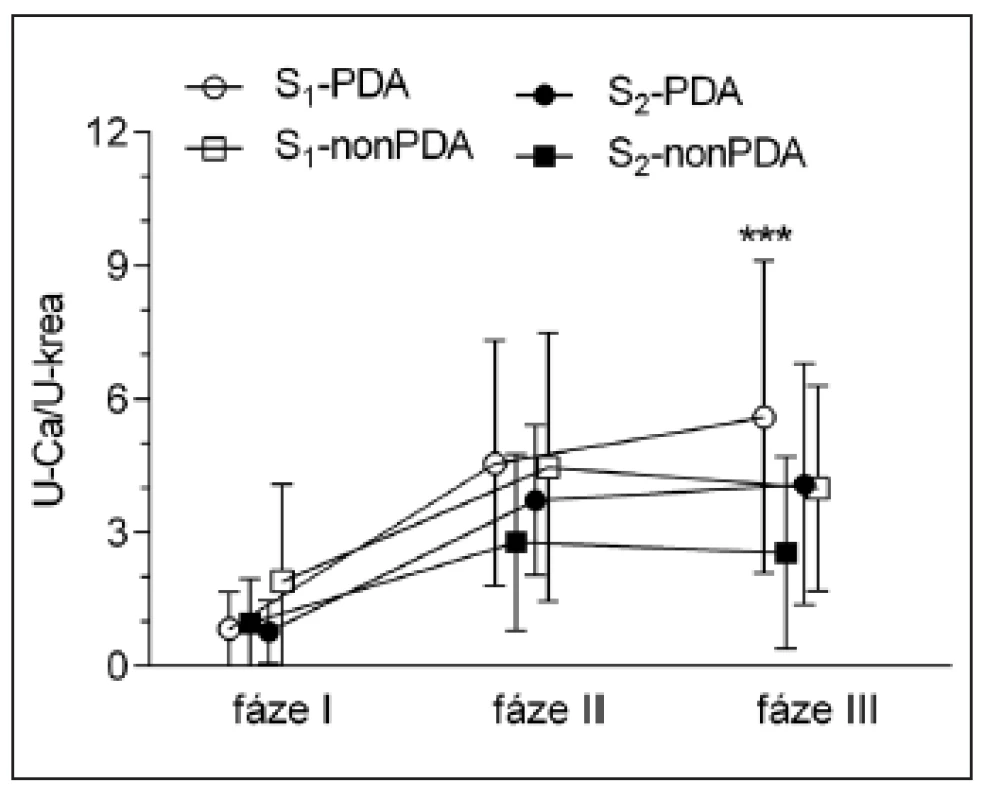
Nárůst hodnot FE-Mg byl pozorován ve všech skupinách. U velmi nedonošených novorozenců ve skupině S1-PDA došlo ve fázích II a III v průměru k 6-7násobnému zvýšení. Ve skupině S1-PDA rozdíly nedosáhly statistickou významnost pro nízký počet subjektů (n = 4). Srovnání mezi skupinami ukázalo na významně nižší FE-Mg ve skupině S2-nonPDA než ve skupinách S1-PDA a S1-nonPDA (tab. 3). Dvoufaktorová ANCOVA ukázala, že GA má statisticky významný vliv na FE-Mg ve fázích II i III (p <0,05) na rozdíl od PDA (p >0,53). Hodnoty FE-Mg korelovaly s Ctrough,3 ve fázi II i III (fáze II: rs = 0,39, p <0,005, fáze III: rs = 0,35, p <0,01), zatímco korelace s AUC nebyla zaznamenána v žádné fázi sledování.
Ve všech skupinách došlo ve fázi II ke zvýšení poměru U-Ca/U-krea a to přetrvávalo i ve fázi III. Ve fázi III byly hodnoty poměru vyšší ve skupině S1-PDA než ve skupině S2-nonPDA. Dvoufaktorová ANCOVA ukázala, že GA má pouze hraničně signifikantní vliv na U-Ca//U-krea ve fázích II (p = 0,061) na rozdíl od PDA (p >0,92). Hodnoty poměru U-Ca/U-krea netěsně korelovaly s Ctrough,3 pouze ve fázi III (rs = 0,32, p <0,05) a s AUC nekorelovaly v žádné fázi sledování.
Pozdní toxicita léčby
Nefrokalcinóza (NK)
Sonografické vyšetření ledvin bylo provedeno během prvního roku věku u 46 (87 %) dětí. NK byla prokázána u jednoho novorozence ze skupiny S1-PDA. Při opakovaném vyšetření před 2. rokem věku byl sonografický nález v normě. Jednalo se o novorozence s metabolickou acidózou ve fázi I (pH = 7,19) a zvýšenou koncentrací S-urea ve fázi II a III (10,4 a 12,1 mmol/l). Ve fázích I až III byla frakční exkrece sodíku i hořčíku pod průměry skupiny S1-PDA (FE-Na: 1,3, 1,7 a 1,6 %;EF-Mg: 1,2, 10,6 a 4,6 %). Poměr Ca/krea v moči byl mírně nad průměrem skupiny ve fázích II a III (0,51, 5 a 7,2). Údolní plazmatické koncentrace Ge po 1. a 3. dávce byly nízké (0,9 a 0,5 mg/l). Během prodloužené fáze follow-up (2.–5. rok), které se zatím zúčastnilo 15 dětí (28 %), byla NK zjištěna u jiného novorozence ze skupiny S1-PDA. Také druhý novorozenec měl údolní koncentrace Ge nižší než 1 mg/l. Od prvního případu se lišil vyššími koncentracemi S-urea (v rozmezí 14–20 mmol/l) a hodnotami frakční exkrece iontů (FE-Na: 6,2, 13 a 13,8 %; EF-Mg: 4,9, 27,1 a 30,5 %). Oběma novorozencům byl podáván furosemid a ibuprofen.
Kochleární ototoxicita
Ve sledovaném souboru nebyla porucha sluchu metodou tranzitorní otoakustické emise během prvního roku věku zjištěna u žádného dítěte.
DISKUSE
Prvním cílem studie bylo sledovat známky časného poškození ledvin při farmakoterapii Ge řízené podle TDM a popsat vztahy mezi ukazateli glomerulární a tubulární dysfunkce na jedné straně a koncentracemi Ge a klinickými charakteristikami jako PDA a GA na straně druhé.
V další části studie byl vyhodnocen výskyt nefrokalcinózy a kochleární toxicity jako pozdních nežádoucích účinků. Nefrotoxicita a ototoxicita patří mezi hlavní toxické účinky Ge a jiných AMG především u pacientů s komorbiditami, u nedonošených nebo donošených novorozenců po asfyxii [19, 20]. Prevalence AMG indukované toxicity je u pacientů v sepsi 10–20 % [21].
Výskyt PDA v našem souboru předčasně narozených novorozenců souhlasí s literárními údaji [22–24]. Posouzení vztahů mezi projevy časné dysfunkce ledvin a vysvětlujícími faktory a charakteristikami novorozenců (kovariátami) včetně koncentrací Ge bylo komplikováno tím, že ve sledovaných skupinách působilo mnoho faktorů současně, byly nerovnoměrně zastoupeny a byly na sobě závislé. Například PDA se vyskytlo třikrát častěji u novorozenců S1 a novorozenci s PDA měli nižší GA než novorozenci bez PDA. Ibuprofen podávaný pro uzávěr PDA častěji ve skupině S1 snižuje u nezralých novorozenců o 30 % clearance aminoglykosidů považovanou za ukazatel rychlosti glomerulární filtrace [25]. Farmakoterapie furosemidem byla více než dvakrát častější ve skupině S1 a jeho průměrná kumulativní dávka byla ve fázi II podstatně vyšší než ve skupině S2. Velmi nedonošení novorozenci byli také sedmkrát častěji léčeni HFOV pro respirační selhání než skupina S2. Naopak užití dopaminu bylo ve skupinách S1 a S2 podobné.
Absence významné kumulace Ge v důsledku individualizované farmakoterapie byla pro nezralé novorozence velmi přínosná, ale zároveň znesnadnila posouzení možného vztahu mezi koncentracemi Ge a známkami časné dysfunkce ledvin. Pouze ve skupině S1-PDA byla koncentrace Ctrough,3 mírně zvýšená ve srovnání se skupinou S2-nonPDA a tuto skupinu charakterizovala také vyšší interindividuální variabilita Ctrough,3 a nadprahové koncentrace u dvou novorozenců. V kumulaci Ge nebyl nalezen mezi novorozenci s PDA a bez PDA statisticky významný rozdíl. Nicméně i přes individualizaci dávkování se koncentrace Ctrough,3 zvyšovala s klesajícím GA (negativní korelace). Kumulace Ge v organismu je spojena se zvýšeným rizikem časné [18] i pozdní toxicity [8].
Význam S-krea jako biomarkeru glomerulární funkce v prvním týdnu života je omezen a tento parametr nelze použít jako citlivý ukazatel glomerulární dysfunkce. V časném poporodním období je koncentrace vysoká a odpovídá kreatininemii matky. U fyziologických novorozenců se S-krea sníží na ustálenou hodnotu v průběhu 1 až 2 týdnů po porodu. Koncentrace S-krea v den porodu se u velmi nedonošených a mírně nedonošených novorozenců neliší [26]. Během prvních 24–36 hodin postnatálního života se S-krea zvyšuje. U velmi nedonošených novorozenců (GA <27 týdnů) se S-krea přechodně zvyšuje až do 4. dne po porodu a pokles probíhá během 3–5 týdnů. Přechodný vzestup S-krea souhlasí s naším pozorováním ve fázi II ve skupině S1-PDA (tab. 2). Pokles S-krea u novorozenců S2 s vyšším GA během fází I až III a absence podobného vývoje spolu s vyššími hodnotami ve fázích II a III u nezralejších novorozenců S1 také odpovídá závěrům jiných autorů [26, 27]. Koncentrace S-krea u novorozenců s PDA pozitivně a poměrně těsně korelovala s koncentrací Ge vyšetřenou ve stejném období (Ctrough,3), a to především z důvodu výskytu zvýšených hodnot obou parametrů v podskupině S1-PDA. Jedním z možných vysvětlení je závislost obou parametrů na rychlosti glomerulární filtrace. Navíc Ge v závislosti na koncentraci akutně snižuje GFR jednak vazokonstrikcí aferentních arteriol a jednak snížením filtračního koeficientu způsobeným kontrakcí mezangiálních buněk, což vede ke zvýšení S-krea [20]. Možný je i vliv farmakoterapie ibuprofenem, která byla ve skupině S1 častá. Ibuprofen ve studii kontrolované placebem ale ovlivnil GFR jen velmi málo a má příznivější bezpečnostní profil u novorozenců než indometacin [28]. Snížení GFR u nezralých novorozenců vlivem ibuprofenu o 30 % bylo doloženo měřením clearance amikacinu [25].
Koncentrace S-urea je ovlivněna rychlostí tvorby urey (přísun a katabolismus proteinů, jaterní syntéza urey), změnami hydratace a exkrecí ledvinami. Wilkins provedl detailní sledování vývoje renální funkce u novorozenců s GA 26–33 týdnů [29]. V jeho studii se koncentrace S-urea během prvního měsíce postnatálního života výrazně měnila a vykazovala těsnou pozitivní korelaci s denním odpadem urey močí. Maximální hodnota denního odpadu urey negativně korelovala s GA a 10krát a více převyšovala obvyklé hodnoty u starších dětí a dospělých (<1 mmol/kg//den). Takto vysoké hodnoty S-urea a denního odpadu autor přisoudil převažujícímu katabolismu proteinů v prvních dnech po porodu. Ve srovnání s koncentrací S-krea jsme pozorovali v obou podskupinách novorozenců S1 výrazně větší nárůst S-urea s postupující fází sledování a také rozdíly mezi skupinami S1 a S2 byly větší. Podobný vývoj S-urea v prvním týdnu postnatálního života závislý na GA popisují i další autoři [27]. Na zvýšení S-urea se nepodílela dehydratace (prerenální azotemie z hypovolemie). V jiné práci jsme totiž ukázali, že celková retence tekutin během fází I a II, která korelovala s nárůstem tělesné hmotnosti, byla u novorozenců S1 oproti S2 o 30 % větší [12]. Nelze vyloučit vliv podávání ibuprofenu na S-urea podobně jako na S-krea. Renální clearance urey koreluje s clearance kreatininu, i když je nižší z důvodu tubulární reabsorpce [29]. Přínos S-urea se nepochybně zvyšuje, pokud se koncentrace zároveň vyšetří i v moči a vypočítá se frakční exkrece urey. Hodnota FE-urea napomáhá odlišit, zda důvod akutního poškození ledvin je prerenální (FE-urea <35 %) nebo renální (nejčastěji akutní tubulární nekróza, FE-urea >50 %). Obecně více přijímaná a častěji v této indikaci vyšetřovaná hodnota FE-Na je zatížena chybou u nemocných léčených diuretiky [30].
Hospodaření s vodou a minerály v časném postnatálním období podléhá prudkým změnám, které jsou zvláště výrazné u nezralých novorozenců s nízkým GA [31]. Novorozenec ztrácí během prvních dnů přibližně 10–15 %objemu celkové tělesné vody a současně odchází ledvinami i sodík. Pro nezralost tu-bulů je FE-Na přechodně výrazně zvýšená (>5 %) nad hodnoty u starších dětí a dospělých osob (<1 %). Podle literárních údajů a v souladu s naším pozorováním FE-Na negativně koreluje s GA [32]. U zralých novorozenců se FE-Na upravuje během prvního týdne a v dalších týdnech její nízká hodnota odpovídá renální retenci sodíku v souvislosti s jeho zvýšenou potřebou v období růstu. U nezralých novorozenců je tento proces zpomalený, zvýšené hodnoty FE-Na přetrvávají a klesají rychlostí přímo úměrnou GA [26]. Z toho vyplývají zvýšené nároky nezralých novorozenců na přísun sodíku a tendence k hyponatremii. V naší studii byla FE-Na vyšší ve skupině S1 než S2 a v podskupině S1-PDA se navíc v prvních dnech dále zvýšila. FE-Na je parametr, který ovlivňují i další faktory kromě zralosti tubulů, jako aktivita systému renin-angiotenzin-aldosteron, atriální natriuretické peptidy, prostaglandiny a z podávaných léčiv zejména furosemid. Furosemid zvyšuje FE-Na u předčasně narozených novorozenců přibližně na dvojnásobek, zatímco u mladých dospělých osob je nárůst až desetinásobný [33, 34]. Pravděpodobným vysvětlením rozdílného účinku jsou primárně zvýšené hodnoty FE-Na před podáním furosemidu u novorozenců.
Hyperkalciurie je spojena se zvýšeným rizikem nefrokalcinózy a ledvinných kamenů u dětí i dospělých. Ke kalcifikaci ledvin dochází u nezralých novorozenců častěji, protože se u nich kombinuje několik rizikových faktorů přispívajících k hypekalciurii, a to zejména snížený tok moči, acidóza, hyperoxalurie, zvýšený příjem kalcia, nízký příjem/vysoké ztráty fosfátů a podávání furosemidu a aminoglykosidů [35]. Poměr U-Ca/U-krea u nedonošených (2,3–2,7 mmol/mmol) je mnohem vyšší než referenční hodnoty u fyziologických novorozenců a starších dětí (<0,6–0,9 mmol//mmol) [30, 36]. S vyzráváním distálních tubulů a kalciových receptorů v nefronu nedonošených novorozenců dochází k fyziologickému poklesu U-Ca/U-krea a FE-Mg během postnatálního života na úroveň srovnatelnou s donošenými novorozenci [36, 37]. Hodnoty FE-Na poměrně těsně korelují s FE-Ca u velmi nezralých, nezralých i fyziologických novorozenců, což se podařilo prokázat i u novorozenců sledovaných v této studii [38, 39]. Kalcium je aktivně vstřebáváno spolu s Na+ v proximálním tubulu, Henleově kličce i v distálním tubulu. Do epiteliálních buněk distálního tubulu Ca2+ vstupuje z moči prostřednictvím kalciového kanálu řízeného parathormonem, zatímco v bazolaterální membráně jde o protisměrný transport s Na+. Ten je snížen při zvýšené renální exkreci Na+. Souhlasně s naším pozorováním i ve studii jiných autorů korelovala renální exkrece vápníku a hořčíku u nedonošených novorozenců [40].
Zvýšené renální ztráty vápníku a hořčíku jsou NÚ, který je koncentračně závislý a manifestuje se od první dávky Ge [41]. Chiruvolu a spolupracovníci ukázali, že po léčbě Ge (4 mg/kg/den) se u 15 % fyziologických novorozenců rozvine hypokalcemie, u nedonošenců s GA <37 týdnů se jedná o 24 % [42]. Další autoři popisují koncentračně závislé poinfuzní zvýšení FE-Na, FE-Mg a poměru U-Ca/U-krea u fyziologických i nedonošených novorozenců [43, 44]. Detailní mechanismus nebyl doposud uspokojivě objasněn. Jak ukazují preklinické studie, může jít o důsledek agonistického účinku Ge na receptoru CSR typu I (calcium--sensing receptor), který vede k down-regulaci exprese a snížení aktivity kanálu NKCC2 („furosemid-senzitivní“ kanál transportující Na+, K+ a 2Cl-) [45]. Jedná se pravděpodobně o podobný mechanismus jako u furosemidu, tj. inhibici paracelulárního transportu vápníku a hořčíku v tenkém vzestupném raménku Henleovy kličky. Jiné studie ukazují i na Ge indukované ztráty Ca2+ v distálním tubulu [46].
V této studii byla nefrokalcinóza diagnostikována u dvou novorozenců ze skupiny velmi nedonošených, léčených pro PDA ibuprofenem s projevy oběhové, glomerulární a tubulární dysfunkce. Akutní stav si vyžádal u obou novorozenců podání furosemidu ke snížení významné retence tekutin a k optimalizaci vodní bilance. V literatuře je prevalence nefrokalcinózy v populaci nedonošených udávána v širokém rozmezí 7–41 %. V 85 % případů vymizí v prvních letech života, ale u malé části dětí se může vyvinout chronická glomerulární a tubulární dysfunkce [35]. Pro definitivní závěr výstupních vyšetření je nutné počkat na doplněné výsledky dlouhodobého sledování mezi 5.–7. rokem věku. Poškození sluchu nebylo v souboru zjištěno, zatímco v literatuře je uváděno přibližně u 2–15 % předčasně narozených novorozenců [47].
Limitace studie je nutné spatřovat v nerovnoměrném zastoupení faktorů se vztahem k riziku renální dysfunkce (např. léčba furosemidem a ibuprofenem) ve skupinách S1 a S2, které ale vyplývá z potřeby intenzivnější péče o nezralejší novorozence. Vliv farmakokinetiky na sledované parametry nebylo možné oddělit od vlivu jiných faktorů z důvodu velmi malých rozdílů v koncentracích Ge mezi skupinami (důsledek farmakokineticky řízené individualizace dávkování), z důvodu absence kontrolní skupiny předčasně narozených novorozenců neléčených Ge a také pro limitovanou velikost souboru, která neumožnila analýzu zahrnující více než dva faktory působící současně. Nedostatkem studie je, že nebyly sledovány jiné biomarkery akutní renální dysfunkce (např. cystatin C) nebo citlivé ukazatele tubulárního poškození, jako jsou kidney injury molecule-1 (KIM-1), neutrophil gelatinase-associated lipocalin (NGAL) a N-acetyl-β-D-glukosaminidáza (NAG) [5].
I přes výše uvedená omezení v interpretaci výsledků studie je patrná souvislost mezi zahájením podávání Ge ve všech skupinách a paralelním zvýšením FE-Mg a poměru U-Ca/U-krea. Došlo k němu i ve skupině S2-nonPDA, která nebyla léčena ibuprofenem a ve které byl podán furosemid v nízké dávce jenom 3 z 18 novorozenců. Koncentrace S-krea a S-urea byly vyšší u novorozenců S1 než S2. Nejvyšší hodnoty byly zaznamenány v podskupině S1-PDA léčené ibuprofenem, ve které byl zároveň více podáván furosemid a byly častější epizody systémové hypotenze než v podskupině S1-nonPDA, a to i přes léčbu dopaminem. Analýza ANCOVA současně hodnotící faktory GA a PDA potvrdila vliv GA na všechny sledované biochemické parametry, zatímco nezávislý vliv PDA nebyl potvrzen u žádného z nich. To je v protikladu se závěry naší dřívější práce o vlivu GA i PDA na farmakokinetiku Ge.
ZÁVĚRY
Příčiny glomerulární a tubulární dysfunkce jsou u nedonošených novorozenců na JIP multifaktoriální. Renální dysfunkce je u většiny z nich relativně mírného stupně, není spojena s oligurií a je přechodná. V časové souvislosti s podáváním Ge dochází u mírně i velmi nedonošených novorozenců k výraznému vzestupu exkrece vápníku do moči, což se spolu s dalšími faktory podílí na zvýšeném riziku nefrokalcinózy. V této souvislosti je potřeba zdůraznit přínos individualizovaného dávkování Ge s využitím TDM, které se projevilo absencí významné kumulace Ge a netoxickými koncentracemi Ge u velké většiny souboru. Výskyt nefrokalcinózy byl nízký a kochleární toxicita nebyla prokázána. Periodické vyšetřování parametrů renální funkce je důležitou součástí péče o předčasně narozené děti, protože u menší části této populace se může rozvinout chronické poškození ledvin.
Poděkování
Autoři děkují všem spolupracovnicím a spolupracovníkům, kteří se podíleli na provedení studie.
Práce byla finančně podpořena granty Ministerstva zdravotnictví ČR IGA 1A 8771-5/05, RVO VFN 64165/2012 a PRVOUK P37/09.
Došlo: 20. 7. 2013
Přijato: 29. 4. 2014
Doc. Ing. Jaroslav Chládek, Ph.D.
Ústav farmakologie
Lékařská fakulta Univerzity Karlovy
Šimkova 870/13
500 03 Hradec Králové
e-mail: chladekj@lfhk.cuni.cz
Zdroje
1. Pacifici GM. Clinical pharmacokinetics of aminoglycosides in the neonate: a review. Eur J Clin Pharmacol 2009; 65 (4): 419–427.
2. Avent ML, Kinney JS, Istre GR, et al. Gentamicin and tobramycin in neonates: comparison of a new extended dosing interval regimen with a traditional multiple daily dosing regimen. Am J Perinatol 2002; 19 (8): 413–420.
3. Měchurová A, Melichar J, Straňák Z, Švihovec P, Mašata J. Perinatální infekce a podávání antibiotik podle nových poznatků – doporučený postup. In: Měchurová A. Doporučené postupy v perinatologii. Česká gynekologie 2010; 75 (Suppl 1, část 13): 1–2.
4. Contopoulos-Ioannidis DG, Giotis ND, Baliatsa DV, et al. Extended-interval aminoglycoside administration for children: a meta-analysis. Pediatrics 2004; 114 (1): e111–118.
5. McWilliam SJ, Antoine DJ, Sabbisetti V, et al. Mechanisms-based urinary biomarkers to identify the potential for aminoglycoside-induced nephrotoxicity in premature neonates: A Proff-of Concept Study. PLoS One 2012; 7 (1): e43809.
6. Quiros Y, Vicente-Vicente L, Morales AI, et al. An integrative overview on the mechanisms underlying the renal tubular cytotoxicity of gentamicin. Toxicol Sci 2011; 119 : 245–256.
7. Mingeot-Leclercq MP, Tulkens PM. Aminoglycosides: nephrotoxicity. Antimicrob Agents Chemother 1999; 43 (5): 1003–1012.
8. Narendra A, White MP, Rolton HA, et al. Nephrocalcinosis in preterm babies. Arch Dis Child Fetal Neonatal Ed 2000; 85 (3): F207–213.
9. Bates DE. Aminoglycoside ototoxicity. Drugs Today (Barc) 2003; 39 (4): 277–285.
10. Xie J, Talaska AE, Schacht J. New developments in aminoglycoside therapy and ototoxicity. J Hear Res 2011; 281 : 28–37.
11. Touw DJ, Westerman EM, Sprij AJ. Therapeutic drug monitoring of aminoglycosides in neonates. Clin Pharmacokinet 2009; 48 : 71–88.
12. Martínková J, Pokorná P, Záhora J, et al. Tolerability and outcomes of kinetically guided therapy with gentamicin in critically ill neonates during the first week of life: An open-label, prospective study. Clin Ther 2010; 32 (14): 2400–2414.
13. Pokorná P, Záhora J, Chládek J, et al. Kineticky řízená léčba gentamicinem u kriticky nemocných septických nedonošených novorozenců v prvním týdnu života – otevřená prospektivní studie (část I). Čes-slov Pediat 2013; 68 (4): 219–233.
14. Goldstein B, Giroir B, Randolph A. International pediatric sepsis consensus conference: definitions for sepsis and organ dysfunction in pediatrics. Pediatr Crit Care Med 2005; 6 (1): 2–8.
15. Young TE, Mangum B. Neofax: A Manual of Drugs Used in Neonatal Care. 19th ed. Raleigh, North Carolina, USA: Acorn Publishing, 2006.
16. Askenazi DJ, Feig DI, Graham NM, et al. 3-5 year longitudinal follow-up of pediatric patients after acute renal failure. Kidney Int 2006; 69 (1): 184–189.
17. Guignard JP, Torrado A, Da Cunha O, et al. Glomerular filtration rate in the first three weeks of life. J Pediatr 1975; 87 : 268–272.
18. Giapros VI, Andronikou SK, Cholevas VI, et al. Renal function and effect of aminoglycoside therapy during the first ten days of life. Pediatr Nephrol 2003;18 (1): 46–52.
19. Mehta RL, Kellum JA, Shah SV, et al. Acute Kidney Injury Network: report of an initiative to improve outcomes in acute kidney injury. Crit Care 2007; 11 (2): R31.
20. Lopez-Novoa JM, Quiros Y, Vicente L, et al. New insights into the mechanism of aminoglycoside nephrotoxicity: an integrative point of view. Kidney Int 2011; 79 (1): 33–45.
21. Boyer A, Gruson D, Bouchet S, et al. Aminoglycosides in septic shock: an overview, with specific consideration given to their nephrotoxic risk. Drug Saf 2013; 36 (4): 217–230.
22. Mercanti I, Boubred F, Simeoni U. Therapeutic closure of the ductus arteriosus: benefits and limitations. J Matern Fetal Neonatal Med 2009; 22 (Suppl 3): 14–20.
23. Mezu-Ndubuisi OJ, Agarwal G, Raghavan A, et al. Patent ductus arteriosus in premature neonates. Drugs 2012; 72 (7): 907–916.
24. Doležel Z, Wechsler D, Elstnerová L. Nefrotoxicita indometacinu u novorozenců. Klin Farmakol Farm 2004; 18 : 181–182.
25. Allegaert K, Cossey V, Debeer A, et al. The impact of ibuprofen on renal clearance in preterm infants is independent of the gestational age. Pediatr Nephrol 2005; 20 : 740–743.
26. Gallini F, Maggio L, Romagnoli C, et al. Progression of renal function in preterm neonates with gestational age < or = 32 weeks. Pediatr Nephrol 2000; 15 (1–2): 119–124.
27. Thayyil S, Sheik S, Kempley ST, et al. A gestation - and postnatal age-based reference chart for assessing renal function in extremely premature infants. J Perinatol 2008; 28 : 226–229.
28. Aranda JV, Thomas R. Systematic review: intravenous Ibuprofen in preterm newborns. Semin Perinatol 2006; 30 : 114–120.
29. Wilkins BH. Renal function in sick very low birthweight infants: 2. Urea and creatinine excretion. Arch Dis Child 1992; 67 : 1146–1153.
30. Gotfried J, Wiesen J, Raina R, et al. Finding the cause of acute kidney injury: which index of fractional excretion is better? Cleve Clin J Med 2012; 79 : 121–126.
31. Drukker A, Guignard JP. Renal aspects of the term and preterm infant: a selective update. Curr Opin Pediatr 2002; 14 : 175–182.
32. Wilkins BH. Renal function in sick very low birthweight infants: 3. Sodium, potassium, and water excretion. Arch Dis Child 1992; 67 : 1154–1161.
33. Costa S, Gallini F, De Carolis MP, et al. Urinary aldosterone excretion and renal function in extremely-low-birth-weight infants following acute furosemide therapy. Neonatology 2009; 96 : 171–174.
34. Musso CG, Reynaldi J, Vilas M, et al. Fractional excretion of K, Na and Cl following furosemide infusion in healthy, young and very old people. Int Urol Nephrol 2010; 42 : 273–277.
35. Schell-Feith EA, Kist-van Holthe JE, van der Heijden AJ. Nephrocalcinosis in preterm neonates. Pediatr Nephrol 2010; 25 : 221–230.
36. Cuzzolin L, Fanos V, Pinna B, et al. Postnatal renal function in preterm newborns: a role of diseases, drugs and therapeutic interventions. Pediatr Nephrol 2006; 21 (7): 931–938.
37. Rodríguez-Soriano J, Aguirre M, Oliveros R, et al. Long-term renal follow-up of extremely low birth weight infants. Pediatr Nephrol 2005; 20 (5): 579–584.
38. Bert S, Gouyon JB, Semama DS. Calcium, sodium and potassium urinary excretion during the first five days of life in very preterm infants. Biol Neonate 2004; 85 (1): 37–41.
39. Giapros VI, Andronikou S, Cholevas VI, et al. Renal function in premature infants during aminoglycoside therapy. Pediatr Nephrol 1995; 9 (2): 163–166.
40. Giapros VI, Papaloukas AL, Andronikou SK. Urinary mineral excretion in preterm neonates during the first month of life. Neonatology 2007; 91 (3): 180–185.
41. Elliott WC, Patchin DS. Effects and interactions of gentamicin, polyaspartic acid and diuretics on urine calcium concentration. J Pharmacol Exp Ther 1995; 273 : 280–284.
42. Chiruvolu A, Engle WD, Sendelbach D, et al. Serum calcium values in term and late-preterm neonates receiving gentamicin. Pediatr Nephrol 2008; 23 (4): 569–574.
43. Giapros VI, Cholevas VI, Andronikou SK. Acute effects of gentamicin on urinary electrolyte excretion in neonates. Pediatr Nephrol 2004; 19 : 322–325.
44. Tugay S, Bircan Z, Cağlayan C, Arisoy AE, et al. Acute effects of gentamicin on glomerular and tubular functions in preterm neonates. Pediatr Nephrol 2006; 21 : 1389–1392.
45. Wang W, Li C, Kwon TH, et al. Reduced expression of renal Na+ transporters in rats with PTH-induced hypercalcemia. Am J Physiol Renal Physiol 2004; 286: F534–F545.
46. Parsons PP, Garland HO, Harpur ES. Localization of the nephron site of gentamicin-induced hypercalciuria in the rat: a micropuncture study. Br J Pharmacol 2000; 130 : 441–449.
47. Zimmerman E, Lahav A. Ototoxicity in preterm infants: effects of genetics, aminoglycosides, and loud environmental noise. J Perinatol 2013; 33 (1): 3–8.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2014 Číslo 4- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Klinická a laboratorní charakteristika 22 dětí s Kawasakiho nemocí
- Akutní a pozdní nežádoucí účinky léčby septických nedonošených novorozenců gentamicinem v prvním týdnu života - otevřená prospektivní studie (část II)
- Dlouhodobé zkušenosti z monitorování jódového zásobení novorozenecké populace v České republice
- Léková aseptická meningitida a Lyellův syndrom: vzácné příčiny bolestí hlavy a exantému v dospívání
- Alagilleův syndrom
- Expozice dětí v zakouřeném prostředí je ještě nebezpečnější, než jsme předpokládali
- Opožděné dospívání u dívky
- Primární amenorea
- Sekundární amenorea nebo oligomenorea
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Alagilleův syndrom
- Sekundární amenorea nebo oligomenorea
- Primární amenorea
- Klinická a laboratorní charakteristika 22 dětí s Kawasakiho nemocí
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



