-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Lyzozómové choroby – vývoj diagnostiky a liečby na Slovensku
Lysosomal storage disorders – development of diagnostic process and treatment in Slovakia
Lysosomal storage disorders belong to the group of inborn errors of metabolism. During the last decade these diseases are losing the nickname „untreatable“. Since the end of 20th century the number of treatable disorders is constantly growing. Even better, with satisfactory therapeutic results.
Authors of this paper are describing the development and an availability of diagnostic procedures of lysosomal storage disorders in Slovakia. Furthermore, they add their own clinical experience with dealing with this type of diseases. They are focusing on pitfalls of commencing the treatment and managing the complications resulting from this therapy.
KEY WORDS:
lysosomal storage disorders, diagnostics, enzyme replacement therapy, substrate reducing therapy, bone marrow transplantation, complications of the treatment
Autoři: K. Juríčková 1; S. Mattošová 2; A. Šalingová 3; P. Jungová 2; K. Brennerová 1; M. Kolníková 4; Ľ. Košťálová 1; A. Hlavatá 1
Působiště autorů: Detská klinika LFUK a NÚDCH, Centrum dedičných metabolických porúch, Bratislava 1; Ústav lekárskej biológie, genetiky a klinickej genetiky LFUK a UNB, Bratislava 2; Oddelenie laboratórnej medicíny NÚDCH, Centrum dedičných metabolických porúch, Bratislava 3; Klinika detskej neurológie LFUK a NÚDCH, Centrum dedičných metabolických porúch, Bratislava 4
Vyšlo v časopise: Čes-slov Pediat 2018; 73 (6): 408-416.
Kategorie: Sympozium: dědičné poruchy metabolismu
Souhrn
Lyzozómové choroby, ktoré patria medzi dedičné metabolické ochorenia, v posledných desaťročiach strácajú prívlastok „neliečiteľné“. Od konca 20. storočia postupne viaceré nozologické jednotky z tejto skupiny chorôb sú terapeuticky ovplyvniteľné. Mnohokrát s dobrým efektom liečby.
Autori vo svojom príspevku popisujú vývoj a dostupnosť diagnostiky lyzozómových chorôb na Slovensku a vlastné klinické skúsenosti s ich terapiou. Zameriavajú sa na úskalia v indikácii terapie liečiteľných lyzozómových chorôb a rozvoja komplikácií v rámci zvolenej terapie.
KĽÚČOVÉ SLOVÁ:
lyzozómové choroby, diagnostika, enzýmová substitučná terapia, substrát redukujúca terapia, transplantácia kostnej drene, komplikácie terapie
ÚVOD
Lyzozómové ochorenia (z angl. lysosomal storage disorders, LSDs) sú geneticky podmienené poruchy degradácie makromolekúl väčšinou na podklade nedostatočnej aktivity lyzozómových enzýmov. Príčinou však môže byť aj nesprávna funkcia lyzozómového transportného proteínu či enzýmového aktivátora. V dôsledku deficitu či nedostatočnej funkcie týchto kľúčových proteínov dochádza k hromadeniu (tezaurácii – odtiaľ starší názov chorôb tezaurizmózy) produktov metabolizmu v organizme. Tvoria heterogénnu skupinu v rámci dedičných metabolických ochorení.
V dnešnej dobe je popísaných viac ako 50 rozličných nozologických jednotiek. Dedičnosť je autozómovo recesívna, s výnimkou X viazaných ochorení: Fabryho choroba, Mukopolysacharidóza typ II, Danonova choroba a autozómovo dominantne dedičnej adultnej formy neuronálnej ceroidnej lipofuscinózy. Dedičné metabolické poruchy (DMP) sa vo všeobecnosti spájajú najmä s pediatrickými pacientmi a ich ťažkým priebehom. Postupom času, nadobúdaním nových vedomostí, zdokonaľovaním diagnostických metód a ich sprístupňovaním dochádza častejšie k odhaľovaniu miernejších foriem ochorení, a to najmä u dospelých pacientov [1, 2]. Vďaka stále sa zlepšujúcemu povedomiu lekárov a pri niektorých DMP ich možnému terapeutickému ovplyvneniu, v posledných rokoch stúpa počet diagnostikovaných pacientov práve s lyzozómovými ochoreniami [3]. V roku 2018 evidujeme na Slovensku doteraz riadne diagnostikovaných a zdokumentovaných 185 pacientov s rôznymi lyzozómovými chorobami, tak ako je uvedené v tabuľke 1.
Tab. 1. Prehľad diagnostikovaných pacientov s lyzozómovými chorobami na Slovensku. 
Najpočetnejšiu skupinu tvoria pacienti s niektorým typom mukopolysacharidózy (MPS). Lyzozómové choroby patria medzi tie dedičné metabolické poruchy, ktoré je možné terapeuticky ovplyvniť. Okrem včasnej symptomatickej liečby pri niektorých lyzozómových chorobách spôsobených deficitom enzýmu je možné chýbajúci enzým nahradiť transplantáciou kostnej drene či farmakologickou substitúciou enzýmu (z angl. enzyme replacement therapy, ERT). Transplantácia kostnej drene má byť vykonaná do 24. mesiaca života dieťaťa, aby bol efektívne chránený CNS [4]. Cestu k úspešnej farmakologickej liečbe náhradou chýbajúcich enzýmov otvorilo objavenie manózo-6-fosfátových receptorov makrofágov, ktoré sprostredkúvajú rozpoznanie a transport špecifických enzýmov do lyzozómov buniek. Pri ERT má pacient intravenóznou infúziou podávaný chýbajúci enzým, ktorý je vyrobený rekombinantnou technológiou. Jedná sa o veľkú molekulu – proteín, ktorý neprechádza cez hematoencefalickú bariéru a tak nemôže ovplyvniť postihnutie CNS [5, 6]. Ďalšou možnosťou liečby pacientov s LSDs je substrát redukujúca terapia (SRT). Jedná sa o malé molekuly, ktoré blokujú syntézu nedegradovateľného materiálu, čím znižujú jeho akumuláciu. Majú schopnosť prenikať do CNS a teoreticky ovplyvniť aj neurologické ťažkosti [7, 8]. Pri niektorých LSDs je možné využiť liečbu chaperonmi, čo sú malé molekuly, ktoré väzbou na endogénny (ale i exogénne podávaný) enzým stabilizujú jeho štruktúru a zvyšujú tak jeho účinnosť [9].
Dnes na Slovensku dostáva enzýmovú substitučnú (ERT) alebo substrát redukujúcu terapiu (SRT) 46 pa-cientov s rôznymi, toho času liečiteľnými, lyzozómovými chorobami. Najpočetnejšia z nich je skupina pacientov s Gaucherovou chorobou. Diagnostika LSDs sa odvíja od typickej klinickej symptomatológie, ktorá spolu s laboratórnymi a zobrazovacími vyšetreniami vyústi do biochemicko-metabolických testov, enzymologického a molekulovo-genetického vyšetrenia. Kým v minulosti sme v diagnostike LSDs boli na Slovensku odkázaní v plnej miere pri finalizácii predpokladanej poruchy na pomoc laboratórií v zahraničí, dnes je väčšina pacientov diagnostikovaných na slovenských pracoviskách.
MUKOPOLYSACHARIDÓZY (MPS)
Mukopolysacharidózy (MPS) sú chronické, progresívne, multisystémové ochorenia zapríčinené geneticky podmienenou zníženou alebo chýbajúcou aktivitou jednej z 11-tich lyzozómových kyslých hydroláz, ktorých substrátom sú glykozaminoglykány (glycosaminoglycans, GAGs), v dôsledku toho dochádza k ich ukladaniu v rámci lyzozómu a ich zvýšenému vylučovaniu močom. Podľa deficitného enzýmu rozlišujeme jednotlivé typy MPS, tak ako je uvedené v tabuľke 2.
Tab. 2. Rozdelenie mukopolysacharidóz na jednotlivé typy podľa deficitného enzýmu a akumulovaného substrátu (upravené podľa Neufeld EF., Muenzer J., 2001). 
Legenda: MPS – mukopolysacharidóza, DS – dermatansulfát, DS – heparansulfát, KS – keratansulfát, CHS – chondroitínsulfát Klinickou manifestáciou MPS je typická faciálna stigmatizácia, kontraktúry končatín, deformity dolných končatín a pazúrovité postavenie prstov, môže byť porucha sluchu. Zmeny pri RTG vyšetrení u pacientov s MPS zahŕňajú rybí tvar deformity stavcov, veslovité rozšírenie rebier a dysplastické zmeny na koxách. Spoločne sa označujú ako dysostosis multiplex. Akumulácia GAG v organizme spôsobuje hepatosplenomegáliu, hernie, očné zmeny (zákal rohovky, glaukóm, retinopatia, anomálie optického nervu), kardiomyopatiu a chlopňové chyby srdca. Rozsah prejavov postihnutia a ich závažnosti sa pohybuje od miernej po ťažkú formu ochorenia. Diagnóza je väčšinou stanovená medzi 18. až 36. mesiacom života. Najmarkantnejším rozdielom medzi deťmi s MPS aj pri podobnom somatickom postihnutí je postihnutie nervového systému a kognitívnych funkcií. Niektoré typy MPS sú bez mentálneho postihnutia, iné sú spojené s výraznou mentálnou retardáciou. Nekonštantné kognitívne postihnutie je pri MPS I typu Hurler-Scheie (MPS I H/S) a bez postihnutia bývajú okrem MPS I typ Scheie aj mierna forma MPS II, MPS IV, MPS VI a MPS IX [10, 11].
Pacienti s MPS tvoria na Slovensku najväčšiu skupinu v rámci LSDs v počte 43. Pacienti s MPS typ I patrili medzi prvých diagnostikovaných pacientov s LSD v 90-tych rokoch, kedy sa začalo zvyšovať povedomie o týchto chorobách [12, 13]. Jednotlivé rozdelenie a počty diagnostikovaných pacientov uvádza tabuľka 3. V rámci fenotypovej variácie u MPS typ I boli diagnostikovaní nielen pacienti s ťažkým a mierne ťažkým fenotypom Hurler, Hurler-Scheie, ale aj dvaja bratia s ľahkou formou Scheie syndrómu (obr. 1).
Tab. 3. Jednotlivé typy MPS diagnostikované v slovenskej populácii. 
Obr. 1. Pacienti s MPS I Scheie syndrómom.
Fig. 1. Patients with MPS I Scheie syndrome.
Zatiaľ neboli diagnostikovaní pacienti do dvoch rokov života s vhodným darcom na transplantáciu kostnej drene, ktorá pri úspešnom zákroku môže zabrániť rozvoju postihnutia CNS. Enzýmovou substitučnou terapiou (ERT) sme liečili 4 pacientov. V rámci nadobúdania skúseností s liečbou sme indikovali aj alternatívny dávkovací režim podávania enzýmu jedenkrát za dva týždne [14, 15]. ERT sme ukončili u dvoch pacientiek s MPS I typ H/S pre nedostatočný efekt terapie a progresiu choroby. Všetci doteraz zachytení pacienti s MPS typ II boli s neurologickým postihnutím. U jedného pacienta v minulosti, keď ešte nebola dostupná ERT, bola v terapii využitá transplantácia kostnej drene. Došlo u neho k trvalému regresu organomegálie a kardiomyopatie, ale po počiatočnom a prechodnom zlepšení kognitívnych funkcií sa jeho klinický stav výrazne zhoršil po mentálnej i pohybovej stránke [16]. Traja pacienti sú aktuálne na ERT.
U MPS typ III dominuje v slovenskej populácii subtyp IIIA. V celej skupine sa skúšala substrát redukujúca liečba 3-hydroxyisoflavónom, avšak nie s veľkým úspechom. Aj pri tomto type u nás dominujú ťažké formy ochorenia. Zatiaľ v SR nebol diagnostikovaný pacient s atenuovanou formou či pacient v dospelom veku. U pacientiek so subtypom IIID sme do veku 14 rokov pozorovali pomerne dobré mentálne funkcie, ktoré im umožnili absolvovať bežnú základnú školu. Traja pacienti boli zachytení s MSP typ IV A. Posledný diagnostikovaný len nedávno začal ERT. Jeden pacient s MPS typ VI je liečený 12 rokov ERT. Nakoľko ochorenie nepostihuje CNS, okrem toho, že má výborný mentálny status vďaka liečbe nemá organomegáliu a je zachovaná jeho mobilita. Je samostatný, študuje, no progredujúce dysplastické zmeny na koxe vyžadujú operačné riešenie.
MORBUS GAUCHER
Morbus Gaucher (z angl. Gaucher disease, GD) je choroba, pri ktorej dochádza ku akumulácii glukozylceramidu v bunkách makrofágového pôvodu v dôsledku deficitu β-glukocerebrozidázy. Nedegradovaný substrát je hromadený v bunkách monocyto - makrofágového systému, čím vznikajú tzv. „Gaucherove bunky“, ktoré sa nachádzajú v jednotlivých tkanivách a orgánoch. Väčšinou ide o metabolicky aktívne orgány. Prvotne býva postihnutá kostná dreň, potom retikuloendotel sleziny, Kuppferove bunky v pečeni, osteoklasty, ale aj ktorýkoľvek orgán či tkanivo ako aj CNS, pľúca či oko [17]. Podľa orgánového postihnutia a klinických príznakov rozdeľujeme Gaucherovu chorobu do 3 základných typov.
Najčastejší typ 1 – non neuronopatická forma, vyskytujúci sa až v 94 %, bol nesprávne nazývaný tiež adultný typ. Prvé príznaky sa najčastejšie objavujú už počas detstva respektíve puberty. V detskom veku býva typickým príznakom neprospievanie, nižší vzrast, neskorší nástup puberty. Pacienti sa sťažujú na únavu, ľahkú tvorbu modrín, bolesti kostí, bolesti brucha. Splenomegália či kombinovaná hepatosplenomegália patria k jedným z typických príznakov. Zvýšená krvácavosť je spôsobená útlakom červenej kostnej drene ukladajúcim sa glukocerebrozidom s následným poklesom krvotvorby. Prvé bývajú postihnuté trombocyty, potom erytrocyty a leukocyty [18]. Akumulácia nedegradovaného materiálu v kostiach spôsobuje ich remodeláciu a útlak cievneho zásobenia. Dôsledkom bývajú intenzívne bolesti kostí, takzvané kostné krízy. Tento stav býva sprevádzaný celkovými prejavmi ako zvýšená teplota, leukocytóza, zvýšenie zápalovej aktivity. Kostné krízy bývajú nesprávne interpretované ako akútna osteomyelitída, avšak hemokultúra býva opakovane negatívna. Môžu vznikať patologické fraktúry. Mentálny vývoj je bez patológie.
Typ 2 – akútna neuronopatická forma – je najzávažnejšou formou GD. Príznaky sa objavujú už prenatálne či perinatálne, najneskôr v prvých mesiacoch života. Patrí k nim hepatosplenomegália, kachexia, retroflexia krku, rýchlo progredujúce neurologické postihnutie v zmysle bulbárneho syndrómu, myoklonickej epilepsie či atypický očný pohyb. Kožné postihnutie má väčšinou charakter kožnej ichtyózy typu collodion-baby. Časté sú dysmorfické rysy. K úmrtiu dochádza už väčšinou do dvoch rokov života [19].
Typ 3 – chronická neuronopatická forma – sa vyskytuje približne u 5 % pacientov s GD. Manifestuje sa v skorom detstve, podobnými príznakmi ako pacienti s GD typ 1, postupne sa však rozvíja aj neurologické postihnutie. V predškolskom či školskom veku sa objavujú atypické pohyby hlavy a očí, strabizmus, nystagmus, sekundárna epilepsia, myoklonické kŕče, tremor, dystónie, spomalenie psychomotorického vývoja až demencia. U niektorých pacientov sa rozvíjajú deformity hrudníka a chrbtice tvorí sa až gibus. U ďalších je najzávažnejšie postihnutie myokardu, chlopní aorty často s masívnymi kalcifikáciami.
Prvá pacientka s GD1 na Slovensku bola diagnostikovaná morfologickým vyšetrením kostnej drene ešte v roku 1958. Enzymologické a genetické vyšetrenie diagnózu potvrdilo v roku 2005. Ďalšie dve adolescentky (sestry) s GD1 boli zachytené až v 90-tych rokoch a ako prvé sa na Slovensku začali liečiť ERT. Ostatní pacienti s GD boli diagnostikovaní až po roku 2000. Doteraz ich je 23. GD1 tvorí 91 % z nich. Najmladší pacient mal v čase stanovenia diagnózy 11 me-siacov a najstarší dospelý pacient 84 rokov. Dvanásť pacientov bolo diagnostikovaných v detskom veku a 10 v dospelom. Aj naše skúsenosti potvrdzujú, že medzi lyzozómovými ochoreniami tvoria pacienti s GD skupinu najdlhšie a najúspešnejšie liečených pacientov u nás. Na obráz-koch detskej pacientky dokumen-tujeme rýchly ústup extrémnej organomegálie po začatí ERT (obr. 2A, B).
Obr. 2. A. Pacientka s Morbus Gaucher – organomegália v čase diagnostikovania ochorenia (vľavo). 2 B. Pacientka s Morbus Gaucher – ústup organomegálie po 12 mesiacoch ERT terapie (vpravo).
Fig. 2. A. Patient with Gaucher disease – organomegaly at the time of diagnosis (left). 2 B. Patient with Gaucher disease – reduction of organomegaly after 12 months of ERT (right).
ERT sa doteraz liečilo 15 pacientov. Traja sa liečia druholíniovou substrát redukujúcou terapiou. U troch dospelých pacientov sme vzhľadom k veku, nevýrazným klinickým ťažkostiam zo strany GD, alebo na ich žiadosť liečbu nezačínali. Momentálne prebieha genotypizácia pacientov za účelom možnej liečby perorálnou prvolí-niovou substrát redukujúcou liečbou. Z ostatných typov GD sme zachytili jednu pacientku s GD typ 2 s akútnym neurologickým postihnutím, ktorá zomrela v druhom roku života. Jeden pacient s GD typ 3, s postupným nástupom neurologických ťažkostí sa lieči 12 rokov ERT od svojich 14 mesiacov. Od zhoršovania neurologickej symptomatológie je liečba v kombinácii so SRT. Výrazne sa tak znížil tremor končatín aj celého tela. U jedného pacienta v detskom veku, ktorý bol diagnostikovaný v rámci rodinného skríningu, zatiaľ neprogredujú klinické ťažkosti, preto sme liečbu nezačínali, ale zostáva pravidelne monitorovaný. Zo špecifických biomarkerov monitorujeme aktivitu chitotriozidázy v sére a glukozylsfingozín (Lyso-Gb1) zo suchej kvapky krvi, ktorý sa nám javí ako výhodný marker na monitorovanie progresie ochorenia a tým pri zhodnotení ostatných laboratórnych i klinických nálezov umožňuje správne načasovanie liečby či sledovanie jej efektivity [20].
MORBUS FABRY
Morbus Fabry (z angl. Fabry disease, FD) je spôsobený poruchou lyzozómovej α-galaktozidázy s následnou akumuláciou neutrálnych glykosfingolipidov a produktov štiepenia alfa-galaktosylu (GB3-globotriosylceramid) v bunkách rôznych orgánov a tkanív (obličky-postihnutie glomerulov, tubulov, myokardu, srdcovej chlopne, ganglií zadných rohov miechy, autonómny nervový systém, endotel, hladké svalstvo ciev). I keď je dedičnosť viazaná na chromozóm X, ochorenie sa môže manifestovať aj u žien „prenášačiek“, ktoré sú tak manifestnými heterozygotkami.
Fabryho choroba je ochorenie s pomalou progresiou, nestretávame sa s rýchle progredujúcimi letálnymi formami. Typickým klinickým príznakom v detstve je krutá bolesť akrálnych častí tela (plosky, dlane), pričom akroparestézie sú provokované teplotou či fyzickou aktivitou. Chorí zle znášajú teplo, majú znížené potenie. Neskôr sa môžu objaviť angiokeratómy na koži. Poškodenie rohovky cornea verticillata, postihnutie gastrointestinálneho traktu – bolesti brucha, hnačky. Časté bývajú bolesti hlavy, vertigo, únava, tinitus či depresia. U adolescentov či mladých dospelých sa objavujú príznaky z poškodenia obličiek či myokardu [21, 22]. Ide o progresívne ochorenie skracujúce dĺžku života. Vyúsťuje do renálnej insuficiencie, infarktu myokardu, mozgovej príhody či multi-orgánového zlyhania [23].
Prvý pacient s FD na Slovensku bol diagnostikovaný v roku 1999 na základe histologického vyšetrenia biopsie obličky indikovanej pre proteinúriu. Doplnené enzýmové a molekulovo-genetické vyšetrenie diagnózu potvrdilo a od roku 2004 sa začal liečiť ERT. Ochorenie bolo potvrdené aj u pacientovej matky, ktorá mala dominantné postihnutie kardiovaskulárneho systému s hypertrofickou kardiomyopatiou. Ako jediná žena zo súboru slovenských pacientiek s FD mala indikovanú ERT.
U Fabryho choroby sme ako u prvého ochorenia z liečiteľných LSDs začali od roku 2008 realizovať projekty aktívneho vyhľadávania u symptomatických pacientov. Projekty sa týkali najčastejších klinických príznakov, ktorými sa ochorenie manifestuje. Kardiológovia sa zameriavali na pacientov s hypertrofickou kardiomyopatiou. U nefrológov sa realizovali projekty medzi transplantovanými, dialyzovanými a pacientami v predialyzačnom programe. Posledné skríningové aktivity realizujeme v spolupráci s neurológmi medzi pacientami s cievnou mozgovou príhodou v mladom veku a pacientami so sklerózou multiplex. Doteraz bolo u nás diagnostikovaných 33 pacientov s FD, 16 mužov a 17 heterozygotných žien. Sedem detí bolo zachytených cez rodinný skríning. Päť z nich je stále asymptomatických a 2 chlapci (bratia) sa začali liečiť v adolescentom veku pre klinickú manifestáciu ochorenia. Celkovo sa ERT liečilo 8 pacientov.
U pacientov s dominantným postihnutím obličiek, či multiorgánovým postihnutím na ERT pozorujeme stabilizáciu renálnych funkcií a pokles proteinúrie po začatí terapie. Len jeden – prvý diagnostikovaný a liečený pacient, ktorý bol už v čase nasadenia liečby v pokročilom štádiu renálnej insuficiencie, podstúpil transplantáciu obličky. U dospelých pacientov s dominantným postihnutím kardiovaskulárneho systému sme po 3 rokoch terapie zaznamenali výrazné zlepšenie klinického stavu a okrem stabilizácie aj zlepšenie kardiologického nálezu. Avšak pri zhoršení compliance pacienta pri podávaní ERT došlo rýchle k progresii základného ochorenia, ktoré viedlo neskoršie k jeho exitu. Iba jeden liečený dospelý pacient s FD nie je v plnom pracovnom pomere a jeden je na čiastočnom invalidnom dôchodku. Biomarkerom pre posúdenie fenotypu ochorenia či možnosti monitoringu efektu terapie je globotriaosyl-sfingozín (Lyso-Gb3) stanovovaný zo suchej kvapky krvi vyšetrovaný na zahraničnom pracovisku [24]. Pre nádejnú perorálnu liečbu chaperónom, ktorá je toho času dostupná aj na Slovensku, sme zatiaľ nemali pacientov s vhodnými mutáciami.
MORBUS POMPE
Morbus Pompe (z angl. Pompe disease, PD) je ochorenie spôsobené deficitom kyslej α-glukozidázy (kyslej maltázy). Tento enzým katalyzuje hydrolýzu α-1,4 - a α-1,6 glykozidických väzieb glykogénu. Nedostatočná aktivita enzýmu spôsobuje hromadenie štrukturálne normálneho glykogénu v lyzozómoch a intracelulárne. Postihnuté sú najmä svalové bunky kostrového svalstva myokardu, hladké svalstvo menej. K akumulácii glykogénu dochádza aj v pečeni. Svalové vlákna v dôsledku ochorenia strácajú schopnosť kontraktility, zmenšuje sa svalová sila a svalový tonus, dochádza k hypoventilácii. Metabolizmus sacharidov nie je porušený, nezaznamenávame hypoglykémiu. Mentálny vývoj nebýva postihnutý, no motorický vývoj u detí je nerovnomerný, porušená býva najmä hrubá motorika [25]. Ochorenie sa môže manifestovať tzv. včasnou – infantilnou, prechodnou – juvenilnou a neskorou – adultnou formou. Zatiaľ čo pre infantilnú formu je typické postihnutie myokardu a kostrového svalstva, pri neskorších formách nebýva postihnutý myokard. Čím skôr sa objavia symptómy, tým skôr býva ochorenie so závažnejším priebehom a s horšou prognózou.
Príznaky infantilnej formy sa objavujú do 6. mesiaca po narodení. Typická je výrazná svalová hypotónia (tzv. obraz „floppy baby“), vedie k problémom so saním, hltaním, dýchaním. Deti neprospievajú, býva mierna hepatomegália a makroglosia. K úmrtiu prichádza do 1–2 rokov na kardiorespiračné zlyhanie.
Juvenilná forma – svalová slabosť a progredujúca hypotónia sa objavujú po 12. mesiaci života. Progresia však nie je taká rýchla. Neliečení pacienti sa dožívajú do 3. dekády [26]. Adultná forma – typická je pomalá progresia postihnutia najmä proximálneho pletencového svalstva, svalstva trupu a bránice s príznakmi prehlbu-júcej sa respiračnej insuficiencie. Problémy sa objavujú väčšinou po 15. roku života. Pacienti nie sú schopní behu alebo rýchlej chôdze, majú problém vstať zo sedu bez pomoci rúk, vyjsť do schodov, objavuje sa abnormálna chôdza s predsunutím panvy a vytáčaním bokov, časté sú pády. Pri vstávaní z drepu vidíme Gowersove znamenie (šplhanie), kedy si pacient pri vstávaní pomáha oporou rúk o dolné končatiny. Činnosť dýchacích svalov a bránice je znížená v horizontálnej polohe, v noci dochádza k hypoventilácii [27]. Pri progresii ochorenia pacient postupne nie je schopný chodiť, stráca sa sebaobslužnosť, neskôr je pripútaný na lôžko. Príčinou smrti býva respiračné zlyhanie, ktorému však môže predchádzať pneumónia, pľúcna hypertenzia či srdcové zlyhanie.
Prvá pacientka s infantilnou formou bola diagnostikovaná v druhej polovici 90-tych rokov ešte v dobe, keď nebola dostupná liečba. O 12 rokov neskôr sa zachytil ďalší pacient s infantilnou formou. V čase, keď začal ako prvý pacient s PD na Slovensku dostávať ERT, bol v tak závažnom stave, že nedošlo k zvráteniu priebehu choroby a exitoval. Ďalšia pacientka s infantilnou formou sa lieči ERT od svojich 4 mesiacov života. Napriek úprave hypertrofickej kardiomyopatie jej klinický stav progreduje. Momentálne ako 8,5-ročná je ležiaca tracheostomovaná pacientka na domácej umelej pľúcnej ventilácii so zavedenou perkutánnou gastrostómiou na zabezpečenie výživy. Štvrtý pacient s infantilnou formou sa začal liečiť ERT po kardio-respiračnom zlyhaní ako prvom prejave ochorenia v 6 mesiacoch života. Vo svojich 5 rokoch sa primerane vyvíja. Je bez hypertrofickej kardiomyopatie, bez poruchy motoriky s dobrou svalovou silou. Posledná pacientka bola diagnostikovaná v 12. mesiaci života neurológom pre pretrvávanie zvýšených koncentrácii aminotransferáz a kreatínkinázy. Od dojčenského veku pre hepatopatiu bola vyšetrovaná gastroenterológom a imunológom. Je asymptomatická a bez liečby. Práve u takýchto pacientov treba zdôrazniť pravidelné monitorovanie, aby sa predišlo progresívnemu zhoršeniu a liečba bola správne načasovaná.
Medzi pacientov s neskorými formami Pompeho choroby tzv. LOPD (z ang. Late-onset Pompe disease) zaraďujeme troch pacientov s juvenilnou formou a siedmich s adultnou formou [28]. Jeden pacient s juvenilnou formou sa doteraz pre asymptomatický stav neliečil. Dvaja dospelí pacienti z vlastného rozhodnutia ukončili liečbu, ktorá mala dobrý efekt po roku a po 6 rokoch jej trvania. U prvé-ho došlo k rýchlej strate nadobudnutých motorických schopností, u druhej pacientky sa rok po ukončení liečby znížila svalová sila, došlo k vzostupu aktivity svalových enzýmov a ku kvantitatívnemu zvýšeniu vylučovania tetrasacharidu v moči. Celkovo u LOPD dominuje poškodenie kostrového svalstva, typické sú u nich známky myopatie.
Štyri pacientky s adultnou formou PD však nevyžadujú pomoc chodítka pri pohybe a päť pracuje na plný úväzok. V našom súbore monitorujeme aj progresívne zhoršovanie respiračných funkcií. Pacientka s juvenilnou formou, ktorá bola diagnostikovaná a liečená až v dospelom veku, v dôsledku progresívneho zhoršovania respiračných funkcií vyžaduje SiPAP. Pomocou pri rozhodovaní kedy začať a ukončiť liečbu u dospelých pacientov by mal byť publikovaný európsky konsenzus odborníkov pre túto problematiku [29].
MORBUS NIEMANN-PICK TYP C
Morbus Niemann-Pick typ C (NP-C) nepatrí medzi lyzozómové enzymopatie, ale je spôsobený poruchou transportu cholesterolu vo vnútri bunky. Dochádza k narušeniu procesu v priebehu endocytózy LDL cholesterolu a jeho sekvestrácie do lyzozómu. Transport z perinukleárneho lyzozómu do bunkovej membrány a endoplazmatického retikula je spomalený až zastavený. V dôsledku deficitu transportného proteínu NPC1 alebo NPC2 je cholesterol zadržaný v lyzozómoch postihnutých buniek, akumuluje sa a vedie k narušeniu ich funkcie. Cholesterol je dôležitou súčasťou bunkovej steny. Jeho akumulácia v bunke s následným nedostatkom v bunkovej stene spôsobuje dysfunkciu až apoptózu bunky. Cholesterol je potrebný napr. aj k myelinizácii nervových vlákien, kde jeho deficit spôsobuje vážne poruchy. NPC1 proteín je dôležitý taktiež na transport sfingozínu, ktorý sa akumuluje spolu s cholesterolom v bunkách a prehlbuje poruchu ich funkcie [30].
Klinické príznaky ochorenia začínajú u 50 % pacientov v novorodeneckom a dojčenskom veku cholestatickou hepatopatiou a hepatosplenomegáliou, ktorá vo väčšine prípadov ustúpi behom niekoľkých mesiacov. Možný je aj nález izolovanej splenomegálie, ktorý môže aj niekoľko rokov predchádzať rozvoju ďalších klinických príznakov objavujúcich sa medzi 3.–13. rokom života. V školskom veku môže byť prvým príznakom neobratnosť, zhoršenie prospechu, pamäte. Objavujú sa zmeny správania, porucha pohľadu nahor, progreduje ataxia, dysartria, extra-pyramídová symptomatológia (dystónia) a demencia. Porucha hltania spôsobuje aspirácie spojené s častými infekciami dolných dýchacích ciest. Charakteristickým príznakom je gelastická kataplexia – náhla strata svalového tonusu vyvolaná emóciou. Môžu sa objaviť aj záchvaty kŕčov s rozvojom sekundárnej epilepsie. V dospelosti môže byť jediným symptómom psychiatrické postihnutie – schizofrénia, bipolárna porucha či demencia [31, 32]. Postupný vývoj klinických príznakov a orgánového postihnutia je zobrazený na obrázku 3.
Obr. 3. Vývoj klinických príznakov a orgánového postihnutia u pacientov s Niemannovou-Pickovou chorobou typ C. 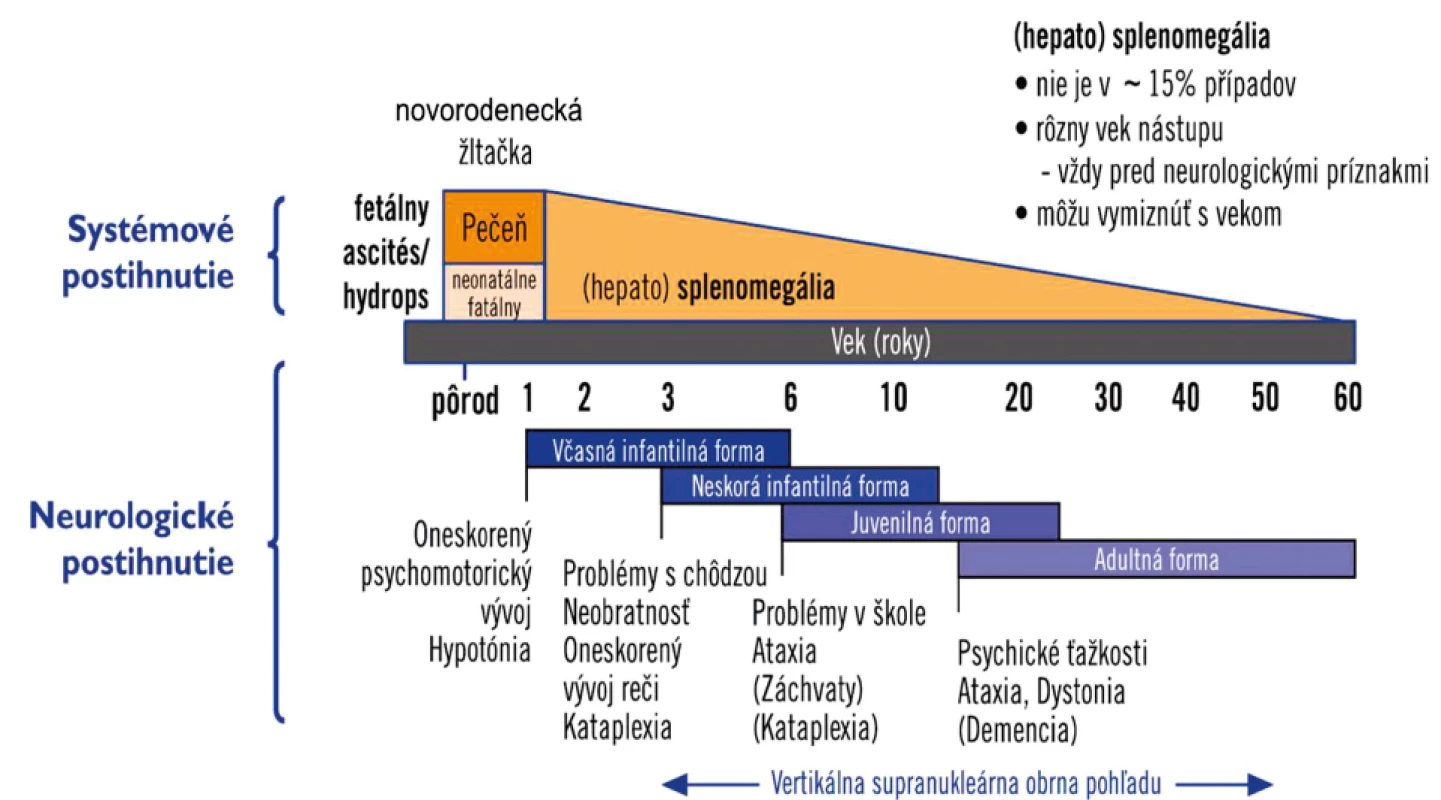
V súbore slovenských pacientov s LSDs, ktoré nie sú spôsobené enzymopatiou, tvoria pacienti s NP-C najpočetnejšiu skupinu. Prvý slovenský pacient mal diagnostikovanú infantilnú formu NP-C v roku 1995. Podozrenie na toto ochorenie vzniklo pri histochemickom vyšetrení preparátov zo sleziny pacienta prof. Ellederom, nakoľko hneď od narodenia bola u dieťaťa pozorovaná rýchle progredujúca splenomegália, ktorá si pre hroziacu ruptúru sleziny vyžiadala splenektómiu už v 2. roku jeho života. Diagnóza bola potvrdená na pracovisku v Lyone tzv. filipínskym testom. U dieťaťa rýchle napredoval vývoj neurologickej symptomatológie. Post mortem bola neskôr diagnóza potvrdená aj molekulovo-genetickým vyšetrením.
O 8 rokov neskôr bola diagnostikovaná druhá slovenská pacientka s NP-C, s juvenilnou formou. Aj u nej bola diagnóza stanovená vďaka kedysi jedinej metóde filipínskym testom na kultivovaných fibroblastoch. Dievča bolo do 14 rokov života premiantkou triedy na bežnej základnej škole. V priebehu 8 rokov však došlo k plnému rozvoju závažného klinického obrazu choroby.
Zlom v diagnostikovaní adultnej formy NP-C nastal pri zameraní sa na pacientov s presenilnou demenciou, kedy v krátkej dobe boli diagnostikované 3 dospelé pa-cientky. Súbor doteraz diagnostikovaných pacientov tvoria 2 pacienti s infantilnou, 7 s juvenilnou a 4 s adultnou formou NP-C. Okrem prvého pacienta, kedy liečba nebola dostupná, sa všetci začali liečiť substrát redukujúcou terapiou (SRT), ktorá spomaľuje progresiu závažného neurologického postihnutia. U druhého pacienta s infantilnou formou však vzhľadom na rýchly rozvoj neurologickej symptomatológie a diagnostikovanie akútnej lymfoblastickej leukémie s komplikovaným priebehom bola terapia zakrátko ukončená.
Prví pacienti NP-C boli diagnostikovaní pomocou spomínaného filipínskeho testu. Celý diagnostický proces bol veľmi zdĺhavý. Pokúsili sme sa preto využiť v diagnostike ako špecifický biomarker vyšetrenie oxysterolov v plazme na zahraničnom pracovisku. Dnes pri vysokej suspekcii, že sa u pacienta jedná o NP-C na základe klinického obrazu a anamnestických údajov, dopĺňame vyšetrenie lysosfingomyelínu 509 zo suchej kvapky krvi na Klinike dětského a dorostového lékařství 1. LF UK a VFN v Diagnostickom laboratóriu DMP v Prahe [33]. Definitívnu diagnózu stanovujeme pomocou molekulovo-genetického vyšetrenia. Vo väčšine prípadov za spolupráce už spomínaného pražského pracoviska.
DIAGNOSTIKA, LIEČBA A MONITOROVANIE PACIENTOV S LYZOZÓMOVÝMI CHOROBAMI NA SLOVENSKU
Vzhľadom na stúpajúci počet pacientov s lyzozómovými chorobami na Slovensku, najmä po roku 2000 sa u nás výrazne rozšírila paleta laboratórnych vyšetrení potrebných v diagnostike a monitorovaní týchto chorôb.
Po zhodnotení klinického obrazu, anamnestických údajov, výsledkov tzv. bežných laboratórnych (krvný obraz, náter periférnej krvi, biochemické parametre) a zobrazovacích vyšetrení (RTG, ultrasonografia parenchymatóznych orgánov, magnetická rezonancia mozgu) pokračujeme metabolickými skríningovými vyšetreniami. Už tradične na laboratórnom úseku Centra dedičných metabolických porúch Národného ústavu detských chorôb (NÚDCH) – Oddelení laboratórnej medicíny NÚDCH, stanovujeme kvantitatívne a kvalitatívne vylučovanie glykozaminoglykánov močom, aspartylglukozaminúriu, sialo-glykoproteíny v moči s kvantitatívnym stanovením kyseliny sialovej. Tenkovrstvovú chromatografiu oligosacharidov v moči používame nielen ako štandardné skríningové vyšetrenie, ale pri zvýšenom vylučovaní tetrasacharidu u pacientov s Pompeho chorobou v spolupráci s Centrom excelentnosti pre glykomiku Chemického ústavu SAV stanovujeme aj jeho kvantitu [34]. Tento parameter využívame aj pri monitorovaní efektivity terapie a pri rozhodovaní nasadenia včasnej liečby u pacientov, ktorí nemajú plne vyvinutý klinický obraz choroby.
Výraznou pomocou pri diagnostike LSDs bolo zavedenie vyšetrenia chitotriozidázy v Ústave lekárskej biológie, genetiky a klinickej genetiky LFUK a UNB, ktorej aktivita sa zvyšuje pri stimulácii makrofágového systému. Vyšetrenie využívame nielen v diagnostike, ale aj pri monitorovaní pacientov s Gaucherovou a Niemannovou--Pickovou chorobou. Na tomto pracovisku zväčša aj finalizujeme diagnostiku pacientov s lyzozómovými chorobami enzymologickým a molekulovo-genetickým vyšetrením [35, 36]. V prípade, že tu nie je diagnostika dostupná, zo zahraničných pracovísk pri finalizácii diagnostiky najčastejšie spolupracujeme s Klinikou dětského a dorostového lékařství 1. LF UK a VFN s Diagnostickým laboratóriom DMP v Prahe.
Stanovenie enzýmovej aktivity zo suchej kvapky kapilarizovanej krvi (SKK) nabratej na filtračný papierik bola metodika, ktorá výrazne posunula vpred diagnostiku lyzozómových enzymopatií. Na Slovensku je dostupná od roku 2006. Postupne sa pomocou suchej kvapky krvi dajú diagnostikovať pacienti s liečiteľnými formami mukopolysacharidóz (MPS I, II, IVA, VI, VII), Pompeho, Fabryho a Gaucherovou chorobou i deficitom kyslej lyzozómovej lipázy (LAL-D). Vo väčšine testovania spolupracujeme so zahraničnými laboratóriami. Skríningové vyšetrenie zo SKK enzýmovej aktivity alfa-glukozidázy deficitnej u pacientov s Pompeho chorobou je od roku 2013 dostupné na Slovensku v Ústave lekárskej biológie, genetiky a klinickej genetiky LFUK a UNB. Novodobé diagnostické metódy umožnili pri LSDs ústup od invazívnych vyšetrení s odberom tkanív k histochemickému vyšetreniu, no biopsia orgánov si ponecháva svoje miesto v nejednoznačných prípadoch. Jedná sa hlavne o prípady s nejasnou patogenitou nájdených mutácií.
Do Centra dedičných metabolických porúch NÚDCH (CDMP NÚDCH) v Bratislave prichádzajú detskí i dospelí pacienti z celého Slovenska nielen za účelom diferenciálnej diagnostiky, ale aj za účelom finalizácie skríningom suponovanej diagnózy. V prípade potvrdenia liečiteľného ochorenia je na klinickom úseku CDMP NÚDCH – Detskej klinike LFUK a NÚDCH, indikovaná terapia. Zatiaľ najviac využívaná je ERT. U pacientov s niektorým typom liečiteľnej MPS je podávaný enzým v týždňových intervaloch, u pacientov s GD, FD a PD je podávaný raz za 14 dní v stacionári CDMP podľa presného protokolu. Centrálny venózny vstup využívame iba u jednej pacientky v podobe port-a-cathu. V úvode liečby používame medikamentóznu premedikáciu. V prípade, že pacient dobre liečbu toleruje, ukončujeme premedikačnú prípravu.
Za takmer 20 rokov podávania ERT sme zaznamenali iba mierne nežiadúce reakcie, ako bola zvýšená teplota, exantém, únava či bolesti hlavy a končatín večer po aplikácii enzýmu. Všetci pacienti začínajú terapiu v CDMP. Ak je bydlisko liečeného pacienta výrazne vzdialené od CDMP, po úvodných podaniach liečby v spolupráci so zdravotnou poisťovňou pacienta zabezpečujeme na pokračovanie terapie v blízkosti jeho domova tzv. aplikačné pracovisko. Dlhodobo dobre spolupracujeme s takýmito aplikačnými pracoviskami v Košiciach, Prešove, Vranove nad Topľou, Poprade, Michalovciach, Bardejove, Liptovskom Mikuláši, Trstenej, Žiline, Zvolene, Starej Ľubovni, Martine, Žiari nad Hronom, Trenčíne a Myjave. Efekt terapie je však naďalej pravidelne, najčastejšie raz za 6 mesiacov, monitorovaný v CDMP NÚDCH. Na Slovensku toho času nie je možné domáce podávanie ERT, ako je tomu vo viacerých európskych krajinách. Aktuálne je ERT liečených 39 pacientov.
U ostatných slovenských pacientov využívame SRT. Liečbu chaperonmi sme zatiaľ nepoužili. Obidva typy používanej terapie sú indikované pacientom v CDMP a efekt podávanej liečby je tu aj monitorovaný. V prípade jednoznačne potvrdenej progresie základného ochorenia, bez pozitívneho vplyvu podávanej terapie je na našom pracovisku aj liečba ukončená. Tak sme to už indikovali u dvoch pacientiek s MPS I a pacienta s infantilnou formou NP-C. Pacient však naďalej zostáva v našej starostlivosti. Na monitorovaní a riešení komplikácií dospelých pacientov spolupracujeme so stabilným tímom lekárov špecialistov pre dospelý vek, kde sú neurológ, hematológ, gastroenterológ, nefrológ, kardiológ, pneumológ.
ZÁVER
Lyzozómovým ochoreniam sa od konca 20. storočia vďaka dostupnej liečbe a zlepšujúcej diagnostike dostáva zvýšená pozornosť nielen medzi špecialistami na vrodené metabolické choroby, ale i z celkového pohľadu zdravotnej starostlivosti o populáciu aj na Slovensku. Dedičné metabolické ochorenia sa vo všeobecnosti spájajú najmä s pediatrickými pacientmi a ich ťažkým priebehom. Postupom času, nadobúdaním nových vedomostí, vylepšovaním diagnostických metód dochádza častejšie k odhaľovaniu miernejších foriem ochorení, a to najmä u dospelých pacientov.
Diagnostike LSDs pomáhajú cielené projekty selektívneho vyhľadávania pacientov s liečiteľnými ochoreniami. Na Slovensku sme od roku 2008 postupne zaviedli 10 takýchto projektov v spolupráci so zahraničnými ale i domácimi laboratóriami. V dnešnej dobe existuje efektívna terapia len na niektoré z týchto chorôb. Preto je nutné poznať aktuálnu situáciu na Slovensku s výskytom LSDs. Bude potrebné zachytiť čo najskôr tých pacientov, ktorí by z liečby profitovali, vedieť predpokladať prognózu a mať vhodné markery na sledovanie účinku terapie. V tomto procese je preto veľmi dôležité získavanie vlastných skúseností v klinickej praxi.
Ďakujeme za spoluprácu pri diagnostikovaní a získavaní epidemiologických údajov o pacien-toch s lyzozómovými chorobami na Slovensku Metabolickej ambulancii Kliniky detí a dorastu LF UPJŠ a DFN v Košiciach, Metabolickej ambulancii DFNsP v Banskej Bystrici a Metabolickej ambulancii Kliniky detí a dorastu UNM a JLF Martin.
MUDr. Katarína Juríčková
Detská klinika LFUK a NÚDCH
Centrum dedičných metabolických porúch
Limbová 1
833 40 Bratislava
Slovenská republika
e-mail: katarina.juricek@gmail.com
Zdroje
1. Sirrs S, Hollak C, Merkel M, et al. The frequencies of different inborn errors of metabolism in adult metabolic centres: Report from the SSIEM Adult Metabolic Physicians Group. JIMD Rep 2016; 27 : 85–91.
2. Pérez-López J, Ceberio-Hualde L, García-Morillo JS, et al. Clinical characteristics of adult patients with inborn errors of metabolism in Spain: A review of 500 cases from university hospitals. Mol Genet Metab Rep 2017; 10 : 92–95.
3. Kingma SDK, Bodamer OA, Wijburg FA. Epidemiology and diagnosis of lysosomal storage disorders; challenges of screening. Best Pract Res Clin Endocrinol Metab 2015; 29 (2): 145–157.
4. Jameson E, Jones S, Wraith JE. Enzyme replacement therapy with laronidase (Aldurazyme(®)) for treating mucopolysaccharidosis type I. Cochrane Database Syst Rev 2013; 11: CD009354.
5. Andersson H, Kaplan P, Kacena K, et al. Eight-year clinical outcomes of long-term enzyme replacement therapy for 884 children with Gaucher disease type 1. Pediatrics 2008; 122 (6): 1182–1190.
6. Starzyk K, Richards S, Yee J, et al. The long-term international safety experience of imiglucerase therapy for Gaucher disease. Mol Genet Metab 2007; 90 (2): 157–163.
7. Fecarotta S, Romano A, Della Casa R, et al. Long term follow-up to evaluate the efficacy of miglustat treatment in Italian patients with Niemann-Pick disease type C. Orphanet J Rare Dis 2015 Feb 27; 10 : 22.
8. Capablo JL, Franco R, de Cabezón AS, et al. Neurologic improvement in a type 3 Gaucher disease patient treated with imiglucerase/miglustat combination. Epilepsia 2007; 48 (7): 1406–1408.
9. Goláň L. Migalastat v terapii Fabryho choroby. Interní Med 2017; 19 (3): 167–170.
10. Parker EI, Xing M, Moreno-De-Luca A, et al. Radiological and clinical characterization of the lysosomal storage disorders: non-lipid disorders. Br J Radiol 2014; 87 (1033): 20130467.
11. Beck M, Arn P, Giugliani R, et al. The natural history of MPS I: global perspectives from the MPS I Registry. Genet Med 2014; 16 (10): 759–765.
12. Hlavatá A, Horáková J, Lukáč J, et al. Mukopolysacharidózy – prehľad diagnostikovaných prípadov. Čs Pediat 1997; 52 (Suppl 1): S21–S21.
13. Ďurovčíková D, Hlavatá A, Kováčová V, et al. Klinicko-genetické skúsenosti s diagnostikou mukopolysacharidóz. Čs Pediat 1998; 53 (7): 403–406.
14. Horovitz DDG, Acosta AX, Giugliani R, et al. Alternative laronidase dose regimen for patients with mucopolysaccharidosis I: a multinational, retrospective, chart review case series. Orphanet J Rare Dis 2016; 11 : 51.
15. Hlavatá K, Šalingová A, Šaligová J, et al. Skúsenosti s alternatívnym spôsobom podávania enzýmovej substitučnej terapie u pacientov s MPS I. Čes-slov Pediat 2015; 70 (Suppl 1): 53–54.
16. Dvorakova L, Vlaskova H, Sarajlija A, et al. Genotype-phenotype correlation in 44 Czech, Slovak, Croatian and Serbian patients with mucopolysaccharidosis type II. Clin Genet 2017; 91 (5): 787–796.
17. Mistry PK, Cappellini MD, Lukina E, et al. A reappraisal of Gaucher disease-diagnosis and disease management algorithms. Am J Hematol 2011; 86 (1): 110–115.
18. Kaplan P, Baris H, De Meirleir L, et al. Revised recommendations for the management of Gaucher disease in children. Eur J Pediatr 2013; 172 (4): 447–458.
19. Elias AF, Johnson MR, Boitnott JK, et al. Neonatal cholestasis as initial manifestation of type 2 Gaucher disease: a continuum in the spectrum of early onset Gaucher disease. JIMD Rep 2012; 5 : 95–98.
20. Elstein D, Mellgard B, Dinh Q, et al. Reductions in glucosylsphingosine (lyso-Gb1) in treatment-naïve and previously treated patients receiving velaglucerase alfa for type 1 Gaucher disease: Data from phase 3 clinical trials. Mol Genet Metab 2017; 122 (1–2): 113–120.
21. Waldek S, Feriozzi S. Fabry nephropathy: a review - how can we optimize the management of Fabry nephropathy? BMC Nephrol 2014; 15 : 72.
22. Bacharova L, Ugander M. Left ventricular hypertrophy: The relationship between the electrocardiogram and cardiovascular magnetic resonance imaging. Ann Noninvasive Electrocardiol 2014; 19 (6): 524–533.
23. Schiffmann R, Ries M. Fabry disease: A disorder of childhood onset. Pediatr Neurol 2016; 64 : 10–20.
24. Nowak A, Mechtler T, Kasper DC, et al. Correlation of lyso-Gb3 levels in dried blood spots and sera from patients with classic and later-onset Fabry disease. Mol Genet Metab 2017; 121 (4): 320–324.
25. van der Meijden JC, Güngör D, Kruijshaar ME, et al. Ten years of the international Pompe survey: patient reported outcomes as a reliable tool for studying treated and untreated children and adults with non-classic Pompe disease. J Inherit Metab Dis 2015 May; 38 (3): 495–503.
26. Byrne BJ, Kishnani PS, Case LE, et al. Pompe disease: design, methodology, and early findings from the Pompe Registry. Mol Genet Metab 2011; 103 (1): 1–11.
27. Boentert M, Prigent H, Várdi K, et al. Practical recommendations for diagnosis and management of respiratory muscle weakness in late-onset Pompe disease. Int J Mol Sci 2016; 17 (10): 1735.
28. Špalek P, Martinka I, Mattošová S, et al. Adultná forma pompeho choroby v SR – diagnostické úskalia a omyly. Neurológia 2014; 9 (3): 157–164.
29. van der Ploeg AT, Kruijshaar ME, Toscano A, et al. European consensus for starting and stopping enzyme replacement therapy in adult patients with Pompe disease: a 10-year experience. Eur J Neurol 2017; 24 (6): 768–e31.
30. Vanier MT. Niemann-Pick diseases. Handb Clin Neurol 2013; 113 : 1717–1721.
31. Mengel E, Klünemann H-H, Lourenço CM, et al. Niemann-Pick disease type C symptomatology: an expert-based clinical description. Orphanet J Rare Dis 2013; 8 : 166.
32. Jahnova H, Dvorakova L, Vlaskova H, et al. Observational, retrospective study of a large cohort of patients with Niemann-Pick disease type C in the Czech Republic: a surprisingly stable diagnostic rate spanning almost 40 years. Orphanet J Rare Dis 2014; 9 : 140.
33. Kuchar L, Sikora J, Gulinello ME, et al. Quantitation of plasmatic lysosphingomyelin and lysosphingomyelin-509 for differential screening of Niemann-Pick A/B and C diseases. Anal Biochem 2017; 525 : 73–77.
34. Pakanová Z, Matulová M, Behúlová D, et al. Molecular diagnosis of Pompe disease using MALDI TOF/TOF and 1H NMR. Chem Pap 2016; 70 (3): 265–271.
35. Mattošová S, Chandoga J, Hlavatá A, et al. Spectrum of GBA mutations in patients with Gaucher disease from Slovakia: identification of five novel mutations. Isr Med Assoc J IMAJ 2015; 17 (3): 166–170.
36. Mattosova S, Hlavata A, Spalek P, et al. Late onset form of Pompe disease. Bratisl Lek Listy 2015; 116 (8): 502–505.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek Barthov syndróm – kazuistika
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2018 Číslo 6- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Editorial: Dědičné poruchy metabolismu dětského věku
- Charakteristické klinické příznaky a laboratorní odchylky dědičných poruch metabolismu
- Deficit fosfomanomutázy 2: klinická, biochemická a molekulárně-genetická charakteristika 22 pacientů diagnostikovaných v České republice
- Komplexný pohľad na deficit vitamínu B12 v detskom veku
- Barthov syndróm – kazuistika
- Novorozenecký screening dědičných metabolických poruch v České republice
- Nutriční terapie u pacientů s dědičnými poruchami metabolismu
- Lyzozómové choroby – vývoj diagnostiky a liečby na Slovensku
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Charakteristické klinické příznaky a laboratorní odchylky dědičných poruch metabolismu
- Komplexný pohľad na deficit vitamínu B12 v detskom veku
- Novorozenecký screening dědičných metabolických poruch v České republice
- Lyzozómové choroby – vývoj diagnostiky a liečby na Slovensku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



