-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Langerhansova histiocytóza v dětském věku
Langerhans histiocytosis in children
Langerhans cell histiocytosis (LCH) is the most common of the histiocytic disorders and occurs when the body accumulates too many immature Langerhans cells, a subset of the larger family of cells known as histiocytes. Scientific discussions on the definition of LCH used to be debated in terms of its classification as either an immune dysfunction or a rare cancer (neoplastic and malignant or not malignant). According to most experts, Langerhans cell histiocytosis (LCH) is currently classified as a myeloid neoplasm.
Keywords:
Langerhans histiocytosis – myeloid neoplasm – BRAFV600E mutation – LCH-associated neurodegeneration of brain
Autori: Z. Křenová 1,2; J. Šenkyřík 2,3
Pôsobisko autorov: Klinika dětské onkologie, LF MU a FN Brno 1; LF MU, Brno 2; Klinika dětské radiologie, LF MU a FN Brno 3
Vyšlo v časopise: Čes-slov Pediat 2021; 76 (8): 440-446.
Kategória: Původní práce
Súhrn
buněk, podskupiny buněk patřících do širší skupiny buněk, označovaných jako histiocyty. Zda klasifikovat LCH jako imunitní poruchu či nádorové bujení (benigní či maligní), se vedla dlouhou dobu vědecká debata. Většina expertů v současné době klasifikuje LCH jako myeloidní neoplazmu.
Klíčová slova:
Langerhansova histiocytóza – myeloidní neoplazma – BRAFV600E mutace – neurodegenerativní choroba mozku spojená s prodělanou LCH
EPIDEMIOLOGIE
Roční výskyt Langerhansovy histiocytózy (LCH) je 5–9 případů na milion obyvatel ve věkové skupině dětí do 15 let. Nejčastěji onemocní děti do 4 let věku, s věkem riziko výskytu LCH klesá. Vysoce riziková je tzv. multisystémová forma onemocnění (dříve tzv. Lettererova-Siweho choroba), s postižením rizikových orgánů (kostní dřeň, játra, slezina), která dominuje u dětí do 2 let věku. Nad hranicí 5 let již převažují LCH s postižením jediného tzv. systému tělního, a to kostní LCH (dříve tzv. „Handova-Schüllerova-Christianova choroba“). Vůbec nejčastější formou onemocnění je izolované postižení kosti (dříve tzv. „eozinofilní granulom“). Častěji onemocní chlapci.
Jako rizikové se pro vznik LCH uvádějí: rodinná anamnéza s výskytem onemocnění štítné žlázy, LCH či obecně onkologické onemocnění. Dále expozice rodiče či rodičů chemikáliím, kovům, či vdechování pilin v pracovním prostředí. Navzdory obecné percepci, že LCH často nastoupí záhy po podané vakcinaci, data uvádí, že LCH je častější u dětí, u kterých neproběhlo očkování v dětském věku.
BIOLOGIE LCH
Revoluční objev rekurentní somatické BRAFV600E mutace (2010, Baret Rollins) zařadil LCH mezi myeloidní neoplazmy a otevřel dveře pro cílenou terapii. Druhou nejčastější somatickou mutací u LCH vedle BRAF (50–60 % případů) je MAPK2K1 (27,5 %), obě způsobí aktivaci 5RAS/RAF MAP/ERK signální cesty. Dalšími rozpoznanými tzv. driving mutacemi jsou KRAS, 1 BRAF fúze, ALK translokace a amplifikace PDGFRA, KIT a MAP3K1. Schéma mutace je uvedeno na obrázku 1 [7].
Obr. 1. Schéma mutace. (Převzato z publikace Allen CE. How I treat Langerhans cell histiocytosis) 
KLINICKÁ PREZENTACE
Langerhansova histiocytóza se může projevit v kterémkoliv věku a její projevy kromě typických mohou být i velmi atypické. U pacientů s diagnózou LCH jsou nejčastěji postiženy kůže (50 %) a kosti (78 %). V případě kostní LCH je nejčastěji postižena lebka (49 %), kyčel/ pánevní kosti (23 %), stehenní kost (17 %) a žebra (8 %). Kožní léze jsou obyčejně mnohočetné a polymorfní: červenohnědé papulky s krustou, pustulky či bolestivé ulcerace v kožních záhybech. Postižení kosti může být izolované, nebo mnohočetné. Může být zcela asymptomatické, jindy je přítomen bolestivý otok či infiltrace podkoží přímou expanzí tumorózních hmot. Vzácněji dojde k patologické zlomenině kosti způsobené rozsáhlejším lytickým defektem (obr. 2). Nejzávažnější komplikace dané primárně postižením kosti byly popsány opakovaně při postižení páteře či lebky. U páteře (nejčastěji při postižení oblasti krční a hrudní) může dojít ke kompresivním frakturám a následnému riziku míšní léze (obr. 3).
Obr. 2. LCH – kostní tumor: a) CT scan v kostním okně, nativně, osteolytické ložisko proximální ulny a olecranu, b) MR T2 STIR scan v sagitálním řezu, solidní infiltrace kostní dřeně proximální ulny, periostální reakce, c) MR T1 scan s potlačením tuku v sagitální rovině, tumor kosti, extraoseální šíření a periostální reakce, d) MR T1 s potlačením tuku v axiální rovině, tumor proximální ulny s extraoseální propagací.
Fig. 2. LCH – tumor of proximal ulna: a) lytic lesion on CT scan, b) soft tissue tumor, edema and periostosis of the ulna on MR STIR scan, c) enhancing tumor with extraosseoal spred on T1 fs in sagital plane and d) in axial plane.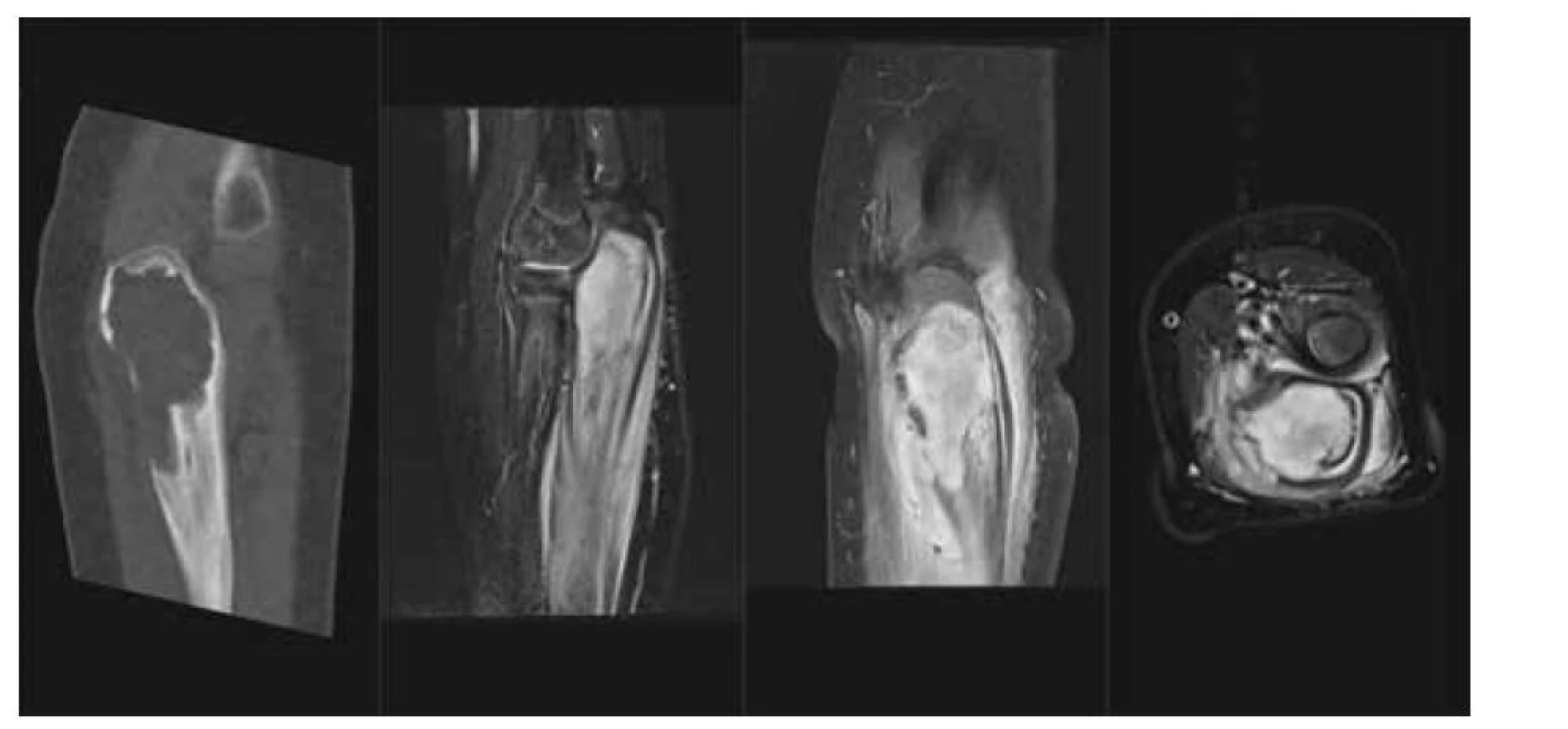
Obr. 3. LCH páteře, 6. hrudního obratle: a) MR T2 STIR sekvence sagitálně, kolaps obratlového těla, solidní expanze v okolí Th6 podmiňující kompresní myelopatii míchy, b) MR T1 po aplikaci k. l., sytící se solidní tumor v okolí kolabovaného obratle Th6 s intraspinální i extraspinální propagací.
Fig. 3. LCH of the spine, of the 6th vertebra: infiltration of the 6th vertebra, soft tissue enhancing tumor extending intraspinal and extraspinal around collapsed the 6th vertebra, myelopathy. a) MR T2 STIR scan, b) T1 scan with contrast medium injection.
K útlaku míchy opakovaně došlo i přímou propagací tumorózních hmot. Obdobně útlak struktur mozku se může prezentovat intrakraniální hypertenzí, epileptickým záchvatem apod. (obr. 4). Do výčtu klinických prezentací typických pro dětskou kostní LCH jistě patří exoftalmus daný postižením orbity, mnohdy velmi výrazný a torpidní. Hluchota nebo chronický výtok z ucha mohou být příznakem postižení bradavkovitého výběžku kosti spánkové. U třetiny dětských pacientů s mnohočetnou LCH dochází k postižení uzlin, izolované postižení uzlin je naopak velmi vzácné, ale může být extenzivní. Při postižení uzlin limitovaného počtu je možná „wait and watch“ strategie, při extenzivním postižení je nutno situaci individuálně léčebně řešit.
Obr. 4. LCH baze lební: a) nativní CT scan v kostním okně, osteolytické léze pravé frontální kosti, zevní porce pravé temporální kosti a sfenoidální kosti vlevo, b) MR scan – T1 sekvence po podání kontrastní látky v axiální rovině, solidní měkkotkáňové sytící se expanze baze lební v rozsahu sfenoidálních a temporálních kostí oboustranně, c, d) MR scan – T1 sekvence po podání k. l. v koronární rovině, sytící se expanze baze lební a stropu pravé orbity.
Fig. 4. LCH of skull base: a) CT scan – bone window, lytic lesions of frontal bone, temporal bone on the right side and sphenoid bone on the left, b) MR scan – T1 after contrast medium injection, axial plane, soft tissue tumors of skull base, c, d) MR scan – T1 after contrast medium injection, coronal plane, enhansing tumor of skull base and the right orbit ceiling.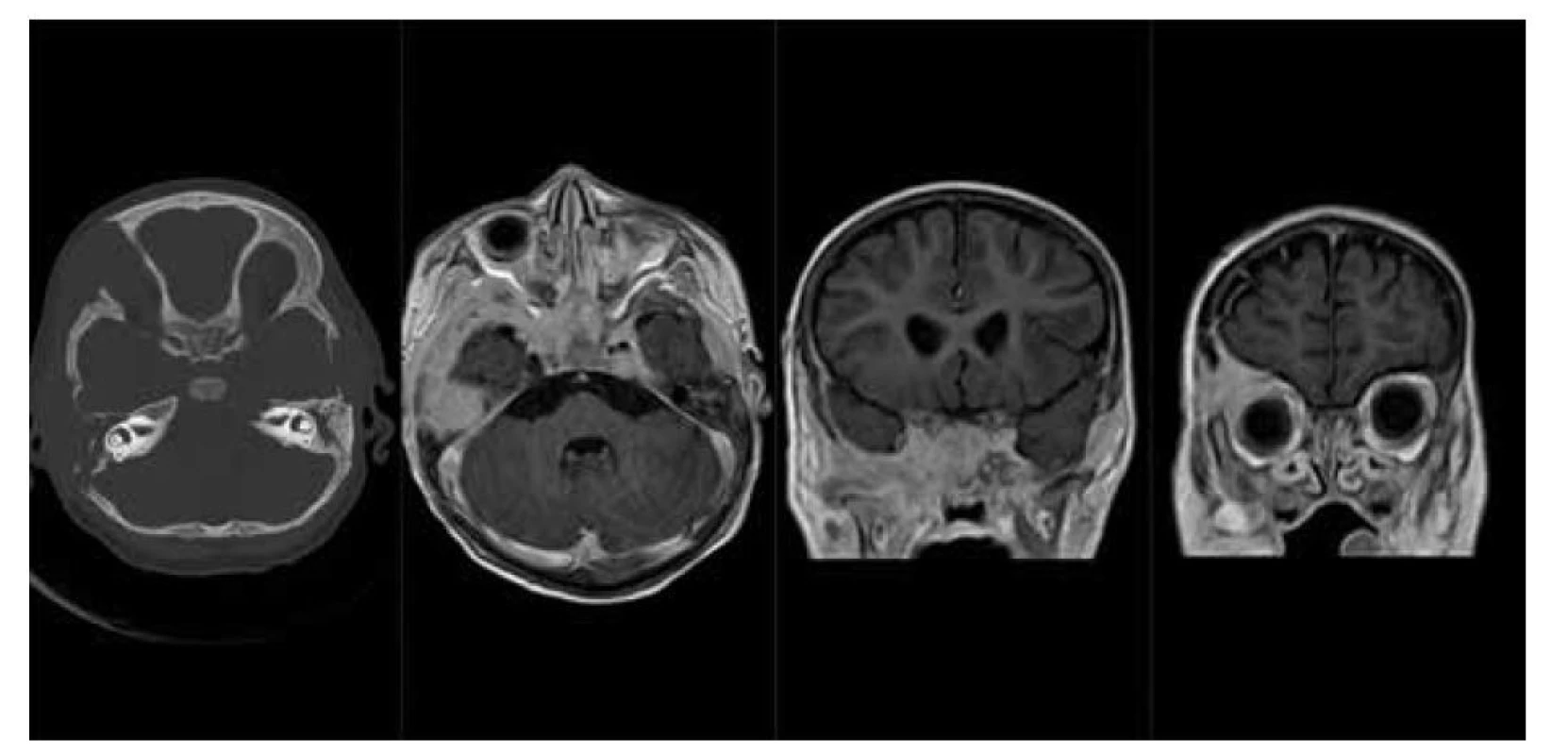
Na tuto vzácnou situaci studiový protokol LCH-IV nepamatuje, a tedy oficiální doporučení neexistuje. Postižení tzv. rizikových orgánů (kostní dřeně, sleziny a jater) pozorujeme nejčastěji u nejmenších dětí s rizikovou multisystémovou formou LCH. Nejčastěji jsou infiltrovány všechny tři rizikové orgány, ale ke splnění kritéria vysoké rizikovosti průběhu choroby stačí i postižení jednoho z uvedených orgánů. Postižení kostní dřeně může být klinicky němé, a proto u všech dětí pod 2 roky věku je doporučeno provést aspiraci kostní dřeně. Aspirát postačí k vyšetření na přítomnost mutované DNA. Pokud se jedná o masivnější infiltraci kostní dřeně, prozradí se bi - či pancytopenií a pak je nutno provést i trepanobiopsii. Pro konstatování postižení jater a sleziny postačí nález hepato - a splenomegalie. Postižení jater provází hypoalbuminémie, zvýšení jaterních testů, včetně GGT.
Infiltrace sliznic gastrointestinálního traktu způsobí chronické průjmy a malabsorpci. Sklerotizující cholangitida způsobená infiltrací žlučovodu je vzácnou, ale velmi obávanou komplikací LCH. U 15 % dětí s LCH dochází k postižení zadní hypofýzy s nálezem většinou ireverzibilního diabetes insipidus. Méně často je nutno řešit centrální endokrinopatie (postižení přední hypofýzy), většinou reverzibilní. Postižení plic na rozdíl od dospělých (LCH kuřáků) nebývá izolované, ale vždy je součástí multisystémové LCH, uvádí se četnost 7–12 % (obr. 5).
Obr. 5. Postižení plic při LCH: a, b) nativní CT scany v axiální rovině, vícečetné drobné noduly plicní tkáně oboustranně.
Fig. 5. LCH lung disorder: a, b) CT scans in axial plane, some lung nodules on both sides.
DIAGNÓZA A VSTUPNÍ VYŠETŘENÍ
Diagnóza LCH je postavena na klinickém nálezu, zobrazovacím vyšetření a histologickém vyšetření. Ke stanovení diagnózy LCH je nutná biopsie. Nejpřístupnější je provést raznicovou biopsii kůže tam, kde je kožní postižení součástí LCH, ostatní PET pozitivní léze v těle již pak bioptovat není nutné. Naopak při izolovaném postižení páteře či CNS lézi je nutno trvat na biopsii, a to i s rizikem komplikací. Histologický nález ukazuje přítomnost charakteristických histiocytů s blandními ledvinovitými jádry a abundantní světlou cytoplazmou. Tyto histiocyty jsou imunohistochemicky pozitivní na S100, CD 1a a Langerin. Průkaz Birbeckových granulí (tzv. tenisových raket) elektronovým mikroskopem není v dnešní době k diagnóze nutný. V pozadí neoplastických histiocytů bývají hojné eozinofily.
U všech pacientů je nutné vyšetřit krevní obraz, CB, albumin, renální testy, jaterní testy, koagulaci, RTG plic a scintigrafii kostí, pokud lze, pak i celotělové MRI. U dětí mladších 2 let je doporučeno provést vyšetření kostní dřeně i v případech, že není přítomna bi - či pancytopenie. Velmi často je v kostním aspirátu nalezena tzv. minimálně diseminovaná choroba, průkazná přítomností buněk s pozitivitou BRAFV600E. Stejně tak se doporučuje stanovit či vyloučit přítomnost mutace v periferní krvi. Tato vyšetření pak umožní citlivou monitoraci efektu léčby a trvání remise či hrozící relaps. Vstupní staging doporučuje vždy provést CT nebo MRI postižených orgánů těla, ideálně zařadit celotělový PET/MRI či PET/CT u větších dětí. V případě průkazu diabetes insipidus nebo postižení CNS pak je nutné provést také MRI CNS. CNS LCH se nejčastěji manifestuje v oblasti podvěsku a šišinky mozkové. Typicky je provázena nálezem diabetes insipidus. Méně často dochází k postižení mening, plexus choroideus a mozečku. V případě podezření na postižení plic patrném na prostém RTG snímku plic je nutno doplnit HRCT plic. Další cílená vyšetření dle potřeby, mnohdy je prezentace LCH i velmi neobvyklá – infiltrace thymu, štítné žlázy a další lokalizace.
LÉČBA
Klinická prezentace LCH do velké míry determinuje možnosti, jak léčit LCH. V případě postižení jediného orgánového systému záleží na tom, který orgán byl postižen a zda izolovaně či mnohočetně (kosti, uzliny). S lokální léčbou vystačíme povětšinou u izolovaného postižení kůže. Ale i zde, při chronickém či refrakterním průběhu, je nutné sáhnout po lokálních kortikosteroidech, 6-merkaptopurinu či perorálním metotrexátu. V případě postižení jediné kosti (eozinofilní granulom) lze uplatnit „wait and watch“ strategii, při rozsáhlejším postižení kosti je navrhována kyretáž kosti, případně i intralezionální aplikace steroidů. V případě i jediné kostní léze, která však je lokalizována tam, kde splňuje kritéria CNS rizikové léze, je systémová terapie rovněž indikována (vinblastin a kortikosteroidy).
Všeobecná shoda je na nutnosti systémové léčby pro pacienty s multisystémovou LCH a mnohočetnou kostní nemocí. Klinická odpověď po 6 týdnech léčby je nejsilnějším prognostickým faktorem. Standardem léčby v těchto indikacích je stále vinblastin a prednison. Dále trvá shoda na tom, že prodloužení léčby na minimálně 12 měsíců snížilo riziko reaktivací LCH [1, 2].
Současná studie LCH-IV stratifikuje multisystémovou, multifokální kostní a CNS rizikovou LCH do ramene STRATUM 1 (skupina 1.2). Všichni pacienti ze STRATUM I skupina 1 budou léčeni 6týdenním blokem – IC 1. Následný postup pak záleží na léčebné odpovědi. Pacienti, kteří mají refrakterní chorobu, nebo jejich odpověď na léčbu je nedostatečná a přitom i trvá postižení rizikových orgánů (kostní dřeň, játra, slezina), bývali dříve léčeni podle ramene STRATUM 3 (kladribin, cytarabin) nebo STRATUM 4 (allo SCT). Dnes jsou tito pacienti léčeni BRAF a MEK inhibitory.
První blok léčby spočívá v podání vinblastinu 6 mg/m2 jednou týdně a podávání prednisonu 40 mg/m2 po dobu čtyř týdnů, a následné 2 týdny se prednison vysazuje. Druhý blok, tzv. IC-2, je obdobný, ale kortikoidy jsou podávány už méně intenzivně, a sice vždy po dobu tří dnů v době podání vinblastinu. Po podání IC1 a IC2 dosáhne většina pacientů tzv. NAD (not active disease), čili kompletní remise, nebo tzv. AD better (active disease better), což odpovídá v onkologii používanému termínu parciální remise. Tito pacienti jsou následně randomizováni a je jim přidělena jedna ze čtyř možností, jak dlouhá a jak intenzivní bude udržovací terapie. Nejméně intenzivní rameno je rameno A, které spočívá v podávání pulzů prednison/vinblastin 1x za 3 týdny po dobu 12 měsíců (počítáno od prvního dne IC-1). Nejintenzivnější udržovací terapií je rameno D (24 měsíců pulzů prednison/vinblastin a denní podávání 6-merkaptopurinu).
Multifokální kostní LCH a CNS rizikoví LCH pacienti jsou léčeni stejným blokem IC1 na počátku, obdobně i podáním IC-2. Udržovací terapie je randomizována pouze mezi dvě ramena, a sice 6 versus 12 měsíců podávání pulzů prednison/vinblastin. Studie LCH-IV ještě probíhá a výsledná data zatím nejsou k dispozici. Zda prodloužení celkové léčby pacientů s LCH povede k snížení rizika návratu choroby se tedy teprve ukáže. Indikace tzv. CNS rizikové kostní LCH (izolované kostní léze lebky v tzv. CNS rizikové lokalizaci) k systémové léčbě je některými zpochybňována. Data ukazují, že nejvýznamnějším rizikovým faktorem pro rozvoj ND-LCH jsou nález DI a BRAFV600, což je kombinace rizikových faktorů spojených nejčastěji s CNS LCH, dále agresivní formou kojenecké LCH. V podstatě méně často pak u případů CNS rizikové LCH. Nicméně obecně se většina lékařů shodne na strategii „better safe than sorry" a takové je i doporučení studie LCH IV [3].
NEURODEGENERATIVNÍ NEMOC MOZKU, SPOJENÁ S PRODĚLANOU LCH
Neurodegenerativní LCH má dvě formy, počáteční klinicky němou, tzv. radiologickou ND-LCH. Jedná se o typický MRI obraz oboustranných symetrických lézí v nukleus dentatus mozečku a/nebo v bazálních gangliích (obr. 6). MRI nález se zhoršil až u 2/3 pacientů během tří let (medián) a byl ireverzibilní. V literatuře je uváděno překvapivě vysoké procento (až 10 %) pacientů léčených pro LCH, kterých se nález radiologické ND-LCH týká [4, 6, 8]. Devastujícím následkem ND-LCH je pak klinicky zjevná neurodegenerace mozku (1–4 % pacientů s LCH) s nepředvídatelným průběhem a délkou trvání. Ve většině případů pozorujeme ataxie, dysartrie, spastické diparézy či psychiatrické nemoci vedoucí k výraznému ovlivnění kvality života a v konečném důsledku k předčasnému úmrtí. Neurodegenerativní nemoc spojená s prodělanou LCH je dosud nezvládnutou, obávanou komplikací LCH. Není shoda na tom, zda se snažit předejít rozvoji klinické ND-LCH podáváním léčiv při nálezu prvních změn na MRI CNS, či až při klinických potížích nemocného. Délka trvání klinicky němého období se liší individuálně, a proč to tak je, není známo. Výzkum se vede ve směru analýzy likvoru u pacientů s radiologickou a floridní ND-LCH. Protein osteopontin a průkaz extracelulární BRAFV600E DNA (ale prokázán pouze u 10 % případů) jsou spojeny s nálezem floridní ND-LCH a jsou pro tento typ neurodegenerace mozku specifickým rysem [8]. Recentně se objevila v odborném tisku velmi zajímavá informace, dokumentující přítomnost proteinu NFL (neurofilament light) v likvoru u pacientů s ND-LCH. Publikovaný soubor čítá jen 5 pacientů, ale všichni měli NFL protein prokázaný v likvoru před léčbou, a u všech se povedlo i prokázat korelující pokles hladin NFL po podání léčby MEK inhibitory [9]. Aktuálně není platné plošné doporučení, jak postupovat, ale panuje shoda napříč odbornou společností bez odkladu začít léčbu u pacientů, kteří začnou mít první, byť subtilní klinické projevy ND-LCH. První projevy mohou být bez dostatečné znalosti problematiky přehlédnuty. Proto u všech pacientů, kteří splňují kritéria rizika vzniku ND-LCH, jsou nutné pravidelné kontroly MRI CNS (á 24 měsíců při absenci klinických potíží) a cílené vyšetření neurologem každých 6 měsíců.
Obr. 6. Neurodegenerace při LCH: a) MR scan – FLAIR sekevence v axiální rovině, hyperintenzní léze mozečkových hemisfér a nuclei caudati bilat., b) MR scan – FLAIR sekevence v axiální rovině, hyperintezní léze v bazálních gangliích oboustranně.
Fig. 6. LCH neurodegeneration: a) MR FLAIR scan in axial plane, bilateral symmetric parenchymal lesions of the cerebellum in the dentate nuclei, b) MR FLAIR scan in axial plane, bilateral hyperintense lesions of the basal ganglia.
Histologický rozbor vzorků parenchymu mozku postiženého ND-LCH popisuje přítomnost zánětu, demyelinizace až následně fibrotickou gliózu mozku. Nedávno publikovaná práce [8] však uvádí, že biopsie mozku pacientů ND-LCH obsahovaly difuzní perivaskulární infiltrace buňkami, fenotypu monocytů (CD14+CD33+ CD163+P2RY12-), které vykazovaly pozitivitu pro BRAFV600E+. Terapie BRAF + MEK inhibitory proto může být efektivní. V léčbě standardně indikované imunoglobuliny (imunosuprese), cytarabin a kyselina transretinová povětšinou proces neurodegenereace nedokázaly zvrátit. Dnes jsou inhibitory lékem volby v této indikaci, jejich časné nasazení proces neurodegenerace dokáže minimálně stabilizovat, v některých případech i významně zlepšit kvalitu života nemocných [10].
ZÁVĚR
LCH patří mezi ta onkologická onemocnění dětského věku, kde šance na 5leté přežití dosahuje 99 % u nízce rizikové formy onemocnění, 80 % pro vysoce agresivní formy LCH s postižením tzv. rizikových orgánů (játra, slezina, kostní dřeň). BRAF + MEK inhibitory šanci na 5leté přežití významně zvýšily i u nejtěžších forem LCH, včetně případů s postižením CNS. Problematickou zůstává otázka prevence a léčby neurodegenerativní choroby a reaktivace LCH v CNS. Lze hypotetizovat, že u pacientů s rizikem ND-LCH, kde BRAF a MEK inhibitory byly použity v první linii, nebude docházet k této obávané pozdní komplikaci. Anebo alespoň signifikantně méně často. Podkladem této úvahy je fakt, že BRAF a MEK inhibitory dokážou vyvolat velmi rychlou léčebnou odpověď, tedy minimalizovat nemoc na tzv. minimální reziduální nemoc v řádu týdnů, což před érou inhibitorů konvenční terapie nedokázala. Většina pacientů s ND LCH jsou pacienti s refrakterní (na léčbu pomalu reagující) či relabující formou LCH, kde ke zjevné či pravděpodobně minimálně mikroskopické infiltraci CNS buňkami LCH došlo [10].
Došlo: 1. 9. 2021
Přijato: 20. 11. 2021
Korespondující autorka:
MUDr. Zdenka Křenová
Klinika dětské onkologie FN Brno a LF MU v Brně
Černopolní 9
612 00 Brno
e-mail: Krenova.Zdenka@fnbrno.cz
Zdroje
1. Rodriguez-Galindo C, et al. First line treatment of pediatric Langerhans cell histiocytosis. In: Abla Ousama, Janka Gritta (eds). Histiocytosis Disorders. Springer, 2018.
2. Haupt R, Minkov M, Astigarraga I, et al. Langerhans cell histiocytosis (LCH): Guidelines for diagnosis, clinical work-up, and treatment for patients till the age of 18 years. Pediatr Blood Cancer 2013; 60c (2): 175–184.
3. Chellapandian D, Shaikh F, van den Bos C, et al. Management and outcome of patients with Langerhans cell histiocytosis and single-bone CNS-risk lesions: A multi-institutional retrospective study. Pediatr Blood Cancer 2015; 62 (12): 2162–2166.
4. Héritier S, Barkaoui MA, Miron J, et al. Incidence and risk factors for clinical neurodegenerative Langerhans cell histiocytosis: a longitudinal cohort study. Br J Haematol 2018; 183 (4): 608–617.
5. Eckstein OS, Visser J, Rodriguez-Galindo C, et al. Clinical responses and persistent BRAF V600E + blood cells in children with LCH treated with MAPK pathway inhibition. Blood 2019; 133 (15): 1691–1694.
6. Wnorowski M, Prosch H, Prayer D, et al. Pattern and course of neurodegeneration in Langerhans cell histiocytosis. J Pediatr 2008; 153 (1): 127–132.
7. Allen CE, Ladisch S, McClain KL. How I treat Langerhans cell histiocytosis. Blood 2015; 126 (1): 26–33.
8. McClain KL, Picarsic J, Chakraborty R, et al. CNS Langerhans cell histiocytosis: Common hematopoietic origin for LCH-associated neurodegeneration and mass lesions. Cancer 2018; 124 (12): 2607–2620.
9. Henter JI, Kvedaraite E, Martín Muñoz D, et al. Response to mitogen - activated protein kinase inhibition of neurodegeneration in Langerhans cell histiocytosis monitored by cerebrospinal fluid neurofilament light as a biomarker: a pilot study. Br J Haematol 2021. doi: 10.1111/bjh.17781.
10. Krenova Z, Sterba J. Langerhans cell histiocytosis: The time has come to consider a CNS-directed prophylactic approach. J Pediatr Hematol Oncol 2016; 38 (6): 493–495.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2021 Číslo 8- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Imunitní trombocytopenie – zkušenosti jednoho centra
- Langerhansova histiocytóza v dětském věku
- Zemřel MUDr. František Schneiberg
- Pneumokoková infekční endokarditida nativní aortální chlopně u 5letého chlapce očkovaného pneumokokovou vakcínou
- Genu recurvatum congenitum
- Současné pohledy na patofyziologii, diagnostiku a léčbu imunitní trombocytopenie v dětském věku
- História invazívneho merania tlaku krvi
- Česká lékařská společnost Jana Evangelisty Purkyně k elektronizaci zdravotnictví
- Správa o 36. Celoštátnej konferencii Spoločnosti dorastového lekárstva s medzinárodnou účasťou a 2. Šašinkovom memoriáli v dňoch 17.–18. septembra 2021 na Starých Horách
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Současné pohledy na patofyziologii, diagnostiku a léčbu imunitní trombocytopenie v dětském věku
- História invazívneho merania tlaku krvi
- Genu recurvatum congenitum
- Imunitní trombocytopenie – zkušenosti jednoho centra
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



