-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Transplantace kmenových buněk krvetvorby u dětí s dědičnými metabolickými poruchami a maligní infantilní osteopetrózou
Hematopoietic stem cell transplantation in children with inborn errors of metabolism and malignant infantile osteopetrosis
Objective: Evaluation of the results of hematopoietic stem cell transplantation (HSCT) in children with inborn errors of metabolism (IEM) and malignant infantile osteopetrosis (MIOP) in the Czech Republic from the beginning of the transplant programme in 1989 to the present.
Methods: In the period 1/1993 to 12/2021 a total of 31 allogeneic HSCTs were performed at the University Hospital Motol in 22 patients with IEM and 5 patients with MIOP. Patients were transplanted from HLA identical sibling (MSD), matched unrelated donor (MUD) or mismatched family donor (MMFD). The source of stem cells was bone marrow (BM), peripheral blood stem cells (PBSC) or umbilical cord blood (UCB). The conditioning regimen was used in accordance with the IEWP-EBMT (Inborn Errors Working party – European Bone Marrow Transplant).
Results: 22 patients with IEM and 5 patients with MIOP underwent the first allogeneic HSCT at the median age of 19,5 months. Engraftment after the first transplant was documented in 24 of 27 patients (89 %). Three patients underwent retransplantation for primary or secondary graft failure. Acute graft-versus-host disease (GVHD) was documented in 11 patients (41 %), severe form of aGVHD gr. III in 1 patient and chronic GVHD in 1 patient, respectively. A total of 6 patients died, 3 patients due to transplant-related mortality, 2 patients from disease progression, respectively and 1 patient died after a successful transplant due to complications of neurosurgery. The overall survival is 78 %, 21 of 27 patients are alive with a median follow-up of 169 months after transplantation (12-347 months), 20 of them with improvement or stabilization of the disease.
Conclusions: HSCT is currently the standard therapy for selected IEM and MIOP. This procedure has become much safer during recent decades, timely diagnosis and indication for HSCT are essential. The treatment requires multidisciplinary management and continuous collaboration with other specialists.
Keywords:
Inborn errors of metabolism – hematopoietic stem cell transplantation – mucopolysaccharidosis – adrenoleucodystrophy – malignant infantile osteopetrosis
Autori: Formánková Renata 1; Říha Petr 1; Keslová Petra 1; Ješina Pavel 2; Honzík Tomáš 2; Magner Martin 2; Starý Jan 1; Sedláček Petr 1; Zeman Jiří 2
Pôsobisko autorov: Klinika dětské hematologie a onkologie, 2. lékařská fakulta Univerzity Karlovy a Fakultní nemocnice v Motole, Praha 1; Klinika pediatrie a dědičných poruch metabolismu, 1. lékařská fakulta Univerzity Karlovy a Všeobecná fakultní nemocnice, Praha 2
Vyšlo v časopise: Čes-slov Pediat 2022; 77 (5): 276-283.
Kategória: Původní práce
doi: https://doi.org/10.55095/CSPediatrie2022/044Súhrn
Cíl studie: Zhodnocení výsledků transplantace kmenových buněk krvetvorby (HSCT, hematopoietic stem cell transplantation) u dětí s dědičnými metabolickými poruchami (DMP) a maligní infantilní osteopetrózou (MIOP) v České republice od začátku transplantačního programu v roce 1989 do současnosti.
Metody: V období 1/1993 až 12/2021 bylo ve FN v Motole provedeno celkem 31 alogenních HSCT u 22 pacientů s DMP a 5 pacientů s MIOP. Dárcem kmenových buněk byl HLA identický sourozenec (MSD, matched sibling donor), nepříbuzný dárce (MUD, matched unrelated donor) nebo haploidentický rodinný dárce (MMFD, mismatched family donor). Zdrojem kmenových buněk byla kostní dřeň (KD), periferní kmenové buňky (PBSC, peripheral blood stem cells) nebo pupečníková krev (UCB, umbilical cord blood). Předtransplantační přípravný režim byl použit v souladu s doporučením IEWP-EBMT (Evropská pracovní skupina pro transplantace vrozených onemocnění).
Výsledky: 1. alogenní HSCT podstoupilo 22 pacientů s DMP a 5 pacientů s MIOP. Medián věku v době HSCT byl 19,5 měsíce. Primární přihojení štěpu po 1. transplantaci bylo dokumentováno u 24 z 27 pacientů (89 %). U 3 pacientů byla z důvodu nepřihojení či odhojení štěpu nutná retransplantace. Akutní reakce štěpu proti hostiteli (GVHD) byla dokumentována u 11 pacientů (41 %), těžkou formu gr. III vyvinul pouze 1 pacient, chronickou GVHD 1 pacient. Zemřelo celkem 6 pacientů, 3 na komplikace spojené s transplantací, 2 na progresi základního onemocnění, 1 pacient po úspěšné transplantaci na komplikace neurochirurgického výkonu. Celkové přežití je 78 %, 21 z 27 pacientů žije s mediánem doby sledování 169 měsíců po transplantaci (12–347 měsíců), 20 pacientů se zlepšením/stabilizací projevů onemocnění.
Závěry: HSCT je v současné době standardní léčebnou metodou u vybraných DMP a MIOP. Naděje na úspěch transplantace vysoce převyšuje její rizika, zásadní je časně stanovená diagnóza a indikace k HSCT. Léčba pacientů vyžaduje komplexní přístup a spolupráci lékařů transplantačního a metabolického centra a dalších specialistů.
Klíčová slova:
transplantace kmenových buněk krvetvorby – dědičné poruchy metabolismu – mukopolysacharidóza – adrenoleukodystrofie – maligní infantilní osteopetróza
Úvod
Alogenní transplantace kmenových buněk krvetvorby (HSCT) je úspěšně používána v léčbě řady maligních i nemaligních onemocnění. Počet alogenních HSCT uskutečněných v Evropě v roce 2018 dosáhl 19 630, z toho 4075 (21 %) bylo provedeno u dětí.(1) V České republice byl program alogenních transplantací zahájen v roce 1989, celkový počet 1. alogenních HSCT do konce roku 2021 byl 693. Hlavní indikací u dětí jsou hematologické malignity, zejména akutní lymfoblastické leukemie, méně časté jsou myeloidní leukemie a myelodysplastický syndrom, z nemaligních hematologických onemocnění je to těžká aplastická anemie. Indikace zcela specifické pro dětský věk představují syndromy vrozeného selhání kostní dřeně, primární imunodeficience a v raritním zastoupení dědičné metabolické poruchy (DMP) a maligní infantilní osteopetróza (MIOP).(1,2)
Ve skupině DMP je HSCT možnou léčebnou metodou zejména u některých lysosomálních střádavých onemocnění (LSDs) a X-vázané adrenoleukodystrofie (X-ALD). Cílem transplantace je dodání chybějícího enzymu dárcovskými krví kolujícími buňkami poškozeným tkáním nebo průnik a přihojení z makrofágů/monocytů generovaných gliových buněk v nervovém systému.(2–4)
Pro některá onemocnění (např. mukopolysacharidóza (MPS)-I, -II, -IV, VI, -VII, Gaucherova nemoc, Pompeho nemoc, Fabryho nemoc, Niemannova–Pickova choroba A/B) je v současné době dostupná enzymová substituční terapie (enzyme replacement therapy, ERT). Nevýhodou ERT je, že enzym neproniká hematoencefalickou bariérou, v porovnání s HSCT tedy nedochází k příznivému ovlivnění funkcí CNS.(3,5)
Autologní HSCT s využitím genové terapie je dosud ve fázi výzkumu a klinických studií, v budoucnu by mohla představovat zlepšení léčebných možností v důsledku nižší toxicity a vyšší účinnosti v souvislosti s dosažením vyšších hladin chybějícího enzymu.(3,4,6)
Největší počty léčených pacientů a nejpřesvědčivější dlouhodobé výsledky HSCT byly při její včasné indikaci publikovány u MPS-I, X-ALD, α-mannosidózy a MIOP.(7–14) Pro metachromatickou leukodystrofii (MLD), Krabbeho globoidní leukodystrofii (GLD) a mukolipidózu chybí přesvědčivé doklady o benefitu HSCT.(3,15)
Mukopolysacharidóza I je autozomálně recesivně (AR) dědičné onemocnění, frekvence výskytu se udává přibližně 1 : 100 000 – 150 000. Příčinou je mutace v genu IDUA, kódujícím enzym α-L-iduronidázu. Nedostatek enzymu vede k poruše odbourávání heparansulfátu a dermatansulfátu, jejichž střádání se projevuje kraniofaciální dysmorfií, hepatosplenomegalií, zákalem rohovky, herniemi, drápovitým postavením prstů na rukou, postižením srdečních chlopní, obstrukcemi dýchacích cest a poruchou růstu s deformitami hrudníku. Na rentgenovém vyšetření skeletu je patrná dysostosis multiplex. Jednotlivé formy – syndrom Scheieův (MPS I-S, pozdější manifestace, mírnější průběh), syndrom Hurlerové–Scheieův (MPS I-HS, středně těžká forma) a nejzávažnější syndrom Hurlerové (MPS I-H) představují kontinuální klinické spektrum. MPS-IH se vyznačuje rychlou progresí a neurologickým postižením, bez léčby dochází k úmrtí zpravidla v první dekádě života.(7–9,17–21) Nejlepších výsledků HSCT je dosahováno u pacientů s MPS I-H mladších 2 let před rozvojem závažného neurokognitivního poškození.(4,20) Indikace HSCT může být individuálně zvažována i u MPS I-HS, MPS I-S. Z ostatních MPS nahradila enzymová terapie HSCT u MPS VI (Maroteauxův–Lamyho syndrom), u dalších typů MPS není příznivý efekt HSCT prokázán.(4,18)
Alfa-mannosidóza je AR dědičná porucha metabolismu glykoproteinů, příčinou je mutace genu MAN2B1, kódujícího enzym α-mannosidázu. Klinicky nejzávažnější forma se manifestuje již v prvních měsících života skeletálními abnormitami, progredující mentální retardací, poruchou sluchu, hydrocefalem, hepatosplenomegalií a recidivujícími infekcemi.( 14)
X-vázaná adrenoleukodystrofie patří mezi tzv. peroxisomální onemocnění, jedná se o X-vázané onemocnění způsobené mutací genu ABCD1. V důsledku deficience membránového proteinu ALD dochází k nedostatečné degradaci mastných kyselin s velmi dlouhými řetězci (VLCFA) β-oxidací v peroxisomech, k jejich akumulaci v cytosolu a inkorporaci do různých lipidových komplexů buněk, z nichž nejzranitelnější jsou buňky CNS a nadledvin. Incidence X-ALD je přibližně 1 : 17 000. Klinicky nejzávažnější formou je v dětství se manifestující cerebrální ALD (childhood cerebral ALD, COCALD) asociovaná s rychlou progresí neurologické symptomatologie a bez léčby s časnou mortalitou. Tíže cerebrální formy X-ALD se hodnotí skórovacím systémem změn na magnetické rezonanci mozku – Loesovo skóre 0–34 bodů, velmi časnému a časnému stadiu odpovídá Loes < 4, respektive 4–8.(10,11)
Mezi další vzácné DMP, jež mohou být za určitých okolností indikovány k HSCT a vyskytují se i v našem souboru pacientů, patří kongenitální erytropoetická porfyrie (CEP).
Kongenitální erytropoetická porfyrie je AR dědičný defekt uroporfyrinogen-III-syntázy vedoucí k zvýšené tvorbě porfyrinů v kostní dřeni a jejich hromadění zejména v erytrocytech. Mezi klinické projevy patří fotoreaktivita, tvorba puchýřů a jizvení kůže, citlivost očí, ztráta řas, anemie, splenomegalie, červené zbarvení zubů a tmavě červená moč.(22)
Maligní infantilní osteopetróza je vzácné geneticky podmíněné AR onemocnění, jehož příčinou je porucha diferenciace a funkce osteoklastů vedoucí ke snížené kostní resorpci a postupnému narůstání kostní masy. Incidence se odhaduje na 1 : 400 000, molekulární podstatou je nejčastěji mutace v genu TCIRG1. První příznaky MIOP se objevují v kojeneckém věku – neprospívání, makrocefalie, postižení zraku. Kostní změny lebky vedou k hydrocefalu, zúžení nosních průduchů a kompresi kanálků zrakových nervů ústící v slepotu. Další klinické symptomy zahrnují mikrognatii, deformity hrudníku, patologické fraktury, hepatosplenomegalii, hypokalcemii, defekty dentice. Selhání funkce kostní dřeně (KD) v důsledku útlaku dřeňových dutin kostní tkání vede k těžké periferní cytopenii. Podstatou úspěšné alogenní HSCT je přihojení z makrofágů derivovaných osteoklastů dárcovského původu. Dochází k remodelaci kostní struktury a obnově funkční hematopoézy.(12,13,23–25)
Pacienti a metodika
V období 1/1993 až 12/2021 bylo ve FN v Motole provedeno celkem 31 alogenních HSCT u 22 pacientů s DMP a 5 pacientů s MIOP. Diagnóza dětí s DMP byla stanovena na Klinice pediatrie a dědičných poruch metabolismu, 1. LF UK a VFN v Praze (dříve Klinika dětského a dorostového lékařství a Ústav dědičných metabolických poruch). Pacienti byli transplantováni na Transplantační jednotce kostní dřeně Kliniky dětské hematologie a onkologie 2. LF a FN Motol v Praze (do roku 2003 byla Transplantační jednotka součástí II. dětské kliniky 2. LF a FN Motol). Transplantační centrum je členem Evropské pracovní skupiny pro transplantace vrozených onemocnění (IEWP-EBMT) a postupuje podle aktuálně platných doporučení.
Metodou první volby byla transplantace KD od HLA identického sourozence (MSD). V případě absence MSD byl vybrán vhodný nepříbuzný dárce (MUD) pro transplantaci KD, eventuelně periferních kmenových buněk (PBSC) či vhodná nepříbuzná pupečníková krev (UCB).
Všechny HSCT byly provedeny po myeloablativním přípravném režimu. Jeho součástí bylo u všech pacientů před 1. HSCT alkylační cytostatikum busulfan. Cyklofosfamid používaný v kombinaci s busulfanem byl od roku 2013 nahrazen méně toxickým fludarabinem,(2,3) výjimečně byly v kombinaci s těmito cytostatiky použity thiotepa, treosulfan a etoposid. U všech pacientů transplantovaných od MUD byla součástí přípravného režimu tzv. séroterapie – antithymocytární globulin (AT G, thymoglobulin), případně alemtuzumab. Prevencí reakce štěpu proti hostiteli (GVHD) byl cyklosporin A v kombinaci s methotrexátem, mykofenolát mofetilem nebo methylprednisolonem.
Přihojení neutrofilů bylo definováno jako první ze tří po sobě následujících dní, kdy absolutní počet neutrofilů byl nad 0,5 × 109/l, přihojení trombocytů jako 7. den, kdy byl počet trombocytů nad 20 × 106/l bez předchozí substituce separovanými trombocyty.(2)
Buněčný chimérismus (podíl procentuálního zastoupení jaderných buněk periferní krve nesoucích genotyp dárce a genotyp příjemce) byl vyšetřován metodou analýzy sekvenčních polymorfismů pomocí elektroforézy a real-time PCR. Přítomnost genotypu dárce ve více než 95 % buněk periferní krve byla hodnocena jako kompletní dárcovský chimérismus (CC).(2,7)
Výsledky
V období 1/1993–12/2021 podstoupilo 1. alogenní HSCT 22 dětí s DMP a 5 dětí s MIOP. Charakteristika pacientů je uvedena v tabulce 1. Medián věku v době HSCT byl 19,5 měsíce (M) (4–182), transplantováno bylo 16 chlapců a 11 dívek. Medián doby sledování byl 130 M (0,4–347). Dárcem kmenových buněk byl nepříbuzný dárce pro 20 pacientů (74 %), HLA identický sourozenec pro 6 pacientů (22 %) a pro 1 pacienta HLA haploidentický rodinný dárce. Zdrojem kmenových buněk byla KD (n = 14, 52 %), PBSC (n = 7, 26 %) a UCB (n = 6, 22 %).
Tab. 1. Soubor pacientů 
Pt – pacient; Dg – diagnóza; M – měsíc; Condit. – conditioning, přípravný režim; Chim. – chimérismus; Lan./Karn. – Lansky/Karnofsky; MPS I – mukopolysacharidóza I; H – Hurler; S – Scheie; X-ALD – X-vázaná adrenoleukodystrofie; MLD – metachromatická leukodystrofie; I-CD – I cell disease; mannos – mannosidóza; CEP – kongenitální erytropoetická porfyrie; MIOP – maligní infantilní osteopetróza; MSD – matched sibling donor, HLA-identický sourozenec; MUD – matched unrelated donor, nepříbuzný dárce; MMFD – mismatched family donor, neidentický rodinný dárce; KD – kostní dřeň; PBSC – peripheral blood cells, periferní kmenové buňky; UCB – umbilical cord blood, pupečníková krev; TCD – T-deplece štěpu; Bu – busulfan; Cy – cyklofosfamid; Flu – fludarabin; Treo – treosulfan; Thio – thiotepa; GF – graft failure, selhání štěpu; GR – graft rejection, rejekce; LPD – lymfoproliferative disease, lymfoproliferativní onemocnění; NCH – neurochirurgický výkon; N.E. – not evaluable, nehodnotitelný; N.D. – not done, nevyšetřeno Primární přihojení štěpu po 1. transplantaci bylo dokumentováno u 24 z 27 pacientů (89 %). Medián přihojení granulocytů byl 20 dní po transplantaci (rozmezí 10–31 dní), medián přihojení trombocytů 24 dní (11–51). Pacient (Pt) 24 s MIOP zemřel časně po HSCT před přihojením štěpu. Primární selhání funkce štěpu (graft failure, GF) jsme dokumentovali u 2 dětí. U Pt 9 s MPS-I došlo k přihojení štěpu po retransplantaci jinou nepříbuznou UCB, další vývoj byl komplikován reaktivacemi virových infekcí a rozvojem EBV asociovaného lymfoproliferativního onemocnění (EBV - -LPD). U Pt 25 s MIOP jsme dokumentovali stabilní přihojení štěpu až po 3. transplantaci T-depletovaného štěpu PBSC od haploidentického otce. K sekundárnímu selhání funkce štěpu došlo u Pt 13 s MPS-I den+71 po 1. transplantaci, dívka podstoupila úspěšnou retransplantaci od stejného MUD.
Akutní GVHD byla dokumentována u 11 pacientů (41 %). Mírnější forma gr. I–II se vyskytla u 10 pacientů, těžší formu akutní GVHD gr. III vyvinul pouze 1 pacient. Chronickou GVHD jsme zaznamenali u 1 pacienta. Bezprostřední příčinou úmrtí nebyla GVHD u žádného pacienta.
Na komplikace spojené s transplantací zemřeli 3 pacienti (11 %) (Pt 3, Pt 9, Pt 24). Příčinou úmrtí byla u 2 pacientů gramnegativní sepse den+55 a den+11 po transplantaci, u Pt 9 došlo po 2. alogenní transplantaci postupně k reaktivaci CMV, ADV a EBV a dívka zemřela den+85 na potransplantační EBV-LPD.
Dva pacienti (Pt 14, Pt 19) zemřeli na progresi onemocnění (ALD, MLD) 12 M a 108 M po transplantaci. Pt 27 (MIOP) zemřel 27 M po úspěšně provedené transplantaci v souvislosti s neurochirurgickým výkonem (plastika baze lební pro rozsáhlou encefalokélu s liquoreou).
Celkové přežití je v našem souboru 78 %, 21 z 27 pacientů žije 12–347 M po transplantaci (medián 169 M), 14 pacientů (67 %) s CC. Karnofského/Lanského skóre bylo hodnoceno u 13 pacientů 90–100 %, u 7 pacientů 70–80 %, pouze u 1 pacientky s mukolipidózou II žijící s progresí onemocnění 30 %.
Dědičné metabolické poruchy
Třináct dětí bylo transplantováno pro MPS, 12 pro MPS I (MPS I-H, n = 9; MPS I-HS; n = 3), 1 dívka pro MPS VI. Medián věku v době stanovení diagnózy byl 14,5 M (2–52), medián věku v době 1. HSCT 18,5 M (4–58). Diagnóza byla stanovena u všech pacientů na biochemické, enzymologické a molekulární úrovni. Enzymová substituční terapie rekombinantně připravenou α-L-iduronidázou byla indikovaná u všech pacientů transplantovaných po roce 2008 v období před transplantací a zpravidla ještě několik týdnů po transplantaci. 11/13 (85 %) pacientů žije 12–347 M po transplantaci (medián 162 M). U všech byla dokumentována normalizace enzymatické aktivity v leukocytech, fyziologické hodnoty GAG v moči a regrese hepatosplenomegalie. Nedošlo k další progresi dysmorfických rysů, zákalu rohovky a střádání v srdci, naopak progredovaly ortopedické komplikace. Všichni pacienti byli/jsou schopni absolvovat školní docházku. První transplantovaný pacient (Pt 1) ukončil učební obor elektrikář, je v invalidním důchodu, podstoupil opakované ortopedické korekční operace, keratoplastiku a transplantaci rohovky, jeho výška je 164 cm. Pt 2 a Pt 5 (transplantovaný v 39 M již s velmi pokročilým onemocněním) ukončili speciální školu, mají významnou poruchu zraku a sluchu, těžkou skoliózu, gibus, drápovitou ruku, jejich výška je 152 cm, IQ v pásmu oligofrenie. Pt 4 (obr. 1) podstoupila opakovaně korekční ortopedické operace, její finální výška je 153 cm, studuje vysokou školu, bez postižení sluchu a vizu (pouze brýlová korekce). U 5 dětí transplantovaných po roce 2008 a žijících více než 2 roky po HSCT postupuje psychomotorický vývoj (PMV) uspokojivě, navštěvují základní či mateřskou školu (2 s osobním asistentem). Jsou sledovány na ortopedii, 4 již podstoupily nějakou korekční operaci, 3 mají vizus bez postižení, u 2 je zašednutí rohovek stacionární.
Obr. 1. Dívka s MPS I, fenotypem Hurlerové– Scheieho, 8 let po alogenní transplantaci 
(fotografie je uveřejněna se souhlasem rodičů) Pět chlapců bylo transplantováno pro X-ALD. U Pt 14 se objevily obtíže ve formě psychických změn v 5,5 letech s rychlým zhoršováním stavu, urgentně provedená HSCT nezabránila další progresi onemocnění a časnému úmrtí 12 M po transplantaci. U 4 chlapců byla diagnóza stanovena na základě pozitivní rodinné anamnézy (RA). Pt 15 byl indikován k HSCT pro progresi demyelinizace na MR (Loes 4) a mírné klinické projevy onemocnění ve věku 10,5 roku, žije 20 let po transplantaci, se stacionárním postižením zraku a sluchu, vystudoval obchodní akademii a pracuje v administrativě. 2 chlapci byli indikováni ve stadiu incipientních mírných změn na MR (Loes skóre 1), třetí pacient pro suspektní mírné zhoršování sluchu a soustředění při dosud normálním nálezu na MR. Žijí 6, 9 a 12,5 roku po HSCT ve velmi dobrém klinickém stavu, studují bez problémů základní, střední a vysokou školu, hladiny VLCFA jsou stacionárně mírně zvýšené, kontrolní MR po transplantaci bez progrese demyelinizace.
Čtyři děti byly transplantovány pro jinou vzácnou DPM: juvenilní formu MLD, mukolipidózu II (I-CD, I-cell disease), α-mannosidózu, CEP. U Pt 19 (MLD) byla po transplantaci přes trvající CC a normální aktivitu arylsulfatázy dokumentována progrese základního onemocnění, zemřel 108 M po HSCT. Rovněž u Pt 20 (I-CD) je přes trvající CC efekt transplantace na vývoj onemocnění nedostatečný. Celková úroveň intelektu je v pásmu lehkého vývojového opoždění, avšak omezení hybnosti kloubů při dysostosis multiplex a porucha růstu jsou výrazné. Dominujícím problémem je progredující neobstruktivní hypertrofická kardiomyopatie a závažná aortální insuficience, sekundární plicní hypertenze a chronická respirační insuficience s nutností tracheostomie a domácí ventilace, dlouhodobě je stav bez výraznějších změn. Pt 21 (α-mannosidóza) žije v dobrém klinickém stavu s uspokojivě postupujícím PMV 21 M po HSCT. Pt 22 (CEP) žije 21 let po HSCT. Ukončil základní vzdělání, trvá CC, jizvy v obličeji jsou nenápadné, s měkkým podkožím, výraznější omezení vlivem jizev na končetinách a trupu nemá.
Maligní infantilní osteopetróza
Pět dětí podstoupilo HSCT pro MIOP ve věku 10,5–35 M, 3 z nich žijí 29, 23 a 17 let po transplantaci. Pt 23, transplantovaná v r. 1993 ve věku 35 M, je téměř nevidomá, přesto ukončila studium na VŠ pedagogické, její finální výška je 141 cm. Pacient, který podstoupil v r. 1998 3 převody štěpu od haploidentického otce, má pouze zbytky zraku, bilaterální nedoslýchavost a vyžaduje speciální ortodontickou péči, nicméně ukončil studium na SŠ veřejnoprávní, celková stigmatizace je minimální a finální výška 169 cm. Pt 26 je předmětem samostatné kazuistiky.
Kazuistika 1
Chlapec z III. fyziologické gravidity, rodiče a 2 starší nevlastní sourozenci zdrávi, perinatální anamnéza nevýznamná. Sledován na neurochirurgii od 5 M pro zvětšení obvodu lbi a pomalu se uzavírající velkou fontanelu (VF), na CT atypický tvar lbi, hypertelorismus a rozšíření lebky kraniokaudálně i laterálně, klenutá VF, rozšíření subarachnoideálních prostorů, suspektní zevní hydrocefalus. V 8 M zjištěna hepatosplenomegalie, anemie a trombocytopenie, provedena aspirace KD, morfologicky buněčně chudá, bez nálezu atypických buněk. Pro leukocytózu (31 × 109/l) a další progresi anemie (HGB 66 g/l) a trombocytopenie (46 × 109/l) v 9 M opět vyšetřena KD, obtížná biopsie ze 3 míst vyloučila maligní hematologické onemocnění. Pro podezření na DMP přeložen na specializované pracoviště ve věku 9,5 M. Na rentgenových snímcích byla popsána významná sklerotizace tubulárních kostí, baze lební i osového skeletu (obr. 2), spolu s klinickým nálezem (stigmatizace, hepatosplenomegalie) svědčící pro těžkou formu osteopetrózy. Retrospektivně byla potvrzena mutace v TCIRG1 genu v homozygotní konstituci, oba rodiče jsou heterozygotní nosiči. Pacient podstoupil alogenní transplantaci PBSC od vhodného nepříbuzného dárce ve věku 12 M. Potransplantační průběh byl komplikován akutní GVHD gr. II a od 5 měsíců po HSCT při smíšeném chimérismu (10–15 % genotypu příjemce) recidivující autoimunní hemolytickou anemií s nutností opakovaného podání rituximabu. V předškolním věku měl chlapec častější respirační infekty, nyní na pravidelné aplikaci s.c. imunoglobulinů je nemocnost nezvýšená, dosáhl CC. Je sledován na očním, nález stacionární, mírná atrofie n. II a hypermetropie bilaterálně, klinicky bez obtíží. Studuje obchodní akademii, stigmatizace při základním onemocnění je minimální, výška 170 cm.
Obr. 2. Srovnání rentgenového nálezu u chlapce s MIOP v době stanovení diagnózy a 8 let po transplantaci 
Diskuse
Prezentujeme soubor 27 pacientů transplantovaných pro DMP a MIOP v České republice za uplynulých 28 let. Tyto indikace představují pouze 4 % našeho transplantačního programu, transplantace u těchto vzácných onemocnění patří ke komplikovanějším, každá diagnóza a často i jednotliví pacienti vyžadují zpravidla individuální přístup a pečlivou monitoraci.
Pouze 6 pacientů bylo transplantováno štěpem od MSD, většina pacientů (74 %) podstoupila HSCT od MUD. Primárního přihojení štěpu bylo dosaženo u všech sourozeneckých transplantací. Dva pacienti s primárním GF po transplantaci od MUD dosáhli přihojení po 2. transplantaci. Transplantace od haploidentického rodinného dárce s T-deplecí štěpu jsou u DMP a MIOP komplikované,(25) pacient v našem souboru dosáhl stabilního přihojení až po 3. HSCT.
Lepších výsledků HSCT (primárního přihojení i celkového přežití) je dosahováno s použitím myeloablativního přípravného režimu.(2,3,7,8) Od roku 2013 používáme dle doporučení IEWP-EBMT standardně kombinaci léků busulfan a fludarabin. Monitorování hladin busulfanu a eventuální úprava dávky vedou ke snížení dříve poměrně vysoké incidence venookluzivní nemoci jater (VOD), závažné potransplantační komplikace asociované s vyšší expozicí léku. Na druhé straně navýšení dávky v případě nedostatečné terapeutické hladiny je prevencí nepřihojení či rejekce štěpu. Zařazení fludarabinu místo dříve používaného cyklofosfamidu snižuje riziko toxicity a zároveň zkracuje délku neutropenie po transplantaci.(26) V našem souboru jsme zaznamenali VOD vyžadující léčbu defibrotidem pouze u 1 pacienta, žádný pacient nezemřel v souvislosti s toxicitou přípravného režimu.
Výhodou použití pupečníkové krve je vyšší pravděpodobnost dosažení CC, rychlá dostupnost, a tedy kratší interval od stanovení diagnózy k provedení transplantace, vyšší míra tolerance případné HLA neshody a u pacientů s MPS také dosažení vyšších hladin enzymu.(2,3,7,8) I v případě UCB však může dojít k selhání štěpu s nutností retransplantace. V našem souboru bylo UCB transplantováno 6 pacientů s DMP, primární GF jsme dokumentovali u 1 pacientky, k přihojení štěpu došlo po retransplantaci jinou UCB.
Dokumentována byla nízká incidence akutní i chronické GVHD. Těžkou formu akutní GVHD gr. III vyvinul pouze 1 pacient a celkově nebyla GVHD příčinou úmrtí u žádného pacienta.
Na infekční komplikace zemřeli v časném potransplantačním období 3 pacienti, jeden z nich již v roce 1993 na sepsi Pseudomonas aeruginosa 11 dní po nepříbuzenské transplantaci. Na EBV-LPD zemřela dívka s prolongovanou imunitní rekonstitucí po dvou alogenních transplantacích UCB.
Celkové přežití v našem souboru je 78 % (21/27), 20 pacientů žije 12–347 měsíců po HSCT se zlepšením či stabilizací základního onemocnění. Z dlouhodobého pohledu jsou naše výsledky srovnatelné s dříve publikovanými zahraničními studiemi.(7,8,13,19) Celkové přežití však není jediným kritériem úspěšnosti léčby HSCT, důležitá je zejména kvalita života po transplantaci. HSCT u řady onemocnění, zejména v případě, že enzym neproniká hematoencefalickou bariérou (např. MPS III), nevedla k významnějšímu pozitivnímu ovlivnění nepříznivého průběhu a není v současné době u těchto pacientů indikovaná.(3)
U pacientů s MPS I jsou časný věk v době transplantace a dostatečná produkce enzymu korelující s CC hlavními prediktory uspokojivého potransplantačního vývoje. Postižení srdce a zašednutí rohovek se u většiny pacientů po transplantaci stabilizuje, či dokonce zlepšuje, naproti tomu ortopedické komplikace zpravidla progredují i po transplantaci a u většiny pacientů jsou nutné opakované operační zákroky. Potransplantační péče musí být multidisciplinární, zahrnující kromě lékařů transplantačního týmu a specialistů z centra metabolických vad rovněž kardiologa, endokrinologa, ortopeda, spondylochirurga, neurologa a psychologa.(2–4,7–9) Ze 4 žijících pacientů transplantovaných pro MPS I v letech 1993–2003 se daří dobře 2 pacientům s MPS I-HS, u 2 pacientů s fenotypem MPS I-H je vývoj méně uspokojivý. Příznivějších výsledků bylo i v našem souboru dosaženo u dětí, jimž byla v předtransplantačním i peritransplantačním období podávána ERT (HSCT po roce 2008). U pacientů s MPS I-H je nejlepších výsledků dosahováno, pokud jsou transplantováni před dosažením 2–2,5 let věku.(2–4,9) V našem souboru podstoupilo HSCT do 30 měsíců věku 7 z 9 dětí s fenotypem m. Hurler, 5/6 transplantovaných od roku 2008. Těchto 5 dětí žije v dobrém klinickém stavu 14–170 M po HSCT, dívka transplantovaná ve věku 36 měsíců zemřela na potransplantační komplikace. Je nezbytné, aby děti s dysmorfickými rysy a dalšími suspektními patologickými nálezy (obr. 3) byly co nejdříve indikovány praktickými lékaři či lékaři odborných ambulancí k vyšetření na specializovaném pracovišti.
Obr. 3. Dívka s MPS I, fenotypem Hurlerové, v době stanovení diagnózy ve věku 2 let, sledována v odborných ambulancích (kardiologie, neurologie, rehabilitace, oční ambulance) pro blíže nezařazené patologické nálezy již od 6–12 měsíců 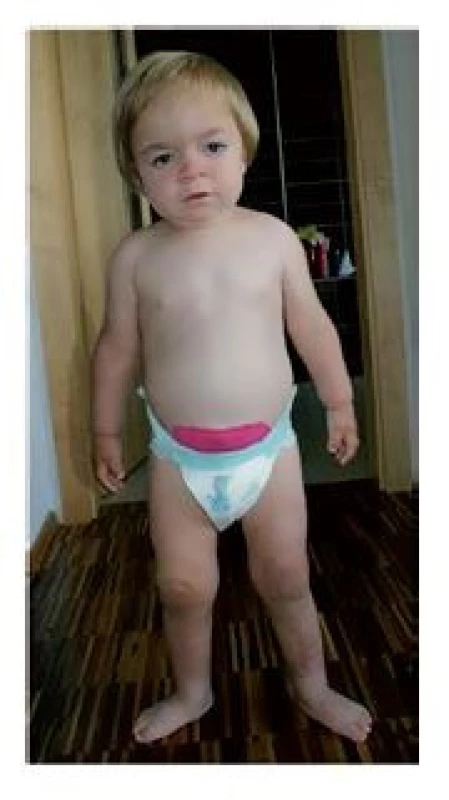
(fotografie je uveřejněna se souhlasem rodičů) Součástí péče o pacienty s X-ALD je substituce hormonů při adrenální insuficienci. Podávání tzv. Lorenzova a GTO olejů vede sice k úpravě hladin VLCFA v krvi, ale nemá vliv na progresi postižení nervového systému. V případě HSCT produkují dárcovské kmenové buňky chybějící enzym a předávají ho přímým kontaktem postiženým tkáním a neuronům. Tím je zajištěna regenerace membránových struktur a funkcí potřebných pro remyelinizaci a prevenci progresivní demyelinizace. Pacientům s X-ALD dává HSCT indikovaná časně na základě pozitivní RA a počínajících změn na MR, před rozvojem klinických symptomů, velkou šanci na zástavu progrese onemocnění.(10,11) V našem souboru jsme dosáhli u 4 takto transplantovaných chlapců velmi dobrých výsledků. K dalšímu zlepšení prognózy by přispěl novorozenecký screening X-ALD.(27)
Transplantace u MIOP bývají komplikované, zatížené vysokým rizikem rejekce štěpu, rozvoje VOD a plicní hypertenze.( 12,24) Lepších výsledků je dosahováno v případě HLA - -identického dárce (MSD i MUD), s 5letým přežitím po HSCT až 84 %.(25) Od počátku transplantačního programu bylo k HSCT indikováno pouze 5 pacientů s MIOP, z toho 1 dívka transplantovaná v roce 2003 byla ze Slovenska. Je velmi obtížné diagnostikovat onemocnění s extrémně nízkou incidencí (v případě MIOP cca 1 : 400 000). Domníváme se, že tito pacienti dlouhodobě pozornosti pediatrů alespoň částečně unikají. Včasná indikace k HSCT před rozvojem ireverzibilního poškození zraku je zásadní pro kvalitu života po transplantaci. Také z tohoto důvodu prezentujeme stručnou kazuistiku chlapce po úspěšné transplantaci pro toto vzácné, bez léčby infaustní onemocnění.
Symptomatickou léčbou extrémně vzácné CEP, dříve Güntherovy choroby (incidence 1 : 2–3 000 000), je doživotní striktní ochrana před slunečním zářením a transfuze erytrocytů. Dlouhodobý efekt HSCT jako jediné možné kauzální léčby byl dosud popsán u minimálního počtu pacientů.(22) Chlapec v našem souboru žije 21 let po transplantaci, s dobrou kvalitou života bez významnějšího omezení.
Nepříznivý osud pacientů s MLD a I-CD po HSCT je v souladu s většinou publikovaných pozorování a zpochybňuje indikaci k této náročné léčbě.
Závěr
Prognóza pacientů se závažnými formami DMP a MIOP je bez léčby krajně nepříznivá, postižení trvale progreduje a onemocnění významně zkracuje délku života.
HSCT je v současné době považována u těchto onemocnění za standardní léčebnou proceduru. V důsledku používání novějších laboratorních technik, méně toxických přípravných režimů a komplexní podpůrné péče naděje na úspěch transplantace vysoce převyšuje její rizika.
Z hlediska efektivity je HSCT mnohem účinnější v prevenci progrese onemocnění než v léčbě již vzniklého orgánového poškození, časně provedená transplantace je spojená s významně lepší prognózou. HSCT u DPM a MIOP vyžaduje komplexní přístup a kontinuální úzkou spolupráci transplantačního týmu, lékařů metabolického centra a dalších mezioborových konziliářů v období před transplantací, v peritransplantačním období, a zejména v dlouhodobém sledování pacientů po transplantaci.
Korespondenční adresa:
MUDr. Renata Formánková, Ph.D.
Klinika dětské hematologie a onkologie, UK 2. LF a FN Motol
V Úvalu 84
150 06 Praha 5
Zdroje
1. Passweg JR, Baldomero H, Chabannon Ch, et al. The EBMT activity survey on hematopoietic-cell transplantation and cellular therapy 2018: CAR-T´s come into focus. Bone Marrow Transplant 2020; 55 : 1604–1713.
2. Boelens JJ, Orchard PJ, Wynn RF. Transplantation in inborn errors of metabolism: current considerations and future perspectives. British J Haematol 2014; 167 : 293–303.
3. Tan EY, Boelens JJ, Jones SA, et al. Hematopoietic stem cell transplantation in inborn errors of metabolism. Front Pediatrics 2019; 7 : 433. doi: 10.3389/ ped.2019.00433.
4. Cetkovský P, Mayer J, Starý J, et al. Transplantace kostní dřeně a periferních hematopoetických buněk. 1. vyd. Praha: Galén 2016 : 1–413.
5. De Ru MH, Boelens JJ, Das AM, et al. Enzyme replacement therapy and/or hematopoietic stem cell transplantation at diagnosis in patiens with mucopolysaccharidosis type I: results of a European consensus procedure. Orphanet J Rare Dis 2011; 6 : 55.
6. Biffi A, Aubourg P, Cartier N. Gene therapy for leukodystrophies. Human Mol Genet 2011; 20: R42–R53.
7. Aldenhoven M, Jones SA, Bonney D, et al. Hematopoietic cell transplantation for mucopolysaccharidosis patients is safe and effective: Results after implementation of international guidelines. Biol Blood Marrow Transplant 2015; 21 : 1106–1109.
8. Taylor M, Khan S, Stapleton M, et al. Hematopoietic stem cell transplantation for mucopolysaccharidosis: past, present and future. Biol Blood Marrow Transplant 2019; 25: e226–e246. doi: 10.1016/j.bbmt.2019.02.012.
9. Parini R, Deodato F, Di Rocco M, et al. Open issues in mucopolysaccharidoses type I-Hurler. Orphanet J Rare Dis 2017; 12 : 112. doi: 10.1186/s13023 - 017-0662-9.
10. Miller W. Stem cell-transplantation therapy for adrenoleukodystrophy: current perspectives. J Neurorestoratol 2017; 5 : 5–19.
11. Miller WP, Rothman SM, Nascene D, et al. Outcomes after allogeneic hematopoietic cell transplantation for childhood cerebral adrenoleukodystrophy: the largest single-institition cohort report. Blood 2011; 118 : 1971–8.
12. Orchard PJ, Fasth AL, Le Rademacher J, et al. Hematopoietic stem cell transplantation for infantile osteopetrosis. Blood 2015; 126(2): 270–6.
13. Nestheh J, Drozdinsky G, Simanovsky N, et al. Improved outcomes of hematopoietic stem cell transplantation in patients with infantile malignant osteopetrosis using fludarabine-based conditioning. Pediatr Blood Cancer 2016; 63(3): 535–40.
14. Mynarek M, Tolar J, Albert MH, et al. Allogeneic hematopoietic SCT for alpha-mannosidosis: an analysis of 17 patients. Bone Marrow Transplant 2012; 47(3): 352–9.
15. Boucher AA, Miller W, Shanley R, et al. Long-term outcomes after allogeneic hematopoietic stem cell transplantation for metachromatic leucodystrophy: the largest single-institution cohort report. Orphanet J Rare Dis 2015; 10 : 94. doi: 10.1186/s13023-015-0313-y.
16. Grewal S, Shapiro E, Braunlin E. Continued neurocognitive development and prevention of cardiopulmonary complications after successful BMT for I-cell disease: a long-term follow-up report. Bone Marrow Transplant 2003; 32 : 957–960.
17. Ješina P, Magner M, Poupětová H, et al. Mukopolysacharidóza I – klinické projevy u 24 dětí z České republiky a Slovenska. Čes-slov Pediat 2011; 66(4): 215–225.
18. Guffon N, Pettazzoni M, Pangaud N, et al. Long term disease burden post-transplantation: three decades of observations in 25 Hurler patiens successfully treated with hematopoietic stem cell transplantation (HSCT). Orphanet J Rare Dis 2021; 16 : 60. doi: 1O.1186/s13023-020-01644-w.
19. Aldenhoven M, Wynn RF, Orchard PJ, et al. Long term outcome of Hurler syndrome patiens after hematopoietic stem cell transplantation: an international multicenter study. Blood 2015; 125(13): 2116–72.
20. Poe MD, Chagnon SL, Escolar ML. Early treatment is associated with improved cognition in Hurler syndrome. Ann Neurol 2014; 76(5): 743–53.
21. Boelens JJ, Aldenhoven M, Purtill D, et al. Outcomes of transplantation using various hematopoietic cell sources in children with Hurler syndrome after myeloablative conditioning. Blood 2013; 121(19): 3981–7.
22. Bernard C, Schmitt C, Galmiche-Rolland L, et al. Bone marrow transplantation in congenital erythropoietic porphyria: Sustained efficacy but unexpected liver dysfunction. Biol Blood Marrow Transplant 2020; 26 : 704 – 711.
23. Penna S, Villa A, Capo V. Autosomal recessive osteopetrosis: mechanisms and treatments. Dis Model Mech 2021; 14(5): dmm048940. doi: 10.1242/ dmm.048940.
24. Stepensky P, Grisariu S, Avni B, et al. Stem cell transplantation for osteopetrosis in patiens beyond the age of 5 years. Blood Advances 2019; 3(6): 862–868.
25. Zhu G, Wei A, Wang B, et al. Haploidentical haematopoietic stem cell transplantation for malignant infantile osteopetrosis and intermediate osteopetrosis: a retrospective analysis of a single centre. Orphanet J Rare Dis 2021; 16 : 314. doi: 10.1186/s13023-021-01955-6.
26. Bartelink IH, van Reij EM, Gerhardt CE, et al. Fludarabine and exposure - -targeted busulfan compares favorably with busulfan/cyclophosphamide - -based regimens in pediatric hematopoietic cell transplantation: maintaining efficacy with less toxicity. Biol Blood Marrow Transplant 2014; 20 : 345–353.
27. Zemanová M, Chrastina P, Dvorakova L, et al. X-linked adrenoleukodystrophy: phenotypy-genotype correlation in hemizygous males and heterozygot females with ABCD1 mutations. Neuro Endocrinol Lett 2021; 42(5): 359–367.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek Co jsme psaliČlánek Pediatrická poezie
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2022 Číslo 5- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
-
Všetky články tohto čísla
- Ze sbírky moderního českého a slovenského umění
- Co jsme psali
- Století profesora Hrodka v dětské hematologii a onkologii
- Nové léčebné postupy v léčbě dětské akutní lymfoblastické leukemie
- Hodgkinův lymfom – minulost a současnost
- Transplantace kmenových buněk krvetvorby u dětí s dědičnými metabolickými poruchami a maligní infantilní osteopetrózou
- Algoritmus pro rozpoznání vážně nemocného dítěte
- Závažné vrozené krvácivé poruchy s manifestací v novorozeneckém období – kazuistiky
- Infantile hepatic hemangioendothelioma
- Nové možnosti echokardiografie v diagnostice subklinické formy kardiotoxicity jako následku léčby dětských onkologických onemocnění
- Hemoragická nemoc novorozence podmíněná nedostatkem vitaminu K
- Syndrom diseminované intravaskulární koagulace u dětí
- Vrozené poruchy krevního srážení
- Historický rozhovor s legendou prof. MUDr. Otto Hrodek, DrSc. (1922–2022)
- Pediatrická poezie
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Hemoragická nemoc novorozence podmíněná nedostatkem vitaminu K
- Syndrom diseminované intravaskulární koagulace u dětí
- Algoritmus pro rozpoznání vážně nemocného dítěte
- Vrozené poruchy krevního srážení
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



