-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Genotypová heterogenita viru hepatitidy C (HCV) u dárců krve v ČR
Genotypic Heterogeneity of Hepatitis C virus (HCV) from Blood Donors in the Czech Republic
Study objectives.
Analysis of the genotypic distribution of HCV from blood donors screened in the Czech Republic in 1999-2007 and sequence heterogeneity of HCV isolates in the NS5 region of the HCV genome.Material and methods.
A total of 402 archived serum samples from blood donors collected in 1999-2007 and confirmed positive for anti-HCV antibodies were tested for HCV RNA. In 220 HCV RNA positive sera, PCR was used to amplify a 401-nt fragment of the NS5 region of the HCV genome. The PCR product was sequenced and phylogenetic analysis of the obtained nucleotide sequences was carried out. Genotyping was performed based on the comparison with the sequence data available in the Genbank database. Regression analysis and non-parametric Pearson’s chi-square test were used for statistical analysis of the distribution of genotypes by age, sex , sampling place and sampling year.Results.
In a representative set of 188 blood donors from the Czech Republic, the following HCV genotypes were determined: 1b (66%), 1a (13.3%), 3 (19.7%), 2a (0.5%) and 2b (0.5%). In 1999-2007, genotype 1b showed a significantly decreasing trend while genotype 3a was becoming significantly more frequent and the incidence of genotype 1a remained unchanged. It was found that the proportion of genotype 1b rises with increasing age of blood donors in contrast to genotypes 1a a 3a. Genotype 1b was detected significantly more frequently in females and genotype 3a significantly predominated in males. Any significant difference was not found in the geographical distribution of HCV genotypes. The mean HCV viral load was 9.6 x 105 I.U./ml.Conclusions.
The predominant HCV genotype among blood donors in the Czech Republic is 1b, showing a significant downward trend in 1999-2007. The increasing prevalence of genotype 3a can be associated with changes in the route of HCV transmission, more precisely with the considerably increased incidence of HCV in injecting drug users over the last 15 years. Surprisingly, the incidence of genotype 1a remained unchanged over the study period.Key words:
HCV – genotype – blood donors.
Autoři: V. Němeček 1
; O. Strunecký 1
Působiště autorů: Národní referenční laboratoř pro virové hepatitidy, Státní zdravotní ústav, Praha 1
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 58, 2009, č. 2, s. 63-72
Souhrn
Cíl práce.
Analýza výskytu genotypů HCV u dárců krve zachycených při screeningu v letech 1999-2007 v České republice a zjištění sekvenční heterogenity izolátů v NS5 oblasti genomu HCV.Materiál a metody.
U 402 archivovaných sér dárců krve s pozitivním výsledkem konfirmace anti-HCV protilátek získaných v letech 1999-2007 byla stanovena HCV RNA. U 220 HCV RNA pozitivních sér byl metodou PCR amplifikován úsek 401 nt z oblasti NS5 genomu HCV. PCR produkt byl sekvenován a byla provedena fylogenetická analýza nukleotidových sekvencí. Genotypy byly určeny s využitím sekvencí známých genotypů HCV z databáze Genbank. Pro statistickou analýzu závislosti rozložení genotypů na věku, pohlaví, místě a roku odběru byla použita regresní analýza a neparametrický Pearsonův χ2 test.Výsledky.
V reprezentativním souboru 188 dárců krve z ČR byl zjištěn genotyp 1b v 66 %, 1a v 13,3 %, 3 v 19,7 % a genotypy 2a a 2b oba v 0,5 %. Během let 1999-2007 četnost genotypu 1b významně klesala a naopak genotypu 3a významně stoupala, četnost genotypu 1a se neměnila. Bylo prokázáno, že s narůstajícím věkem dárců zastoupení genotypu 1b stoupá, genotypů 1a a 3a klesá. Byl zjištěn významně vyšší výskyt genotypu 1b u žen a genotypu 3a u mužů. Nebyla nalezena významná geografická rozdílnost ve výskytu genotypů HCV. Byla zjištěna distribuce virové nálože s průměrnou hodnotou 9,6 x 105 I.U./ml.Závěry.
Dominantním genotypem u dárců krve v ČR je 1b, jeho četnost však v období 1999-2007 významně klesala. Stoupající četnost genotypu 3a může souviset se změnami způsobu přenosu HCV, zejména výrazným nárůstem incidence HCV u injekčních uživatelů drog (IDU) v posledních 15 letech. Četnost genotypu 1a se v uvedeném období překvapivě neměnila.Klíčová slova:
HCV - genotyp - dárci krve.Virus hepatitidy C (HCV) patří v současné době k nejvýznamnějším parenterálně přenosným infekčním agens, která se uplatňují v lidské patologii. Ve srovnání s ostatními typy hepatitid význam virové hepatitidy C (VHC) v poslední době narůstá. Odhaduje se, že v Evropě je infikováno cca 1 % populace. Prevalence v jednotlivých evropských zemích je velmi rozdílná, gradient nárůstu je od severu k jihu. Ve skandinávských zemích je prevalence 0,1-0,2 %, ve střední Evropě v Rakousku 0,5 %, SRN 0,6 %, Švýcarsku 1 %, v jižní Evropě ve Španělsku 2,5 %, v Itálii 3,5 %. Vysoká prevalence je ve státech východní Evropy, v Estonsku 2,5 %, na Ukrajině 4,0 % v Rumunsku 6 % Výsledky sérologického přehledu provedeného v roce 2001 ukázaly, že prevalence anti-HCV v běžné populaci je 0,2 %. V České republice se kvalifikovaný odhad prevalence infekce HCV na podkladě výsledků sérologického přehledu a údajů o prevalenci u injekčních uživatelů drog (IDU) pohybuje od 0,3 do 0,5 %. To zařazuje ČR v evropském kontextu k zemím s nízkou prevalencí.Incidence hlášených případů na 100 000 obyvatel se pohybuje v zemích EU v rozmezí desetin až desítek. Trend byl v devadesátých létech většinou narůstající, po roce 2000 se nárůst většinou zpomaluje, zastavuje nebo dochází k poklesu. Účinnost hlásících systémů je v jednotlivých zemích EU rozdílná a proto je třeba opatrnosti při porovnávání dat. Nejvyšší hodnoty incidence (v řádu desítek) jsou zjišťovány ve Švédsku, Finsku, Estonsku, Velké Británii a na Islandu. Incidence nově hlášených případů v ČR stoupala z 4,4 případů na 100 000 obyv. v r. 1998 na 10,0 v r. 2006, v roce 2007 byla 9,6 (EPIDAT). Na rozšíření infekce se v minulém století významně podílely nezabezpečené parenterální injekce, invazivní medicínské postupy, transfuze infikované krve a aplikace kontaminovaných krevních přípravků a derivátů. Studie z Itálie, Francie a Španělska dokládají, že 2-10 % transfundovaných krví nebo krevních přípravků bylo infekčních. Role iatrogenního přenosu se však díky zavedení a soustavnému zlepšování screeningu dárců krve a množství preventivních a technických opatření ve zdravotnických zařízeních výrazně snížila. Epidemické šíření intravenózní aplikace drog a nedodržování zásad prevence způsobuje, že tato forma parenterálního přenosu HCV se stává dominantní. Rovněž v ČR je v současné době injekční užívání drog hlavní cestou šíření HCV infekce. Podíl IDU u hlášených případů HCV infekce v ČR plynule narůstá a v roce 2007 dosáhl již 68 % (Beneš Č. osobní sdělení). Odhad současného počtu intravenózních uživatelů drog v ČR je podle údajů Národního monitorovacího centra pro drogy a drogové závislosti asi 30 000.
Genom viru hepatitidy C je značně variabilní. Heterogenita jednotlivých oblastí genomu HCV je však značně rozdílná. Rozsah odlišnosti genomů jednotlivých izolátů větší než 30 % vedl k vymezení typů HCV [1-6], rozdíly menší, 20 až 25 % k definici subtypů (označovaných abecedně malými písmeny), je jich známo přes 70. Genotypová analýza se zpravidla provádí pouze z části virového genomu. NS5b oblast genomu obsahuje subtypově specifické sekvence a její sekvenační analýza se pro epidemiologické aplikace považuje za standard. Četnost výskytu jednotlivých genotypů je geograficky rozdílná, reflektuje fylogenezi a epidemiologické aspekty šíření HCV. Výrazné změny v četnosti genotypů v některých zemích jsou zaznamenávány i v současnosti. Rozdílná genetická diverzita jednotlivých genotypů z různých geografických oblastí světa vypovídá o míře endemicity HCV v oblasti a o způsobech a době šíření. Rozdíly v diverzitě mezi genotypy např. 3a, 1a, 1b, 2 a 4 umožňují odhadnout historicky dobu, kdy se který genotyp v oblasti začal šířit a dávat to do souvislosti s parenterálními rizikovými faktory infekce jako např. užívání krevních transfuzí, používání krevních derivátů připravovaných z mnohačetných směsí, plošné imunizační nebo léčebné kampaně a šíření injekčního užívání grog [6].
V Evropě je nejčastější výskyt genotypů 1b, 1a a 3a, v některých státech je častý i výskyt typů 2 a 4. Poměrné zastoupení genotypů se však v jednotlivých zemích často liší. Například relativní zastoupení genotypu 2 je velké v jižní Francii a Itálii, ale i ve Švédsku a Finsku, zatímco ve střední Evropě je jeho výskyt jen ojedinělý. Podstatné rozdíly v četnosti mohou být v datech získaných u dárců krve zachycených při screeningu, u příjemců transfuzí, u pacientů z terapeutických studií nebo od injekčních uživatelů drog. Poměrné zastoupení genotypů se může významně měnit v čase. Rozdíly odrážejí zejména změny v populačních skupinách, věk v době infekce, dobu trvání infekce a způsob přenosu.
Řada studií ukázala, žev Evropě je genotyp 1b a 2 nalézán spíše ve starších věkových skupinách, častěji u žen a při transfuzi v anamnéze, zatímco genotyp 1a a 3a je častěji nalézán v mladších věkových skupinách, u mužů a při anamnéze IDU. Typová heterogenita genomu HCV má význam rovněž pro klinický vývoj infekce a úspěšnost interferonové léčby. Bylo prokázáno, že typ 1 hůře odpovídá na interferonovou terapii a je doporučeno používání prodlouženého léčebného schématu.
Sekvenace izolátů HCV, kromě přesného určení typové a subtypové specificity, umožňuje získat podrobná data o míře jejich genetické rozdílnosti. Pro molekulárně epidemiologické analýzy je užitečné znát v reprezentativním množství nukleotidové sekvence izolátů v určité geografické oblasti, státu, regionu, lokalitě.
Cílem této práce bylo provést sekvenaci izolátů HCV zachycených v ČR při screeningu dárců krve v období let 1999 až 2007 a zjistit relativní četnosti genotypů HCV a fylogenetickou analýzou určit heterogenitu izolátů HCV. Dále jsme chtěli zjistit, zda je výskyt genotypů závislý na pohlaví, věku v době záchytu a geograficky na místě odběru dárce a zda dochází k významným změnám v průběhu uvedeného období. Dalším cílem bylo vytvoření databáze parciálních nukleotidových sekvencí z NS5 oblasti genomu HCV jako zdroje užitečných referenčních dat pro molekulárně epidemiologické analýzy HCV v ČR.
Materiál a metodika
Ze sér dárců krve, povinně posílaných do Národní referenční laboratoře pro virové hepatitidy (NRL-VH) k ověření reaktivního nálezu anti-HCV protilátek v letech 1999 až 2007, byly vybrány vzorky s pozitivním výsledkem konfirmace přítomnosti anti-HCV protilátek. Tyto vzorky byly otestovány na HCV RNA kvantitativním testem COBAS AmpliPrep/COBAS TaqMan HCV (Roche). Séra s pozitivní HCV RNA byla vybrána pro sekvenaci. Séra byla do zpracování uchovávána zamražená při -20 °C. Virová RNA byla extrahována soupravou QIAamp Viral RNA Mini Kit (Qiagene) z 240 μl séra. Extrahovaná virová RNA byla transkribována pomocí random hexamer primerů (Invitrogen) reverzní transtriptásou AMV podle návodu (Roche) při 40 °C po dobu 60 min. Transkribovaná DNA byla amplifikována polymerázovou řetězovou reakcí (PCR) ( 94 °C 15s, 55 °C 30s, 72 °C 90s, počet cyklů 45) v objemu 50 μl s použitím 100mM primerů SV542as, směsi SV360s, SV361s a 0,03U/ml Taq polymerázy (Invitrogen). Primery byly zvoleny z oblasti NS5B HCV genomu v pozici nukleotidů (nt) 8249-8650 s očekávanou délkou amplikonu 401 nt:
SV542as 5’-GGA GGG GCG GAA TAC CTG GTC ATR GCY TCC GTR AA
SV360s 5’-CTT CTC ATA TGA CAC CCG CTG YTT YGA,
SV361s 5’ - CTT CTC ATA TGA CAC CCG WTG CTT YGA, (Viazov S., osobní sdělení). Přečištění před sekvenční PCR bylo provedeno soupravou QiaQuick 96 PCR Purification Kit (Qiagene). Rovněž obě sekvenační PCR reakce byly provedeny s primery SV542as, a směsí SV360s a SV361s podle standardního protokolu BigDye 3.1 terminator reaction mix. (Applied Biosystems Inc.). Produkt byl precipitován směsí 66 % ethanolu a 3M octanu sodného. Sekvenace se prováděla na sekvenátoru ABI 3100 Avant, v 36 cm kapiláře, na polymeru POP6.
Sekvenační data byla zpracována pomocí programu Seqscape 2.0 (Applied Biosystems). Výsledné sekvence jednotlivých izolátů byly seřazeny algoritmem ClustalW v programu Bioedit 7.0.9, kde proběhla i vizuální kontrola sekvencí. Fylogenetická analýza byla provedena programem MEGA metodou neigbour joining. Při konstrukci fylogenetického stromu byly jako genotypové srovnávací sekvence použity nukleotidové sekvence HCV se známým genotypem převzaté z databáze Genbank s následujícími identifikačními čísly: genotyp 1a: gi 385120, gi 385118, gi 385116, gi 385114, gi 385112, gi 385110, gi 385078; genotyp 1b: gi 438611, gi 385126, gi 385124, gi 385122, 1c, gi 385132, gi 385130, genotyp 2a: gi 385138, gi 385136, gi 385134; genotyp 2b: gi 385150, gi 385148, gi 385146, gi 385144, gi 385142, gi 385140; genotyp 2c:,gi 385158, gi 385156, gi 385154, gi 385152; genotyp 3a: gi 2599513, gi 2599509, gi 385092, gi 385090, gi 385088, gi 385086, gi 385084, gi 385082, gi 385080; genotyp 4a: gi 2599511, gi 2599507, gi 385094, gi 385098, gi 385096; genotyp 5a: gi 385106, gi 385104, gi 385102, gi 385100; genotyp 6a: gi 2326454, gi 385108
Statistické hodnocení výsledků bylo provedeno v programu SPSS Statistics 16.0 (SPSS Inc. USA). Pro vzájemné hodnocení závislostí testovaných skupin dat byl použit neparametrický Pearsonův χ2 test. Pro testování závislosti genotypů na věku a roku odběru byla použita logistická regresní analýza.
Výsledky
Výběr a charakterizace souboru
V letech 1999 až 2007 bylo provedeno primární konfirmační vyšetření anti-HCV protilátek u 4294 vzorků sér dárců krve poslaných z laboratoří transfuzní služby z celé ČR (soubor dále označovaný jako TS). Průměrný počet vzorků ročně byl 477 s minimem 417 v r.2007 a maximem 567 v r. 2005. V souboru bylo 2750 mužů (64,0 %) a 1544 žen (36,0 %). Průměrný věk dárců v době odběru byl 33,7 roku a nelišil se významně u obou pohlaví. Pozitivní závěr konfirmace anti-HCV protilátek byl u 481 dárců krve, tj. u 11,2 %. Pro stanovení HCV RNA byly v dostatečném množství k dispozici vzorky od 402 dárců (84 %) s pozitivním výsledkem konfirmace anti-HCV. HCV RNA byla zjištěna u 220 (55 %) vzorků, u 178 (44 %) nebyla HCV RNA prokázána a 4 vzorky (1 %) inhibovaly PCR reakci. Nukleotidové sekvence v potřebné kvalitě pro genotypovou a sekvenační analýzu byly získány ze 188 (85 %) vzorků. Tento soubor 188 vzorků je dále označován jako GT. Soubor GT se významně neliší od souboru TS z hlediska pohlaví, 125 mužů (66,5 %), 63 žen (33,5 %). Také průměrný věk 32,8 let se v GT významně neliší od skupiny TS. Významný rozdíl však byl nalezen ve věkové distribuci mezi pohlavími ve skupině GT (p=0,001), např. mezi muži souboru GT bylo 92 % ve věkové skupině do 40 let, zatímco mezi ženami bylo ve stejné věkové skupině pouze 53 %. Průměrný věk mužů byl 29,2 let a žen 40,1 let.
Analýza virové nálože.
Kvantitativní stanovení virové HCV RNA umožnilo zjistit distribuci virové nálože v sérech dárců krve (soubor GT). Průměrná virová nálož byla 9,58 x 105 IU/ml. Z grafu 1 ukazujícího distribuci kvantity HCV RNA v souboru GT i z uvedeného průměru je zřejmé, že převažují vysoké hodnoty virové nálože. Statistická analýza ukázala, že úroveň virové nálože není závislá na pohlaví ani na věku a nemění se ani v závislosti na roku odběru, což vypovídá o tom, že množství HCV RNA v závislosti na době skladování vzorků neklesá.
Graf 1. Distribuce virové nálože v souboru GT (v grafu jsou znázorněny jen hodnoty řádu virové nálože) Chart 1. Viral load distribution in 188 HCV positives blood donors (viral load given in orders of magnitude) 
Genotypová analýza
Typová a subtypová specificita HCV jednotlivých izolátů v souboru GT byla určena na základě fylogenetické analýzy části NS5 oblasti genomu HCV. Analyzovaná délka nukleotidových sekvencí byla 222 nukleotidů (pozice 8316-8537 nt podle [4]).
Shluky ve fylogenetickém stromu reprezentující jednotlivé subtypy HCV byly identifikovány pomocí subtypově specifických sekvencí HCV získaných z genové banky (Genbank). V souboru GT byly nalezeny genotypy 1a, 1b, 2a, 2b a 3a. Nejčastěji byl zjištěn genotyp 1b v 66,0 % (124/188), genotyp 3a v 19,7 % (37/188), genotyp 1a v 13,3 % (25/188). Genotypy 2a a 2b byly nalezeny každý jen v jednom případě (1/188) tj, 0,5 %.
Analyzovali jsme, jaká je závislost výskytu genotypů na věku, pohlaví, roku odběru a oblasti, ze které byl vzorek ke konfirmaci odeslán. Protože genotypy 2a a 2b se vyskytly v souboru GT jen v jednom případě, nebyly zařazeny do statistické analýzy.
Logistická regresní analýza prokázala závislost genotypů 1a, 1b a 3a na věku. Výskyt genotypu 1a s narůstajícím věkem klesá (p=0,03). Rovněž výskyt genotypu 3a klesá s narůstajícím věkem (p=0,05). Výskyt genotypu 1b vykazuje opačný trend a s narůstajícím věkem stoupá (p<0,001).
Změny ve výskytu jednotlivých genotypů v průběhu sledovaného období 1999-2007 byly hodnoceny jako závislost výskytu genotypů na roku odběru. Pro statistické hodnocení byly jednotlivé roky sloučeny do tříletých období 1999-2001, 2002-2004 a 2005-2007. U genotypu 1a nebyla nalezena statisticky významná závislost na období odběru (p=0,62). U genotypu 1b klesal výskyt v závislosti na rostoucích letech odběru (p<0,001). Výskyt genotypu 3a naopak s rostoucím rokem odběru stoupá (p = 0,005) (graf 2).
Graf 2. Zastoupení genotypů 1a, 1b, 3a v souboru GT v období let 1999-2007 Chart 2. Distribution of genotypes 1a, 1b and 3a in 188 HCV positives blood donors, 1999-2007 
Pearsonův test ukázal, že je statisticky významná závislost genotypu na pohlaví u genotypů 1b (p=0,04) a 3a (p=0,045), zatímco u genotypu 1a byla závislost nevýznamná (p=0,58). U genotypu 1b byl vyšší výskyt u žen, u genotypu 3a vyšší u mužů (graf 3).
Graf 3. Zastoupení genotypů v souboru GT ve věkových skupinách podle pohlaví Chart 3. Distribution of HCV genotypes in 188 HCV positives blood donors by age group and sex 
Analýza geografické závislosti výskytu genotypů byla komplikována velmi nerovnoměrným zastoupením HCV pozitivních dárců v jednotlivých krajích, proto byly kraje pro statistické vyhodnocení sloučeny do šesti regionů: US, KV, PL do Čechy západ, JC, VY do Čechy jih, LI, HK, PA do Čechy východ, PH, SC do Čechy střed, JM, ZL do Morava jih, OC a MS do Morava sever. Množství případů v jednotlivých regionech a četnosti genotypů jsou uvedeny v tab. 1. V rámci ČR se prokázala závislost genotypu na regionu pouze u genotypu 1a (p=0,01), zatímco u genotypů 3a a 1b byla nevýznamná (p=0,29) resp. (p=0,19). Vyšší výskyt genotypu 1a byl zjištěn v regionu Čechy západ, kde bylo jeho zastoupení v rámci nalezených případů 33 %, zatímco v ostatních regionech nepřekračovalo 10 procent. Genotyp 1b byl v jednotlivých regionech přítomen nejméně v padesáti procentech případů s nejvyšším zastoupením v regionu Morava sever s 85 procenty. Genotyp 3a byl nejčastěji nalézán v regionu Čechy jih s 36 procenty, zatímco v regionu Čechy východ nebyl nalezen vůbec. Významný rozdíl v četnosti genotypů nebyl nalezen ani mezi regiony Čechy střed a Morava sever (p=0,14), které měly v souboru GT největší počty HCV pozitivních dárců krve.
Tab. 1. Zastoupení genotypů 1a, 1b a 3a v regionech Table 1. Distribution of HCV genotypes 1a, 1b and 3a by region 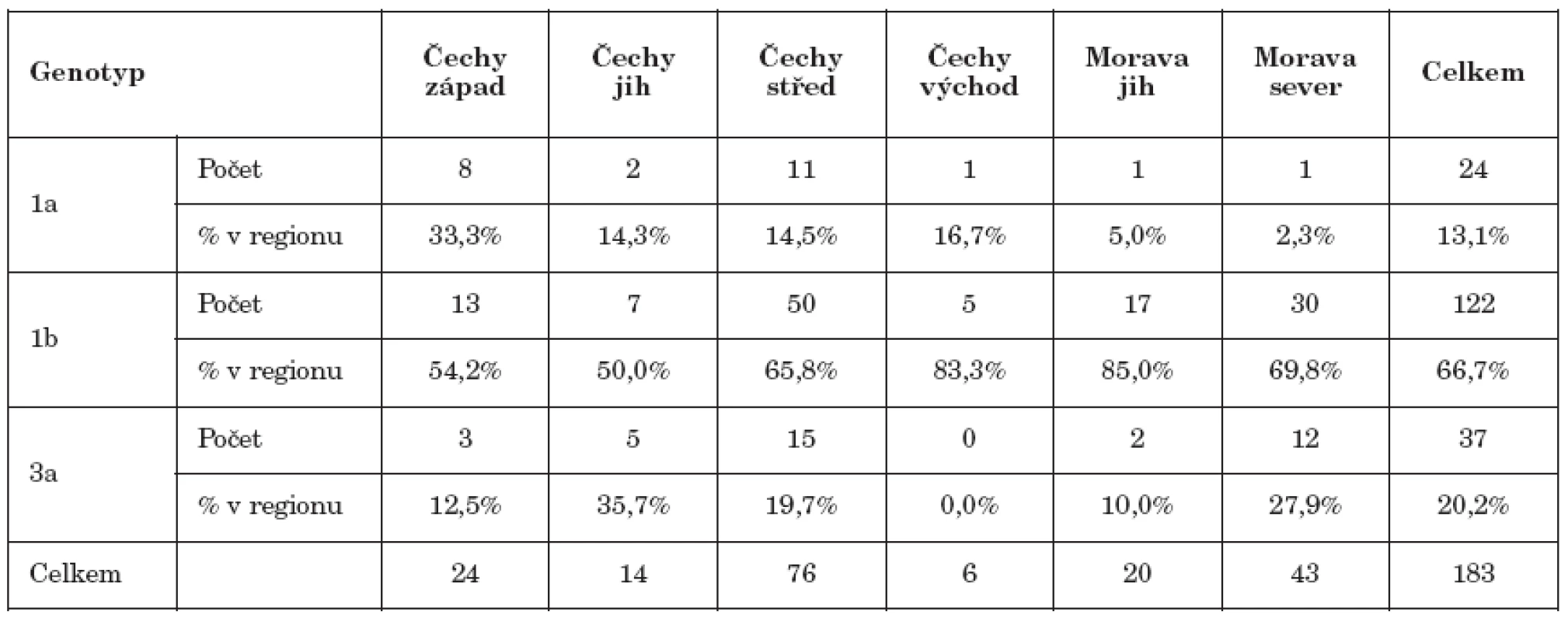
Fylogenetická analýza heterogenity HCV u dárců krve
Z nukleotidových sekvencí oblasti NS5 genomu HCV z izolátů ze souboru GT byl zkonstruován fylogenetický strom. Schematické znázornění stromu na úrovni subtypů s grafickým znázorněním početního zastoupení jednotlivých izolátů je na obr. 1. Detailní části fylogenetického stromu pro genotypy 1b, 1a a 3a jsou zobrazeny na obr. 2. Z obrázků je patrná úroveň heterogenity izolátů. Byly zachyceny i extrémně odlišné izoláty např. 191 01, 1028 99, 583 04 ve shluku genotypu 1b nebo 2015 03 ve shluku genotypu 1a; 1908 07, 1877 07 a 2695 01 ve shluku genotypu 3a. Naopak byla nalezena dvojice a čtveřice identických sekvencí pro analyzovanou oblast genomu HCV u genotypu 1b (1774 00, 310 00 a 1649 04, 1991 99, 2682 01,448 01) a dvě dvojice a jedna trojice identických sekvencí v genotypu 3a (2983 04, 3560 03 a 581 07, 662 07 a 2270 07, 2411 07,1097 04). Z geografického hlediska tyto identické izoláty pocházejí z transfuzních stanic z různých krajů s výjimkou dvou izolátů genotypu 1b z transfuzní stanice Tábor, ale odlišných roků odběru (1999 a 2001) a dvou izolátů z Prahy u genotypu 3a ze stejného roku odběru, jeden z TS ÚVN Střešovice a druhý z TS FN K.Vinohrady.
Obr. 1. Schematické znázornění fylogenetického stromu na úrovni genotypů souboru GT (šířka trojúhelníků znázorňuje množství izolátů určitého subtypu, měřítko určuje genetickou vzdálenost subtypů, čísla vyjadřují hodnoty boot-strap analýzy v %) Fig. 1. Genotype phylogenetic tree for 188 HCV positives blood donors (triangle base represents the number of isolates of the respective subtype, numbers are bootstrap percentages, the genetic distance scale bar is shown) 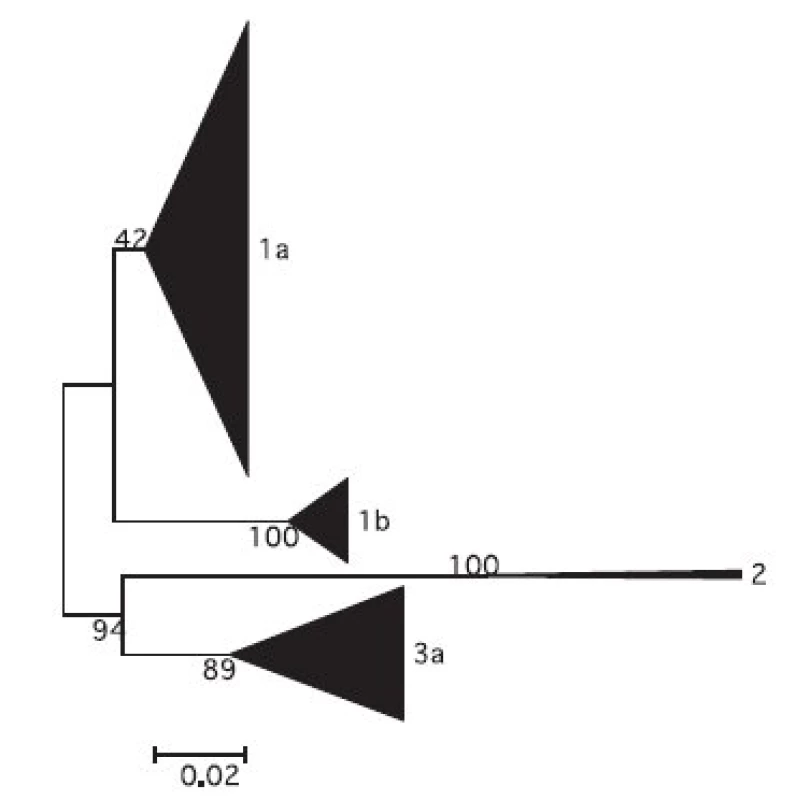
Obr. 2. Fylogenetický strom souboru GT pro jednotlivé subtypy: 1b, 1a, 3a. Čtverečky označují typové sekvence z Genbank, měřítko určuje genetickou vzdálenost subtypů Fig. 2. Subtype 1b, 1a and 3a phylogenetic trees for 188 HCV positives blood donors (squares are Genbank sequences, the genetic distance scale bar is shown) 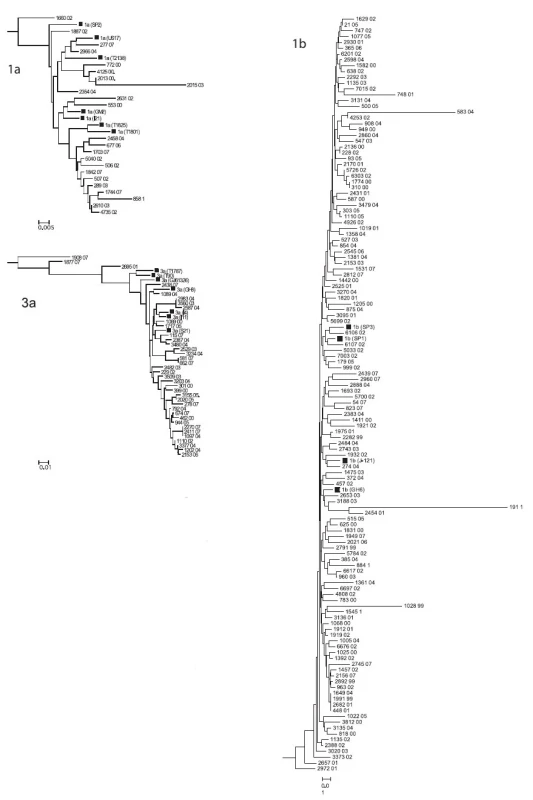
Rozsáhlý soubor 188 parciálních nukleotidových sekvencí HCV umožnil vytvoření databáze, která zahrnuje reprezentativní soubor izolátů zachycených při screeningu dárců krve plošně z celé ČR za období let 1999-2007.
Diskuse
Povinná konfirmace všech reaktivních nálezů anti-HCV protilátek při screeningu dárců krve v NRL pro virové hepatitidy a dlouhodobá archivace vzorků v NRL umožnila vytvoření souboru sér pro fylogenetickou analýzu genomové heterogenity a stanovení genotypů HCV u dárců krve v období let 1999 až 2007. HCV RNA byla prokázána u relativně nízkého počtu 220 dárců, tj. u 55 % z 402 konfirmovaných anti-HCV pozitivních přesto, že její stanovení bylo provedeno testem COBAS TaqMan (Roche) s vysokou citlivostí detekce. Podobně nízký záchyt byl již publikován [16]. Obecně bývá tento podíl u dárců krve nižší než v souborech pacientů z klinických studií. To, že nižší podíl HCV RNA v našem souboru pozitivních nesouvisí s citlivostí detekce HCV RNA dokumentuje i distribuce hodnot virových náloží s převahou vysokých hodnot, jak ukazuje graf 2. Protože virová nálož koreluje s infekčností krve, je zjištění, že u HCV RNA pozitivních dárců byly nalezeny převážně vysoké virové nálože důležitým údajem pro transfuzní službu.
Z 220 HCV RNA pozitivních vzorků se podařilo získat kvalitní nukleotidové sekvence v obou směrech u 188 vzorků, tj. u 94 %. Ostatních 22 vzorků buď nebylo opakovaně možné osekvenovat v jednom směru nebo čtení sekvence bylo nejednoznačné, patrně v důsledku směsné infekce. Směsné infekce jsou u HCV poměrně časté, obvykle až v řádu procent.
Genotypová analýza 188 izolátů HCV zachycených při screeningu dárců krve v období let 1999 až 2007 v ČR prokázala genotyp 1a v 12,3 %, genotyp 1b v 66 %, genotyp 3a v 19,7 % a genotypy 2a a 2b shodně v 0,5 %. V tuzemských studiích dominantní výskyt genotypu 1b zjistila rovněž Krekulová et al. v pilotní studii ve skupině 52 IDU (genotyp 1a v 27 %, 1b v 65 %, 2 v 2 %, 3 v 6 %) a skupině 39 pacientů bez anamnézy IDU (genotyp 1a v 18 %, 1b v 82 %, 2 a 3 nezjištěn) . Podobně Urbánek et al. u 143 pacientů v terapeutické studii zjistil typ genotyp1b v 73,4 %, genotyp 1 bez určení subtypu v 13,3 %, 2 v 0,7 %, 3 v 4,2 %. Výskyt genotypu 3a v 19,7 %, který jsme zjistili u dárců krve byl v porovnání s uvedenými dvěma studiemi překvapivě významně vyšší.
Vysoká prevalence genotypu 1b a relativně nízká prevalence genotypů 1a a 3a jsou nalézány ve státech střední a východní Evropy. V Polsku byla u dárců krve nalezena prevalence genotypu 1a 4 %, 1b 76 %, 3a 15 %, 4c a 4d celkem 4 %, 6a 1 %. V Maďarsku u pacientů genotyp 1a v 6 %, 1b v 85,5 %, typ 3 v 0,5 %, genotyp 1a a 2 směsný s 1b v celkem 4 %, typ 4 ve 2 %. Studie u skupiny dárců krve a pacientů z Ruska, Běloruska, Moldávie ukázala dominanci genotypu 1b jak u dárců krve, tak pacientů a četnost genotypu 1a v 5 %, 1b v 82 %, 3a v 10 %, 2a a 2c celkem v 5 %. Ve státech severní, západní i jižní Evropy je poměrný výskyt genotypů zpravidla odlišný. V zemích severní Evropy, kde je nejvyšší incidence infekce HCV, je nejvyšší relativní četnost genotypů 1a a 3a a překvapivě je vysoká i četnost typu 2, zatímco četnost genotypu 1b je nízká. Např. ve Švédsku byla u dárců krve zjištěna prevalence genotypu 1a 40 %, 1b 10 %, 2b 21 %, 3a 29 %. Genotyp 2b významně asocioval s transfuzí krve v anamnéze, genotyp 3a s IDU a tetováním. Ze zemí západní Evropy dominují genotypy 1a a 3a rovněž v Anglii, Walesu i Skotsku, ve Skotsku je častý i typ 2 (14 %). Ve studii dárců krve z jižní Francie za období 1991-2003 byla zjištěna prevalence genotypů: 1a ve 27,7 %, 1b ve 30,2 %, 2 v 10,9 %, 3a ve 22,4 %, 4d 5 %, 4a 2,5 %, 5a 1,3 %. Významné změny v prevalenci subtypů v čase nastaly u genotypu 3a, nárůst v létech 1990-1999 z 0 % na 28 %, pokles 1b v letech 1990-1998 z 50 % na 23 %. V jiné studii z Francie byl pozorován pokles relativní frekvence genotypů 1b i 2. U dárců krve v Portugalsku byl výskyt jednotlivých genotypů: 1a ve 30 %, 1b v 21 %, 2 ve 3 %, 3a v 22 %, 4 v 7 %. (Caldeira M.R. osobní sdělení.) V jižní Evropě, ve Španělsku byla zjištěna relativní frekvence genotypů 1a v 19,5 %, 1b v 34,3 %, 2 v 11,4 %, 3a ve 24 %.
Změny v zastoupení genotypů jsou odrazem změn ve způsobu šíření HCV infekce. Podíl iatrogenních infekcí v důsledku zavedení a zlepšování screeningu dárců krve a rozvoji preventivních a technických opatření ve zdravotnických zařízeních se výrazně snížil. V souvislosti s tím zřejmě dochází ke snižování výskytu genotypů 1b a 2 [5]. Rozsáhlé šíření injekčního užívání drog spolu s nedodržováním preventivních opatření k zábraně parenterálního přenosu je naopak dáváno do souvislosti s nárůstem výskytu genotypu 1a, 3a i typu 4. Zatímco k šíření IDU v západní Evropě docházelo již od šedesátých let minulého století, v zemích bývalého východního bloku došlo k šíření IDU výrazněji až od devadesátých let. V tom je třeba spatřovat hlavní příčinu rozdílného zastoupení genotypů HCV v těchto zemích.
Skutečnost, že k zmíněnému vývoji v zastoupení genotypů dochází postupně i ve středo a východoevropských zemích potvrzuje několik prací. Např. odlišné zastoupení genotypů bylo zjištěno u 50 anti-HCV negativních dárců krve, ale pozitivních na HCV RNA zachycených tzv. NAT screeningem, tudíž prokazatelně akutních infekcí. Významně nižší zastoupení bylo prokázáno u genotypu 1b (36 %) a naopak významně vyšší u genotypu 3a (40 %).
Vysoké zastoupení jinde minoritního genotypu 4 (23,4 %), bylo zjištěno ve studii u IDU zejména u koinfikovaných HIV v severovýchodním Polsku (genotyp 1b ve 30,6 %, 1a v 8,1 %, 3a v 37,8 %). Pro podobný vývoj zastoupení genotypů HCV v ČR svědčí i výsledky této studie. Během sledovaného období let 1999-2007 byl u dárců krve zaznamenán významný nárůst zastoupení genotypu 3a a naopak významný pokles genotypu 1b. V zastoupení genotypu 1a nebyla prokázána významná změna. Výsledky analýzy závislosti výskytu genotypů na věku a pohlaví dárců odpovídají údajům zjišťovaným v řadě publikovaných studií [5]. Zastoupení genotypu 1a i 3a s věkem klesá a naopak genotypu 1b stoupá. Výskyt genotypu 1b je větší u žen, genotypu 3a u mužů. Při základním porovnávání výchozího souboru TS 4294 dárců krve a souboru GT 188 dárců s ogenotypovaným HCV nebyl zjištěn rozdíl v zastoupení pohlaví, ani průměrný věk v obou souborech se významně nelišil, byl však nalezen významný rozdíl ve věkové distribuci mezi pohlavími.
Geografické rozdíly v distribuci genotypů na úrovni regionů tvořených několika kraji nebyly zjištěny, s výjimkou vyššího zastoupení genotypu 1a v regionu Čechy západ.
Pro interpretaci změn v zastoupení genotypů u dárců krve v ČR je podstatné znát současnou situaci a dynamiku změn v distribuci genotypů u IDU. Výsledky paralelně prováděné studie u IDU ukazují výrazný vzestup v zastoupení genotypů 3a a hlavně 1a v této rizikové skupině během posledního desetiletí (Krekulová, osobní sdělení). Otázkou je, jak epidemiologicky vysvětlit to, že nebyl zjištěn nárůst genotypu 1a u dárců krve při významném nárůstu tohoto genotypu ve skupině IDU, když u genotypu 3a byl zjištěn významný nárůst v obou skupinách.
Fylogenetická analýza ukázala míru divergence izolátů HCV u dárců krve. Identické sekvence v analyzované oblasti NS5 byly nalezeny ojediněle u genotypu 3a i 1b. Podstatným přínosem parciální sekvenace izolátů HCV od dárců krve je ve vytvoření referenční databáze sekvencí z ČR užitečné pro další molekulárně epidemiologické analýzy.
Závěr
Studie byla provedena na reprezentativním souboru HCV pozitivních dárců krve z ČR za období let 1999 až 2007. Podíl dárců s aktivní replikací viru byl 55 % z pozitivně konfirmovaných a průměrná hodnota virové nálože HCV byla 9,6 x 105. Studie poskytla prvotní data o výskytu a relativní četnosti genotypů HCV u dárců krve v ČR. Nejvyšší prevalence byla nelezena u genotypu 1b (66 %) pak u 3a (19,7 %) a 1a (13,3 %). Genotypy 2a a 2b byly nalezeny ojediněle (0,5 %). Během let 1999-2007 u dárců krve významně klesla četnost genotypu 1b a naopak stoupla u genotypu 3a, zatímco u genotypu 1a se významně neměnila. Změny v zastoupení genotypů v čase, stejně jako závislosti na věku a pohlaví odpovídají trendům pozorovaným v evropských zemích, které souvisejí se změnami ve způsobu přenosu HCV.
Projekt byl finančně podporován grantem IGA MZČR č. NR9044-3/2006.
Poděkování
Autoři děkují Dr. S. Viazovovi (Univ. Essen) za poskytnutí sekvencí citovaných primerů, RNDr. B. Procházkovi, CSc. za významnou pomoc při statistickém zpracování dat a Mgr. P. Fritzovi za revizi rukopisu.
Do redakce došlo 15. 1. 2009
RNDr.Vratislav Němeček, CSc.
Národní referenční laboratoř pro virové hapatitidy
Státní zdravotní ústav
Šrobárova 48
100 42 Praha 10
e-mail: nemecek@szu.cz
Zdroje
1. Brojer, E., Gronowska, A., Medynska, J., Grabarczyk, P., Mikulska, M. et al. The hepatitis C virus genotype and subtype frequency in hepatitis C virus RNA-positive, hepatitis C virus antibody-negative blood donors identified in the nucleic acid test screening program in Poland. Transfusion, 2004,44, 1706-1710.
2. Cantaloube, J. F., Gallian, P., Attoui, H., Biagini, P.et al. Genotype distribution and molecular epidemiology of hepatitis C virus in blood donors from southeast France. J Clin Microbiol, 2005,43, 3624-3629.
3. Chlabicz, S., Flisiak, R., Kowalczuk, O., Wiercinska-Drapalo, A., Pytel-Krolczuk, B.et al. High prevalence of genotype 4 among hepatitis C virus-infected intravenous drug users in north-eastern Poland. J Med Virol, 2008,80, 615-618.
4. Choi, J., Xu, Z., Ou, J. H. Triple decoding of hepatitis C virus RNA by programmed translational frameshifting. Mol Cell Biol, 2003,23, 1489-1497.
5. Esteban, J. I., Sauleda, S., Quer, J. The changing epidemiology of hepatitis C virus infection in Europe. J Hepatol, 2008,48, s.148-162.
6. Frank, C., Mohamed, M. K., Strickland, G. T., Lavanchy, D., Arthur, R. R et al. The role of parenteral antischistosomal therapy in the spread of hepatitis C virus in Egypt. Lancet, 2000,355, 887-891.
7. Gervain, J., Simon, G., Jr., Papp, I., Szabone, B. K. [Determination of the type and subtype of the hepatitis C virus in chronic viral hepatitis patients in Hungary]. Orv Hetil, 2001,142, 1315-1319.
8. Krekulova, L., Rehak, V., Madrigal, N., Johnson, M., Killoran, P., Riley, L. W. Genotypic and epidemiologic characteristics of hepatitis C virus infections among recent injection drug user and nonuser populations. Clin Infect Dis, 2001,33, 1435-1438.
9. Martinot-Peignoux, M., Roudot-Thoraval, F., Mendel, I., Coste, J., Izopet, J.et al. Hepatitis C virus genotypes in France: relationship with epidemiology, pathogenicity and response to interferon therapy. The GEMHEP. J Viral Hepat, 1999,6, 435-443.
10. Nemecek, V., Castkova, J., Fritz, P., Linhartova, A., Svandova, E.et al. The 2001 serological survey in the Czech Republic—viral hepatitis. Cent Eur J Public Health, 2003,11 Suppl, S54-S61.
11. Payan, C., Roudot-Thoraval, F., Marcellin, P., Bled, N., Duverlie, G. et al. Changing of hepatitis C virus genotype patterns in France at the beginning of the third millenium: The GEMHEP GenoCII Study. J Viral Hepat, 2005,12, 405-413.
12. Rantala, M., van de Laar, M. J. Surveillance and epidemiology of hepatitis B and C in Europe - a review. Euro Surveill, 2008,13.
13. Shev, S., Widell, A., Foberg, U., Fryden, A., Hermodsson, S., et al. HCV genotypes in Swedish blood donors as correlated to epidemiology, liver disease and hepatitis C virus antibody profile. Infection, 1995,23, 253-257.
14. Simmonds, P. Genetic diversity and evolution of hepatitis C virus-15 years on. J Gen Virol, 2004,85, 3173-3188.
15. Simmonds, P., Alberti, A., Alter, H. J., Bonino, F., Bradley, D. W., et al. A proposed system for the nomenclature of hepatitis C viral genotypes. Hepatology, 1994,19, 1321-1324.
16. Tallo, T., Norder, H., Tefanova, V., Krispin, T., Schmidt, J.et al. Genetic characterization of hepatitis C virus strains in Estonia: fluctuations in the predominating subtype with time. J Med Virol, 2007,79, 374-382.
17. Urbánek P., Subhanová I., Janoušová, E., Dušek L., Mareček Z. et al. Účinnost terapie pegylovaným interferonem a ribavirinem u pacientů s chronickou HCV infekcí. Vnitř lék, 2009 (v tisku).
18. Viazov, S., Kuzin, S., Paladi, N., Tchernovetsky, M., Isaeva, E., et al. Hepatitis C virus genotypes in different regions of the former Soviet Union (Russia, Belarus, Moldova, and Uzbekistan). J Med Virol, 1997,53, 36-40.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2009 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- SDĚLENÍ Z ČLS JEP Společné prohlášení České lékařské společnosti Jana Evangelisty Purkyně a Asociace inovativního farmaceutického průmyslu O spolupráci mezi lékařskou odbornou veřejností a inovativním farmaceutickým průmyslem
- Životní jubileum doc. MUDr. Otto Lochmanna, CSc.
- K 85. narozeninám prof. MUDr. Vladislava Potužníka, DrSc.
- Recenze
- Nové možnosti očkování proti chřipce
- TEST Z IMUNOLOGIE
- Zprávy z internetu
- Laboratórna diagnostika toxoplazmózy
- Genotypová heterogenita viru hepatitidy C (HCV) u dárců krve v ČR
- Vliv náhlých změn teploty a tlaku vzduchu na úmrtnost v ČR
- Situace a trendy v zastoupení genotypů viru hepatitidy C v populaci injekčních uživatelů drog
- Borrelia burgdorferi s.l. v klíšťatech na ostravských haldách
- Alimentární přenos klíšťové encefalitidy v České republice (1997–2008)
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Laboratórna diagnostika toxoplazmózy
- TEST Z IMUNOLOGIE
- Vliv náhlých změn teploty a tlaku vzduchu na úmrtnost v ČR
- Genotypová heterogenita viru hepatitidy C (HCV) u dárců krve v ČR
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



