-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nová metoda a schéma typizace Streptococcus pneumoniae
A Novel Typing Method and Scheme for Streptococcus pneumoniae
Study aim:
To introduce a novel molecular PCR method for the typing of Streptococcus pneumonia in the National Reference Laboratory (NRL) for Streptococcal Infections.Material and Methods:
Strains of Streptococcus pneumoniae are referred to the NRL from different regions of the Czech Republic. Generally, the identification and typing are based on strain morphology, optochin susceptibility, bile solubility, latex agglutination, and the Quellung reaction. Since 2012, a novel multiplex polymerase chain reaction (mPCR) assay has been introduced. The novel assay was tested on 210 S. pneumoniae isolates and 8 isolates of the related species S. pseudopneumoniae, S. sanguinis, and S. oralis.Results:
The NRL for Streptococcal Infections has included a novel mPCR assay in the algorithm of S. pneumoniae identification and typing. The mPCR assay was able to identify and type any pneumococcal strain from the study collection, with the isolates of the related species remaining negative. The mPCR assay showed 100% sensitivity and specificity in this study. The pCR appeared to be an excellent tool for S. pneumoniae typing.Conclusion:
Until recently, S. pneumoniae serotypes and serogroups were differentiated using a serological approach (Quellung reaction), but the NRL for Streptococcal Infections has switched to a novel mPCR assay. This molecular tool improves S. pneumoniae typing, making it more accurate.Keywords:
PCR typing of Streptococcus pneumoniae – Quellung reaction – Streptococcus pneumoniae
Autoři: Vacková Zuzana; Klímová Martina; Kozáková Jana
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 62, 2013, č. 2, s. 50-58
Souhrn
Cíl práce:
Zavedení nové molekulární PCR metodiky pro účely typování kmenů Streptococcus pneumoniae v NRL pro streptokokové nákazy.Materiál a metodika:
Kmeny Streptococcus pneumoniae jsou zasílány do NRL z různých regionů České republiky. Běžně je identifikace a typizace založena na morfologii kmene, citlivosti k optochinu, rozpustnosti ve žluči, latexaglutinaci a Quellung reakci. Od roku 2012 byla použita nová multiplexová polymerázová řetězová reakce (mPCR). Proběhlo testování nové metody na 210 izolátech S. pneumoniae a na 8 izolátech příbuzných druhů S. pseudopneumoniae, S. sanguinis a S. oralis.Výsledky:
Nová mPCR metoda byla v NRL pro streptokokové nákazy aplikována do algoritmu identifikace a především typizace S. pneumoniae. Technika mPCR umožnila správně identifikovat a otypovat všechny kmeny pneumokoků zkoumaného souboru, naopak izoláty příbuzných druhů vykazovaly správnou negativní reakci. Metoda mPCR měla ve zkoumaném souboru 100% senzitivitu i specificitu. Ukázalo se, že PCR reakce je pro typování S. pneumoniae výborně použitelná metoda.Závěr:
Sérotypy a séroskupiny S. pneumoniae byly doposud rozlišovány pouze pomocí sérologické Quellung reakce, nyní došlo ke změně a novému zavedení mPCR reakce. Jedná se o molekulární metodu zlepšující a zpřesňující typizaci S. pneumoniae.Klíčová slova:
PCR typování Streptococcus pneumoniae – Quellung reakce – Streptococcus pneumoniaeÚVOD
Streptococcus pneumoniae patří celosvětově k nejvýznamnějším patogenům. Způsobuje pestrou škálu různých onemocnění, od nejzávažnějších invazivních onemocnění (IPO), jakými jsou meningitidy, bakterémie, sepse či pneumonie, až po život zpravidla neohrožující akutní otitidy či sinusitidy. Nejvyšší nemocnost IPO je pozorována u nejmenších dětí (do jednoho roku věku), u seniorů (nad 65 let věku), ale také vysoce rizikovou skupinu představují imunokompromitovaní pacienti a pacienti s chronickými kardiopulmonárními nemocemi [1].
Pneumokoky se řadí mezi grampozitivní bakterie, typicky se vyskytující ve formě diplokoků. Jejich hlavním faktorem virulence je pouzdro. Jedná se o pouzdro polysacharidové povahy, tvořené typově specifickými antigeny. Podle strukturální variability typově specifického polysacharidového pouzderného antigenu, se pneumokoky klasifikují do více než 90 sérotypů a 46 séroskupin [2]. Sérotypy můžeme podle složení pnemokokových vakcín označit na dvě skupiny, vakcinační a nevakcinační. Distribuce jednotlivých sérotypů je ovlivněna geografickou polohou, socioekonomickými podmínkami, věkem pacienta, klinickou formou onemocnění, ale i vakcinační strategií [3, 4, 5]. Při dlouhodobém používání konjugovaných vakcín se nesmí zapomínat i na problém fenoménu replacementu, kompetitivní náhrady sérotypů krytých vakcínou jinými, tzv. nevakcinačními pneumokokovými sérotypy.
Z mnoha důvodů je proto velice žádoucí neustále monitorovat a analyzovat zastoupení sérotypů u kmenů pneumokoků izolovaných z klinických materiálů pacientů. A právě i této problematice se NRL pro streptokokové nákazy (NRL/STR) již celou řadu let věnuje a snaží se novelizovat používané metodiky dle současně známých informací.
V tomto sdělení prezentujeme novou molekulární metodu PCR používanou v procesu identifikace, ale především typizace S. pneumoniae v NRL/STR. Tato metoda byla v průběhu roku 2012 NRL/STR testována a od roku 2013 zařazena do rutinního provozu laboratoře.
MATERIÁL A METODIKY
Kmeny
V období testování nové PCR metody byly použity kmeny S. pneumoniae napříč sérotypy (210 izolátů) z databáze IPO NRL/STR, S. pseudopneumoniae (2 izoláty), S. sanguinis (4 izoláty) a S. oralis (2 izoláty) ze sbírky NRL/STR. Celkem bylo tedy otestováno 218 izolátů. Jednalo se o kmeny získané z různých biologických vzorků – hemokultura (110 izolátů), likvor (24 izolátů), stěr z epidurálního prostoru (1 izolát), sputum (14 izolátů), bronchoalveolární laváž (10 izolátů), nazofaryngeální výtěr (31 izolátů), stěr ze středouší (9 izolátů), stěr z oka (2 izoláty), punktát (8 izolátů), aspirát (4 izoláty), absces (4 izoláty), stěr z rány (1 izolát).
Identifikace Streptococcus pneumoniae
Pro identifikaci species se používá několik testů. Po získání čisté kultury bakteriálního kmene na krevním agaru Columbia (COA) s optochinovým diskem je hodnocena morfologie kolonií. Pneumokoky jsou citlivé k optochinu v koncentraci, jenž neovlivní ostatní viridující streptokoky. Následuje Test rozpustnosti ve žluči, pneumokoky jsou lyzovány v 10% roztoku deoxycholátu sodného. Kombinací těchto metod zjistíme, zda se jedná o S. pneumoniae. V případě problémů či nejasností lze využít ještě další identifikační metody, jakými jsou např. latexaglutinace, reakce s pneumokokovým OMNI sérem, biochemická identifikace, mikroskopie, katalázový test, či molekulární metody (PCR, MLST).
Typizace Streptococcus pneumoniae
1. Sérotypizace
Quellung (Neufeldova) reakce je používána již od roku 1902 a doposud představuje zlatý standard [6]. Jedná se o sérologickou reakci mezi typovým pouzderným polysacharidovým antigenem pneumokoka a typově specifickou protilátkou v hyperimunním králičím komerčním antiséru. Existují poolová antiséra A–I (tab. 1) a pro případné finální dourčení faktorová antiséra (SSI Dánsko). Pozitivní reakce se projeví zvýrazněním pouzderného materiálu – „bobtnání pouzdra“, které se pozoruje v nativním preparátu pod mikroskopem s fázovým kontrastem.
Tab. 1. Tabulka sérotypového složení poolových antisér pro Quellung reakce Table 1. Table of serotype-specific antisera included in the pool for the Quellung reaction 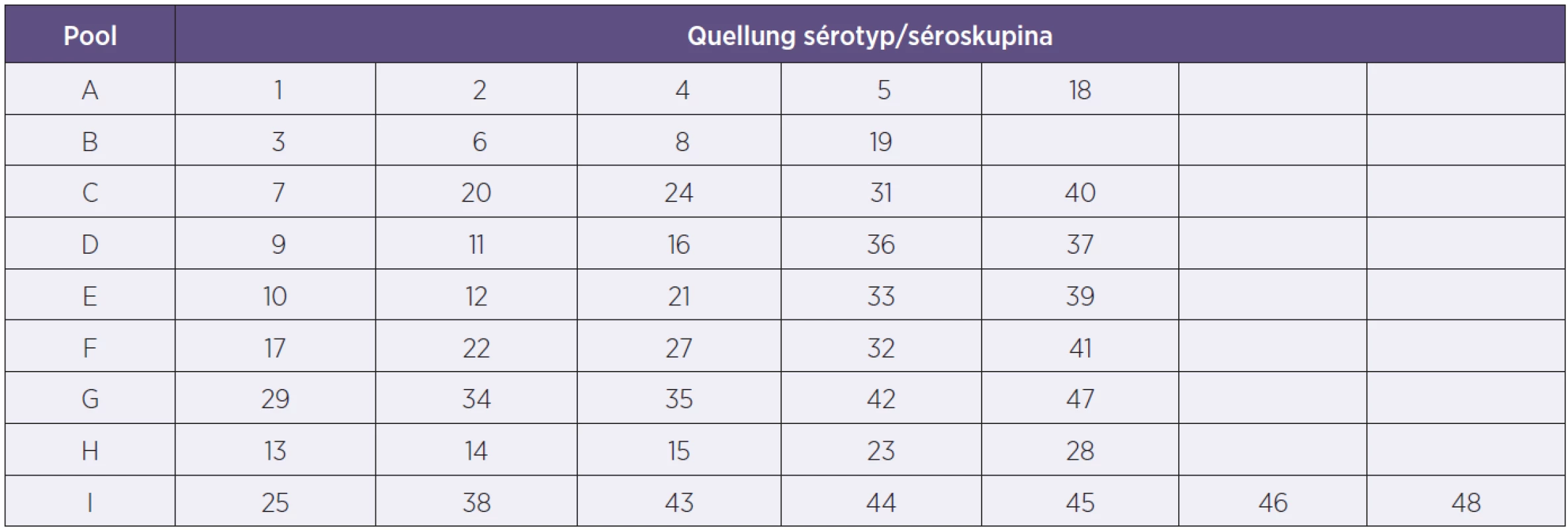
2. Genotypizace
Genotypizace představuje modernizaci metodiky typizace S. pneumoniae za použití polymerázové řetězové reakce, neboli PCR. NRL/STR vycházela při navrhování nové metodiky z principu metody PCR používané v THL, National Institute for Health and Welfare, Helsinky [7]. Následně došlo k modifikaci metody. Jedná se o molekulární metodu uspořádanou do schématu multiplexové reakce PCR (mPCR) s vyhodnocením na agarózové elektroforéze. Účelem této metody je detekce pneumokokových genů, v genomu bakterie, které jsou typické pro určitou kapsulu séroskupiny či sérotypu S. pneumoniae. PCR využívá specifických primerů pro dané geny podle CDC, The Centers for Disease Control and Prevention, Atlanta, USA [9]. Používané geny jsou kapsulární determinanty (geny: cpsA, wzy, cpsH, cpsI, capB, wciY, cpsK, cpsG, galU, wciP, cpsO, wci, Nbeta, wcwL, werG, wzx, wciL). Do multiplex PCR reakcí bylo dále ještě zařazeno testování cpsA genu pro molekulární identifikaci S. pneumoniae bez ohledu na séroskupinu či sérotyp.
Algoritmus používání mPCR reakce typující S. pneumoniae
V literatuře je popsán následující mechanismus typování S. pneumoniae [8]: Sestavení šesti mPCR reakcí podle prevalencí výskytu jednotlivých sérotypů. Každá mPCR obsahuje primery na šest sérotypů či séroskupin a vždy primery pro cpsA gen S. pneumoniae. S vlastním DNA vzorku se vždy začíná s testováním mPCR1 a pokračuje se postupně s dalšími mPCR reakcemi až do doby pozitivního nálezu, což může být i mPCR6. Po mPCR reakcích se podle potřeby provádí dourčení Quellung reakcí s faktorovými antiséry.
Tento mechanismus byl v NRL/STR otestován s výbornými výsledky. Nicméně se neukázal pro místní použití dostatečně efektivní, a proto došlo k následujícím úpravám: Bylo sestaveno devět různých mPCR reakcí podle složení poolových antisér pro Quellung reakci (tab. 2). Podle nich se také jednotlivé mPCR reakce nazvaly A–I. Jednotlivé mPCR se liší počtem primerů pro sérotypy či séroskupiny, od dvou do sedmi a taktéž vždy obsahují primery pro detekci cpsA genu. S vlastní DNA vzorku se použije mPCR označená písmenem podle poolového antiséra, se kterým kmen dává pozitivní Quellung reakci. Jedná se tedy pouze o předurčenou jednu mPCR reakci pro daný vzorek. V případě potřeby následuje dourčení Quellung reakcí s faktorovými antiséry.
Tab. 2. Tabulka sérotypového složení mPCR směsí pro PCR reakce Table 2. Table of serotypes included in the mPCR mixes 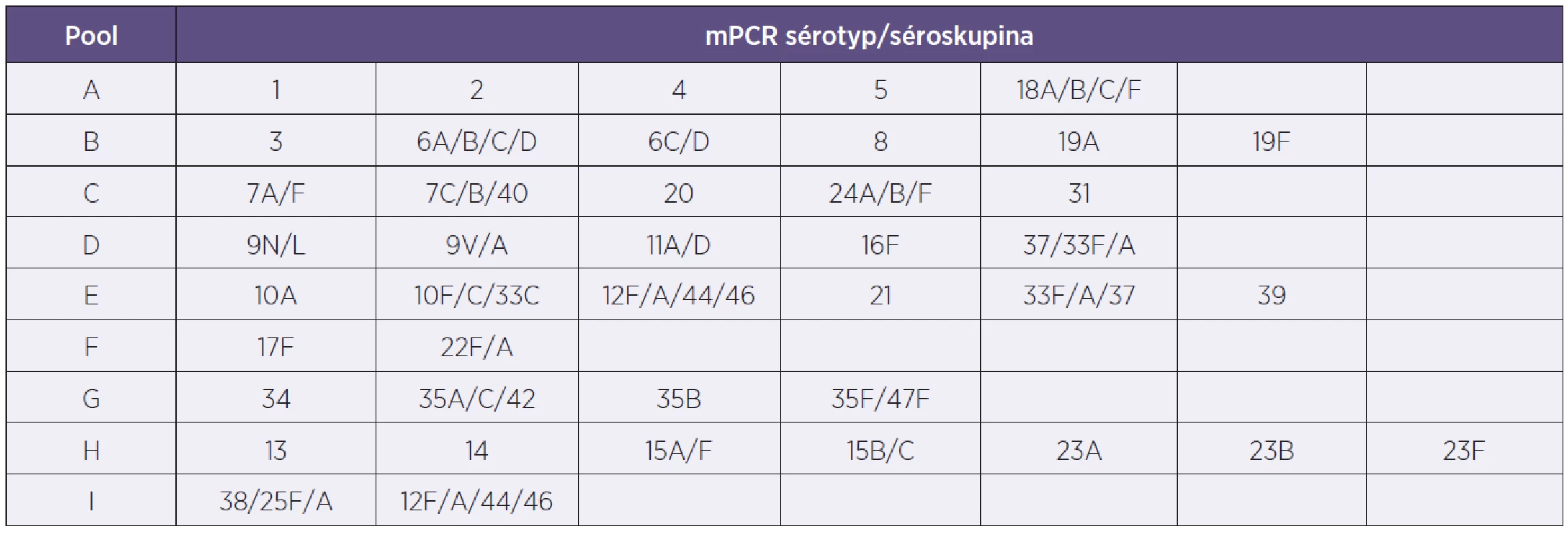
Provedení mPCR rekce typující S. pneumoniae
Izolace DNA z bakteriálních kmenů S. pneumoniae se provádí pomocí Amp QIAGEN mini kit podle manuálu [10].
Obecné složení multiplexPCR reakcí (specifické složení jednotlivých typů A–I se liší):
2,5 µl (1x) 10x reakčního pufru k iTaq DNA polymeráze
2 µl MgCl2
0,5 µl (0,2 mM) dNTP 10 mM
podle typu (10 µM) specifického primeru – forward
podle typu (10 µM) specifického primeru – reverse
0,4 µl iTaq DNA polymeráza
ad 25 µl PCR vody
K 2,5 µl izolované templátové DNA z vyšetřovaných vzorků se přidá po 22,5 µl master mixu do 0,2 ml PCR zkumavek.
Amplifikace DNA:
Cykly: 94 °C – 4 min
94 °C – 45 sec
54 °C – 45 sec
65 °C – 2 : 30 min
65 °C – 10 min
4 °C
Elektroforéza produktu:
Používá se 2% agaróza připravená v 1krát koncentrovaném TBE pufru a obarvení je provedeno ethidium bromidem. Elektroforéza probíhá 120 min při 80 V. Následná vizualizace pomocí UV (330nm).
Hodnocení:
Jedná se o metodu s kvalitativním vyhodnocováním, které se provádí na základě znalosti a porovnávání velikostí amplifikovaných produktů vzorků, pozitivní kontroly (referenční kmeny zpracované stejně jako vzorek) a negativní kontroly (voda) s 50bp DNA Ladderem a jednotlivými pozitivními kontrolami v porovnání s uváděnými výsledky CDC, Atlanta,USA [8].
Nově navržený algoritmus identifikace a typování kmenů S. pneumoniae v NRL/STR
- kultivace + optochinový test
- test rozpustnosti ve žluči
- Quellung reakce s poolovými antiséry A–I
- izolace DNA
- mPCR A – I + elektroforetické vyhodnocení
- případné dourčení Quellung reakcí s faktorovými antiséry
VÝSLEDKY A DISKUSE
Za použití výše popsaného nového algoritmu bylo testováno 210 kmenů S. pneumoniae všech dostupných sérotypů zaslaných do NRL/STR. Jednalo se o 66 sérotypů: 1, 3, 4, 5, 6A, 6B, 6C, 7A, 7B, 7C, 7F, 8, 9A, 9N, 9L, 9V, 10A, 10C, 10F, 11A, 11D, 12A, 12F, 13, 14, 15A, 15B, 15C, 15F, 16F, 17F, 18A, 18B, 18C, 18F, 19A, 19F, 20, 21, 22A, 22F, 23A, 23B, 23F, 24A, 24B, 24F, 25A, 25F, 31, 33A, 33C, 33F, 34, 35A, 35B, 35C, 35F, 37, 38, 39, 40, 42, 44, 46, 47F. Dále bylo testováno 8 izolátů příbuzných streptokoků S. pseudopneumoniae, S. sanguinis a S. oralis.
Novým výše popsaným mechanismem se podařilo správně identifikovat a typovat všechny kmeny S. pneumonie ve zkoumaném souboru (210 izolátů) při použití doposud známých primerů až po sérotyp (obr. 1–9: Elektroforetické hodnocení jednotlivých mPCR reakcí). Jediné dva sérotypy, na které jsou známé primery a nebyly otestovány, jsou sérotyp 2 a 6D, neboť NRL/STR nemá ve sbírce dostupné kmeny. Výsledky mPCR byly verifikovány Quellung reakcí. Kromě S. pneumoniae byly testovány i kmeny příbuzných streptokoků S. pseudopneumoniae (2 izoláty), S. sanguinis (4 izoláty) a S. oralis (2 izoláty), které naopak v mPCR metodě vykazovaly negativní výsledky (obr. 10), nebyl zde tedy problém s falešnou pozitivitou.
Obr. 1. mPCR pool A Dráha 1: 50bp DNA Ladder Dráha 2: <i>S. pneumoniae</i> sérotyp 1 (280bp) Dráha 3: <i>S. pneumoniae</i> sérotyp 5 (362bp) Dráha 4: <i>S. pneumoniae</i> sérotyp 4 (430bp) Dráha 5: <i>S. pneumoniae</i> sérotyp 18F (573bp) Dráha 6: <i>S. pneumoniae</i> sérotyp 18A (573bp) Dráha 7: <i>S. pneumoniae</i> sérotyp 18B (573bp) Dráha 8: <i>S. pneumoniae</i> sérotyp 18C (573bp) Dráha 9: negativní kontrola Dráha 2–8: pozitivní produkt cpsA (160bp)<br> Fig. 1. mPCR pool A Lane 1: 50bp DNA Ladder Lane 2: <i>S. pneumoniae</i> serotype 1 (280bp) Lane 3: <i>S. pneumoniae</i> serotype 5 (362bp) Lane 4: <i>S. pneumoniae</i> serotype 4 (430bp) Lane 5: <i>S. pneumoniae</i> serotype 18F (573bp) Lane 6: <i>S. pneumoniae</i> serotype 18A (573bp) Lane 7: <i>S. pneumoniae</i> serotype 18B (573bp) Lane 8: <i>S. pneumoniae</i> serotype 18C (573bp) Lane 9: negative control Lanes 2–8: positive product cpsA (160bp) 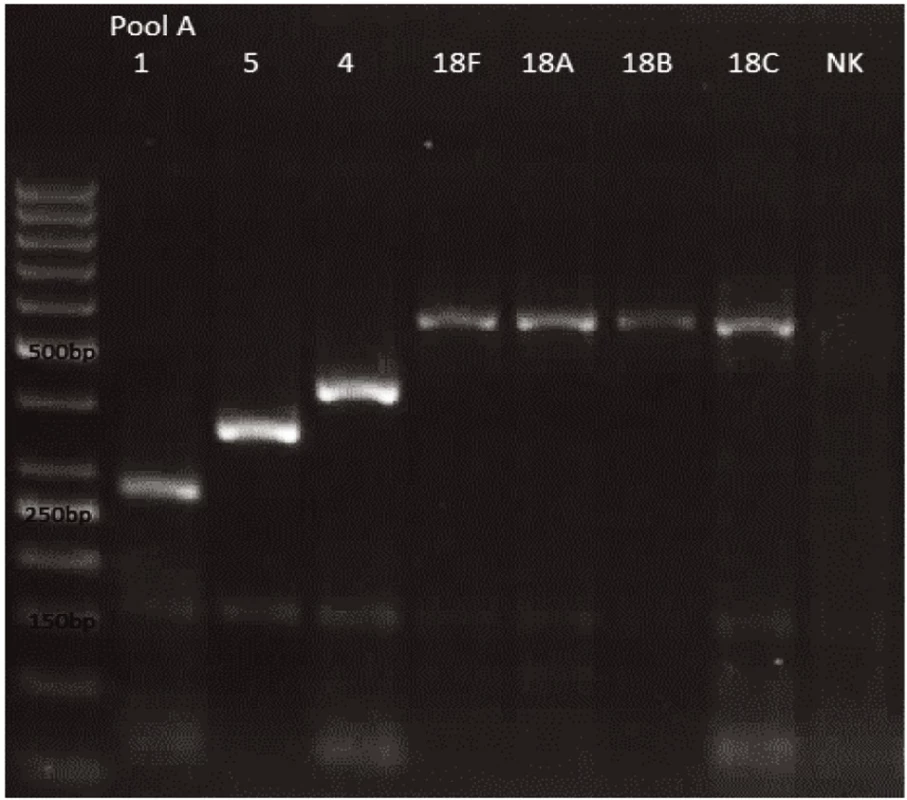
Obr. 2. mPCR pool B Dráha 1: 50bp DNA Ladder Dráha 2: <i>S. pneumoniae</i> sérotyp 8 (201bp) Dráha 3: <i>S. pneumoniae</i> sérotyp 6A (250bp) Dráha 4: <i>S. pneumoniae</i> sérotyp 6B (250bp) Dráha 5: <i>S. pneumoniae</i> sérotyp 19F (304bp) Dráha 6: <i>S. pneumoniae</i> sérotyp 3 (371bp) Dráha 7: <i>S. pneumoniae</i> sérotyp 19A (566bp) Dráha 8: <i>S. pneumoniae</i> sérotyp 6C (250bp, 727bp) Dráha 9: negativní kontrola Dráha 2–8: pozitivní produkt cpsA (160bp)<br><br> Fig. 2. mPCR pool B Lane 1: 50bp DNA Ladder Lane 2: <i>S. pneumoniae</i> serotype 8 (201bp) Lane 3: <i>S. pneumoniae</i> serotype 6A (250bp) Lane 4: <i>S. pneumoniae</i> serotype 6B (250bp) Lane 5: <i>S. pneumoniae</i> serotype 19F (304bp) Lane 6: <i>S. pneumoniae</i> serotype 3 (371bp) Lane 7: <i>S. pneumoniae</i>serotype 19A (566bp) Lane 8: <i>S. pneumoniae</i> serotype 6C (250bp, 727bp) Lane 9: negative control Lanes 2–8: positive product cpsA (160bp) 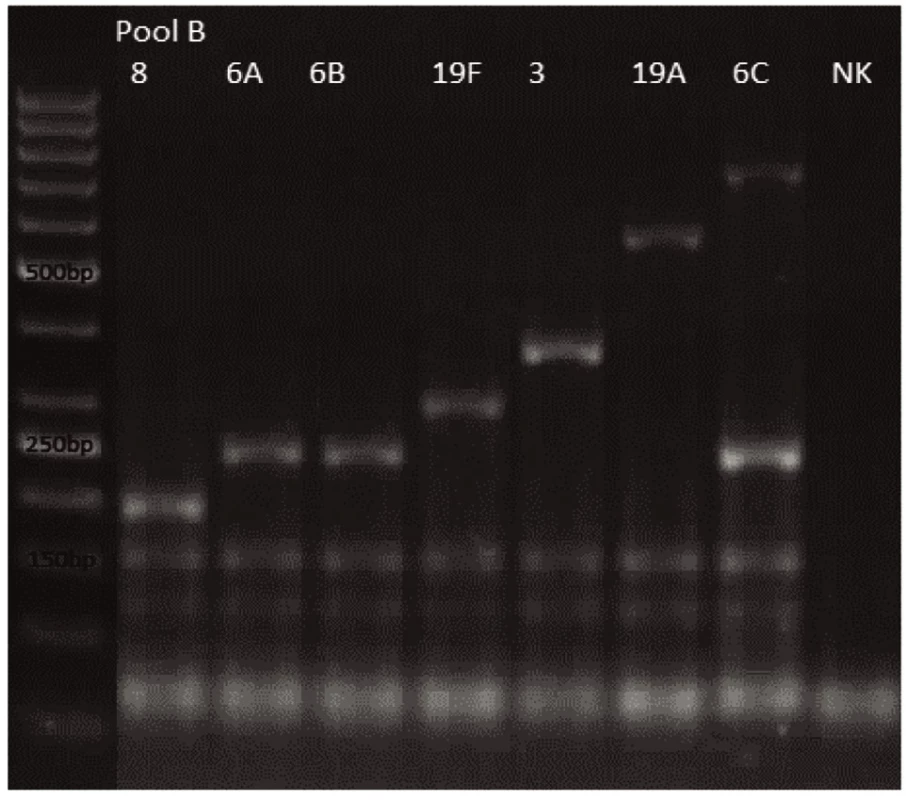
Obr. 3. mPCR pool C Dráha 1: 50bp DNA Ladder Dráha 2: <i>S. pneumoniae</i> sérotyp 24A (99bp) Dráha 3: <i>S. pneumoniae</i> sérotyp 24B (99bp) Dráha 4: <i>S. pneumoniae</i> sérotyp 24F (99bp) Dráha 5: <i>S. pneumoniae</i> sérotyp 7C (260bp) Dráha 6: <i>S. pneumoniae</i> sérotyp 7B (260bp) Dráha 7: <i>S. pneumoniae</i>sérotyp 40 (260bp) Dráha 8: <i>S. pneumoniae</i> sérotyp 20 (514bp) Dráha 9: <i>S. pneumoniae</i> sérotyp 7A (599bp) Dráha 10: <i>S. pneumoniae</i> sérotyp 7F (599bp) Dráha 11: <i>S. pneumoniae</i> sérotyp 31 (701bp) Dráha 12: negativní kontrola Dráha 2–11: pozitivní produkt cpsA (160bp)<br> Fig. 3. mPCR pool C Lane 1: 50bp DNA Ladder Lane 2: <i>S. pneumoniae</i> serotype 24A (99bp) Lane 3: <i>S. pneumoniae</i> serotype 24B (99bp) Lane 4: S<i>S. pneumoniae</i> serotype 24F (99bp) Lane 5: <i>S. pneumoniae</i> serotype 7C (260bp) Lane 6: <i>S. pneumoniae</i> serotype 7B (260bp) Lane 7: <i>S. pneumoniae</i> serotype 40 (260bp) Lane 8: <i>S. pneumoniae</i> serotype 20 (514bp) Lane 9: <i>S. pneumoniae</i> serotype 7A (599bp) Lane 10: <i>S. pneumoniae</i> serotype 7F (599bp) Lane 11: <i>S. pneumoniae</i> serotype 31 (701bp) Lane 12: negative control Lanes 2–11: positive product cpsA (160bp) 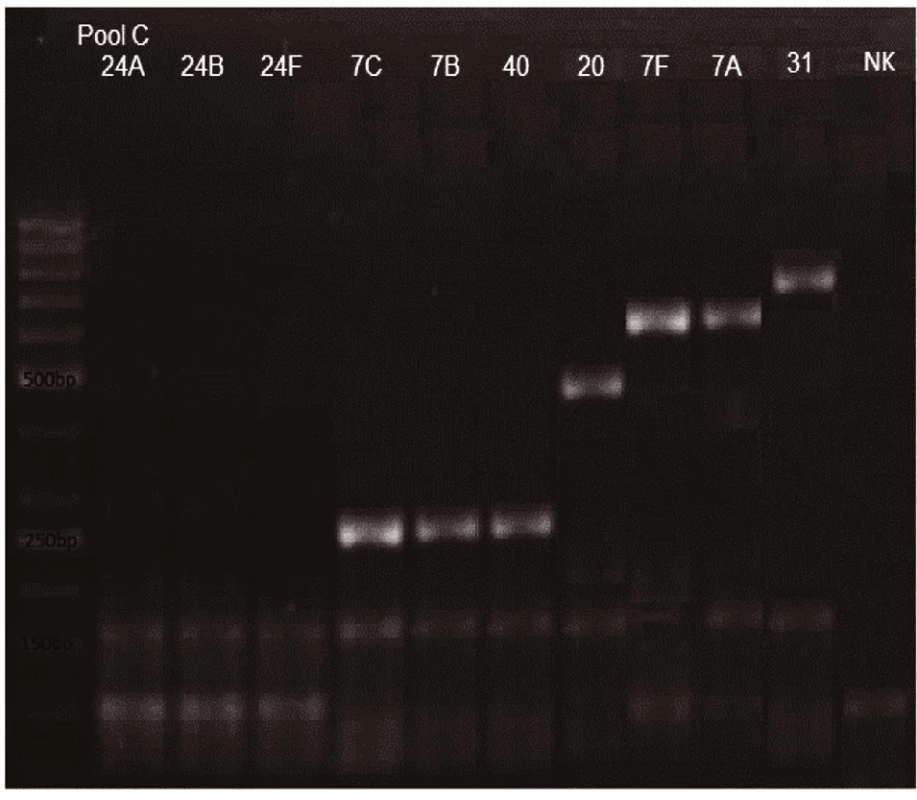
Obr. 4. mPCR pool D Dráha 1: 50bp DNA Ladder Dráha 2: <i>S. pneumoniae</i> sérotyp 37 (338bp) Dráha 3: <i>S. pneumoniae</i> sérotyp 11A (463bp) Dráha 4: <i>S. pneumoniae</i> sérotyp 11D (463bp) Dráha 5: <i>S. pneumoniae</i> sérotyp 9N (516bp) Dráha 6: <i>S. pneumoniae</i> sérotyp 9L (516bp) Dráha 7: <i>S. pneumoniae</i> sérotyp 16F (717bp) Dráha 8: <i>S. pneumoniae</i> sérotyp 9V (816bp) Dráha 9: <i>S. pneumoniae</i> sérotyp 9A (816bp) Dráha 10: negativní kontrola Dráha 2–9: pozitivní produkt cpsA (160bp)<br> Fig. 4. mPCR pool D Lane 1: 50bp DNA Ladder Lane 2: <i>S. pneumoniae</i> serotype 37 (338bp) Lane 3: <i>S. pneumoniae</i> serotype 11A (463bp) Lane 4: <i>S. pneumoniae</i> serotype 11D (463bp) Lane 5: <i>S. pneumoniae</i> serotype 9N (516bp) Lane 6: <i>S. pneumoniae</i> serotype 9L (516bp) Lane 7: <i>S. pneumoniae</i> serotype 16F (717bp) Lane 8: <i>S. pneumoniae</i> serotype 9V (816bp) Lane 9: <i>S. pneumoniae</i> serotype 9A (816bp) Lane 10: negative control Lanes 2–9: positive product cpsA (160bp) 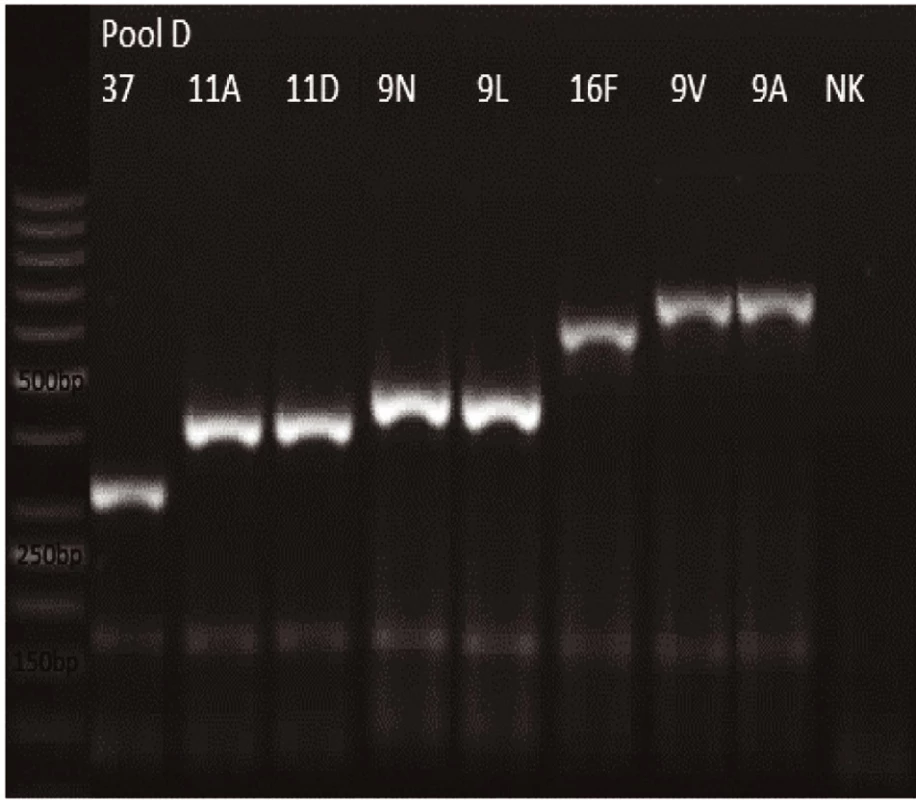
Obr. 5. mPCR pool E Dráha 1: 50bp DNA Ladder Dráha 2: <i>S. pneumoniae</i> sérotyp 39 (99bp) Dráha 3: <i>S. pneumoniae</i> sérotyp 21 (192bp) Dráha 4: <i>S. pneumoniae</i> sérotyp 10F (248bp) Dráha 5: <i>S. pneumoniae</i> sérotyp 10C (248bp) Dráha 6: <i>S. pneumoniae</i> sérotyp 33C (248bp) Dráha 7: <i>S. pneumoniae</i> sérotyp 33F (338bp) Dráha 8: <i>S. pneumoniae</i>sérotyp 33A (338bp) Dráha 9: <i>S. pneumoniae</i> sérotyp 12F (376bp) Dráha 10: <i>S. pneumoniae</i> sérotyp 12A (376bp) Dráha 11: <i>S. pneumoniae</i> sérotyp 10A (628bp) Dráha 12: negativní kontrola Dráha 2–11: pozitivní produkt cpsA (160bp)<br> Fig. 5. mPCR pool E Lane 1: 50bp DNA Ladder Lane 2: <i>S. pneumoniae</i> serotype 39 (99bp) Lane 3: <i>S. pneumoniae</i> serotype 21 (192bp) Lane 4: <i>S. pneumoniae</i> serotype 10F (248bp) Lane 5: <i>S. pneumoniae</i> serotype 10C (248bp) Lane 6: <i>S. pneumoniae</i> serotype 33C (248bp) Lane 7: <i>S. pneumoniae</i> serotype 33F (338bp) Lane 8: <i>S. pneumoniae</i> serotype 33A (338bp) Lane 9: <i>S. pneumoniae</i> serotype 12F (376bp) Lane 10: <i>S. pneumoniae</i> serotype 12A (376bp) Lane 11: <i>S. pneumoniae</i> serotype 10A (628bp) Lane 12: negative control Lanes 2–11: positive product cpsA (160bp) 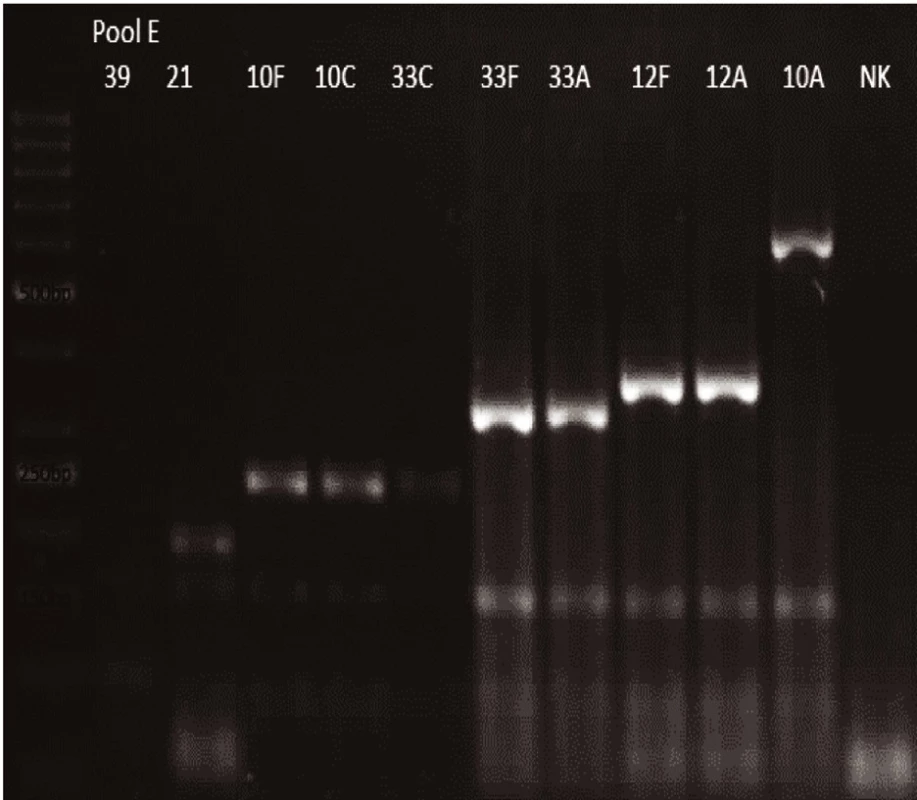
Obr. 6. mPCR pool F Dráha 1: 50bp DNA Ladder Dráha 2: <i>S. pneumoniae</i> sérotyp 22F (643bp) Dráha 3: <i>S. pneumoniae</i> sérotyp 22A (643bp) Dráha 4: <i>S. pneumoniae</i> sérotyp 17F (693bp) Dráha 5: negativní kontrola Dráha 2–4: pozitivní produkt cpsA (160bp)<br> Fig. 6. mPCR pool F LLane 1: 50bp DNA Ladder Lane 2: <i>S. pneumoniae</i> serotype 22F (643bp) Lane 3: <i>S. pneumoniae</i> serotype 22A (643bp) Lane 4: <i>S. pneumoniae</i> serotype 17F (693bp) Lane 5: negative control Lanes 2–4: positive product cpsA (160bp) 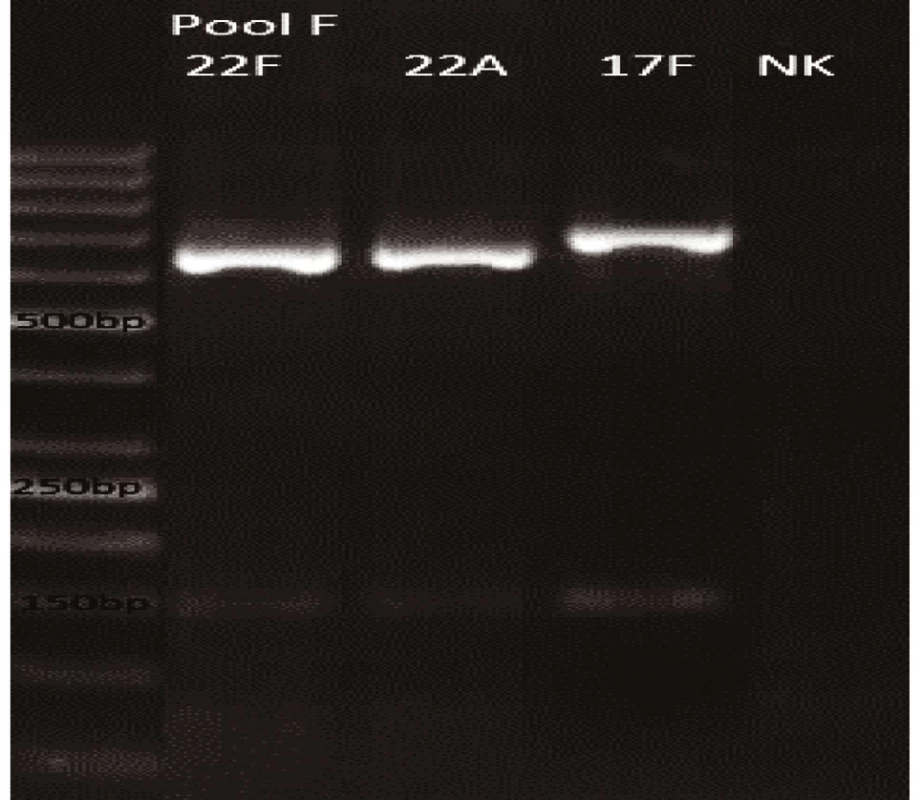
Obr. 7. mPCR pool G Dráha 1: 50bp DNA Ladder Dráha 2: <i>S. pneumoniae</i> sérotyp 35A (280bp) Dráha 3: <i>S. pneumoniae</i> sérotyp 35C (280bp) Dráha 4: <i>S. pneumoniae</i> sérotyp 42 (280bp) Dráha 5: <i>S. pneumoniae</i> sérotyp 34 (408bp) Dráha 6: <i>S. pneumoniae</i> sérotyp 35F (517bp) Dráha 7: <i>S. pneumoniae</i> sérotyp 47F (517bp) Dráha 8: <i>S. pneumoniae</i> sérotyp 35B (677bp) Dráha 9: negativní kontrola Dráha 2–8: pozitivní produkt cpsA (160bp)<br> Fig. 7. mPCR pool G Lane 1: 50bp DNA Ladder Lane 2: <i>S. pneumoniae</i> serotype 35A (280bp) Lane 3: <i>S. pneumoniae</i> serotype 35C (280bp) Lane 4: <i>S. pneumoniae</i> serotype 42 (280bp) Lane 5: <i>S. pneumoniae</i> serotype 34 (408bp) Lane 6: <i>S. pneumoniae</i> serotype 35F (517bp) Lane 7: <i>S. pneumoniae</i> serotype 47F (517bp) Lane 8: <i>S. pneumoniae</i> serotype 35B (677bp) Lane 9: negative control Lanes 2–8: positive product cpsA (160bp) 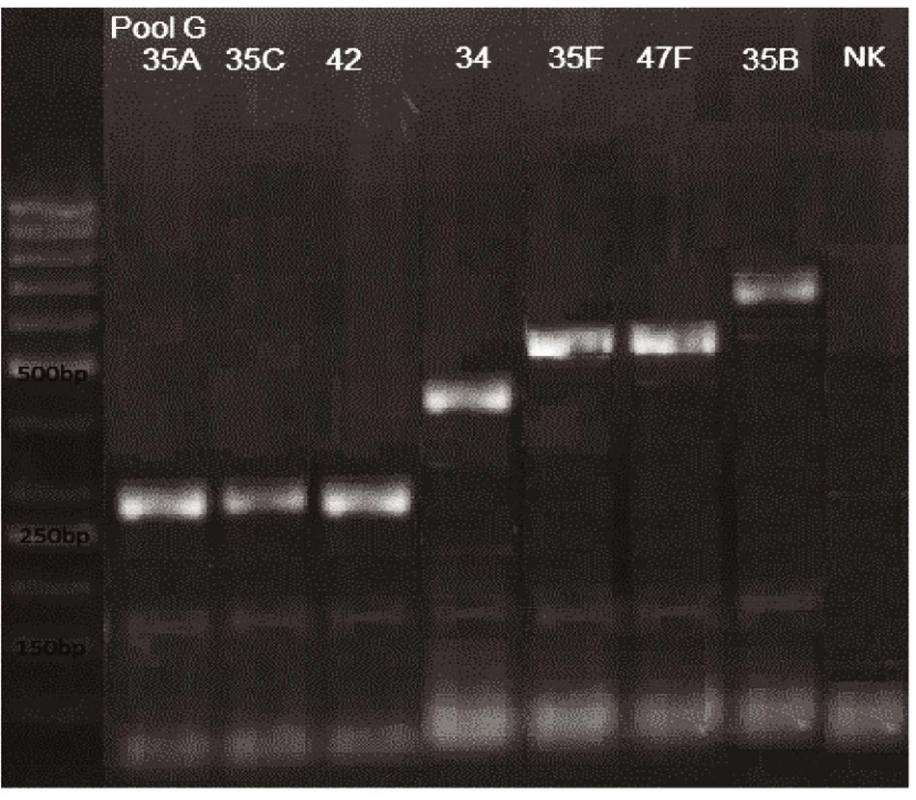
Obr. 8. mPCR pool H Dráha 1: 50bp DNA Ladder Dráha 2: <i>S. pneumoniae</i> sérotyp 14 (189bp) Dráha 3: S<i>S. pneumoniae</i> sérotyp 23B (199bp) Dráha 4: <i>S. pneumoniae</i> sérotyp 23F (384bp) Dráha 5: <i>S. pneumoniae</i> sérotyp 15A (434bp) Dráha 6: <i>S. pneumoniae</i> sérotyp 15F (434bp) Dráha 7: <i>S. pneumoniae</i> sérotyp 15B (496bp) Dráha 8: <i>S. pneumoniae</i> sérotyp 15C (496bp) Dráha 9: <i>S. pneumoniae</i> sérotyp 13 (655bp) Dráha 10: S. pneumoniae sérotyp 23A (722bp) Dráha 11: negativní kontrola Dráha 2–10: pozitivní produkt cpsA (160bp)<br> Fig. 8. mPCR pool H Lane 1: 50bp DNA Ladder Lane 2: <i>S. pneumoniae</i> serotype 14 (189bp) Lane 3: <i>S. pneumoniae</i> serotype 23B (199bp) Lane 4: <i>S. pneumoniae</i> serotype 23F (384bp) Lane 5: <i>S. pneumoniae</i> serotype 15A (434bp) Lane 6: <i>S. pneumoniae</i> serotype 15F (434bp) Lane 7: <i>S. pneumoniae</i> serotype 15B (496bp) Lane 8: <i>S. pneumoniae</i> serotype 15C (496bp) Lane 9: <i>S. pneumoniae</i> serotype 13 (655bp) Lane 10: <i>S. pneumoniae</i> serotype 23A (722bp) Lane 11: negative control Lanes 2–10: positive product cpsA (160bp) 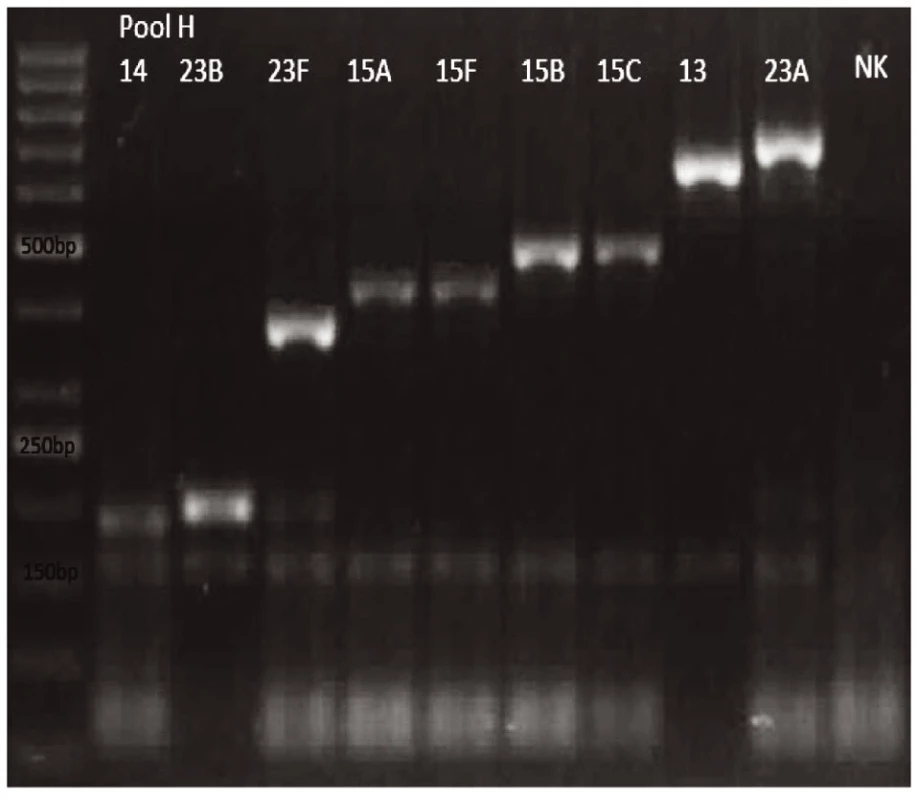
Obr. 9. mPCR pool I Dráha 1: 50bp DNA Ladder Dráha 2: <i>S. pneumoniae</i> sérotyp 44 (376bp) Dráha 3: <i>S. pneumoniae</i> sérotyp 46 (376bp) Dráha 4: <i>S. pneumoniae</i> sérotyp 38 (574bp) Dráha 5: <i>S. pneumoniae</i> sérotyp 25F (574bp) Dráha 6: <i>S. pneumoniae</i> sérotyp 25A (574bp) Dráha 7: negativní kontrola Dráha 2–6: pozitivní produkt cpsA (160bp)<br> Fig. 9. mPCR pool I Lane 1: 50bp DNA Ladder Lane 2: <i>S. pneumoniae</i> serotype 44 (376bp) Lane 3: <i>S. pneumoniae</i> serotype 46 (376bp) Lane 4: <i>S. pneumoniae</i> serotype 38 (574bp) Lane 5: <i>S. pneumoniae</i> serotype 25F (574bp) Lane 6: <i>S. pneumoniae</i> serotype 25A (574bp) Lane 7: negative control Lanes 2–6: positive product cpsA (160bp) 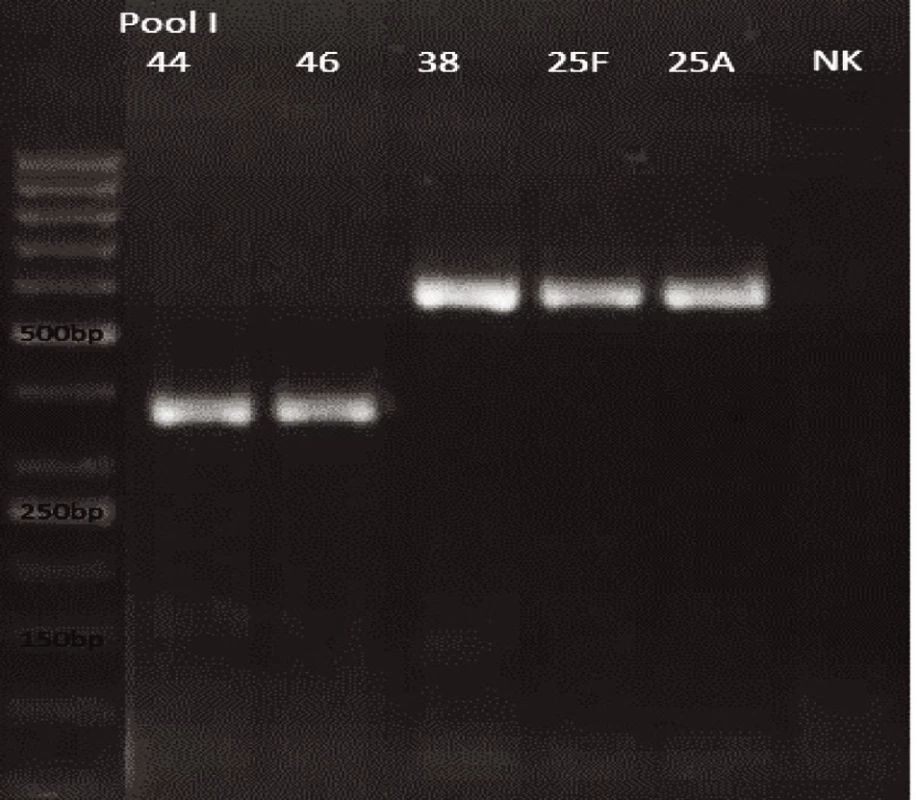
Obr. 10. Příbuzné streptokoky Dráha 1: 50bp DNA Ladder Dráha 2: <i>S. pseudopneumoniae</i> Dráha 3: S. sanguinis</i> Dráha 4: S. oralis</i> Dráha 5: negativní kontrola<br> Fig. 10. Related streptococci Lane 1: 50bp DNA Ladder Lane 2: <i>S. pseudopneumoniae</i> Lane 3: <i>S. sanguinis</i> Lane 4: <i>S. oralis</i> Lane 5: negative control 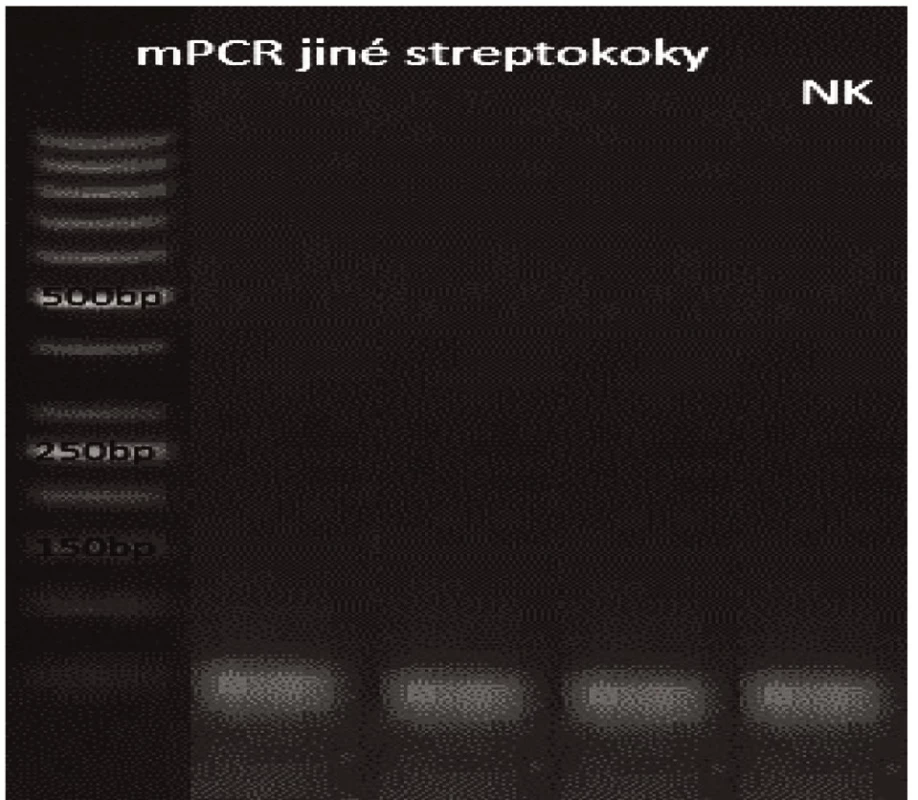
Pro PCR i Quellung metodu byly vypočteny hodnotící parametry podle následujících vzorců: senzitivita = a/(a + c), specificita = d/(b + d), pozitivní předpovědní hodnota = a/(a + b), negativní předpovědní hodnota = d/(c + d). Ve zkoumaném souboru 218 izolátů byly zjištěny následující parametry.
Pro multiplex PCR:
- a) správná pozitivita 210 vzorků
- b) falešná pozitivita 0 vzorků
- c) falešná negativita 0 vzorků
- d) správná negativita 8 vzorků
senzitivita = 1,000
specificita = 1,000
pozitivní předpovědní hodnota = 1,000
negativní předpovědní hodnota = 1,000
Pro Quellung reakci:
- a) správná pozitivita 209 vzorků
- b) falešná pozitivita 0 vzorků
- c) falešná negativita 1 vzorek
- d) správná negativita 8 vzorků
senzitivita = 0,995
specificita = 1,000
pozitivní předpovědní hodnota = 1,000
negativní předpovědní hodnota = 0,888
Doposud se při využívání sérologických typizačních metod uvádělo, že většina (98 %) kmenů S. pneumoniae je typovatelných a malé procento (2 %) kmenů je netypovatelných (NT), tzv. bezpouzderné varianty. Při testování popsaného souboru byl nalezen jeden izolát S. pneumoniae z hemokultury, jenž byl pomocí sérologické Quellung metody netypovatelný, ale pomocí PCR metody typovatelný. Výsledek PCR reakce byl pozitivní při použití primeru jak pro gen cpsA identifikující S. pneumoniae, tak pro gen identifikující séroskupiny 33F/33A/37. V tomto případě nebylo možné přesnější určení faktorovými séry, jelikož se jedná opět o sérologickou Quellung metodu. Mohlo se tedy jednat o příklad kmene, který disponuje genem pro kapsulární antigen, ovšem má problém s expresí antigenu anebo jeho strukturou. Díky tomu není možnost využít sérologických metod založených na principu reakce antigenu s protilátkou. Molekulární metody založené na detekci genu je ovšem pro typizaci neopouzdřených kmenů možné použít. Lze tedy očekávat snížení počtu doposud netypovatelných kmenů S. pneumoniae při používání molekulárních metod, jako je PCR.
A s tím nepřímo souvisí také identifikace nových sérotypů S. pneumoniae těmito novými molekulárními metodikami, např. sérotyp 6D, který není identifikovatelný klasickou sérologickou metodou [11, 12].
Nevýhodou PCR metody je, že v současné době nejsou známé primery pro typizaci všech popsaných sérotypů S. pneumoniae. Dochází však v tomto směru k vývoji a aktualizaci seznamu popsaných primerů.
ZÁVĚR
Zavedení multiplex PCR reakce do systému identifikace a především typizace S. pneumoniae se ukázalo jako velice přínosné. Doposud jedinou používanou metodou pro typizaci byla jen sérologická Quellung reakce. Je to sice zlatý standard, ale jedná se o metodu velice pracovně, časově a finančně nákladnou. Metoda mPCR umožňuje typování všech vakcinačních a i většiny nevakcinačních sérotypů S. pneumoniae. Jedná se o novou a moderní metodu s mnoha výhodami. Její velkou předností je časová nenáročnost a menší finanční nákladnost, především díky obrovské redukci potřeby antisér. V daném souboru izolátů předvedla nová mPCR 100% senzitivitu i specificitu.
V NRL/STR se výborně osvědčil modifikovaný algoritmus typování, kdy se po provedení Quellung reakce s poolovými antiséry A–I vybere pouze příslušná mPCR A–I reakce. Výsledný sérotyp se odečte buď přímo, nebo pokud mPCR reakce určí séroskupinu, dourčí se sérotyp Quellung reakcí s faktorovými antiséry.
Kromě S. pneumoniae byly testovány i kmeny příbuzných streptokoků S. pseudopneumoniae, S. sanguinis a S. oralis, které naopak v mPCR metodě vykazovaly správně negativní výsledky a nebyl zjištěn problém s falešnou pozitivitou.
Autoři děkují všem kolegům z laboratoří v ČR, kteří posílají kmeny do NRL pro streptokokové nákazy.
Do redakce došlo dne 2. 4. 2013.
Adresa pro korespondenci:
Mgr. Zuzana Vacková
SZÚ Praha
Šrobárova 48
100 42 Praha 10
e-mail: zuzana.vackova@szu.cz
Zdroje
1. Motlová, J., Beneš, Č., Kozáková, J., Křížová, P. Invazivní pneumokoková onemocnění v České republice v roce 2011. Zprávy CEM, 2012, 21, p. 51–58.
2. Bratcher, P. E., Park, I. H., Hollingshead, S. K. & Nahm, M. H. Production of a unique pneumococcal capsule serotype belonging to serogroup 6. Microbiology, 2009, 155, p. 576–583.
3. Zemlickova, H., Jakubu, V., Urbaskova, P., Motlova, J., Musilek, M., Adamkova, V. Serotype-specific invasive disease potential of Streptococcus pneumoniae in Czech children. J. Med. Microbiol., 2010, 59, p. 1079–1083.
4. Motlova, J., Benes, C., Kriz, P. Incidence of invasive pneumococcal disease in the Czech Republic and serotype coverage by vaccines, 1997–2006. Epidemiol. Infect., 2009, 137, p. 562–569.
5. Prymula, R., Motlova, J., Kriz, P. Comparison of Streptococcus pneumoniae serotypes causing acute otitis media & invasive disease in young children in the Czech Republic. Indian. J. Med. Res., 2004, 119, p. 168–170.
6. Merrill, C. W, Gwaltney, J. M. Jr., Hendley, J. W., Sande, M. A. Rapid identification of pneumococci. Gram stain vs. the quellung reaction. N. Engl. J. Med., 1973, 288, p. 510–512.
Dostupné na www:
http://www.ssi.dk/English/SSI%20Diagnostica/Products%20from%20SSI%20Diagnostica/Antisera_antibodies/Pneumococcus%20antisera/Neufeld.aspx.
7. Siira, L., Kaijalainen, T., Lambertsen, L., Nahm, M. H., Toropainen, M., Virolainen, A. From Quellung to Multiplex PCR, and back when needed, in pneumococcal serotyping. J. Clin. Microbiol., 2012, 50, p. 2727–2431.
8. The Centers for Disease Control and Prevention Specifické primery dle CDC, Atlanta, USA. Dostupné na www: http://www.cdc.gov/ncidod/biotech/strep/pcr.htm.
9. Manuál QIAamp DNA Mini Kit. Dostupné na www:
http://www.qiagen.com/Products/Catalog/Sample-Technologies/DNA-Sample-Technologies/Genomic-DNA/QIAamp-DNA-Mini-Kit#technicalspecification.
10. Bratcher, P. E., Kim, K. H., Kang, J. H., Hong, J. Y., Nahm, M. H. Identification of natural pneumococcal isolates expressing serotype 6D by genetic, biochemical and serological characterization. Microbiology, 2010, 156, p. 555–560.
11. Oftadeh, S., Satzke, C., Gilbert, G. L. Identification of newly described Streptococcus pneumoniae serotype 6D by use of the Quellung reaction and PCR. J. Clin. Microbiol., 2010, 48, p. 3378–3379.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2013 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Časopis Epidemiologie, mikrobiologie, imunologie získal impakt faktor
- Antibiotická rezistence u netyfových sérovarů Salmonella spp. v České republice
- Nová metoda a schéma typizace Streptococcus pneumoniae
- Epidemické případy salmonelóz v České republice v roce 2012
- Intravenózní a subkutánní imunoglobulinová terapie
- Prevalenční odhad problémových uživatelů drog v ČR v letech 2006 a 2007 metodou zpětného záchytu
- 50 rokov Ústavu epidemiológie Lekárskej fakulty UK v Bratislave
- Buc, M.: Základná a klinická imunológia
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Intravenózní a subkutánní imunoglobulinová terapie
- Antibiotická rezistence u netyfových sérovarů Salmonella spp. v České republice
- Nová metoda a schéma typizace Streptococcus pneumoniae
- Časopis Epidemiologie, mikrobiologie, imunologie získal impakt faktor
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



