-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Přínos avidity IgG protilátek u příušnic ve vysoce proočkované populaci v kontextu s ostatními sérologickými metodami laboratorní diagnostiky příušnic a současnou epidemiologickou situací
The benefit from mumps virus IgG antibody avidity testing in the population with high vaccine coverage in the context of other serological methods for laboratory diagnosis of mumps and the current epidemiological
Aim:
Regular vaccination against mumps resulted in a significant reduction in epidemic mumps in the Czech Republic. However, mumps cases have recently shown an upward trend, even in the vaccinated population where a considerable proportion of cases have occurred. The aim of this study was to find out, by mumps virus IgG antibody avidity testing, whether the high incidence of mumps in the vaccinated population is a result of primary or secondary vaccine failure and whether the vaccinated differ from the naturally immunised in anamnestic antibody avidity. Given the problematic laboratory diagnosis of mumps in the population with high vaccination coverage, the informative value of the detected IgM, IgA, and IgG antibodies was also considered as well as the potential of antibody avidity testing for improving laboratory diagnosis from a single sample of blood, the most commonly analysed clinical material, in patients with suspected mumps.Material and methods:
Sixty-four patients laboratory confirmed with mumps, whose vaccination status was known, were included in the study (groups 1 and 2). Other study groups were 30 healthy naturally immunised subjects (group 3) and 22 vaccinated children 2–4-years of age with no etiological link to the mumps virus (group 4). The avidity index (AI) was determined using the Siemens Enzygnost Anti-Mumps/IgG kit and 6M urea, able to induce the dissociation of antigen-antibody bonds proportionally to the antibody avidity. IgM, IgG, and IgA antibodies were tested using the Siemens Enzygnost Anti-Mumps/IgM and /IgG, and Mast Diagnostica Mastazyme Mumps IgA kits. The EPIDAT system served as the data source.Results:
The results showed that the mumps virus induces antibodies with a low AI after both vaccination, even recent, and natural immunisation. Antibodies with a high AI were only detected in convalescent sera of the vaccinated patients or in re-infected, naturally immunised persons, as a result of recent contact with the mumps virus. The comparison of the results of acute sera testing revealed that in the vaccinated patients, 56% of cases were laboratory confirmed based on IgA positivity, i.e. 20% more cases in comparison with routine detection of IgM antibodies, while of unvaccinated cases, 87% were IgA positive and 74% IgM positive.Conclusion:
The results of mumps virus IgG antibody avidity testing suggest that the high proportion of cases in the vaccinated patients result from secondary vaccine failure, also known as waning immunity. Diagnostic benefit from antibody avidity testing has been observed in convalescent sera and/or acute sera from both vaccinated and naturally immunised patients collected from day 6 after the onset of the disease when significant increase in AI occurs.
The comparison of the serological methods for the detection of IgM, IgG, and IgA antibodies in acute sera revealed that the highest percentage of mumps infection was detected by IgA antibody testing. The addition of this serological method to mumps laboratory diagnosis made the latter considerably more effective, particularly in the vaccinated patients.Keywords:
mumps virus – IgG antibody avidity – primary and secondary vaccine failure – serological diagnosis
Autori: R. Limberková 1
; D. Smíšková 2; M. Havlíčková 1; K. Herrmannová 2; P. Lexová 1; V. Marešová 2
Pôsobisko autorov: Státní zdravotní ústav, Centrum epidemiologie a mikrobiologie, Praha 1; Klinika infekčních, parazitárních a tropických nemocí, Nemocnice Na Bulovce, Praha 2
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 65, 2016, č. 1, s. 39-44
Kategória: Původní práce
Súhrn
Cíl práce:
Zahájením pravidelného očkování se výskyt epidemické parotitidy v ČR významně snížil. V posledních letech je však pozorován zvýšený počet onemocnění, a to i v očkované populaci, která tvoří převážnou část nemocných. Cílem této studie bylo zjistit, zda vysoká nemocnost vakcinovaných je důsledkem primárního nebo sekundárního selhání vakcinace pomocí testování avidity IgG protilátek a zda je rozdíl v aviditě anamnestických protilátek mezi vakcinovanými a přirozeně promořenými. S ohledem na problematickou laboratorní diagnostiku příušnic ve vysoce proočkované populaci byla posuzována i výpovědní hodnota stanovení IgM, IgA a IgG protilátek a možnost využití avidity pro zkvalitnění laboratorního průkazu z jednoho vzorku krve jako nejčastěji vyšetřovaného klinického materiálu při podezření na onemocnění příušnicemi.Materiál a metody:
Do studie byl zahrnut soubor 64 pacientů s laboratorně potvrzeným onemocněním příušnicemi a známým vakcinačním stavem (soubor 1 a 2). Současně byl vyšetřen soubor 30 zdravých přirozeně promořených osob (soubor 3) a soubor 22 vakcinovaných 2–4letých dětí bez etiologické souvislosti s virem příušnic (soubor 4). Pro stanovení indexu avidity (IA) byla využita souprava Enzygnost Anti-Mumps/IgG, Siemens a 6M urea, která má schopnost vyvolat disociaci vazby antigen-protilátka, úměrnou aviditě protilátek. Protilátky IgM, IgG a IgA byly testovány soupravami Enzygnost Anti-Mumps/IgM a /IgG, Siemens a Mastazyme Mumps IgA, Mast Diagnostica. Jako zdroj epidemiologických údajů byl využit systém EPIDAT.Výsledky:
Výsledky vyšetření studovaného souboru ukázaly, že virus příušnic indukuje protilátky s nízkým IA jak po vakcinaci, a to i nedávné, tak i po přirozené infekci. Vysokoavidní protilátky byly detekovány pouze v rekonvalescentních sérech vakcinovaných osob nebo u reinfekcí osob přirozeně promořených, a to v souvislosti s recentním stykem s virem příušnic. Porovnáním výsledků vyšetření akutních sér bylo zjištěno, že u vakcinovaných bylo na základě IgA pozitivity laboratorně potvrzeno 56 % případů, což je o 20 % více než při rutinně prováděném vyšetření pomocí IgM protilátek, u nevakcinovaných bylo 87 % IgA a 74 % IgM pozitivních případů.Závěr:
Výsledky avidity IgG protilátek svědčí pro to, že vysoká nemocnost vakcinovaných je důsledkem sekundárního selhání vakcinace označovaného též jako vyvanutí imunity. Diagnostické využití avidity je přínosné při vyšetření rekonvalescentních sér a/nebo akutních sér s odběrem od 6. dne po začátku onemocnění, a to u vakcinovaných či přirozeně promořených osob, kdy dochází k signifikantnímu nárůstu IA.
Srovnáním sérologických metod na stanovení IgM, IgG a IgA protilátek v akutním séru bylo zjištěno, že nejvyšší průkaznosti infekce virem příušnic bylo dosaženo na základě pozitivity IgA protilátek. Zařazení této sérologické metody výrazně zefektivnilo laboratorní diagnostiku příušnic, a to zejména u vakcinovaných osob.Klíčová slova:
virus parotitidy – avidita IgG protilátek – primární a sekundární selhání vakcinace – sérologická diagnostikaÚVOD
Příušnice jsou akutní virové onemocnění charakterizované horečkou a bolestivým zduřením jedné nebo více slinných žláz, obyčejně příušních, někdy také podčelistních nebo podjazykových. Přestože v dětství příušnice probíhají pod obrazem mírného onemocnění a téměř 30–40 % případů je asymptomatických, mohou být komplikovány orchitidou, meningitidou nebo pankreatitidou. Mezi méně časté komplikace patří encefalitida, dočasné nebo trvalé postižení sluchu, myokarditida nebo artritida, vzácně pak mastitida, nefritida, případně thyreoiditida.
Po zavedení celoplošného očkování v roce 1987 incidence příušnic významně poklesla, přesto epidemiologické údaje posledních let svědčí o návratu pravidelných 5–6letých intervalů zvýšeného výskytu onemocnění s lokálními epidemiemi. Zatím poslední epidemická vlna se objevila v roce 2012 a onemocnělo při ní 3902 převážně vakcinovaných osob.
Zda je vysoká nemocnost vakcinovaných důsledkem primárního nebo sekundárního selhání vakcinace je možné prokázat pomocí avidity IgG protilátek. Avidita vyjadřuje sílu vazby mezi polyvalentním antigenem a polyvalentní protilátkou, přičemž obecně platí, že čím je protilátka starší, tím je síla vazby antigen a protilátka silnější a avidita vyšší. Pro primární selhání vakcinace a primoinfekci je charakteristický nález nízkoavidních IgG protilátek (NIA), u sekundárního selhání vakcinace nebo reinfekce nacházíme protilátky s vysokým IA (VIA).
Laboratorní průkaz příušnic z jednoho, nejčastěji akutního, vzorku séra je ve vysoce proočkované populaci velmi obtížný [2, 8, 17]. Pozitivita IgM protilátek se v akutních sérech vakcinovaných často neobjeví, a proto byla diagnostika příušnic rozšířena ještě o IgA protilátky. Ačkoli bylo s použitím této metody zaznamenáno zvýšení průkaznosti infekce, zůstává při vyšetření akutního vzorku séra poměrně vysoké procento nakažených, u kterých nelze probíhající onemocnění sérologicky potvrdit. Naším záměrem proto bylo ověřit i možný diagnostický přínos avidity IgG protilátek.
MATERIÁL A METODY
Sběr klinických vzorků probíhal na Klinice infekčních, parazitárních a tropických nemocí Nemocnice Na Bulovce v Praze a zahrnoval období od ledna 2013 do konce roku 2014. Pro účely této studie byl vybrán soubor 64 pacientů s laboratorně prokázaným onemocněním příušnicemi (tab. 1) a známým vakcinačním stavem – 38/64 vakcinovaných (soubor 1) a 26/64 nevakcinovaných (soubor 2). V souboru vakcinovaných mělo komplikovaný průběh 5 pacientů z 38 nemocných – 3krát byla diagnostikována orchitida a 2krát meningitida. Mezi nevakcinovanými byly komplikace častější – celkem u 9 pacientů z 26 : 5krát orchitida, 3krát meningitida a 1krát meningoencefalitida. Do kontrolního souboru byla zařazena séra od 30 zdravých v minulosti přirozeně promořených osob pro zjištění avidity anamnestických protilátek po přirozené infekci (soubor 3) a soubor 22 vakcinovaných 2–4letých dětí bez etiologické souvislosti s virem příušnic pro zjištění výše indexu avidity krátce po imunizaci (soubor 4). Celkem bylo vyšetřeno 85 vzorků sér, a to 21 párových, 38 akutních a 5 rekonvalescentních sér v souborech nemocných a 52 sér v kontrolních souborech. Všechna akutní séra byla odebrána do sedmého dne od počátku klinické manifestace onemocnění, téměř polovina z nich do čtvrtého dne.
Tab. 1. Výčet laboratorních metod potvrzujících onemocnění příušnicemi Table 1. List of laboratory methods used to confirm mumps 
Protilátky byly testovány soupravou Enzygnost Anti--Mumps/IgG (Siemens, Germany). Mikrotitrační destička tohoto kitu je rozdělena do dvoustripů. Jamky na levé straně dvoustripu jsou potaženy virovým antigenem, získaným z permanentní linie buněk opičích ledvin infikovaných virem příušnic a jamky na pravé straně jsou potaženy kontrolním antigenem. Test byl prováděn podle návodu výrobce, kromě toho, že naředěné sérum bylo nakapáno do 2 dvoustripů. Po inkubaci sér bylo do jednoho dvoustripu aplikováno 100 µl 6M urey k odstranění nízkoavidních IgG a do druhého 100 µl promývacího roztoku. Po deseti minutách inkubace při pokojové teplotě následovalo čtyřnásobné promytí obou dvoustripů a dále se pokračovalo podle instrukcí výrobce. Základem pro výpočet avidity byla hodnota optické denzity (OD) vzorku s virovým antigenem po odečtení hodnoty OD kontrolního antigenu, tato hodnota se značí ΔA. Výpočet indexu avidity (IA) se uvádí v procentech a je stanoven jako poměr ΔA vzorku promytého 6M ureou a ΔA vzorku bez urey x 100. Avidita vzorku byla počítaná pouze v případě, že jeho ΔA v jamce bez urey byla ≥ 0,100. Použití 6M urey vycházelo z předchozích prací [10, 13, 14]. Cut-off hodnota pro rozlišení nízké a vysoké avidity protilátek byla stanovena na 32 %. Jako nízkoavidní byly hodnoceny IgG protilátky s IA < 32 %, jako vysokoavidní pak ty, u nichž byl IA ≥ 32 %. Pro testování protilátek IgM, IgG a IgA byly použity soupravy Enzygnost Anti-Mumps/IgM a /IgG, Siemens a Mastazyme Mumps IgA, Mast Diagnostica, při práci bylo postupováno podle instrukcí výrobce.
VÝSLEDKY
Avidita
Ve studovaném souboru nemocných bylo z celkového počtu 64 osob 38 vakcinovaných (soubor 1) a 26 nevakcinovaných (soubor 2). V akutních sérech odebraných do 5. dne od počátku onemocnění byly detekovány protilátky s nízkou aviditou v souboru 1 i 2. Pokud byla akutní séra u vakcinovaných odebrána později, od 6. dne po počátku onemocnění, byla v nich již prokázána přítomnost IgG protilátek s VIA. V rekonvalescentních sérech byly zjištěny nízkoavidní IgG protilátky u nevakcinovaných (soubor 2), zatímco u vakcinovaných (soubor 1) a u reinfekcí osob v minulosti přirozeně promořených (soubor 2) byly protilátky vysokoavidní. Anamnestické protilátky v souboru zdravých přirozeně promořených osob nebo vakcinovaných malých dětí (soubor 3 a 4) vykazovaly NIA.
U nemocných byl prokázán zásadní rozdíl v aviditě IgG protilátek rekonvalescentních sér mezi vakcinovanými, u všech dosažené výsledky svědčí pro sekundární selhání vakcinace (VIA), a nevakcinovanými, u nichž převažoval nález odpovídající prvnímu styku s virem příušnic (NIA), kromě dvou případů, kdy byly v rekonvalescentním séru detekovány IgG protilátky s VIA. Tento nález je možné vysvětlit reinfekcí přirozeně promořených osob, která není zcela neobvyklá [7, 22].
Z výsledků vyšetření studovaného souboru vyplynulo, že virus příušnic, na rozdíl od jiných virů, indukuje protilátky s nízkým IA jak po vakcinaci, a to i nedávné, tak i po přirozené infekci. Vysokoavidní protilátky byly detekovány pouze v rekonvalescentních sérech vakcinovaných nebo u reinfekcí osob přirozeně promořených, a to v souvislosti s recentním stykem s virem příušnic. Přehled výsledků avidity v jednotlivých souborech uvádí graf 1.
Graf 1. Výsledky avidity IgG protilátek v jednotlivých souborech Figure 1. Results of mumps virus IgG antibody avidity testing by study group 
I. akutní sérum; II. rekonvalescentní sérum; *odběr akutního séra ≥ 6. den od začátku onemocnění; **bez výsledků rekonvalescentního séra nelze odlišit I. acute serum; II. convalescent serum; *acute serum collected on day ≥ 6 after the onset of the disease; **results for convalescent serum not available Diagnostický přínos IgM, IgA, IgG protilátek a avidity
Porovnání výsledků IgM a IgA protilátek v akutních sérech nemocných ukázalo, že u vakcinovaných (soubor 1) bylo na základě IgM pozitivity v akutním séru laboratorně potvrzeno 36 % případů, u nevakcinovaných (soubor 2) to bylo 74 %. Při využití stanovení IgA protilátek byla průkaznost onemocnění vyšší, a to 56 % u vakcinovaných a 87 % u nevakcinovaných osob. Protilátky IgG nejsou vhodným markerem pro laboratorní průkaz infekce v akutním séru, a proto nebyl tento test do porovnání zařazen. IA IgG protilátek byl ve všech akutních vzorcích sér odebraných do 6. dne od počátku onemocnění nízký a diagnostický přínos tato metoda neměla.
Při vyšetření rekonvalescentních sér byla v souboru 1 a 2 laboratorní průkaznost onemocnění příušnicemi všemi testy 100%, kromě stanovení IgM protilátek v souboru vakcinovaných, kde bylo jen 80 % případů pozitivních. Testem avidity IgG protilátek byl prokázán VIA u 100 % rekonvalescentních sér vakcinovaných a u dvou rekonvalescentních sér nevakcinovaných. Ve všech případech byl nález vysokého IA spojen s nálezem vysokých titrů IgG protilátek. Diagnostické využití avidity IgG je přínosné při vyšetření rekonvalescentních sér a/nebo akutních sér s odběrem od 6. dne po začátku onemocnění, a to u vakcinovaných či přirozeně promořených osob, kdy dochází k signifikantnímu nárůstu IA.
Přehled výsledků jednotlivých testů uvádí tabulka 2.
Tab. 2. Porovnání výsledků IgM, IgA, IgG a avidity IgG protilátek v akutních a rekonvalescentních sérech nemocných vakcinovaných (soubor 1) a nevakcinovaných (soubor 2) Table 2. Comparison of the results obtained by the detection of IgM, IgA, and IgG antibodies and IgG antibody avidity testing in acute and convalescent sera of vaccinated (group 1) and unvaccinated (group 2) patients 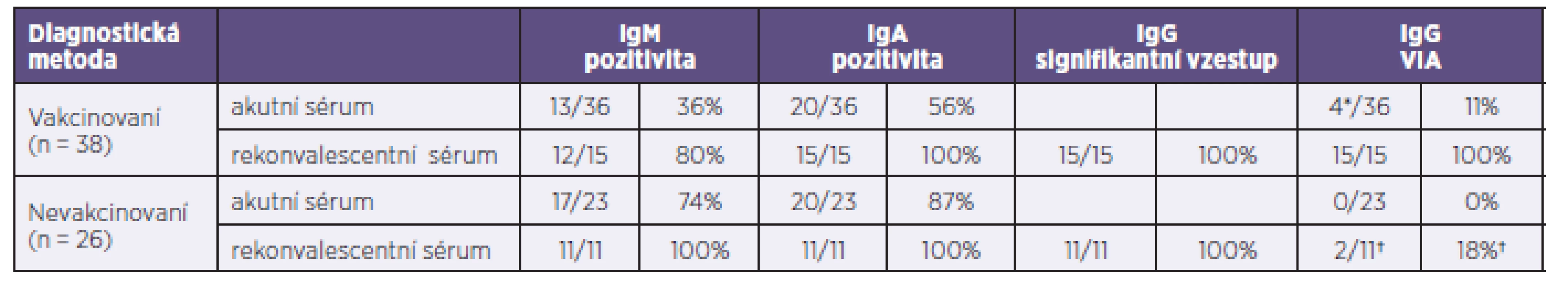
* odběr akutního séra ≥ 6. den od začátku onemocnění † projev reinfekce přirozeně promořených *acute serum collected on day ≥ 6 after the onset of the disease †result of re-infection in naturally immunised patients DISKUSE
Česká republika patří mezi země s vysokým vakcinačním pokrytím, a přesto je zde pozorován zvýšený počet onemocnění včetně lokálních epidemií. Historie vakcinace proti příušnicím se začala psát na přelomu let 1985/1986, kdy byla u kolektivizovaných 1,5–3letých dětí provedena úspěšná vakcinační studie s monovalentní vakcínou Pavivac (dostupná v letech 1985–2009). Od roku 1987 byla v rámci celoplošného očkování v dvoudávkovém vakcinačním schématu používána bivalentní vakcína Mopavac (1987–2008), od roku 1995 trivalentní vakcína Trivivac (1995–2009) a od roku 2009 se očkuje trivalentní vakcínou Priorix. Alternativou je čtyřvalentní vakcína Priorix Tetra obohacená o varicelovou složku. Očkovací schéma je dvoudávkové, první dávka se aplikuje od prvního dne 15. měsíce věku dítěte a druhá za 6–10 měsíců po primovakcinaci [15, 16].
Zatímco v epidemickém roce 2012 bylo hlášeno téměř 4 000 případů, v letech sběru prezentovaných klinických vzorků byl počet nemocných výrazně nižší. V roce 2013 to bylo 1 553 případů, v roce 2014 se jednalo o 677 případů onemocnění příušnicemi. Nejčastěji onemocněli 10–19letí, kteří tvořili téměř 52 % a 51 % v roce 2013, respektive 2014. Téměř 20 % případů v obou letech tvořily děti ve věku 5–9 let, což představuje závažné epidemiologické zjištění. Nejmenší nemocnost byla mezi přirozeně promořenými osobami. Ačkoli většina případů proběhla bez komplikací, bylo v obou letech zaznamenáno téměř 10 % onemocnění s komplikovaným průběhem. Převažovala orchitida spolu s meningitidou. Z celkového počtu nemocných bylo alespoň jednou dávkou vakcinováno 83 % a 84,5 % v roce 2013, respektive 2014. Očkovaných dvěma dávkami bylo asi 80 % nemocných v roce 2013 a 81 % v roce následujícím.
Výsledky sérologického přehledu 2001 prokázaly, že se prevalence protilátek v jednotlivých věkových skupinách vakcinovaných osob pohybovala mezi 70–86 % [11]. Mnohem závažnější zjištění ovšem přinesly sérologické přehledy 2013. V nejpostiženějších věkových skupinách 10–19letých je pouze 35 % séropozitivních, mezi 5–9letými dětmi je séropozitivita u 53 % a mezi 20–29letými je jen 38 % séropozitivních osob. U přirozeně promořených osob je prevalence protilátek jen kolem 80 %, což je asi o 10 % méně, než bylo zjištěno v roce 2001 [6]. Nesoulad mezi dlouhodobě vysokou proočkovaností (nad 98 %) a zjištěnými hodnotami prevalujících protilátek, které nejsou dostatečné pro zajištění kolektivní imunity a přerušení šíření onemocnění, je alarmující. Je zřejmé, že pro volbu cílené strategie boje s onemocněním příušnicemi má pravidelné monitorování imunitního stavu populace své nezastupitelné místo.
Na zvýšeném výskytu příušnic se pravděpodobně podílí několik faktorů. V první řadě je to postupné slábnutí ochranného účinku vakcinace, které je navíc ovlivněno méně častým kontaktem s přirozeně cirkulujícím virem v období mezi epidemiemi, což snižuje žádoucí booster efekt. Dalším zvažovaným faktorem je primární selhávání vakcinace v důsledku genotypové neshody mezi vakcinačním a cirkulujícím kmenem. Tato teorie ovšem není jednoznačně podložena, a ani naše dosavadní laboratorní zkušenosti tomu nenasvědčují [9, 12, 19]. Výskyt příušnic ve vysoce proočkované populaci není spojený pouze s aplikací vakcinálního kmene Jeryl-Lynn (genotyp A), ale také s kmenem Urabe AM9 (genotyp B) a Leningrad-3 a L-Zagreb (genotyp D). Lze tedy předpokládat, že vývoj nového vakcinálního kmene ke snížení nemocnosti nepovede [18]. Zda je možné předejít dalším epidemiím změnou vakcinační strategie v podobě aplikace třetí dávky či změnou v načasování současného dvoudávkového vakcinačního schématu je globálně diskutovanou otázkou [1, 3, 4, 5, 21].
Rekonvalescentních sér a/nebo později odebraných akutních sér, ve kterých lze pomocí avidity prokázat primární nebo sekundární vakcinační selhání, bylo ve studovaných souborech nemocných necelých 30. Jejich výsledky naznačují, že výskyt onemocnění příušnicemi ve vysoce proočkované populaci České republiky je, podobně jako v jiných zemích, důsledkem sekundárního selhání vakcinace – vyvanutí imunity [13, 14, 20, 21].
Avidita vyjadřuje sílu vazby mezi polyvalentním antigenem a polyvalentní protilátkou, přechod z avidity nízké do vysoké přichází u příušnic asi 160–180 dní po infekci či vakcinaci. Podle literárních údajů vysoký IA postupně klesá a již za 6 měsíců od aplikace druhé dávky vakcíny jsou ve většině případů detekovány již jen nízkoavidní protilátky, za 20 let od druhé dávky vakcíny dochází u příušnic k poklesu IA až o 24 % [10]. Testováním sér zdravých vakcinovaných 2–4letých dětí (soubor 4), ani přirozeně promořených osob (soubor 3) nebyly prokázány protilátky s vysokým IA. Soubor 4 ovšem nebyl dostatečně početný (n = 22), aby bylo možné vyloučit, že mezi 2–4letými dětmi nebudou ještě detekovány postvakcinační protilátky s vysokým IA. Tuto skutečnost je nutné mít na zřeteli při interpretaci nálezu vysokoavidních IgG protilátek.
Avidita IgG protilátek je vhodnou metodou pro diferenciální diagnostiku primárního a sekundárního selhání vakcinace. Využití může mít i jako doplňková diagnostická metoda pro laboratorní potvrzení infekce virem příušnic u sér odebraných od šestého dne po začátku onemocnění, a to u vakcinovaných nebo u reinfekcí přirozeně promořených osob, kdy vysoký IA signalizuje recentní infekci virem příušnic. Z uvedeného vyplývá, že informace o začátku onemocnění je zásadním údajem pro správnou interpretaci laboratorního nálezu. Skutečnost, že většina vyšetřovaných sér bývá odebraná v časné fázi onemocnění, kdy test avidity IgG protilátek nemá ještě dostatečnou výpovědní hodnotu, jeho diagnostické využití poněkud omezuje.
Výsledky této studie mohou být limitovány počtem testovaných sér a také tím, že testování avidity IgG protilátek zatím není pro příušnice validováno a hodnoty cut-off pro stanovení nízkého a vysokého IA se různí. Ve většině studií se za nízkoavidní považují protilátky s IA < 32%, za vysokoavidní pak ty, u nichž je IA ≥ 32 % [13, 14, 20]. Jiní autoři za nízkoavidní považují protilátky s IA < 30%, jako vysokoavidní hodnotí protilátky s IA > 50% a hodnoty 30–50 % označují jako střední [10].
Ze srovnání sérologických metod vyplynulo, že stanovení IgA protilátek významně zefektivnilo výpovědní hodnotu sérologického vyšetření v počátku klinické manifestace onemocnění a že pro sérologický průkaz infekce je stěžejní vhodné načasování odběru, neboť výpovědní hodnota sér odebraných v časné fázi onemocnění je výrazně nižší. U vakcinovaných bylo sice na základě IgM pozitivity v akutním séru laboratorně potvrzeno pouze 36 % případů, ale v rekonvalescentních sérech to už bylo 80 % případů. Při vyšetření protilátek IgA u vakcinovaných stoupla pozitivita z 56 % v akutním na 100 % v rekonvalescentním séru. U nevakcinovaných bylo v akutním séru 74 % IgM pozitivních, 87 % IgA pozitivních a v rekonvalescentním séru byl 100% průkaz všemi metodami.
ZÁVĚR
Výsledky této studie ukazují, že virus příušnic, na rozdíl od jiných virů, indukuje protilátky s nízkým IA jak po vakcinaci, tak po přirozené infekci. Vysokoavidní protilátky byly detekovány pouze v rekonvalescentních sérech vakcinovaných nebo u reinfekcí osob přirozeně promořených, a to v souvislosti s recentním onemocněním příušnicemi.
Vysoká nemocnost vakcinovaných v České republice je, podobně jako v jiných zemích, důsledkem sekundárního selhání vakcinace.
Specifika laboratorní diagnostiky vakcinovaných osob, které představují naprostou většinu nemocných, vedou k nutnosti zefektivnění rutinní sérologické diagnostiky. Největší výpovědní hodnotu při vyšetření akutního séra má stanovení IgA protilátek, a ačkoli je avidita přínosná pro diferenciální diagnostiku primárního a sekundárního selhání vakcinace, tak jako metoda pro zkvalitnění laboratorního průkazu infekce příušnicemi, má své limity.
Podpořeno grantem IGA MZČR NT 14059-3/2013.
Do redakce došlo dne 2. 7. 2015.
Adresa pro korespondenci:
MUDr. Radomíra Limberková
Státní zdravotní ústav
Šrobárova 48
100 42 Praha 10
email: limberkova@szu.cz
Zdroje
1. Anis E, Grotto I, Moerman L, Warhavsky B, Slater PE, Lev B. Mumps outbreak in Israel´s highly vaccinated society: are two doses enough? Epidemiol Infect, 2012;140(3):439–446. Dostupné na www: http:// dx.doi.org/10.1017/S095026881100063X.
2. Bitsko RH, Cortese MM, Dayan GH, Rota PA, Lowe L, Iversen SC, Bellini WJ. Detection of RNA of mumps virus during an outbreak in a population with a high level of measles, mumps, and rubella vaccine coverage. J Clin Microbiol, 2008;46 : 1101–1103.
3. Date AA, Kyaw MH, Rue AM, Klahn J, Obrecht L, et al. Long-term perzistence of Mumps antibody after receipt of 2 measles-mumps-rubella (MMR) vaccinations and antibody response after third MMR vaccination among a university population. J Infect Dis, 2008; 197(12):1662–1668. Dostupné na www: http://dx.doi.org/10.1086/588197.
4. Dayan GH, Quinlisk MP, Parker AA, Barskey AE, Harris ML, et al. Recent resurgence of Mumps in the United States. New Engl J Med, 2008;358(15):1580–1589. Dostupné na www: http://dx.doi.org/10.1056/NEJMoa0706589.
5. Fiebelkorn AP, Coleman LA, Belongia EA, Freeman SK, York D. Mumps Antibody Response in Young Adults After a Third Dose of Measles--Mumps-Rubella Vaccine. Open Forum Infect Dis, 2014;1(3): ofu094 first published online September 19, 2014. doi:10.1093/ofid/ofu094.
6. Fránová D, Jílková E, Král V, Skorkovský J, Sojková N, Stiborová I. Víceúčelový sérologický přehled (spalničky, příušnice, pertuse, virová hepatitida B) SP 2013, ČR. Zprávy Centra epidemiologie a mikrobiologie, 2014;(23)Příloha 1 : 36–52.
7. Gut JP, Lablache C, Behr S, Kirn A. Symptomatic mumps virus reinfection. J Med Virol, 1995;(45):17–23.
8. Hatchette T, Davidson R, Clay S, Pettipas J. Laboratory diagnosis of mumps in a partially immunized population: The Nova Scotia experience. Can J Infect Dis Med Microbiol, 2009; 20(4):157–162.
9. Kaaijk P, Zeijst BA, Boog MC, Hoitink CW. Increased mumps incidence in the Netherlands: review on the possible role of vaccine strain and genotype. Euro Surveill, 2008; 13(26):pii=18914.
10. Kontio M, Jokinen S, Paunio M, Peltola H, Davidkin I. Waning antibody levels and avidity: implication for MMR vaccine-induced protection. J Infect Dis, 2012;(206):1542–1548.
11. Mrázová M, Smelhausová M, Sestáková Z, Svandová E, Benes C. The 2001 serological survey in the Czech Republic-mumps. Cent Eur J Public Health, 2003;11(Suppl):50–53.
12. Mühlemann K. The molecular epidemiology of mumps virus. Infect Genet Evol, 2004; 4(3):15–219.
13. Narita M, Matsuzono Y, Takekoshi Y, et al. Analysis of mumps vaccine failure by means of avidity testing for mumps virus – specific immunoglobulin G. Clin Diag Lab Immunol, 1998;(5):799–803.
14. Park DW, Nam MH, Kim JY, Kim HJ, Sohn JW, Cho Y, Song KJ, Kim MJ. Mumps outbreak in a highly vaccinated school population: assessment of secondary vaccine failure using IgG avidity measurements. Vaccine, 2007;(25):4665–4670.
15. Paulů V, Polanecký V. Očkování – trend 20. a 21. století. Jak je to s očkováním v ČR? Remedia, 2002;12(3):198–204.
16. Petráš M, Lesná IK. Manuál očkování 2010. 3.vyd., Praha 2010; 202–217 s. ISBN: 978-80-254-5419-0.
17. Rota JS, Rosen JB, Doll MK, McNall RJ, McGrew M, et al. Comparison of the sensitivity of laboratory diagnostic methods from a well-characterized outbreak of mumps in New York City in 2009. Clin Vaccine Immunol, 2013;20(3):391–396.
18. Rubin SA, Link MA, Sander CJ, Zhang C, Ngo L, et al. Recent mumps outbreaks in vaccinated populations: no evidence of immune escape. J Virol, 2012;86(1):615–620.
19. Rubin SA, Qi L, Audet SA, Sullivan B, et al. Antibody induced by immunization with the Jeryl Lynn mumps vaccine strain effectively neutralizes a heterologous wild-type mumps virus associated with a large outbreak. J Infect Dis, 2008;198(4):508–515.
20. Sanz-Moreno JC, Limia-Sánchez A, García-Comas L, Mosquera--Gutiérrez MM, Echevarria-Mayo JE, et al. Detection of secondary mumps vaccine failure by means of avidity testing for specific immunoglobulin G. Vaccine, 2005;23(41):4921–4925.
21. Vandermeulen C, Roelants M, Vermoere M, Roseeuw K, Goubau P, Hoppenbrouwers K. Outbreak of Mumps in a vaccinated child population: a guestion of vaccine failure? Vaccine, 2004;(22):2713–2716.
22. Yoshida N, Fujino M, Miyata A, Nagai T, Kamada M, Sakiyama H, Ihara T, Kumagai T, Okafuji T, Okafuji T, Nakayama T. Mumps virus reinfection is not a rare event confirmed by reverse transcription loop-mediated isothermal amplification. J Med Virol, 2008;80(3):517–523.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2016 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Antibiotická léčba klostridiové kolitidy
- Prevalence infekčních komplikací u popálených pacientů vyžadujících intenzivní péči: data z panevropské studie
- Úvodník
- Prevalence Candida pelliculosa, Candida utilis a Candida fabianii ve Fakultní nemocnici Olomouc – epidemiologická studie
- Přínos avidity IgG protilátek u příušnic ve vysoce proočkované populaci v kontextu s ostatními sérologickými metodami laboratorní diagnostiky příušnic a současnou epidemiologickou situací
- Virus hepatitidy E
- Chřipka u dětské populace v Istanbulu – zkušenosti jednoho centra 2009–2014
- Posuzování invalidity u infekčních onemocnění
- Infekční a další somatická komorbidita problémových uživatelů drog – výsledky průřezové studie s lékařským vyšetřením
- XXV. Tomáškovy dny mladých mikrobiologů
- PhMr. Jaroslav Švec
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Antibiotická léčba klostridiové kolitidy
- Infekční a další somatická komorbidita problémových uživatelů drog – výsledky průřezové studie s lékařským vyšetřením
- Virus hepatitidy E
- Posuzování invalidity u infekčních onemocnění
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



