-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Detekcia markerov bunkovej smrti ako nástroj na testovanie citlivosti baktérií na antibiotiká
Detection of cell death markers as a tool for bacterial antimicrobial susceptibility testing
Antimicrobial resistance among nosocomial pathogens has emerged as one of the most important health care problems in the new millennium. In this review, we present new methods for bacterial antimicrobial susceptibility testing, based on the detection of antibiotic-mediated cell death markers that could provide valuable alternatives to existing phenotypic approaches in the very near future.
KEYWORDS:
cell death – resistance – antimicrobials – Pseudomonas – real-time PCR
Autoři: P. Mlynárčik; M. Kolář
Působiště autorů: Ústav mikrobiologie, Lékařská fakulta Univerzity Palackého v Olomouci
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 65, 2016, č. 2, s. 85-91
Kategorie: Souhrnné sdělení
Souhrn
Antimikrobiálna rezistencia nozokomiálnych patogénov sa ukázala v novom tisícročí ako jeden z najvýznamnejších problémov v zdravotnej starostlivosti. V tomto prehľade uvádzame nové metódy na testovanie citlivosti baktérií na antibiotiká založené na detekcii markerov antibiotikami sprostredkovanej bunkovej smrti, ktoré by sa mohli stať v blízkej budúcnosti cennými alternatívami k už existujúcim fenotypovým metódam.
KĽÚČOVÉ SLOVÁ:
bunková smrť – rezistencia – antibiotiká – Pseudomonas – real-time PCRÚVOD
Za posledné dve desaťročia sme svedkami narastajúceho výskytu infekcií spôsobených mnohonásobne rezistentnými mikroorganizmami. Antimikrobiálna rezistencia baktérií sa objavila ako problém nielen v humánnom, ale aj vo veterinárnom lekárstve. Mnoho štúdií naznačuje, že včasné poskytnutie primeranej antibiotickej liečby je nesmierne dôležité pri záchrane života. Momentálne sa lekári spoliehajú pri výbere empirickej terapie na kombináciu klinických, epidemiologických a demografických údajov, pretože získanie výsledkov kultivácie a testovania citlivosti na antibiotiká môže trvať 48 hodín a dlhšie. Z tohto dôvodu je tu pokračujúca snaha o vývoj skoršej a citlivejšej detekcie rezistentných baktérií.
Karbapenémy a polymyxín E (kolistín) sú považované za jedny z mála liekov určených na liečbu infekcií spôsobených multirezistentnými gramnegatívnymi baktériami. Účinok kolistínu spočíva v narušení cytoplazmatickej membrány, pričom rezistencia voči nemu už bola popísaná a vychádza napríklad zo zmien lipopolysacharidu na vonkajšej membráne z dôvodu mutácií regulačných génov, napr. phoQ génu [1]. Narastajúci vývoj rezistencie ku karbapenémom u nozokomiálnych patogénov [2] sa stáva závažným klinickým problémom hlavne kvôli veľkému spektru týchto enzýmov a obmedzenému množstvu terapeutických možností. Navyše produkciu karbapenemáz nie je možné ľahko vyvodiť z antimikrobiálneho profilu rezistencie [3] (karbapenemázy-produkujúce baktérie môžu niekedy vykazovať iba mierny nárast hodnoty minimálnej inhibičnej koncentrácie pre karbapenémy), a tak šírenie týchto enzýmov medzi nozokomiálnymi patogénmi (napr. Pseudomonas aeruginosa, Enterobacteriaceae a Acinetobacter baumannii) je hrozbou pre verejné zdravie hlavne kvôli obmedzeniu našich antibiotických možností a musí byť pozorne sledované (fenotypové alebo genetické testy).
Antibiotické mechanizmy rezistencie u nozokomiálnych patogénov sú zvyčajne spojené s:
- a) enzymatickou inaktiváciou antibiotík,
- b) zníženou priepustnosťou vonkajšej membrány kvôli strate vonkajších povrchových proteínov (porínov),
- c) modifikáciou lipopolysacharidov na vonkajšej membráne a
- d) zvýšenou expresiou efluxných púmp [4–7].
Okrem toho, napríklad u baktérií P. aeruginosa je známe, že sú schopné rásť vo forme biofilmu [8], čo je výhodné pre patogenitu/kolonizáciu a odolnosť voči antibiotickej liečbe. Ďalšie mechanizmy, ako je vývoj tzv. swarming kolónií, prísnej odpovedi (tzv. stringent response, t. j. odpoveď na nedostatok živín) a formovanie subpopulácie multirezistentných perzistentných buniek (pomaly rastúce, alebo nedeliace sa bunky) prispievajú k multirezistentnému fenotypu [9–11]. Z daných skutočností vyplýva, že niektoré baktérie vykazujú vysokú odolnosť voči antibiotickej liečbe, ktorá je dosiahnutá prostredníctvom kombinácie rôznych faktorov.
Medzi aktuálne používané metódy slúžiace na detekciu karbapenemáz u nozokomiálnych patogénov patria bežné fenotypové testy (napr. mikrodilučná metóda), CARBA NP (Carbapenemase Nordmann-Poirel) test (výsledok za 2 hodiny) a hmotnostná spektrometria – matricou asistovaná laserová desorbcia/ionizácia s detekciou času letu (MALDI-TOF), ktorá môže byť použitá napríklad na detekciu degradačných produktov antibiotík v dôsledku ich hydrolýzy po inkubácii s bakteriálnym izolátom. Príkladom toho je napríklad detekcia karbapenemázovej aktivity (VIM-2) u P. aeruginosa [12]. Zhrnutie existujúcich technológií, ktoré môžu byť aplikované na detekciu antibiotickej rezistencie u mnohonásobne rezistentných baktérií je dostupné v prehľade Mlynárčika et al. [13]. V tomto prehľade poskytujeme súhrn molekulárnej podstaty bunkovej smrti a prehľad nových metód založených na detekcii markerov bunkovej smrti slúžiacich na rýchlu detekciu antibiotickej rezistencie u baktérií.
BUNKOVÁ SMRŤ A JEJ MOLEKULÁRNE ZÁKLADY
Programovaná bunková smrť je proces riadený génmi, ktorý je zapojený do rozvoja a homeostázy mnohobunkových organizmov [14]. Najbežnejší spôsob programovanej bunkovej smrti je apoptóza, ktorá je charakterizovaná stereotypným súborom biochemických a morfologických znakov. Dwyer et al. popísali, že Escherichia coli tiež vykazuje charakteristické znaky apoptotickej programovanej bunkovej smrti (bunková smrť podobná apoptóze, z anglického Apoptosis-Like Death) po ošetrení s baktericídnymi antibiotikami alebo UV žiarením [15]. Antibiotikami sprostredkovaná bunková smrť u baktérií je všeobecne charakterizovaná nasledovnými biochemickými markermi:
- a) fragmentácia DNA,
- b) chromozomálna kondenzácia,
- c) vystavenie fosfatidylserínu na vonkajšej membráne a
- d) strata membránového potenciálu [15].
Vzhľadom k účinku konkrétnych antibiotík bola bunková smrť spojená s formovaním zlomov v dvojvláknovej DNA po liečbe s inhibítormi topoizomerázy II (tiež známej ako DNA gyráza) [16], so zastavením RNA syntézy závislej na DNA (po liečbe s rifamycínovými antibiotikami [17], s poškodením bunkovej steny a stratou štruktúrnej celistvosti po liečbe s inhibítormi syntézy bunkovej steny [18], a s bunkovou energetikou, viazaním ribozómu a chybnou transláciou proteínov po liečbe s inhibítormi syntézy bielkovín [19].
Mnohé štúdie naznačujú, že bakteriálny stres spôsobený napríklad nedostatkom živín alebo baktericídnymi antibiotikami má za následok produkciu škodlivých reaktívnych foriem kyslíka (tzv. Reactive Oxygen Species – ROS), zahrňujúcich superoxidový anión (O2−), peroxid vodíka (H2O2) a hydroxylový radikál (OH•), prostredníctvom poškodenia vyvolaného oxidačným stresom. Toto oxidačné poškodenie u grampozitívnych a gramnegatívnych baktérií prispieva k bunkovej smrti v dôsledku zmien v centrálnom metabolizme (t. j. zmeny v Krebsovom cykle – cyklus trikarboxylových kyselín) a metabolizme železa [20, 21]. Bolo zistené, že primárna interakcia antibiotika s jeho cieľovým miestom (aminoglykozidy interagujú s ribozómami, chinóny s DNA gyrázou a β-laktámy s penicilín-viažucimi proteínmi) stimuluje oxidáciu NADH (nikotínamid adenín dinukleotid) prostredníctvom elektrónového transportného reťazca, ktorý je závislý na Krebsovom cykle. Zvýšená aktivita tohto elektrónového transportného reťazca stimuluje tvorbu superoxidu (O2−), ktorý môže poškodiť esenciálne enzýmy obsahujúce zhluky železa a síry (tzv. [4Fe-4S] zhluky). Táto oxidačná inaktivácia esenciálnych enzýmov má za následok tvorbu [3Fe-4S] zhlukov a uvoľňovanie dvojmocného železa (Fe2+), ktoré je následne k dispozícii pre Fentonovú reakciu [22]. Fentonová reakcia vedie k formovaniu hydroxylového radikálu (OH•) a hydroxylové radikály poškodzujú DNA, proteíny a lipidy, čo prispieva k antibiotiku indukovanej bunkovej smrti [21] – obrázok 1. Ďalej bolo zistené, že chinolóny, β-laktámové antibiotiká a aminoglykozidy tiež spúšťajú formovanie hydroxylových radikálov a bunkovú smrť prostredníctvom tzv. obalového – cell envelope (Cpx) a redox-reagujúceho (Arc) dvojzložkového systému [23]. Účasť Cpx systému pri antibiotikami sprostredkovanej bunkovej smrti ukazuje, že membránová integrita je dôležitá pre prežitie baktérií. Aktivácia tohto dvojzložkového systému je objasnená u aminoglykozidov, avšak zostáva neobjasnená pre β-laktámové antibiotiká a chinolóny. U β-laktámových antibiotík sa predpokladá, že táto membránová integrita je ovplyvnená priamo prostredníctvom interakcie cieľového miesta s antibiotikom, zatiaľ čo s aminoglykozidmi vyzerá, že membránová funkcia a integrita je najviac ovplyvnená s chybnou transláciou proteínov vyvolanou antibiotikami. V krátkosti, interakcia medzi aminoglykozidmi a ribozómami zapríčiňuje chybnú transláciu a chybné skladanie membránových proteínov. Začlenenie týchto chybných proteínov do bunkových membrán stimuluje spomínané dvojzložkové systémy Cpx a Arc. Aktivácia týchto systémov následne narušuje bunkový metabolizmus (zmeny v Krebsovom cykle) a membránový potenciál, čo má za následok vznik smrteľných hydroxylových radikálov [23] – obrázok 1. Na druhej strane však iné štúdie preukázali, že ROS neboli jedinými arbitrami antibiotikami sprostredkovaného zabitia [24]. Je to založené na skutočnosti, že smrtiaci efekt antibiotík bol významne znížený, nie však úplne eliminovaný za striktne anaeróbnych podmienok. Allison et al. popísali, že tolerancia E. coli rastúca v biofilme bola zmiernená pridaním metabolitov, ktoré obnovujú schopnosť generovať OH• pomocou hyperoxidácie NADH odvodenej z Krebsovho cyklu [25]. Navyše zistenie, že doplnenie dusičnanov zlepšuje baktericídny účinok antibiotík za anaeróbnych podmienok nielen podporuje názor, že bunkové dýchanie sa podieľa na antibiotickej letalite, ale tiež znamená, že činidlá zvyšujúce respiračnú aktivitu alebo elektrónový transport môžu zlepšiť antibiotické zabíjanie [26].
Obr. 1. Model spoločnej dráhy bunkovej smrti pre baktericídne antibiotiká Figure 1. Model of common cell death pathways for bactericidal antimicrobials 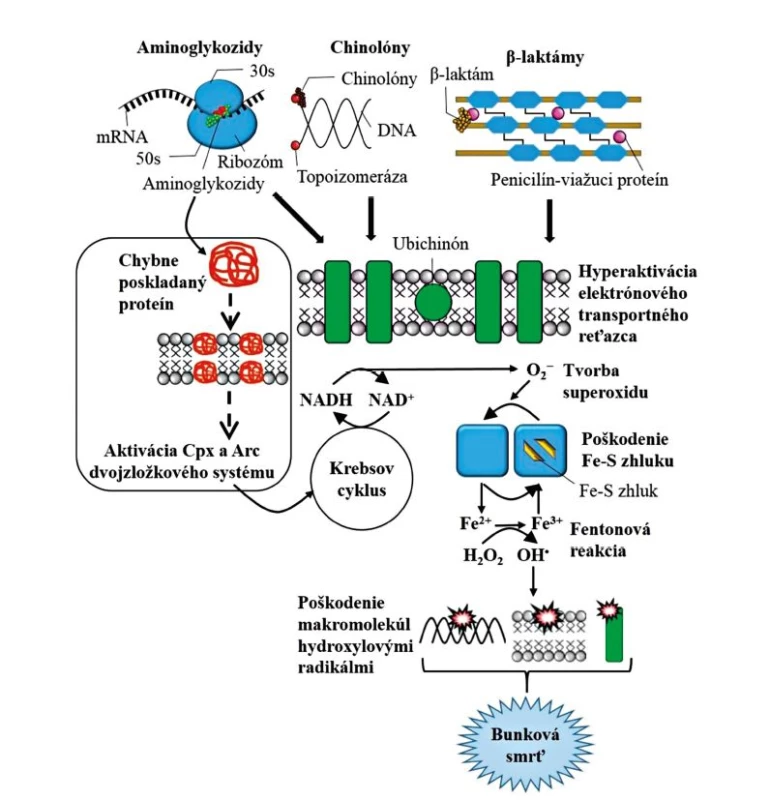
Skratky: Cpx = obalový dvojzložkový systém, Arc = redox-reagujúci dvojzložkový systém, DNA = deoxyribonukleová kyselina, mRNA = mediátorová ribonukleová kyselina, 30s/50s = ribozómové podjednotky, O2 − = superoxidový anión, NADH/NAD+ = nikotínamid adenín dinukleotid, Fe-S = železo a síra, Fe3+ = trojmocné železo, Fe2+ = dvojmocné železo, OH• = hydroxylový radikál a H2O2 = peroxid vodíka. Abbreviations: Cpx = two-component envelope system, Arc = redox-reactive two-component system, DNA = deoxyribonucleic acid, mRNA = messenger ribonucleic acid, 30s/50s = ribosomal subunits, O2− = superoxide anion, NADH/NAD+ = nicotinamide adenine dinucleotide, Fe-S = iron and sulfur, Fe3+ = trivalent iron, Fe2+ = bivalent iron, OH• = hydroxyl radical, and H2O2 = hydrogen peroxide. Molekulárne základy antibiotikami sprostredkovanej bunkovej smrti sú najlepšie preštudované u modelového organizmu E. coli. Produkcia škodlivých ROS molekúl, ako je uvedené u E. coli, bola popísaná aj u ostatných bakteriálnych druhov (P. aeruginosa, Salmonella enterica, A. baumannii, Mycobacterium tuberculosis, apod.), a preto sa predpokladá, že tento fenotyp je vysoko konzervatívny. Breidenstein et al. [27] popísali komplexný ciprofloxacínový rezistóm u P. aeruginosa, ktorý zahŕňal napríklad mutácie v niekoľkých génov podieľajúcich sa na transporte železa, čo je v súlade s názormi, ktoré naznačujú úlohu voľných radikálov pri antibiotikami sprostredkovanom zabití [21]. U P. aeruginosa a E. coli rastúcich v biofilmoch bol ďalej zistený vplyv prísnej odpovedi pri udržiavaní nízkej hladiny ROS [11, 28], čo zvyšuje pravdepodobnosť, že kontrola antibiotikami indukovaného oxidačného stresu pomocou prísnej odpovedi je tiež bežná v baktériách. Je zaujímavé preto predpokladať, že ROS odvodené od antibiotikami indukovaných fyziologických zmien sa môžu podieľať na generalizovanej stresovej odpovedi, ktorá má za následok úhyn baktérií pri letálnych hladinách, ale podporuje mutagenézu pri subletálnych dávkach.
Stojí za zmienku spomenúť, že poškodenie DNA je spojené s tzv. SOS stresovou odpoveďou, ktorá predstavuje dráhu regulujúcu opravu DNA. SOS odpoveď riadia dve hlavné proteíny – LexA (tzv. utlačovateľ) a RecA (tzv. induktor), pričom LexA potláča transkripciu regulónu zahrňujúceho viac ako 50 génov. Pri poškodení DNA alebo v dôsledku ROS sa mení neaktívna forma RecA na jej aktívnu formu, ktorá stimuluje samoštiepenie LexA, čo vedie k derepresii SOS génov. Za neprítomnosti poškodenia DNA bazálna hladina expresie LexA zaisťuje deaktiváciu systému [29]. Pokiaľ je poškodenie DNA nezvratné, nastáva bunková smrť podobná apoptóze [30] – obrázok 2. Z daných skutočností vyplýva, že RecA predstavuje multifunkčný proteín, ktorý plní smrtiace aj životne dôležité úlohy. Letálna aktivita aktívneho RecA je negatívne regulovaná prostredníctvom ClpP proteázového komplexu ClpXP [15]. Inými slovami povedané, komplex ClpXP potláča smrtiacu aktivitu RecA. Tieto faktory tiež tlmia LexA-regulované bakteriálne poškodenie DNA (alebo SOS) v dôsledku stresovej odpovedi, ktoré je dôležité pre účinnú indukciu apoptóze-podobnej bunkovej smrti pri odozve na bunkový stres (obr. 2).
Obr. 2. Bunková smrť u baktérií a jej charakteristické fyziologické a biochemické znaky Figure 2. Bacterial cell death and its characteristic physiological and biochemical hallmarks 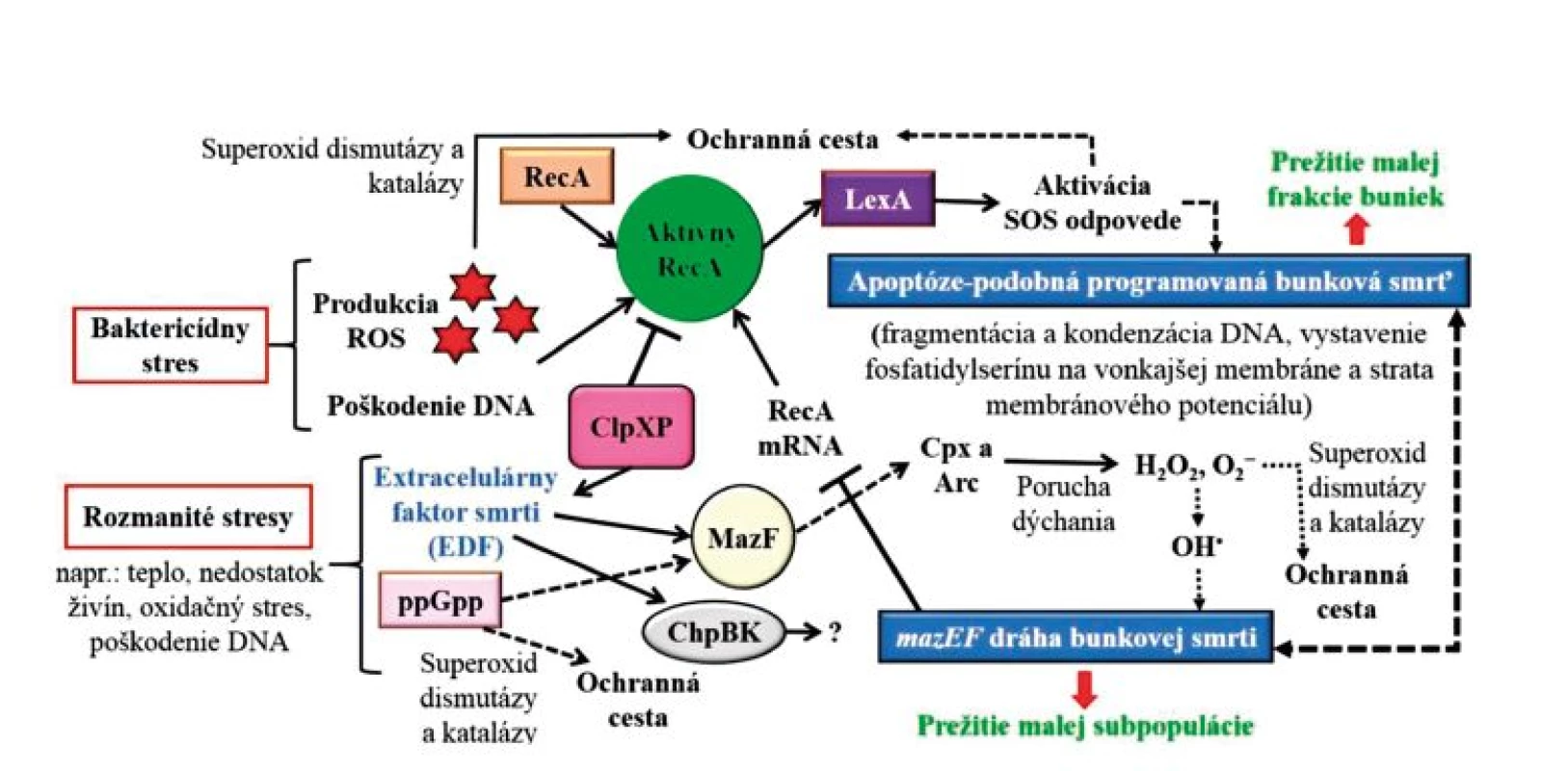
Skratky: ROS = reaktívne formy kyslíka, DNA = deoxyribonukleová kyselina, mRNA = mediátorová ribonukleová kyselina, RecA = induktor SOS stresovej odpovede, LexA = utlačovateľ SOS stresovej odpovede, Cpx = obalový dvojzložkový systém, Arc = redox-reagujúci dvojzložkový systém, ppGpp = guanozín tetra-fosfát, MazF = toxín, ChpBK = homologický toxín s MazF, H2O2= peroxid vodíka, O2− = superoxidový anión, OH• = hydroxylový radikál a mazEF = toxín-antitoxín (TA) stresom indukovaný systém. Abbreviations: ROS = reactive oxygen species, DNA = deoxyribonucleic acid, mRNA = messenger ribonucleic acid, RecA = SOS stress response inductor, LexA = SOS stress response inhibitor, Cpx = two-component envelope system, Arc = redox-reactive two-component system, ppGpp = guanosine tetraphosphate, MazF = toxin, ChpBK = MazF toxin homolog, H2O2 = hydrogen peroxide, O2− = superoxideanion, OH• = hydroxyl radical, and mazEF = stress-induced toxin-antitoxin (TA) system. Bol popísaný aj iný typ indukovanej bunkovej smrti u E. coli (viď obr. 2), ktorý je nezávislý na proteíne RecA a je riadený pomocou mazEF toxín-antitoxín (TA) systému. Zdá sa pritom, že apoptóze-podobná a mazEF dráha sú navzájom prepojené, pričom samotná mazEF dráha potláča apoptóze-podobnú dráhu znížením mRNA hladín recA [30]. ClpXP sa podieľa na syntéze signalizačného faktora quorum sensing, EDF, ktorý je označený ako extracelulárny faktor smrti [31]. EDF je potrebný pre mazEF-sprostredkovanú bunkovú smrť a indukuje endoribonukleatickú aktivitu MazF a ChpBK (homologický toxín s MazF) [32]. Čo sa týka napríklad baktérií P. aeruginosa, boli u nich prezentované najmenej tri TA systémy - relBE, parDE a higBA (RelE je ako MazF u E. coli) [33], avšak ich účasť na bunkovej smrti nebola doposiaľ popísaná. Ďalej bolo u P. aeruginosa popísané, že inaktivácia prísnej odpovedi (stresovej odpovedi na hlad riadenej produkciou molekuly (p)ppGpp /guanozín penta - a tetra-fosfát/, ktorá je katalyzovaná proteínmi RelA a SpoT) prispieva k bunkovej smrti cez zníženú aktivitu superoxid dismutázy a katalázy [11] (viď obr. 2). U Pseudomonas putida bolo zistené, že aplikácia ampicilínu indukovala oxidačné obranné gény, ako napríklad ahpC a DNA opravné gény, ako napríklad ung (kódujúci uracil DNA glykozylázu) [34]. Naopak, Aizenman et al. zistili, že zvýšená expresia ppGpp potlačila prepis mazEF promótora a napriek tomu indukovala mazEF-sprostredkovanú bunkovú smrť u E. coli [35] – obrázok 2. V skratke, spotrebovanie antitoxínu MazE v bunke v spojení so zníženým stupňom prepisu spôsobilo nárast voľnej formy toxínu MazF, ktorý bol schopný vykonávať svoje škodlivé účinky majúce za následok zabitie bunky. Čo sa týka ďalších génov, bolo zistené, že oxidačné gény s odpoveďou na stres u E. coli boli tiež zapojené do bunkovej smrti podporovaním glykácie alebo neenzymatickej glykozylácie proteínov a nukleových kyselín [36]. Bolo tiež popísané, že inhibícia expresie chaperonínov GroEL/GroES bola spojená so zvýšenou citlivosťou voči aminoglykozidu a následnou bunkovou smrťou [37]. Navyše dostupnosť železa bola preukázaná ako dôležitá pre účinok antibiotík (zvýšená expresia reduktáz železitých iónov urýchľuje antibiotikami sprostredkovanú bunkovú smrť u P. aeruginosa) [34]. Z daných faktov vyplýva, že samotná dráha antibiotikami sprostredkovanej bunkovej smrti predstavuje komplexný proces, ktorý začína interakciou antibiotikum-cieľové miesto s primárnymi účinkami príslušných interakcií a zahŕňa množstvo enzýmov, pričom ďalšie molekuly zapojené do tohto javu zostávajú neobjasnené.
Existencia dvoch dráh, mazEF a apoptóze-podobnej, ktoré sú navzájom prepojené, predstavuje záložný systém pri zabezpečení bunkovej smrti a nástroj pri striedaní bunkovej reakcie na rôzne typy a intenzitu stresu. Ich hlavnou výhodou sa zdá byť, že umožňujú prežívanie malej časti bakteriálnej populácie [30, 38] – viď obrázok 2. Takže, keď sa rastové podmienky stanú menej stresujúcimi, je pravdepodobné, že táto malá populácia prežívajúcich buniek sa stane základom novej bunkovej populácie.
DETEKCIA APOPTÓZE-PODOBNÝCH MARKEROV PROSTREDNÍCTOM KVANTITATÍVNEJ REAL-TIME PCR, VYSOKO VÝKONNEJ („HIGH-THROUGHPUT“) mRNA ANALÝZY ALEBO RNA SEKVENOVANIA
Jedná sa o štúdium génov bunkových štruktúr a génov zapojených do bunkových procesov, ako je Krebsov cyklus, SOS odpoveď, prísna odpoveď, oxidačný stres, TA komponenty a ostatných génov (založených na podrobnej rešerši literatúry) u izolátov nozokomiálnych patogénov, ktoré vplývajú na antibiotikami sprostredkovanú smrť. Potencionálne markery bunkovej smrti by mohli byť spoľahlivými ukazovateľmi na testovanie citlivosti na antibiotiká. Ich identifikácia spočíva vo využití real-time PCR, vysoko výkonnej („high-throughput“) mRNA analýzy alebo RNA sekvenovania. Čo sa týka nášho vedomia, doposiaľ neevidujeme žiadne pokusy o uskutočniteľnosti tohto princípu.
Martín Peña et al. popísali detekciu rezistencie voči imipenému, ciprofloxacínu, kolistínu a amikacínu u klinických izolátov A. baumannii použitím real-time PCR zameranej na detekciu veľmi zachovaných sekvencií ompA génu kódujúceho vonkajší povrchový proteín [39]. Zmeny pomeru (z anglického „fold change“) v počte kópií genomickej DNA po 6 hodinách rastu boli použité na určenie rezistencie a výsledky boli porovnané s výsledkami získanými s použitím dilučnej mikrometódy. Výsledky real-time PCR boli na 95,8% zhodné so zisteniami dilučnej mikrometódy. Podobný princíp, avšak založený na detekcii apoptóze-podobných markerov, by mohol byť použitý na stanovenie antibiotickej rezistencie [40], pričom by sa po inkubácii baktérií s baktericídnymi antibiotikami sledovali iba špecifické gény. V krátkosti, čisté kultúry baktérií by boli vystavené rôznym baktericídnym antibiotikám, následne by bola vykonaná izolácia celkovej RNA a jej analýza spočívajúca v štúdii zmien v expresii génov súvisiacich s bunkovou smrťou. V rôznych časových intervaloch by mohla byť odobraná časť vzorky na stanovenie počtu kolónií („colony forming units“) prostredníctvom nanesenia vzorky na LB agarové platničky. Skúmanie vplyvu vybraných génov na antibiotikami sprostredkovanú bunkovú smrť by mohlo byť overené prostredníctvom mutantných kmeňov baktérií. Rozlíšenie na citlivé a rezistentné kmene na antibiotiká by bolo založené na detekcii zložiek produkovaných pri bunkovej smrti po inkubácii s baktericídnymi antibiotikami (zmena expresie špecifických génov zapojených do bunkovej smrti u citlivých a odolných kmeňov). Princíp kvantitatívnej real-time PCR spočíva v schopnosti presne kvantifikovať počet kópií bakteriálneho genómu vo vzorke. Výhodou tohoto prístupu je to, že:
- pri experimentoch môžu byť použité veľmi krátke inkubačné časy na rozlíšenie citlivých od rezistentných kmeňov,
- metóda nie je závislá na mechanizme rezistencie a test nepriamo meria fenotypovú rezistenciu zistením rastu za prítomnosti testovaného antibiotika. Jej hlavnou nevýhodou je, že si vyžaduje predošlú kultiváciu a metóda nemôže byť použitá priamo na klinické vzorky.
Ďalšou sľubnou možnosťou je analýza transkriptómu u citlivých a rezistentných kmeňov baktérií použitím vysoko výkonnej („high-throughput“) mRNA analýzy použitím tzv. SmartChip Real-Time PCR systému pri štúdiu apoptóze-podobných markerov. Jedná sa o genómovú analýzu novej generácie umožňujúcej vysoko výkonnú mRNA analýzu použitím 5184 nanočipov, ktoré by boli použité na skúmanie zmien v expresii génov v závislosti na bunkovej smrti indukovanej rôznymi antibiotikami (štúdium dráh bunkovej smrti). Hood et al. popísali rozdielny transkripčný profil u A. baumannii použitím čipov v reakcii na NaCl. Podarilo sa im zistiť, že 18 predpokladaných faktorov spojených s efluxom antibiotík, ktoré neboli predtým charakterizované, bolo výrazne aktivovaných a indukovali rezistenciu voči levofloxacínu a amikacínu počas rastu A. baumannii za fyziologicky relevantných soľných podmienok [41]. Výhodou uvedeného testu je kvalitnejší výkon SmartChips jamiek o veľkosti 100 nl bez potreby preamplifikácie pri variabilných nastaveniach testu a vzorky. Tento systém umožňuje dosiahnutie veľmi reprodukovateľných výsledkov v rámci opakovaných vzoriek, naprieč rôznych čipov a silnú lineárnu koreláciu pri sériových riedeniach. Ďalšími prednosťami uvedenej metódy je:
- schopnosť detegovať široké množstvo rozdielnych génov rezistencie v jednej skúške,
- vysoká citlivosť a špecifickosť na detekciu rezistentných génov,
- výsledky môžu byť získané v priebehu jedného dňa.
Nevýhodou tohto prístupu je, že:
- získané dáta sa nemusia stále zhodovať s fenotypovou rezistenciou,
- neposkytuje hodnoty minimálnych inhibičných koncentrácií príslušných antibiotík.
Obidva prístupy, real-time PCR metóda a SmartChip Real-Time PCR systém využívajú cDNA získanú prepisom celkovej RNA použitím reverzných transkriptáz (ako je uvedené vyššie) a boli by použité na detekciu špecifických RNA molekúl u baktérií zapojených do bunkovej smrti. Identifikované markery bunkovej smrti prostredníctvom tohto prístupu by mohli byť následne využité na stanovenie citlivosti baktérií na antibiotiká povedzme pomocou real-time PCR, ktoré by spočívalo iba v sledovaní menšieho množstva určitých génov, markerov bunkovej smrti, po inkubácii baktérií s baktericídnymi antibiotikami.
Ďalšou alternatívnou možnosťou je identifikácia markerov bunkovej smrti použitím RNA sekvenovania za účelom štúdia transkripčnej odpovedi v dôsledku účinku antibiotika. V tomto prípade ide o sekvenovanie cDNA získanej prepisom RNA (ako je uvedené vyššie). Antibakteriálna aktivita, čiže citlivosť k antibiotiku, by bola v tomto prípade definovaná ako variabilná úroveň expresie sledovaných génov bunkovej smrti v porovnaní so sledovaním génovej expresie pri kontrole rastu alebo rezistentného kmeňa. Inak povedané, transkripcia sledovaných génov by mohla byť znížená alebo zvýšená u buniek s indukovanou bunkovou smrťou, zatiaľ čo ich expresia by bola nezmenená pri kontrole rastu alebo rezistentného kmeňa. Avšak v prípade rezistentného kmeňa bude treba zvážiť prípadnú zmenu expresie súvisiacu s vývojom adaptívnej rezistencie. Henry et al. popísali detekciu génov podmieňujúcich rezistenciu voči kolistínu u A. baumannii použitím RNA sekvenovania za účelom porovnania transkripčných profilov [42]. Výhodou metódy je získanie obrovského množstva dát. Na druhej strane – dlhý čas sekvenovania, zvýšené náklady a nutnosť spolupráce s bioinformatikmi pri spracovávaní veľkého množstva dát vyzerajú byť kľúčovými aspektami pri využití uvedeného prístupu. Napriek tomu sa predpokladá, že sekvenovanie transkriptómu, ako aj ďalšie formy sekvenovania, ako celogenómové sekvenovaie alebo sekvenovanie novej generácie poskytnú v blízkej budúcnosti nové možnosti na predikciu rezistencie.
ZÁVER
Nakoľko je získanie výsledkov testovania citlivosti baktérií na antibiotiká časovo náročné, je tu pretrvávajúca snaha o vývoj skoršej a citlivejšej detekcie rezistentných baktérií. Testovanie citlivosti založenej na detekcii markerov bunkovej smrti pomocou kvantitatívnej real-time PCR, ako aj ostatných prístupov zameraných na štúdiu mRNA expresie (mikročipy, RNA sekenovanie) sa zdajú byť sľubným nástrojom na testovanie citlivosti baktérií na antibiotiká. Samotný postup by vyžadoval použitie viac ako 105 buniek na experiment. Predpokladané sú stredné náklady, pričom samotný princíp by mohol byť manuálny alebo automatický. Ostáva však ešte overiť daný princíp, jeho senzitivitu a špecificitu. Identifikácia týchto markerov by nám mohla umožniť včasné stanovenie citlivosti/rezistencie voči antibiotikám u baktérií pochádzajúcich z klinických vzoriek. Metódy založené na tomto princípe by sa mohli stať v blízkej budúcnosti cennou alternatívou k už existujúcim metódam fenotypového testovania citlivosti v klinických laboratóriách, a tak pomôcť pri začatí cielenej antibiotickej liečby. V neposlednom rade, nakoľko je celá dráha bakteriálnej odpovedi na antibiotikami sprostredkovanú bunkovú smrť komplexná a nie dobre známa, lepšie porozumenie a charakterizácia dráh bunkovej smrti u bakterií, mechanizmu rezistencie, bakteriálnej odpovedi na antibiotiká, ako aj identifikácia apoptóze-podobných markerov, by mohli pomôcť pri pochopení a čelení narastajúcej vlne bakteriálnych kmeňov odolných voči dostupnej antibiotickej liečbe, ako aj pri vývoji nových a účinnejších antimikrobiálnych zlúčenín.
Poďakovanie
Táto publikácia bola podporovaná výskumným grantom CZ.1.07/2.3.00./30.0004.
Do redakce došlo dne 2. 9. 2015.
Adresa pro korespondenci:
Mgr. Patrik Mlynárčik, PhD.
Ústav mikrobiologie, LF UP v Olomouci
Hněvotínská 3
775 15 Olomouc
e-mail: patrik.mlynarcik@upol.cz
Zdroje
1. Choi M-J, Ko KS. Mutant prevention concentrations of colistin for Acinetobacter baumannii, Pseudomonas aeruginosa and Klebsiella pneumoniae clinical isolates. J Antimicrob Chemother, 2014;69(1):275–277.
2. Canton R, Akova M, Carmeli Y, et al. Rapid evolution and spread of carbapenemases among Enterobacteriaceae in Europe. Clin Microbiol Infect, 2012;18(5):413–431.
3. Cornaglia G, Akova M, Amicosante G, et al. Metallo-beta-lactamases as emerging resistance determinants in Gram-negative pathogens: open issues. Int J Antimicrob Agents, 2007;29(4):380–388.
4. Bou G, Martinez-Beltran J. Cloning, nucleotide sequencing, and analysis of the gene encoding an AmpC beta-lactamase in Acinetobacter baumannii. Antimicrob Agents Chemother, 2000;44(2):428–432.
5. Endimiani A, Luzzaro F, Migliavacca R, et al. Spread in an Italian hospital of a clonal Acinetobacter baumannii strain producing the TEM-92 extended-spectrum beta-lactamase. Antimicrob Agents Chemother, 2007;51(6):2211–2214.
6. Muller C, Plesiat P, Jeannot K. A two-component regulatory system interconnects resistance to polymyxins, aminoglycosides, fluoroquinolones, and beta-lactams in Pseudomonas aeruginosa. Antimicrob Agents Chemother, 2011;55(3):1211–1221.
7. Wang M, Borris L, Aarestrup FM, et al. Identification of a Pseudomonas aeruginosa co-producing NDM-1, VIM-5 and VIM-6 metallo-beta-lactamases in Denmark using whole-genome sequencing. Int J Antimicrob Agents, 2015;45(3):324–325.
8. Cernohorska L, Slavikova P. Antibiotic resistance and biofilm formation in Pseudomonas aeruginosa strains isolated from patients with urinary tract infections. Epidemiol Mikrobiol Imunol, 2009;58(4):154–157.
9. Moker N, Dean CR, Tao J. Pseudomonas aeruginosa increases formation of multidrug-tolerant persister cells in response to quorum-sensing signaling molecules. J Bacteriol, 2010;192(7):1946–1955.
10. Overhage J, Bains M, Brazas MD, et al. Swarming of Pseudomonas aeruginosa is a complex adaptation leading to increased production of virulence factors and antibiotic resistance. J Bacteriol, 2008;190(8):2671–2679.
11. Khakimova M, Ahlgren HG, Harrison JJ, et al. The stringent response controls catalases in Pseudomonas aeruginosa and is required for hydrogen peroxide and antibiotic tolerance. J Bacteriol, 2013;195(9):2011–2020.
12. Hrabak J, Walkova R, Studentova V, et al. Carbapenemase activity detection by matrix-assisted laser desorption ionization-time of flight mass spectrometry. J Clin Microbiol, 2011; 49(9):3222–3227.
13. Mlynarcik P, Kolar M, Roderova M. New technologies for antibiotic susceptibility testing of bacteria. Klin Mikrobiol Infekc Lek, 2014;20(3):72–78.
14. Kerr JF, Wyllie AH, Currie AR. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. Br J Cancer, 1972;26(4):239–257.
15. Dwyer DJ, Camacho DM, Kohanski MA, et al. Antibiotic-induced bacterial cell death exhibits physiological and biochemical hallmarks of apoptosis. Mol Cell, 2012;46(5):561–572.
16. Drlica K, Malik M, Kerns RJ, et al. Quinolone-mediated bacterial death. Antimicrob Agents Chemother, 2008;52(2):385–392.
17. Floss HG, Yu T-W. Rifamycin-mode of action, resistance, and biosynthesis. Chem Rev, 2005;105(2):621–632.
18. Tomasz A. The mechanism of the irreversible antimicrobial effects of penicillins: how the beta-lactam antibiotics kill and lyse bacteria. Annu Rev Microbiol, 1979;33 : 113–137.
19. Vakulenko SB, Mobashery S. Versatility of aminoglycosides and prospects for their future. Clin Microbiol Rev, 2003;16(3):430–450.
20. Dwyer DJ, Kohanski MA, Collins JJ. Role of reactive oxygen species in antibiotic action and resistance. Curr Opin Microbiol, 2009;12(5):482–489.
21. Kohanski MA, Dwyer DJ, Hayete B, et al. A common mechanism of cellular death induced by bactericidal antibiotics. Cell, 2007;130(5):797–810.
22. Dixon SJ, Stockwell BR. The role of iron and reactive oxygen species in cell death. Nat Chem Biol, 2014;10(1):9–17.
23. Kohanski MA, Dwyer DJ, Wierzbowski J, et al. Mistranslation of membrane proteins and two-component system activation trigger antibiotic-mediated cell death. Cell, 2008;135(4):679–690.
24. Keren I, Wu Y, Inocencio J, et al. Killing by bactericidal antibiotics does not depend on reactive oxygen species. Science, 2013;339(6124):1213–1216.
25. Allison KR, Brynildsen MP, Collins JJ. Metabolite-enabled eradication of bacterial persisters by aminoglycosides. Nature, 2011;473(7346):216–220.
26. Dwyer DJ, Belenky PA, Yang JH, et al. Antibiotics induce redox-related physiological alterations as part of their lethality. Proc Natl Acad Sci USA, 2014;111(20):E2100–E2109.
27. Breidenstein EB, Khaira BK, Wiegand I, et al. Complex ciprofloxacin resistome revealed by screening a Pseudomonas aeruginosa mutant library for altered susceptibility. Antimicrob Agents Chemother, 2008;52(12):4486–4491.
28. Nguyen D, Joshi-Datar A, Lepine F, et al. Active starvation responses mediate antibiotic tolerance in biofilms and nutrient-limited bacteria. Science, 2011;334(6058):982–986.
29. Butala M, Zgur-Bertok D, Busby SJW. The bacterial LexA transcriptional repressor. Cell Mol Life Sci, 2009;66(1):82–93.
30. Erental A, Sharon I, Engelberg-Kulka H. Two programmed cell death systems in Escherichia coli: an apoptotic-like death is inhibited by the mazEF-mediated death pathway. PLoS Biol, 2012;10(3):e1001281.
31. Kolodkin-Gal I, Engelberg-Kulka H. Induction of Escherichia coli chromosomal mazEF by stressful conditions causes an irreversible loss of viability. J Bacteriol, 2006;188(9):3420–3423.
32. Belitsky M, Avshalom H, Erental A, et al. The Escherichia coli extracellular death factor EDF induces the endoribonucleolytic activities of the toxins MazF and ChpBK. Mol Cell, 2011;41(6):625–635.
33. Pandey DP, Gerdes K. Toxin-antitoxin loci are highly abundant in free-living but lost from host-associated prokaryotes. Nucleic Acids Res, 2005;33(3):966–976.
34. Yeom J, Imlay JA, Park W. Iron homeostasis affects antibiotic-mediated cell death in Pseudomonas species. J Biol Chem, 2010;285(29):22689–22695.
35. Aizenman E, Engelberg-Kulka H, Glaser G. An Escherichia coli chromosomal "addiction module" regulated by guanosine [corrected] 3',5'-bispyrophosphate: a model for programmed bacterial cell death. Proc Natl Acad Sci USA, 1996;93(12):6059–6063.
36. Pepper ED, Farrell MJ, Nord G, et al. Antiglycation effects of carnosine and other compounds on the long-term survival of Escherichia coli. Appl Environ Microbiol, 2010; 76(24):7925–7930.
37. Goltermann L, Good L, Bentin T. Chaperonins fight aminoglycoside-induced protein misfolding and promote short-term tolerance in Escherichia coli. J Biol Chem, 2013;288(15): 10483–10489.
38. Carmona-Gutierrez D, Kroemer G, Madeo F. When death was young: an ancestral apoptotic network in bacteria. Mol Cell, 2012;46(5):552–554.
39. Martin-Pena R, Dominguez-Herrera J, Pachon J, et al. Rapid detection of antibiotic resistance in Acinetobacter baumannii using quantitative real-time PCR. J Antimicrob Chemother, 2013;68(7):1572–1575.
40. van Belkum A, Dunne WM, Jr. Next-generation antimicrobial susceptibility testing. J Clin Microbiol, 2013;51(7):2018–2024.
41. Hood MI, Becker KW, Roux CM, et al. genetic determinants of intrinsic colistin tolerance in Acinetobacter baumannii. Infect Immun, 2013;81(2):542–551.
42. Henry R, Vithanage N, Harrison P, et al. Colistin-resistant, lipopolysaccharide-deficient Acinetobacter baumannii responds to lipopolysaccharide loss through increased expression of genes involved in the synthesis and transport of lipoproteins, phospholipids, and poly-beta-1,6-N-acetylglucosamine. Antimicrob Agents Chemother, 2012;56(1):59–69.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2016 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Multiple-locus variable number tandem repeat analýza souboru kmenů Bordetella pertussis v ČR z období 1967–2015: rozšíření varianty adaptované na proočkovanou populaci
- Zlepšení diagnostického přístupu použitím rekombinantních antigenů v detekci intratekální produkce protilátek IgM/IgG u dětí s lymeskou neuroboreliózou
-
Výskyt klíštěte obecného Ixodes ricinus a významných patogenů jím přenášených ve vybraných oblastech se zvýšeným počtem onemocnění klíšťovou encefalitidou v různých nadmořských výškách v České republice
Část I. Klíště obecné Ixodes ricinus a virus klíšťové encefalitidy - Vliv kyslíku na produkci endotoxinu u bakterií ze skupiny Bacteroides fragilis group izolovaných od pacientů s kolorektálním karcinomem
- Rozdíly ve fosforylaci Akt v CD4+ lymfocytech u patogenní a nepatogenní infekce SIV
- Popis familiární formy Creutzfeldt-Jakobovy nemoci
- Pamiatke Charlesa Nicolla, nositeľa Nobelovej ceny za fyziológiu a medicínu
- Kulaté narozeniny doc. Bohumíra Kříže
- Prestižní ocenění Světové organizace pro zdraví zvířat (OIE) získal letos za zásluhy v boji proti vzteklině poprvé v historii český veterinární lékař MVDr. Oldřich Matouch, CSc.
- Nové přístupy v kontrole vzestupu počtu onemocnění pertusí
- Pandemie infekce virem hepatitidy C
- Některé aspekty imunitního systému v patogenezi Alzheimerovy choroby
- Detekcia markerov bunkovej smrti ako nástroj na testovanie citlivosti baktérií na antibiotiká
- Molekulární a antigenní analýza hemaglutininu virů chřipky A H3N2 detekovaných v České republice v epidemické sezoně 2014/2015
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Popis familiární formy Creutzfeldt-Jakobovy nemoci
- Nové přístupy v kontrole vzestupu počtu onemocnění pertusí
-
Výskyt klíštěte obecného Ixodes ricinus a významných patogenů jím přenášených ve vybraných oblastech se zvýšeným počtem onemocnění klíšťovou encefalitidou v různých nadmořských výškách v České republice
Část I. Klíště obecné Ixodes ricinus a virus klíšťové encefalitidy - Vliv kyslíku na produkci endotoxinu u bakterií ze skupiny Bacteroides fragilis group izolovaných od pacientů s kolorektálním karcinomem
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



