-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vliv lipofosfonoxinů na inhibici bakteriální kolonizace kostních cementů
Effect of lipophosphonoxins on inhibition of bacterial colonization of bone cements
Objective:
The study aimed at determining the ability of lipophosphonoxin DR5026 to inhibit the formation of bacterial biofilm on the bone cement surface and assessing potential development of bacterial resistance.Material and methods:
Bone cement (Hi-Fatigue Bone Cement 2x40, aap Biomaterials GmbH, Germany) was polymerized with lipophosphonoxin DR5026. Cement samples were cultured using bacterial suspension containing Staphylococcus epidermidis CCM7221 at an inoculum density of 106 CFU/mL. After three, 24, and 48 hours of incubation at 35 °C, the number of bacteria adhered to the sample was measured and their growth curve was plotted. In 14 cycles, strains of Staphylococcus aureus, Enterococcus faecalis, Pseudomonas aeruginosa, and Streptococcus agalactiae were exposed to subinhibitory concentrations of DR5026 and the minimum inhibitory concentrations (MICs) were determined.Results:
After three hours of culture in the bacterial inoculum with an initial concentration of 106 CFU/mL, the number of colonies isolated from the cement sample treated with DR5026 was smaller by two orders of magnitude when compared to a control cement sample. After 24 and 48 hours of incubation, the number of CFU remained at 50 in the treated cement, whereas 109 CFU were cultured from control cement samples. The plotted growth curves for bacteria adhered to cements clearly showed the inhibitory effect of lipophosphonoxin on their growth and multiplication, particularly after 48 hours. Following 14 cycles of repeated exposure to subinhibitory concentrations of DR5026, no increase in MICs was noted in the tested strains.Conclusion:
Lipophosphonoxin DR5026 used to treat bone cement was found to have antibacterial effects and to inhibit the formation of bacterial biofilm. Repeated exposure of the tested bacteria to subinhibitory concentrations of the above lipophosphonoxin did not induce their resistance or increase their MICs.Key words:
bone cement – joint replacement infections – lipophosphonoxins – antibacterial effect – biofilm
Autoři: R. Večeřová 1; K. Bogdanová 1; D. Rejman 2; J. Gallo 3; M. Kolář 1
Působiště autorů: Ústav mikrobiologie LF UP v Olomouci 1; Ústav organické chemie a biochemie AV ČR v. v. i. 2; Ortopedická klinika FNOL a LF UP v Olomouci 3
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 65, 2016, č. 3, s. 171-176
Kategorie: Původní práce
Souhrn
Cíl práce:
Cílem práce bylo stanovení schopnosti lipofosfonoxinu DR5026 inhibovat tvorbu bakteriálního biofilmu na povrchu kostního cementu a posoudit možnost vývoje bakteriální rezistence.Materiál a metodika:
Kostní cement (Hi-Fatigue Bone Cement 2x 40, aap Biomaterials GmbH, Germany) byl polymerizován s lipofosfonoxinem DR5026. Vzorky cementů byly kultivovány s bakteriální suspenzí Staphylococcus epidermidis CCM7221 o hustotě inokula 106 CFU/ml. Po inkubaci 3, 24 a 48 hodin při 35 °C byl vyhodnocen počet bakterií adherovaných na vzorku a byla stanovena jejich růstová křivka. Kmeny Staphylococcus aureus, Enterococcus faecalis, Pseudomonas aeruginosa a Streptococcus agalactiae byly ve 14 cyklech vystaveny subinhibičním koncentracím DR5026 a byly sledovány minimální inhibiční koncentrace (MIC).Výsledky:
Po 3 hodinách kultivace v bakteriálním inokulu o iniciální koncentraci 106 CFU/ml byl počet izolovaných kolonií z cementového vzorku s DR5026 o 2 řády nižší než z kontrolního cementového vzorku. Po 24 a 48 hodinách inkubace zůstává počet CFU u ošetřeného cementu 50, zatímco z kontrolních cementů bylo vykultivováno 109 CFU. Při sestavení růstových křivek bakterií adherovaných na cementech je patrný inhibiční vliv lipofosfonoxinu na jejich růst a množení, zvláště po 48 hodinách. Po 14 cyklech opakované expozice subinhibičním koncentracím DR5026 nedošlo u testovaných kmenů k navýšení MIC.Závěr:
Byl prokázán antibakteriální účinek lipofosfonoxinu DR5026 ve vazbě na kostní cement a inhibice tvorby bakteriálního biofilmu. Opakované vystavení testovaných bakterií subinhibičním koncentracím použitého lipofosfonoxinu nevedlo k indukci rezistence, respektive ke zvýšení MIC.Klíčová slova:
kostní cement – infekce kloubních náhrad – lipofosfonoxiny – antibakteriální účinek – biofilmÚVOD
Jako kostní cement se v ortopedii označuje polymetylmetakrylát (PMMA), který vzniká polymerizační reakcí po smíchání práškové směsi PMMA a tekutého monomeru. V ortopedické praxi je využíván již přes 60 let v různých indikacích. Používá se běžně k fixaci kloubních náhrad, při terapii kostních nádorů, kostních a kloubních infekcí. Z biomechanického hlediska je důležitá především pevnost tohoto materiálu v kompresi. Při léčbě infekcí je významná schopnost PMMA absorbovat a poté postupně uvolňovat antibiotika.
Infekce kloubní náhrady (IKN) je jednou z nejčastějších časných komplikací endoprotetiky. Odhaduje se, že postihuje 1–5 % všech pacientů po primární endoprotéze, u reoperací je pravděpodobnost vzniku IKN ještě vyšší [24]. Typicky se manifestuje v průběhu 3–12 měsíců od operace. V poslední době se objevují práce poukazující na vyšší incidenci, než se uvádělo dříve [31]. IKN představuje závažný problém nejen v kontextu dopadu na pacienta, ale také v souvislosti s vysokou finanční náročností léčby [9]. Vznik IKN je multifaktoriální, ačkoliv ke kontaminaci rány dojde nejčastěji na operačním sále. Významnou roli hraje celkový stav hostitele (např. stav imunity, předchozí infekce, diabetes mellitus) a především jeho imunitního systému, který se zřejmě u pacientů s IKN není schopen ubránit bakteriální expozici spojené s operačním výkonem. Důležitou roli sehrávají vlastnosti původce, virulence, citlivost k antimikrobiálním látkám a schopnost adherovat na cizorodé povrchy [9, 27]. Na povrchu kostních cementů vytváří bakterie celkem snadno biofilm, v němž adherují k povrchu a produkují polysacharidovou hmotu, která je obklopuje. Vznikají složité struktury připomínající tkáně vyšších organismů. Bakterie v biofilmu jsou chráněny proti zásahům imunitního systému hostitele a rovněž jsou odolnější k antibiotické léčbě než planktonické buňky [30]. Standardní antibiotická léčba účinná při ostatních infekcích, jako jsou např. pneumonie, při léčbě IKN selhává. Nejčastěji izolované agens u IKN jsou stafylokoky a streptokoky [27, 20]. Tande ve své přehledové práci hodnotící celkem 2 435 případů IKN uvádí výskyt grampozitivních bakteriálních původců v 69 % (Staphylococcus aureus 27 %, koaguláza negativní Staphylococcus sp. 27 %, Streptococcus sp. 8 %, Enterococcus sp. 3 %, Propionibacterium acnes 4 %), gramnegativní tyčky byly zachyceny v 9 %, polymikrobiální infekce v 15 %. [24]. Velmi podobnou strukturu bakteriálních původců uvádí i jiní autoři [10, 19].
Nejlepší strategií v boji s bakteriální IKN zůstává prevence. Jedním z nejefektivnějších postupů je kombinovat celkové a lokální podání antibiotika v kostním cementu. Kostní cement s navázanou antibakteriální látkou si však musí mimo vlastní antibakteriální aktivitu zachovat mechanickou odolnost a biokompatibilitu. Množství přidané antimikrobiální susbstance je tedy limitováno. Výhodou cementů kombinovaných s antibiotiky je dosažení vysoké lokální koncentrace antibiotika bez rizika celkových komplikací a toxicity, čehož nelze dosáhnout při systémové aplikaci [4]. V praxi se pro prevenci a terapii infekcí muskoskeletárního aparátu používá například kostní cement obohacený gentamicinem (Palacos R + G, Hi-Fatigue G, Cemex Genta aj.), erytromycinem a kolistinem (Simplex PE + C), vankomycinem a gentamicinem (Vankogen X) nebo klindamycinem (Copal) [8].
Možným rizikem při používání kostních cementů s antimikrobiální látkou je vznik bakteriální rezistence. Po aplikaci cementu jsou organismus hostitele i bakterie vystaveny dlouhodobé expozici antimikrobiální látky. Antibiotika se z kostního cementu uvolňují dlouhodobě, ale eluce dostatečně vysokých účinných koncentrací probíhá pouze v několika prvních dnech po aplikaci cementu. Množství a doba eluce antibiotika z cementu je ovlivněna typem cementu, jeho povrchem, zpracováním, podmínkami prostředí a v neposlední řadě typem a množstvím přidaného antibiotika [4, 8, 18]. Dlouhodobé uvolňování subinhibičních koncentrací antibiotika představuje ideální podmínky pro selekci bakteriální rezistence [4, 17].
Z důvodu rostoucí rezistence bakterií na antimikrobiální léčiva je nutné hledat jiné možnosti a postupy v prevenci a léčbě IKN. Lipofosfonoxiny jsou nedávno objevené látky, u kterých byla zjištěna antibakteriální aktivita proti grampozitivním bakteriím, na které působí baktericidně destrukcí cytoplazmatické membrány [21]. Jsou to uměle vytvořené modulární látky vycházející ze struktury fosfonoxinů [26], skládají se ze čtyř strukturních modulů: nukleosid, iminocukr, hydrofobní lipofilní alkylový řetězec a spojovací fosfonát [22], který spojuje jednotlivé moduly (schéma 1).
Schéma 1. Modulární struktura lipofosfonoxinů Scheme 1. Modular structure of lipophosphonoxins 
K účinným lipofosfonoxinům patří látka DR5026 (schéma 2) vykazující antibakteriální aktivitu proti grampozitivním bakteriím včetně multirezistentních kmenů, jako jsou vankomycin-rezistentní Enterococcus faecium nebo methicilin-rezistentní Staphylococcus aureus [21].
Schéma 2. Struktura lipofosfonoxinu DR5026 Scheme 2. Structure of lipophosphonoxin DR5026 
Cíl práce
Cílem předložené práce bylo stanovení schopnosti látky DR5026 inhibovat tvorbu bakteriálního biofilmu na povrchu kostního cementu a posoudit možnost vývoje bakteriální rezistence.
MATERIÁL A METODY
Za sterilních podmínek byl připraven kostní cement (Hi-Fatigue Bone Cement 2x 40, aap Biomaterials GmbH, Germany) s testovaným lipofosfonoxinem DR5026 (Ústav organické chemie a biochemie AV ČR v. v. i.). Bylo smícháno 300 mg DR5026 s 5 g kostního cementu a polymerizováno přidáním 2,5 ml polymerizačního média. Z připraveného cementu byly vytvarovány kuličky o průměru cca 5 mm. Jako kontrola byl použit cement, který byl připraven ze stejné výrobní šarže, avšak bez přidané antimikrobiální látky.
Christensenovou metodou byla u kmene Staphylococcus epidermidis CCM7221 (Česká sbírka mikroorganismů, Brno; pozitivní kontrola pro detekci tvorby biofilmu a ica operonu) ověřena schopnost tvorby biofilmu statickou kultivací v kultivačním mediu (Brain heart infusion, HIMEDIA, s 0,5 % glukózy) při 35 °C [6, 23, 25]. Testování bylo provedeno v mikrotitrační destičce typu P (GAMEDIA). Počáteční koncentrace inokula odpovídala 106 CFU/ml. Po 24hodinové inkubaci při 35 °C byla destička šetrně promyta vodou a utvořený biofilm byl fixován přidáním 200 μl 99% metanolu na dobu 15 minut. Po odsátí a vyschnutí byly jamky nabarveny přidáním 160 μl 1% krystalové violeti na dobu 10 minut, důkladně promyty vodou a fixované barvivo rozpuštěno přidáním 160 μl 33% kyseliny octové. Intenzita zbarvení byla hodnocena spektrofotometricky při vlnové délce 570 nm. Silná produkce biofilmu je potvrzena, pokud optická denzita zbarvení čtyřnásobně překročí optickou denzitu negativní kontroly zvětšenou o 3 směrodatné odchylky vypočítané ze 4 měření. Jako negativní kontrola bylo použito kultivační médium bez bakterie [25].
Antibakteriální účinnost látky DR5026 u Staphylococcus epidermidis CCM7221 byla testována pomocí standardní diluční mikrometody určením minimální inhibiční koncentrace (MIC) potřebné k inhibici růstu bakterie a minimální baktericidní koncentrace (MBC) potřebné k usmrcení. Testování bylo prováděno v mikrotitračních destičkách, vzorky byly ředěny geometrickou řadou v kultivačním médiu (Brain heart infusion, HIMEDIA) na koncentrace 200–1,56 mg/l. Do destiček bylo očkováno standardní množství testovaného mikroba – hustota inokula odpovídala 106 CFU/ml. Po 24hodinové inkubaci při 35 °C byla odečtena MIC jako nejnižší koncentrace testované látky, která inhibovala viditelný růst mikroorganismu. Jamky bez viditelného růstu byly inokulovány na krevní agar pro stanovení MBC [14, 29].
Pro sledování počtu a aktivity adherovaných buněk na kostních cementech byly vzorky umístěny do 12jamkových panelů a zality 3 ml kultivačního média s bakteriální suspenzí Staphylococcus epidermidis CCM7221. Počáteční hustota bakteriálního inokula odpovídala 106 CFU/ml. Následovala statická inkubace po dobu 3, 24 a 48 hodin, poté byly vzorky z jamek vyjmuty, třikrát opláchnuty sterilním fyziologickým roztokem a umístěny do 2 ml kultivačního média (Brain heart infusion, HIMEDIA, s 0,5 % glukózy) ve zkumavce. Pro uvolnění adherovaných buněk následovala sonikace a důkladné roztřepání. Do jamek sterilní mikrotitrační destičky bylo následně přeneseno 100 µl sonikovaného kultivačního média a destička byla umístěna do spektrofotometru se zabudovaným inkubátorem. Statická inkubace probíhala 24 hodin při 35 °C, v intervalu 1 hodiny byla po dvouminutovém roztřepání měřena optická denzita (OD) při 630 nm. Ze získaných hodnot byla sestavena růstová křivka [1]. Zároveň bylo 100 µl sonikovaného média přeneseno na MH agar (Trios) a rozetřeno inokulační hokejkou. Po 24hodinové inkubaci při 35 °C byly spočítány narostlé kolonie.
K testování indukce rezistence, respektive zvýšení hodnot MIC, byly použity kmeny Staphylococcus aureus CCM4223, Enterococcus faecalis CCM4224, Pseudomonas aeruginosa CCM3955 (Česká sbírka mikroorganismů, Brno) a Streptococcus agalactiae AV2006 (sbírka Ústavu mikrobiologie LF UP v Olomouci). Minimální inhibiční koncentrace látky DR5026 u testovaných bakteriálních kmenů byly stanoveny opět standardní diluční mikrometodou [14, 29].
Indukce rezistence byla provedena v mikrotitrační destičce opakovanou expozicí výše uvedených bakteriálních kmenů subinhibičním koncentracím testované látky DR5026, která byla v kultivačním médiu (Brain heart infusion, HIMEDIA) exponenciálně naředěna na koncentrace 1,6–200 mg/l. Připravené destičky byly skladovány při -20 °C. Do rozmražené mikrotitrační desky byl inokulován příslušný bakteriální kmen. Konečná koncentrace inokula v jamce byla 106 CFU/ml. Destičky byly inkubovány při 35 °C po dobu 24 hodin. Po inkubaci bylo 10 µl bakteriální suspenze z jamky s nejvyšší subinhibiční koncentrací testované látky vyočkováno na krevní agar a inkubováno 24 hodin při 35 °C. Získané bakterie byly použity pro další cyklus. Popsaný postup představuje 1 cyklus indukce rezistence a celkem bylo provedeno 14 cyklů. Po posledním cyklu byla stanovena MIC původního kmene a srovnána s MIC po indukci [11].
Jako kontrolní látka pro indukci vzniku rezistence byl použit ciprofloxacin, ke kterému vzniká rezistence velmi rychle [12, 15]. Ciprofloxacin byl testován za stejných podmínek v koncentracích 0,06–8 mg/l.
VÝSLEDKY
Inhibice tvorby biofilmu
Christensenovou metodou byla za použitých podmínek u Staphylococcus epidermidis CCM7221 potvrzena silná produkce biofilmu. Minimální inhibiční koncentrace látky DR5026 byla stanovena na 12,5 mg/l a odpovídala hodnotě minimální baktericidní koncentrace.
Počet bakterií uvolněných pomocí sonikace a roztřepání biofilmu z testovaného cementu se lišil v závislosti na době inkubace. Po tříhodinové inkubaci kostního cementu kombinovaného s látkou DR5026 bylo z cementové kuličky uvolněno 50 CFU Staphylococcus epidermidis CCM7221, zatímco z neošetřeného cementu bylo vykultivováno 103 CFU. Po 24 - a 48hodinové expozici zůstával počet kolonií u ošetřeného cementu 50 CFU, zatímco u kontrolního neošetřeného cementu dosahoval hodnot 109 CFU.
Získané růstové křivky potvrzují antibakteriální účinek látky DR5026 (grafy 1–3). Po tříhodinové inkubaci cementů v hustém bakteriálním inokulu odpovídajícím koncentraci 106 CFU/ml dochází na cementu s obsahem látky DR5026 k opožděnému nárůstu bakteriální masy. Exponenciální fáze růstové křivky u neošetřeného cementu nastává po 7 hodinách, zatímco u cementu s obsahem látky DR5026 až po 15 hodinách (graf 1). Stejný efekt je patrný i v případě cementů inkubovaných s bakteriální suspenzí po dobu 24 hodin (graf 2). Po 48hodinové inkubaci cementové kuličky s obsahem látky DR5026 dochází jednak k opoždění nástupu exponenciální fáze růstu a dále ke snížení nárůstu bakteriální masy pod hodnotou kontroly, optická denzita bakteriální masy je nižší o 38 % oproti kontrole (graf 3).
Graf 1. Růstová křivka <i>Staphylococcus epidermidis</i> uvolněného z cementu po 3 hodinách inkubace Figure 1. Growth curve of <i>Staphylococcus epidermidis</i> released from cement after three hours of incubation 
Graf 2. Růstová křivka <i>Staphylococcus epidermidis</i> uvolněného z cementu po 24 hodinách inkubace Figure 2. Growth curve of <i>Staphylococcus epidermidis</i> released from cement after 24 hours of incubation 
Graf 3. Růstová křivka <i>Staphylococcus epidermidis</i> uvolněného z cementu po 48 hodinách inkubace Figure 3. Growth curve of <i>Staphylococcus epidermidis</i> released from cement after 48 hours of incubation 
Indukce rezistence
MIC látky DR5026 byla u Staphylococcus aureus CCM4223 stanovena na 25 mg/l, v případě Enterococcus faecalis CCM4224 činila 6,2 mg/l, u Pseudomonas aeruginosa CCM3955 > 200 mg/l a Streptococcus agalactiae AV2006 3,1 mg/l. Po 14 krocích opakované expozice testovaných bakterií subinhibičním koncentracím se hodnoty MIC látky DR5026 nezměnily (tab. 1). Naopak u ciprofloxacinu byl zaznamenán rozdíl, MIC původního kmene Pseudomonas aeruginosa byla 0,25 mg/l, po indukci dosáhla hodnoty 4 mg/l. Opakovaná expozice kmene Staphylococcus aureus subinhibičním koncentracím ciprofloxacinu rovněž vedla ke vzniku rezistence, respektive zvýšení MIC z 0,1 mg/l na 2 mg/l (viz tab. 1).
Tab. 1. Výsledky MIC testovaných bakterií před indukcí a po ní Table 1. MICs of tested bacteria prior to and after induction 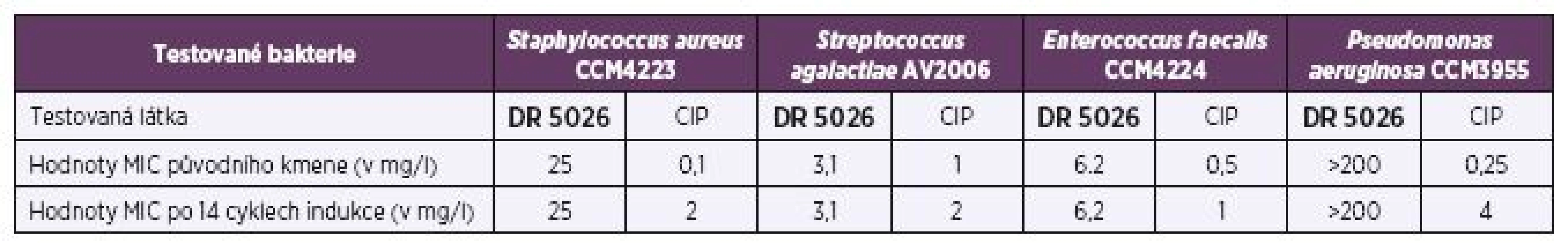
Legenda: CIP – ciprofloxacin, MIC – minimální inhibiční koncentrace DISKUSE
V předložené studii byl prokázán in vitro silný antibakteriální a antibiofilmový efekt kostního cementu obohaceného látkou ze skupiny lipofosfonoxinů. K demonstraci efektu byl použit koaguláza-negativní stafylokok, potenciálně nejzávažnější původce IKN. Jedná se o první studii popisující zmiňovaný účinek lipofosfonoxinů v ortopedické aplikaci.
Lipofosfonoxin v kombinaci s kostním cementem by mohl být potenciálně významnou alternativou k dnes široce využívaným antibiotikům. Antibiotika jsou do kostního cementu přidávána již více než 40 let [5] a jejich účinnost byla opakovaně doložena [2]. Významnou výhodou antibiotiky obohaceného cementu je dosažení vysoké lokální koncentrace, které by nebylo možné dosáhnout při systémové aplikaci. Používání cementů s antibiotiky má však i své nevýhody. Množství přidaného antibiotika je limitováno biomechanickými vlastnostmi cementu [4]. Problémem může být i volba antibiotika, protože nelze předem odhadnout, jaká bakterie se bude podílet na infekci a jakou bude mít citlivost [17]. Některá antibiotika, například gentamicin, jsou nefrotoxická a nelze predikovat, zda se u pacienta s antibiotickým cementem v budoucnu nerozvine renální selhání [28]. Významným faktorem je také uvolňování antibiotika z cementu. Gallo et al. ve své práci prokázali, že z kostního cementu Vancogen X se uvolňuje vankomycin i gentamicin, a to po dobu 8 dní [8]. S dlouhodobým uvolňováním subinhibičních koncentrací antibiotik narůstá riziko selekce rezistentních kmenů [4, 13, 16]. Corona et al. popisují signifikantně vyšší výskyt grampozitivních koků rezistentních k aminoglykosidům (gentamicinu a tobramycinu), pokud byl použit cement s obsahem aminoglykosidů [7].
Z výše zmíněných důvodů je vyvíjena celá řada strategií a protiinfekčních povrchových úprav ortopedických materiálů, od prevence bakteriální adheze a adsorpce, přes baktericidní povrchy na bázi kovů, organických či anorganických látek až k takzvaným „chytrým“ povrchům [9]. Byly publikovány práce hodnoticí antibakteriální a antibiofilmové vlastnosti PMMA obohaceného chitosanem, stříbrem, antibakteriálními peptidy a dalšími látkami [3]. Největším problémem není antibakteriální a antibiofilmový efekt uvedených látek, ale dosažení těchto účinků na povrchu PMMA a v jeho bezprostředním okolí (pokrytí tzv. mrtvého prostoru) při uchování biokompatibility takto upraveného kostního cementu. V případě PMMA pro preventivní účely musí být současně zachovány také požadované mechanické vlastnosti materiálu.
Lipofosfonoxiny nejsou registrované pro použití v humánní medicíně. Jedná se o nově objevené látky s prokázanou účinností proti grampozitivním bakteriím včetně rezistentních kmenů [21], které představují slibnou možnost dalšího vývoje nejen v oblasti prevence IKN. Byl prokázán antibiofilmový účinek látky DR5026, a ani po 14 cyklech nedošlo ke zvýšení hodnot MIC této látky u testovaných bakterií. Získané výsledky jsou podle našeho názoru jasným důkazem inhibice tvorby biofilmu. Z obohacených kuliček cementu bylo po 3, 24 i 48 hodinách kultivace izolováno na MH agaru vždy 50 kolonií stafylokoka. Tyto uvolněné bakterie se ale chovají odlišně při sledování růstových křivek. Dochází k opožděnému nástupu exponenciální fáze i k nižšímu množství bakteriální masy. Bakterie zůstávají živé, ale je ovlivněn jejich růst a množení. Doba testování pouze 48 hodin byla zvolena záměrně, v klinické praxi má zásadní význam pro vznik IKN prvních několik hodin po operaci [9]. Také z hlediska laboratorního průkazu biofilmu je optimální doba sledování do 48 hodin. Poté může docházet k odlučování biofilmu díky nižší soudržnosti biofilmové vrstvy vlivem regulačního quorum-sensing systému [23].
Zajímavým jevem je tvar růstové křivky stafylokoka na neupraveném cementu. Na konci exponenciální fáze růstu vzniká vlna s vyšší optickou denzitou. Tento jev jsme zaznamenali za stejných testovacích podmínek i v jiných experimentech, ale pouze u stafylokoků. Možným vysvětlením by mohla být změna ve vzájemném uspořádání stafylokoků (dvojice, čtveřice, nepravidelné shluky) při přechodu do stacionární fáze.
Zjištěné údaje však nejsou pro možnosti využití lipofosfonoxinů v této indikaci dostatečné. Cílem publikace bylo upozornit na možnost inhibice bakteriálního biofilmu lipofosfonoxinem I. generace. Jedná se o pilotní studii testování kostního cementu, při jehož přípravě byl do navážky přidán lipofosfonoxin v jedné koncentraci. Zatím nebyl vypracován standardní postup a stanoveno optimální množství lipofosfonoxinu v nosných materiálech. Antimikrobiální vlastnosti „hand-made“ cementů nejsou konstantní, jsou závislé na technice výroby, způsobu míchání a vzniklé konzistenci cementu [19]. Uvolňování z vazby na cement a stanovení koncentrace lipofosfonoxinu v různých prostředích bude předmětem dalšího testování, které plánujeme zároveň s testováním nových generací lipofosfonoxinů.
ZÁVĚR
V řešení IKN mají stále důležitou roli cementy obohacené antibiotiky, ale zároveň jsou rozšiřovány alternativní možnosti s cílem redukovat, nejlépe však zcela eliminovat rizika, která s sebou používání cementů s antibiotiky přinášejí. Slibné řešení přinášejí lipofosfonoxiny, které lze vázat na cementy. Na základě výsledků naší studie byl prokázán antibakteriální účinek lipofosfonoxinu DR5026 ve vazbě na kostní cement a inhibice tvorby bakteriálního biofilmu. Za velmi důležitý lze považovat výsledek, že při opakované expozici bakterií subinhibičním koncentracím použitého lipofosfonoxinu nebyl prokázán vznik bakteriální rezistence. Případnému využití lipofosfonoxinů pro prevenci a léčbu IKN ale musí předcházet další studie týkající se toxicity, eluce a difuze látky z cementu do okolních tkání, způsobu přípravy, stability a v neposlední řadě změn mechanických vlastností obohaceného cementu.
Práce byla podpořena vnitřním grantem LF UP v Olomouci (LF_2015_035) a grantem TA02010035 (TAČR, Technological Agency of the Czech Republic).
Do redakce došlo dne 17. 12. 2015.
Adresa pro korespondenci:
Mgr. Renata Večeřová
Ústav mikrobiologie LF UP v Olomouci
Hněvotínská 3
779 00 Olomouc
e-mail: renata.vecerova@fnol.cz
Zdroje
1. Alt V. In vitro testing of antimicrobial activity of bone cement. Antimicrob Agents Chemother, 2004; 48(11): 4084–4088.
2. Anagnostakos K, Kelm J. Enhancement of antibiotic elution from acrylic bone cement. J Biomed Mater Res B Appl Biomater, 2009; 90(1): 467–475.
3. Arora M, Chan EKS, Gupta S, et al. Polymethylmethacrylate bone cements and additives: A review of the literature. World J Orthop, 2013; 4(2): 67–74.
4. Bistolfi A, Massazza G, Verne E, et al. Antibiotic-loaded cement in orthopaedic Surgery: A review. ISRN Orthopaedics, 2011; 2011 : 8 pages. doi:10.5402/2011/290851.
5. Buchholz HW, Engelbrecht H. Über die Depotwirkung einiger Antibiotica bei Vermischung mit dem Kunstharz Palacos. Chirurg, 1970; 41 : 511–515.
6. Christensen GD, Simpson WA, Younger JJ, et al. Adherence of coagulase-negative staphylococci to plastic tissue culture plates: a quantitative model for the adherence of staphylococci to medical devices. J Clin Microbiol, 1985; 22 (6): 996–1006.
7. Corona PS, Espinal L, Rodriguéz-Pardo D, et al. Antibiotic susceptibility in gram-positive chronic joint arthroplasty infections: Increased amminoglycoside resistance rate in patients with prior aminoglycoside-impregnated cement spacer use. J Arthroplasty, 2014; 28(8): 1617–1621.
8. Gallo J, Bogdanová K, Šiller M et al. Mikrobiologické a farmakologické vlastnosti kostního cementu VancogenX. Acta Chir Orthop Traumatol Cech, 2013; 80 : 69–76.
9. Gallo J, Holinka M, Moucha C. Antibacterial surface treatment for orthopaedic implants. Int J Sci, 2014; 15 : 13849–13880.
10. Gallo J, Kolar M, Dendis M, et al. Culture and PCR analysis of joint fluid in the diagnosis of prosthetic joint infection. New Microbiol, 2008; 154 : 97–104.
11. Gullberg E, Cao S, Berg OG, Ilback C, et al. Selection of resistant bacteria at very low antibiotic concentrations. PLoS Pathog, 2011; 7(7): e1002158.
12. Hanulík V, Htoutou Sedláková M, Petrželová J, et al. Možnosti flourochinolonů v současné klinické praxi. Klin Farmakol a Farm, 2010; 24(4): 184–186.
13. Hope PG, Kristinsson KG, Norman P, et al. Deep infection of cemented total hip arthroplasties caused by coagulase negative staphylococci. J Bone Joint Surg Br, 1989;71 : 851–855.
14. Isenberg HD. Clinical microbiology procedures handbook – 2nd ed. Washington: ASM Press; 2004.
15. Jindrák V, Urbášková P, Nyč O. Fluorochinolony – kriticky ohrožená skupina antibiotik. Practicus, 2007; 6 : 6–11.
16. Jiranek WA, Hansen AD, Greenwald AS. Antibiotic-loaded bone cement for infection prophylaxis in total joint replacement. J Bone Joint Surg Am, 2006; 88(11): 2487–2500.
17. Kühn KD. Release of active ingredients. In: Kühn KD. Bone cements. Berlin: Springer; 2000. s. 253–258.
18. Meyer J, Piller G, Spiegel CA et al. Vacuum-mixing significantly changes antibiotic elution characteristics of commercially available antibiotic-impregnated bone cements. J Bone Joint Surg Am, 2011; 93(22): 2049–2056.
19. Proček T, Ryšková L, Kučera T. Zhodnocení významu ready-made spaceru s gentamicinem ve vztahu k bakteriologickým nálezům u pacientů s infekcí kloubní náhrady. Epidemiol Mikrobiol Imunol, 2014; 63 (2): 142–148.
20. Pulido L, Ghanem E, Joshi A et al. Periprosthetic joint infection, the incidence, timing and predisposing factors. Clin Orthop Relat Res, 2008; 446 : 1710–1715.
21. Rejman D, Rabatinova A, Pombinho AR et al. Lipophosphonoxins: new modular molecular structures with significant antibacterial properties. J Med Chem, 2011; 54(22): 7884–7898.
22. Rosenberg I. Chemie fosfonátových analogů nukleotidů a oligonukleotidů – stručná reminiscence a současnost. Chem Listy, 2014; 108 : 375–386.
23. Růžička F, Holá V, Votava M. Možnosti průkazu tvorby biofilmu v rutinní mikrobiologické praxi. Epidemiol. Mikrobiol. Imunol, 2006; 55 (1): 23–29.
24. Shuman EK, Urqhart A, Malani PN. Management and prevention of prosthetic joint infection. Infect Dis Clin North Am, 2012; 26 : 29–39.
25. Stepanovic S, Vukovic D, Holá V, et al. Quantification of biofilm in microtiter plates: overview of conditions and practical recommendations for assessment of biofilm production by staphylococci. APMIS, 2007; 115 : 891–899.
26. Suk DH, Rejman D, Dykstra CC, et al. Phosphonoxins: rational design and discovery of a potent nucleotide anti-Giardia agent. Bioorg Med Chem Lett, 2007; 17 : 2811–2816.
27. Tande AJ, Patel R. Prosthetic Joint Infection. Clin Microbiol Rev, 2014; 27 : 302–345.
28. Trippel SB. Antibiotic-impregnated cement in total joint arthroplasty. J Bone St Surg Am, 1986; 68 : 129–302.
29. Urbášková P. Diluční metody – obecný postup. In: Urbášková P. Rezistence bakterií k antibiotikům – vybrané metody. Praha: TRIOS; 1998. S. 1.3–1.7.
30. Votava M. Růst bakterií v podobě biofilmu. In: Votava M. Lékařská mikrobiologie obecná. Brno-Jundrov: Neptun; 2005. s. 57.
31. Witso E. The rate of prosthetic joint infection is underestimated in the arthroplasty registers. Acta Orthopaedica, 2015; 86(3): 277–278.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2016 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Avidita vybraných autoprotilátek – přínos jejich stanovení pro klinické účely
- Výskyt virové hepatitidy typu A v Královéhradeckém kraji České republiky v posledním desetiletí
- Vliv lipofosfonoxinů na inhibici bakteriální kolonizace kostních cementů
- Stenotrophomonas maltophilia jako původce ventilátorové pneumonie u pacientky s toxickou epidermální nekrolýzou a klostridiovou kolitidou: čas na off-label podání tigecyklinu?
-
Výskyt klíštěte obecného Ixodes ricinus a významných patogenů jím přenášených ve vybraných oblastech se zvýšeným počtem onemocnění klíšťovou encefalitidou v různých nadmořských výškách v České republice
Část II. Klíště obecné Ixodes ricinus a genospecie komplexu Borrelia burgdorferi sensu lato - Kampylobakterióza v Jihočeském kraji – opakovaný problém
- Epidemie HIV/AIDS v subsaharských regionech na počátku druhé dekády 21. století: regionální specifika na pozadí analýzy dat UNAIDS
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Stenotrophomonas maltophilia jako původce ventilátorové pneumonie u pacientky s toxickou epidermální nekrolýzou a klostridiovou kolitidou: čas na off-label podání tigecyklinu?
- Avidita vybraných autoprotilátek – přínos jejich stanovení pro klinické účely
-
Výskyt klíštěte obecného Ixodes ricinus a významných patogenů jím přenášených ve vybraných oblastech se zvýšeným počtem onemocnění klíšťovou encefalitidou v různých nadmořských výškách v České republice
Část II. Klíště obecné Ixodes ricinus a genospecie komplexu Borrelia burgdorferi sensu lato - Epidemie HIV/AIDS v subsaharských regionech na počátku druhé dekády 21. století: regionální specifika na pozadí analýzy dat UNAIDS
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



