-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Výskyt a analýza případů onemocnění kampylobakteriózou v České republice v letech 1997–2017
Incidence and analysis of campylobacteriosis cases in the Czech Republic in 1997–2017
Aim: The aim of our study was to conduct analysis of reported epidemiological data on human campylobacteriosis in the Czech Republic (CZ) from 1997 to 2017 and to summarize the current knowledge about the disease.
Methods: We conducted a descriptive epidemiological analysis of data on campylobacteriosis cases reported to the national surveillance system of infectious diseases in the CZ (EpiDat) from 1997 to 2017. MS Excel 2010 and statistical program R were used for data management and analysis. The incidence maps were created using the ECDC Map Maker tool (EMMa).
Results: Overall, 411 699 campylobacteriosis cases (average annual incidence of 188.9/ 100 000) were reported in the CZ from 1997 to 2017. Between 1997 and 2005, the annual incidence of campylobacteriosis was increasing sharply, but it showed a fairly stable trend over the last decade. The highest average age-specific incidence of 1 068.5/100 000 was observed in the age group 1–4 years followed by <1 year-olds with 814.7/100 000. The highest average annual incidence by administrative region was reported in the Moravian-Silesian Region (297.1/100 000) and Southern Moravia Region (274.0/100 000). A total of 52 398 cases (12.7%) required hospitalization, and 84 campylobacteriosis-related deaths (0.02%) were recorded. Nevertheless, campylobacteriosis was identified as the direct cause of death in only one patient. In the CZ, campylobacteriosis mainly occurs as sporadic cases or family clusters (>99% of cases). The most common etiologic agent of campylobacteriosis is Campylobacter jejuni.
Conclusions: Since 2007, campylobacteriosis is the most common food - and water-borne disease in the CZ. Given the high number of cases, this infectious disease is a rising public health concern. The prevention should be focused on the main risk groups, i.e. children under 5 years of age, who are the most affected, and those older than 80 years, who have more complications and a higher hospitalization rate.
Keywords:
Czech Republic – Campylobacter spp. – campylobacteriosis – food- and water-borne diseases
Autoři: M. Špačková 1
; K. Kolářová 1; M. Gašpárek 2
Působiště autorů: Oddělení epidemiologie infekčních nemocí, Centrum epidemiologie a mikrobiologie, Státní zdravotní ústav, Praha 1; Národní referenční centrum pro analýzu epidemiologických dat, Oddělení biostatistiky, Státní zdravotní ústav, Praha 2
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 68, 2019, č. 3, s. 122-130
Kategorie: Původní práce
Souhrn
Cíl práce: Cílem naší práce bylo analyzovat hlášená epidemiologická data výskytu kampylobakterióz v České republice v letech 1997–2017 a shrnout současné poznatky ohledně výskytu tohoto onemocnění.
Metody: Provedli jsme deskriptivní analýzu dat kampylobakterióz zaznamenaných v rámci systému pro hlášení infekčních onemocnění (EpiDat) pro Českou republiku ve sledovaném období. Pro zpracování a třídění dat byl použit statistický program R a MS Excel 2010. Incidenční mapy byly vytvořeny pomocí ECDC Map Maker tool (EMMa).
Výsledky: V letech 1997–2017 bylo v naší republice hlášeno celkem 411 699 případů kampylobakterióz (průměrná roční incidence 188,9/100 000 obyv.). Roční incidence kampylobakteriózy v České republice v letech 1997–2005 prudce stoupala. Trend výskytu kampylobakterióz se však v posledních deseti letech ustálil. Nejvyšší průměrná věkově specifická incidence byla ve věkových skupinách 1–4 roky 1 068,5/100 000 obyvatel a do jednoho roku 814,7/100 000 obyvatel. Nejvyšší průměrná roční incidence kampylobakterióz byla hlášena v krajích Moravskoslezském (297,1/100 000 obyvatel) a Jihomoravském (274,0/100 000 obyvatel). Hospitalizováno bylo 52 398 osob (12,7 %). V souvislosti s kampylobakteriózou bylo v celém sledovaném období zaznamenáno celkem 84 úmrtí (0,02 %), jako přímá příčina úmrtí však byla kampylobakterióza uvedena pouze jedenkrát. Onemocnění kampylobakteriózou má v České republice charakter sporadických případů a rodinných výskytů (> 99 % výskytů) a nejčastějším etiologickým agens u kampylobakterióz je Campylobacter jejuni.
Závěry: Od roku 2007 je kampylobakterióza nejčastěji se vyskytujícím onemocněním infekční etiologie přenášeným vodou a potravinami v naší republice. Vzhledem k velkému množství případů toto onemocnění způsobuje významnou zátěž pro obyvatelstvo i zdravotní systém. Prevence onemocnění by se měla soustředit především na rizikové skupiny obyvatelstva, kterými jsou děti do pěti let z důvodu vysoké četnosti případů, a starší 80 let, jimž hrozí vyšší podíl těžkých průběhů a hospitalizací.
Klíčová slova:
Česká republika – Campylobacter spp. – kampylobakterióza – alimentární infekce
ÚVOD
Kampylobakterióza je infekční průjmové onemocnění přenášené potravinami a vodou. Od roku 2005 jsou kampylobakteriózy nejčastěji hlášenou zoonózou v Evropské unii (EU) [1, 2]. Od roku 2008 byla v mnoha zemích EU pozorována zvyšující se incidence kampylobakteriózy a tento trend se stabilizoval v letech 2012–2016 [1, 2].
Campylobacter spp. se vyskytuje v trávicím traktu člověka a mnoha druhů zvířat. U lidí tyto bakterie vyvolávají akutní střevní infekce (až 96 milionů onemocnění na světě ročně) a u domácích zvířat potraty [3].
Původně byla tato skupina gramnegativních nesporulujících bakterií známa jako mikroaerofilní vibria. Vibrio fetus byl poprvé izolován v roce 1909 z potracených plodů ovcí [4]. V roce 1947 byl izolován z krve těhotných žen, jejichž těhotenství bylo ukončeno spontánním potratem [5]. V roce 1973 se podařila první izolace na selektivních kultivačních půdách [6] a v roce 1977 byla bakterie izolována v mikroaerofilním prostředí ze stolic dětí s průjmy. Zároveň byly definovány náročné růstové podmínky kampylobakterů, které je odlišují od vibrií a bylo zavedeno nové označení pro tento rod Campylobacter spp. [7, 8]. V říjnu 2017 byl rod kampylobakterů tvořen 29 genotypicky homologními druhy [2]. Osmnáct z těchto 29 druhů je schopno vyvolat onemocnění u lidí [6, 9–11] – tabulka 1. Kampylobaktery rostou za mikroaerofilních podmínek s koncentrací kyslíku v rozmezí 3–15 %. V aerobní atmosféře kampylobaktery rychle hynou [6]. Optimální růstová teplota pro kampylobaktery je 35–37 °C. Termofilní druhy (např. Campylobacter jejuni, C. coli, C. upsaliensis a C. lari) kultivujeme při teplotě 42–43 °C, nerostou při teplotách nižších než 30 °C a vyšších než 45 °C. V přírodě jsou kampylobaktery hojně rozšířeny, zejména ve střevním traktu teplokrevných zvířat [12, 13], ale také u mořských živočichů, například v ústřicích [6, 9]. Kampylobaktery se vyskytují rovněž v trusu klokanů a vombatů a způsobují průjmy turistů v australské buši [14]. C. jejuni a C. lari se vyskytují hlavně u drůbeže a C. coli u prasat a psů [6, 9, 12]. Z domestikovaných zvířat jsou pro člověka nejrizikovějším zdrojem nákazy mláďata koček a psů, která ve většině případů mají bezpříznakový průběh onemocnění [15]. Kampylobaktery přežívají při nízké teplotě ve vodě i několik týdnů a protože je ptáci i jiná volně žijící zvířata prakticky neustále vylučují [16], lze je izolovat téměř z jakékoliv povrchové vody [17].
Tab. 1. Campylobacter spp., druhy způsobující klinická onemocnění u lidí a jejich klinická manifestace, zpracováno z několika různých zdrojů [6, 9–11]
Table 1. Campylobacter spp. causing clinical diseases in humans and their clinical manifestations, taken from various sources [6, 9–11]![<i>Campylobacter</i> spp., druhy způsobující klinická onemocnění u lidí a jejich klinická manifestace, zpracováno z několika různých
zdrojů [6, 9–11]<br>
Table 1. <i>Campylobacter</i> spp. causing clinical diseases in humans and their clinical manifestations, taken from various sources [6, 9–11]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/f6dcfd2c6c957ec5c8ea59393c2c5253.png)
K nákaze u lidí dochází nejčastěji po konzumaci nedostatečně tepelně zpracované drůbeže, zejména kuřat, nebo potravin kontaminovaných kontaktem se syrovým drůbežím masem [2, 13, 18, 19], kontaktem s nakaženými zvířaty [2, 20], či pitím nepasterizovaného mléka [6]. Kampylobaktery se mohou nalézat také na mražené drůbeži, vepřových játrech a dalších potravinách živočišného původu. Na přenosu kampylobakterů se dále podílí nedostatečná hygiena při ošetřování, chlazení a zpracovávání masa, a to také v domácnostech (např. stále stoupající obliba grilovaného masa). Kampylobaktery přežívají na potravinách skladovaných v chladničkách při teplotách nižších než 0 °C až po dobu 112 dní [6, 7], v másle při 5 °C i po dobu 13 dnů. Kampylobaktery jsou rovněž citlivé na zvýšenou salinitu prostředí, nižší pH a ultrafialové záření [21]. Málo známým vehikulem pro přenos kampylobakteriózy je voda rybníků a jezer kontaminovaná trusem divokých ptáků [18, 22]. Přenos z člověka na člověka je vzácný a může k němu dojít například při ošetřování inkontinentních osob nebo sexuálním stykem [2, 12].
Pro člověka jsou z epidemiologického hlediska nejvýznamnější C. jejuni, která způsobuje v Evropě více než 80 % kampylobakterióz u lidí a C. coli (8 %) [1]. Tyto nejčastější kampylobaktery způsobují po 1–7denní inkubační době (většinou 2–4 dny v závislosti na infekční dávce a imunitním stavu infikované osoby) akutní střevní infekce u lidí [12]. Jsou inaktivovány teplotou nad 48 °C, čili i pasterizací nebo varem. Infekční dávka pro vypuknutí alimentárního onemocnění je průměrně 10 000 (102–106) kampylobakterů [12]. Nemocný vylučuje v akutním stadiu onemocnění až 106–109 kampylobakterů v 1 g stolice. Rekonvalescentní vylučování kampylobakterů stolicí trvá ve vyspělých zemích 2–3 týdny [9, 12], v rozvojových zemích o něco kratší dobu, zřejmě z důvodu vysoké úrovně imunity v populaci [9]. C. jejuni se množí v tenkém střevě, kde vyvolává zánět epiteliálních buněk. Onemocnění je provázeno bolestmi břicha, výrazným průjmem (v 15 % krvavým), bolestmi hlavy a horečkou. Někdy mohou být přítomny také bolest svalů, závrať a zvracení [6]. U dětí nebývá horečka, zato zvracení je časté. Až u 92 % infikovaných dětí ve věku do 1 roku se objevuje krev ve stolici. Průměrné onemocnění trvá 5–7 dní a zpravidla vymizí i bez léčby [12, 21]. Delší trvání onemocnění nebo jeho relapsy se objevují u 10–20 % případů [12]. Rizikovým faktorem pro vznik kampylobakteriózy u lidí je dlouhodobé užívání inhibitorů protonové pumpy [23]. Mezi komplikace kampylobakteriózy patří např. apendicitida, kolitida, erythema nosodum u žen, masivní střevní krvácení, bakteriémie (zvláště u pacientů s oslabeným imunitním systémem), hepatitida, pankreatitida, cholecystitida, potrat, hemolyticko-uremický syndrom, reaktivní artritida, Reiterův syndrom a Guillain-Barrého syndrom [12, 13, 24, 25]. C. fetus postihuje téměř výhradně oslabené pacienty s jiným základním chronickým onemocněním. Většinou vyvolává závažnější infekce s horečkami a bakteriémií [12]. Infekce ostatními druhy rodu Campylobacter spp. jsou u lidí popisovány zcela ojediněle [12]. Z terapeutického hlediska je nejdůležitější rehydratace, podání solných roztoků s glukózou a dieta [12]. Antibiotická léčba je nutná asi u 5 % pacientů, a to zejména u jedinců s imunodeficitem nebo krvavým průjmem, a trvá-li onemocnění déle než týden [12]. Antibiotická léčba zároveň zkracuje dobu vylučování kampylobakterů stolicí na 72 hodin od zahájení léčby [12]. Celosvětově narůstá rezistence kampylobakterů k fluorochinolonům, proto by tato antibiotika měla být předepisována pouze po předchozím ověření citlivosti [1, 12, 26, 27].
V případě kampylobakterióz, stejně jako u jiných průjmových onemocnění, předpokládáme v evropském kontextu relativně vysokou „podhlášenost“ případů, která se může v jednotlivých zemích lišit podle systému notifikace infekčních onemocnění a vyhledávání případů [28–30]. V některých zemích může být systém sledování pouze částečný a zaznamenává např. jen epidemické výskyty nebo jen případy onemocnění u hospitalizovaných osob. Převládají sporadické případy, epidemie kampylobakterióz nejsou obvyklé [31].
METODY
Provedli jsme deskriptivní analýzu kampylobakterióz hlášených v rámci systému pro hlášení infekčních onemocnění (EpiDat) v České republice (ČR) v letech 1997–2017 [32]. Povinnost hlášení infekčních onemocnění v ČR je dána zákonem č. 258/2000 Sb., o ochraně veřejného zdraví, ve znění pozdějších předpisů, v souladu s vyhláškou č. 473/2008 Sb., o systému epidemiologické bdělosti pro vybrané infekce.
Pracovali jsme s diagnózou kampylobakterióza A04.5 (podle Mezinárodní klasifikace nemocí a přidružených zdravotních problémů, 10. revize). V rámci této diagnózy byly analyzovány základní epidemiologické charakteristiky; pohlaví, věk, kraj, hospitalizovanost, sezonnost a úmrtí. Za sporadické případy a rodinné výskyty jsme považovaly ty, které nebyly v EpiDatu označeny za součást epidemického výskytu. Porovnávali jsme také charakteristiky a trendy jednotlivých proměnných pro dvě poslední desetiletá období 1997–2006, 2007–2016 a samostatný rok 2017. Pro zpracování a třídění dat jsme využili statistický program R [33] a MS Excel 2010 [34]. Incidenční mapy byly vytvořeny pomocí ECDC Map Maker tool (EMMa) [35]. Incidence onemocnění byla přepočítána na 100 000 obyvatel středního stavu populace ČR podle odhadu populace Českého statistického úřadu vždy k 1. červenci daného roku.
VÝSLEDKY
V období 1997–2017 bylo hlášeno celkem 411 699 případů kampylobakterióz (průměrná roční incidence 188,9/100 000 obyvatel). Počet onemocnění a incidence kampylobakterióz v ČR od roku 1997 prudce stoupala do roku 2005, kdy byla pozorována nejvyšší incidence onemocnění za celé sledované období (incidence 295,8/100 000 obyvatel). Od roku 2006 se trend incidence onemocnění ustálil a v roce 2017 bylo hlášeno 24 508 případů (incidence 231,4/100 000 obyvatel) – obr. 1. Nejvyšší průměrná věkově specifická incidence v letech 1997–2017 byla ve věkových skupinách 1–4 roky 1 068,5/100 000 obyvatel a do jednoho roku 814,7/100 000 obyvatel – obr. 2, obdobně jako ve všech sledovaných obdobích, kdy se průměrná incidence v těchto věkových skupinách lišila pouze v řádu jednotek. Podíl kampylobakterióz byl celkově vyšší u mužů (52,0 %); průměrná věkově specifická incidence byla vyšší u mužů všech věkových skupin do dosažení 19 let a potom opět mírně vyšší u mužů starších 70 let, a to jak za celé sledované období, tak i pro jednotlivá sledovaná období zvlášť (viz obr. 2).
Obr. 1. Počet případů podle pohlaví a incidence onemocnění kampylobakteriózou v ČR v letech 1997–2017, EpiDat
Figure 1. Campylobacteriosis cases by sex and incidence rates in the Czech Republic in 1997–2017, EpiDat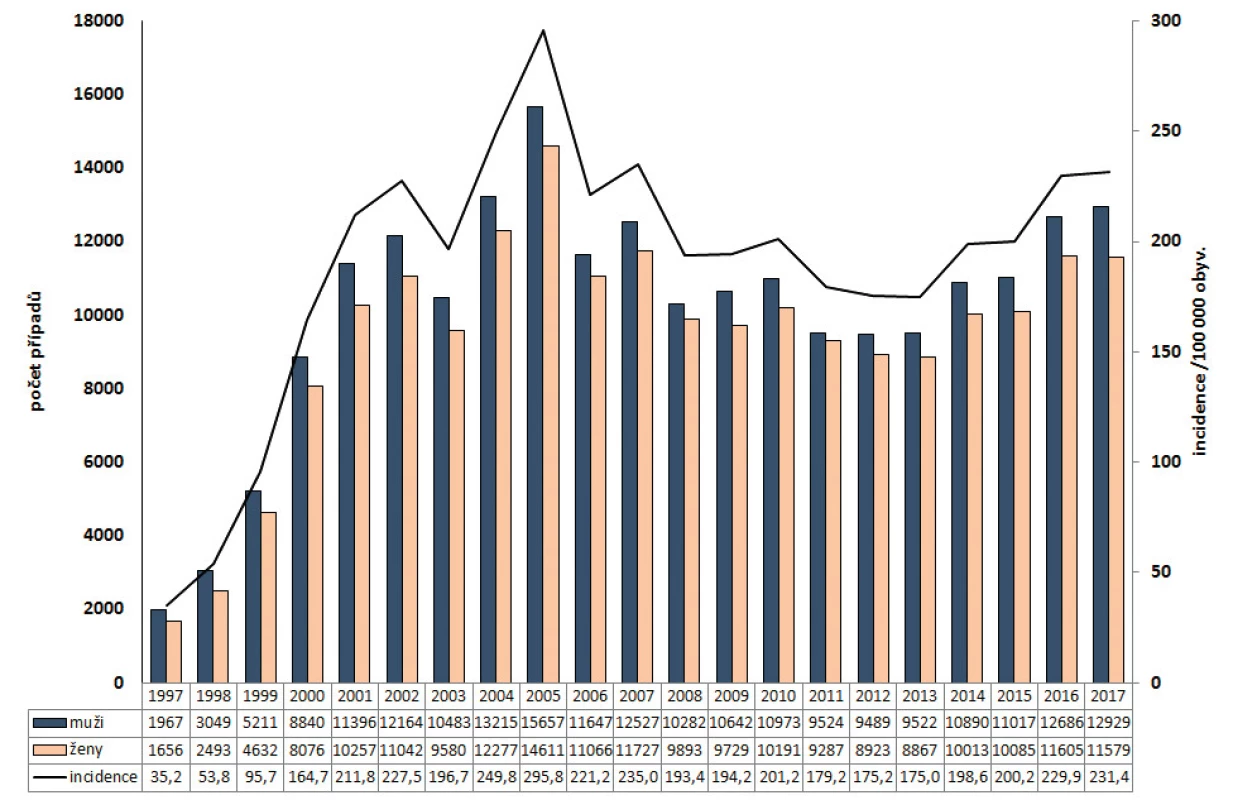
Obr. 2. Průměrná incidence kampylobakterióz v ČR v letech 1997–2017 podle pohlaví a věkových skupin a podíl mužů podle věkových skupin, EpiDat
Figure 2. Average annual incidence of campylobacteriosis by sex and age group and the proportion of males in each age group in the Czech Republic in 1997–2017, EpiDat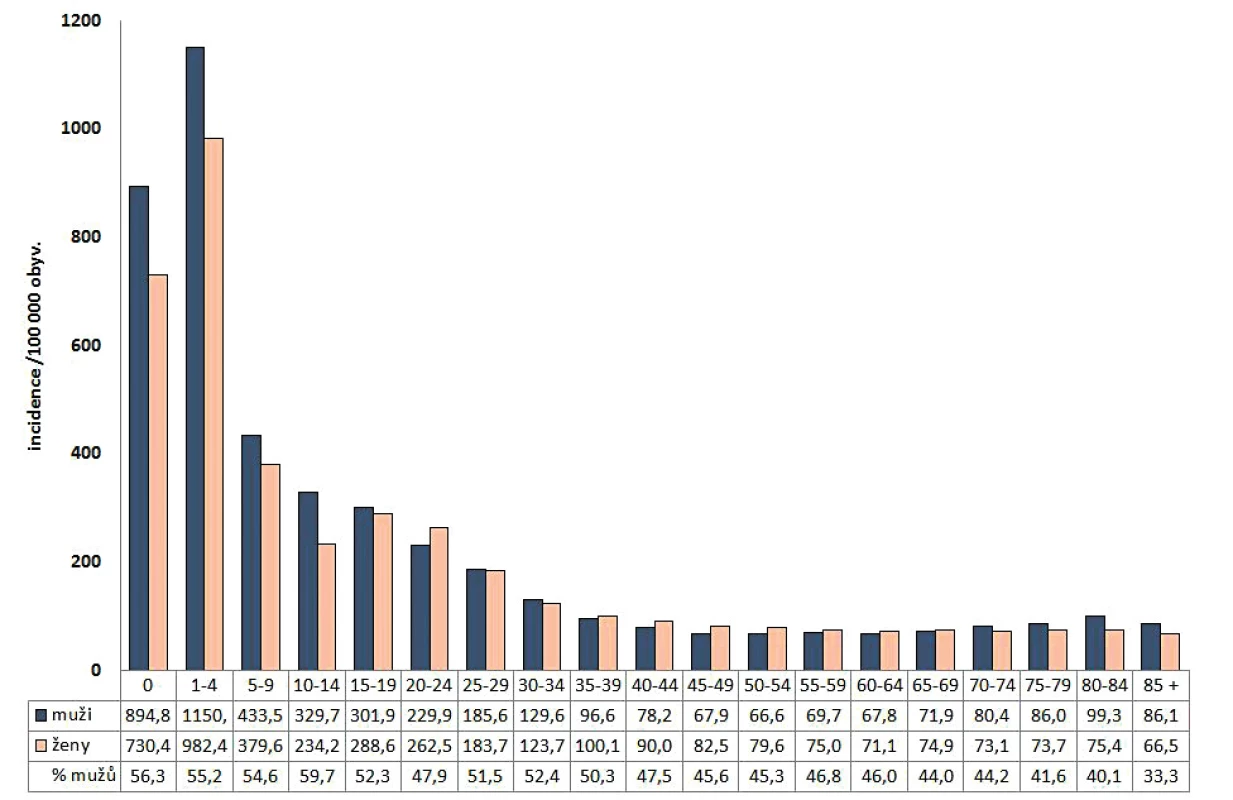
V celém období 1997–2017 byla nejvyšší průměrná roční incidence hlášena v krajích Moravskoslezském (297,1/100 000 obyvatel) a Jihomoravském (274,0/100 000 obyvatel). Incidence v těchto krajích byla obdobná ve všech sledovaných obdobích. Nejnižší průměrná roční incidence v celém období 1997–2017 byla zjištěna v krajích Libereckém (96,2/100 000 obyvatel), Královehradeckém (110,5/100 000 obyvatel), Ústeckém (121,3/100 000 obyvatel) a Pardubickém (126,9/100 000 obyvatel). Největší rozdíl incidence v jednotlivých sledovaných obdobích 1997–2006, 2007–2016 a 2017 jsme zaznamenali v krajích Libereckém (66,3; 119,0 a 160,3/100 000 obyvatel), Královehradeckém (64,0; 148,4 a 194,2/100 000 obyvatel) a Pardubickém (76,0; 167,2 a 226,0/100 000 obyvatel) – obr. 3.
Obr. 3. Průměrná roční incidence kampylobakteriózy v obdobích 1997–2006 a 2007–2016 a incidence v roce 2017 v ČR podle jednotlivých krajů, EpiDat
Figure 3. Average annual incidence of campylobacteriosis in the Czech Republic in 1997–2006 and 2007–2016 and distribution of cases by administrative region in 2017, EpiDat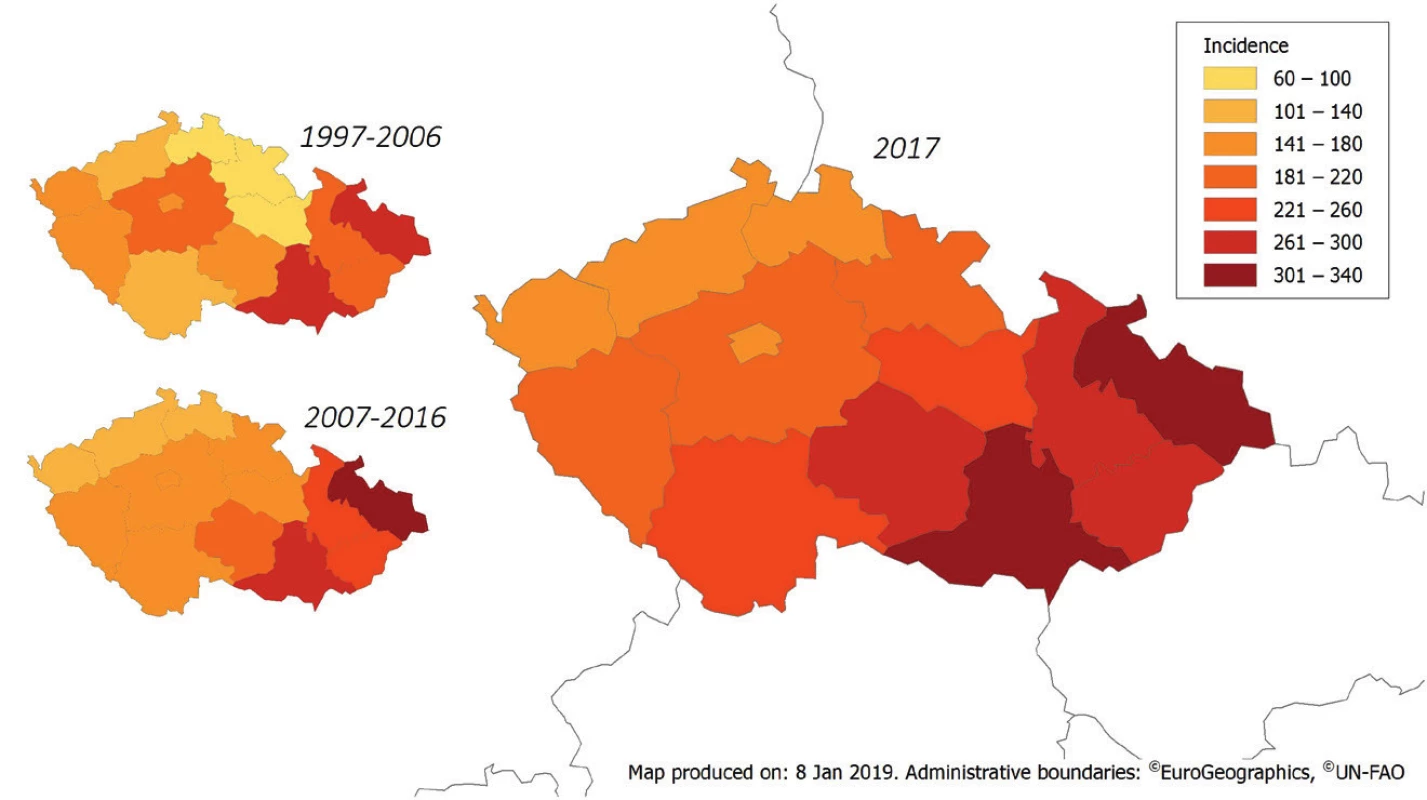
V letech 1997–2017 bylo hospitalizováno celkem 52 398 osob (12,7 %); v letech 1997–2006 11,5 %, v letech 2007–2016 13,8 % a v roce 2017 13,0 %. Nejmenší podíl hospitalizovaných byl ve všech obdobích zaznamenán ve věku 25–59 let a nejvyšší ve věku od 80 let (obr. 4). Ve sledovaném období 1997–2017 bylo v souvislosti s kampylobakteriózou zaznamenáno celkem 84 úmrtí (0,02 %); 39 u mužů a 45 u žen; podle věku bylo 39 úmrtí zaznamenáno u osob starších 75 let, 8 ve věkové skupině 70–74 let, 10 ve věkové skupině 65–69 let a 27 ve věku od 15 do 64 let. Jako přímá příčina úmrtí byla kampylobakterióza uvedena pouze jedenkrát v roce 2001 u ženy starší 70 let.
Obr. 4. Podíl hospitalizovaných případů kampylobakterióz v ČR podle věkových skupin v jednotlivých sledovaných obdobích 1997–2006, 2007–2016 a 2017, EpiDat
Figure 4. Distribution of campylobacteriosis cases requiring hospitalization by age group in the Czech Republic in 1997–2006, 2007–2016, and 2017, EpiDat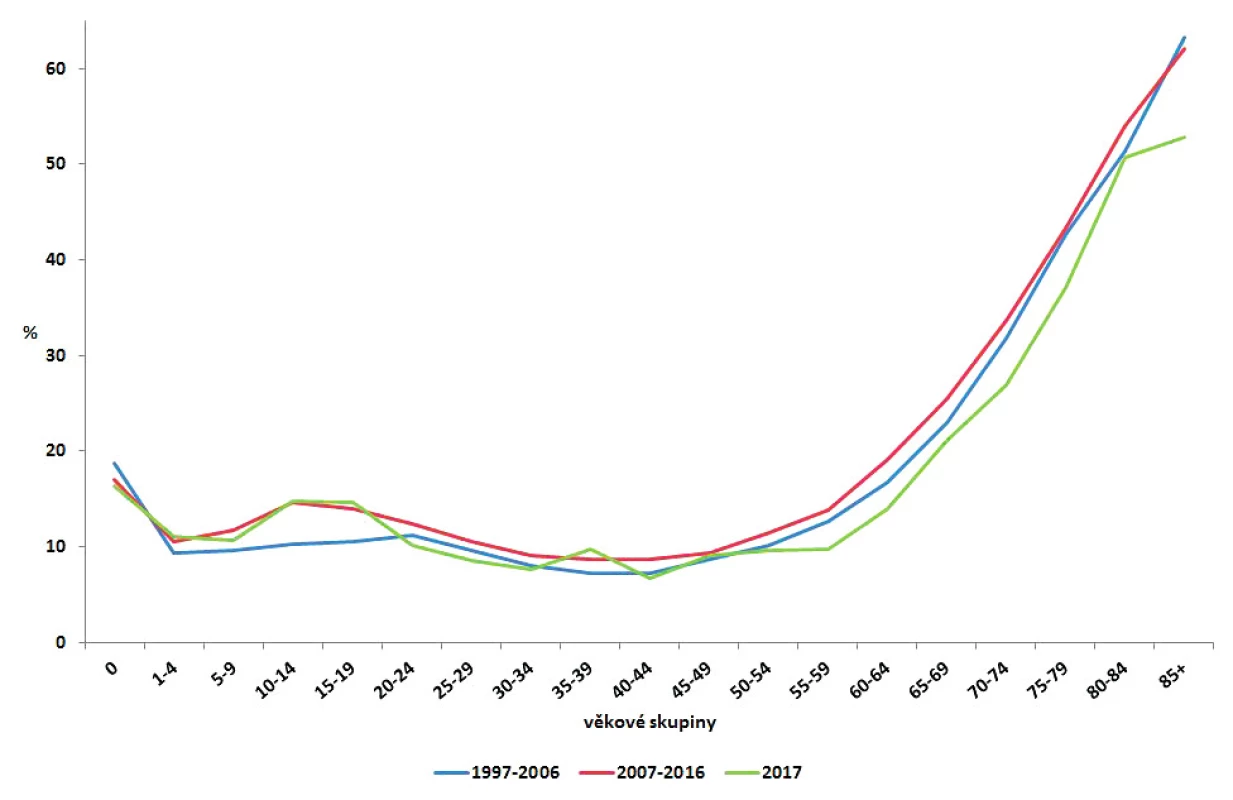
Onemocnění kampylobakteriózou mělo v ČR v celém sledovaném období charakter sporadických případů a rodinných výskytů (> 99 % výskytů). V rámci epidemického výskytu bylo zaznamenáno v letech 1997–2006 pouze 0,4 % případů, v letech 2007–2016 a v roce 2017 0,1 % případů.
Nejčastějším etiologickým agens u kampylobakterióz byly v celém období 1997–2017 C. jejuni (91,8 %) a C. coli (1,4 %) – obr. 5. V letech 1997–2006 to byly C. jejuni (94,8 %) a C. coli (0,3 %), v letech 2007–2016 C. jejuni (90,6 %) a C. coli (1,7 %), a v roce 2017 C. jejuni (80,1 % všech kampylobakterióz) a C. coli (6,1 %). V roce 2016 byla zavedena nová diagnostická metoda detekce specifických protilátek Campylobacter spp. na principu CLIA (Chemiluminiscence Immuno Assay). Tato metoda se projevila hlášením v kategoriích, které dříve neexistovaly: „C. jejuni/C. coli“ hlášeno 159 případů, C. upsaliensis 10 případů a v kategorii „C. species nespecifikovaný“ bylo v roce 2016 hlášeno 3 003 případů.
Pro samostatné období 2007–2016 jsme provedli rovněž analýzu klinického průběhu kampylobakterióz podle charakteru onemocnění; jako akutní průjmové onemocnění proběhlo 98,6 % případů (n = 204 972), bezpříznakový průběh byl zjištěn u 1,3 % případů (n = 2 648), extraintestinální symptomy v 0,1 % (n = 88) a Guillain-Barrého syndrom ve dvou případech. Dále jsme v tomto období provedli analýzu případných jiných základních onemocnění u lidí nemocných kampylobakteriózou. Záznam o anémii byl v anamnéze dostupný u 38 % případů, z nichž anémii mělo 0,06 % (n = 46); záznam o chronických gastrointestinálních potížích byl dostupný u 36,5 %, potíže mělo 1,3 % (n = 987); záznam o recidivujících průjmech byl dostupný u 36,5 % a potíže mělo 1,04 % (n = 789), záznam o poruchách funkce jater byl dostupný u 36,3 % a poruchu mělo 0,08 % (n = 64); a záznam o jiných chronických onemocněních byl dostupný u 36,4 %, z nichž 1,8 % (n = 1 333) mělo chronické onemocnění.
Obr. 5. Podíl jednotlivých druhů rodu Campylobacter spp. na onemocnění kampylobakteriózou v ČR v letech 1997–2017, EpiDat
Figure 5. Distribution of campylobacteriosis cases by causative species in the Czech Republic in 1997-2017, EpiDat
V letech 1997–2017 bylo zaznamenáno celkem 4 025 importovaných nákaz kampylobakterióz (1,0 %). Nejčastější byly importy ze Slovenska a Chorvatska (obr. 6). Sezonní výskyt onemocnění kampylobakteriózou je v ČR pravidelně nejvyšší v období květen až říjen.
Obr. 6. Importovaná onemocnění kampylobakteriózou podle nejčastějších zdrojových zemí importu nákazy, 1997–2017, EpiDat
Figure 6. Imported cases of cympylobacteriosis by source country, 1997–2017, EpiDat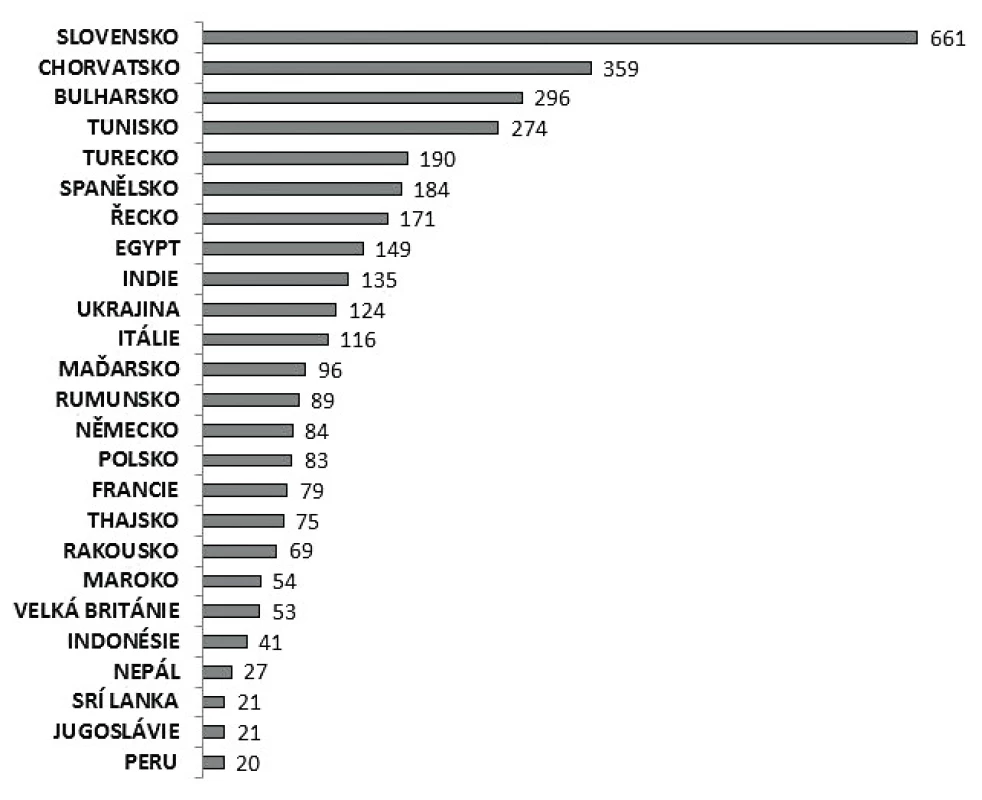
DISKUSE A ZÁVĚR
První hlášené případy kampylobakteriózy evidujeme v systému hlášení infekčních nemocí v ČR už od roku 1984. Od roku 1997 došlo k prudkému nárůstu incidence tohoto onemocnění i v ostatních evropských zemích a od roku 2007 je kampylobakterióza nejčastěji se vyskytujícím onemocněním infekční etiologie přenášeným vodou a potravinami v ČR. Do roku 2005 jsme v ČR pozorovali prudce stoupající trend incidence kampylobakterióz, zatímco od roku 2006 je trend výskytu tohoto onemocnění v ČR stabilní (viz graf 1). Naopak v mnoha zemích EU byla pozorována zvyšující se incidence kampylobakteriózy od roku 2008 a tento trend se stabilizoval v letech 2012–2016 [1, 2]. V ČR je ve srovnání s průměrem incidence kampylobakterióz členských států EU až 4krát vyšší [1]. Průměrná incidence kampylobakteriózy v EU v roce 2016 byla 66,3/100 000 obyvatel [1], ČR hlásila incidenci kampylobakteriózy 228,2/100 000 obyvatel, Slovensko 140,5/100 000 obyvatel, Švédsko 111,9/100 tisíc obyvatel a Velká Británie 90,2/100 000 obyvatel. Nejnižší nemocnost kampylobakteriózou v roce 2016 hlásily Bulharsko, Kypr, Lotyšsko, Polsko, Portugalsko a Rumunsko (≤ 4,6/100 000 obyvatel) [1]. Vysoká hlášená incidence kampylobakteriózy u lidí v ČR je zřejmě výsledkem povinného celoplošného systému surveillance tohoto onemocnění v ČR a může být ovlivněna také vyšší spotřebou drůbežího masa ve srovnání s jinými členskými zeměmi EU. Podle dat Českého statistického úřadu se od roku 1997 do roku 2017 spotřeba drůbežího masa v ČR téměř zdvojnásobila; v roce 1997 bylo spotřebováno cca 15 kg/osobu, zatímco v roce 2017 28 kg/osobu [36]. Nárůst hlášených případů kampylobakterióz mohl být v podmínkách ČR dále ovlivněn také zlepšenou laboratorní diagnostikou. V evropském kontextu předpokládáme relativně vysokou podhlášenost případů, která se v jednotlivých členských zemích může lišit podle systému notifikace infekčních onemocnění a vyhledávání případů [28–30]. Systém surveillance se v jednotlivých členských státech EU liší. V některých zemích jsou například hlášeny pouze epidemické výskyty anebo jen případy onemocnění u hospitalizovaných osob.
Na výskytu onemocnění se podílejí také například míra kontaminace rizikových potravin a klimatické podmínky [37]. Kampylobakteriózy se vyskytují po celý rok, avšak maximum výskytu je v rozvinutých zemích mírného klimatického pásma zaznamenáváno v létě a časném podzimu [1, 12]. V ČR je nejvyšší sezonní výskyt kampylobakterióz zaznamenáván v měsících květen až říjen. V letních měsících jsou vhodné klimatické podmínky pro množení těchto bakterií, proto je třeba dbát na zvýšenou pozornost při správném zpracování a uchovávání potravin. Byla také prokázána korelace nemocnosti kampylobakteriózou s průběhem průměrných denních teplot, kdy vyšší teploty korelují s vyšším výskytem počtu tohoto onemocnění [38, 39].
Podle evropského programu redukce prevalence kampylobakteriózy u drůbeže vysoká incidence kampylobakterióz u lidí koreluje se zvyšující se spotřebou a konzumací drůbeže v Evropě i ČR a svědčí o trvalé přítomnosti zdrojů kampylobakterů mezi drůbeží [26, 40]. Souvislost výskytu tohoto onemocnění se spotřebou drůbežího masa dokládá například situace na Novém Zélandu, kde po zavedení opatření k redukci kontaminace kuřecího masa Campylobacter spp. významně klesl počet onemocnění kampylobakteriózou u lidí [41]. Výskyt kampylobakterů u zvířat i v potravinách v ČR sleduje „Národní referenční laboratoř pro kampylobaktery“ Státního veterinárního ústavu (SVS) Olomouc. V letech 2006–2007 se v ČR kontaminace brojlerů drůbeže Campylobacter spp., zjišťěná z kloakálních výtěrů drůbeže na jatkách, pohybovala kolem 50 % (C. jejuni 46 % a C. coli 3 %) [26]; v roce 2015 ze vzorků odebraných ze slepých střev brojlerů drůbeže na jatkách to bylo 65 % [42]. Kontaminovaná svalovina kuřecích brojlerů běžně obsahuje 102–103 KTJ (kolonie tvořících jednotek kampylobakterů)/gram, ve střevním obsahu se však nachází až 107 KTJ/gram [9]. Výskyt kampylobakterů u drůbeže v ostatních zemích Evropy je obdobný, pouze v severských státech je nižší s výraznější sezonní variací (odlišné klima, odlišná opatření na farmách a jatkách) [2]. Pouze několik členských států hlásilo v roce 2016 data ohledně výskytu kampylobakterů u zvířat a v potravinách; 36,7 % hlášených výskytů pocházelo z čerstvého masa kuřat a 11 % z čerstvého masa krocanů, 1 % pocházelo z mléka a mléčných výrobků [1]. V ČR bylo podle studií SVS v obchodní síti v roce 2009 kontaminováno kampylobaktery na povrchu asi 70–75 % chlazené a 36–37 % mražené drůbeže [42, 43]. Počátkem roku 2010 se na zvýšení nemocnosti kampylobakteriózou v ČR projevil také prodej nepasterizovaného mléka [44].
Onemocnění kampylobakteriózou v ČR má charakter sporadických případů a rodinných výskytů (> 99 % výskytů). Většina případů je získána na území ČR (99 %), podobně jako ve většině Evropských zemí (≥ 90 % případů) [1]. Mezi importovanými případy bylo v rámci EU 47,6 % hlášeno jako importovaná onemocnění z jiné země EU, nejvíce ze Španělska (17,8 %), Francie (4,3 %) a Řecka (4,2 %) [1] a do ČR byla kampylobakterióza importována nejčastěji ze Slovenska a Chorvatska, což pravděpodobně odráží oblíbenost těchto destinací v rámci letních dovolených u obyvatel EU, potažmo ČR.
Pro člověka jsou z epidemiologického hlediska nejvýznamnější C. jejuni, který způsobuje v Evropě více než 80 % kampylobakterióz u lidí a C. coli (8 %) [1]. Nejčastějším etiologickým agens u kampylobakterióz v ČR je dlouhodobě C. jejuni (91,8 %), i když jeho podíl na celkovém výskytu kampylobakterióz se postupně snižuje, z 94,8 % v letech 1997–2006 až na pouhých 80,1 % v roce 2017. Na druhou stranu záchyt C. coli u nemocných kampylobakteriózou ve sledovaném období postupně narůstal; z 0,3 % v letech 1997–2006 na 6,1 % v roce 2017. Důvody této změny nejsou známé, je možné, že se bude jednat o změnu druhového složení kampylobakterů u drůběže.
Nejvyšší incidenci kampylobakterióz dlouhodobě pozorujeme ve věkové skupině 1–4 roky a u dětí do jednoho roku věku. Vyšší incidence onemocnění byla zaznamenána u mužů než u žen, a to zejména ve věku do 15 let a u starších osob. Důvod zvýšeného výskytu kampylobakterů u dětí mužského pohlaví není přesně znám, ačkoliv byl již v odborné literatuře opakovaně popsán [28, 45, 46]. Uvažuje se v tomto ohledu o nedostatečně vyvinuté imunitě [28]. Celkově i v jednotlivých sledovaných obdobích jsme zaznamenali trvale nejvyšší incidenci onemocnění kampylobakteriózou v krajích Moravskoslezském a Jihomoravském. Nejnižší incidence byla za celé sledované období v krajích Libereckém, Královehradeckém, Ústeckém a Pardubickém. V krajích Libereckém, Královehradeckém a Pardubickém se průměrná roční incidence v posledních dvou desetiletích více než zdvojnásobila. Příčina tohoto prudkého vzestupu výskytu onemocnění v těchto krajích není známa; jedním z důvodů může být zkvalitnění systému hlášení kampylobakteriózy a tento důvod je nejpravděpodobnější. Další příčinou, kterou jsme v tomto ohledu uvažovali, by mohla být změna věkového složení obyvatelstva v těchto krajích, avšak počty obyvatel nejnižších věkových skupin (do jednoho roku věku a 1–4 roky) se ve sledovaných obdobích významně nelišily. Vzhledem ke geografické poloze těchto krajů, je diskutabilní také změna stravovacích návyků v těchto oblastech.
V letech 1997–2017 bylo v ČR hospitalizováno 12,7 %, přičemž podíl hospitalizovaných jedinců se postupně v jednotlivých obdobích mírně zvyšoval (v období 1997–2006 11,5 % a v roce 2017 13,0 %). Není jasné, proč máme v ČR menší podíl hospitalizovaných jedinců než v EU (v roce 2016 bylo v EU hospitalizováno 28,5 % všech hlášených případů [1]), ale pravděpodobně to bude dáno rovněž velmi dobrým systémem hlášení v ČR, kdy jsou nahlášeny i nehospitalizované případy onemocnění častěji než v jiných zemích EU. V celém sledovaném období jsme v ČR dále zaznamenali 0,02 % úmrtí v souvislosti s kampylobakteriózou (v roce 2016 0,03 %), což velmi dobře koreluje s daty z EU, kde bylo v roce 2016 zaznamenáno 0,03 % úmrtí na kampylobakteriózu. Vzhledem k velkému celkovému počtu případů tohoto onemocnění to není zcela bezvýznamné množství [1]. V ČR se úmrtí v souvislosti s kampylobakteriózou vyskytnou většinou u starších jedinců s jinou základní diagnózou.
Kampylobaktery jsou velmi citlivé na podmínky vnějšího prostředí (sucho, teplo, světlo, dezinfekční prostředky). Při běžném skladování se v chladničkových teplotách nepomnožují, ale přežívají ve vodě, mléce a potravinách i několik týdnů [11]. Chlazením a mražením jsou počty kampylobakterů redukovány, avšak nikoliv eliminovány. Vaření, smažení a pečení tyto bakterie spolehlivě ničí. Prevencí onemocnění kampylobakteriózou je důkladné tepelné opracování potravin (pasterizace), zamezení křížové kontaminace v průběhu zpracování a skladování potravin [42], dodržování nejen sanitace a dezinfekce v průběhu produkce a zpracování potravin, ale také náležitá osobní hygiena a hygiena stravování [47]. V domácnosti je vhodné dodržovat základní hygienická pravidla; neomývat zakoupenou drůbež a maso pod tekoucí vodou, jelikož zde vzniká aerosol, který potřísní a infikuje okolní plochy a předměty; striktně oddělit kuchyňské pomůcky a nástroje pro práci se syrovým masem a vejci od ostatních, které jsou určeny ke zpracování pokrmů pro přímou konzumaci; časté mytí a dezinfekce rukou a pracovních ploch, zejména po kontaktu se syrovým drůbežím masem a drůbežími vnitřnostmi; dostatečná tepelná úprava pokrmů (i uvnitř pokrmů) bezprostředně před požitím; syrové (nepasterizované) mléko převařit; při skladování oddělovat potraviny určené k přímé spotřebě od masných produktů a vajec. Dodržování hygienických pravidel je významnou prevencí onemocnění i v případě kontaktu s domácími mazlíčky a při koupání v přírodních venkovních vodních nádržích.
Do redakce došlo dne 22. 1. 2019.
Adresa pro korespondenci:
MUDr. Michaela Špačková
CEM, Státní zdravotní ústav
Šrobárova 48
100 00 Praha 10
e-mail: michaela.spackova@szu.cz
Zdroje
1. EFSA, ECDC, The European Union summary report on trends and sources of zoonoses, zoonotic agents and food-borne outbreaks in 2016. EFSA Journal, 2017;15(12):5077.
2. Hansson I, Sandberg M, Habib I, et al. Knowledge gaps in control of Campylobacter for prevention of campylobacteriosis. Transboundary and emerging diseases, 2018;65 : 30–48.
3. Kirk MD, Pires SM, Black RE, et al. World Health Organization estimates of the global and regional disease burden of 22 foodborne bacterial, protozoal, and viral diseases, 2010: a data synthesis. PLoS medicine, 2015;12(12):e1001921.
4. Reay DJM. Report of the Departmental Committee appointed by the Board of Agriculture and Fisheries to inquire into and report upon the subject of agricultural education in England and Wales in Parliament. 1908. Printed for HMSO, by McCorquodale & Co., Ltd.
5. Vinzent R. Abortion following severe septicemia due to Vibrio fetus. Bull. Acad. nat. méd, 1947;131 : 90.
6. Hochel I. Metody detekce a charakterizace Campylobacter sp. Chemické listy, 2009;103 : 814–822.
7. Skirrow M, Campylobacter enteritis: a” new” disease. Br Med J, 1977;2(6078):9–11.
8. Sebald M, Veron M. Base DNA content and classification of Vibrios. in Annales de l’Institut Pasteur. 1963.
9. Turková M. Campylobacter jejuni. Diplomová práce. 2014, Univerzita Karlova.
10. On SL, Isolation, identification and subtyping of Campylobacter: where to from here? Journal of microbiological methods, 2013;95(1):3–7.
11. Kaakoush NO, Castaño-Rodríguez N, Mitchell HM, et al. Global epidemiology of Campylobacter infection. Clinical microbiology reviews, 2015;28(3):687–720.
12. Beneš J. Infekční lékařství. 2009: Galen.
13. Man SM. The clinical importance of emerging Campylobacter species. Nature reviews Gastroenterology & hepatology, 2011;8(12):669.
14. Julák J. Klinicky významné bakterie. 2012, Praha: Triton.
15. Acke E, Whyte P, Jones B, et al. Prevalence of thermophilic Campylobacter species in cats and dogs in two animal shelters in Ireland. Veterinary Record, 2006;158(2):51–54.
16. Konicek C, Vodrážka P, Barták P, et al. Detection of Zoonotic Pathogens in Wild Birds in the Cross-Border Region Austria–Czech Republic. Journal of wildlife diseases, 2016;52(4): 850–861.
17. Greenwood D. Lékařská mikrobiologie: přehled infekčních onemocnění: patogeneze, imunita, laboratorní diagnostika a epidemiologie. 1999: Grada publishing.
18. Dasti JI, Tareen AM, Lugert R, et al. Campylobacter jejuni: a brief overview on pathogenicity-associated factors and disease-mediating mechanisms. International Journal of Medical Microbiology, 2010;300(4):205–211.
19. Doorduyn Y, Van Den Brandhof W, Van Duynhoven Y, et al. Risk factors for indigenous Campylobacter jejuni and Campylobacter coli infections in The Netherlands: a case-control study. Epidemiology & Infection, 2010;138(10):1391–1404.
20. Sheppard SK, Dallas JF, Strachan NJ, et al. Campylobacter genotyping to determine the source of human infection. Clinical Infectious Diseases, 2009;48(8):1072–1078.
21. Bednář M, Fraňková V, Schindler J, et al. Lékařská mikrobiologie. Praha: Marvil, 1996.
22. Patrick ME, Gilbert MJ, Blaser MJ, et al. Human infections with new subspecies of Campylobacter fetus. Emerging infectious diseases, 2013;19(10):1678.
23. Feodoroff B, de Haan CP, Ellström P, et al. Clonal distribution and virulence of Campylobacter jejuni isolates in blood. Emerging infectious diseases, 2013;19(10):1653.
24. Blaser MJ, Engberg J. Clinical aspects of Campylobacter jejuni and Campylobacter coli infections, in Campylobacter, Third Edition. American Society of Microbiology, 2008 : 99-121.
25. Poropatich KO, Walker CLF, Black RE, Quantifying the association between Campylobacter infection and Guillain-Barré syndrome: a systematic review. Journal of health, population, and nutrition, 2010;28(6):545.
26. Bardon J, Kolar M, Cekanova L, et al. Prevalence of Campylobacter jejuni and its resistance to antibiotics in poultry in the Czech Republic. Zoonoses and public health, 2009; 56(3):111–116.
27. Bardoň J, Pudová V, Koláčková I, et al. Virulence and antibiotic resistance genes in Campylobacter spp. in the Czech Republic. Epidemiologie, mikrobiologie, imunologie: casopis Spolecnosti pro epidemiologii a mikrobiologii Ceske lekarske spolecnosti JE Purkyne, 2017;66(2):59–66.
28. Schielke A, Rosner BM, Stark K. Epidemiology of campylobacteriosis in Germany–insights from 10 years of surveillance. BMC infectious diseases, 2014;14(1):30.
29. Havelaar AH, van Pelt W, Ang CW, et al. Immunity to Campylobacter: its role in risk assessment and epidemiology. Critical reviews in microbiology, 2009;35(1):1–22.
30. Jansen A, Stark K, Kunkel J, et al. Aetiology of community-acquired, acute gastroenteritis in hospitalised adults: a prospective cohort study. BMC infectious diseases, 2008;8(1):143.
31. Unicomb LE, Fullerton KE, Kirk MD, et al. Outbreaks of campylobacteriosis in Australia, 2001 to 2006. Foodborne Pathogens and Disease, 2009;6(10):1241–1250.
32. Informační systém hlášení infekčních nemocí EpiDat. 2018. Orgány ochrany veřejného zdraví České republiky, Státní zdravotní ústav.
33. The R Foundation, The R Project for Statistical Computing. 2018.
34. Microsoft Office 10, Microsoft Excel. 2018.
35. European Centre for Disease Prevention and Control, ECDC Map Maker tool (EMMa). 2019.
36. Český statistický úřad. Spotřeba potravin – 2017. 2018 4. 12. 2018. Dostupné na www: https://www.czso.cz/csu/czso/spotreba-potravin-2017.
37. European Centre for Disease Prevention, Annual Epidemiological Report. 2011: ECDC, European Centre for Disease Prevention and Control.
38. Nichols GL, Richardson JF, Sheppard SK, et al. Campylobacter epidemiology: a descriptive study reviewing 1 million cases in England and Wales between 1989 and 2011. BMJ open, 2012;2(4):e001179.
39. Lal A, Hales S, French N, et al. Seasonality in human zoonotic enteric diseases: a systematic review. PLoS One, 2012;7(4):e31883.
40. Roubalová M. Situační a výhledová zpráva – drůbež a vejce 2014. Dostupné na www: http://www.apic-ak.cz/data_ak/15/k/DaV/DaVSVZ1411.pdf.
41. Tam CC, Higgins CD, Neal KR, et al. Chicken consumption and use of acid-suppressing medications as risk factors for Campylobacter enteritis, England. Emerging infectious diseases, 2009;15(9):1402.
42. Bardoň J. Ten years of monitoring of thermotolerant Campylobacter in the human food chain in the Czech republic. Zoonoses – Protection of public and animal health, 2016 : 22.
43. Bardoň J, Kolář M, Karpíšková R, et al. Prevalence of thermotolerant Campylobacter spp. in broilers at retail in the Czech Republic and their antibiotic resistance. Food Control, 2011; 22(2):328–332.
44. Bardon J, Ondruskova J, Oslikova M, et al. Zoonotic potential of raw cow’s milk in the Czech Republic. Klinicka mikrobiologie a infekcni lekarstvi, 2012;18(2):32–37.
45. Kuhn K, Nielsen E, Mølbak K, et al. Epidemiology of campylobacteriosis in Denmark 2000–2015. Zoonoses and public health, 2018;65(1):59–66.
46. Skirrow M. A demographic survey of campylobacter, salmonella and shigella infections in England: a Public Health Laboratory Service survey. Epidemiology & Infection, 1987;99(3):647–657.
47. Maďar R, Podstatová R, Řehořová J. Prevence nozokomiálních nákaz v klinické praxi. 2006: Grada Publishing as.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2019 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Vysoká prevalence virové hepatitidy C ve vyloučené komunitě brněnských Romů
- Výskyt a analýza případů onemocnění kampylobakteriózou v České republice v letech 1997–2017
- Molekulárně genetická studie mykobakteriálních kmenů prevalujících na území České republiky v roce 2014
- Prevalence a role CCR5Δ32 v progresi onemocnění u HIV pozitivních pacientů v České republice
- Antivirová adoptivní imunoterapie pomocí antigen specifických lymfocytů T u příjemců alogenního transplantátu krvetvorných buněk
- West Nile virus (linie 2) poprvé detekován v komárech v jižních Čechách: nová endemická oblast?
- Zemřela doc. RNDr. Jarmila Jelínková, CSc.
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Výskyt a analýza případů onemocnění kampylobakteriózou v České republice v letech 1997–2017
- Prevalence a role CCR5Δ32 v progresi onemocnění u HIV pozitivních pacientů v České republice
- Antivirová adoptivní imunoterapie pomocí antigen specifických lymfocytů T u příjemců alogenního transplantátu krvetvorných buněk
- Vysoká prevalence virové hepatitidy C ve vyloučené komunitě brněnských Romů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



