-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
MAIT-bunky – ich biologický a medicínsky význam
MAIT cells, their biological and medical significance
MAIT cells are a separate cell population differentiating in the thymus. They are mostly present in the peripheral blood, liver, intestine, and lungs, less often in other tissues, and infrequently in the lymph nodes. The presentation molecules for MAIT cells are MR1 proteins. They are evolutionarily conserved and non-polymorphic, resemble class I HLA molecules, and are expressed by all cell types. They present bacterial and yeast vitamin metabolites which arise during the synthesis of vitamin B2. The effector functions of MAIT cells are promoted through cytokine synthesis. They also act cytotoxically, directly killing infected or tumour cells. MAIT cells may also play a role in pathological processes. Their involvement in the development of rheumatoid arthritis, systemic lupus erythematosus, autoimmune diabetes mellitus, Crohn's disease, and bronchial asthma has been demonstrated. In practical terms, MAIT cells are very sensitive to therapeutic doses of glucocorticoids. Treatment of patients with BA or chronic obstructive pulmonary disease with glucocorticoids increases their susceptibility to pneumonia, especially when caused by Streptococcus pneumoniae.
Keywords:
MAIT cells – presentation molecule MR1 – role in disease pathogenesis – susceptibility to glucocorticoids
Autori: M. Buc
Pôsobisko autorov: Imunologický ústav Lekárskej fakulty Univerzity Komenského, Bratislava, Slovenská republika
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 69, 2020, č. 4, s. 189-193
Kategória: Souhrnná sdělení, původní práce, kazuistiky
Súhrn
MAIT-bunky predstavujú samostatnú populáciu buniek diferencujúcu sa v týmuse. Nachádzajú sa najviac v periférnej krvi, v pečeni, v čreve, v pľúcach, menej v iných tkanivách a veľmi málo v lymfatických uzlinách. Prezentačnými molekulami pre MAIT-bunky sú proteíny MR1. Sú evolučne konzervované, nepolymorfné, podobajú sa HLA-molekulám prvej triedy; exprimujú ich všetky typy buniek. Prezentujú metabolity vitamínov baktérií a kvasiniek, ktoré vznikajú pri syntéze vitamínu B2. Efektorové funkcie MAIT-bunky presadzujú prostredníctvom syntézy cytokínov. Pôsobia aj cytotoxicky, priamo zabíjajú infikované alebo nádorové bunky. MAIT-bunky sa môžu podieľať aj na patologických procesoch. Dokázala sa ich účasť na rozvoji reumatoidnej artritídy, systémového lupus erythematosus, autoimunitného diabetes mellitus, Crohnovej choroby a astma bronchiale. MAIT-bunky sú veľmi citlivé na terapeutické dávky glukokortikoidov. Liečba pacientov s AB, resp. s chronickou obštrukčnou chorobou pľúc glukokortikoidmi zvyšuje tak ich vnímavosť na pneumónie, najmä tie, ktoré vyvoláva Streptococcus pneumoniae.
Klíčová slova:
MAIT-bunky – MR1 prezentačná molekula – účasť v patogenéze chorôb – citlivosť na glukokortikoidy
ÚVOD
Dlhé roky sa populácia lymfocytov delila iba na dve základné skupiny, B - a T-lymfocyty. Označujeme ich aj ako konvenčné a patria k základným kameňom adaptívnej imunity. Až neskôr sa zistilo, že situácia je zložitejšia a že existujú ešte ďalšie dobre definované skupiny lymfocytov, ktoré patria skôr k prirodzenej imunite a označujeme ich ako nekonvenčné. Pri porovnávaní s konvenčnými lymfocytmi majú viaceré výhody. Predovšetkým je to skutočnosť, že doba ich aktivácie je krátka, niekoľko hodín oproti dňom, ktorú potrebujú T-lymfocyty. Ďalšia ich významná vlastnosť je, že frekvencia ich prekurzorov je vysoká a rôznorodosť antigénových receptorov malá, nepodliehajú imunitnej reštrikcii, čo všetko im umožňuje reagovať rýchlo a na omnoho širšie spektrum terčových štruktúr, najčastejšie mikroorganizmov a nádorových buniek [1] (tab. 1, obr. 1). V predkladanom článku sa zameriavame na MAIT-bunky, o ktorých v ostatnej dobe pribudlo viacero nových poznatkov.
Obr. 1. Porovnanie pôsobenia nekonvenčných lymfocytov s konvenčnými T-lymfocytmi, (upravené podľa Godfrey et al., Nat Immunol 2015;16(11):1114–1123)
Figure 1. Comparison of activities of non-conventional lymphocytes and conventional T lymphocytes, (adapted from Godfrey et al., Nat Immunol 2015;16(11):1114–1123)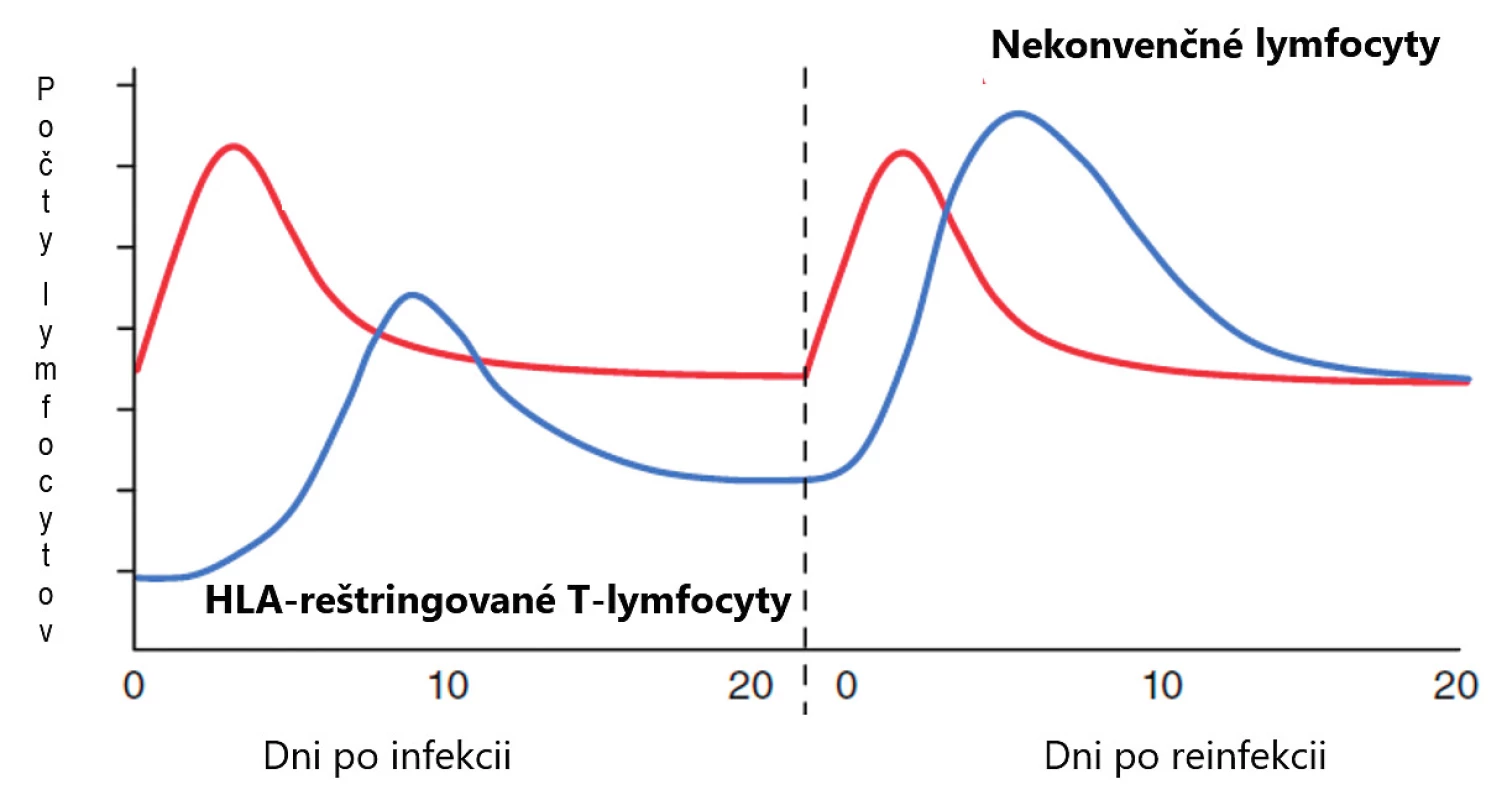
Ľavá polovica obrázku predstavuje na primárnu imunitnú odpoveď infekciu a pravá polovica obrázku sekundárnu imunitnú odpoveď. Pri porovnávaní nekonvenčných lymfocytov s konvenčnými vidíme, že doba aktivácie nekonvenčných lymfocytov je krátka, niekoľko hodín oproti dňom, ktorú potrebujú T-lymfocyty. Ďalšia ich významný rozdiel je, že frekvencia nekonvenčných prekurzorov je vysoká, čo im umožňuje reagovať rýchlo a na omnoho širšie spektrum terčových štruktúr, najčastejšie mikroorganizmov.
The left half of the picture illustrates the primary immune response to infection and the right half the secondary immune response. The comparison shows that non-conventional lymphocytes need a short time to get activated, several hours, in contrast to several days required by conventional T lymphocytes for their activation. Another important difference lies in the frequency of non-conventional precursors, which is high and thus allows a rapid reaction to a much wider range of target structures, mostly microorganisms.Tab. 1. Rozdiely medzi konvenčnými a nekonvenčnými lymfocytmi
Table 1. Differences between conventional and unconventional lymphocytes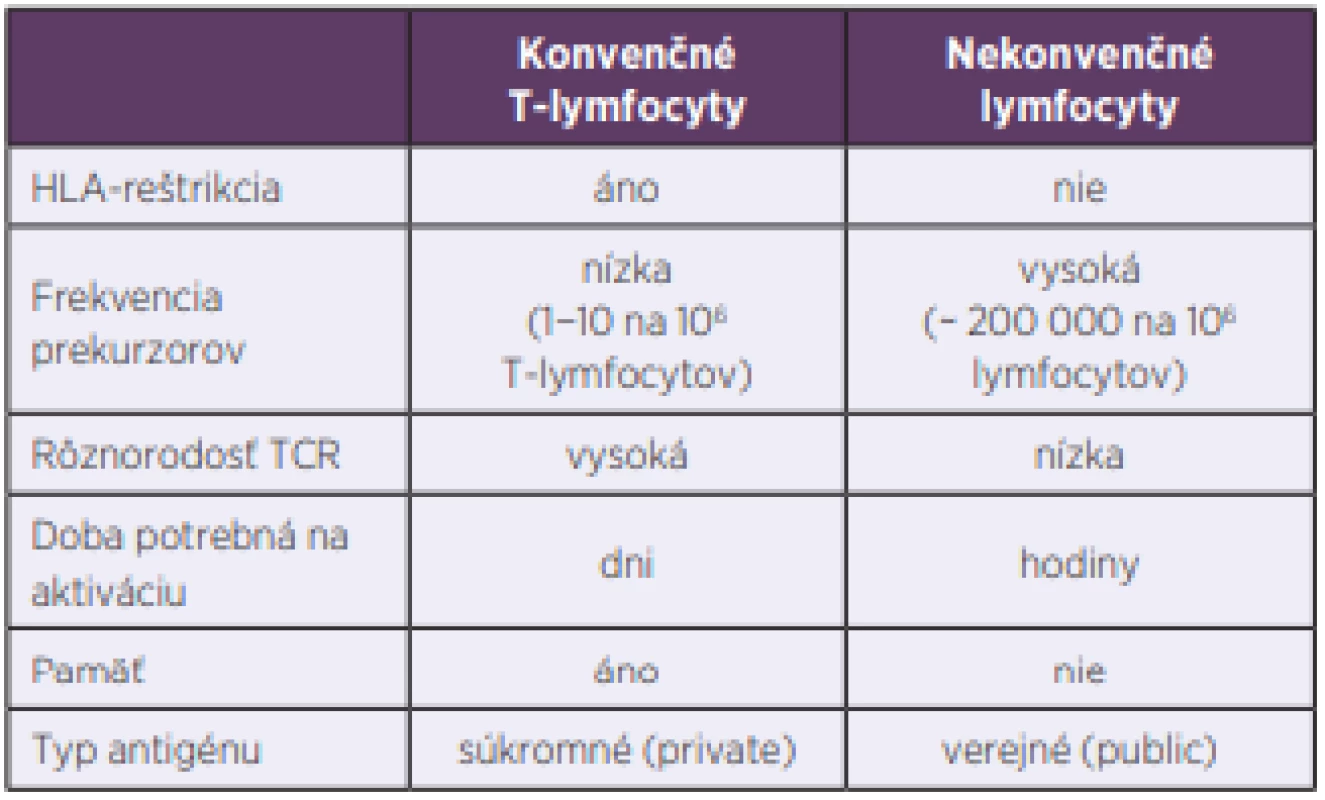
TCR – antigénový receptor T-lymfocytov
TCR – T cell receptorZÁKLADNÁ CHARAKTERISTIKA MAIT-BUNIEK
MAIT-bunky (mucosal-associated invariant T cells) predstavujú samostatnú populáciu lymfocytov, ktorá sa diferencuje v týmuse. Týmus opúšťajú v nezrelom stave a po osídlení svojich terčových orgánov či tkanív rýchlo dozrievajú [2]. MAIT-bunky sa vyznačujú invariabilným antigénovým receptorom T-lymfocytov a CD8-homodimérom (α/α), alebo, menej často, CD8--heterodimérom (α/β); existujú však aj subpopulácie CD4+CD8- a CD4-CD8 - [3]. Z iných znakov sa vyznačujú prítomnosťou receptorov pre viaceré cytokíny a CXCR6 a CCR9, čo sú receptory pre chemokíny, ktoré podporujú ich migráciu do periférnych tkanív. Nemajú však CCR7 a CD62L, ktoré treba na migráciu do lymfatických uzlín, výsledkom čoho je, že MAIT-bunky sa tu nenachádzajú, alebo len v malých počtoch. Aj samotné MAIT bunky po stimulácii produkujú IL-2, IL-17A, IFN-γ, TNF a IL-10 [4].
V svojim membránach majú aj CD26, a to v značnom množstve. Je to ektopeptidáza, ktorá odštepuje dipeptidy na N-konci peptidov. Významné je najmä odštepovanie dipeptidov z natívnej molekuly chemokínov, čím MAIT-bunky ovplyvňujú charakter a priebeh imunitnej odpovede [5]. Majú aj receptory NK-buniek, čo poukazuje na ich cytotoxické vlastnosti, čo napokon dokazuje ich schopnosť syntézy perforínov a granzýmov [6].
MAIT-bunky získali svoje pomenovanie pre svoje preferenčné umiestnenie v črevnej lamina propria. Ich význam pre slizničnú imunitu podčiarkuje aj fakt, že pri bezmikróbnych („germ-free“) myšiach MAIT-bunky chýbajú. Až neskôr sa zistilo, že sa nachádzajú aj v iných častiach organizmu. Najviac ich je v pečeni (20–50 %), v čreve (1–10 %) a v pľúcach (2–4 %). V krvi je ich do 10 % zo všetkých T-lymfocytov. MAIT-bunky človeka (myši ich majú prekvapujúco málo − 10 až 100 menej ako človek [1]) sa nachádzajú tiež v iných tkanivách vrátane ženskej genitálnej sliznice, obličiek, prostaty a vaječníkov [7].
AKTIVÁCIA MAIT-BUNIEK
Podobne ako T-lymfocyty a NKT-bunky aj MAIT-bunky potrebujú pre svoju aktiváciu svoje prezentačné molekuly. Kým pre T-lymfocyty sú to HLA-molekuly, pre NKT-bunky CD1D, tak pre MAIT-bunky ide o MR1-molekuly. Sú invariabilné a evolučne veľmi konzervované, podobajú sa HLA-molekulám prvej triedy, resp. CD1-molekulám. Nachádzajú sa na všetkých typoch buniek; sú v ich cytoplazme a až po väzbe ligandu sa zabudujú do membrány bunky [8].
MAIT-bunky sa aktivujú na veľmi široké spektrum grampozitívnych aj gramnegatívnych baktérií, ako aj mykobaktérií, ba dokonca reagujú aj na kandidy a nepriamo aj na vírusy. MR1-molekuly prezentujú MAIT-bunkám metabolity ktoré vznikajú riboflavínovou biosyntetickou dráhou (viažu aj metabolity vitamínu B9, ale tieto MAIT--bunky neaktivujú). Keďže cicavce riboflavín nesyntetizujú, je tak zabezpečená selekcia, čo patrí organizmu samému a na čo imunitný systém reagovať nesmie a čo je cudzie, ktoré treba čo najrýchlejšie a najefektívnejšie zlikvidovať [9].
MR1-molekuly sú za fyziologických okolností v membráne endoplazmového retikula. Ich žliabok je voľný, resp. zatiaľ nepoznáme jeho prirodzený ligand. Po väzbe ligandov sa MR1-molekuly presúvajú do membrány bunky, kde ho prezentujú MAIT-bunkám. Ligandy pochádzajú buď z extracelulárneho prostredia, alebo ich produkujú intracelulárne parazitujúce baktérie. Komplexy „MR1-VitB2“ zostávajú v membráne bunky niekoľko hodín a ak ich MAIT-bunky nerozpoznajú, vydajú sa na endocytovú dráhu svojej degradácie; niektoré snáď sa vracajú späť na povrch bunky [9].
MAIT-bunky sa aktivujú až po rozpoznaní svojho ligandu a získaní aktivačných cytokínov od buniek prezentujúcej antigén. V prípade infekcie, v zápalovom prostredí, pod vplyvom IL-18, IL-12 alebo IL-23 začnú syntetizovať IFN-γ a IL-17A, ktoré následne rozvíjajú obranné mechanizmy [17]. IFN-γ aktivuje makrofágy, ktoré následne zvýšia svoju cídnu aktivitu a usmrtia pohltené intracelulárne parazitujúce baktérie. IFN-γ aktivuje aj dendritové bunky, ktoré následne začnú produkovať IL-12, ktorý indukuje vznik Th1-imunitnej odpovede. IL-17A aktivuje neutrofily, ktoré zabíjajú extracelulárne parazitujúce baktérie. MAIT-bunky ničia infikované epitelové bunky aj priamo, lebo syntetizujú aj perforíny aj granzýmy B. Predpokladá sa, že za fyziologických okolností sa to deje najmä v čreve, kde MAIT-bunky kontrolujú normálnu baktériovú flóru čreva [10].
Vírusy, na rozdiel od baktérií, pretože nemajú vlastný metabolizmus, nemôžu aktivovať MAIT-bunky. Vírusy však dokážu stimulovať dendritové bunky a makrofágy (aktiváciou vzorkových receptorov TLR7, TLR8 a TLR9), aby produkovali IL-12 a IL-18. Keďže MAIT-bunky exprimujú početné receptory pre tieto cytokíny, aktivujú sa. Svojou produkciou IFN-γ, perforínov a granzýmov B infikované bunky zabíjajú [6, 10].
FYZIOLOGICKÁ FUNKCIA MAIT-BUNIEK
Hlavná biologická úloha MAIT-buniek je v obrane proti mikroorganizmom. Svedčia o tom viaceré pozorovania. Napríklad u pacientov s tuberkulózou pľúc dochádza k presunu MAIT-buniek z periférnej krvi do pľúc a prispievajú tu svojou aktivitou k obranyschopnosti. Rovnako tomu je aj pri infekcii vírusmi chrípky. Podobne pri črevných infekciách vyvolávaných Escherichia coli, Shigella flexneri, či Salmonella typhimurium dochádza k presunu MAIT-buniek z krvi do čreva a u pacientov trpiacich na sepsu pozorujeme zase v periférnej krvi zvýšenie počtu MAIT-buniek. Rezidentné MAIT-bunky majú význam v homeostáze tkanív, napr. v koži pod vplyvom komenzálnych baktérií produkujú IL-22, ktorý zodpovedá za regeneračné procesy pri jej poškodení [11].
Nemenej významná úloha MAIT-buniek je v obrane proti rakovine. Expresia NKG2D (aktivačný receptor NK-buniek) MAIT-bunkami im umožňuje rozpoznať na malígnych bunkách stresové molekuly (MICA, MICB a ULBP) a následne uvoľňovať cytotoxické molekuly (perforíny a granzýmy), ktoré malígne bunky zneškodnia. Okrem toho, aktivované MAIT-bunky patria medzi veľmi aktívnych producentov IFN-γ. Ide o cytokín, ktorý je rozhodujúci pre prirodzenú a adaptívnu imunitu proti vírusovým, niektorým baktériovým a protozoálnym infekciám. IFN-γ je dôležitým aktivátorom makrofágov a induktorom expresie molekúl hlavného histokompatibilného komplexu. Na nádorových bunkách zvyšuje počet HLA-molekúl prvej triedy ako aj FAS-molekúl (CD95), čo ich robí náchylnými k usmrteniu rôznymi typmi zabíjačských buniek. IFN-γ tiež aktivuje NK-bunky, cytotoxické T-lymfocyty (CTL) a M1-makrofágy, čím tiež svojim dielom prispieva k ničeniu nádorových buniek. Napokon, niektoré MAIT-bunky exprimujú aj CD16 (FcγRIII), čo im umožňuje likvidovať nádorové bunky, podobne ako NK-bunky, prostredníctvom ADCC-reakcie [12, 13] (obr. 2).
Obr. 2. Cytotoxicita sprostredkovaná bunkami závislá od protilátky (ADCC)
Figure 2. Antibody-dependent cell-mediated cytotoxicity (ADCC)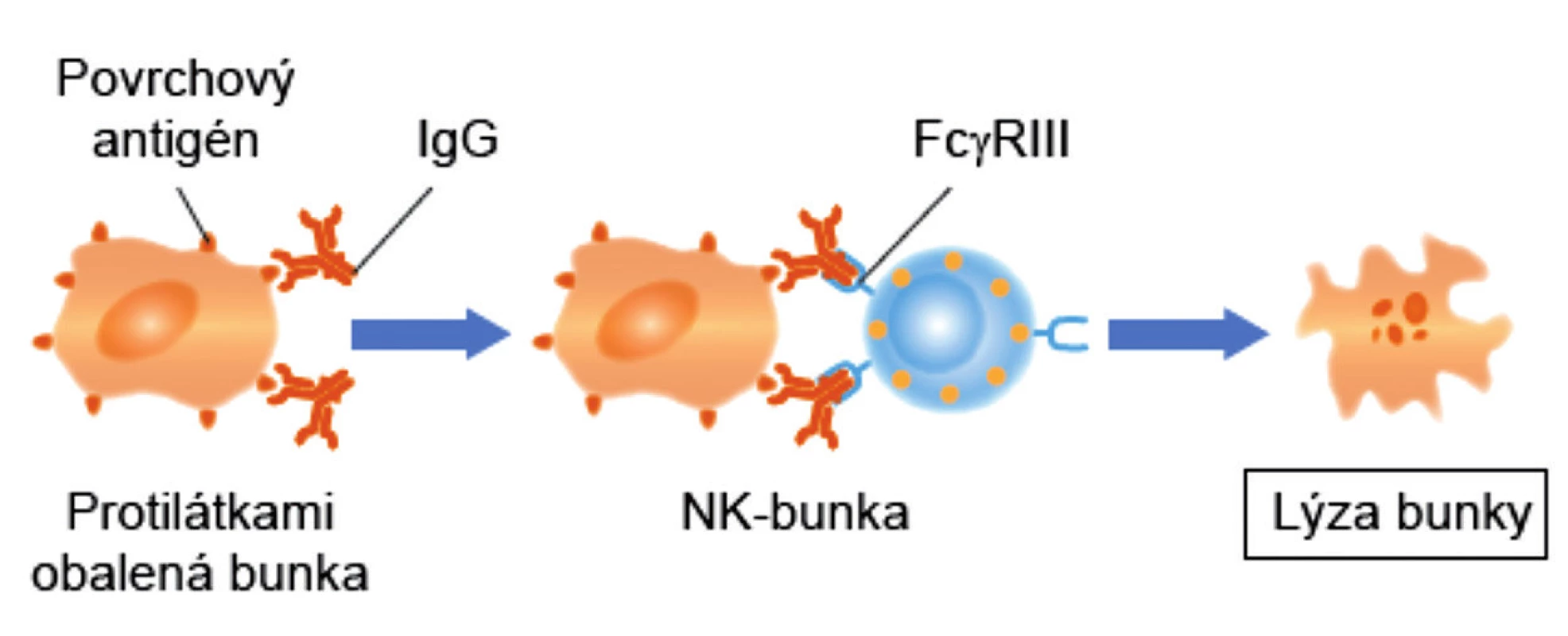
Na terčovú bunku sa nadviaže špecifická protilátka, ktorá v jej membráne rozpoznáva svoj špecifický antigén. Na takto obalenú terčovú bunku sa nadviaže K-bunka, pretože má receptory pre protilátky. Aktivuje sa a do bezprostrednej blízkosti terčovej bunky uvoľní cytotoxické látky, ktoré ju zničia.
ADCC – antibody dependent cell mediated cytolysis, K-bunka – killer cell
Specific antibody binds to the target cell and recognizes the specific antigen in the membrane of the latter. K cell, which has antibody receptors, binds to the antibodycoated target cell. It becomes activated and releases toxic compounds in the immediate vicinity of the target cell that kill it.
ADCC – Antibody-dependent cell-mediated cytolysis, K cell – killer cellMAIT-BUNKY V PATOLOGICKÝCH PROCESOCH
MAIT-bunky sa podieľajú aj na rozvoji viacerých autoimunitných chorôb a astma bronchiale. Pri ankylozujúcej spondilitíde nachádzame znížený počet cirkulujúcich MAIT-buniek, kým v synoviovej tekutine je to naopak, ich počty sú zvýšené. Navyše sú aktivované, t. j. exprimujú CD69, čo koreluje s aktivitou choroby. Aktiváciu MAIT-buniek zabezpečujú prozápalové cytokíny v mieste zápalu, nie rozpoznanie samotného antigénu. K rozvoju choroby prispievajú produkciou IL-17A [14].
Systémový lupus erythematosus charakterizuje zvýšená produkcia IFN-α (interferónový podpis). Tento dokáže aktivovať MAIT-bunky, čo sa prejaví zvýšenou expresiou CD69 v ich membránach. Počty CD69+ MAIT-buniek v periférnej krvi pozitívne korelujú s hladinou IL-18 a IFN-α v sérach od pacientov a s vážnosťou choroby. Zvýšené hladiny IL-18 zvyšujú aj expresiu adhezívnych molekúl VLA-4 v membránach MAIT-buniek, čo umožňuje ich interakciu s partnerskými molekulami VCAM-1 na endotelových bunkách obličiek a ich prechod do glomerulov, čo napokon vyústi do vývoja lupusovej nefritídy (v moči pacientov dokážeme IL-18 a solubilné VCAM-1 molekuly) [15].
MAIT-bunky sa podieľajú aj na patologických procesoch pri Crohnovej chorobe, ich úloha v patogenéze ulceróznej kolitídy je menej jasná. V stene čreva nachádzame zvýšený počet MAIT-buniek, kým na periférii je ich menej. Sú aktivované (CD69+) a ich počet koreluje s aktivitou choroby. Na patogenetických procesoch sa podieľajú syntézou IL-17A, čím podporujú zápal. Príčinou zvýšenej prítomnosti a aktivity MAIT-buniek pri Crohnovej chorobe môže byť aj zmena baktériovej flóry. Vieme, že je tu zvýšené množstvo baktérií patriacich oddeleniu (phylum) Bacteroidetes a znížené množstvo baktérií patriacich oddeleniu Firmicutes. A práve baktérie oddelenia Bacteroidetes výrazne aktivujú MAIT-bunky [16]. Bacteroidetes sú gramnegatívne obligatórne anaerobné paličky; v črevnom trakte sú prítomné predovšetkým rody Bacteroides a Prevotella. Oddelenie Firmicutes zastupujú grampozitívne baktérie s nízkym obsahom GC-párov v chromozómovej DNA. Patria sem rody Lactobacillus, Enterococcus, Fecalibacterium, Clostridium, Peptococcus, Peptostreptococcus, Eubacterium, Abiotrophia, Staphylococcus a iné.
Napokon MAIT-bunky sa podieľajú aj na patogenéze asthma bronchiale. Počty CD69+ MAIT-buniek u pacientov vo vzorkách z periférnej krvi sú znížené pre prestup z krvi do tkaniva. Počty CD69+ MAIT-buniek sú vo vzorkách periférnej krvi astmatikov znížené, pravdepodobne pre ich prestup do tkaniva dýchacích ciest. V bronchoalveolovej laváži ich počet je tak isto znížený, pravdepodobne pre ich depozíciu v distálnejších častiach dýchacích ciest. Zníženie počtov koreluje so závažnosťou a trvaním choroby [17]. Výsledky naznačujú, že MAIT-bunky sa podieľajú na rozvoji, ale nie na indukcii asthma bronchiale (doména ILC2 - a Th2-lymfocytov).
Z praktického hľadiska je významný poznatok, že MAIT--bunky sú veľmi citlivé na terapeutické dávky glukokortikoidov, takže ich počty v periférnej krvi pacientov liečených týmito imunosupresívami sú znížené. Liečba pacientov s AB, resp. s chronickou obštrukčnou chorobou pľúc (v češtine chronická obstrukční plicní nemoc) glukokortikoidmi zvyšuje tak ich vnímavosť na pneumónie, najmä tie, ktoré vyvoláva Streptococcus pneumoniae. Táto baktéria využíva riboflavínovú syntetickú dráhu, takže možno predpokladať, že za uvedenú možnú komplikáciu zodpovedá práve zníženie počtov a funkcie MAIT-buniek [18].
Zoznam skratiek
ADCC − cytotoxicita závislá od protilátky sprostredkovaná bunkami (antibody dependent cell cytotoxicity)
CD − diferenciačné molekuly (cluster of differentiation)
CTL − cytotoxické T-lymfocyty
IFN-γ − intereferón gama
IL − interleukín
ILC − innate lymphoid cells
MAIT-bunky − mucosal-associated invariant T cells
NK-bunky − natural killer cells
NKT-bunky − natural killer T cells
TNF − faktor nekrotizujúci nádory (tumournecrosing factor)
TLR − Toll like receptors
Do redakce došlo dne 26. 2. 2020.
Adresa pro korespondenci:
prof. MUDr. Milan Buc, DrSc.
Imunologický ústav LFUK
Odborárske nám. 14
813 72 Bratislava
Slovenská republika
e-mail: milan.buc@fmed.uniba.sk
Zdroje
1. Godfrey DI, Uldrich AP, McCluskey J, et al. The burgeoning family of unconventional T cells. Nat Immunol, 2015;16(11):1114–1123.
2. Koay HF, Gherardin NA, Anselm Enders A, et al. A three-stage intrathymic development pathway for the mucosal-associated invariant T cell lineage. Nat Immunol, 2016;17(11):1300–1311.
3. Franciszkiewicz K, Salou, Legoux F, et al, MHC class I-related molecule, MR1, and mucosal-associated invariant T cells. Immunol Rev, 2016;272(1):120–138.
4. Ghazarian LS, Caillat-Zucman S, Houdouin V. Mucosal-Associated invariant T cell interactions with commensal and pathogenic bacteria: Potential role in antimicrobial immunity in the child. Front Immunol, 2017;8 : 1837.
5. Ohnuma K, Dang NH, Morimoto C. Revisiting an old acquaintance: CD26 and its molecular mechanisms in T cell function. Trends Immunol, 2008;29(6):295–301.
6. Rudak PT, Choi J, Haeryfar SMM. MAIT cell-mediated cytotoxicity: Roles in host defense and therapeutic potentials in infectious diseases and cancer. J Leukoc Biol, 2018;104(3):473–486.
7. Gibbs A, Leeansyah E, Introini A, et al. MAIT cells reside in the female genital mucosa and are biased towards IL-17 and IL-22 production in response to bacterial stimulation. Mucosal Immunol, 2017;10(1):35–45.
8. Kjer-Nielsen L, Patel O, Corbett AJ, et al. MR1 presents microbial vitamin B metabolites to MAIT cells. Nature, 2012;491(7426):717–723.
9. Birkinshaw RW, Kjer-Nielsen L, Eckle SBG, et al. MAITs, MR1 and vitamin B metabolites. Curr Opin Immunol, 2014;26 : 7–13.
10. Kurioka A, Ussher JE, Cosgrove C, et al. MAIT cells are licensed through granzyme exchange to kill bacterially sensitized targets. Mucosal Immunol, 2015;8(2):429–440.
11. Garrett WS. Immune recognition of microbial metabolites. Nat Rev Immunol, 2020; 20(2):91–92.
12. Kursunel MA, Esendagli G. The untold story of IFN-gamma in cancer biology. Cytokine Growth Factor Rev., 2016;31 : 73–81.
13. Ling L, Lin Y, Zheng W, et al. Circulating and tumor-infiltrating mucosal associated invariant T (MAIT) cells in colorectal cancer patients. Sci Rep, 2016;6 : 20358.
14. Hayashi E, Chiba A, Tada K. et al. Involvement of mucosal-associated invariant T cells in ankylosing spondylitis. J Rheumatol, 2016;43(9):1695–1703.
15. Singh S, Wu T, Xie C, et al. Urine VCAM-1 as a marker of renal pathology activity index in lupus nephritis. Arthritis Res Ther, 2012;14(4):R164.
16. Tastan C, Karhan E, Zhou W, et al. Tuning of human MAIT cell activation by commensal bacteria species and MR1-dependent T-cell presentation. Mucosal Immunol, 2018;11(6):1591–1605.
17. Ishimori A, Harada N, Chibaet A, et al. Circulating activated innate lymphoid cells and mucosal-associated invariant T cells are associated with airflow limitation in patients with asthma. Allergol Int, 2017;66(2):302–309.
18. Talbot TR, Hartert TV, Mitchel E. Asthma as a risk factor for invasive pneumococcal disease. N Engl J Med, 2005;352(20):2082–2090.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2020 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Těžké komunitní pneumonie v intenzivní péči
- Data z první vlny epidemie covidu-19 z ÚVN Praha
- Individualizované dávkování vankomycinu u geriatrických pacientů
- Health literacy on HIV infection among adolescents in the Czech Republic: a case study of two Czech cities Plzeň and České Budějovice
- MAIT-bunky – ich biologický a medicínsky význam
- 29. Pečenkovy epidemiologické dny v Plzni, 2020
- Zomrel prof. MUDr. Štefan Straka, DrSc.
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Data z první vlny epidemie covidu-19 z ÚVN Praha
- Těžké komunitní pneumonie v intenzivní péči
- Individualizované dávkování vankomycinu u geriatrických pacientů
- MAIT-bunky – ich biologický a medicínsky význam
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



