-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Transplantácia obličky a metabolický syndróm
Kidney transplantation and metabolic syndrome
Aims:
The metabolic syndrome developed after kidney transplantation is the result of several factors which are identical with the risk factors in normal population, however, also some factors typical for the transplanted patients – especially the effects of immunosuppressive therapy.Material and Methods:
In the group of 268 patients after kidney transplantation, which had no type 1 or type 2 diabetes mellitus before transplantation, we identified patients with metabolic syndrome(based on IDF criteria), 12 months from the kidney transplantation. In all patients, we recorded the following parameters: age at the time of transplantation, type of immunosuppression, waist measure, the value of triacylglycerols, the value of HDL cholesterol, presence of arterial hypertension, and the value of glycaemia in fasting state (or presence of diabetes mellitus). The group of patients was divided into the control group and the group of patients with metabolic syndrome.Results:
The average age of patients was 46.1 ± 11.6 years. The control group included 149 patients (55.6 %), and we identified the metabolic syndrome in 119 patients (44.4 %). The patients with metabolic syndrome were significantly older (p < 0.0001), had significantly larger waist (both the entire group and the males and females) p < 0.0001. The females with metabolic syndrome had significantly lower value of HDL-cholesterol (p = 0.0013), and significantly higher number of patients with metabolic syndrome had hyperglycaemia in fasting state or diabetes mellitus (p = 0.0006).Conclusion:
By controlling the weight and waist, we may identify the risk patients for development of metabolic syndrome after kidney transplantation.Key words:
immunosuppressive therapy – kidney transplantation – metabolic syndrome
Autoři: Ivana Dedinská 1; Juraj Miklušica 1; Ľudovít Laca 1; Blažej Palkoci 1; Denisa Osinová 2; Pavel Makovický 3; Peter Galajda 3; Marián Mokáň 3
Působiště autorů: Chirurgická klinika a transplantačné centrum, Jesseniova LF UK a UN Martin 1; Klinika anesteziológie a intenzívnej medicíny, Jesseniova LF UK a UN Martin 2; I. interná klinika, Jesseniova LF UK a UN Martin 3
Vyšlo v časopise: Forum Diab 2016; 5(2): 94-98
Kategorie: Hlavná téma
Souhrn
Metabolický syndróm vzniknutý po transplantácii obličky je výsledkom viacerých faktorov, ktoré sú identické s rizikovými faktormi v bežnej populácii, avšak aj faktorov typických pre transplantovaných pacientov – predovšetkým účinkov imunosupresívnej liečby. V súbore 268 pacientov po transplantácii obličky, ktorí nemali diabetes mellitus 1., resp. 2. typu pred transplantáciou, sme identifikovali pacientov s metabolickým syndrómom (na základe IDF-kritérií), a to 12 mesiacov od transplantácie obličky. U všetkých pacientov sme zistili: vek v čase transplantácie, typ imunosupresie, obvod pása, hodnotu triacylglycerolov, hodnotu HDL-cholesterolu, prítomnosť artériovej hypertenzie a hodnotu glykémie nalačno (resp. prítomnosť diabetes mellitus). Súbor pacientov sme rozdelili na kontrolnú skupinu a skupinu pacientov s metabolickým syndrómom. Priemerný vek pacientov bol 46,1 ± 11,6 rokov. Do kontrolnej skupiny sme zaradili 149 pacientov (55,6 %) a u 119 (44,4 %) pacientov sme identifikovali metabolický syndróm. Pacienti s metabolickým syndrómom boli významne starší (p < 0,0001), mali významne väčší obvod pása (tak celý súbor ako aj muži a ženy) p < 0,0001, ženy s metabolickým syndrómom mali významne nižšiu hodnotu HDL-cholesterolu (p = 0,0013) a významne viac pacientov s metabolickým syndrómom malo hyperglykémiu nalačno, resp. diabetes mellitus (p = 0,0006). Kontrolou hmotnosti a obvodu pása môžeme identifikovať rizikových pacientov pre rozvoj metabolického syndrómu po transplantácii obličky. Skríning rizikových faktorov by sa mal realizovať ešte pred zaradením pacienta na čakaciu listinu.
Kľúčové slová:
imunosupresívna liečba – metabolický syndróm – transplantácia obličkyÚvod
Metabolický syndróm (MS) definujeme ako nenáhodný spoločný výskyt porúch metabolizmu cukrov súvisiacich s inzulínovou rezistenciou (IR), zahrňujúcich hraničnú glykémiu nalačno (HGN) a poruchu glukózovej tolerancie (PGT), centrálnej obezity, dyslipidémie spojenej so zvýšením hladiny triacylglycerolov (TAG) a znížením lipoproteínov s vyššou denzitou (HDL), artériovej hypertenzie (AH) a ďalších faktorov, ktoré sa podieľajú na zvýšenom riziku ischemickej choroby srdca (ICHS) a diabetes mellitus 2. typu (DM2T) [1]. Existencia viacerých definícií viedla k určitým problémom a treba povedať aj zmätkom, zvlášť pri epidemiologických štúdiách. Preto v roku 2005 IDF (International Diabetic Federation) navrhla zjednotenie v tejto otázke (ako pre klinických, tak aj laboratórnych pracovníkov), tab. 1 [2].
Tab. 1. Metabolický syndróm (IDF, 2005) 
Transplantácia obličky je typickým príkladom medziodborovej problematiky, ktorá využíva súčasné poznatky z nefrológie, urológie, chirurgie, imunológie a patológie. Predstavuje jednu z možností liečby pacientov so zlyhaním obličiek a je spojená s dlhším prežívaním pacientov v porovnaní s dialyzačnými metódami. Zmyslom transplantácie obličky je plná rehabilitácia pacientov a ich návrat do plnohodnotného života [3,4]. Metabolický syndróm vzniknutý po transplantácii obličky je výsledkom viacerých faktorov, ktoré sú identické s rizikovými faktormi v bežnej populácii, avšak aj faktorov typických pre transplantovaných pacientov – predovšetkým účinky imunosupresívnej liečby [5]. Kombinovaná imunosupresívna terapia výrazne zlepšila úspešnosť orgánových transplantácií. Okrem očakávaných účinkov (infekcie, malignity) sa pri dlhodobom užívaní rozvíjajú nežiaduce účinky, ktoré zahŕňajú diabetes mellitus, dyslipidémiu a s nimi združené kardiovaskulárne ochorenia, čo nepriaznivo vplýva na morbiditu a mortalitu transplantovaných pacientov [6]. Glukokortikoidy majú prostredníctvom regulácie génovej transkripcie silné imunosupresívne a protizápalové vlastnosti. Je dobre známe, že glukokortikoidy majú aj závažné metabolické nežiaduce účinky. Inhibítory kalcineurínu vyvolávajú reverzibilnú supresiu sekrécie inzulínu na úrovni transkripcie mRNA inzulínu väzbou na FK506 binding protein 12 a následnou inhibíciou kalcineurínu v B-bunkách pankreasu. Monoterapia rapamycínom, resp. kombinovaná imunosupresívna liečba (rapamycín + inhibítor kalcineurínu) je spojená s rezistenciou na inzulín a vyšším výskytom novovzniknutého diabetes mellitus po transplantácii. Je všeobecne známe, že tukové tkanivo produkuje hormóny, ktorých regulácia je multifaktoriálna. Viacerými štúdiami bolo potvrdené, že tvorbu hormónov tukového tkaniva (predovšetkým adiponektínu) ovplyvňujú genetické faktory, glukokortikoidy a telesná distribúcia tuku. Neustále rozvíjajúci sa transplantačný program vedie k nutnosti eliminovať metabolické nežiaduce účinky imunosupresívnej liečby [7]. Špecifický algoritmus pre imunosupresívny protokol a imunouspresívne režimy u rizikových pacientov by mali eliminovať vznik DM po transplantácii (new onset diabetes mellitus after transplantation – NODAT). Samozrejme, pri voľbe imunosupresie je nutné vziať do úvahy aj imunologické riziko pacienta s cieľom vyhnúť sa rejekcii. U pacientov s nízkym rizikom rejekcie a vysokým rizikom vzniku NODAT je vhodný cykosporin A. Naopak u pacientov s vysokým rizikom rejekcie sa odporúča takrolimus [8,9]. V prípade, že dôjde k rozvoju NODAT, je vhodné redukovať dávku takrolimu a kortikosteroidy, avšak vtedy je vhodné zvýšiť (resp. ponechať alebo pridať do liečby) mykofenolát mofetil, aby bola zachovaná dostatočná imunosupresia [10]. U pacientov, ktorí sú liečení takrolimom a NODAT je ťažko kontrolovaný, je alternatívou prechod na cyklosporín A [11]. V prípade pacienta v tesnom potransplantačnom období alebo u pacienta s vysokým imunologickým rizikom (anamnéza akútnej rejekcie, práve liečená akútna rejekcia, sekundárna a vyššia transplantácia obličky), môže byť zmena imunosupresie (takrolimus na cyklosporín A) kontraproduktívna. Redukcia imunosupresie u takto rizikových pacientov môže navodiť rozvoj rejekcie a liečba rejekcie v konečnom dôsledku vedie k ďalšiemu zhoršeniu NODAT.
Materiál a metódy
Súbor tvorilo 268 pacientov (stredoeurópanov) po primárnej transplantácii obličky od mŕtveho darcu (v rokoch 2003–2012) v Transplantačnom centre Martin. Do sledovania sme nezaradili pacientov, ktorí mali v čase transplantácie už diagnostikovaný diabetes mellitus 1. a 2. typu alebo prediabetes (hyperglykémia nalačno alebo porucha glukózovej tolerancie). V súbore sme identifikovali pacientov s metabolickým syndrómom (na základe IDF kritérií), a to 12 mesiacov od transplantácie obličky. U všetkých pacientov sme zistili: obvod pása, hodnotu triacylglycerolov, hodnotu HDL-cholesterolu, prítomnosť artériovej hypertenzie a hodnotu glykémie nalačno (resp. prítomnosť diabetes mellitus). V prípade nálezu hyperglykémie nalačno bol u pacienta realizovaný orálny glukózový tolerančný test. Diabetes mellitus po transplantácii bol diagnostikovaný podľa ADA (American Diabetes Association) kritérií.
U všetkých pacientov sme zistili vek v čase transplantácie, body mass index (BMI), hmotnosť v čase transplantácie, prírastok na hmotnosti od transplantácie v 12. mesiaci od transplantácie obličky, typ imunosupresie – IS (takrolimus, cyklosporin A, sirolimus) a ich priemerné hladiny a priemernú dávku prednizonu/deň počas sledovaného obdobia. Súbor pacientov sme rozdelili na kontrolnú skupinu a skupinu pacientov s metabolickým syndrómom. V skupine pacientov s metabolickým syndrómom sme zistili zastúpenie jednotlivých kritérií pre metabolický syndróm a zistili sme hodnoty odhadovanej glomerulárnej filtrácie (eGFR) 12 mesiacov po transplantácii obličky.
V štatistickom zhodnotení sme použili certifikovaný štatistický program MedCalc verzia 13. 1. 2. a nasledovné štatistické analýzy: Studentov t-test, χ2- test. Za štatisticky významnú hodnotu považujeme p < 0,05.
Výsledky
V celom súbore bolo 268 pacientov s priemerným vekom 46,1 ± 11,6 rokov, z toho 155 mužov a 113 žien. Do kontrolnej skupiny sme zaradili 149 pacientov (55,6 %) a u 119 (44,4 %) pacientov sme identifikovali metabolický syndróm (MS). V súbore bolo 214 (79,9 %) pacientov, ktorí užívali v sledovanom období takrolimus, 30 pacientov, ktorí užívali cyklosporín (11,2 %) a 24 pacientov (8,9 %), ktorí užívali mTOR inhibítor.
Porovnali sme priemerné hladiny IS a štatistickým zhodnotením sme zistili významne vyššiu hladinu sirolimu (p < 0,0001) v skupine pacientov s metabolickým syndrómom. V priemerných hladinách takrolimu a cyklosporinu sme nenašli štatisticky významný rozdiel medzi kontrolnou skupinou a skupinou pacientov s MS, podobne aj priemerná dávka prednizonu/deň bola bez štatisticky významného rozdielu v sledovaných skupinách (p = 0,5083), tab. 2.
Tab. 2. Porovnanie jednotlivých sledovaných parametrov v kontrolnej skupine vs skupina s MS 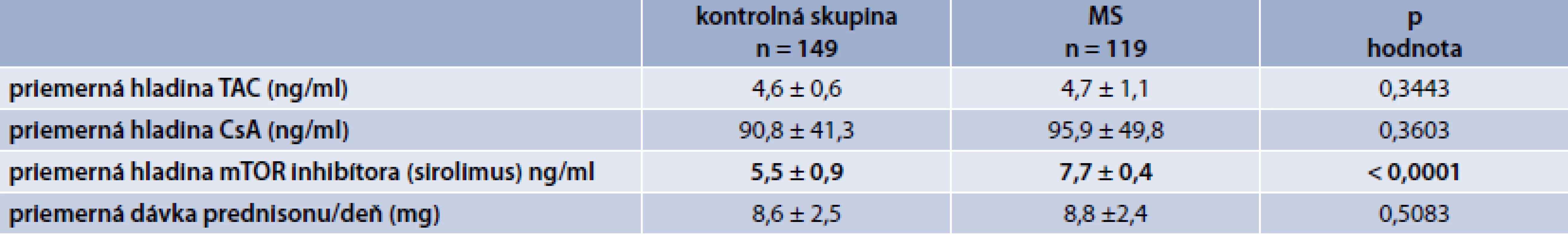
TAC – takrolimus CsA – cyklosporín A mTOR proteinkináza (mammalian target of rapamycin) V tab. 3 sú zobrazené charakteristiky súboru a porovnanie kontrolnej skupiny a skupiny pacientov s MS. Pacienti s MS boli významne starší, mali významne väčší obvod pása (tak celý súbor ako aj muži a ženy), ženy s MS mali významne nižšiu hodnotu HDL-cholesterolu a významne viac pacientov s MS malo hyperglykémiu nalačno, resp. diabetes mellitus.
Tab. 3. Porovnanie jednotlivých sledovaných parametrov v kontrolnej skupine vs skupina s MS 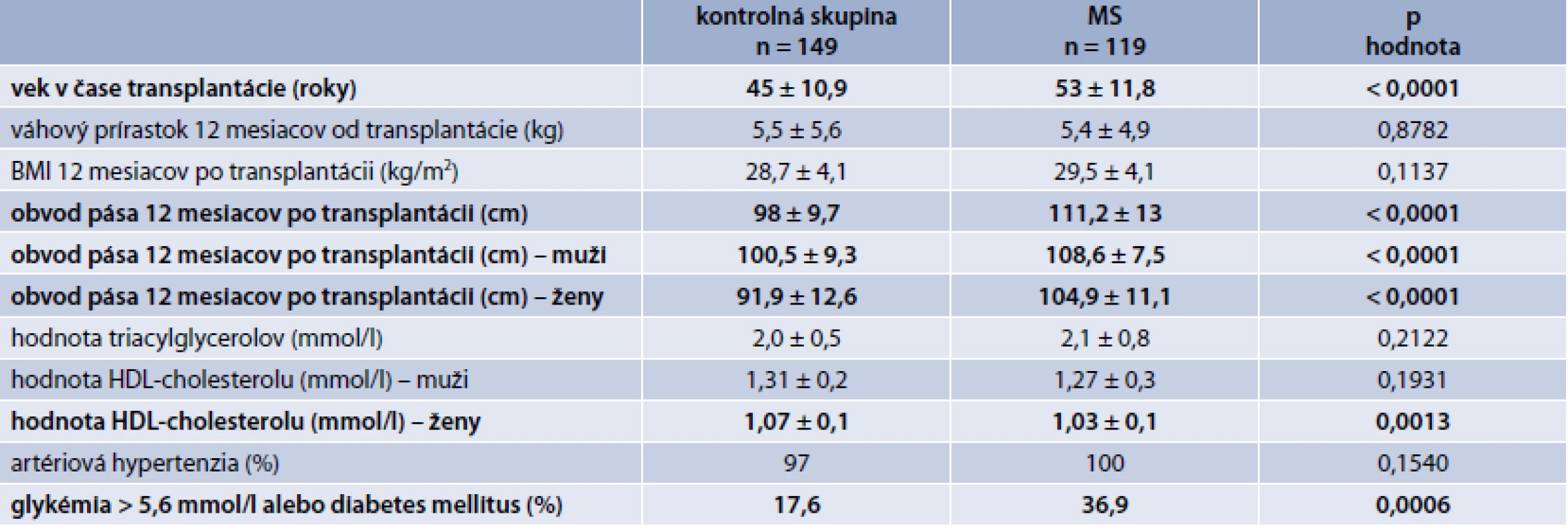
Ďalej sme v skupine s MS vyhodnotili zastúpenie jednotlivých komponentov MS. Najčastejšie sa vyskytovala artériová hypertenzia (100 %), nasledovala hyperglykémia nalačno, resp. DM (36,9 %), hodnota triacylglycerolov > 1,7 mmol/l (31 %) a nakoniec hodnota HDL-cholesterolu < 1,04 mmol/l, resp. 1,29 mmol/l (21 %).
Hodnota odhadovanej glomerulárnej filtrácie (eGFR) podľa CKD-EPI rovnice 12 mesiacov po transplantácii obličky bola v kontrolnej skupine 52,8 ml/min, v skupine pacientov s MS to bolo štatisticky významne menej (46,8 ml/min). Hodnota kreatinínu 12 mesiacov po transplantácii obličky bola v kontrolnej skupine 135,7 µmol/l, v skupine pacientov s MS 140,1 µmol/l (tab. 4).
Tab. 4. Porovnanie funkcie štepu 12 mesiacov po transplantácii 
Diskusia
V bežnej populácii je metabolický syndróm spojený s rizikom rozvoja DM a kardiovaskulárnych ochorení. Metabolický syndróm je taktiež spojený s proteinúriou a zníženou GFR. DM po transplantácii a proteinúria sú pomerne časté a bežné komplikácie po transplantácii obličky a úloha metabolického syndrómu v ich rozvoji je v poslednej dobe v centre pozornosti. Vplyv metabolického syndrómu po transplantácii na rozvoj kardiovaskulárnych ochorení môže byť skreslený, a to z toho dôvodu, že riziko kardiovaskulárnych ochorení sa v prípade úspešnej transplantácie výrazne znižuje v porovnaní s pacientmi v dialyzačnom programe. Stále taktiež nie je jasný vplyv metabolického syndrómu na rozvoj DM po transplantácii (new-onset diabetes after transplantation – NODAT) v porovnaní s tradičnými rizikovými faktormi, ako je vek, etnický pôvod, rodinná anamnéza, resp. obezita. A nakoniec, patofyziológia vzniku MS v bežnej populácii je v prípade transplantovaných pacientov dramaticky zmenená užívanou imunosupresívnou liečbou [12].
Obezita pred transplantáciou (definovaná ako BMI > 30 kg/m2) zvyšuje riziko straty štepu a po transplantácii zvyšuje riziko kardiovaskulárnych ochorení [13]. Prírastok na hmotnosti je u pacientov po transplantácii takmer pravidlom [14,15]. Kolektív slovenských autorov identifikoval obvod pása u mužov > 94 cm a u žien > 80 cm (podľa IDF-kritérií pre MS) v súbore slovenských pacientov po transplantácii obličky ako nezávislý rizikový faktor rozvoja NODAT v horizonte 12 mesiacov (muži: HR = 1,9492, [95% CI: 1,1697–3,2480], p = 0,0104 a ženy: HR = 4,5018, [95% CI: 1,8669–10,8553], p = 0,009) [16]. Tento fakt podporuje aj takmer 40% výskyt prediabetických stavov, resp. DM v našom súbore v skupine pacientov s MS. Podľa IDF kritérií pre MS je obvod pása základným parametrov pre MS. V našom súbore sme preto logicky zistili štatisticky významne väčší obvod pása v prípade pacientov s MS v porovnaní s kontrolnou skupinou (a taktiež izolovane v prípade mužov a žien). Obezita potenciálnych príjemcov pred transplantáciou je častý nález. BMI > 35 kg/m2 je kontraindikáciou pre transplantáciu obličky a BMI v rozmedzí 33–35 kg/m2 je relatívnou kontraindikáciou k transplantácii s nutnosťou predtransplantačného vyšetrenia chirurgom. Vyššie hodnoty BMI pred transplantáciu sú spojené s inzulínovou rezistenciou po transplantácii a edukácia pacientov o redukcii hmotnosti ešte pred transplantáciou vedie k zníženému riziku vzniku NODAT a kardiovaskulárnych ochorení [17–19].
Artériová hypertenzia je bežná po transplantácii obličky a prispieva k strate štepu. Vzácnou príčinou je stenóza anastomózy alebo stenóza a. renalis nad anastomózou [20]. K artériovej hypertenzii po transplantácii môže prispievať aj užívanie cyklosporínu A, ktorý je však v súčasnosti de novo používaný len v prípade veľmi nízkeho imunologického rizika u starších pacientov. V našom súbore sa artériová hypertenzia ako komponent metabolického syndrómu vyskytovala u všetkých pacientov s MS, ale v prípade pacientov v kontrolnej skupine to bolo tiež až v 97 % – teda sme nepotvrdili štatisticky významný rozdiel vo výskyte artériovej hypertenzie v sledovaných skupinách. Tento nález potvrdzuje veľmi veľkú prevalenciu artériovej hypertenzie v populácii pacientov po transplantácii obličky.
Hodnota triacylglycerolov bola v prípade kontrolnej skupiny a skupiny s MS bez významného rozdielu, významný rozdiel sme zaznamenali v prípade hodnoty HDL-cholesterolu u žien. Hyperliporpoteinémia pri MS je charakterizovaná tzv. aterogénnym lipidovým profilom. Pri vzniku hyperlipoproteinémie hrá dôležitú úlohu inzulínová rezistencia a hyperinzulinémia s rezistenciou v oblasti supresívneho účinku inzulínu na lipolýzu viscerálneho tuku a tvorbu VLDL v pečeni [21]. Na hodnotu triacylglycerolov má vplyv aj imunosupresívna liečba, a to predovšetkým mTOR inhibítory (v našom súbore mali pacienti s MS signifikantne vyššiu hladinu mTOR inhibítora v sledovanom období). Sirolimus blokuje sekréciu inzulínu sprostredkovanú pomocou GLUT1. Prodiabetogénny účinok mTOR môže byť vysvetlený tým, že mTOR komplex 1 a 2, ktorý je inhibovaný, má vplyv na inzulínové signálne dráhy. Inhibícia mTOR komplexu má kľúčovú úlohu v inzulínovej signálnej kaskáde a v experimentálnych štúdiách bol potvrdený priamy toxický účinok sirolimu na B-bunky pankreasu v zmysle apoptózy s autofágiou. Účinok je silnejší v prípade kombinovanej liečby mTOR + CNI . Sirolimus znižuje vychytávanie glukózy v bunkách tukového tkaniva a ovplyvňuje aj metabolizmus glukózy v pečeni. Monoterapia mTOR inhibítormi, resp. kombinovaná terapia (mTOR + CNI) je spojená s inzulínovou rezistenciou, hyperlipoproteinémiou s inhibíciou adipogenézy a naopak stimuláciou lipolýzy [22,23].
V súbore našich pacientov s MS sme zistili signifikantne horšiu funkciu štepu charakterizovanú eGFR (CKD-EPI) 12 mesiacov po transplantácii obličky v porovnaní s pacientmi v kontrolnej skupine. Samozrejme, na funkciu štepu vplývajú viaceré faktory (napríklad rejekčné epizódy, parametre darcu a pod). Na funkciu štepu významne vplýva aj vek a komorbidity darcu a vzhľadom k tomu, že pacient v skupine MS boli signifikantne starší, môžeme predpokladať, že aj darcovia pre týchto príjemcov mali vyšší vek v porovnaní s darcami pacientov v kontrolnej skupine (berúc do úvahy alokačné kritériá platné v SR). Samozrejme, MS a jeho komponenty ovplyvňujú tak prežívanie pacientov, ako aj funkciu štepu, ale predovšetkým v dlhodobom horizonte (7 a viac rokov po transplantácii) [24].
Záver
Kontrola hmotnosti a obvodu pása je veľmi jednoduchá metóda, ktorou môžeme identifikovať rizikových pacientov pre rozvoj metabolického syndrómu po transplantácii obličky. Skríning rizikových faktorov pre rozvoj MS a NODAT po transplantácii by sa mal realizovať ešte pred zaradením pacienta na čakaciu listinu, vhodné je zrealizovať orálny glukózový tolerančný test (minimálne u pacientov s pozitívnou rodinnou anamnézou pre diabetes mellitus a u pacientov s abdominálnou obezitou).
Pacienti na čakacej listine, ktorí majú rizikové faktory pre diabetes mellitus, by preto mali byť informovaní o ich eliminácii (kontrola hmotnosti, diéta, cvičenie) [24] – kľúčovú úlohu v edukácii majú nefrológovia v dialyzačných strediskách v spolupráci s diabetológmi. Okrem toho, malo by byť samozrejmosťou, že pacient prestane fajčiť [25].
MUDr. Ivana Dedinská, PhD.
idedinska@yahoo.co.uk
MUDr. Juraj Miklušica, PhD.
juraj.miklusica@gmail.com
Chirurgická klinika a transplantační centrum, UN Martin
www.unm.sk
Doručené do redakcie 4. 5. 2016
Prijaté po recenzii 12. 5. 2016
Zdroje
1. Galajda, P, Mokáň M. Problematika etiopatogenézy a diagnostiky metabolického syndrómu. Diabetes a obezita 2004; 4(7): 39–49.
2. Pearson TA, Mensah GA, Alexander RW et al. [AHA/CDC Scientific Statement]. Markers of inflammation and cardiovascular disease: application to clinical and public health practice. Circulation 2003; 107(3): 499–511.
3. Dedinská I, Laca L, Miklušica J et al. Twelve-Month and Five-Year Analyses of Risk Factors for New-Onset Diabetes After Transplantation in a Group of Patients Homogeneous for Immunosuppression. Transplant Proc 2015; 47(6): 1831–1839.
4. Laca ľ, Olejník J, Vician M et al. The effect of occlusive techniques on the short-term prognosis after liver resections. Hepatogastroenterology 2006; 53(70): 576–579.
5. Goldsmith D, Pietrangeli CE. The metabolic syndrome following kidney transplantation. Kidney Int Suppl 2010; (118): S8-S14.
6. Kershaw EE, Flier JS. Adipose tissue as an endocrine organ. J Clin Endocrinol Metab 2004; 89(6): 2548–2556.
7. Karlsson AF, Berglund L, Berne CH. Low serum adiponectin concentrations are associated with insulin sensitivity independent of obesity in Sudanese subjects with type 2 diabetes mellitus. Diabetol Metabolic Syndr 2013; 5(1): 15.
8. Ekberg H, Tedesco-Silva H, Demirbas A et al. [ELITE-Symphony Study]. Reduced exposure to calcineurin inhibitors in renal transplantation. N Engl J Med 2007; 357(25): 2562–2575.
9. Noël C, Abramowicz D, Durand D et al. Daclizumab versus antithymocyte globulin in high-immunological-risk renal transplant recipients. J Am Soc Nephrol 2009; 20(6): 1385–1392.
10. van Gelder T, Le Meur Y, Shaw LM et al. Therapeutic drug monitoring of mycophenolate mofetil in transplantation. Ther Drug Monit 2006; 28(2): 145–154.
11. Pascual J, Galeano C, Royuela A et al. A systematic review on steroid withdrawal between 3 and 6 months after kidney transplantation. Transplantation 2010; 90(4): 343–349.
12. Hricik DE. Metabolic Syndrome in KidneyTransplantation: Management of Risk Factors. Clin J Am Soc Nephrol 2011; 6(7): 1781–1785.
13. Meier-Kriesche HU, Arndorfer JA, Kaplan B. Theimpact of body mass index on renal transplant outcomes: A significant independent risk factor for graft failure and patient death. Transplantation 2002; 73(1): 70–74.
14. Clunk JM, Lin CY, Curtis JJ. Variables affecting weight gain in renal transplant recipients. Am J Kidney Dis 2001; 38(2): 349–353.
15. Potluri K, Hou S. Obesity in kidney transplant recipients and candidates. Am J Kidney Dis 2010; 56(1): 143–156.
16. Dedinská I, Laca Ľ, Miklušica M et al. Waist circumference as anindependent risk factorfor NODAT. Ann Transplant 2015; 20 : 154–159. Dostupné z DOI: <http://dx.doi.org/10.12659/AOT.892067>
17. Cashion AK, Sanchez ZV, Cowan PA et al. Changes in weight during the first year after kidney transplantation. Prog Transplant 2007; 17(1): 40–47.
18. Leavey SF, McCullough K, Hecking E et al. Body mass index and mortality in ‘healthier’ as comparedwith ‘sicker’ haemodialysis patients: results from the Dialysis Outcomes and Practice Patterns Study (DOPPS). Nephrol Dial Transplant 2001; 16(12): 2386–2394.
19. Salahudeen AK. Obesity and survival on dialysis. Am J Kidney Dis 2003; 41(5): 925–932.
20. Zeleňák K, Šinák I, Janík J et al. Bleeding in acute pancreatitis treated by transcatheter arterial embolization with ethylen-vinyl alcohol copolymer (ONYX). VASA 2012; 41(5): 380–382.
21. Dedinská I, Kantárová D, Laca et al. Metabolické účinky imunosupresívnej liečby. Diabetes a obezita 2014; 14(27): 81–85.
22. Stuchlíková M, Kantárová D, Michalková D et al. Association of HLA-DPB1 alleleswith type I diabetes mellitus in Slovak population. Bratislavské lekárske listy 2006; 107(3): 73–75.
23. Dedinská I, Miklušica J. Základy pre odbery orgánov a transplantácie obličiek. P + M: Turany 2014. ISBN 978–80–89694–12–9. Dostupné z WWW: <http://portal.jfmed.uniba.sk/clanky.php?aid=271>.
24. Wilkinson A, Davidson J, Dotta F et al. Guidelines for the treatment and management of new-onset diabetes after transplantation. Clin Transplant 2005; 19(3): 291.
25. Vojtková J, Ďurdík P, Michnová Z et al. Exhaled carbonmonoxide in adolescents with diabetic cardiovascular autonomic neuropathy. J Pediatr Endocrinol Metab 2014; 27(7–8): 709–715.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseForum Diabetologicum
Najčítanejšie tento týždeň
2016 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Konsenzuálny terapeutický algoritmus pre liečbu pomocou inzulínovej pumpy a kontinuálne meranie glykémie (v súlade s aktuálnym znením indikačných obmedzení)
- Kardiovaskulárne riziko a diabetes mellitus, odborné sympózium na XXXI. kongrese Slovenskej hypertenziologickej spoločnosti SLS a konferencii pracovnej skupiny preventívnej kardiológie SKS
- Vážené dámy, vážení páni, milí kolegovia, milí čitatelia
-
Kvalita péče o pacienty s diabetem v České republice.
Analýza dat VZP - Iatrogénna hypoglykémia ako závažný medicínsky problém
- Výskyt diabetickej retinopatie v populácii pacientov s diabetes mellitus na Slovensku
- Transplantácia obličky a metabolický syndróm
- Konsenzuálny terapeutický algoritmus pre diabetes mellitus 2. typu (v súlade s SPC, aktuálnym znením indikačných obmedzení a odporúčaní ADA/EASD)
- Forum Diabetologicum
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Konsenzuálny terapeutický algoritmus pre liečbu pomocou inzulínovej pumpy a kontinuálne meranie glykémie (v súlade s aktuálnym znením indikačných obmedzení)
- Konsenzuálny terapeutický algoritmus pre diabetes mellitus 2. typu (v súlade s SPC, aktuálnym znením indikačných obmedzení a odporúčaní ADA/EASD)
- Transplantácia obličky a metabolický syndróm
- Iatrogénna hypoglykémia ako závažný medicínsky problém
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



