-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Chronické srdeční selhání – specifika léčby seniorů
Chronic heart failure – specifics of treating seniors
Heart failure is a serious disease with a higher prevalence in senior age. There are several drug classes, which are recommended for the treatment of chronic heart failure. In this article we discuss these drugs and also mention specific aspects of pharmacotherapy in seniors. We also mention the possibilities of non-surgical device treatment and cardio-surgical interventions. At the end we discuss palliative care approach, which is appropriate for the treatment of irreversible terminal heart failure.
Keywords:
heart failure – pharmacotherapy – palliative care
Autoři: L. Pavlíčková; A. Cybulja
Vyšlo v časopise: Geriatrie a Gerontologie 2015, 4, č. 2: 74-80
Kategorie: Přehledové články
Souhrn
Srdeční selhání je závažné onemocnění, jehož prevalence stoupá s věkem. V článku jsou probrány jednotlivé lékové skupiny doporučované pro léčbu chronického srdečního selhání. Jsou zde zmíněna specifika farmakoterapie s ohledem na seniory a dále jsou uvedeny možnosti přístrojové a kardiochirurgické léčby. V závěru je diskutována paliativní péče, která je indikovaná v případě ireverzibilního terminálního srdečního selhání.
Klíčová slova:
srdeční selhání – farmakoterapie – paliativní péčeDiagnóza a klasifikace
Chronické srdeční selhání postihuje zhruba 10 % seniorské populace ve věku nad 70 let(1).
Stanovení diagnózy chronického srdečního selhání se dříve opíralo o takzvaná Framinghamská kritéria(2). Bylo nutné, aby pacient splňoval alespoň 2 z hlavních kritérií či 1 hlavní a 2 vedlejší kritéria (tab. 1). Podle současných doporučení Evropské i České kardiologické společnosti by pacienti s diagnózou srdečního selhání měli mít některý z těchto projevů: dušnost, ortopnoe, paroxysmální noční dušnost, snížená tolerance zátěže, mdloby, otoky dolních končetin, synkopy, rychlý nárůst hmotnosti, popřípadě ztráta hmotnosti v pokročilém stadiu, palpitace, kašel, zmatenost a delirantní stavy (zejména u starších pacientů). Dále by měly být přítomny objektivní známky kardiální insuficience, jako je například zvýšený centrální žilní tlak, hepatojugulární reflux, třetí srdeční ozva, srdeční šelest, chrůpky na plicích, otoky dolních končetin, skrota či zad (podle polohy pacienta), přikrácený poklep nad plícemi, hepatomegalie, ascites nebo v pokročilém stadiu známky kardiální kachexie. Všechno jsou to projevy a známky nespecifické, proto je pro diagnózu srdečního selhání potřeba průkaz strukturální či funkční abnormity srdce. Je také vhodné zjistit vyvolávající příčinu srdečního selhání, respektive kardiální dekompenzace, a to zvláště, je-li možné ji odstranit (infekce, tachyfibrilace síní apod.). Ke stanovení diagnózy a závažnosti srdečního selhání jsou kromě klinických projevů onemocnění důležitá pomocná vyšetření – echokardiografie, EKG, skiagrafie a laboratorní vyšetření. K těmto základním vyšetřovacím metodám je možné připojit specializovaná vyšetření za účelem stanovení etiologie srdečního selhání – koronarografie, magnetická rezonance, scintigrafie myokardu a jiné(3, 4).
Tab. 1. Framinghamská kritéria srdečního selhání (převzato z www.medicalcriteria.com) 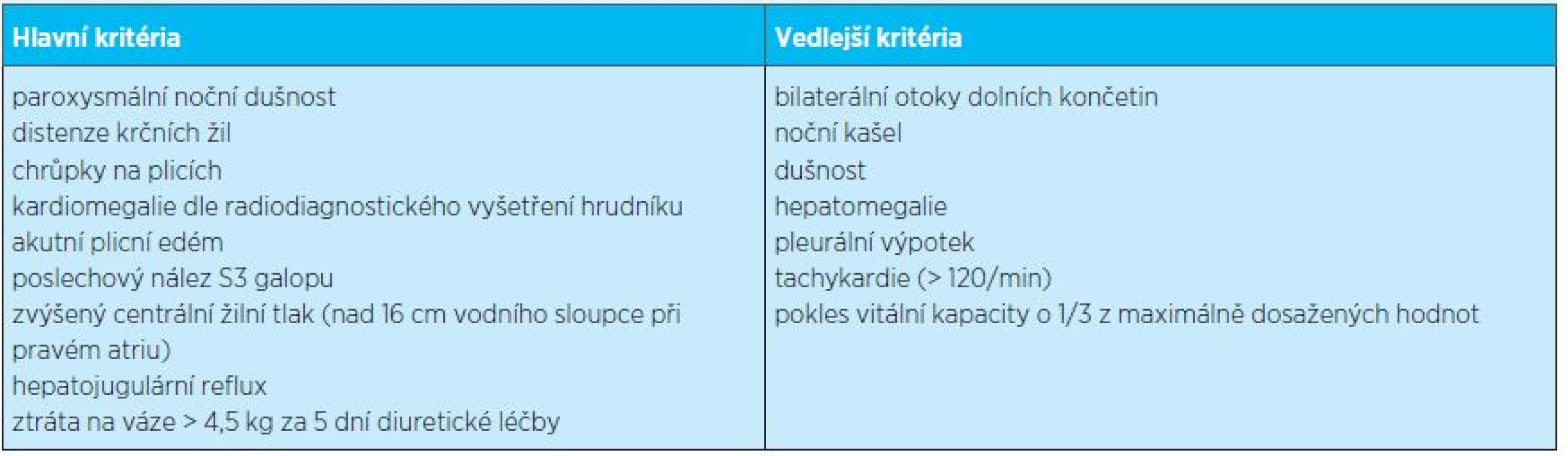
Závažnost srdečního selhání je nejčastěji klasifikována podle škály New York Heart Association – NYHA (tab. 2). Podle Americké kardiologické společnosti je možné použít též novou klasifikaci(5), která zahrnuje pacienty s rizikem rozvoje srdečního selhání a hodnotí progresi onemocnění (tab. 3).
Tab. 2. Klasifikace srdečního selhání podle New York Heart Association (NYHA) 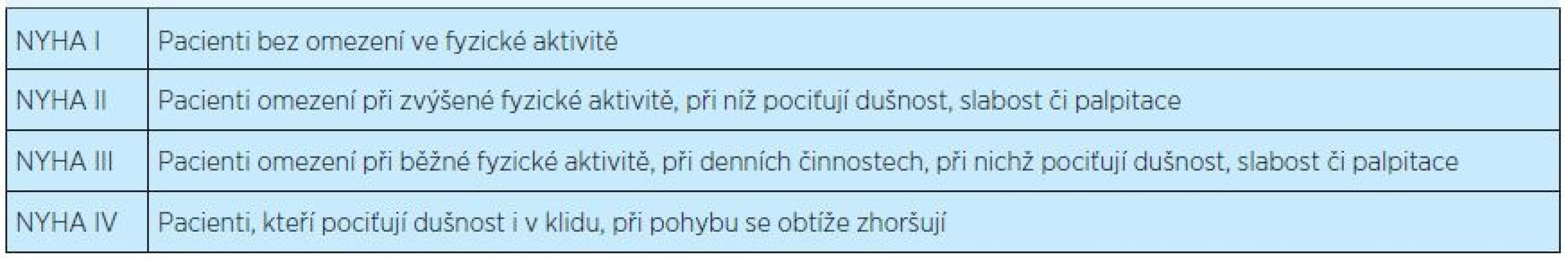
Tab. 3. Nová klasifikace srdečního selhání podle Americké kardiologické společnosti podle doporučených postupů z roku 2009<sup>(5)</sup> 
Farmakoterapie
Podkladem projevů syndromu srdečního selhání je, alespoň do značné míry, aktivace neurohumorálního systému renin-angiotenzin-aldosteron a sympatického nervového systému. Díky mediátorům těchto systémů dochází k retenci sodíku, tekutin a k myokardiální elektrické nestabilitě. Proto je také farmakologická léčba cílena na tyto abnormity. Z hlediska terapie a celkové strategie léčby pacientů je zásadní poznání, zda se jedná o systolické srdeční selhání, tedy srdeční selhání se sníženou systolickou funkcí levé komory, či o srdeční selhání se zachovanou systolickou funkcí levé komory srdeční (ejekční frakce levé komory nad 50 %), u něhož je za příčinu srdečního selhání považována zejména diastolická dysfunkce levé komory. Tento druhý typ srdečního selhání je častěji zastoupen u žen a jeho prevalence stoupá s věkem. Více probádanou formou jak z hlediska patofyziologie, tak z hlediska farmakoterapie je srdeční selhání se sníženou systolickou funkcí levé komory, neboť většina velkých randomizovaných studií zahrnovala převážně pacienty s tímto typem srdečního selhání.
ACEI a ARB
Inhibitory angiotenzin-konvertujícího enzymu (ACEI) významně snižují mortalitu a morbiditu pacientů se srdečním selháním; měly by být společně s betablokátory základem farmakoterapie srdečního selhání se sníženou systolickou funkcí levé komory. Opatrnosti při jejich preskripci je třeba u pacientů s renální insuficiencí, neboť mohou mírně zhoršovat renální funkce a současně zvyšovat hladinu draslíku (K+) v krvi. Neměly by být proto nasazovány při hladině kreatininu nad 221 µmol/l nebo glomerulární filtraci (eGFR) pod 30 ml/min/1,73 m2. Kontraindikací k jejich podávání je též anamnéza oboustranné stenózy renální tepny. Negativní vliv na renální funkce je potencován současným užíváním nesteroidních antirevmatik. Hladinu K+ je třeba sledovat i při normálních ledvinných funkcích, neboť hyperkalemie patří k nežádoucím účinkům ACE inhibitorů. Dalším nežádoucím účinkem je suchý kašel, který se podle dostupných údajů vyskytuje v souvislosti s léčbou ACEI u 5–10 % bílých Evropanů, ale až u 50 % Číňanů(6, 7, 8). Angioedém vlivem užívání ACE inhibitorů se vyskytuje u méně než 1 % pacientů; je způsoben aktivací kininu(8). Přestože je účinek ACE inhibitorů chápaný jako skupinový efekt, zdá se, že mohou být mezi jednotlivými léčivy rozdíly.
Například ve studii, kterou provedl Pilote et al. u populace seniorů(9), byla zjištěna mortalita vyšší o 10–15 % při užívání enalaprilu a captoprilu oproti jiným ACE inhibitorům. Nejčastějším nežádoucím účinkem ACE inhibitorů je ortostatická hypotenze. U seniorů je tento efekt výrazněji manifestován vzhledem k zhoršené autoregulaci cévního tonu a snížené elasticitě tepen. Blokátory receptorů pro angiotenzin (ARB) je doporučováno použít při intoleranci ACE inhibitorů z důvodu suchého kašle či angioedému. Mají podobný vliv na mortalitu pacientů se srdečním selháním jako ACE inhibitory. Nedoporučuje se však jejich přidání k léčbě ACE inhibitorem a betablokátorem, neboť tento lékový režim byl asociován se zvýšenou mortalitou a morbiditou(6).
Betablokátory
Mortalitu i morbiditu pacientů se srdečním selháním snižují též betablokátory. Tento prospěch je patrný, pokud jsou přidány k léčbě ACE inhibitorem. Betablokátory by měly být ovšem nasazovány u stabilizovaných pacientů. Opatrnosti je třeba při současné či nedávné dekompenzaci srdečního selhání. Pokračování v terapii již nasazeného betablokátoru v průběhu epizody dekompenzace se však zdá být bezpečné(4). Benefit betablokátorů u pacientů se srdečním selháním byl prokázán též u seniorské populace(10). Na základě klinických studií by měl být v léčbě srdečního selhání užíván bisoprolol, carvedilol či metoprolol sukcinát.
U populace seniorů proběhla studie SENIORS(11) s dalším betablokátorem nebivololem, která prokázala rovněž mírný pokles hospitalizací z kardiovaskulárních příčin a celkové mortality. Pro efekt ostatních betablokátorů není dostatek důkazů v klinických studiích.
Mezi nežádoucí účinky betablokátorů patří retence tekutin, bradykardie a hypotenze. Senioři jsou k těmto účinkům citlivější, pravděpodobně kvůli zvýšené vagotonii a zhoršené autoregulaci cévního tonu. Zejména na počátku léčby či při navyšování dávky by měly být nežádoucí účinky betablokátorů monitorovány. Retence tekutin se vyskytuje při zahájení léčby betablokátorem přibližně v 5 % případů. Je to stav přechodný, měl by být řešen přidáním diuretika. Hypotenze a bradykardie patří mezi častější nežádoucí účinky léčby betablokátory a vyplývají z podstaty jejich sympatolytického působení. Zejména u seniorů mohou tyto účinky vést k přerušení léčby. Léčba betablokátorem by proto měla být u starších pacientů zahájena nízkou dávkou, kterou je možné zvyšovat podle tolerance pacienta. Vysazení betablokátoru je indikováno při projevech hypoperfuze orgánů, při trvající slabosti, vertigu a tendenci k pádům, pokud tyto obtíže nastaly v souvislosti se zahájením léčby betablokátorem. Cílové dávky betablokátorů při srdečním selhání (50 mg carvedilolu či 10 mg bisoprololu) bývá dosaženo podle studie CIBIS-ELD u 800 seniorů se srdečním selháním jen u 25 % pacientů kvůli intoleranci cílových dávek pro výše zmíněné nežádoucí účinky(12). Při podávání beta-blokátorů je třeba zvýšené opatrnosti u pacientů s léčeným diabetem, neboť mohou maskovat projevy hypoglykemie. Dalším rizikovým faktorem je diabetická mikroangiopatie či ischemická choroba dolních končetin; u obojího onemocnění mohou betablokátory potencovat periferní vazospasmy a vést tak k rozvoji nebo zhoršení syndromu diabetické nohy či ischemických defektů na dolních končetinách(13). Rizikovou skupinou pro užívání betablokátorů jsou také pacienti s chronickou obstrukční plicní nemocí (CHOPN) a asthma bronchiale.
Přestože CHOPN nepatří mezi kontraindikace užívání betablokátorů a přes možnost užívání kardioselektivních betablokátorů, může dojít při jejich podávání k zhoršení bronchospasmů. Betablokátory by neměly být vysazovány náhle, neboť náhlé přerušení léčby bývá provázeno „rebound fenoménem“, tedy výrazným zvýšením tepové frekvence a s tím souvisejícím zhoršením srdečního selhání, zejména při přítomnosti fibrilace síní.
Blokátory aldosteronových (mineralokortikoidních) receptorů
Spironolakton a eplerenon blokují receptory pro aldosteron, čímž zasahují do aktivovaného systému renin-angiotenzin-aldosteron. Jejich pozitivní účinek na snížení mortality u srdečního selhání se sníženou systolickou funkcí levé komory srdeční byl prokázán zejména ve 3 velkých klinických studiích – RALES II(14), EMPHASIS-HF(15) a EPHESUS(16). Vzhledem k riziku hyperkalemie při léčbě blokátory aldosteronových receptorů by tato léková skupina neměla být podávána pacientům s výrazně omezenou funkcí ledvin (clearance kreatininu < 30 ml/min). Při hodnotách clearance kreatininu 30–50 ml/min by měla být podávána snížená dávka těchto léčiv – 12,5 mg spironolaktonu, resp. 25 mg eplerenonu denně(6). Hladina K+ by měla být při léčbě monitorována. Zvýšenou pozornost mineralogramu je třeba věnovat též při zvyšování dávky současně podávaného ACE inhibitoru vzhledem k potenciaci rizika hyperkalemie. U seniorů je doporučovaná maximální dávka spironolaktonu 25 mg/den pro riziko časté hyperkalemie, jak uvádí Fialová et al. na základě Beersových kritérií z roku 2012 (33).
Kličková diuretika a thiazidy
Kličková diuretika jsou indikována k úlevě symptomů způsobených retencí tekutin. Jejich účinek na mortalitu a morbiditu doposud nebyl studován ve velkých randomizovaných klinických studiích. Zástupcem kličkových diuretik užívaných u nás je furosemid. Jeho účinek je rychlý a vyvolává intenzivní diurézu. Kličková diuretika jsou proto, zejména v akutní fázi srdečního selhání, preferována oproti thiazidům (hydrochlorothiazid, chlortalidon, indapamid), jejichž efekt je protrahovaný a mírnější. V léčbě chronického srdečního selhání při rezistentních otocích je možné kličkové diuretikum kombinovat s thiazidem. Účinek thiazidů je však snížený již při mírné renální insuficienci, zatímco kličková diuretika lze podat i při těžké renální insuficienci (do hodnot clearance kreatininu 10 ml/min). Vzhledem k tomuto faktu a též vzhledem k rizikovému použití thiazidů u diabetiků, u nichž mohou zhoršit renální funkce a kompenzaci diabetu, je jejich podávání u seniorů často nevhodné(13). Dávku diuretik je třeba upravovat podle klinického stavu pacienta za současných kontrol mineralogramu. Jsou popisovány interindividuální rozdíly v biologické dostupnosti furosemidu po perorálním podání(6, 17). Na sníženém vstřebávání z gastrointestinálního traktu se podílí kongesce sliznic při retenci tekutin.
V akutní fázi je proto vhodnější intravenózní podání se sledováním bilance tekutin a elektrolytů. Podle Leto et al.(18) se zdá být bezpečnější a efektivnější kontinuální podávání furosemidu oproti bolusovému podávání, neboť navozuje konstantní plazmatickou hladinu s lepším natriuretickým a diuretickým efektem a menším množstvím nežádoucích účinků (např. zhoršení renálních funkcí, iontová dysbalance, ototoxicita). Po ústupu retence tekutin by dávka diuretika měla být redukována na nejnižší tolerovatelnou. Při léčbě diuretiky je třeba též předcházet významnému poklesu krevního tlaku, např. přechodným vysazením některých antihypertenziv. Kličková i thiazidová diuretika vyvolávají z podstaty svého působení iontové dysbalance, způsobují hyponatremii, hypokalemii a hypomagnesemii. Tyto poruchy je třeba během léčby monitorovat a substituovat. K udržení normální hladiny draslíku je proto vhodné současné podávání blokátoru aldosteronových receptorů. Z hlediska chronické léčby srdečního selhání je účelná edukace pacienta k úpravě dávek diuretik podle jeho aktuálního stavu. Pacienti by se měli minimálně 2krát týdně vážit; na přírůstek hmotnosti by měli reagovat konzultací s lékařem či navýšením dávky diuretik. U seniorů je však tato spolupráce vzhledem k častému kognitivnímu deficitu limitovaná.
Digoxin
Digoxin byl společně s diuretiky základem léčby srdečního selhání před objevením pozitivního vlivu ACE inhibitorů, betablokátorů a blokátorů mineralokortikoidních receptorů. Nyní je podle současných doporučení České a Evropské kardiologické společnosti digoxin indikován u pacientů se srdečním selháním při snížené EF levé komory s fibrilací síní s rychlou odpovědí komor. Je možné jej podávat též při sinusovém rytmu u symptomatického srdečního selhání se sníženou systolickou funkcí levé komory, pokud základní léčba nevede k zmírnění symptomů. Tyto indikace jsou podpořeny jedinou velkou klinickou studií s digoxinem, která prokázala snížení počtu hospitalizací z důvodu srdečního selhání; mortalita v této studii nebyla ovlivněna(19). Jiné menší studie prokázaly zmírnění symptomů srdečního selhání při léčbě digoxinem(20).
Problémem podávání digoxinu je jeho úzké terapeutické rozmezí. U seniorů se doporučuje podávání maximálně 0,125 mg denně(21). Toxicita i při nízkých dávkách digoxinu hrozí zejména u pacientů s renální insuficiencí a u dehydratovaných kachektických pacientů, u nichž je snížený distribuční objem digoxinu. Rizikovou skupinou pro léčbu digoxinem jsou též pacienti s hypothyreózou. Americká kardiologická společnost doporučuje cílovou sérovou koncentraci digoxinu 0,5–1 ng/ml, přestože konvenční terapeutická sérová koncentrace digoxinu je definována hodnotami 0,8–2 ng/ml. Toto doporučení je na základě studií, které prokázaly efekt digoxinu i při nižší sérové koncentraci a naopak zjistily zhoršení mortality při sérové koncentraci > 1 ng/ml(5, 22). Rizikem při léčbě digoxinem jsou též lékové interakce; významné interakce jsou zejména s amiodaronem, verapamilem, quinidinem, makrolidovými antibiotiky a periferními myorelaxancii. Tato farmaka zvyšují sérovou koncentraci digoxinu, a tak i jeho toxické působení. Digoxin je kontraindikován při hypertrofické kardiomyopatii s obstrukcí, při atrio-ventrikulární blokádě II. a III. stupně, při syndromu preexcitace (WPW syndrom) a u čerstvého infarktu myokardu. Rovněž není vhodné jej podávat při významné aortální či mitrální stenóze, při cor pulmonale s respirační insuficiencí, při perikarditidě či akutní myokarditidě. U akutního selhání pravé komory není digoxin většinou dobře účinný(23).
Výskyt nežádoucích účinků digoxinu stoupá s jeho sérovou koncentrací, při koncentraci > 2 ng/ml jsou nežádoucí účinky (respektive projevy toxicity digoxinu) časté. Patří mezi ně gastrointestinální obtíže (nauzea, zvracení), dále poruchy zraku a srdeční arytmie. Zvýšené riziko srdečních arytmií je při iontové dysbalanci a narušení acidobazické rovnováhy; proto je třeba vnitřní prostředí při léčbě digoxinem kontrolovat. U seniorů je též vyšší riziko výrazné bradykardie či riziko vzniku sino-atriální nebo atrio-ventrikulární blokády při léčbě digoxinem kvůli zvýšené fibrotizaci myokardu včetně převodního systému srdce.
Nitráty
Nitráty jsou indikované u akutního srdečního selhání s nekorigovanou arteriální hypertenzí. V léčbě chronického srdečního selhání jsou indikovány v kombinaci s hydralazinem podle Americké kardiologické společnosti při intoleranci ACE inhibitorů i blokátorů receptorů pro angiotenzin či při přetrvávání symptomů srdečního selhání při konvenční léčbě ACE inhibitorem, betablokátorem a blokátorem aldosteronových receptorů, a to zejména u afroamerické populace. Pozitivní efekt nitrátu (isosorbid dinitrát) s hydralazinem na snížení mortality byl zkoumán ve studii V-HeFT I a II(24, 25)v době před objevením klinického účinku ACE inhibitorů u pacientů se srdečním selháním. Pozdější studie ovšem prokázaly příznivější účinek ACE inhibitorů a betablokátorů na snížení mortality i morbidity. Dodatečnou analýzou výše uvedených studií s nitráty bylo zjištěno, že jejich výraznější efekt je patrný u afro-americké populace, což bylo potvrzeno studií A-HeFT(26). Problémem této léčby je nutnost užívání velkého množství tablet (4x denně) a časté nežádoucí účinky (bolesti hlavy a hypotenze). U 5–10 % pacientů se při léčbě nitrátem a hydralazinem vyskytují artralgie. U pacientů bílé rasy chybí studie, která by potvrzovala pozitivní efekt kombinace nitrátu s hydralazinem ve srovnání s léčbou ACEI a betablokátorem.
Další lékové skupiny
Antikoagulační léčba při srdečním selhání není indikovaná. Její nasazení při současné fibrilaci síní je třeba zhodnotit podle skórovacích kritérií CHA2DS2-VASc skóre a HAS-BLED skóre(27). Antiagregace je indikovaná při prokázané ischemické chorobě srdeční. Byl sledován vliv statinů při srdečním selhání, ale profit na snížení mortality nebyl prokázán – studie CORONA(28) a GISSI-HF(29). Ivabradin zpomaluje srdeční frekvenci na úrovni sinusového uzlu. Studie SHIFT(30) prokázala pozitivní účinek léčby ivabradinem u pacientů se srdečním selháním se sníženou systolickou funkcí levé komory a trvající sinusovou tachykardií i přes léčbu betablokátorem. Při užívání ivabradinu došlo k snížení počtu hospitalizací; pokles úmrtnosti nebyl signifikantní.
Nevhodná léčba při srdečním selhání
Pacienti se srdečním selháním by neměli být léčeni glitazony, neboť mohou způsobovat zhoršení srdečního selhání. Stejně tak blokátory kalciových kanálů (s výjimkou amlodipinu a felodipinu) mohou vést k zhoršení srdečního selhání kvůli jejich negativně ionotropnímu efektu. Také nesteroidní antirevmatika (NSA) a inhibitory cyklooxygenázy 2(COX-2) mohou působit nepříznivě při srdečním selhání, mohou zhoršovat renální funkce a způsobovat retenci sodíku a vody. Rovněž není vhodné přidání blokátoru receptorů pro angiotenzin k léčbě ACE inhibitorem a blokátorem aldosteronových receptorů. Dochází pak ke kumulaci rizika hyperkalemie a zhoršení renálních funkcí(4).
Přístrojová léčba
Přístrojová nechirurgická léčba zahrnuje implantaci kardioverteru-defibrilátoru (ICD) a srdeční resynchronizační léčbu (SRL). Implantace kardioverteru-defibrilátoru je indikována u pacientů po oběhové zástavě z důvodu fibrilace komor či komorové tachykardie po vyloučení reverzibilní příčiny (např. infarkt myokardu). Dále je implantace ICD vhodná při epizodách symptomatických komorových arytmií, způsobujících hemodynamickou nestabilitu, bez ohledu na ejekční frakci levé komory při dobrém funkčním stavu a očekávané délce života více než 1 rok. ICD je též indikován při EF ≤ 35 % při trvajícím symptomatickém srdečním selhání i přes léčbu delší než 3 měsíce a současně dobrém funkčním stavu s očekávanou délkou života > 1 rok. Implantace ICD je doporučována minimálně 40 dní od proběhlého akutního infarktu myokardu. ICD není vhodný u perzistujícího srdečního selhání s klidovými obtížemi (NYHA IV), pokud takovýto pacient není současně indikován k SRL nebo není čekatelem na transplantaci srdce, neboť přežití pacientů ve stadiu NYHA IV je velmi limitované(4).
Při srdeční resynchronizační léčbě jsou stimulovány obě komory prostřednictvím implantovaných elektrod do levé i pravé komory a často i do pravé síně, čímž se zlepší mechanika srdečního stahu, který je v důsledku snížené systolické funkce levé komory a narušení převodního systému nesynchronní a neefektivní. K resynchronizační terapii jsou indikováni pacienti s EF LK ≤ 30 %, se sinusovým rytmem a šíří QRS komplexu na EKG ≥ 150 ms s obrazem blokády levého Tawarova raménka (LBBB) bez ohledu na tíži projevů srdečního selhání (NYHA I–IV). Podmínkou SRL je dobrý funkční stav pacienta a očekávané přežití více než 1 rok. U pacientů více symptomatických (NYHA III–IV) jsou indikační kritéria mírnější – sinusový rytmus, EF ≤ 35 % a šíře QRS ≥ 120 ms při LBBB, nebo QRR ≥ 150 ms při jiné morfologii QRS. Nejasná jsou doporučení stran SRL u pacientů s perzistující fibrilací síní. Dvoudutinová stimulace by měla být zvažována též u pacientů se srdečním selháním, u kterých je plánována implantace kardiostimulátoru z důvodu výrazné bradykardie, AV-blokády či jiné indikace a kteří mají současně systolickou dysfunkci levé komory srdeční, přestože ostatní kritéria (šíře a tvar QRS) pro SRL nesplňují. Indikace pro SRL a implantaci ICD se v řadě případů překrývají, proto je často implantován biventrikulární kardioverter-defibrilátor.
Revaskularizace a chirurgická léčba
U pacientů, u kterých lze očekávat přežití více než 1 rok a kteří jsou v dobrém funkčním stavu a schopni operačního výkonu s ohledem na své komorbidity, je možné srdeční funkci výrazně zlepšit kardiochirurgickým výkonem. Při současné ischemické chorobě srdeční a viabilním myokardu lze zvažovat indikaci k srdečnímu aorto-koronárnímu bypassu (CABG). Alternativou jsou perkutánní koronární intervence. U pacientů s významnou chlopenní vadou, kteří splňují kritéria k chirurgickému zákroku na postižené chlopni, lze rovněž příčinu srdečního selhání kardiochirurgickým výkonem kauzálně vyřešit.
Mimo chirurgické zákroky se provádí též perkutánní výkony – transkatétrová implantace aortální chlopně (TAVI), endovaskulární zákroky na aortální i mitrální chlopni, endovaskulární uzávěr defektu septa síní, uzávěr ouška levé síně jako prevence tvorby trombů při kontraindikaci antikoagulační terapie u fibrilace síní. Endovaskulární výkony jsou preferovány u starších pacientů, pokud jsou tito ještě v dobrém funkčním stavu. V terminální fázi srdečního selhání je možné indikovat pacienty k transplantaci srdce. Tato možnost se však týká zejména mladších pacientů do 60 let věku, kteří nemají závažné komorbidity (významné renální či jaterní selhání, malignitu v posledních 5 letech, systémové onemocnění, recentní tromboembolickou příhodu, významné periferní arteriální či cerebrovaskulární postižení, fixovanou plicní hypertenzi a jiné). Kontraindikací k transplantaci je též trvající abúzus alkoholu či drog a nespolupráce pacienta. V poslední době se rozšiřuje spektrum mechanických srdečních podpor (mechanická podpora levé komory – LVAD, biventrikulární podpora – BiVAD, intraaortální balonková kontrapulzace aj.). Účelem jejich použití byla dříve zejména přechodná léčba k transplantaci srdce či stabilizaci pacienta, nyní je možné je využít též jako takzvanou destinační léčbu, tzn. alternativu transplantace srdce. K této léčbě by měli být opět indikováni nemocní v dobrém funkčním stavu s očekávanou délkou života více než 1 rok, kteří jsou v terminální fázi srdečního selhání, symptomatičtí i přes adekvátní léčbu, a nejsou vhodní k transplantaci srdce(3).
Paliativní péče
Svou relativně krátkou prognózou (5 let od stanovení diagnózy přežívá asi 20–30 % pacientů) je srdeční selhání podobné nádorovým onemocněním. Průběh srdečního selhání je však velmi individuální a odvíjí se od tíže onemocnění v době stanovení diagnózy, komorbidit, rezerv daného pacienta, dostupnosti zdravotní péče a podobně. U řady pacientů dochází k opakovaným fázím dekompenzací. Někteří pacienti přežijí život ohrožující situace, někteří naopak zemřou již při první manifestaci srdečního selhání. K zhodnocení prognózy pacientů se srdečním selháním byly vytvořeny různé skórovací systémy (např. HF Survival Score, Seattle HF Score či CardioVascular Medicine Heart Failure Index), přesto však je prognóza každého pacienta značně individuální a často špatně predikovatelná. Přibližující se terminální fázi nasvědčují časté dekompenzace v posledních 6 měsících i přes optimální léčbu, výskyt maligních arytmií, potřeba časté či kontinuální intravenózní diuretické terapie, dlouhodobě špatná kvalita života, vysoký stupeň závislosti na jiných osobách, symptomy odpovídající klasifikaci NYHA IV a známky kardiální kachexie(31).
Zatímco v raných stadiích srdečního selhání je léčba orientovaná na snížení mortality a počtu hospitalizací, v terminální fázi je u pacientů, kteří nejsou indikováni k transplantaci srdce či mechanické srdeční podpoře, vhodná paliativní péče. Ta podle definice WHO zahrnuje úlevu od bolesti a jiných obtíží a pohlíží na umírání jako na přirozený proces. Nesměřuje k oddalování ani k urychlování smrti, zahrnuje psychologické a duchovní aspekty péče o pacienty s život ohrožujícím onemocněním, snaží se umožnit pacientovi aktivní život až do smrti, poskytuje podporu též pro pečující a truchlící blízké pacienta, využívá týmové spolupráce k zajištění potřeb pacienta a jeho rodiny a je celkově zaměřená na zlepšení kvality života.
Paliativní péči je možné poskytovat již v raných fázích závažného onemocnění současně s kurativní léčbou(32). Základem paliativní péče je komunikace s pacientem a jeho rodinou. Je vhodné umožnit pacientovi, aby se podílel na rozhodování o dalším průběhu svého onemocnění. Důležité je správně rozpoznat a hodnotit symptomy pacienta. Hlavním z nich je u srdečního selhání dušnost, od které ulevuje oxygenoterapie, diuretická léčba a léčba opioidy. Dalším ze symptomů pokročilého srdečního selhání bývá slabost a tendence k mdlobám. Může to být způsobeno hypotenzivní medikací, kterou je v takových případech dobré redukovat. Je možné též zvážit kontinuální ionotropní či vazopresorickou léčbu. Častým problémem u pacientů se srdečním selháním bývá deprese a úzkost; léčba úzkostných a depresivních stavů patří rovněž do paliativní péče. Nejčastěji jsou užívány léky ze skupiny selektivních inhibitorů zpětného vychytávání serotoninu (SSRI).
Na léčbu úzkostných stavů se doporučují benzodiazepiny, které mohou též mírně snižovat pocity dušnosti. Paliativní léčba se zaměřuje na řadu dalších nespecifických symptomů – kašel, nespavost, zácpu apod. Přesné doporučené postupy paliativní léčby srdečního selhání zatím nebyly vytvořeny a jsou orientovány individuálně podle potřeb každého pacienta. V terminální fázi srdečního selhání je vhodné zhodnotit u daného pacienta indikaci ke kardiopulmonální resuscitaci. Kromě lékařského zázemí by paliativní péče měla zahrnovat též spirituální a psychosociální podporu, proto by ji měl poskytovat tým odborníků. Současný model doporučuje propojení paliativní péče se specializovanou kurativní léčbou, s pokročilostí onemocnění pak převažuje paliativní přístup. Tento model, který je propagován Evropskou i Americkou onkologickou společností, podporuje též Pracovní skupina pro pokročilé srdeční selhání v rámci Evropské kardiologické společnosti. Je založen na spolupráci mezi kardiology, praktickými lékaři a specialisty v oboru paliativní péče a zahrnuje jak nemocniční, tak komunitní péči(31).
Závěr
Chronické srdeční selhání je časté onemocnění seniorského věku a jeho špatná prognóza je srovnatelná s nádorovými onemocněními. Značně zhoršuje kvalitu života a způsobuje četné obtíže. Doporučené postupy pro léčbu srdečního selhání vymezují několik lékových skupin, u nichž byl prokázán efekt na snížení mortality a morbidity pacientů. Některá z doporučovaných léčiv mohou být však seniory špatně tolerována. Individuální úprava léčby je nutná též s ohledem na časté komorbidity pacientů. I v seniorském věku je třeba zvažovat možnosti kardiochirurgické intervence, popřípadě přístrojové léčby srdečního selhání. S progredujícím stavem onemocnění je pak vhodné zapojit také principy paliativní péče. Uplatnění zmíněných přístupů může výrazně zlepšit kvalitu života těchto závažně nemocných pacientů.
Autoři prohlašují, že v souvislosti s publikací článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny farmaceutickou firmou.
MUDr. Ludmila Pavlíčková,
MUDr. Anatolij Cybulja
Oddělení geriatrie a následné péčeThomayerova nemocnice, Praha
MUDr. Ludmila Pavlíčková
e-mail: ludmila.pavlickova@ftn.cz
Je absolventkou 1. LF UK v Praze. V letech 2006–2009 byla zaměstnána na II. interní klinice Všeobecné fakultní nemocnice v Praze. V období 2009–2010 pracovala na Georgetown University ve Washingtonu DC, kde se v laboratoři profesora Y. Suzukiho zabývala studiem reaktivních forem kyslíku a plicní hypertenze. Od ledna 2011 působí na oddělení geriatrie a následné péče Thomayerovy nemocnice v Praze. V roce 2014 složila atestaci z geriatrie.
Zdroje
1. Mosterd A, Hoes AW. Clinical epidemiology of heart failure. Heart 2007; 93 : 1137–1146.
2. McKee PA, Castelli WP, McNamara PM, Kannel WB. The natural history of congestive heart failure: the Framingham study. N Engl J Med 1971; 285(26): 1441–1446.
3. Spinar J, Vitovec J, Hradec J, a kol. Doporučený postup České kardiologické společnosti pro diagnostiku a léčbu chronického srdečního selhání, 2011. Cor et Vasa 2012; 54 : 113–134.
4. McMurray JJ, Adamopoulos S, Anker SD, et al. ESC Committee for Practice Guidelines. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Eur Heart J 2012; 33(14): 1787–1847.
5. Hunt SA, Abraham WT, Chin MH, et al. Focused update incorporated into the ACC/AHA 2005 Guidelines for the Diagnosis and Management of Heart Failure in Adults: A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation 2009; 119 : 391–479.
6. Cheng JW, Nayar M. A review of heart failure management in the elderly population. Am J Geriatr Pharmacother 2009; 7(5): 233–249.
7. Woo KS, Nicholls MG. High prevalence of persistent cough with angiotensin converting enzyme inhibitors in Chinese. Br J Clin Pharmacol 1995; 40 : 141–144.
8. Israili ZH, Hall WD. Cough and angioneurotic edema associated with angiotensin-converting enzyme inhibitor therapy. A review of the literature and pathophysiology. Ann Intern Med 1992; 117 : 234–242.
9. Pilote L, Abrahamowicz M, Eisenberg M. Effect of different angiotensin-converting-enzyme inhibitors on mortality among elderly patients with congestive heart failure. CMAJ 2008; 178(10): 1303–1311.
10. Dulin BR, Haas SJ, Abraham WT, Krum H. Do elderly systolic heart failure patients benefit from beta-blockers to the same extent as the non-elderly? Meta-analysis of >12,000 patients in large-scale clinical trials. Am J Cardiol 2005; 95 : 896–898.
11. Flather MD, Shibata MC, Coats AJ, et al. Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patients with heart failure (SENIORS). Eur Heart J 2005; 26 : 215–225.
12. Cleland JGF, Coletta AP, Torabi A, Clark AL. Clinical trials update from the European Society of Cardiology heart failure meeting 2009: CHANCE, B-Convinced, CHAT, CIBISELD and Signal HF. Eur J Heart Fail 2009; 11(8): 802–805.
13. Kubesova HM, Weber P, Meluzinova H, et al. Benefits and pitfalls of cardiovascular medication in seniors. Wien Klin Wochenschr 2013; 125(15–16): 425–436.
14. Pitt B, Zannad F, Remme WJ, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. N Engl J Med 1999; 341 : 709–717.
15. Zannad F, McMurray JJ, Krum H, et al. Eplerenone in patients with systolic heart failure and mild symptoms. N Engl J Med 2011; 364 : 11–21.
16. Pitt B, Remme W, Zannad F. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 2003; 348 : 1309–1321.
17. Murray MD, Haag KM, Black PK, et al. Variable furosemide absorption and poor predictability of response in elderly patients. Pharmacotherapy 1997; 17 : 98–106.
18. Leto L, Aspromonte N, Feola M. Efficacy and safety of loop diuretic therapy in acute decompensated heart failure: a clinical review. Heart Fail Rev 2014; 19(2): 237–246.
19. The Digitalis Investigation Group. The effect of digoxin on mortality and morbidity in patients with heart failure. N Engl J Med 1997; 336 : 525–533.
20. Hood WB Jr, Dans AL, Guyatt GH, et al. Digitalis for treatment of congestive heart failure in patients in sinus rhythm: a systematic review and meta-analysis. J Card Fail 2004; 10 : 155–164.
21. Fialova D, Topinkova E, Gambassi G, et al. Potentially inappropriate medication use among elderly home care patients in Europe. JAMA 2005; 293(11): 1348–1358.
22. Rathore SS, Curtis JP, Wang Y, et al. Association of serum digoxin concentration and outcomes in patients with heart failure. JAMA 2003; 289 : 871 – 878.
23. www.sukl.cz/modules/medication/detail.php?code=0083318&tab=texts
24. Cohn JN, Archibald DG, Ziesche S, et al. Effect of vasodilator therapy on mortality in chronic congestive heart failure. N Engl J Med 1986; 314 : 1547–1552.
25. Cohn JN, Johnson G, Ziesche S, et al. A comparison of enalapril with hydralazine-isosorbide dinitrate in the treatment of chronic congestive heart failure. N Engl J Med 1991; 325 : 303–310.
26. Taylor AL, Ziesche S, Yancy C, et al. Combination of isosorbide dinitrate and hydralazine in blacks with heart failure. N Engl J Med 2004; 351 : 2049–2057.
27. Camm AJ, Kirchhof P, Lip GY, et al. Guidelines for the management of atrial fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J 2010; 31 : 2369–2429.
28. Kjekshus J, Apetrei E, Barrios V. Rosuvastatin in older patients with systolic heart failure. N Engl J Med 2007; 357 : 2248–2261.
29. Tavazzi L, Maggioni AP, Marchioli R. Effect of rosuvastatin in patients with chronic heart failure (the GISSI-HF trial). Lancet 2008; 372 : 1231–1239.
30. Swedberg K, Komajda M, Bohm M, et al. Ivabradine and outcomes in chronic heart failure (SHIFT). Lancet 2010; 376 : 875–885.
31. Jaarsma T, Beattie JM, Ryder M, et al. Palliative care in heart failure: a position statement from the palliative care workshop of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail 2009; 11 : 433–443.
32. www.who.int/cancer/palliative/en
Štítky
Geriatria a gerontológia Praktické lekárstvo pre dospelých Protetika
Článek Editorial
Článok vyšiel v časopiseGeriatrie a Gerontologie
Najčítanejšie tento týždeň
2015 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Naděje budí časná diagnostika Parkinsonovy choroby založená na pachu kůže
-
Všetky články tohto čísla
- Atypický průběh disekce hrudní aorty u 80leté ženy
- Geriatrie 2015 v Evropě a u nás
-
Recenze knihy:
Ošetřovatelství v geriatrii – hodnoticí nástroje - Editorial
- Jsou senioři s duševní poruchou více nemocní a medicínsky náročnější?
- Vnímání psychické dimenze kvality života seniory s chronickou nenádorovou bolestí
- Chronické srdeční selhání – specifika léčby seniorů
- Chronická pankreatitida ve stáří
- Nutriční podpora u nemocných s demencí
- Recenze anglické směrnice o omezovacích prostředcích
- Využití podtlakové terapie v lokální terapii chronických a obtížně hojitelných ran
- Geriatrie a Gerontologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Chronická pankreatitida ve stáří
- Nutriční podpora u nemocných s demencí
- Chronické srdeční selhání – specifika léčby seniorů
- Atypický průběh disekce hrudní aorty u 80leté ženy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




