-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Čo je vernakalant a kde je jeho miesto v klinickej praxi?
What is vernakalant and what is its place in clinical practice?
Pharmacological cardioversion is a frequent approach used by doctors with respect to atrial fibrillation in routine clinical practice. It ensures the modification (version) of arrhythmia to the sinus rhythm or contributes to the control and suppression of symptoms of the disease (usually palpitation, breathlessness, weakness, anxiety). In this treatment, proven antiarrhythmics are used which, however, are frequently not so effective or are effective after a longer period (hours, days). Even today, clinical practice requires new antiarrhythmics – especially those with a fast effect, both effective and safe, effective in treating atrial fibrillation and without a (negative) impact on the electrical activity of the ventricles. Vernakalant is one of these new “atrial selective” antiarrhythmics. It is administered intravenously and has been approved for use in the European Union. The article presents its pharmacological characteristics, its effectiveness and safety (based on available clinical trials).
Keywords:
atrial fibrillation – medicamentous cardioversion – selective atrial antiarrhythmics – vernakalant
Autoři: J. Murín; J. Vítovec
Působiště autorů: I. interní kardioangiologická klinika LF MU a FN u sv. Anny v Brně ; I. interna klinika, Univerzitná nemocnica Bratislava
Vyšlo v časopise: Kardiol Rev Int Med 2012, 14(2): 115-119
Kategorie: Zprávy ze zahraničí
Souhrn
Farmakologická kardioverzia je častým prístupom lekára k predsieňovej fibrilácii v rutinnej klinickej praxi. Zabezpečí úpravu (verziu) arytmie na sínusový rytmus alebo prispeje ku kontrole a utlmeniu symptómov ochorenia (obvykle palpitácií, dušnosti, slabosti, anxiety). Pri tejto liečbe používame osvedčené antiarytmiká, ktoré však často nie sú účinné alebo na ich efekt treba dlhšie čakať (hodiny, dni). Klinická prax vyžaduje i dnes príchod novších antiarytmík – hlavne ak je rýchlo pôsobiace, ak je významne účinné, ale i bezpečné, ak účinkuje na fibrilujúce predsiene a nepôsobí (negatívne) na elektrickú aktivitu komôr. K týmto novým „átriálne-selektívnym“ antiarytmikám patrí aj vernakalant. Podáva sa intravenózne a dostal schválenie pre použitie v Európskej únii. Článok prezentuje jeho farmakologické vlastnosti, jeho účinnosť i bezpečnosť (podľa dostupných klinických štúdií).
Kľúčové slová:
predsieňová firbilácia – medikamentózna kardioverzia – selektívne átriálne antiarytmiká – vernakalantÚvod
Predsieňová fibrilácia (PF) je najčastejšou arytmiou v rutinnej klinickej praxi [1]. Rozdeľujeme ju na viaceré typy, ako paroxyzmálna PF s výskytom 24,8 %, perzistentná PF s výskytom 22,3 %, permanentná PF s výskytom 46,4 % a tzv. prvýkrát zistená PF s výskytom 6,5 % (podľa registra REALISE AF) [2]. Jej výskyt v celej populácii je asi 1,5–2 %, ale u osôb starších (≥ 65 rokov) je to 7–10 % [3], no a so starnutím toto percento stúpa. K rizikovým faktorom PF okrem veku patria srdcové ochorenia (hlavne chlopňové, ktoré zväčšujú ľavú predsieň, ale i chronické srdcové zlyhávanie), a časté kardiovaskulárne rizikové faktory ako hypertenzia a diabetes [3]. Hneď ako dosiahneme vek 40 rokov, je naše celoživotné riziko pre vývoj PF asi 25 % [4].
Hlavnými cieľmi v liečebnom prístupe u PF je prevencia komplikácií (vývoja a zhoršenia srdcového zlyhávania, embolickej náhlej cievnej mozgovej príhody či inej embolizácie) a redukcia sprievodných symptómov pacienta. Jedinou osvedčenou stratégiou v prevencii komplikácií PF je antitrombotická liečba (obvykle dlhodobá antikoagulácia warfarínom s INR okolo 2,5).
Úsilie upraviť a udržať dlhodobo sínusový rytmus (tzv. stratégia kontroly rytmu) u týchto pacientov však nepreukázalo lepšie dlhodobé prežívanie oproti liečebnému prístupu s upokojením ventrikulárnej frekvencie pri pretrvávajúcej PF (tzv. stratégia kontroly frekvencie) (viaceré klinické štúdie) [5,6].
Ale napriek tomu je antiarytmická liečba dôležitá v rutinnej klinickej praxi pri manažmente PF. Hlavne ak je pre kontrolu symptómov pacienta potrebná stratégia úpravy (sínusového) rytmu alebo ak tento rytmus musíme rýchlo upraviť, napr. pri vzniknutej ťažkej hemodynamickej situácii (srdcové zlyhanie). Je tu možné siahnuť i k elektrickej kardioverzii, ktorá je účinnejšia ako antiarytmická liečba, ale obvykle vyžaduje anestézu (z ktorej sa potom pacient niekedy ťažšie preberá) s jej možnými komplikáciami. U elektrickej kardioverzie môžu byť ďalšie komplikácie, ako atrioventrikulárne blokády, prolongovaný sinus arrest, poškodenie kože v prekordiu a poškodenie funkcie pacemakeru alebo defibrilátora, ak ich pacient má implantované [7].
Farmakologická kardioverzia sa vykonáva v praxi ľahšie, lieky sú obvykle okamžite k dispozícii a pacient nevyžaduje anestézu. Máme k dispozícii viaceré antiarytmiká. Rozhodujeme sa pre použitie tým antiarytmikom, ktoré je pre pacienta čo najbezpečnejšie a najúčinnejšie. Zohľadňujeme i svoje osobné skúsenosti s daným antiarytmikom. Sme radi, ak jeho dlhodobé používanie je bezpečné a ak bráni recidívam arytmie.
Avšak mnohé dnes dostupné a používané antiarytmiká pre farmakologickú kardioverziu majú len miernu alebo stredne intenzívnu účinnosť, ich pôsobenie nie je okamžité, majú pomalý metabolizmus, mávajú mnohé nežiaduce účinky, včítane účinkov pro-arytmických [8]. Vážne pro-arytmie sú obvykle spôsobené účinkami antiarytmík na ventrikulárny akčný potenciál (obvykle predlžujú QT interval), zvyšujú riziko torsades de pointes, ovplyvňujú AV vedenie s rizikom prevodu predsieňového flutteru v pomere 1 : 1 na komory.
Preto sa stále hľadajú novšie či lepšie (?) antiarytmiká, pôsobiace novými mechanizmami účinku [9]. No a medzi nimi nájdeme i látky, ktoré selektívne inhibujú iónové kanály, ktoré sú aktívne pri predsieňovej repolarizácii. Nazývame ich „atrial repolarization-delaying agents“ (predĺžujú predsieňovú repolarizáciu). Niektorí autori ich označujú ako „atriálne selektívne antiarytmiká“. Sú dnes pokladané za potenciálne ideálne antiarytmiká (u predsieňovej fibrilácie), nakoľko sú jednak veľmi účinné, ale súčasne i bezpečné (pre ich atriálnu selektivitu, a teda neprítomnosť ventrikulárnej pro-arytmie) [10].
Rýchlo pôsobiace, účinné a bezpečné antiarytmikum, ktoré pôsobí na fibrilujúce predsiene bez ovplyvnenia ventrikulárnej refraktérnosti, je veľmi klinicky žiadané a stane sa iste cennou alternatívou k dnešnej farmakologickej liečbe PF. Okrem toho rýchla farmakologická kardioverzia vedie aj k redukcii potreby hospitalizácie (alebo túto aspoň značne skráti), čo je z ekonomického hľadiska pre zdravotníctvo žiaduce a potrebné.
Vernakalant
Spomedzi už spomínaných a potenciálne „átriálne selektívnych antiarytmík“ je v klinickom vývoji najďalej vernakalant (3-pyrrolidinol, 1-[(1R, 2R) - 2 - (2 - [3, 4 dimethoxyphenyl] ethoxy) cyclohexyl] – B hydrochlorid [3R] -). Pôsobí selektívne na predsiene a predlžuje predsieňovú repolarizáciu. Selektívne ovplyvňuje (blokuje) hlavne K+ kanály, ktoré sú vyjadrené v predsieňach, a tým predlžuje efektívnu refraktérnu periódu predsieňových myocytov.
V ďalšom texte informujeme o farmakologických vlastnostiach liečiva, o jeho nežiaducich účinkoch, o jeho bezpečnosti a účinnosti podľa klinických štúdií publikovaných u pacientov s PF.
Mechanizmus účinku
Vernakalant je blokátor K+ aj Na+ kanálov a pôsobí selektívne v predsieňových myocytoch [11]. Pôsobí výraznejšiu redukciu rýchlosti vedenia elektrického impulzu a tiež potláča tkanivovú elektrickú excitabilitu významnejšie, ak je u pacienta prítomná vysoká srdcová frekvencia, no a to je práve prípad pacienta s PF.
Spomedzi mnohých káliových kanálov je treba spomenúť niektoré: a) IKur – jeho blokovanie predlžuje trvanie predsieňového akčného potenciálu [12]; b) IKAch – aktivovaný acetylcholínom, prispieva k skráteniu trvania predsieňového akčného potenciálu, prispieva k vzniku i k udržovaniu PF [13], no a tak jeho blokáda redukuje zvýšenú predsieňovú vulnerabilitu a mení aj proces elektrickej remodelácie v predsieňach počas PF; c) ostatné K+ kanály vernakalant neblokuje alebo ich blokuje len minimálne.
Vernakalant blokuje i Na+ kanály, hoci menej intenzívne ako K+ kanály. Tento blokujúci efekt je tiež výraznejší pri vyššej srdcovej frekvencii (ako je to práve pri PF). Opäť tento blokujúci (Na+) efekt redukuje rýchlosť vedenia elektrického impulzu predsieňami, znižuje predsieňovú excitabilitu, a teda prispieva k selektivite pôsobenia na predsieňové tkanivá [11]. V poslednej dobe výskum preukázal účasť Na+ kanálov v patogenéze PF [14] a tu môže byť ďalšie užitočné pôsobenie vernakalantu.
Teda – vernakalant inhibuje mnohé (hlavne však káliové a nátriové) kanály, ktoré sú aktívne pri predsieňovej myokardiálnej depolarizácii i repolarizácii. Inhibícia je vyššia pri vysokej srdcovej frekvencii, čo je typické pri PF. Je málo pro-arytmogénny, nakoľko nepôsobí v komorách.
Farmakokinetické vlastnosti
Vernakalant má jednak vylučovanie mechanizmom tzv. prvého rádu a má tiež lineárne farmakokinetické vlastnosti pri dávkovaní 0,1–5,0 mg/kg po 10-minútovej i.v. infúzii (podľa výrobcu). Rýchla a extenzívna distribúcia liečiva v organizme vedie k poklesu sérovej koncentrácie vernakalantu o viac ako 40 % do 5 min po skončení infúzie. Neviaže sa výrazne na plazmatické proteíny a vylučuje sa pečeňou (obvykle prostredníctvom enzýmu CYP 2D6, hlavne u tzv. dobrých metabolizérov) i obličkami (v tomto prípade hlavne u tzv. slabých metabolizérov). Netreba však dávku liečiva zohľadňovať v klinickej praxi podľa stavu metabolizovania liečiva, a to vďaka veľkému distribučnému objemu liečiva. Priemerný polčas eliminácie liečiva je 3,0–5,5 hod.
Klinické štúdie nepreukázali významnejší vplyv veku, rasy, pohlavia, renálnej funkcie a srdcového zlyhávania na farmakokinetické vlastnosti vernakalantu [15]. Klinické štúdie zamerané na liekové interakcie varnakalantu sú veľmi obmedzené, ale preukázali, že betablokátory a inhibítory CYP2D6 neovplyvňujú jeho farmakokinetické vlastnosti [16]. Perorálna biologická dostupnosť vernakalantu je asi 20 % a pri liečbe dvakrát denne 300–600 mg sa dosahuje „steady-state“ koncentrácia v sére asi do 4 dní.
Klinická účinnosť
Intravenózna forma podávania prešla klinickými štúdiami, ktoré testovali konverziu nedávno vzniknutej (teda paroxyzmálnej) predsieňovej fibrilácie (PF) na sínusový rytmus (jedna štúdia bola vo fáze II, 3 štúdie vo fáze III [randomizované, dvojito-slepé, placebom kontrolované], jedna bola nekontrolovaná a jedna aktívne kontrolovaná a randomizovaná štúdia). Aké výsledky priniesli?
1) CRAFT štúdia (the Conversion of Recent onset Atrial Fibrillation Trial).
Išlo o fázu II, štúdia hľadala optimálne dávkovanie pre účinnosť i bezpečnosť vernakalantu u pacientov s PF [17]. Bolo v nej 56 pacientov s nedávno vzniknutou PF (3–72 hod trvania). Boli randomizovaní na liečbu vernakalantom (dve použité dávky) alebo placebom. V ramene liečby vernakalantom sa podávala skúmaná látka v iniciálnej infúzii (buď 0,5, alebo 2,0 mg/kg) po dobu 10 min. Potom nasledovala druhá infúzia (1 alebo 3 mg/kg), ak do 15 min po skončení predošlej infúznej liečby nedošlo ku konverzii PF na sínusový rytmus. U pacientov liečených vyššou dávkou vernakalantu bola vyššia účinnosť konverzie na sínusový rytmus oproti placebu (61 % vs 5 %, rozdiel p < 0,005). Medián doby do konverzie bol 14 min, neboli hlásené vážne nežiaduce účinky.
2) Nasledovali štúdie vo fáze III, a to ACT-1 až ACT-4 (the Atrial Arrhythmia Conversion Trials).
Štúdie ACT-1 a ACT-3 mali podobný dizajn. Randomizácia k liečbe vernakalantom alebo placebom, najprv infúzia (3 mg/kg) a potom druhá infúzia (2 mg/kg) po 15 min, ak PF pretrvávala. Analýza oboch štúdií preukázala nasledovnú účinnosť v konverzii na sínusový rytmus: vernakalant (51,1 %) a placebo (3,8 %) s p < 0,0001. Efekt bol prítomný len u pacientov s nedávno vzniknutou PF (trvanie menej ako 7 dní), u ostatných pacientov (trvanie > 7 dní a u flutteru predsiení) efekt nebol preukázaný. Priemerná doba do konverzie arytmie bola 11 min a 8 min v spomínaných štúdiách [18,19].
Štúdia ACT-2 vyhodnocovala účinnosť a bezpečnosť vernakalantu pri konverzii postoperačnej PF či predsieňového flutteru na sínusový rytmus (150 pacientov, vykonaný aorto-koronárny bypass alebo valvulárny chirurgický zákrok). Preukázala účinnosť vernakalantu s 47% konverziou arytmie do 90 min od podania i. v. dávky 3 mg/kg a event. aj druhej infúzie 2 mg/kg, ak konverzia arytmie nenastala do 15 min, vs len s 14 % konverziou arytmie pri použití placeba, rozdiel bol významný s p < 0,001. Nedošlo k úprave rytmu u flutteru predsiení [20].
Štúdia ACT-4 (multicentrická, otvorená, zahrnula 167 pacientov s PF v trvaní 3 hod–7 dní) preukázala v liečebnej skupine (s podobným i.v. dávkovaním ako v štúdii ACT-2) u 50,9 % pacientov rýchlu konverziu arytmie na sínusový rytmus. Ak sa vyhodnotil efekt liečby u pacientov s kratším trvaním PF (< 48 hod), tak bol efekt liečby ešte vyšší (57,9 % pacientov konvertovalo). Pacienti, ktorí konvertovali na sínusový rytmus do 90 min, mali i neskôr stále prítomný sínusový rytmus: po 8 hod to bolo 98,8 % a po 24 hod 97,4 % pacientov) [21].
Účinnosť konverzie PF na sínusový rytmus pomocou vernakalantu v porovnaní s placebom je zobrazená v tab. 1.
Tab. 1. Účinnosť konverzie PF na sínusový rytmus pomocou vernakalantu, podľa už uvedených klinických štúdií. 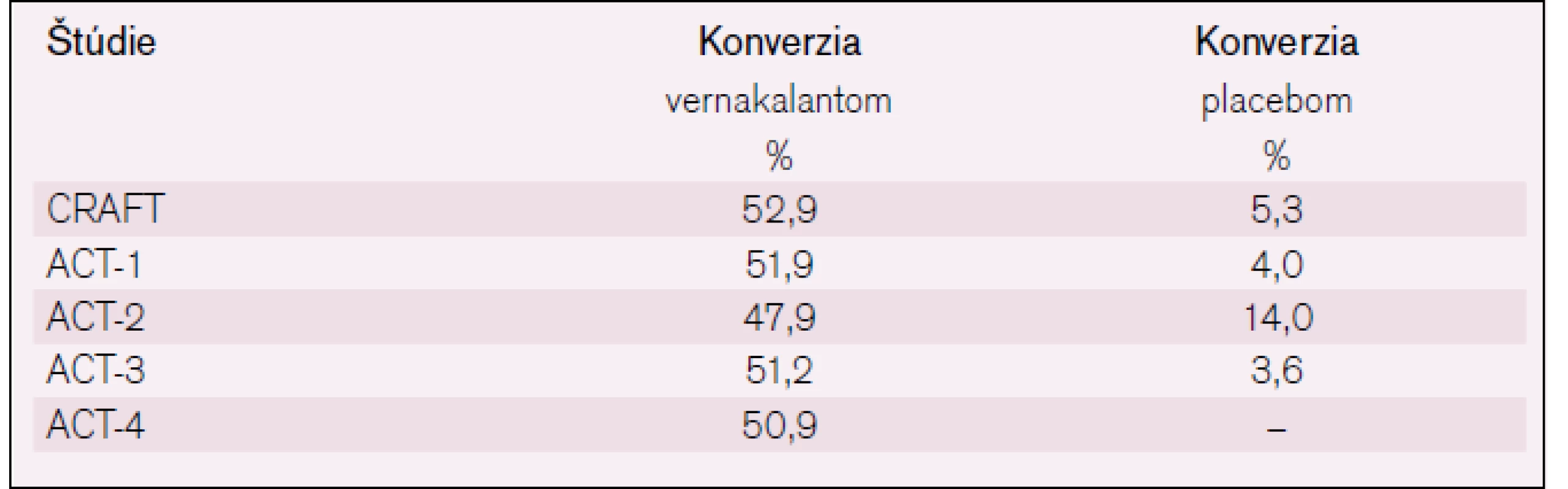
Použitie vernakalantu v prevencii recidív PF, teda perorálne použitie. Výsledky klinickej fázy II sú veľmi nádejné v tejto oblasti a štúdie fázy III zatiaľ neboli ešte ukončené.
Štúdia vo fáze IIa (dvojito-slepá, placebom kontrolovaná, randomizovaná, hľadajúca správne dávkovanie) sledovala bezpečnosť a tolerabilitu, farmakokinetiku a účinnosť orálneho podávania vernakalantu (v priebehu 28 dní) u pacientov v riziku rekurencie PF. Väčšina zaradených pacientov mala PF v trvaní od 30–180 dní. V štúdii podávali 300 a 600 mg vernakalantu či placeba dvakrát denne perorálne po dobu 25 dní po úspešnej kardioverzii. Významne viac pacientov bolo na sínusovom rytme na konci štúdie pri oboch použitých dávkach liekov vo vernakalantovom ramene liečby: pri 300 mg dávke 61 % osôb a pri vyššej dávke (kombinácia 300 a 600 mg dvakrát denne) to bolo 52 % osôb (oproti placebu) (údaje od výrobcu liečiva).
Štúdia vo fáze IIb porovnávala vernakalant (150 mg, 300 mg a 500 mg dvakrát denne) s placebom a trvanie bolo 90 dní. V najvyššej dávke sa prejavil významne efekt liečby – udržanie sínusového rytmu u 51 % vs len u 37 % placebom liečených pacientov (p = 0,0221), nízky bol výskyt vedľajších účinkov, nebol prípad torsades de pointes (údaje od výrobcu).
Jedinou priamo porovnávajúcou klinickou štúdiou u pacientov s PF nedávneho trvania bolo porovnanie účinnosti vernakalantu vs amiodaronu pri konverzii arytmie na sínusový rytmus (AVRO štúdia: the Active-Controlled Superiority Study of Vernakalant versus Amiodarone in Recent Onset Atrial Fibrillation) [22]. Išlo tiež o randomizovanú, dvojito-slepú štúdiu porovnávajúcu účinnosť a bezpečnosť i. v. podania vernakalantu (3 mg/kg v 10 min infúzii, event. aj podania druhej infúzie v dávke 2 mg/kg za 10 min, ak v prvom prípade nedošlo do 15 min k vzniku sínusového rytmu) oproti i. v. podaniu amiodaronu (5 mg/kg v 60-minútovej infúzii a event. v ďalšej infúzii 50 mg počas 60 min) pri akútnej konverzii nedávno vzniknutej PF (menej ako 48 hod trvania).
Primárnym ukazovateľom tu bola proporcia pacientov s úpravou rytmu na sínusový rytmus v priebehu 90 min. Zaradených bolo 254 pacientov a vernakalant preukázal lepšiu účinnosť ako amiodaron (51,7 % pacientov vs len 5,2 % pacientov, rozdiel významný s p < 0,0001). V ramene vernakalantovom sa výraznejšie upravili aj symptómy ochorenia. Vážne nežiaduce účinky (vedúce k prerušeniu liečby) boli zriedkavé. Iné komparatívne štúdie (vernakalant vs antiarytmiká triedy IC, event. iné látky) neboli zatiaľ publikované.
Bezpečnosť a tolerabilita
Vzhľadom na svoje dominantné predsieňovo-selektívne pôsobenie sa predpokladá, že vernakalant bude mať výborný bezpečnostný profil a nízke pro-arytmické riziko k indukcii ventrikulárnych tachyarytmií.
In vivo humánne elektrofyziologické štúdie v priebehu infúzie vernakalantu preukázali ľahké predĺženie AV vedenia a zotavovacieho času sínusového uzla, avšak bez významnejšieho predĺženia QT intervalu [23]. V klinických štúdiách sa oproti placebu výraznejšie predĺžilo trvanie QRS i QT intervalu: a) štúdia ACT-1: predĺženie QRS trvania z úrovne 100,1 ± 16,6 msec na 106 ± 21,45 msec na konci prvej infúzie v dávke 3 mg/kg a predĺženie QTc intervalu o 22,1 msec v 10. minúte a o 18,8 msec v 35. minúte, pričom úprava nastala asi po 50 min [18]. Tieto predĺženia QRS a QTc neviedli k pro-arytmii.
Vernakalant má veľmi krátky polčas a nežiaduce účinky sa mu preto pripisujú len vtedy, ak nastali v prvých 24 hod po infúzii. Ak spojíme všetky klinické štúdie dokopy, tak bola incidencia vážnych nežiaducich účinkov v prvých 24 hod po infúzii niečo vyššia vo vernakalantovej podskupine (2,1 %) oproti placebovej podskupine (0,3 %). Išlo o tieto nežiaduce účinky: hypotenzia (1 %), sínusová bradykardia (0,4 %), kompletný AV blok (0,3 %). Z hore uvedených klinických štúdií boli vylúčené osoby v NYHA triede IV so srdcovým zlyhávaním (hoci sa medzi pacientmi našli prípady pacientov so stredne ťažkým i ťažkým znížením ejekčnej frakcie).
V týchto štúdiách sa vyskytlo spolu 6 prípadov úmrtí. Len v jednom prípade sa uvažovalo, že by to mohlo súvisieť s liečbou vernakalantom (ale bol to klinicky nestabilný pacient s ťažkou aortovou stenózou, s akútnym koronárnym syndrómom a hemodynamickou nestabilitou – nemal byť na túto liečbu ani indikovaný). Po dvoch infúziách vernakalantu vyvinul komorovú fibriláciu, následne elektro-mechanickú disociáciu a resuscitácia nebola úspešná.
Vo vernakalantovej liečebnej skupine sa vyskytlo viac ventrikulárnych arytmií než v placebovom ramene liečby. V prípade 5 pacientov s ventrikulárnou arytmiou v priebehu prvých 2 hod po podaní vernakalantu boli traja pacienti s anamnézou srdcového zlyhávania. U troch iných pacientov sa vyvinula arytmia torsade de pointes, ale len v jednom prípade investigátori podozrievali pri vzniku arytmie pôsobenie vernakalantu.
Incidencia hypotenzie v prvých dvoch hodinách po infúzii bola 7,6 % v ramene liečby vernakalantom a 5,1 % v ramene liečby placebom (rozdiel nevýznamný). Hypotenzia so systolickým tlakom < 80 mm Hg po podaní lieku bola vyššia v ramene liečby placebom (1,5 %) [24]. Anamnéza srdcového zlyhávania a nízkeho vstupného systolického TK (< 105 mm Hg) korelovali najlepšie s rizikom hypotenzie. Teda je tu možný negatívne inotrópny vplyv vernakalantu u hemodynamicky nestabilného pacienta.
Najčastejšie vedľajšie účinky vernakalantu v infúzii sa vyskytli do prvých 24 hod po skončení infúzie: dysgeusia (20,1 %), kýchanie (14,6 %), parestézie (7,8 %), hypotenzia (4 %) a nauzea (4,5 %) [24]. Obvykle tieto prejavy boli len mierne či stredne intenzívne, boli prechodné a neobmedzovali ďalšiu liečbu [25]. Prerušenie liečby bolo nízke v týchto štúdiách, v prípade vernakalantu to bolo 1,3 % pacientov a v prípade placeba len 0,9 % pacientov.
Teda – z bezpečnostného hľadiska ide u vernakalantu o prejavy z KV systému (hypotenziu, kardiogénny šok, AV blok a bradykardiu). Zriedkavé boli ventrikulárne arytmie. Vernakalant netreba podávať do 4 hod po i.v. liečbe antiarytmikami triedy I a III, ani pacientom s ťažkou hypotenziou, s triedou NYHA IV srdcového zlyhávania, pri akútnom koronárnom syndróme, pri bradykardii a pri predĺženom QT intervale.
Uvedené skutočnosti o bezpečnosti platia i pre perorálnu formu liečby.
Záver a perspektívy liečby vernakalantom
V porovnaní s inými i.v. antiarytmikami pre konverziu PF na sínusový rytmus je vernakalant veľmi rýchlo pôsobiaci. Je tiež bezpečný. Veľmi účinný je u pacientov s nedávno vzniknutou PF, s dobrou funkciou ľavej komory, hoci ide aj o organické srdcové ochorenie. V porovnaní s amiodaronom má oveľa vyššiu účinnosť v krátkom časovom období po podaní (tab. 2).
Tab. 2. Priemerná doba do konverzie na sínusový rytmus pomocou i.v. liečby antiarytmikami u PF [26–29]. ![Priemerná doba do konverzie na sínusový rytmus pomocou i.v. liečby antiarytmikami u PF [26–29].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/4c90a330fd0fba1ed49c8c40b81ea37f.png)
Vernakalant nebol v účinnosti porovnávaný s účinnými antiarytmikami triedy IC. Nepredpokladáme vyššiu konverznú účinnosť vernakalantu oproti antiarytmikám triedy IC, ale predpokladáme rýchlejšiu konverziu v prípade vernakalantu. Preto sa táto liečba hodí hlavne pre veľmi symptomatických pacientov. Predpokladáme efekt vernakalantu v priebehu pár minút od jeho podania, oproti efektu do 2–3 hod od podania v prípade antiarytmík triedy IC.
Vernakalant sa teda javí byť efektívnym a bezpečným antiarytmikom u selektovaných pacientov s PF a vie zabezpečiť veľmi rýchlu konverziu arytmie na sínusový rytmus. Bráni aj recidíve arytmie. Mohol by tak zabrániť niektorým hospitalizáciám pre PF, čím by tiež šetril finančné prostriedky.
Doručeno do redakce 3. 12. 2011
Přijato po recenzi 20. 12. 2011
prof. MUDr. Ján Murín, CSc., FESC
prof. MUDr. Jiří Vítovec, CSc., FESC
I. interna klinika, Univerzitná nemocnica Bratislava
I. interní kardioangiologická klinika LF MU a FN u sv. Anny v Brně
jan.murin@gmail.com
Zdroje
1. Go AS, Hylek EM, Phillips KA et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk factors In Atrial fibrillation (ATRIA) study. JAMA 2001; 285 : 2370–2375.
2. Steg PG, Alam S, Chiang CE et al. RealiseAF investigators. Symptoms, functional status and quality of life in patients with controlled and uncontrolled atrial fibrillation: data from the RealiseAF cross-sectional international registry. Heart Online, published on September 22, 2011 as 10.1136/heartjnl-2011-300550.
3. Kannel WB, Wolf PA, Benjamin EJ et al. Prevalence, incidence prognosis and predisposing conditions for atrial fibrillation: population-based estimates. Am J Cardiol 1998; 82 : 2N–9N.
4. Lloyd-Jones DM, Wang TJ, Leip EP et al. Life-time risk for development of atrial fibrillation: the Framingham heart study. Circulation 2004; 110 : 1042–1046.
5. Wyse DG, Waldo AL, Di Marco JP et al. Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) Investigators. A comparison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med 2002; 347 : 1825–1833.
6. Roy D, Talajic M, Nattel S et al. Atrial Fibrillation and Congestive Heart Failure Investigators. Rhythm control versus rate control for atrial fibrillation and heart failure. N Engl J Med 2008; 358 : 2667–2677.
7. Galagher MM, Yap YG, Padula M et al. Arrhythmic complications of electrical cardioversion: relationship to shock energy. Int J Cardiol 2008; 123 : 307–312.
8. Nichol G, McAlister F, Pham B et al. Meta-analysis of randomised controlled trials of the effectiveness of antiarrhythmic agents at promoting sinus rhythm in patients with atrial fibrillation. Heart 2002; 87 : 535–543.
9. Dobrev D, Nattel S. New antiarrhythmic drugs for treatment of atrial fibrillation. Lancet 2010; 375 : 1212–1223.
10. Camm AJ, Savelieva I. New antiarrhythmic drugs for atrial fibrillation: focus on dronedarone and vernakalant. J Interv Card Electrophysiol 2008; 23 : 7–14.
11. Fedida D, Orth PM, Chen JY et al. The mechanism of atrial antiarrhythmic action of RSD 1235. J Cardiovasc Electrophysiol 2005; 16 : 1227–1238.
12. Amos GJ, Wettwer E, Metzger F et al. Differences between outward currents of human atrial and subepicardial ventricular myocytes. J Physiol (Lond.) 1996; 491 : 31–50.
13. Dobrev D, Friedrich A, Voigt N et al. The G protein-gated potassium current I (K, ACh) is constitutively active in patients with chronic atrial fibrillation. Circulation 2005; 112 : 3697–3706.
14. Sossalla S, Kallmeyer B, Wagner S et al. Altered Na+ currents in atrial fibrillation effects of ranolazine on arrhythmias and contracitility in human atrial myocardium. J Am Coll Cardiol 2010; 55 : 2330–2342.
15. Mao ZL, Wheeler JJ, Clohs L et al. Pharmacokinetics of novel atrial-selective antiarrhythmic agent vernakalant hydrochloride injection (RSD1235): influence of CYP2D6 expression and other factors. J Clin Pharm 2009; 49 : 17–29.
16. Cheng JW. Vernakalant in the management of atrial fibrillation. Ann Pharmacother 2008; 42 : 533–542.
17. Roy D, Rowe BH, Stiell IG et al. CRAFT Investigators. A randomized, controlled trial of RSD1235, a novel antiarrhythmic agent in the treatment of recent onset of atrial fibrillation. J Am Coll Cardiol 2004; 44 : 2355–2361.
18. Roy D, Pratt CM, Torp-Pedersen C et al. Atrial Arrhythmia Conversion Trial Investigators. Vernakalant hydrochloride for rapid conversion of atrial fibrillation: a Phase III, randomized, placebo-controlled trial. Circulation 2008; 117 : 1518–1525.
19. Pratt CM, Roy D, Torp-Pedersen C et al. Atrial Arrhythmia Conversion Trial (ACT-III) Investigators. Usefulness of vernakalant hydrochloride injection for rapid conversion of atrial fibrillation. Am J Cardiol 2010; 106 : 1277–1283.
20. Kowey PR, Roy D, Pratt CM et al. Atrial Arrhythmia Conversion Trial Investigators. Vernakalant hydrochloride for the rapid conversion of atrial fibrillation after cardiac surgery: a randomized, double-blind, placebo-controlled trial. Circ Arrhythm Electrophysiol 2009; 2 : 652–659.
21. Stiell IG, Roos JS, Kavanagh KM et al. A multicenter, open label study of vernakalant for the conversion of atrial fibrillation to sinus rhythm. Am Heart J 2010; 159 : 1095–1101.
22. Camm AJ, Capucci A, Hohnloser S et al. AVRO Investigators. A randomized active-controlled study comparing the efficacy and safety of vernakalant to amiodarone in recent onset atrial fibrillation. J Am Coll Cardiol 2011; 57 : 313–321.
23. Dorian P, Pinter A, Mangat I et al. The effect of vernakalant (RSD1235), an investigational antiarrhythmic agent, on atrial electrophysiology in humans. J Cardiovasc Pharmacol 2007; 50 : 35–40.
24. European Medicines Agency. Assessment report for Brinavess. www.ema.europa.eu/docs/en_GB/ Document_library/EPAR__Public_assessment_report/human/001215/WC500097150.pdf (Assessed 12 Dec 2010).
25. Tian D, Frishman WH. Vernakalant: a new drug to treat patients with acute onset atrial fibrillation. Cardiol Rev 2011; 19 : 41–44.
26. Kochiadakis GE, Igoumenidis NE, Hamilos ME et al. A comparative study of the efficacy and safety of procainamide versus propafenone versus amiodarone for the conversion of recent-onset atrial fibrillation. Am J Cardiol 2007; 99 : 1721–1725.
27. Boriani G, Diemberger I, Biffi M et al. Pharmacological cardioversion of atrial fibrillation: current management and treatment options. Drugs 2004; 64 : 2741–2762.
28. Alp NJ, Bell JA, Shahi M. Randomized double blind trial of oral versus intravenous flecainide for the cardioversion of acute atrial fibrillation. Heart 2000; 84 : 37–40.
29. Ellenbogen KA, Clemo HF, Stambler BS et al. Efficacy of ibutilide for termination of atrial fibrillation and flutter. Am J Cardiol 1996; 78 : 42–45.
Štítky
Detská kardiológia Interné lekárstvo Kardiochirurgia Kardiológia
Článok vyšiel v časopiseKardiologická revue – Interní medicína
Najčítanejšie tento týždeň
2012 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Kam se ubírá současný vývoj léků ovlivňujících krevní srážení?
- Vorapaxar v klinických studiích
- Čo je vernakalant a kde je jeho miesto v klinickej praxi?
- Eprosartan – duální blokátor AT1 receptorů
- Polypragmazie a oběhové selhání při maligních komorových arytmiích s postižením jaterních funkcí
- Pacientka po transplantaci srdce s plicní formou invazivní aspergilózy
- Galerie autorů
- Máme dnes k dispozici lepší antitrombotika?
- Antiagregační a antikoagulační léčba – základní principy
- Perorální protidestičková léčba u pacientů s akutním koronárním syndromem
- Současné doporučení k antiagregační léčbě v neurologii
- Antikoagulační terapie a fibrilace síní
- Nová perorální antitrombotika v prevenci a léčbě trombembolizmu
- Nová antitrombotika v prevenci pooperační tromboembolické nemoci
- Současné možnosti monitorování antitrombotické léčby – nová antitrombotika
- Kardiologická revue – Interní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Antiagregační a antikoagulační léčba – základní principy
- Antikoagulační terapie a fibrilace síní
- Kam se ubírá současný vývoj léků ovlivňujících krevní srážení?
- Současné doporučení k antiagregační léčbě v neurologii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



