-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Antitrombotika v prevenci cévní mozkové příhody. 2. část – Význam antikoagulační léčby
Antithrombotics in the prevention of cerebrovascular accidents. Part II – Significance of anticoagulant therapy
Cerebrovascular accidents of ischemic etiology most frequently occur in the background of atherothrombosis, in which case antiplatelet treatment plays a crucial role in the prophylaxis, or they are of thromboembolic origin, usually related to cardioembolization, in which case prevention is based on anticoagulant treatment. The strategy of blockage of primary haemostasis was the subject of the first part of the overview while this part focuses on the inhibition of secondary haemostasis, i.e. on anticoagulants. Currently, we have anti-vitamins K available in the indication of prophylaxis of thromboembolic incidents in patients with atrial fibrillation, specifically warfarin, which inhibits more coagulation factors, or direct inhibitors of thrombin (dabigatran) or factor Xa (rivaroxaban and, awaiting approval for clinical use, apixaban). Considering the great inter - and intra-individual variability of the effect of warfarin in the background of interactions with drugs and food as well as of pharmacogenetic influences, the slow onset of action and several other unfavourable pharmacological properties, the above-mentioned direct inhibitors of thrombin or factor Xa were introduced. Direct comparison with warfarin has demonstrated the greater efficacy and safety of the newly introduced anticoagulants.
Keywords:
cerebrovascular accident – atrial fibrillation – warfarin – dabigatran – rivaroxaban – apixaban
Autoři: Prof. MUDr. Jan Bultas, CSc.; doc. MUDr. Debora Karetová, CSc.
Působiště autorů: II. interní klinika kardiologie a angiologie 1. LF UK a VFN, Praha ; Jan. Bultas@lf3. cuni. cz ; Farmakologický ústav 3. LF UK, Praha
Vyšlo v časopise: Kardiol Rev Int Med 2013, 15(1): 41-53
Kategorie: Cévní mozkové příhody
Souhrn
Cévní mozkové příhody ischemické etiologie vznikají nejčastěji na podkladě aterotrombózy, zde v profylaxi hraje rozhodující úlohu protidestičková léčba, nebo jsou původu tromboembolického, zpravidla při kardioembolizaci, pak je prevence postavena na léčbě antikoagulační. Strategie blokády primární hemostázy byla předmětem první části přehledu, tato část je naopak věnována inhibici hemostázy sekundární, tj. antikoagulanciím. V současné době máme k dispozici v indikaci profylaxe tromboembolických příhod u nemocných s fibrilací síní antivitaminy K, konkrétně warfarin inhibující více koagulačních faktorů nebo přímé inhibitory trombinu (dabigatran) či faktoru Xa (rivaroxaban a před schválením ke klinickému užití je apixaban). Vzhledem k velké inter - i intraindividuální variabilitě účinku warfarinu na podkladě interakcí s léky a s potravou a farmakogenetických vlivů, pomalému nástupu účinku a řadě dalších nevýhodných farmakologických vlastností byly zavedeny výše zmíněné přímé inhibitory trombinu či faktoru Xa. Při přímém porovnání s warfarinem byla doložena vyšší účinnost a větší bezpečnost nově zavedených antikoagulancií.
Klíčová slova:
cévní mozková příhoda – fibrilace síní – warfarin – dabigatran – rivaroxaban – apixabanÚvod
První část přehledu „Antitrombotika v prevenci cévní mozkové příhody“ byla věnována prevenci ischemických mozkových příhod na podkladě aterotrombózy, kdy rozhodující léčebnou strategií bylo podávání protidestičkových léků. Tato druhá část je věnována profylaxi tromboembolizačních iktů a tranzitorních ischemií. V této oblasti jednoznačně dominují antikoagulancia, neboť embolizující trombus vzniká při oblenění průtoku a stagnaci krve, kdy jsou splněny podmínky pro aktivaci sekundární hemostázy.
Tromboembolizační mozkové příhody jsou, ve srovnání s trombotickými příhodami, méně časté. Na příhodách ischemické etiologie se podílí asi jednou pětinou. Zdrojem embolizace do mozku jsou nejčastěji levé oddíly srdeční, zpravidla síně při fibrilaci či flutteru nebo při jejich extrémní dilataci. Kardioembolizace při chlopenních vadách, po implantaci chlopenní náhrady nebo při aneuryzmatu levé komory, paradoxní embolizace na podkladě defektu síňové přepážky či embolizace z oblasti výdutě vzestupné aorty jsou výrazně vzácnější.
Účinné blokády hemokoagulační kaskády dosáhneme při inhibici na různých úrovních – inhibicí Xa faktoru (např. gatrany, pentasacharidy či LMWH), inhibicí trombinu (např. xabany či heparinem) či při zásahu na více místech (např. antivitaminy K, konkrétně warfarinem). Ve srovnání s primární hemostázou (kdy léčbu cílíme na více působků) účinné inhibice hemokoagulace docílíme jen na jediné úrovni. Blokáda trombinu či faktoru Xa je stejně účinná jako zásah na více místech při inhibici koagulačních faktorů závislých na vitaminu K. Poklesu tromboembolizačních příhod o více než polovinu dosáhneme již jedním antikoagulanciem, v případě aterotrombotických příhod dosáhneme stejného poklesu pouze kombinací dvou i tří protidestičkových léků.
Zdálo by se tak, že vedení antikoagulační léčby je proto jednodušší. Doposud, při rozhodující preskripci warfarinu, je opak pravdou. I když lege artis vedená léčba warfarinem sníží výskyt mozkových příhod při fibrilaci síní o dvě třetiny a celkovou mortalitu o čtvrtinu, je antikoagulační léčba podávána u menšího počtu nemocných – jen méně než polovina indikovaných je skutečně léčena. U velké části pacientů není terapie vůbec zahájena, u zbytku je předčasně ukončena. V podskupinách nemocných s výrazně větším rizikem tromboembolizace – zejména u seniorů v osmé a vyšší dekádě – klesá podíl skutečně léčených pod jednu třetinu. Pokud se podíváme na dopad předčasného ukončení nebo dočasného přerušení antikoagulační léčby, pak v časném období po přerušení léčby se riziko tromboembolické příhody významně zvyšuje a např. dle analýzy studie Rocket AF dosahuje výskyt tromboembolických komplikací kolem 5 % [1]. Uvědomíme-li si uvedená fakta, pak zásadním problémem současné antikoagulační léčby u fibrilace síní je nízká prevalence léčby a nízká adherence k léčbě. Zvýšení dostupnosti nových perorálně účinných antikoagulancií pro klinickou praxi jistě tento neuspokojivý stav zlepší.
Dalším handicapem je neuspokojivá kvalita, resp. intenzita antikoagulační léčby – terapeutické okno warfarinu, kdy dosahujeme optimální prevence tromboembolizačních příhod, a přitom krvácivé komplikace zůstávají v přijatelných mezích, je INR 2 až 3, event. 2 až 3,5. Této hodnoty je dosahováno ve „skleníkovém“ prostředí klinických studií v průměru pouze po dvě třetiny doby léčby (tzv. time in therapeutic range – TTR). V praxi pak je dosaženo uspokojivé intenzity antikoagulace výrazně méně často a TTR (měřený počtem dnů v terapeutickém rozmezí INR 2 až 3) klesá pod 50 %.
Shrneme-li, pak v současné době, kdy stále perorální antikoagulační léčbě výrazně dominuje warfarin, je léčena méně než polovina indikovaných nemocných a z nich je účinné antikoagulace dosahováno zpravidla u méně než poloviny. Uvědomíme-li si tento nepříznivý stav, je jen logický nástup nových perorálně účinných antikoagulancií – přímých inhibitorů trombinu čili gatranů (dabigatranu) a přímých inhibitorů faktoru Xa neboli xabanů (rixaroxaban, apixaban aj.).
Antikoagulancia klasicky dělíme na inhibitory trombinu, inhibitory faktoru Xa a na antivitaminy K působící na více místech kaskády. První dvě skupiny pak členíme podle mechanizmu účinku na nepřímé, které aktivují antitrombin, jenž blokuje katalytické místo trombinu či faktoru Xa, a na inhibitory přímé, které ovlivňují katalytické místo bez zprostředkovatelské molekuly.
Heparin a jeho deriváty (nízkomolekulární hepariny LMWH a pentasacharidy) se v profylaxi tromboembolizačních mozkových příhod mnoho neužívají, jejich jediné místo je při zahájení léčby warfarinem či při krátkodobém přerušení léčby, zde volíme nejčastěji parenterálně aplikované LMWH. Dlouhodobá léčba vyžaduje perorální aplikaci. Až donedávna byly jedinou dostupnou skupinou antivitaminy K, v našich podmínkách warfarin, z historických i ekonomických důvodů tato léčba stále výrazně dominuje.
Antikoagulační léčba v prevenci kardioembolizačního iktu u fibrilace síní – indikace
Riziko tromboembolické mozkové příhody u nemocných s fibrilací síní je odlišné v různých populacích. U mladých osob bez dalších komorbidit klesá riziko pod 1 % ročně, naopak u seniorů s polymorbiditou (zejména s anamnézou předchozí mozkové příhody, s diabetem, srdečním selháním či s hypertenzí) výskyt tromboembolického iktu stoupá výrazně nad 10 %. K orientaci v riziku příhody nás na základě analýzy řady studií informují skóre rizika tromboembolické příhody. Starší a stále v praxi nejrozšířenější je skóre CHADS2. To vyjadřuje závažnost rizikových faktorů cardiac failure, hypertension, age, diabetes mellitus, stroke přidělením jednoho bodu každému faktoru a iktu přidělením bodů dvou (tab. 1). Význam faktorů je tak částečně kvantifikován a přiřazení bodu či dvou vyjadřuje relativní zvýšení vlastního rizika tromboembolické mozkové příhody. V posledních letech je zaváděno modifikované skóre CHA2DS2Vasc, kdy je riziko věku rozděleno do dvou kategorií a navíc jsou přidány dva nové faktory: ženské pohlaví a přítomnost cévního onemocnění, jako např. prodělaný infarkt myokardu, přítomnost ischemické choroby DK či aterosklerotických plátů v aortě (tab. 1). Riziko iktu či systémové závažné tromboembolické příhody stoupá se vzrůstajícím skóre od 1–2 % ročně po 15–18 % ročně (obr. 1).
Tab. 1. Skóre rizika tromboembolické mozkové příhody. 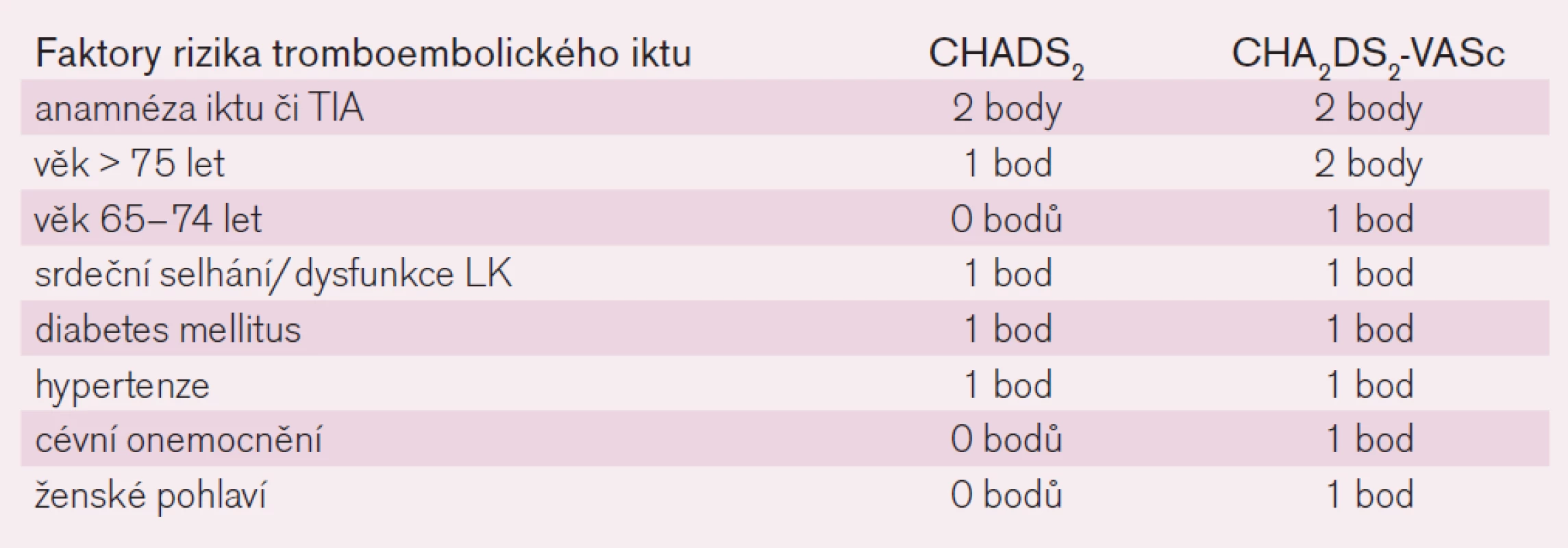
Obr. 1. Relativní riziko CMP při kumulaci rizikových faktorů u nemocných s fibrilací síní [12]. ![Relativní riziko CMP při kumulaci rizikových faktorů u nemocných s fibrilací síní [12].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/3ed637d9aa68d7f6795aa6d50e0525a1.jpg)
Obdobně je klasifikováno riziko krvácení prostřednictvím skóre HAS-BLED (hypertension, abnormal renal/liver function, stroke, bleeding history or predisposition, labile INR, elderly (> 65 let), drugs/alcohol). Také zde riziko významně stoupá od asi 0,5 % ročně. Jak je patrné z tabulky (tab. 2), jsou rizikové faktory tromboembolické příhody velmi často obdobné jako faktory zvyšující riziko krvácení. Senioři s polymorbiditou pak zpravidla spadají do nejvyšších kategorií rizika iktu i krvácení. Nicméně zejména ve vyšších věkových skupinách je přínos léčby zpravidla největší, byť tato stran tromboembolie nejohroženější kategorie nemocných je v praxi k léčbě nejméně často indikována.
Tab. 2. Skóre rizika hemoragické příhody HAS-BLED. 
Vlastní indikaci antikoagulační léčby určíme podle rizikového skóre CHADS2/CHA2DS2Vasc. Rizikové faktory CHADS2 jsou všechny považovány za „velké“, naopak věk mezi 65–74 lety, ženské pohlaví či vaskulární postižení za „malé“. Absence rizikových faktorů svědčí pro velmi nízké riziko tromboembolie, riziko krvácení převažuje nad benefitem, antikoagulační léčba indikována není. Přítomnost jednoho velkého či dvou faktorů malých ukazuje na mírné riziko, které jen mírně převažuje nad rizikem krvácení. Zde zvažujeme riziko HAS-BLED a při nízkém riziku krvácení indikujeme antikoagulační léčbu, event. léčbu protidestičkovou podáním kyseliny acetylsalicylové. Přítomnost více tromboembolických faktorů či anamnéza mozkové příhody indikuje podávání antikoagulancií již jednoznačně. U vyššího skóre HAS-BLED (≥ 3) pak zvažujeme léčbu přímými inhibitory trombinu či faktoru Xa, výskyt krvácivých komplikací je výrazně nižší než při podávání antivitaminů K.
Indikace antikoagulační léčby u nemocného s fibrilací síní podle skóre CHADS2/CHA2DS2Vasc je sice nepřesným, ale prakticky užitečným schématem. Je-li stav nemocného hodnocen jako nerizikový, tj. nezískal-li žádný bod a je-li ve věku pod 60 let, jeho absolutní riziko tromboembolické mozkové příhody v následujícím desetiletí je minimální a pohybuje se mezi 1–2 %. Nemocný k antikoagulační či k protidestičkové léčbě indikován není. Při skóre 1, tj. s jedním méně významným faktorem, je riziko tromboembolie větší a absolutní přínos antitrombotické léčby tak mírně převažuje nad rizikem významného krvácení. Podle rizika krvácení, schopnosti spolupráce a preference nemocného pak zvážíme indikaci protidestičkové léčby podáním ASA nebo zavedeme lege artis terapii antikoagulační. Skóre 2 a vyšší je pak jasnou indikací k antikoagulační léčbě, přínos jasně převládá nad rizikem. Tak například překonaná mozková příhoda v anamnéze zvyšuje riziko recidivy ischemického iktu na 10–15 % ročně. Zvyšující se věk zvětšuje riziko rovněž velmi výrazně: od 1,5 % v šesté dekádě k 20–25 % v dekádě deváté. Navíc u těchto seniorů jsou zpravidla přítomny i další faktory rizika. Vedle základních ukazatelů zařazených do schémat máme i ukazatele nezařazené. Konkrétně je doloženo, že vznikla-li fibrilace síní na podkladě chlopenní vady, zejména vady revmatické, zvyšuje se riziko tromboembolického iktu nejméně dvojnásobně proti riziku u nevalvulární etiologie.
Závěrem nutno zdůraznit, že všechna skóre – jak rizika tromboembolie, tak rizika krvácení – byla postavena na konkrétních epidemiologických datech z kohort léčených antivitaminy K, konkrétně warfarinem. Nová antikoagulancia, tj. gatrany i xabany jsou v profylaxi účinnější a zejména stran rizika krvácení bezpečnější. Aplikace schémat platících pro warfarin je tak znevýhodňuje, lze proto očekávat, že kritéria indikace pro nová antikoagulancia se rozšíří a v dohledné době tak lze čekat překlasifikování indikace k léčbě na základě stanovení poměru přínosu a rizika platného pro nemocné léčené novými antikoagulancii.
Inhibice koagulačních faktorů závislých na vitaminu K (warfarin)
Léčba warfarinem má jistě řadu kladů: jak praktičtí lékaři, tak specialisté s ní mají dlouhodobé zkušenosti, vedení léčby patří ke každodenní praxi, jedná se o léčbu nepříliš nákladnou a v neposlední řadě je v plejádě indikací dobře doložena klinická účinnost. Nicméně antikoagulační léčba warfarinem přináší řadu problémů, které vyplývají na jedné straně z velkých rozdílů v terapeutické odpovědi mezi jednotlivci – tedy z interindividuální variability – či na straně druhé z variability aktuální antikoagulační odezvy v čase u daného nemocného – tedy z rozdílů intraindividuálních. Tyto odlišnosti vyplývají zejména z komplikovaných farmakokinetických i farmakodynamických vlastností warfarinu. Nepříznivé farmakologické vlastnosti antivitaminů K jsou pro klinika významné, neboť terapeutické okno je velmi úzké. Již malé snížení antikoagulačního účinku zvyšuje riziko trombotické či tromboembolické komplikace či opačně – zvýšení efektu je provázeno neúnosným rizikem krvácení. Na jedné straně nás tak láká zrádný zpěv Scylly a na druhé nám hrozí nenasytný chřtán Charybdy. Udržování léčebného rozmezí na bezpečné a účinné hranici – tj. indexu INR (international normalised ratio) mezi 2, 0 až 3,0 (event. 3,5) – je imperativem a vyžaduje časté monitorování účinku.
Bez nadsázky je možno považovat warfarin z farmakologického hlediska za jeden z „nejnepřátelštějších“ léků jak pro lékaře, tak i pro nemocného. Pro lékaře zejména z pohledu obtížného nastavení léčebné hladiny a kvůli vysokému riziku krvácivých komplikací, pro nemocného pro nutnost těsné spolupráce stran dodržování dietních opatření, omezení užívání řady léků a nutnosti monitorování účinku. Při nedodržování disciplíny hrozí trombotická či hemoragická komplikace.
Warfarin je nepochybně lék vysoce účinný s příznivým dopadem na prognózu nemocných při jeho užití v řadě indikací. Navíc se jedná o lék masově užívaný – v roce 2011 bylo v České republice warfarinem dlouhodobě léčeno kolem 100 tisíc nemocných, tedy jedno procento populace, většina právě v indikaci profylaxe iktu u fibrilace síní. Je proto účelné se podívat na základní farmakologické vlastnosti warfarinu. Příčiny variability v léčebné odpovědi na warfarin můžeme rozdělit do dvou skupin – na odlišnosti vyplývající z farmakogenetické výbavy (interindividuální variabilita) a na odlišnosti účinku při potravinových a lékových interakcích (intraindividuální variabilita).
Interindividuální rozdíly v odpovědi na antivitaminy K, zejména na warfarin, jsou známy již 50 let. Kliniky jsou plně respektovány a nastavení a důsledné vedení léčby podle hodnot INR je běžnou praxí. Na variabilitě účinku, tj. na optimální cílové dávce warfarinu se podílí jak rozdíly ve farmakokinetice (odlišná expozice léku či aktivního metabolitu), tak ve farmakodynamice, tedy rozdílné odpovědi organizmu na léčivo. Řada cílových struktur zodpovědných za působení warfarinu – zejména receptorů a enzymů – je polymorfních, tedy významná část populace odpovídá na léčbu výrazněji či naopak slaběji (obr. 2). V populaci se tak objevuje velká mozaika jedinců s různou citlivostí k působení warfarinu (z důvodu polymorfizmu cílového enzymu, jehož aktivitu antivitaminy K inhibují), s různou nabídkou warfarinu na úrovni hepatocytu (z důvodu odlišností v biodegradaci warfarinu či transportních kanálů zajišťujících přenos přes membránu) nebo různou nabídkou vitaminu K na úrovni hepatocytu (při zpomalené bioeliminaci vitaminu K). Podívejme se na hlavní příčiny rozdílů v citlivosti k warfarinu z důvodů farmakogenetických i z důvodů věku, hmotnosti a pohlaví.
Obr. 2. Mechanizmus účinku warfarinu a polymorfizmy ovlivňující farmakodynamickou odpověď a farmakokinetiku warfarinu. 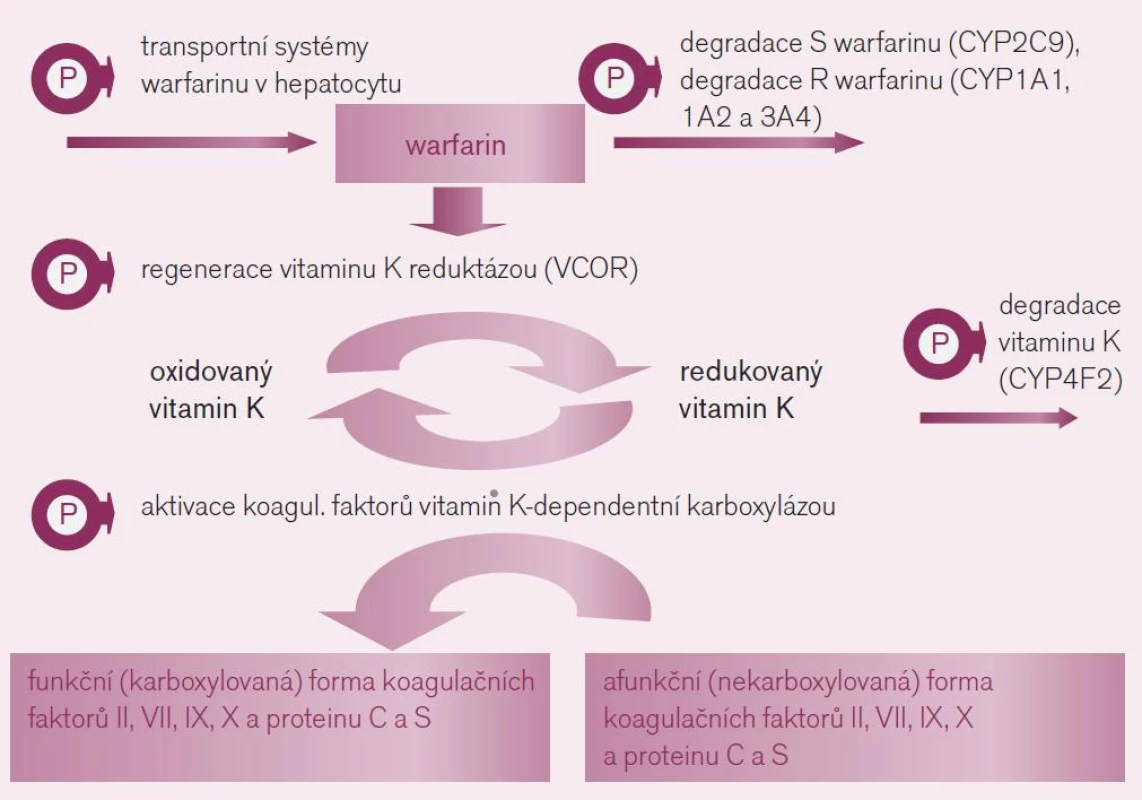
- Polymorfizmus cílového enzymu – reduktázy vitaminu K: K aktivaci řady koagulačních faktorů (trombinu, VII, IX, X či proteinu C a S) je potřeba redukované formy vitaminu K (přirozený vitamin K). Ten při této aktivaci přechází do formy oxidované – epoxid vitaminu K a tato oxidovaná forma je cyklicky regenerována pomocí enzymu – vitamin K reduktázy (VKOR) opět na funkční vitamin K. Vlastní aktivace (γ-karboxylace) koagulačních faktorů je zprostředkována enzymaticky – γ-glutamyl karboxylázou (GGCX), která je dependentní na přítomnosti redukované formy vitaminu K (obr. 2).
Warfarin stejně jako ostatní antivitami-ny K inhibuje regeneraci oxidovaného vitaminu K blokádou tohoto enzymu – VKOR. Tento enzym je však polymorfní, resp. polymorfní je jeho podjednotka C1 (VKORC1). Kvůli variabilní aktivitě se v populaci setkáváme s různou citlivostí k inhibici antivitaminy K. Nositelé alelické varianty VKORC1AA, což je asi čtvrtina populace, konstituují výslednou subpopulaci warfarin-senzitivní a na druhém pólu stejná část jedinců s variantou VKORC1BB je k působení warfarinu méně citlivá, tj. subpopulace warfarin-rezistentní. Nositelé smíšeného genotypu VKORC1AB tvořící zbytek – polovinu populace – jsou středně citliví. Takto máme vedle sebe tři relativně velké podskupiny s rozdílnou odpovědí na lék. Nezávisle na přítomnosti dalších polymorfizmů ovlivňujících účinek warfarinu se pro genotyp senzitivní účinná dávka pohybuje kolem 3 mg/den, pro rezistentní kolem 6 mg/den. Vedle polymorfizmu VKORC1 hraje roli v citlivosti k warfarinu též aktivita γ-glutamyl karboxylázy, výsledná citlivost k warfarinu však je polymorfizmem významně méně ovlivněna. - Polymorfizmy ovlivňující nabídku warfarinu na úrovni hepatocytu: Druhým důvodem rozdílné odpovědi na warfarin jsou rozdíly v biodegradaci (obr. 2). Warfarin podáváme jako racemát dvou stereoizomerů – podstatně účinnější S-warfarin a méně účinný R-warfarin. S-warfarin je transformován a inaktivován polymorfním izoenzymem CYP2C9. Oxidáza CYP2C9 bývá u části populace afunkční – typ CYP2C9*1*1 – pomalí metabolizátoři či naopak hyperaktivní, s genotypem CYP2C9*2*2 nebo CYP2C9*1*3, čili rychlí metabolizátoři. U prvních stačí k plnému antikoagulačnímu účinku nízké dávky warfarinu, pro druhý extrém je potřeba volit dávky vysoké. Sejdou-li se však současně genotyp „pomalého metabolizátora“ a genotyp „VKOR senzitivní“, pak se odpovídající léčebná dávka pohybuje kolem 1–2 mg/den či může dokonce klesnout i pod 1 mg warfarinu denně. Naopak druhým extrémem je koincidence „rezistentního“ genotypu a současně rychlého metabolizátora – zde musíme často zvýšit dávku až k 10 či 15 mg warfarinu denně.
R-warfarin se zpravidla na antikoagulačním efektu významně nepodílí, nicméně za situace, kdy je z genetických příčin či při lékové interakci nedostatečná aktivita biodegradačních enzymů (CYP1A1, 1A2 nebo 3A4), může být nabídka R-warfarinu vysoká a může se klinicky též uplatnit zvýšením celkové antikoagulační aktivity warfarinu.
Z genetických faktorů určujících citlivost k warfarinu se mohou podílet i další polymorfizmy, např. transmembránových transportních proteinů kontrolujících vstup a eliminaci vitaminu K či S-warfarinu do hepatocytu, ty však mají menší význam (obr. 2). - Polymorfizmy ovlivňující nabídku vitaminu K v hepatocytu: Vitamin K je metabolizován v hepatocytu polymorfním izoenzymem CYP4F2. Nosiči méně aktivní varianty této oxidázy (CYP4F2 V433M) degradují vitamin K pomaleji, nabídka aktivního vitaminu K v hepatocytu je vyšší, ke stejnému antikoagulačnímu efektu antivitaminu K je potřeba větší dávka.
- Vliv hmotnosti, věku, pohlaví a průvodních onemocnění: Obdobně jako u jiných léků, také hmotnost může ovlivnit výsledný efekt, mechanizmus vyplývá z distribuce léčiva do většího objemu a z výsledné nižší koncentrace léčiva v hepatocytu. Vyšší věk je zpravidla spojen s mírně sníženou expresí jaterních izoenzymů CYP a s nižší biodegradací warfarinu, ve výsledku se setkáváme zpravidla s nutností redukce dávky. Naproti tomu v expresi izoenzymu CYP2C9, z pohledu biodegradace warfarinu klíčového enzymu, nebyly zjištěny rozdíly v pohlaví.
Přítomnost závažného průvodního onemocnění je při léčbě warfarinem běžná, výslednou účinnou dávku warfarinu ovlivňuje významně renální selhání a významná hepatopatie. Při mírné renální insuficienci s glomerulární filtrací 0,5–1,0 ml/sec je v průměru nutno redukovat dávku warfarinu o 10 %, při selhání s filtrací pod 0,5 ml/sec již o 20 %. Také přítomnost jaterní léze zvyšuje citlivost k účinku antivitaminů K, bohužel kvantifikace redukce dávky není dostupná.Příčin intraindividuální variability v léčebné odpovědi na warfarin je opět více. Léčíme-li pacienta antivitaminy K, často se setkáváme s významným kolísáním intenzity antikoagulace s „přestřelováním“ do vysokých či nízkých hodnot INR. Ve velkých kontrolovaných studiích, ve kterých se klade velký důraz na kooperaci nemocných i na dodržování předepsaných postupů, se doba, po kterou je nemocný mimo terapeutickou hodnotu INR (zpravidla mezi 2 až 3 nebo 2 až 3,5), pohybuje kolem 40 %, dokonce i v zemích s vysokou úrovní zdravotnictví a na špičkových specializovaných pracovištích nebývá dosahováno více než 70 % „doby v terapeutickém rozmezí“. Platí přitom vztah mezi touto „dobou“ a výskytem tromboembolických příhod či krvácení. Tak například v nedávno zveřejněné studii ROCKET AF byl v centrech s dobou kontrolou intenzity antikoagulační léčby warfarinem roční výskyt příhod 1,8 % proti centrům s nižším procentem doby v terapeutickém rozmezí, kde byl výskyt příhod 2,5 % [1,2]. Za intraindividuální kolísání odpovědi na léčbu warfarinem jsou zodpovědné jednak příjem vitaminu K v potravě či v polyvitaminových kapslích, jednak lékové interakce.Uvědomíme-li si, že warfarin je inhibitorem „regenerace“ vitaminu K, pak nepřekvapí, že příjem vitaminu K v potravě významně ovlivní antikoagulační efekt. Řada potravin má vysoký obsah vitaminu K, zejména zelenina, vnitřnosti a maso jsou bohatým zdrojem. Odhad příjmu je však nespolehlivý, např. obsah vitaminu K v mase je závislý na stravě zvířete a sezónně kolísá. Výkyvy v konzumaci potravy bohaté na vitamin K zásadně ovlivní účinek antivitaminů K. Vedle potravy je část přijatého vitaminu K původem ze střevních bakterií, po jejich potlačení antibiotiky může být snížena nabídka vitaminu K a zvýšen účinek warfarinu.
Posledním významným faktorem ovlivňujícím variabilitu účinku warfarinu jsou lékové interakce. Ty se zpravidla týkají ovlivnění metabolizmu biologicky aktivnějšího S-warfarinu, vzácněji se však mohou uplatnit i lékové interakce na úrovni R stereoizomeru. Klinicky významné interakce antikoagulačního efektu warfarinu mohou být na různých úrovních – ovlivněním resorpce léčiva ve střevě (např. pryskyřicemi), jeho vytěsněním z vazby na albumin a zvýšením volné, účinné frakce léčiva (např. acetylsalicylovou kyselinou), indukcí či inhibicí hepatálních izoenzymů degradujících S-warfarin (CYP2C9), event. R-warfarin (CYP 1A1, 1A2 či 3A4). Význam mají také interakce ovlivňující nabídku vitaminu K – jak přijímaného per os (multivitaminy), tak produkovaného bakteriemi v tlustém střevě (zejm. antibiotika, střevní dezinficiencia či laxativa).
Klinicky nejvýznamnější jsou interakce na úrovni oxidázy degradující S stereoizomer warfarinu – CYP2C9. Mezi významné induktory CYP2C9 – snižující efekt warfarinu – patří zejména barbituráty, rifampicin, karbamazepin či třezalka a extrakty z ní. K inhibitorům – zvyšujícím nabídku warfarinu a tak i antikoagulační efekt – patří zejména amiodaron, propafenon, azolová antimykotika, klarithromycin, diltiazem, omeprazol, clopidogrel, fluvastatin, nesteroidní antiflogistika, anabolické steroidy, fenofibrát, karbimazol, metronidazol aj. V metabolizmu R-formy warfarinu se může uplatnit pouze výrazná inhibice biodegradace oxidáz CYP zvyšující silně nabídku R-warfarinu. Mezi významné inhibitory CYP1A1 a 1A2 – zvyšující antikoagulační účinek warfarinu – patří ciprofloxacin, amiodaron, fluvoxamin či cimetidin. Z praktického hlediska je významná zejména interakce s amiodaronem či s propafenonem (nikoli však s dronedaronem), neboť tyto léky jsou velmi často podávány u nejčastější indikace antikoagulační léčby – fibrilace síní. Dále má význam nekontrolované užívání antiflogistik (koxibů, piroxikamu, indometacinu aj.), vedle rizika „přestřelení“ antikoagulační léčby se zvyšuje i riziko slizničních lézí v trávicím traktu s krvácením. Lékař často o užívání těchto léků není informován, pacient by tak měl být poučen, že relativně bezpečná je kombinace s paracetamolem či s atypickými opioidy typu tramadolu.
Na výsledné variabilitě účinku warfarinu se podílí jak genetické, tak zevní vlivy – zdá se, že podíl obou složek je srovnatelný. Práce určující podíl jednotlivých faktorů se shodují, že na interindividuální variabilitě účinku se podílí známé polymorfizmy asi ze tří čtvrtin: variabilita reduktázy vitaminu K asi 40–50 %, variabilita aktivity CYP2C9 asi 10–20 % a ostatní polymorfizmy dohromady asi 10 %. Věk, hmotnost a pohlaví přispívají zbývající čtvrtinou. Naproti tomu intraindividuální variabilita účinku warfarinu je nejvíce ovlivněna měnlivým příjmem vitaminu K v potravě – odhaduje se, že podíl činí kolem 40 %, lékové interakce pak přispívají 10–20 %, nedostatečná spolupráce nemocných – vynechání léku či naopak duplicitní dávky – se pravděpodobně podílejí rovněž 10–20 % a zbytek příčin kolísání antikoagulační aktivity v průběhu léčby zůstává neodhalen.
Jaká máme data pro podávání warfarinu v profylaxi iktu a systémové embolizace u nemocných s fibrilací síní? Ač je léčba warfarinem – z pohledu vedení léčby lékařem i z pohledu nemocného – značně problematická, její klady v dané indikaci významně převyšují negativa. Platí to zejména stran účinnosti v profylaxi iktu. Metaanalýzy dokládají snížení rizika příhody o dvě třetiny proti placebu a o dvě pětiny proti kyselině acetylsalicylové či jiným protidestičkovým lékům při antikoagulační léčbě warfarinem vedené lege artis [3]. Konkrétně byl v šesti velkých studiích kontrolovaných placebem doložen konzistentní efekt warfarinu, zaznamenán pokles mozkových příhod o 64 % – RR 0,36; CI 49–74 (obr. 3). Obdobně byl v sedmi studiích kontrolovaných kyselinou acetylsalicylovou či ve třech hodnoceních srovnávajících efekt s duální protidestičkovou léčbou či s jinými antiagregancii pozorován další pokles incidence iktů o 37 % (obr. 4).
Obr. 3. Srovnání účinku warfarinu s placebem v prevenci iktu u nemocných s fibrilací síní. 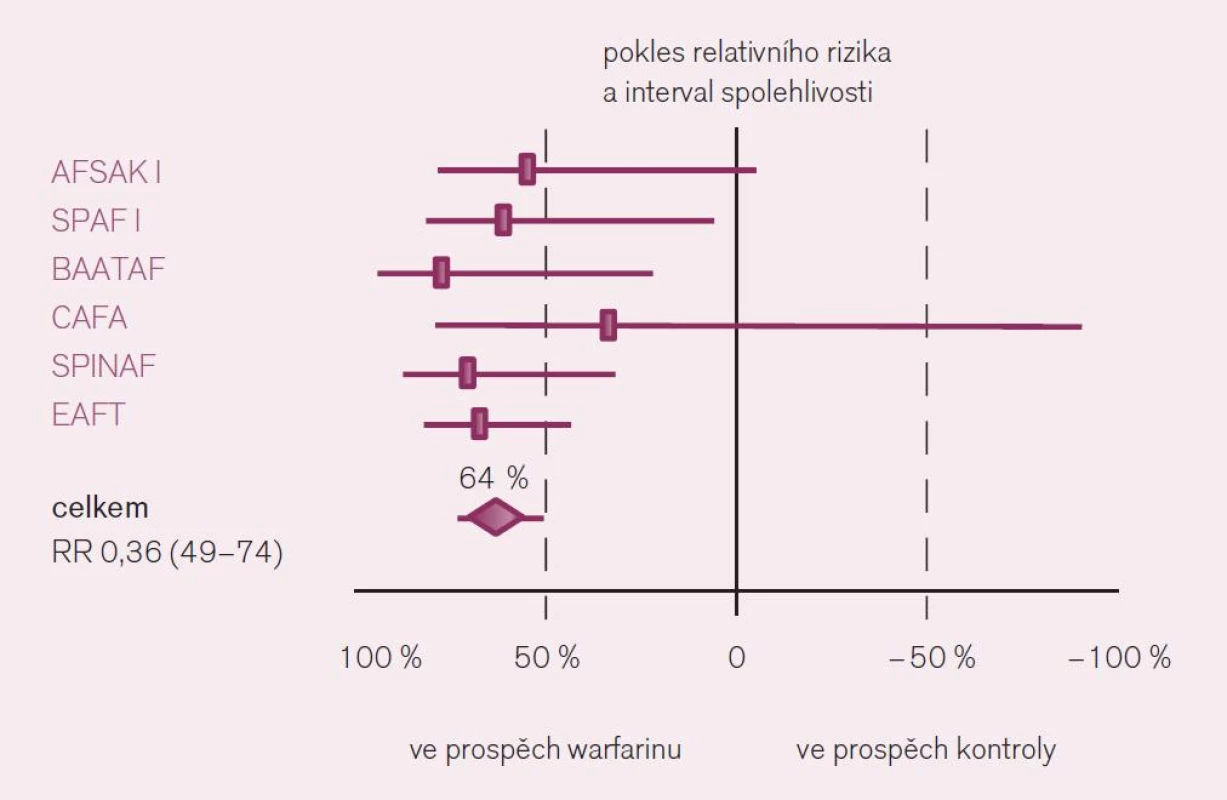
Obr. 4. Srovnání účinku warfarinu s protidestičkovými léky (zejm. s kyselinou acetylsalicylovou) v prevenci iktu u nemocných s fibrilací síní. 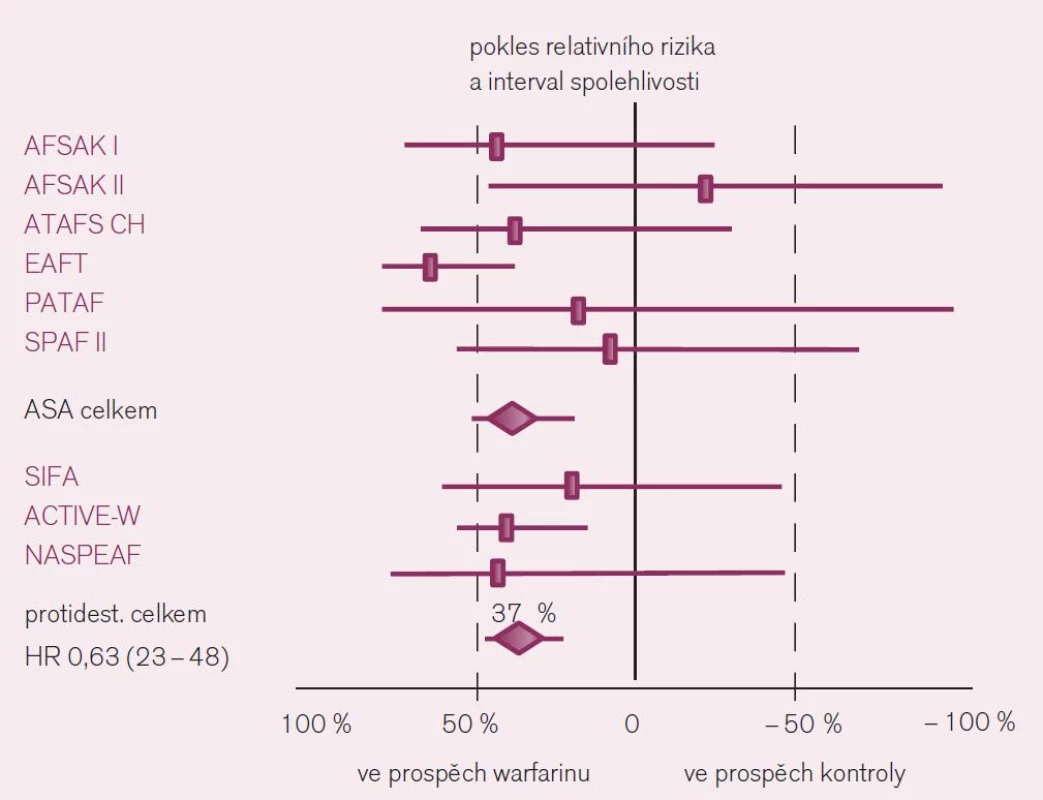
Efekt warfarinu je přísně vázán na kvalitu kontroly inhibice antikoagulačního působení, tj. udržením INR v rozmezí 2–3. V subterapeutických dávkách (INR 1,8–2) byl účinek významně menší, naopak při vzestupu INR nad 3 (resp. výrazněji při INR nad 4) se zvýšilo riziko krvácení. Jedním z významných omylů je názor, že u seniorů je optimální strategií dosahování nižší cílové úrovně INR, tedy 1,8–2,5 či dokonce jen 1,5–2,0. Ač nemáme v této otázce k dispozici dostatek dat z kontrolovaných prospektivních studií, kohortní retrospektivní studie dokládají dvojnásobný nárůst iktů při sub-terapeutické dávce warfarinu proti léčbě lege artis s dosaženými hodnotami INR v rozmezí 2–3.
Stanovení procenta dnů strávených v terapeutickém rozmezí (target therapeutic range – TTR) ukázalo na zásadní přínos kvality léčby, resp. kontroly efektu. Bohužel i zde platí, že v klinických studiích bylo dosahováno významně větší hodnoty TTR, než je pravidlem v běžné praxi. Uvědomíme-li si, že dle nepublikované „vnitřní analýzy“ kvality léčby warfarinem v ČR provedené plátci zdravotní péče je TTR pod 50 %, řada nemocných vůbec kontrolována není! Je tak otázkou, zda předložená data platí i pro „reálný život“. Špatná kontrola intenzity antikoagulační léčby (z podcenění ze strany pacienta či z nezájmu lékaře) je pravděpodobně důvodem ke zvážení pokračování v léčbě. Nejsou-li předpoklady pro účinnou a bezpečnou léčbu, pak je nutno aplikaci warfarinu ukončit a volit jinou strategii. Jednou je léčba novými přímými inhibitory trombinu či faktoru Xa.
Přímé inhibitory trombinu (dabigatran)
Mezníkem v profylaxi tromboembolických mozkových příhod bylo zavedení nových perorálně účinných antikoagulancií – gatranů a xabanů. Dabigatran je jediným antikoagulanciem typu přímých inhibitorů trombinu, který je uvolněn v indikaci profylaxe mozkových cévních příhod a systémové embolizace u nevalvulární fibrilace síní.
Přímé inhibitory trombinu, jako je dabigatran, se selektivně vážou na katalytické místo trombinu a k jejich působení, na rozdíl od nepřímých inhibitorů (např. heparinů), není potřeba antitrombin. Díky tomu je léčba spolehlivější, působí též u nemocných s deficiencí antitrombinu. Proti nepřímým inhibitorům může dabigatran inaktivovat trombin vázaný ve fibrinové síti, a nevzniká tak riziko rebound-fenoménu s hyperkoagulačním stavem po uvolnění aktivního trombinu po rozpadu trombu. Dabigatran inhibuje nejen konverzi fibrinogenu na fibrin, ale též aktivaci trombocytů a trombomodulinu (obr. 5). Inaktivace trombinu je dobře predikovatelná a léčba nevyžaduje monitorování antikoagulační aktivity. Spolehlivost účinku, bez rizika navození prokoagulačního efektu, je významnou předností dabigatranu. Při potřebě posouzení antikoagulačního účinku, například před chirurgickým zákrokem, máme ke zjištění aktivity dabigatranu, resp. inaktivace trombinu dostupné aktivovaný parciální tromboplastinový čas (aPTT) či přímé určení hladiny dabigatranu pomocí testu Hemoclot.
Obr. 5. Místo působení přímých inhibitorů trombinu a faktoru Xa. Ve schématu je dobře dokumentován význam obou faktorů při <i>iniciaci koagulace</i> (fáze 1 a 2) – kdy působením tkáňového faktoru (TF) je uvolněno po aktivaci faktoru Xa malé množství trombinu, i ve fázi <i>propagace koagulace</i> (fáze 3 a 4) – kdy toto malé množství trombinu aktivuje celou kaskádu na více místech, včetně faktoru Xa. Uvolněné větší množství trombinu pak při <i>inhibici koagulace</i> (fáze 5 a 6) aktivuje trombomodulin a proteiny C a S degradující komplexy aktivních koagulačních faktorů. Paralelně trombin aktivuje destičkovou hemostázu stimulací trombocytárních receptorů PAR-1 (fáze 7 ve schématu). 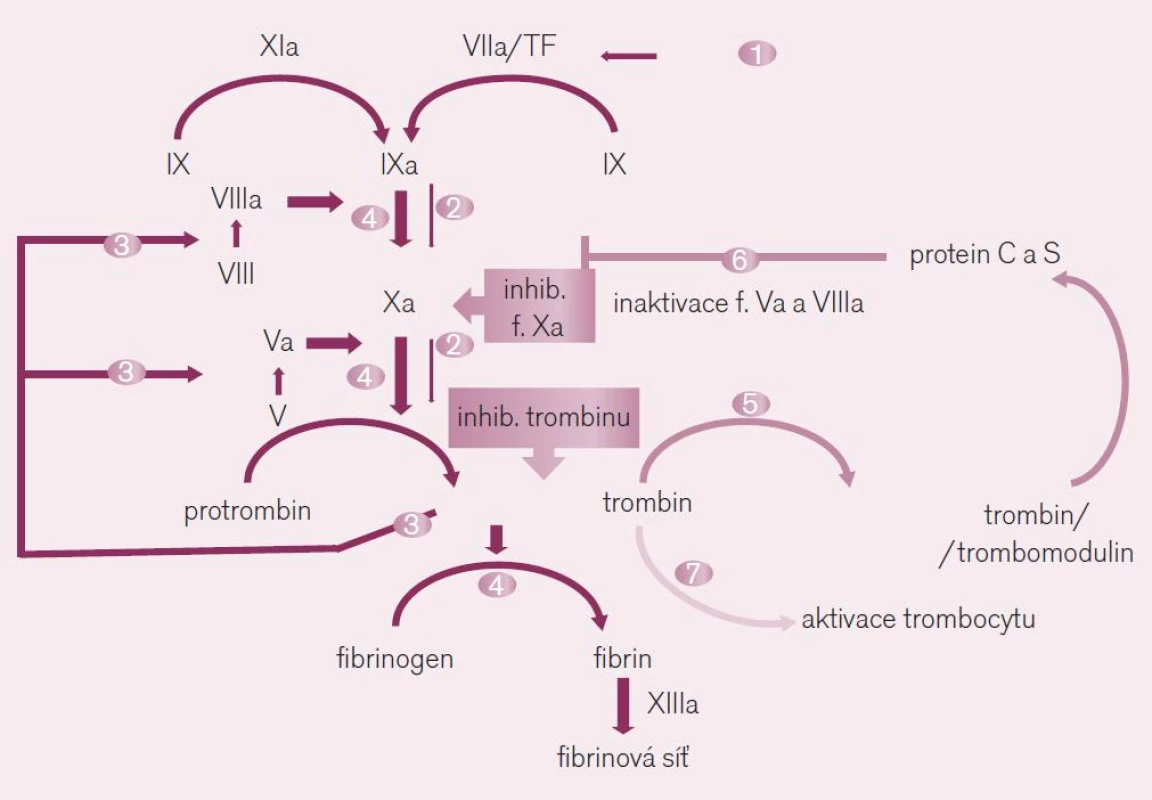
Dabigatran má velmi rychlý nástup účinku (≈ 30 min), plazmatický poločas (12–14 hod) je dostatečně dlouhý, aby spolehlivě pokryl dávkové období při podávání 1krát denně a současně udržel hladinu při jednorázovém vynechání dávky (tab. 3). Vylučován je převážně ledvinami, proto vždy před započetím léčby stanovujeme renální funkce. Pro riziko kumulace při renálním selhání (s clearancí kreatininu pod 0,5 ml/sec) je lék kontraindikován, při renální nedostatečnosti (s clearancí kreatininu mezi 1,0 až 0,5 ml/sec) dávku redukujeme. Společnou nevýhodou přímých inhibitorů trombinu i inhibitorů faktoru Xa je nedostupnost specifického antidota. Při krvácení je však možno zkusit aplikaci rekombinantního faktoru VII (NovoSeven®) nebo komplexního koncentrátu protrombinu a faktorů IX a X (FEIBA®). In vitro studie sledující efekt u zdravých dobrovolníků ukázala dobrou obnovu hemostázy při užití obou přípravků v testech in vitro [4]. Klinický účinek při krvácení a nutnost ukončení účinku dabigatranu však bude nutno ověřit.
Tab. 3. Srovnání farmakologických vlastností perorálně účinných antikoagulancií. 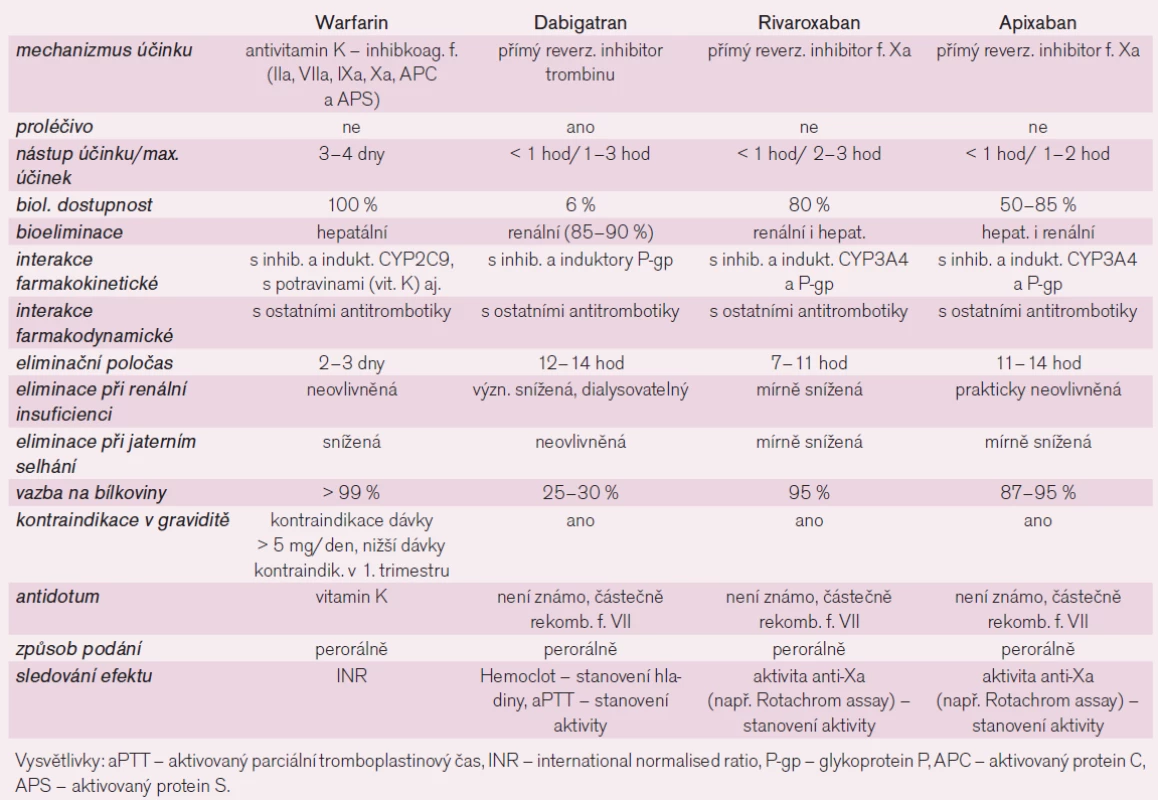
Riziko lékových interakcí je při léčbě dabigatranem nízké. S lékovými interakcemi se setkáváme na úrovni farmakodynamické (potencuje se zpravidla efekt synergisticky působících léků) či na úrovni farmakokinetické (zejména vzájemným ovlivněním dostupnosti, metabolizmu a eliminace). Riziko krvácení zvyšují nesteroidní antirevmatika (ibuprofen, indometacin, diklofenak), naopak bezpečné jsou paracetamol, tramadol a krátkodobě léčba koxiby. Lékové interakce farmakokinetické jsou omezeny na ovlivnění dostupnosti na úrovni enterální resorpce a hepatální eliminace refluxní pumpou glykoproteinu P. Dabigatran-etexilát ani jeho účinný metabolit dabigatran totiž nejsou transformovány izoenzymy CYP, bioaktivace probíhá již ve střevě a nepodléhá interakcím. Současné podávání inhibitorů P-gp (verapamil, azolová antimykotika, amiodaron, klaritromycin) zvyšuje dostupnost dabigatranu o 40–250 %. Silné inhibitory glykoproteinu P ketokonazol, itrakonazol, cyklosporin a takrolimus jsou při podávání dabigatranu kontraindikovány, při současném podávání verapamilu či amiodaronu volíme nižší dávku dabigatranu (tj. 2krát 110 mg). Současné podávání induktorů glykoproteinu P (třezalka, řada antikonvulziv či rifampicin) snižuje dostupnost dabigatranu a klesá účinek, kombinaci se proto vyhneme.
Jaká jsou data pro užití přímých inhibitorů trombinu v profylaxi iktu a systémové embolizace u nemocných s fibrilací síní? Jedním z nejvýznamnějších kroků na poli kardiovaskulární farmakoterapie posledního desetiletí bylo zavedení nových antikoagulancií ze skupiny přímých inhibitorů trombinu či faktoru Xa. Po krátké epizodě ximelagatranu byl do klinické praxe úspěšně zaveden druhý představitel přímých inhibitorů trombinu, již bezpečnější dabigatran. Obdobně byl pro indikaci profylaxe iktu u fibrilace síní schválen přímý inhibitor faktoru Xa – rivaroxaban. Schvalovací proces probíhá pro stejnou skupinu nemocných také u jiného představitele skupiny xabanů – apixabanu.
Doklady o příznivém účinku na pokles tromboembolických komplikací u nemocných s non-valvulární fibrilací síní a s rizikovým skóre indikujícím je k antikoagulační léčbě máme pro tři představitele nových antitrombotik. Dabigatran byl v této indikaci prověřen ve studii RE-LY, byl schválen ke klinickému užití a byly též stanoveny podmínky úhrady. Efekt rivaroxabanu byl doložen ve studii ROCKET AF, byl rovněž uvolněn ke klinickému užití, schválení podmínek úhrady se však teprve (v září 2012) očekává a lze předpokládat obdobné znění podmínek i stejnou výši úhrady. Apixaban má pouze doklad o příznivém účinku (studie ARISTOTLE), schválení indikace se však zatím očekává. U edoxabanu v této indikaci probíhá studie III. fáze hodnocení ENGAGE-AF, ostatní přímé inhibitory trombinu (otamixaban, betrixaban, razaxaban aj.) jsou stále v časnějších fázích klinického hodnocení.
Účinnost a bezpečnost dabigatranu u nemocných s nevalvulární fibrilací síní s přítomností alespoň jednoho rizikového faktoru embolizace (anamnéza iktu, TIA nebo systémové embolizace, symptomatické srdeční selhání či snížená EF levé komory pod 40 % nebo věk nejméně 75 let, resp. 65 let spolu s cukrovkou nebo s ICHS či s hypertenzí) byla prověřována ve studii RE-LY [5]. Prakticky se tato kritéria jen minimálně odlišují od zavedené indikace antikoagulační léčby na podkladě skóre CHADS2. V porovnání s warfarinem byly testovány dávky 110 mg nebo 150 mg dabigatranu podávané 2krát denně. Primární ukazatel – výskyt iktu či systémové embolizace – se při testování nižší dávky (2krát 110 mg) dabigatranu nelišil (RR 0,90; CI 0,74–1,10; NS), při vyšší dávce (2krát 150 mg) však byl výrazně, tj. o 35 % nižší (RR 0,65; CI 0,52–0,81; p < 0,001 pro superioritu) (obr. 6).
Obr. 6. Výskyt ischemické či blíže neurčené mozkové příhody ve srovnání s výskytem hemoragické mozkové příhody u nemocných s fibrilací síní (studie RE-LY). 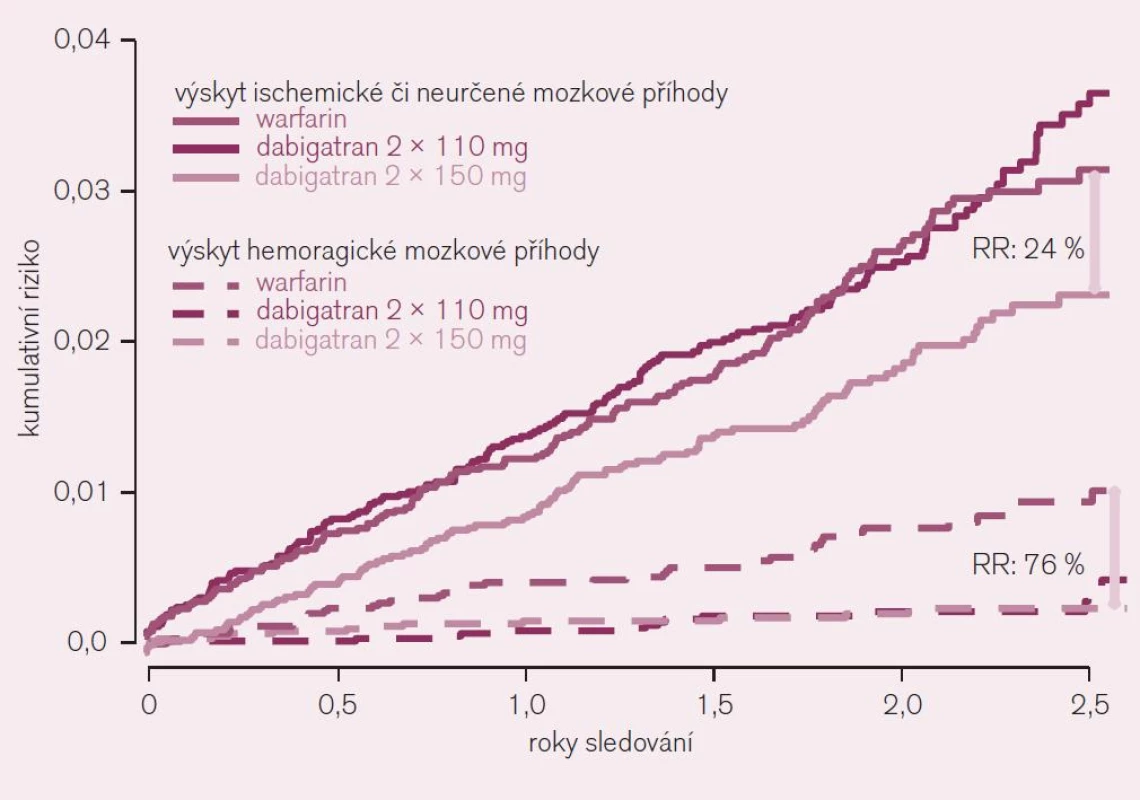
Závažné krvácení bylo při dávce dabigatranu 220 mg/den o 20 % nižší (p < 0,03) a život ohrožující krvácení pokleslo dokonce o třetinu. Také při vyšším dávkování dabigatranu poklesl významně, tj. o 20 % výskyt život ohrožujícího krvácení. Obávaná komplikace – hemoragická mozková příhoda byla redukována při obou dávkách dabigatranu na čtvrtinu, resp. třetinu (obr. 6). Studie prokázala – proti standardnímu podávání warfarinu – větší účinnost i bezpečnost dabigatranu aplikovaného v dávce 2krát denně 150 mg a srovnatelnou účinnost při větší bezpečnosti při dávce 2krát denně 110 mg. Výsledky byly konzistentní i v podskupinové analýze, tj. u nemocných v různém riziku příhody (podle skóre CHADS2), u mužů i žen a podobně.
Jediný podstatný rozdíl v efektu se ukázal v podskupinové analýze podle kontroly účinnosti antikoagulační léčby ve warfarinové větvi, tedy v kvartilech podle dosažené doby v terapeutické hladině INR v rozmezí 2–3 (TTR). Nemocní léčení v centrech s méně dobrou kontrolou INR, tedy s méně než 65 % dnů v terapeutickém rozmezí (dva nižší kvartily), získali větší prospěch z léčby vyššími dávkami dabigatranu; rozdíl ve výskytu iktu či systémové embolizace byl téměř 50 % (obr. 7). Lze shrnout, že pacienti s nedostatečnou kontrolou intenzity antikoagulační léčby warfarinem profitují z podávání dabigatranu nejvíce. Jak již bylo řečeno, takovýchto nemocných je v reálné praxi většina.
Obr. 7. Význam kvality antikoagulace – ve kvartilech dle procenta dnů strávených v terapeutickém rozmezí (TTR) – na základě analýzy studie RE-LY. 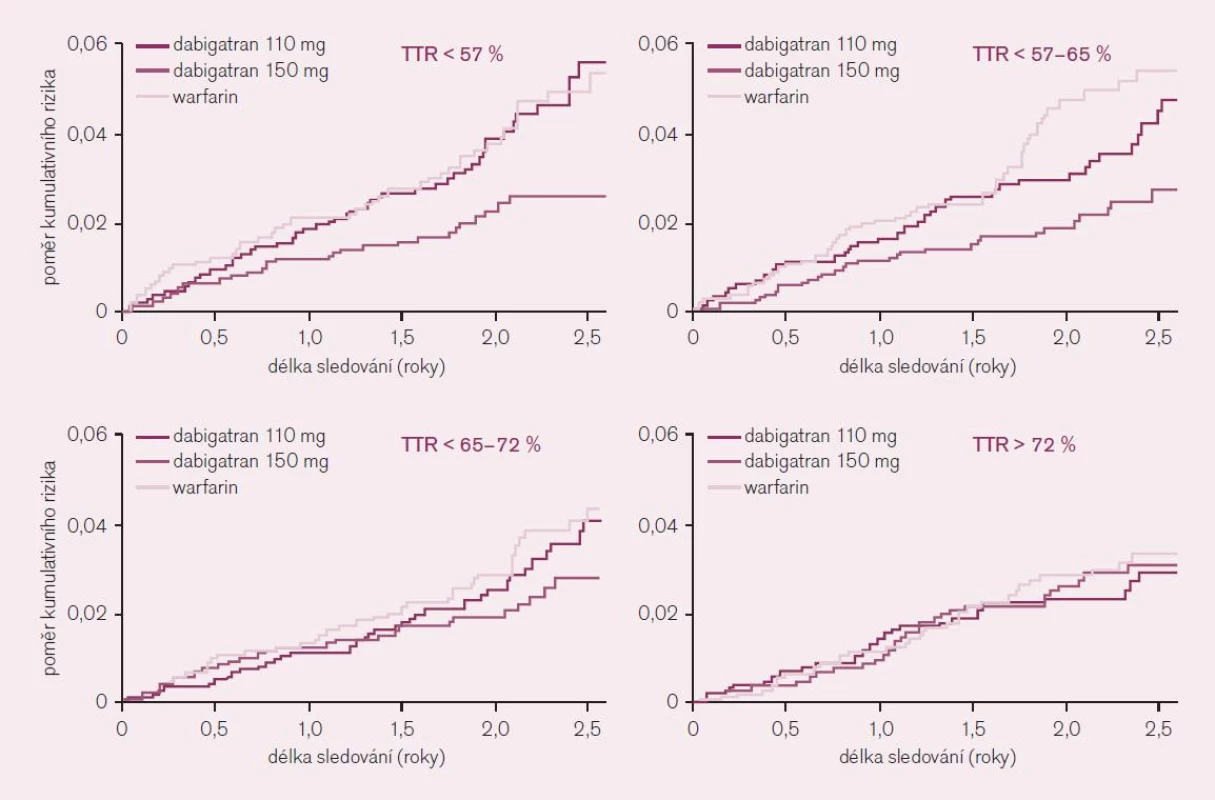
Taktéž bylo řečeno, testovány a schváleny ke klinickému užití v Evropě byly dvě dávky dabigatranu (2krát denně 110 mg či 2krát denně 150 mg). Kdy užít kterou dávku pro konkrétní skupinu nemocných? Otázku musíme řešit ze dvou hledisek – z pohledu účinnosti a z pohledu bezpečnosti. Podíváme-li se na účinnost, pak chceme-li dosáhnout většího poklesu výskytu tromboembolických příhod u nemocných s fibrilací síní, je nutno volit intenzivnější antikoagulaci, tedy není-li kontraindikace, volit dávku 2krát 150 mg dabigatranu. Největší absolutní zisk mají nemocní nejvíce ohrožení tromboembolií, tj. s vysokým (≥ 3) skóre CHADS2, zejména nemocní s anamnézou tromboembolické příhody. Další skupinou jsou nemocní s nedostatečnou kontrolou terapeutického rozmezí warfarinu, tedy ti, u kterých se nám opakovaně nedaří docílit INR mezi 2–3. Klesá-li doba strávená v terapeutickém rozmezí INR pod 60 %, pak je možno počítat s více než polovičním výskytem příhod při léčbě dabigatranem proti léčbě warfarinem.
Budeme-li sledovat bezpečnost, pak u nemocných s vysokým rizikem krvácení je poměr přínos/riziko naopak největší při užití dávky nižší, tj. 2krát 110 mg dabigatranu. Sem patří nemocní s nedostatečnou kontrolou hypertenze, s anamnézou krvácení do zažívacího traktu, s anamnézou vředové choroby, nemocní užívající častěji nesteroidní antirevmatika či léčení protidestičkovou léčbu, nemocní se špatnou kontrolou INR nebo nemocní se sníženými renálními či jaterními funkcemi. Rovněž nízká tělesná hmotnost pod 50 kg zvyšuje riziko hemoragie. Ostatní skupiny s vyšším rizikem krvácení, tj. starší nemocní či hypertonici mají sice též vyšší riziko krvácení, nicméně riziko tromboembolie u nich převažuje, nižší dávce proto dáváme přednost jen u seniorů nad 75 let.
Je reálný předpoklad, že v denní klinické praxi, kdy je dosahováno jen nízké kontroly antikoagulační léčby (měřeno indexem TTR), bude dosahováno spíše většího efektu dabigatranu ve srovnání s warfarinem. Jaké však bude v reálné praxi riziko krvácení? Stejnou otázku si položila Evropská léková agentura (EMA). Po roční zkušenosti s dabigatranem v dané indikaci nebyl ve státech EU pozorován větší výskyt krvácivých komplikací při léčbě dabigatranem v porovnání s daty klinických studií. Naopak výskyt krvácení ve skutečné praxi byl mírně nižší [6].
Na základě předložených dat byly recentně pro preskripci dabigatranu stanoveny i podmínky a výše úhrady. Při předpisu odborným lékařem (kardiolog, neurolog, internista) je v dané indikaci hrazen v prevenci cévní mozkové příhody a systémové embolie u dospělých pacientů s nevalvulární fibrilací síní indikovaných k antikoagulační léčbě při kontraindikaci warfarinu, tj.:
a) nemožnost pravidelných kontrol INR
b) nežádoucí účinky při léčbě warfarinem
c) nemožnost udržet INR v terapeutickém rozmezí 2,0–3,0; tzn. dvě ze šesti měření nejsou v uvedeném terapeutickém rozmezí
d) rezistence na warfarin, tj. nutnost podávat denní dávku více než 10 mg, a to v sekundární prevenci (tj. po cévní mozkové příhodě, tranzitorní ischemické atace nebo systémové embolii) a v primární prevenci za předpokladu přítomnosti jednoho nebo více z následujících rizikových faktorů: ejekční frakce levé komory < 40 %, symptomatické srdeční selhání třídy II či vyšší podle klasifikace NYHA, věk nad (nebo rovno) 75 let, věk 65–74 let, pokud pacient trpí diabetem mellitem, ischemickou chorobou srdeční nebo hypertenzí.
V indikaci profylaxe tromboembolie při fibrilaci síní zahajujeme léčbu nižší dávkou (tj. 2krát 110 mg dabigatranu denně) jen u vybraných skupin nemocných – tj. ve věku 80 let a starších nebo současně užívajících verapamil. Nižší dávka je dále vhodná u pacientů s tělesnou hmotností pod 50 kg, při současném podávání protidestičkové léčby či při nekontrolovaném užívání nesteroidních antirevmatik, při renální insuficienci s glomerulární filtrací 0,5 až 0,83 ml/sec (30–50 ml/min), při současném podávání středně silných inhibitorů efluxní pumpy glykoproteinu P (verapamil, amiodaron) nebo obecně při vysokém riziku krvácení a nízkém riziku embolizace. Naopak všechny ostatní nemocné budeme indikovat k léčbě dávkou vyšší, tj. 2krát 150 mg dabigatranu denně z důvodu výše uvedené vyšší účinnosti v prevenci iktu oproti warfarinu. Před nasazením léčby, resp. výběrem dávky bychom měli znát renální funkce, hmotnost, věk a souběžnou léčbu. Potřebujeme-li převést na dabigatran nemocného léčeného warfarinem, pak bychom měli vyčkat poklesu INR pod 2 a k volbě dávky stanovit renální funkce. Podávání dabigatranu je kontraindikováno při hypersenzitivitě, u stavů s aktivním krvácením či jeho vyšším rizikem (porucha hemostázy apod.), riziko kumulace při renálním selhání (s clearancí kreatininu pod 0,5 ml/sec) či při souběžném podávání silných inhibitorů glykoproteinu P (cyklosporin, ketokonazol, itrakonazol či takrolimus).
Přímé inhibitory faktoru Xa (rivaroxaban, apixaban aj.)
Rivaroxaban, apixaban a ostatní představitelé skupiny xabanů, které jsou ještě ve fázi klinického hodnocení (betrixaban, edoxaban či otamixaban), jsou perorálně účinnými, přímými, kompetitivními a vysoce selektivními inhibitory aktivovaného faktoru Xa (obr. 6). Efekt na inhibici faktoru Xa není zprostředkován antitrombinem, účinek je proto spolehlivější. Nástup účinku je u obou registrovaných inhibitorů rychlý (≈ 30 min) a dlouhodobý (eliminační poločas rivaroxabanu je 7–11 hod a apixabanu 11–14 hod). Překvapivě i při relativně kratším účinku rivaroxabanu volil výrobce podávání v jedné denní dávce, naopak u apixabanu s mírně delší účinkem v dávkách dvou (tab. 3).
Též rivaroxaban a apixaban jsou substráty glykoproteinu P izoenzymu CYP3A4, oba systémy snižují jejich dostupnost. Silné inhibitory P-gp a CYP3A4, jako jsou azolová antimykotika (zejm. ketokonazol), makrolidová antibiotika (klarytromycin) a antiretrovirotika (zejm. ritonavir), zvyšují dosažitelnost a zpomalují eliminaci a inaktivaci. Expozice rivaroxabanu a apixabanu se zvyšuje na dvojnásobek až trojnásobek a maximální koncentrace stoupá o 50–100 %. Jejich podávání je proto kontraindikováno. Menší zvýšení expozice apixabanu a rivaroxabanu lze očekávat při současném podávání středně silných inhibitorů CYP3A4 a P-gp – verapamilu, diltiazemu, amiodaronu, dronedaronu či flavonoidů grepové šťávy. Zvýšení hladiny o 30–50 % je na hranici klinické významnosti. Nutno však upozornit, že faktory zvyšující expozici se sčítají, takže např. podání verapamilu a současně nízká hmotnost léčeného vedou k významnému zvýšení expozice. Silné induktory P-gp a CYP3A4 (některá antiepileptika a antikonvulziva – fenobarbital, fenytoin, karbamazepin či antibiotikum rifampicin nebo třezalka tečkovaná) naopak expozici významně snižují. Jejich podávání se vyhneme. Hladinu nových antikoagulancií není nutno monitorovat, přetrvávající účinek rivaroxabanu a apixabanu ukáže sledování aktivity účinku anti-Xa. Podobně jako u dabigatranu, nemáme pro přímé inhibitory faktoru Xa dostupné antidotum, které by neutralizovalo antikoagulační účinek. Ve stejné studii, v jaké byla in vitro prověřována možnost obnovit hemokoagulaci podáním koagulačních faktorů [4]. V případě rivaroxabanu bylo nejúčinnější podání koncentrátu protrombinu a faktorů IX a X, přípravku FEIBA®, rekombinantní faktor VII byl méně účinný. Laboratorní nález bude i v tomto případě nutno ještě prověřit klinickým hodnocením.
Rivaroxaban je schválen ke klinickému užití v indikaci profylaxe mozkové příhody či systémové embolizace u non-valvulární fibrilace síní jako alternativa warfarinu. Také u rivaroxabanu bylo potvrzení indikace založeno na výsledcích klinického hodnocení, konkrétně studie ROCKET AF [1]. Tato studie porovnávala efekt lege artis podávaného warfarinu s rivaroxabanem u více než 14 tisíc rizikových nemocných (průměrný věk 73 let a vysoké CHADS2 skóre 3,5). Při hodnocení efektu podle kritéria skutečně léčených nemocných – „on treatment“ poklesl během 1–3 roky trvajícího sledování výskyt embolizačních příhod (mozkových i systémových) při léčbě rivaroxabanem o více než pětinu (RR 0,79; CI 0,66–0,96, hodnota p < 0,001 pro non-inferioritu) (obr. 8). Při hodnocení účinku podle randomizace do větví (tak byly hodnoceny i ostatní studie s novými antikoagulancii) byl účinek menší, rozdíl ve prospěch rivaroxabanu byl 12 % (RR 0,88; CI 0,74–1,03, p < 0,001 pro non-inferioritu). Vzhledem ke struktuře studie nebylo při hodnocení podle randomizace (intention to treat) dosaženo kritérií „superiority“ rivaroxabanu proti warfarinu, při hodnocení nemocných skutečně léčených (on treatment) kritérií většího účinku rivaroxabanu dosaženo bylo (p < 0,015 pro superioritu).
Obr. 8. Pokles výskytu iktu a systémové embolie při srovnání rivaroxabanu s warfarinem při analýze „on-treatment“ ve studii ROCKET AF. 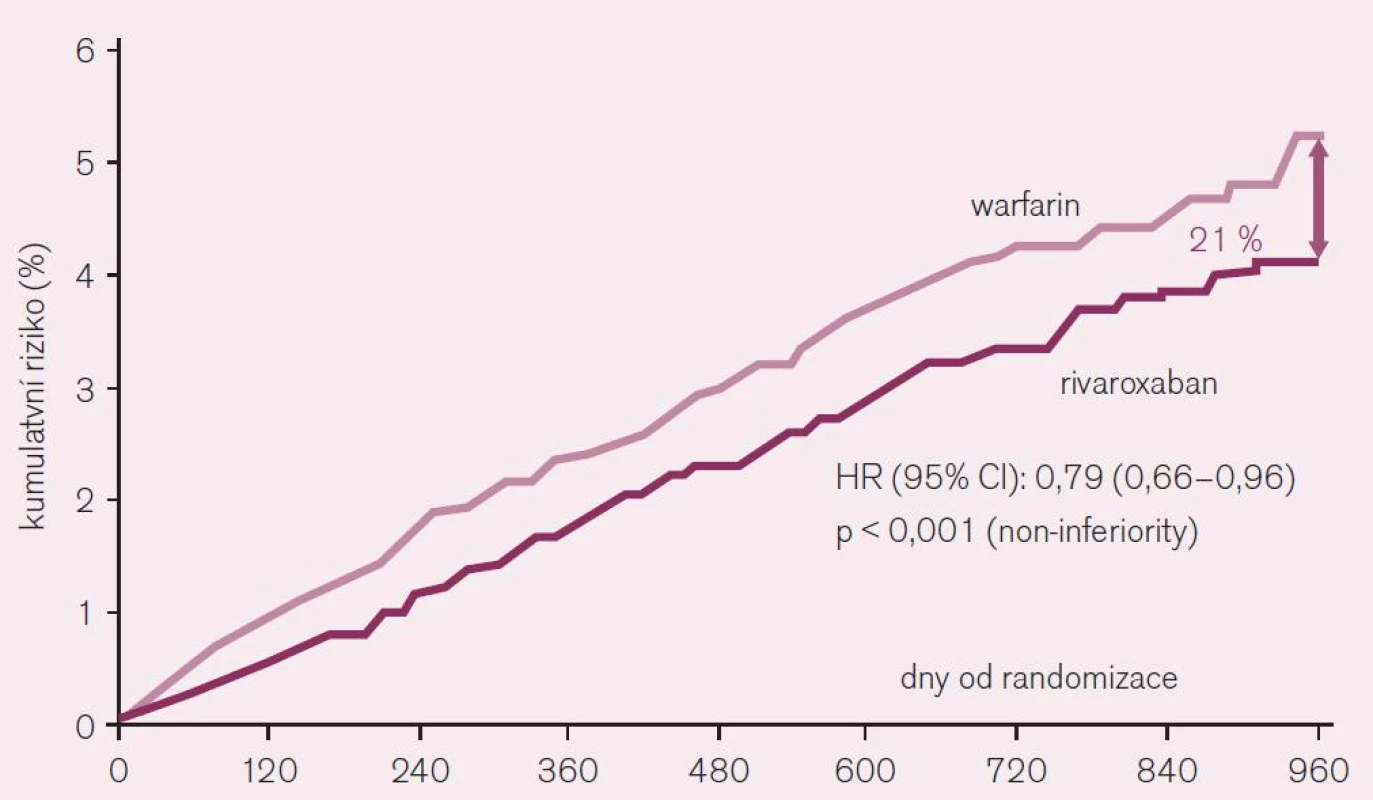
Bezpečnost rivaroxabanu ve srovnání s warfarinem byla srovnatelná či nižší. Konkrétně výskyt klinicky významného krvácení zůstal na stejné úrovni, výskyt obávaného mozkového krvácení byl při léčbě rivaroxabanem o téměř polovinu nižší (RR 0,59; CI 0,37–0,93, p = 0,024 pro superioritu). Možno tedy konstatovat, že ve standardní dávce 20 mg 1krát denně (či u mírné renální insuficience v dávce 15 mg) je rivaroxaban při standardním hodnocení všech nemocných (intention to treat) nejméně stejně účinný jako warfarin a při hodnocení nemocných skutečně léčených podle protokolu studie (on treatment) je rivaroxaban účinnější. Závažné komplikace – konkrétně mozkové krvácení – jsou významně méně časté. Závěry jsou obdobné jako v předchozí studii RE-LY s dabigatranem. Hlavní rozdíl mezi studiemi s perorálně účinnými novými antikoagulancii lze vidět ve významně rizikovější testované populaci ve studii ROCKET AF, nicméně účinek – nižší výskyt embolizačních příhod, resp. nižší výskyt mozkového krvácení a letálních hemoragických příhod je u obou přímých inhibitorů obdobný.
Třetí lék s dokladem o příznivém účinku v indikaci prevence tromboembolizačních iktů při non-valvulární fibrilaci síní je apixaban. Doklad o efektu v dané indikaci byl podán ve studii ARISTOTLE [7]. Také tato studie byla primárně koncipována jako non-inferiorní proti warfarinu. Randomizováno bylo více než 18 tisíc nemocných s fibrilací síní (s alespoň jedním rizikovým faktorem CHADS2) do dvou větví: apixabanové – léčené 2krát denně 5 mg a warfarinové – léčené v dávce podle cílové hodnoty INR 2–3. Primárním ukazatelem byl výskyt mozkové příhody (ischemické, hemoragické či blíže neurčené) nebo systémové embolizace. Po 18 měsících sledování (medián) byl doložen pokles primárního ukazatele účinnosti o 21 % (RR 0,79; CI 0,66–0,95, p = 0,01 pro superioritu) ve prospěch apixabanu (obr. 9). Primární ukazatel bezpečnosti, tj. významné krvácení podle klasifikace ISTH poklesl při léčbě apixabanem rovněž významně o 31 % (RR 0,69; CI 0,60–0,80, p < 0,001). Velmi důležitý ukazatel – výskyt hemoragického iktu poklesl téměř o polovinu (RR 0,51; CI 0,35–0,75, p < 0,001) a celková mortalita klesla v apixabanové větvi o 11 % (RR 0,89; CI 0,80–0,99, p = 0,047) (obr. 9). Výsledky dokumentují nejen významně vyšší účinnost apixabanu v prevenci mozkové příhody a systémové embolizace (pokles o pětinu), ale též v redukci fatálních příhod. Současně se významně zvýšila bezpečnost, tedy výskyt závažného krvácení poklesl asi o třetinu a hemoragických iktů asi o polovinu. Pokles celkové mortality byl doložen u apixabanu jako u jediného přímého inhibitoru, u ostatních byl pozorován pouze trend ke snížení.
Obr. 9. Pokles výskytu iktu a systémové embolie při srovnání apixabanu s warfarinem při analýze „intention to treat“ ve studii ARISTOTLE. 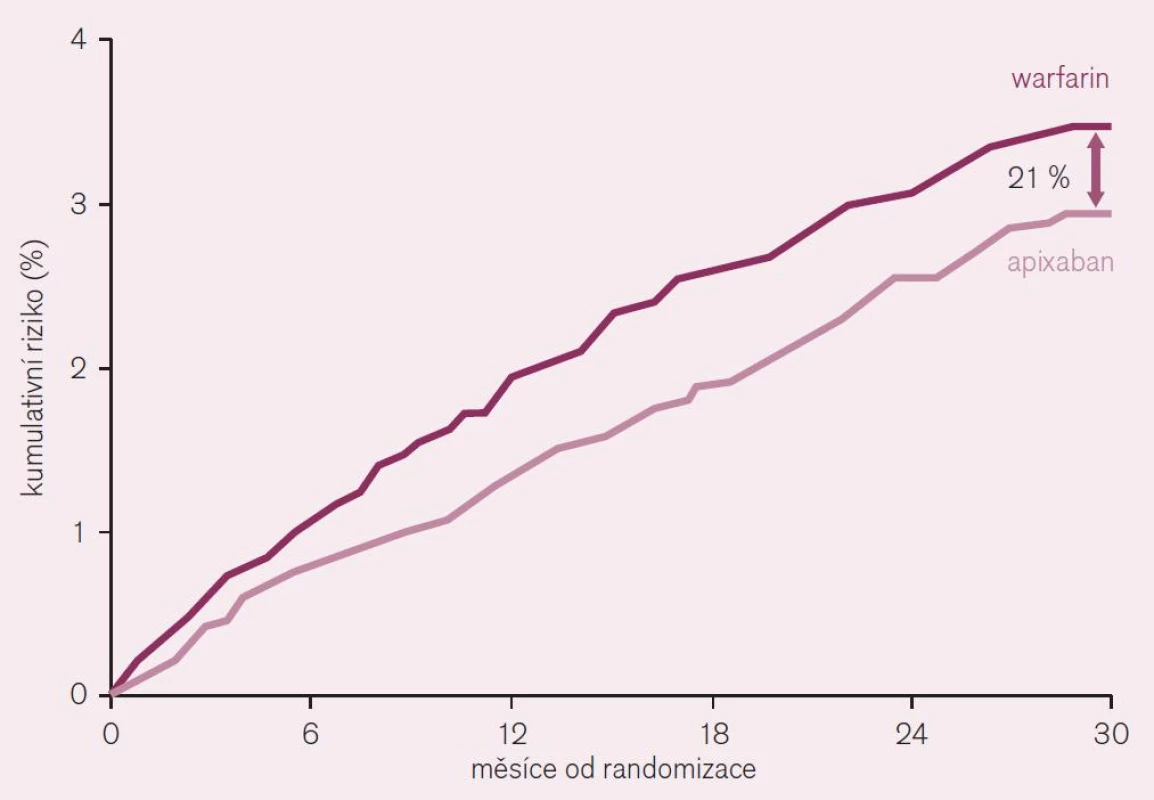
Jak rivaroxaban, tak apixaban jsou schváleny k užití v indikaci profylaxe tromboembolických příhod u nemocných s nevalvulární fibrilací síní s nejméně jedním rizikovým faktorem tromboembolizace. Indikace je stejná jako pro dabigatran. Rovněž úhrada byla stanovena obdobně, jako pro dabigatran (viz výše).
Deriváty heparinu (LMWH a pentasacharidy)
Vzhledem k nutnosti parenterální aplikace jsou k profylaxi mozkové embolizace u nemocných s fibrilací síní nízkomolekulární hepariny a event. fondaparinux indikovány pouze k překlenutí období před nástupem účinku warfarinu a po přerušení léčby warfarinem (např. do operačního zákroku). K dlouhodobé profylaxi nejsou vhodné.
Srovnání jednotlivých léčebných postupů
Při výběru optimálního léčiva zvažujeme farmakologické vlastnosti (tab. 3), stav a komorbidity nemocného, současnou provázející léčbu, ekonomickou náročnost léčby a zejména vlastní účinnost a bezpečnost léčebného postupu.
Srovnání výsledků studií RE-LY s dabigatranem, ROCKET AF s rivaroxabanem a ARISTOTLE s apixabanem, všech hodnocených standardně podle kritéria „intention to treat“ (ITT), tedy u všech nemocných určených na základě randomizace k léčbě, je uvedeno graficky (obr. 10). Pro srovnání efektu tří různých přímých inhibitorů proti standardu (warfarinu) je nutno užít srovnatelnou metodiku, proto efekt rivaroxabanu nehodnocen podle kritéria „on treatment“, tj. pouze u nemocných, kteří byli skutečně léčeni podle protokolu studie, ale dle užívanější metodiky ITT. Z těchto důvodů se výsledná čísla udávající efekt rivaroxabanu liší. Analýza „on treatment“ či „per protocol“ dává zpravidla příznivější výsledky, nehodnotí totiž nemocné, kteří léčbu z různých důvodů přerušili. Dabigatran, jak ukazuje trojice grafů, je v dávce 2krát denně 150 mg nejúčinnější v profylaxi tromboembolických mozkových příhod a systémové embolizace i ve snížení mortality z cévních příčin. Naopak apixaban ve standardní dávce 2krát 5 mg byl nejbezpečnější, proti léčbě warfarinem snížil nejvíce výskyt závažného krvácení.
Obr. 10. Srovnání kritérií účinnosti a bezpečnosti ve studiích RE-LY s dabigatranem, ROCKET AF s rivaroxabanem a ARISTOTLE s apixabanem, všech hodnocených standardně podle kritéria ITT. 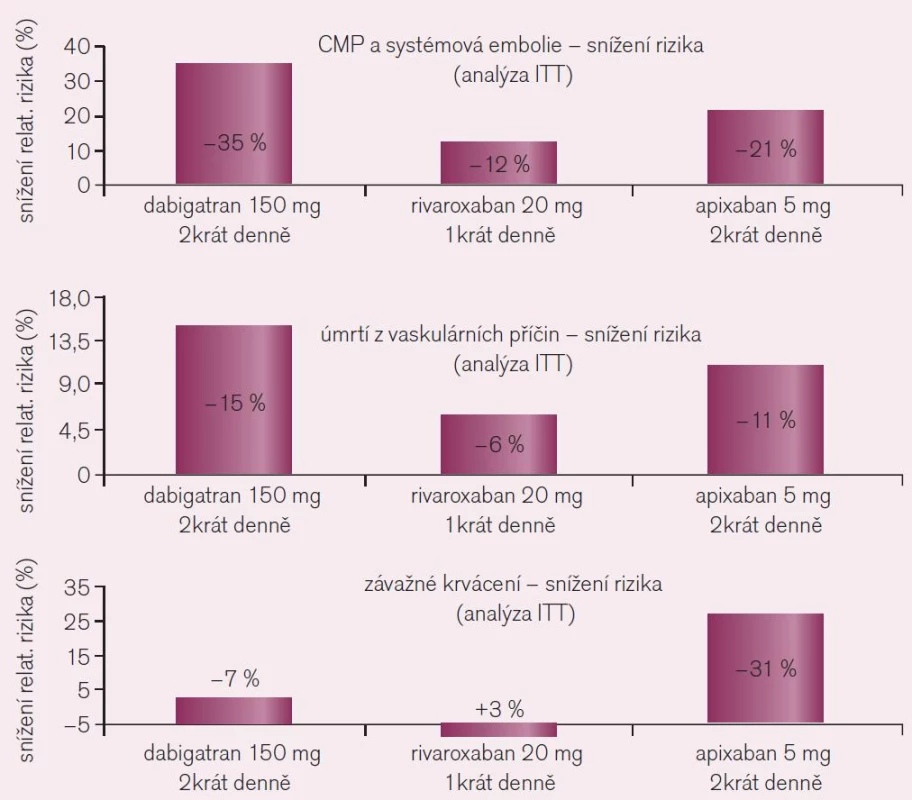
Při rozhodování o výběru konkrétního léčiva – dabigatranu či rivaroxabanu – je nutno konstatovat větší účinnost dabigatranu v dávce 2krát denně 150 mg proti standardní dávce rivaroxabanu. V této dávce dabigatranu je srovnatelná i bezpečnost obou antikoagulancií. Při srovnání s nižší dávkou dabigatranu (2krát 110 mg) je efekt rivaroxabanu mírně vyšší či srovnatelný (podle hlediska hodnocení), naopak stran krvácení je dabigatran v této dávce bezpečnější.
Apixaban (ve standardní dávce 2krát 5 mg) je jen o málo méně účinný než dabigatran ve vyšší dávce v profylaxi tromboembolických příhod či úmrtí z cévních příčin, je však méně zatížen rizikem krvácení. Nutno však zdůraznit, že přímé srovnání jednotlivých nových antikoagulancií nemáme, síťové analýzy jsou jen hrubě orientační. Velké, klinicky podstatné rozdíly mezi jednotlivými představiteli nebudou. Z ostatních kritérií nutno uvést výhodu možnosti podání rivaroxabanu či apixabanu i u nemocných se středně pokročilým renálním selháním (zde jen redukujeme mírně dávku na 15 mg). Stran gastrointestinální tolerance je rivaroxaban i apixaban lépe snášen. Určitou výhodou i nevýhodou rivaroxabanu je aplikace v jedné denní dávce. Výhodná je díky menším nárokům na počet denních tablet, naopak v situaci, kdy nemocný dávku vynechá, je nevýhodou obnovení koagulace, tj. odeznění účinku při subterapeutické hladině léčiva. V porovnání farmakoekonomické výhodnosti máme jedinou studii srovnávající oba přímé inhibitory v podmínkách kanadského zdravotnictví [8]. V modelu dlouhodobého sledování při snížené incidenci intrakraniálního krvácení (0,33 dabigatran vs 0,71 rivaroxaban) a ischemických iktů (3,40 vs 3,96) na každých 100 pacient-roků byla zjištěna větší výhodnost dabigatranu při nižších nákladech na získaný hodnotný rok života (QUALY).
Druhé porovnání je nutno udělat i proti ostatním antikoagulanciím, zejména pak proti dosavadnímu standardu – warfarinu. Nespornou výhodou přímých inhibitorů je perorální aplikace, větší spolehlivost účinku bez nutnosti monitorování, větší účinnost a zpravidla i vyšší bezpečnost. To jsou vlastnosti, které jsou z hlediska nemocného i zdravotníků jednoznačně preferovány. Dosud dostupné perorální antikoagulans warfarin má řadu nevýhod, zejména pomalý nástup účinku, velkou intra - i interindividuální variabilitu efektu, nutnost monitorace léčby, riziko lékových a potravinových interakcí, vyšší riziko krvácení i dalších nežádoucích účinků. Naproti tomu výhodou warfarinu jsou nízké přímé náklady na léčbu. Srovnáme-li však náklady veškeré, tedy stanovení nákladů na získaný hodnotný rok života (QUALY), pak ve vyspělejších zemích dopadl farmakoekonomický pohled ve prospěch rivaroxabanu a dabigatranu. Tedy porovnáme-li nejen přímé náklady, ale započítáme-li i cenu odvrácených iktů a významných krvácivých příhod, zjistíme, že i po finanční stránce jsou přímé inhibitory trombinu (dabigatran) a faktoru Xa (rivaroxaban) výhodné.
Porovnáme-li účinnost nových přímých inhibitorů trombinu s ostatními antitrombotiky, je doložen nejvýraznější efekt této nové skupiny na pokles tromboembolických komplikací, zejména však na snížení výskytu iktů, u nemocných s fibrilací síní (obr. 11).
Obr. 11. Pokles rizika iktu u nemocných s fibrilací síní při různé antitrombotické strategii (převzaté od Chris Granger, Symposium ESC Congress Paris, ESC 2011). 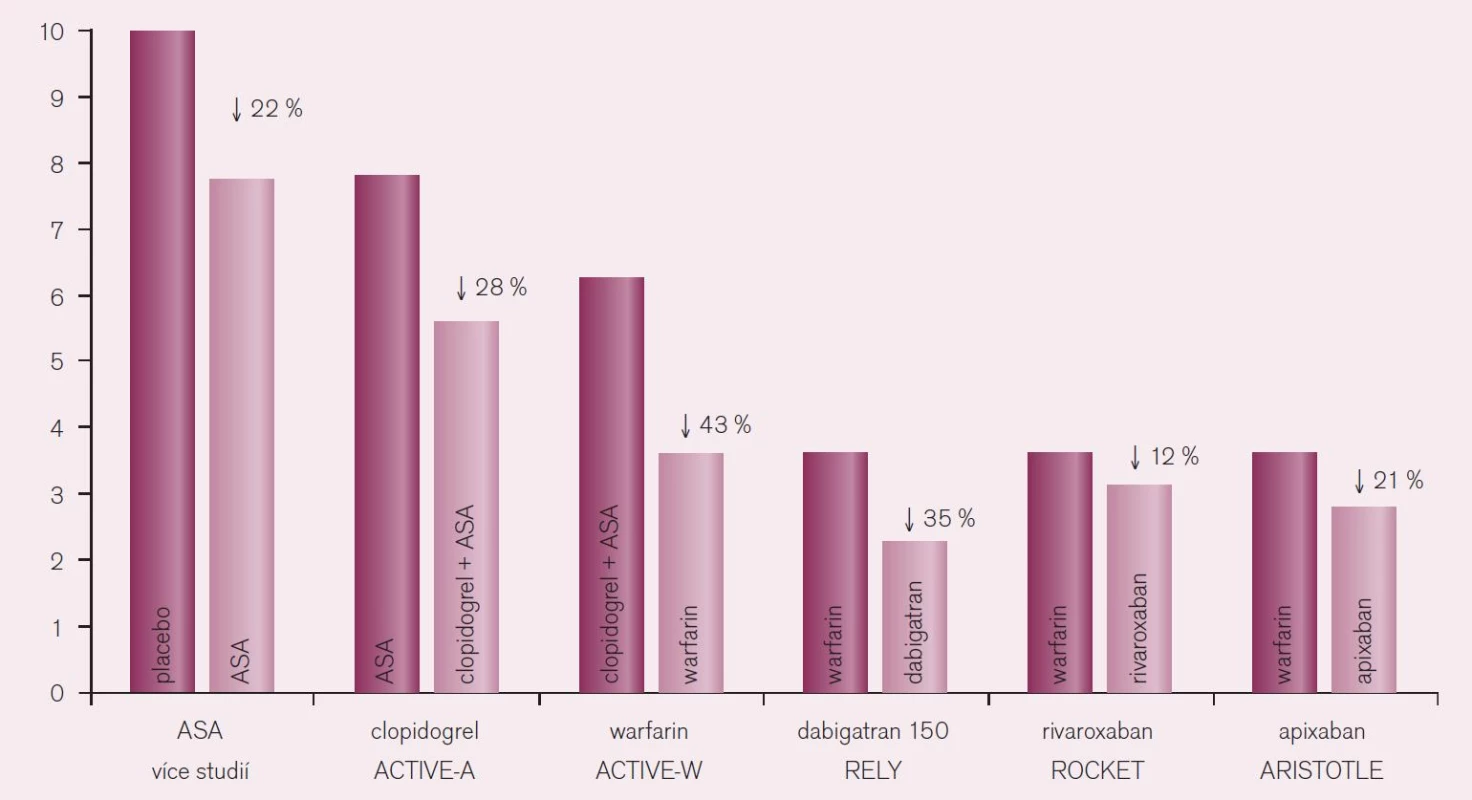
Nová antikoagulancia jsou nejen bezpečnější a účinnější ve srovnání s warfarinem, ale jsou také výrazně účinnější při srovnatelné bezpečnosti proti léčbě kyselinou acetylsalicylovou. Minimálně to platí pro apixaban, kde ve studii AVERROES došlo u nemocných s fibrilací síní k více než polovičnímu výskytu iktu nebo systémové tromboembolizace (RR 0,46; CI 0,33–0,64) ve srovnání s léčbou kyselinou acetylsalicylovou [9]. Per analogiam bude nejspíše platit, že léčba novými antikoagulancii bude rovněž účinnější než duální protidestičková léčba ASA s clopidogrelem. Léčba warfarinem vedla ve studii ACTIVE-W k významně nižšímu výskytu iktu – pokles o 43 % – oproti duální protidestičkové léčbě.
Přínos nových přímých inhibitorů trombinu a faktoru Xa recentně zhodnotily nové doporučené postupy pro profylaxi mozkových příhod u nevalvulární fibrilace síní vydané zainteresovanými odbornými společnostmi v USA jako American Heart Association a American Stroke Association [10] a Evropskou kardiologickou společností [11]. Hlavní zásady a změny proti předchozím doporučením je možno shrnout:
- Warfarin, dabigatran, rivaroxaban a apixaban jsou indikovány k profylaxi a k prevenci recidivy u nemocných s fibrilací síní non-valvulární etiologie.
- Při výběru konkrétního léčiva je nutno přihlédnout k přítomným rizikovým faktorům, snášenlivosti léčby, úspěchu držet účinnou a bezpečnou úroveň antikoagulace (rozmezí INR při léčbě warfarinem), k ekonomickým možnostem, k riziku lékových interakcí, k renálním funkcím a v neposlední řadě též k preferencím nemocného.
- Dabigatran v základní dávce 2krát 150 mg je účinnější alternativou warfarinu v profylaxi tromboembolizačních iktů a systémové embolizace při fibrilaci síní (s přítomností nejméně jednoho rizikového faktoru) při zachovaných renálních funkcích (tj. CrCl > 0,5 ml/sec), ve srovnání s warfarinem je výskyt krvácivých komplikací stejný.
- Dabigatran v redukované dávce 2krát 75 mg je indikován při snížených renálních funkcích v rozmezí CrCl 0,25 až 0,5 ml/sec. Při snížení clearance kreatininu pod 0,25 ml/sec není léčba dabigatranem indikována. U osob se zachovanými renálními funkcemi s fibrilací síní je doložena srovnatelná účinnost (pokles mozkových příhod a systémových tromboembolizačních příhod) a větší bezpečnost (pokles krvácivých komplikací) ve srovnání s warfarinem.
- Rivaroxaban v dávce 20 mg denně je alternativou warfarinu zejména u nemocných s větším rizikem tromboembolické příhody, tj. v profylaxi recidivy mozkové a systémové embolizace nebo s více rizikovými faktory. Při snížených renálních funkcích (CrCl 0,83 až 0,25 ml/sec) je preferována dávka 15 mg rivaroxabanu, ve fázi těžšího renálního selhání rivaroxaban indikován není.
- Apixaban v dávce 2krát 5 mg je u nemocných s fibrilací síní v prevenci tromboembolické příhody účinnější ve srovnání s léčbou kyselinou acetylsalicylovou u nemocných s kontraindikací warfarinu. Při srovnání s warfarinem je v dávce 2krát 5 mg účinnější v profylaxi mozkových příhod a systémových tromboembolizačních příhod, významněji snižuje celkovou mortalitu i výskyt závažného krvácení. V dávce redukované, tj. 2krát 2,5 mg je apixaban indikován u nemocných s vysokým rizikem krvácení (tj. s kumulací alespoň dvou faktorů – věk > 80 let, váha < 60 kg či při renální insuficienci). Při renálním selhání s CrCl < 0,42 ml/sec nelze apixaban užít ani v redukovaných dávkách.
- Dabigatran, rivaroxaban i apixaban (aplikované ve výše uvedeném dávkování) významně snižují výskyt intrakraniálního krvácení ve srovnání s léčbou warfarinem.
Závěr
Lze konstatovat, že pro nemocné s fibrilací síní se před námi otevírají možnosti léčit účinněji a bezpečněji, indikovat a skutečně účinně léčit podstatně větší procento indikovaných nemocných. Nicméně nikdy nesmíme zapomenout na to, že každá účinná léčba přináší svá rizika. U antitrombotik to platí dvojnásob, riziko krvácení je velmi reálné. Nicméně u lege artis vedené léčby přínos významně převažuje nad riziky.
Doručeno do redakce 6. 9. 2012
Přijato po recenzi 25. 9. 2012
prof. MUDr. Jan Bultas, CSc.
doc. MUDr. Debora Karetová, CSc.
Farmakologický ústav 3. LF UK, Praha,
II. interní klinika kardiologie a angiologie 1. LF UK a VFN, Praha
Jan.Bultas@lf3.cuni.cz
Zdroje
1. Patel MR, Mahaffey KW, Garg J et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011; 365 : 1557–1559.
2. ROCKET AF Study Investigators. Rivaroxaban-oncedaily, oral, direct factor Xa inhibition compared with vitamin K antagonism for prevention of stroke and Embolism Trial in Atrial Fibrillation: rationale and design ofthe ROCKET AF study. Am Heart J 2010; 159 : 340–347.
3. Hart RG, Pearce LA, Aguilar MI. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med 2007; 146 : 857–867.
4. Marlu R, Hodaj E, Paris A et al. Effectof non-specific reversal agents on anticoagulant activity of dabigatran and rivaroxaban. A randomised crossover ex vivo study in healthy volunteers. Thromb Haemost 2012; 108 : 217–224.
5. Connolly SJ, Ezekowitz MD, Yusuf S et al. RE-LY Steering Committee and Investigators. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361 : 1139–1151.
6. European Medicines Agency updates patient and prescriber information for Pradaxa. Press release 25/05/2012. http://www.ema.europa.eu/docs/en_GB/document_library/Press_release/2012/05/WC500127771.pdf.
7. Granger CB, Alexander JH, McMurray JJ et al. ARISTOTLE Committees and Investigators. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011; 365 : 981–992.
8. http://www.thepharmacyconnection.com. Dabigatran versus rivaroxaban for the prevention of stroke and system icembolism in atrial fibrillation. http://www.thepharmacyconnection.com/cardiology/2012/08/19/dabigatran-rivaroxaban-prevention-stroke-systemic-embolism-atrial-fibrillation/#lyrPqAwz0LkAwILc.99.
9. Connolly SJ, Eikelboom J, Joyner C et al. AVERROES Steering Committee and Investigators. Apixaban in patients with atrial fibrillation. N Engl J Med 2011; 364 : 806–817.
10. Furie KL, Goldstein LB, Albers GW et al. Oral Antithrombotic Agents for the Prevention of Stroke in Nonvalvular Atrial Fibrillation: A Science Advisory for Health care Professionals From the American Heart Association/American Stroke Association. Stroke 2012 Aug 2. [Epub ahead of print].
11. Camm AJ, Lip GYH, De Caterina R et al. 2012 focused update ofthe ESC Guidelines for the management of atrial fibrillation. Eur Heart J 2012; 33 : 2719–2747. http://www.escardio.org/guidelines-surveys/esc-guidelines/GuidelinesDocuments/Guide-lines_Focused_Update_Atrial_Fib_FT.pdf.
12. Fuster V, Rydén LE, Asinger RW et al. ACC//AHA/ESC guidelines for the management of patients with atrial fibrillation: executive summary. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines and Policy Conferences (Committee to Develop Guidelines for the Management of Patients With Atrial Fibrillation): developed in Collaboration With the North American Society of Pacing and Electrophysiology. J Am Coll Cardiol 2001; 38 : 1231–1266.
13. Chris Granger, Symposium ESC congress Paris, 2011 (von Granger, Duke, ESC 2011).
Štítky
Detská kardiológia Interné lekárstvo Kardiochirurgia Kardiológia
Článok vyšiel v časopiseKardiologická revue – Interní medicína
Najčítanejšie tento týždeň
2013 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Statinová intolerance
- Co dělat při intoleranci statinů?
-
Všetky články tohto čísla
- EDITORIAL
- Nejdůležitější metody v diagnostice akutní cévní mozkové příhody
- Terapie akutní ischemické cévní mozkové příhody
- Arytmie a cévní mozková příhoda
- Primární a sekundární prevence ischemických cévních mozkových příhod
- Antitrombotika v prevenci cévní mozkové příhody. 2. část – Význam antikoagulační léčby
- Kontrola krevního tlaku v primární a sekundární prevenci cévní mozkové příhody
- Levosimendan v kardiochirurgii
- SPAF Academy: Významná role přímého inhibitoru trombinu mezi novými perorálními antikoagulancii
- Galerie autorů
- K 15. VÝROČÍ KARDIOLOGICKÉ REVUE
- Kardiologická revue – Interní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Nejdůležitější metody v diagnostice akutní cévní mozkové příhody
- Terapie akutní ischemické cévní mozkové příhody
- Primární a sekundární prevence ischemických cévních mozkových příhod
- Arytmie a cévní mozková příhoda
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



