-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Invazivní léčba karotických stenóz a možnosti její optimalizace transkraniální dopplerovskou ultrasonografií
Beneficial use of transcranial Doppler ultrasound in invasive treatment of carotid artery disease
Surgical carotid endarterectomy was for a long time considered the standard approach to the treatment of atherosclerotic carotid artery disease. Despite its initial limitations and slow acceptance, carotid artery stenting has evolved into an elaborate method currently considered to be equivalent and in some patients even preferable to carotid endarterectomy. Given the fact that the long‑term outcomes of carotid artery stenting and carotid endarterectomy are comparable, the major risk of both procedures is derived from the periprocedural complications, which are highly operator dependent. Transcranial Doppler ultrasound is a well‑established diagnostic and monitoring tool allowing optimising the care of patients with carotid artery disease. The article summarises the knowledge regarding the invasive treatment of carotid artery disease with a focus on the beneficial use of transcranial Doppler ultrasound.
Keywords:
transcranial Doppler ultrasound – carotid artery stenting – carotid endarterectomy – emboli protection devices
Autoři: M. Špaček; J. Veselka
Působiště autorů: Kardiologická klinika 2. LF UK a FN v Motole, Praha
Vyšlo v časopise: Kardiol Rev Int Med 2014, 16(1): 10-14
Kategorie: Kardiologická revue
Souhrn
Karotická endarterektomie byla dlouho považována za zlatý standard v léčbě a prevenci ischemické cévní mozkové příhody u pacientů s významnou stenózou vnitřních karotických arterií. Karotický stenting, i přes počáteční limitace, dosahuje v současné době výsledků srovnatelných s karotickou endarterektomií a u selektovaných pacientů je považován za rovnocennou volbu. Bezpečnost obou výkonů je dána zejména rizikem periprocedurálních komplikací, které jsou významně ovlivněny zkušenostmi operatéra. Transkraniální dopplerovská ultrasonografie je zavedenou diagnostickou a monitorovací metodou, jejíž využití přispívá ke zkvalitnění péče o pacienty podstupující karotické intervence. Tento článek shrnuje znalosti týkající se invazivní léčby karotických stenóz se zaměřením na možnosti optimalizace pomocí transkraniální dopplerovské ultrasonografie.
Klíčová slova:
transkraniální doppler – karotický stenting – karotická endarterektomie – protektivní systémyÚvod
Ischemická cévní mozková příhoda (iCMP) je druhou nejčastější příčinou úmrtí ve vyspělých zemích a celosvětově nejčastější příčinou invalidity [1]. Odhaduje se, že stenózy extrakraniálních úseků vnitřních karotických arterií se na vzniku iCMP podílí v 15–20 %. Bylo prokázáno, že karotická endarterektomie (CEA) je účinnější v prevenci iCMP než samotná medikamentozní terapie [2–5], a proto se stala metodou volby v léčbě pacientů s významnou stenózou. S rozvojem karotického stentingu (CAS), který v posledních 20 letech zaznamenal výrazný pokrok, je část pacientů léčena endovaskulárně a optimální výběr léčby se stal konsenzuálním rozhodnutím neurologa, cévního chirurga a endovaskulárního specialisty zohledňující anatomické a klinické charakteristiky pacienta. U asymptomatických pacientů je zcela nezbytné uvážit jejich preference a zkušenosti pracoviště. Transkraniální dopplerovská ultrasonografie (TCD) je zavedenou diagnostickou a monitorovací metodou umožňující při výkonu v reálném čase sledovat cerebrovaskulární hemodynamiku a embolizační zátěž, a tak podávat cenné informace o riziku periprocedurálních komplikací. Současně umožňuje optimalizovat přípravu pacienta a případně predikovat riziko peri ‑ a postprocedurálních komplikací, čímž dále zvyšuje bezpečnost procedury.
Historické protiklady invazivní léčby
První zmínky o CEA se datují do počátků 50. let minulého století. Záhy po představení byla CEA přijata chirurgickou veřejností a zavedena do standardní praxe. Každoročně pak narůstal počet operací, a to v takové míře, že se v 80. letech objevily první připomínky kritizující příliš volné indikace vedoucí k neúměrnému riziku komplikací. Až počátkem 90. let potvrdily první velké prospektivní randomizované studie benefit CEA u symptomatických pacientů se stenózou nad 50 % a asymptomatických pacientů se stenózou nad 60 – 70 % [2 – 5].
Naopak přístup k endovaskulární léčbě, jejíž počátky se datují na přelom 70. a 80. let minulého století, byl zdrženlivý a až převzetí techniky implantace stentů z koronárních intervencí vedlo k výraznějšímu rozvoji této metody. CAS však nadále zůstával vyhraněn zejména pro pacienty s vysokým operačním rizikem, k čemuž přispěly publikace inferiorních výsledků srovnávacích studií jako SPACE a EVA ‑ 3S i přesto, že byly opakovaně kritizovány pro metodické chyby a zejména participaci center s minimálními zkušenostmi s endovaskulárními výkony [6,7]. Zásadní pro aplikaci CAS tedy byly dlouho očekávané výsledky studie CREST publikované v roce 2010, které potvrdily srovnatelné riziko komplikací CAS a CEA prováděných ve zkušených centrech s adekvátním tréninkem operatérů. Na základě výsledků studie CREST lze obě metody považovat za rovnocenné za předpokladu správné selekce pacientů [8].
Protektivní systémy
Vzhledem k nutnosti optimalizovat techniku CAS bylo od počátku nezbytné identifikovat děje odehrávající se v jednotlivých fázích výkonu. K tomu se zdálo TCD výhodné, neboť umožňuje v reálném čase hodnotit krevní tok a jeho změny v magistrálních cerebrálních tepnách (do té doby využívané zejména v neurologii a pediatrii (tab. 1)) a současně umožňuje detekovat mikroembolizační signály (MES či HITS – High Intensity Transient Signals) vznikající při periferní embolizaci partikulí aterogenních hmot.
Při TCD vyšetření se používá modifikovaná nízkofrekvenční ultrazvuková sonda přikládaná do míst minimálního oslabení signálu lebečními kostmi – např. transforaminální pozice (skrze foramen magnum) či transtemporální pozice nad zygomatickým obloukem. Při kontinuální monitoraci je sonda pevně fixována obvykle právě nad temporálním oknem s cílem monitorovat průtok ve střední cerebrální arterii (MCA) (obr. 1).
Obr. 1. TCD monitorace CAS u pacienta s fi brilací síní: A) Spektrální (průtoková) křivka s oblastí zvoleného vzorkovacího objemu v hloubce 50 mm odpovídající M1/M2 úseku střední cerebrální arterie (škála x osy v cm/s). Zachyceny 2 HITS. B) Barevně kódované M-mode zobrazení (hloubkový řez (škála x osy v mm)) zachycující dopplerovský signál z ipsilaterální arteria cerebri media (k sondě – červeně) a v kontralaterální arteria cerebri media (od sondy – modře). Nastavená oblast zájmu spektrálního vyšetření (A) je zobrazena tenkou linkou a (+). Bilaterální HITS označeny šipkami. 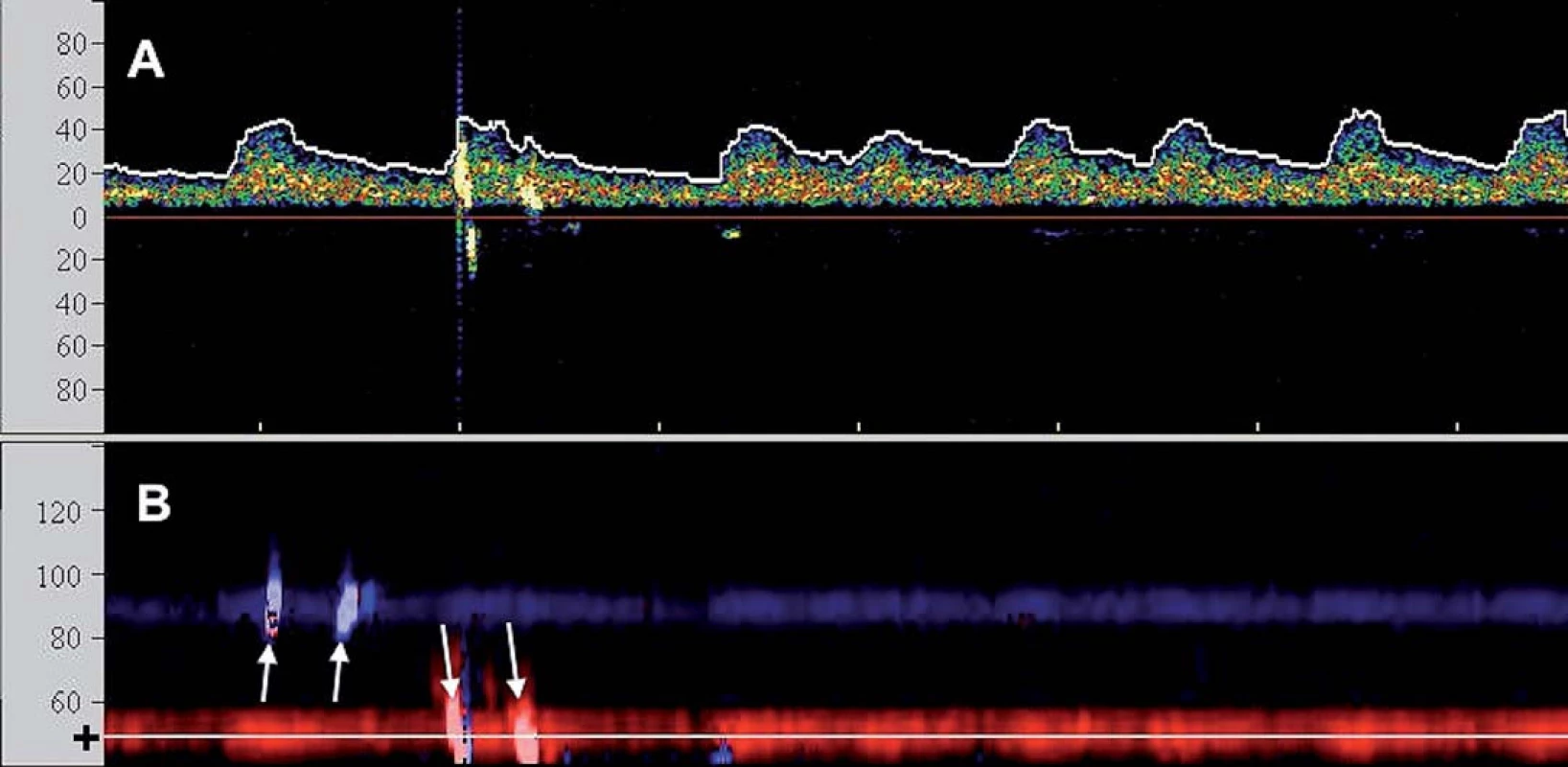
Iniciální srovnávací studie pomocí TCD potvrdily vyšší embolizační zátěž při CAS oproti CEA, zejména ve fázi implantace stentu a postdilatace [9], a přispěly k iniciaci vývoje protektivních systémů (PS). Ty mají za úkol eliminovat výskyt makroembolů (embolizační signál doprovázený poklesem průtoku v monitorované tepně) a minimalizovat množství MES (obr. 2).
Obr. 2. Schematické znázornění typů protektivních systémů. Vodicí drát prochází stenózou vnitřní karotické arterie ve všech panelech. A) Distální okluze. B) Distální fi ltr. C) Proximální okluze (distální balon v arteria carotis externa a proximální balon v arteria carotis communis). 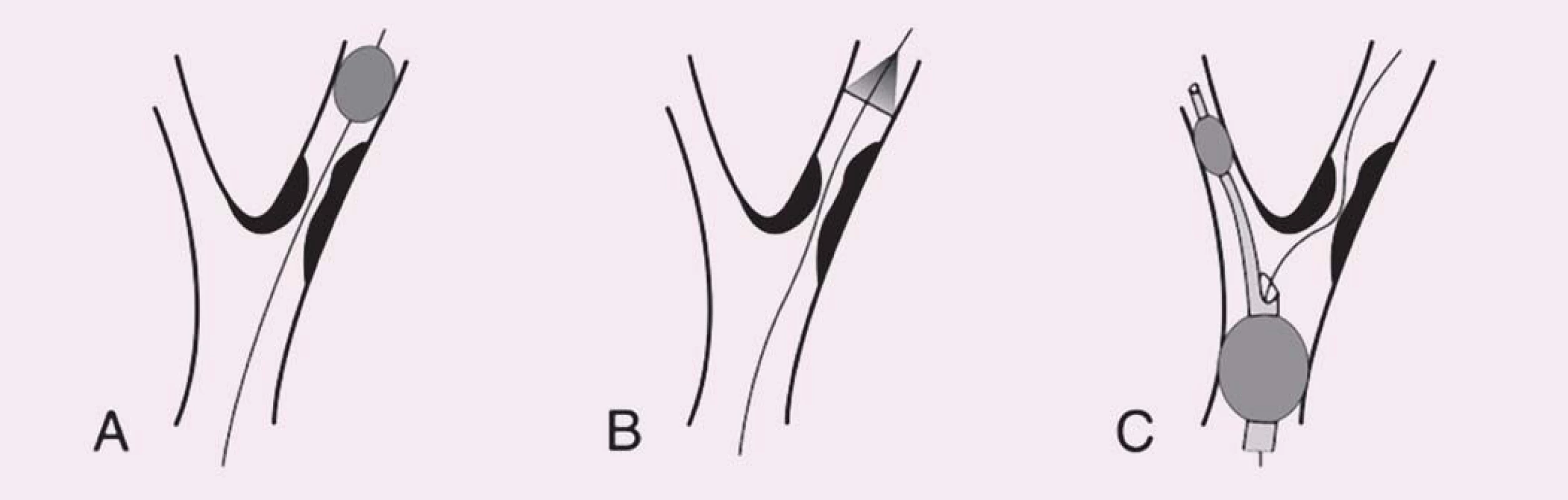
První koncept PS publikovali Theron et al – na principu distální protekce zavedli okluzní balon kraniálně od léze, čímž dosáhli krevní stázy v intervenované arterii umožňující po ošetření odsát nahromaděné aterogenní hmoty [10]. Zdaleka nejrozšířenějšími PS se však staly systémy na principu distálního filtru. Jejich nespornou výhodou je možnost zachování toku, což usnadňuje orientaci při implantaci stentu. Tyto systémy však jsou zatíženy vyšším množstvím mikroembolizací, což je vysvětlováno tak, že zachycený makroembolus se desintegruje na menší partikule pro filtr již průchodné. Z TCD studií je však známo, že nakupené mnohočetné sprchy MES v krátké časové periodě, jako je tomu při implantaci stentu či jeho postdilataci (obr. 3), jsou nezávislým rizikovým faktorem periprocedurální iCMP [11]. Proto je nejvíce nadějí vkládáno do stále více se prosazujících proximálních PS. Tyto systémy fungují na principu podobném clampu při endarterektomii – distální balon obliteruje a. carotis externa a proximální balon obliteruje a. carotis communis, čímž je dosaženo stázy krve v a. carotis interna, avšak bez nutnosti překonávání nechráněné léze. Srovnávací studie u těchto systémů prokázaly v porovnání s filtry výrazný pokles v celkovém množství MES, výskytu ischemických lézí detekovaných magnetickou rezonancí a současně neurologických komplikací [12 – 14] a předpokládá se, že zavedení proximálních PS do rutinní praxe dále povede ke zvýšení bezpečnosti CAS.
Obr. 3. Spektrální křivka znázorňující četné sprchy MES detekované po postdilataci. 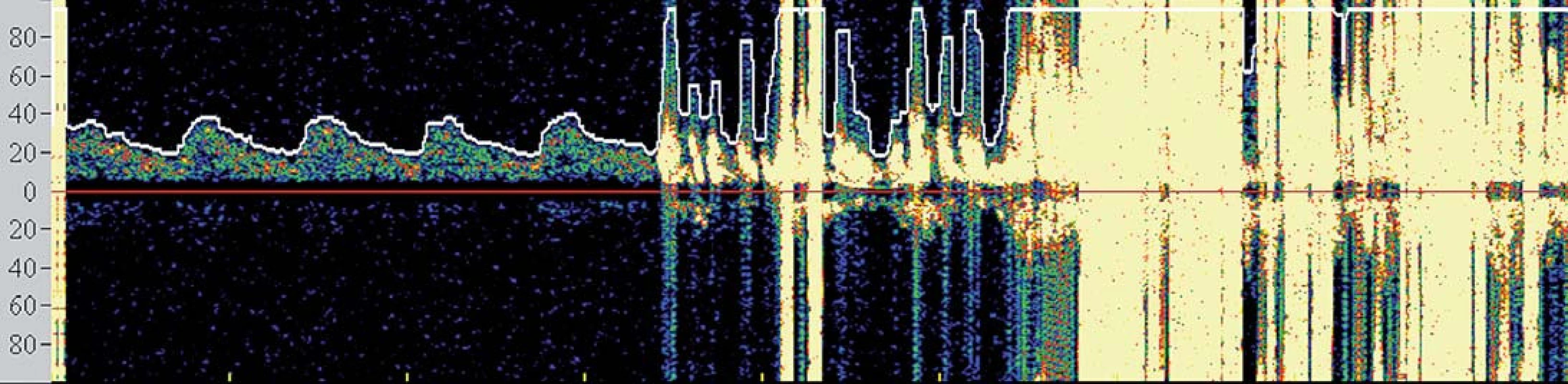
Selekce a příprava pacienta
Jedním z nejdiskutovanějších témat karotických intervencí je racionální selekce asymptomatických pacientů k výkonu. Z původních prací vyplývá, že 17 – 18 asymptomatických pacientů muselo podstoupit CEA na to, aby byl po dobu pětiletého sledování jeden z nich uchráněn iCMP [4,5]. Toto je zohledněno v současných indikacích, které doporučují zvažovat preventivní intervenci v případě průkazu stenózy nad 70 %, a to vždy individuálně s ohledem na dlouhodobý profit vs riziko výkonu a vždy s přihlédnutím k preferencím pacienta [15]. Nadále je tedy nutné pátrat po metodách umožňujících lepší selekci pacientů a TCD nabízí relativně nízkou cenu vyšetření, neinvazivní charakter a absenci radiační zátěže. V tomto směru byly podrobně studovány zejména dva aspekty, a to: 1. tzv. němé embolizace a 2. vyčerpaná cerebrovaskulární rezerva.
Markus et al se ve své prospektivní observační studii zaměřili na detekci němých embolů jakožto nepřímých markerů vulnerability plátu. Po dobu dvou let sledovali celkem 467 pacientů léčených optimální medikamentózní terapií a rozdělených do dvou skupin dle přítomnosti němých embolizací při vstupním TCD vyšetření. Z výsledků jejich studie vyplývá, že pacienti s pozitivní detekcí němých mikroembolizací měli v porovnání s kontrolními pacienty 5,5krát vyšší riziko iCMP [16].
Druhým předpokladem bylo, že oslabená cerebrovaskulární rezerva hraje důležitou roli ve zvýraznění důsledků embolizací [17,18]. Indikátorem cerebrovaskulární rezervy je testování vazomotorické reaktivity (VMR). Vyčerpaná VMR značí, že rezistenční cévy distálně od stenózy jsou maximálně dilatovány, aby udržely dostatečný průtok, a další narušení této rovnováhy vede k více či méně významnému omezení krevního toku. Možnosti, jak testovat VMR, jsou v zásadě dvě, a to buď pomocí technik citlivých na změny perfuze (např. PET, SPECT, CT či MRI), které jsou technicky a finančně velmi náročné, nebo pomocí sledování změn krevního toku magistrálními cévami pomocí TCD, a to za použití vazodilatačních stimulů, jimiž mohou být např. aplikace acetazolamidu (Diamox).
Silvestrini et al vyšetřovali pacienty pomocí TCD testu se zadržením dechu (breath ‑ holding test) využívajícím jako vazodilatační stimulus elevaci CO2 danou volní apnoickou pauzou a prokázali, že snížená VMR je významným prediktorem iCMP. Jako dolní limit normy “breath ‑ holding indexu” stanovili hodnotu 0,69. Pacienti, kteří měli v jejich studii index nižší než 0,69, měli roční riziko iCMP 13,9 %, kdežto pacienti s normální hodnotou měli riziko 4,1 % [19]. Gupta et al následně v rozsáhlé metaanalýze s 991 pacienty potvrdili, že pacienti s vyčerpanou cerebrovaskulární rezervou mají čtyřikrát vyšší riziko iCMP [20].
Dosud však není ani jeden z těchto TCD ukazatelů implementován v indikačních kritériích, což může být změněno s prezentací výsledků studií srovnávajících invazivní metody léčby s optimální medikamentózní terapií u asymptomatických pacientů, které v současné době probíhají na několika centrech v Evropě i USA a které mohou vznést vyšší nároky na selekci pacientů.
Periprocedurální monitorace
Přesto, že pacienti se sníženou cerebrovaskulární rezervou přednostně profitují z intervence, je nutno mít na paměti, že jsou současně vystaveni vyššímu riziku periprocedurálních komplikací [21]. Ačkoli metody založené na principu karotického clampu snižují počet embolizací, pacient může být v průběhu výkonu vystaven klinicky asymptomatické hypoperfuzi, v jejímž terénu dojde snadněji k demaskování i menšího množství embolizací. Navíc, samotná protrahovaná hypoperfuze je známým rizikovým faktorem periprocedurální iCMP [11]. Proto je nutné minimalizovat množství MES uvolněných při ukončení clampu [22] a současně by bylo výhodné predikovat riziko hypoperfuze a tím např. ovlivnit způsob léčby a případně použití PS.
Odhaduje se, že 3 – 7 % pacientů zcela netoleruje clamp [23], velmi obtížné je však pacienty v riziku hypoperfuze předem identifikovat, zejména s ohledem na komplexnost kolaterálního cerebrálního řečiště. Někteří autoři doporučovali provádět tzv. karotický kompresní test [24], který spočíval v monitoraci reziduálního toku v ipsilaterální MCA při kompresi stenotické karotické arterie. Zachovalý tok v MCA při průkazu dobré kolateralizace přední komunikantou prakticky vylučoval intoleranci okluze. Tento test byl však opuštěn pro riziko distálních embolizací při manipulaci se stenotickou karotickou arterií, a tudíž není k dispozici žádný standardní test, který by umožnil spolehlivě predikovat intoleranci okluze.
V současné době se tedy většina center provádejících karotické intervence spoléhá při výkonu na základní klinickou monitoraci neurologických funkcí obvykle v podobě řeči a jednoduchých motorických úkonů. TCD však podává operatérovi komplexní informace o změnách v cerebrovaskulární hemodynamice. Je známo, že dojde‑li k poklesu střední průtokové rychlosti v MCA pod 50 % bazálních hodnot, je pacient ve zvýšeném riziku periprocedurálních komplikací [25] (obr. 4) a při poklesu pod 30 % obvykle dochází k intoleranci okluze. Navíc, zvýrazněná hypoperfuze v době aktivního odsávání aterogenních hmot při CAS může být komplikována motorickým neklidem pacienta znemožňujícím dostatečné odsání, a tím vystavení zvýšenému množství nechráněných MES a riziku iCMP. TCD tedy umožňuje operatérovi modifikovat postup ještě předtím, než dojde k rozvoji klinické symptomatologie.
Obr. 4. Spektrální křivka znázorňující pokles průtoku a ztrátu pulzatility ve střední cerebrální arterii po zavedení clampu. 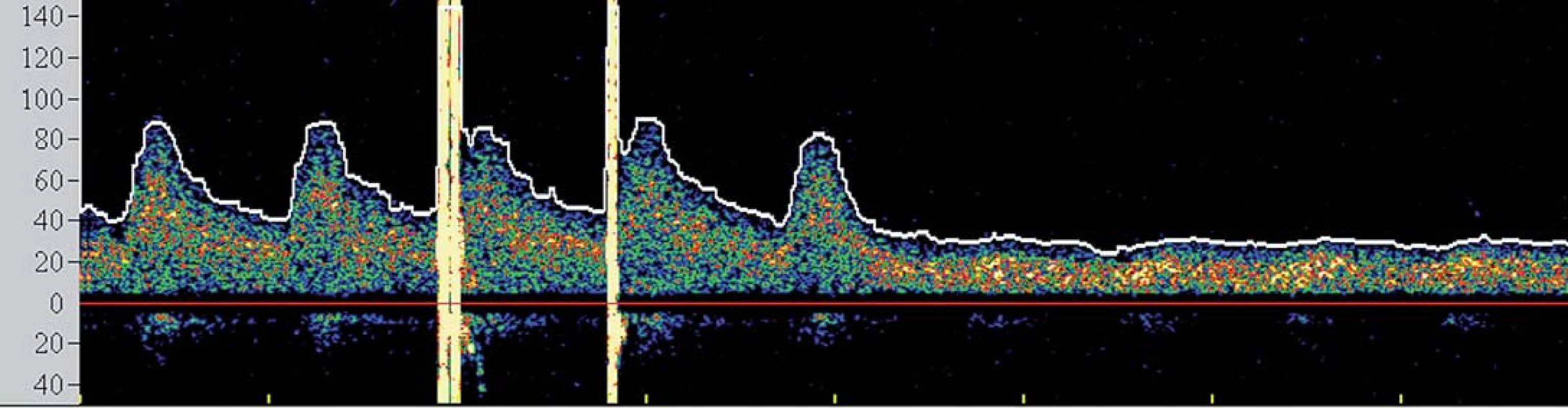
Hyperperfuzní syndrom
I přesto, že je největší pozornost věnována prevenci rozvoje komplikací v průběhu výkonu, jsou zejména pacienti s vyčerpanou cerebrovaskulární rezervou ohroženi i v časné fázi po výkonu, a to rozvojem potenciálně fatálního hyperperfuzního syndromu (HPS). Tento syndrom byl definován jako rozvoj cefaley (obvykle pulzujícího charakteru) s nebo bez přítomnosti nevolnosti, vomitu a fokálního neurologického deficitu a komplikuje 2 – 3 % procedur [26,27]. Za jeho příčinu je považována neschopnost cerebrálního řečiště vyrovnat se s nově zvýšeným průtokem v chronicky dilatovaných rezistenčních arteriích, které pozbyly schopnost autoregulace průtoku. Jelikož HPS může vyústit v závažné (obvykle fatální) nitrolební krvácení, je nutno pacienty ve zvýšeném riziku aktivně vyhledávat. Mezi rizikové faktory HPS patří zejména kritická stenóza karotidy (či string ‑ sign) s vyčerpanou VMR, významná kontralaterální stenóza, hypertenze, pokročilý věk pacienta a recentní ipsilaterální iCMP [28]. TCD umožňuje časně predikovat pacienty v riziku HPS. Dojde‑li po rekanalizaci k navýšení střední průtokové rychlosti v MCA na více než dvojnásobek bazálních hodnot (obr. 5), pacient je ohrožen rozvojem HPS a je nutno jeho klinický stav bedlivě observovat, pravidelně monitorovat změny v nitrolební cirkulaci, aktivně snižovat krevní tlak a uvážit vysazení či odklad antiagregační léčby.
Obr. 5. Spektrální křivky vzestupu průtokových rychlostí po intervenci u pacienta v riziku hyperperfuzního syndromu. 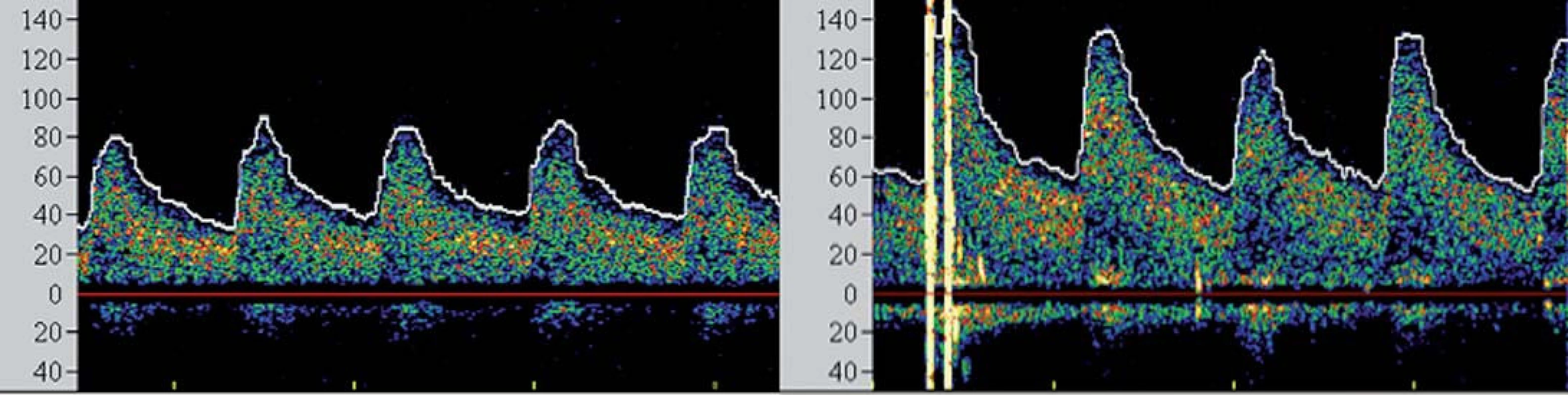
Závěr
Je prokázáno, že odstranění významné stenózy karotických arterií vede u symptomatických pacientů ke snížení rizika recidivy iCMP. U asymptomatických pacientů je dlouhodobý profit preventivního výkonu vždy podmíněn rizikem periprocedurálních komplikací. TCD umožňuje zvýšit bezpečnost karotických intervencí tím, že v průběhu výkonu podává operatérovi cenné informace o rozsahu embolizační zátěže a změnách v cerebrovaskulární hemodynamice. Operatér tak může reagovat na hrozící komplikace ještě před rozvojem klinické symptomatologie. Mimoto může TCD pozitivně ovlivnit selekci asymptomatických pacientů a v neposlední řadě napomáhá ve vyhledávání pacientů v riziku peri ‑ a zejména postprocedurálních komplikací, čímž dále zvyšuje bezpečnost, a tím profit z karotických intervencí.
Podpořeno projekty Ministerstva zdravotnictví: koncepčního rozvoje výzkumné organizace 00064203 (FN MOTOL) a NT13319.
Doručeno do redakce: 6. 1. 2014
Přijato po recenzi: 28. 1. 2014
MU Dr. Miloslav Špaček
www.fnmotol.cz
mildaspacek@gmail.com
Zdroje
1. Donnan GA, Fisher M, Macleod M et al. Stroke. Lancet 2008; 371 : 1612 – 1623. doi: 10.1016/ S0140 – 6736(08)60694 – 7.
2. North American Symptomatic Carotid Artery Trial Collaborators. Beneficial effect of carotid endarterectomy in symptomatic patients with high‑grade carotid stenosis. N Engl J Med 1991; 325 : 445 – 453.
3. European Carotid Surgery Trialists’ Collaborative Group. MRC European Carotid Surgery Trial: interim results for symptomatic patients with severe (70 – 99%) or mild (0 – 29%) carotid stenosis. Lancet 1991; 337 : 1235 – 1243.
4. Executive Committee for the Asymptomatic Carotid Atherosclerosis Study. Endarterectomy for asymptomatic carotid artery stenosis. JAMA 1995; 273 : 1421 – 1428.
5. Halliday AW, Thomas D, Mansfield A. The Asymptomatic Carotid Surgery Trial (ACST). Rationale and design. Steering Committee. Eur J Vasc Surg 1994; 8 : 703 – 710.
6. Ringleb PA, Allenberg J, Brückmann H et al. 30 day results from the SPACE trial of stent ‑ protected angioplasty versus carotid endarterectomy in symptomatic patients: a randomised non‑inferiority trial. Lancet 2006; 368 : 1239 – 1247.
7. Mas JL, Chatellier G, Beyssen B et al. Endarterectomy versus stenting in patients with symptomatic severe carotid stenosis. N Engl J Med 2006; 355 : 1660 – 1671.
8. Brott TG, Hobson RW 2nd, Howard G et al. Stenting versus endarterectomy for treatment of carotid ‑ artery stenosis. N Engl J Med 2010; 363 : 11 – 23. doi: 10.1056/ NEJMoa0912321.
9. Jordan WD Jr, Voellinger DC, Doblar DD et al.Microemboli detected by transcranial Doppler monitoring in patients during carotid angioplasty versus carotid endarterectomy. Cardiovasc Surg 1999; 7 : 33 – 38.
10. Theron JG, Payelle GG, Coskun O et al. Carotid artery stenosis: treatment with protected balloon angioplasty and stent placement. Radiology 1996; 201 : 627 – 637.
11. Ackerstaff RG, Suttorp MJ, van den Berg JC et al. Prediction of early cerebral outcome by transcranial Doppler monitoring in carotid bifurcation angioplasty and stenting. J Vasc Surg 2005; 41 : 618 – 624.
12. Montorsi P, Caputi L, Galli S et al. Microembolization during carotid artery stenting in patients with high‑risk, lipid ‑ rich plaque. A randomized trial of proximal versus distal cerebral protection. J Am Coll Cardiol 2011; 58 : 1656 – 1663.
13. Clair DG, Hopkins LN, Mehta M et al. EMPiRE Clinical Study Investigators. Neuroprotection during carotid artery stenting using the GORE flow reversal system: 30 - day outcomes in the EMPiRE Clinical Study. Catheter Cardiovasc Interv 2011; 77 : 420 – 429.
14. Bijuklic K, Wandler A, Hazizi F et al. The PROFI Study (Prevention of Cerebral Embolization by Proximal Balloon Occlusion Compared to Filter Protection During Carotid Artery Stenting): a prospective randomized trial. J Am Coll Cardiol 2012; 59 : 1383 – 1389.
15. Rothwell PM, Goldstein LB. Carotid endarterectomy for asymptomatic carotid stenosis: asymptomatic carotid surgery trial. Stroke 2004; 35 : 2425 – 2427.
16. Markus HS, King A, Shipley M et al. Asymptomatic embolisation for prediction of stroke in the Asymptomatic Carotid Emboli Study (ACES): a prospective observational study. Lancet Neurol 2010; 9 : 663 – 671. doi: 10.1016/ S1474 – 4422(10)70120 – 4.
17. Yonas H, Smith HA, Duram SR et al. Increased stroke risk predicted by compromised cerebral blood flow reactivity. J Neurosurg 1993; 79 : 483 – 489.
18. Caplan LR, Hennerici M. Impaired clearance of emboli (washout) is an important link between hypoperfusion, embolism, and ischemic stroke. Arch Neurol 1998; 55 : 1475 – 1482.
19. Silvestrini M, Vernieri F, Pasqualetti P et al. Impaired cerebral vasoreactivity and risk of stroke in patients with asymptomatic carotid artery stenosis. JAMA 2000; 283 : 2122 – 2127.
20. Gupta A, Chazen JL, Hartman M et al. Cerebrovascular reserve and stroke risk in patients with carotid stenosis or occlusion: a systematic review and meta‑analysis. Stroke 2012; 43 : 2884 – 2891.
21. Sfyroeras G, Karkos CD, Liasidis C et al. The impact of carotid stenting on the hemodynamic parameters and cerebrovascular reactivity of the ipsilateral middle cerebral artery. J Vasc Surg 2006; 44 : 1016 – 1022.
22. Spacek M, Veselka J. Microembolization following balloon deflation during proximally protected carotid artery stenting – a potential focus of procedure improvement? Catheter Cardiovasc Interv 2013 Apr 24. doi: 10.1002/ ccd.24969.
23. Cremonesi A, Rigattieri S, Liso A et al. Proximal protection in carotid artery stenting: rationale and recent findings. EuroIntervention 2007; 3 : 269 – 274.
24. Visser GH, Wieneke GH, van Huffelen AC et al. The use of preoperative transcranial Doppler variables to predict which patients do not need a shunt during carotid endarterectomy. Eur J Vasc Endovasc Surg 2000; 19 : 226 – 232.
25. Garami Z, Lumsden AB. Intra ‑ Operative TCD Monitoring, in Cerebrovascular Ultrasound in Stroke Prevention and Treatment, Second Edition (ed A. V. Alexandrov), Wiley ‑ Blackwell, Oxford, UK. doi: 10.1002/ 9781444327373.ch13.
26. Meyers PM, Higashida RT, Phatouros CC et al. Cerebral hyperperfusion syndrome after percutaneous transluminal stenting of the craniocervical arteries. Neurosurgery 2000; 47 : 335 – 343.
27. Ouriel K, Shortell CK, Illig KA et al. Intracerebral hemorrhage after carotid endarterectomy: incidence, contribution to neurologic morbidity, and predictive factors. J Vasc Surg 1999; 29 : 82 – 87.
28. Jansen C, Sprengers AM, Moll FL et al. Prediction of intracerebral haemorrhage after carotid endarterectomy by clinical criteria and intraoperative transcranial Doppler monitoring: results of 233 operations. Eur J Vasc Surg 1994; 8 : 220 – 225.
Štítky
Detská kardiológia Interné lekárstvo Kardiochirurgia Kardiológia
Článok vyšiel v časopiseKardiologická revue – Interní medicína
Najčítanejšie tento týždeň
2014 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Statinová intolerance
- Co dělat při intoleranci statinů?
-
Všetky články tohto čísla
- Invazivní léčba karotických stenóz a možnosti její optimalizace transkraniální dopplerovskou ultrasonografií
- Trvalá kardiostimulace z pohledu nových evropských doporučení roku 2013
- Kardiohepatální syndrom u chronického srdečního selhání
- Prognostický význam elevace funkčních jaterních testů u akutních koronárních syndromů s manifestním srdečním selháním
- Vývoj renálních parametrů u pacientů s pokročilým srdečním selháním léčených levosimendanem – retrospektivní analýza
- Hluboká žilní trombóza a plicní embolie při užívání hormonální antikoncepce
- Argumenty pro konzervativní léčbu chronické formy ischemické choroby srdeční přibývají
- Komplexní ošetřovatelská dokumentace při krátkodobé hospitalizaci pacientů indikovaných k trvalé kardiostimulaci
- XXVII. ročník „Šamánkových“ Poděbrad
- XVII. Kardiovaskulární dny v Lázních Teplice nad Bečvou
- Interní medicína
- Chronické onemocnění ledvin – novinky v klasifikaci a terapii
- Farmakoterapie při chronickém onemocnění ledvin
- Akutní poškození ledvin
- Rychle progredující glomerulonefritidy (srpkovité glomerulonefritidy)
- Vybrané choroby ledvin v těhotenství
- Infekce dolních a horních močových cest
- Editorial 2014
- Hluboká žilní trombóza a plicní embolie při užívání hormonální antikoncepce. Kardiol Rev Int Med 2014; 16(1): 36–38
- Kardiologická revue – Interní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Akutní poškození ledvin
- Vybrané choroby ledvin v těhotenství
- Rychle progredující glomerulonefritidy (srpkovité glomerulonefritidy)
- Farmakoterapie při chronickém onemocnění ledvin
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




