-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Chronická pankreatitida
Chronic pancreatitis
Chronic pancreatitis is a progressive inflammatory disease characterized by the replacement of the pancreatic gland by fibrous tissue, resulting in an impairment of exocrine and endocrine function. Under the local conditions, the disease can usually be attributed to chronic alcohol abuse in combination with genetic, metabolic and environmental factors. Pancreatic stellate cells play a key role in the complex pathogenesis of the disease by producing fibrous tissue in response to various stimuli. The main symptoms include pain, maldigestion and diabetes. The management of patients with chronic pancreatitis requires an accurate diagnosis, recognition of aetiology, evaluation of symptoms and complications and adequate therapy often utilizing a multidisciplinary team. The goals of treatment are pain control, replacement of the lost digestive function with pancreatic enzymes, insulin therapy in diabetes patients and treatment of complications (for example bile duct stricture, pseudocyst). In the treatment of pain, non‑narcotic analgesics, opioids or their combinations with antipsychotics are used; in the treatment of pancreatic exocrine insufficiency preparations of pancreatin are administered. Patients who do not respond to medical therapy are candidates for interventional treatment. Endoscopic therapy is less effective than surgical therapy; however it often remains the method of choice for its safety and for preserving the possibility of a later surgical procedure. Endoscopy can be used with the help of extracorporeal lithotripsy to treat pancreatic duct stones, but more often it is used to treat pancreatic and bile duct strictures or to treat pseudocysts. Symptomatic pseudocysts are routinely drained transluminally under endosonography guidance. Surgical therapy, either in the form of drainage or resection, is very effective, but has a significant risk of complications.
Keywords:
chronic pancreatitis – alcohol – smoking – pain – pancreatic exocrine insufficiency
Autoři: T. Hucl; P. Mačinga
Působiště autorů: Klinika hepatogastroenterologie, Institut klinické a experimentální medicíny, Praha
Vyšlo v časopise: Kardiol Rev Int Med 2014, 16(3): 244-251
Kategorie: Interní medicína
Souhrn
Chronická pankreatitida je progresivní zánětlivé onemocnění, při kterém dochází k náhradě pankreatické tkáně vazivem. Důsledkem je poškození exokrinní a endokrinní funkce žlázy. Onemocnění vzniká v našich podmínkách nejčastěji jako důsledek nadměrné konzumace alkoholu v kombinaci s faktory genetickými, metabolickými a faktory vnějšího prostředí. V komplexní patogenezi hrají centrální roli stelární buňky, které v reakci na různorodé podněty tvoří vazivo. Hlavními symptomy chronické pankreatitidy jsou bolest, maldigesce a diabetes. Péče o pacienty s chronickou pankreatitidou spočívá v přesné diagnostice, určení příčiny, zhodnocení symptomů a komplikací a jejich adekvátní léčbě často za účasti multidisciplinárního týmu. Cílem léčby je kontrola bolesti, náhrada ztracené trávicí funkce pankreatickými enzymy, substituce inzulinu u pankreatogenního diabetu a léčba komplikací (např. stenózy žlučovodů, pseudocysty). V léčbě bolesti užíváme běžná analgetika, opiáty či jejich kombinaci s psychofarmaky, v léčbě pankreatické exokrinní nedostatečnosti preparáty pankreatinu. Pacienti s nedostatečnou odpovědí na medikamentózní léčbu jsou zvažování k léčbě intervenční. Endoskopická léčba je o něco méně efektivní než léčba chirurgická, zůstává však často metodou první volby pro svou bezpečnost a zachování možnosti následné chirurgické intervence. Endoskopickou léčbu lze využít s pomocí extrakorporální litotripse k léčbě wirsungolitiázy, častěji je však indikována k léčbě stenóz hlavního pankreatického vývodu, stenóz distálního choledochu či k léčbě pseudocyst. Symptomatické pseudocysty jsou rutinně drenované transmulinálně pod endosonografickou kontrolou. Chirurgická léčba, drenážní či resekční, je vysoce efektivní, avšak provázena nezanedbatelným rizikem komplikací.
Klíčová slova:
chronická pankreatitida – alkohol – kouření – bolest – pankreatická exokrinní insifuciencieÚvod
Chronická pankreatitida (CHP) je onemocnění charakterizované progresivním a ireverzibilním poškozením funkční žlázy s následnou alterací endokrinní a exokrinní funkce. Histopatologicky je charakterizována fibrózou, acinární atrofií, chronickým zánětem a přestavbou pankreatických vývodů. Mohou být přítomny kalcifikace či lymfoplazmocytární infiltrace.
Incidence CHP je geograficky rozdílná a spíše narůstá. Ve vyspělých zemích se incidence nemoci pohybuje od 5,4 do 8,6 na 100 000 obyvatel/ rok [1,2], v České republice dosáhla v oblasti jižní a střední části Moravy hodnoty 7,9 na 100 000 obyvatel/ rok [3].
Z klinického hlediska charakterizují CHP bolest, maldigesce a diabetes. Charakteristická bolest v nadbřišku s iradiací do zad je obvyklým symptomem. Porucha trávení se v pokročilém stadiu projevuje steatoreou a úbytkem tělesné hmotnosti. Maldigesce tuků se steatoreou předchází kachektizaci, jelikož sekrece lipázy se snižuje rychleji než sekrece proteázy či amylázy. Pankreatogenní diabetes je pozdním příznakem onemocnění a vzniká důsledkem destrukce buněk pankreatických ostrůvků. Kauzální terapie CHP kromě její vzácné autoimunitní formy neexistuje, mezi základní pilíře léčby patří symptomatická léčba bolesti, náhrada ztracené trávicí funkce pankreatickými enzymy a substituce inzulinu u pankreatogenního diabetu. V některých případech je nezbytná endoskopická či chirurgická intervence [4].
Exokrinní pankreas
Slinivka břišní je žláza s exokrinní a endokrinní funkcí a má zásadní úlohu v asimilaci a utilizaci energetických zdrojů organizmu. Exokrinní pankreas je tvořen acinárními buňkami a buňkami pankreatických vývodů. V acinárních buňkách dochází k syntéze inaktivních digestivních enzymů (zymogenů), úlohou tubulárních buněk je sekrece vody a zásaditých hydrogenuhličitanů. Enzymy jsou za fyziologických podmínek vyplaveny v alkalické pankreatické šťávě do střeva, kde jsou pak aktivovány. Hlavní roli v procesu aktivace sehrává trypsin, který moderuje konverzi samotného trypsinogenu na jeho aktivní formu a iniciuje aktivační kaskádu ostatních digestivních proenzymů.
Předčasná intrapankreatická aktivace zymogenů (zejména trypsinogenu) vede k poškození buněk a následné indukci zánětlivé odpovědi, kterou klinicky rozeznáváme jako akutní pankreatitidu [5]. Z tohoto důvodu jsou součástí exokrinního pankreatu četné protektivní mechanizmy, které aktivitu pankreatických enzymů kontrolují. Ochrannou funkci má autolýza trypsinu, při které trypsin a CTRC (chymotrypsinogen C – proteolytický zymogen aktivovaný trypsinem) štěpí trypsinogen a trypsin a tím jej inaktivují [6,7]. Dalšími obrannými mechanizmy jsou SPINK1 (serine protease inhibitor, Kazal type 1), které mají schopnost inhibovat trypsin a dále přítomnost CFTR (cystic fibrosis transmembrane conductance regulator) proteinu, jehož funkce na apikální membráně tubulárních buněk umožňuje uvolnění sekretu bohatého na bikarbonáty, který pak odplaví intraluminální obsah tubulů do duodena [4].
Etiopatogeneze chronické pankreatitidy
Chronická pankreatitida je onemocnění různorodé etiologie. Jednotlivé etiologie faktory, které shrnuje nejčastěji používaný klasifikační systém – tzv. TIGARO klasifikace [8] (tab. 1) – přispívají ke vzniku pankreatitidy různými mechanizmy. Vedle přímého toxického působení alkoholu či tabáku se uplatňují mechanizmy jako rekurentní nekróza vyvolávající fibrózu, obstrukce vývodů či oxidativní stres. Společným efektorem všech mechanizmů jsou pankreatické stelární (hvězdicovité) buňky, které jsou lokalizovány v interlobulární a interacinární části lidského pankreatu. Ve svém aktivovaném stadiu, do kterého se dostávají po stimulaci přímým působením některých nox (alkohol a jeho metabolity, tabák) a jimi indukovaného oxidačního stresu nebo prostřednictvím prozánětlivých cytokinů jako např. TGF beta, TNF alfa či PDGF produkují proteiny extracelulární matrix [4].
Tab. 1. TIGARO klasifikace chronické pankreatitidy. 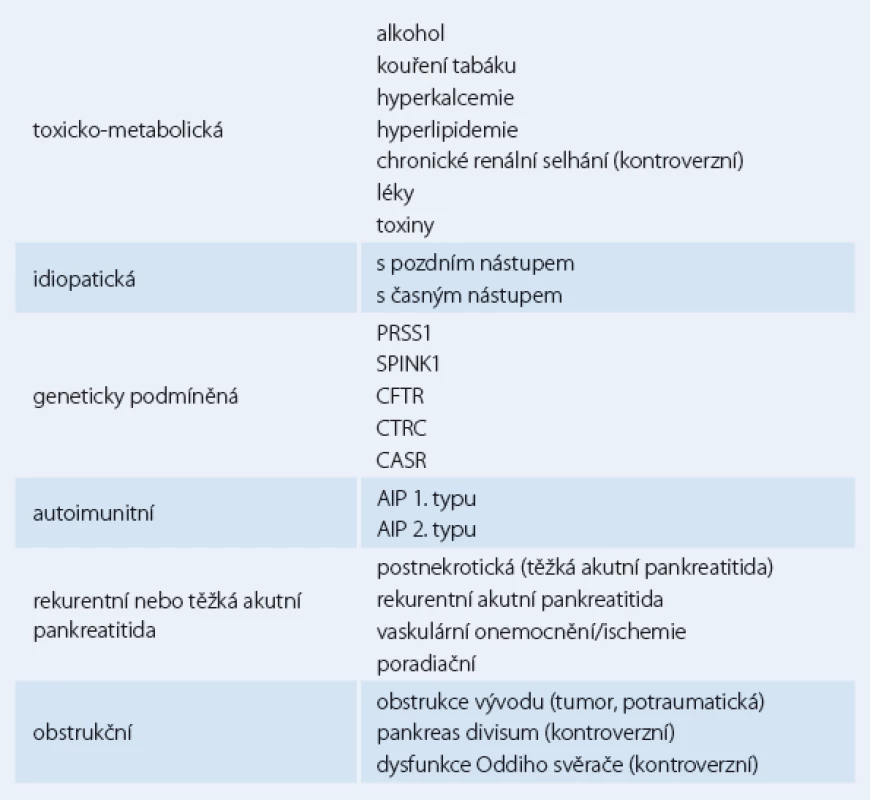
Alkoholická chronická pankreatitida
Alkohol a jeho metabolity acetaldehyd a etylestery mastných kyselin mají přímý toxický vliv na acinární a duktální buňky [9], vedou k tvorbě kyslíkových radikálů a aktivují stelární buňky. V západním světě se zastoupení alkoholické etiologie CHP odhaduje na 70 % [3]. Riziko rozvoje CHP následkem chronické konzumace alkoholu je v porovnání s ostatními chorobami indukovanými alkoholem relativně nízké a je závislé na dávce. Ke vzniku onemocnění je nejspíše nutné dosažení prahové dávky, která se odhaduje asi na 4 – 5 drinků denně (jeden drink obsahuje přibližně 12 g čistého alkoholu). Platí ale, že akutní či chronickou pankreatitidu vyvine 10 – 20 % či dokonce méně konzumentů významného množství alkoholu [10 – 13]. Vedle příjmu prahové dávky alkoholu je ke vzniku pankreatitidy nutná i interakce s dalšími genetickými či zevními faktory [14]. Tuto teorii podporuje například zjištění signifikantně vyšší prevalence SPINK1 mutací u pacientů s alkoholickou CHP v porovnání s nemocnými s idiopatickou CHP, zdravými kontrolami či nemocnými s alkoholickou jaterní cirhózou [15].
V posledních několika letech se dostává do popředí studium vlivu nikotinizmu na rozvoj CHP. Kouření ovlivňuje sekreci bikarbonátů do pankreatické šťávy [16], snižuje pankreatickou sekreci [17], indukuje oxidativní stres, snižuje inhibiční kapacitu trypsinu [4] a zvyšuje riziko vzniku kalcifikací [18]. Několik recentně publikovaných case ‑ control a populačních studií prokázalo, že kouření je nezávislým rizikovým faktorem rozvoje jak akutní, tak chronické pankreatitidy. Americká a evropské studie shodně prokázaly signifikantně vyšší prevalenci CHP u kuřáků s relativním rizikem mezi 1,34 a 4,45 [19,20].
Idiopatická chronická pankreatitida
Do této skupiny se řadí pacienti, u kterých není přítomen žádný jasný rizikových faktor CHP. Jejich zastoupení je odhadováno na 10 – 30 % [21]. Z klinického hlediska rozlišujeme idiopatickou CHP s časným a pozdním nástupem. Mladí pacienti mají zejména výrazný algický syndrom, starší pacienti naopak často známky pankreatické insuficience [4].
Geneticky podmíněná pankreatitida
Geneticky podmíněná pankreatitida může být sporadická, kdy je pacient bez pozitivní rodinné anamnézy nosičem mutace jednoho či více pankreatických genů, familiární, kdy má navíc pozitivní rodinnou anamnézu, či hereditární, kdy je postiženo tři a více členů rodiny minimálně dvou generací. Hereditární pankreatitida je typicky podmíněná mutací v genu pro kationický trypsinogen PRSS1 [22]. PRSS1 mutace usnadňují autoaktivaci trypsinogenu, následná intrapankreatická aktivace zymogenů vede k poškození parenchymu, indukci zánětlivé odpovědi a fibrogenezi. Přestože se jedná o velmi vzácnou chorobu, je nutno zmínit mnohonásobně vyšší (≈ 50×) celoživotní riziko karcinomu slinivky u nosičů mutací PRSS1 v porovnání se zdravými jedinci, zatímco všeobecné riziko pacientů s chronickou pankreatitidou je „pouze“ dvacetinásobné [23,24].
SPINK1, rovněž známý jako pancreatic secretory trypsin inhibitor (PSTI), je považován za důležitý negativní regulátor předčasné aktivace trypsinu. Nejčastější mutací SPINK1 je N34S, která je detekována zejména u pacientů s chronickou pankreatitidou bez pozitivní rodinné anamnézy. Patnáct až čtyřicet procent pacientů s idiopatickou CHP nesou N34S na jedné nebo obou alelách. Překvapivě je ale v populaci N34S haplotyp relativně častý (1 – 3 %), a to při nízké prevalenci CHP (42/ 100 000) [25]. Zdá se tedy, že heterozygotní mutace spíše modifikuje průběh CHP, nežli přímo zvyšuje susceptibilitu vůči onemocnění [26].
Cystická fibróza je způsobená ztrátovou mutací v genu CFTR (cystic fibrosis transmembrane conductance regulator). Je charakterizována klasickou trias – chronickým obstrukčním plicním onemocněním, exokrinní pankreatickou insuficiencí a elevací koncentrace natria a chloridů v potu. V roce 1998 byly simultánně publikovány dvě studie [27,28], které popsaly vyšší frekvenci mutací CFTR u pacientů s alkoholickou či idiopatickou chronickou pankreatitidou. Otázkou je, jestli tito pacienti trpí mírnou, atypickou cystickou fibrózou anebo mají pankreas specifické CFTR ‑ asociováno onemocnění [29]. V každém případě je zřejmé, že adekvátní funkce CFTR je nutná pro správnou funkci pankreatických duktálních buněk, a tudíž jsou mutace CFTR asociovány s vyšší susceptibilitou vůči chronické pankreatitidě.
Mutace CASR (calcium ‑ sensing receptor) i CTRC (chymotrypsin C, caldecrin) jsou asociovány s chronickou pankreatitidou [30], avšak téměř vždy se vyskytují spolu s heterozygotními variantami PRSS1, CFTR anebo SPINK1 [31]. Zdá se tedy, že mutace CASR a CTRC nejsou samy o sobě dostatečné k indukci onemocnění, ale spolu s jinými rizikovými faktory zvyšují susceptibilitu vůči CHP. Chymotrypsin C je člen rodiny S1 peptidáz, jenž se podílí na degradaci kationického trypsinogenu, a tím působí protektivně vůči CHP [6]. Patogenetické CTRC varianty způsobují ztrátu funkce chymotrypsinogenu C prostřednictvím alterace jeho sekrece, aktivity a proteolytické stability [32].
Při úvaze o genetickém testování pacientů s CHP je nutné si uvědomit, že kromě mutací v PRSS1 genu, které způsobují hereditární pankreatitidu, jsou mutace v ostatních genech pouze rizikovým faktorem vzniku pankreatitidy. Celosvětově platná doporučení ke genetickému testování pacientů s CHP neexistují. Evropská doporučení navrhují provedení genetické analýzy PRSS1, SPINK1 a CTRC u všech pacientů léčených pro akutní nebo chronickou pankreatitidu s pozitivní rodinnou anamnézou chronické pankreatitidy či nádoru pankreatu nebo u všech pacientů s chronickou pankreatitidou bez rodinné anamnézy po vyloučení ostatních predisponujících faktorů. Kromě pacientů s hereditární pankreatitidou však výsledek testování klinickou péči neovlivní [4].
Autoimunitní pankreatitida
Autoimunitní pankreatitida (AIP) je vzácná klinická jednotka (2 – 4 % všech CHP) definována specifickým klinickým, laboratorním i histologickým nálezem. Rozlišujeme AIP 1. typu s vysokou prevalencí v Japonsku a Asii asociovanou s IgG4 systémovou sklerozující chorobou a AIP 2. typu asociovanou s idiopatickými střevními záněty a s vyšším výskytem v západní populaci. Důležitým rysem AIP je významná odpověď na imunosupresivní léčbu s možností úplné regrese onemocnění a zhojením ad integrum. Výrazné rozdíly v rasové a geografické distribuci AIP naznačují, že v patogenezi nemoci hrají důležitou roli genetické a enviromentální faktory, které jsou však doposud neznámé [4].
Obstrukční pankreatitida
Příčinou obstrukční pankreatitidy je omezení odtoku pankreatické šťávy zúženým či obturovaným pankreatickým vývodem. Příčinou stenózy lumen může být například intraduktální konkrement nebo extraduktální útlak pankreatickou malignitou. Mezi další příčiny patří intraparenchymatická jizva po akutní pankreatitidě či stenóza Vaterovy papily.
Klinický obraz
Hlavními symptomy CHP jsou bolest, maldigesce a diabetes. Charakteristická bolest v nadbřišku s iradiací do zad je symptomem, který v průběhu nemoci vyvine až 85 % pacientů. Porucha trávení projevující se steatoreou a úbytkem tělesné hmotnosti se obvykle manifestuje v pokročilejším stadiu onemocnění, kdy klesá sekrece lipázy pod 10 % normální hodnoty. Pankreatogenní diabetes je pozdním příznakem onemocnění a vzniká důsledkem destrukce buněk pankreatických ostrůvků. Jeho léčba bývá komplikována vyšším rizikem hypoglykemie při současné nedostatečné syntéze glukagonu.
Bolest bývá klasicky popisována jako tupá a stálá, lokalizovaná do středního epigastria, často vyzařující do zad. Lokalizace a intenzita bolesti se může individuálně výrazně lišit. Nezřídka bývá kvantifikace bolesti a posouzení jejího vlivu na kvalitu života obtížná, především u pacientů s chronickým abúzem alkoholu či analgetik. Léčba bolesti je u pacientů s CHP náročná a často nedostatečně úspěšná. Přestože u většiny pacientů s CHP dojde v průběhu progrese onemocnění do terminální fáze k vyhasnutí bolesti [33], čekání na spontánní ústup bolesti není na místě. V etiologii bolesti se uvažuje o vlivu obstrukce pankreatického vývodu se zvýšením intraduktálního tlaku, poškození nervového zásobení pankreatu s patologickou přestavbou neuronálních výběžků, působení zánětlivých mediátorů jako nocicepčních podnětů, centrální neuropatii či hormonálních změnách organizmu jako zvýšené hladiny cholecystokininu (CCK) [4].
Exokrinní insuficience pankreatu (EIP) nastává v případě, že množství enzymů uvolňovaných do duodena jako odpověď na příjem potravy není dostatečné k zachování normálního trávení. Vzhledem k velkým funkčním rezervám pankreatu a přítomnosti kompenzatorních mechanizmů, které mohou částečně zastoupit ztrátu pankreatických enzymů (např. slinná amyláza, gastrická lipáza), se klinické symptomy EIP obvykle manifestují až při poklesu aktivity pankreatické lipázy pod 10 % normálních postprandiálních hodnot. Hlavní klinickou konsekvencí EIP je maldigesce tuků, které jsou nejbohatším zdrojem energie v potravě. Obvykle se projeví steatoreou – zapáchající, objemnou, našedlou či žlutou stolicí. Pacienti si mohou rovněž stěžovat na bolesti břicha, křeče anebo flatulenci. Pokročilá maldigesce makronutrientů (tuky, proteiny, cukry) vede nejen k malnutrici a následnému úbytku hmotnosti, ale je rovněž asociována s deficiencí vitaminů rozpustných v tucích (vit. A, D, E, K), magnezia, kalcia a esenciálních amino ‑ a mastných kyselin [34]. Pacienti s CHP jsou v důsledku EIP ohrožení osteoporózou (při snížených sérových hladinách metabolitů vitaminu D) [35] a zvýšeným rizikem kardiovaskulárních příhod (v důsledku snížené plazmatické hladiny HDL‑cholesterolu a apolipoproteinu A1) [36,37]. Z výše uvedeného vyplývá důležitost včasné diagnostiky a efektivní léčby EIP.
Diagnostika
Prvním krokem k úspěšné léčbě CHP je správná diagnóza, o které uvažujeme zejména na základě výše uvedené klinické symptomatologie. První diagnostická linie sestává z pečlivé anamnézy, fyzikálního vyšetření a nálezů zobrazovacích metod.
Zobrazovací metody
Charakteristickým nálezem ultrasonografie a počítačové tomografie, nozognostickým pro CHP, jsou atrofie pankreatu, dilatace pankreatických vývodů a kalcifikace. Vhodnou modalitou k posouzení nálezu na slinivce je i magnetická rezonance s cholangiopankreatografií (event. i s podáním sekretinu), jejíž výhodou je přesnější zobrazení anatomie pankreatického vývodu, nicméně často nezobrazí kalcifikace pankreatu. Endosonografické vyšetření má výbornou senzitivitu a zobrazí již incipientní změny pankreatu, jejím nedostatkem je ale nízká specificita a invazivita. Zobrazovací metody zároveň slouží i k vyloučení nádorového onemocnění u pacientů se symptomy hubnutí a bolestí v epigastriu, a to i v kontextu chronické pankreatitidy jakožto rizikového faktoru vzniku karcinomu pankreatu. Odlišení tumoru a CHP je zásadní zejména u její autoimunitní formy, která může velice sugestivně karcinom pankreatu napodobovat nejen nálezy zobrazovacích metod a klinickou manifestací, ale i epidemiologickou charakteristikou pacientů. Algoritmus vyšetřování suspektní autoimunitní CHP sleduje několik parametrů jako morfologii slinivky a pankreatického vývodu, z laboratorních vyšetření je nutná znalost hladiny podtřídy imunoglobulinů IgG4 v krvi. Specifikem je i mnohem nižší práh k provedení invazivních vyšetření jako ERCP či biopsie pankreatické tkáně, které se obvykle v diagnostice CHP neprovádí. Stanovení diagnózy autoimunitní CHP je obtížné i navzdory přítomnosti recentně definovaných konsenzuálních kritérií (ICDC) [38] a diagnostický proces by měl být prováděn na pracovištích, která se věnují dispenzarizaci a léčbě tohoto onemocnění. V případě inkonkluzivního morfologického nálezu na pankreatu dle zobrazovacích metod mohou diagnózu CHP podpořit funkční vyšetření exokrinního pankreatu.
Funkční metody
V praxi je podezření na exokrinní pankreatickou insuficienci (EIP) obvykle vysloveno na základě klinického stavu pacienta a sdělených symptomů (změna defekačního rytmu, hubnutí, steatorea). Ke stanovení exokrinní funkce pankreatu bylo vyvinuto několik metod. Přímé funkční testy (jako např. sekretinový ‑ cholecystokininový stimulační test) mají největší specificitu a senzitivitu, ale v běžné klinické praxi se prakticky neužívají pro svou technickou náročnost, invazivní povahu a cenu. Nepřímé funkční vyšetření lze rozdělit do čtyř kategorií: fekální testy (sběr stolice, fekální elastáza), dechové testy (MTG – mixed triglyceride test) a močové testy, které byly v praxi nahrazeny jednoduššími krevními testy (hladina sérového trypsinogenu) s vyšší specificitou a senzitivitou.
Sběr stolice za 72 nebo 96 hod a její následná analýza je považována za zlatý standard v diagnostice a kvantifikaci maldigesce tuků, nicméně neumožňuje odlišit pankreatickou a extrapankreatickou příčinu maldigesce a již pro charakter dlouhodobě sbíraného biologického materiálu není mezi pacienty moc oblíbená. V praxi se z nepřímých funkčních vyšetření obvykle užívá stanovení fekální elastázy (FE ‑ 1) ve stolici. Pankreatická elastáza 1 je enzym vylučovaný v pankreatické šťávě, jenž je charakterizován vysokou stabilitou v průběhu pasáže gastrointestinálním traktem. Výhodou testu je jeho jednoduché provedení, nevýhodou je senzitivita omezená na střední až významnou exokrinní pankreatickou insuficienci [39]. Slibným funkčním vyšetřením se jeví být neinvazivní dechový test MTG se senzitivitou na úrovni 90 % [40]. Jeho provedení spočívá v podání 13C značených triglyceridů, které jsou působením pankreatické lipázy štěpeny v duodenu, přičemž dochází ke vstřebání značených mastných kyselin, které jsou následně metabolizovány v játrech za uvolnění 13CO2, který je měřen ve vydechovaném vzduchu. Širší využití MTG je limitováno vysokou cenou substrátů a absencí jednotného protokolu vyšetření.
Léčba
Kauzální terapie v současnosti u CHP, vyjma její autoimunitní formy, neexistuje. Mezi základní pilíře léčby patří symptomatická kontrola bolesti, náhrada ztracené trávicí funkce pankreatickými enzymy, substituce inzulinu u pankreatogenního diabetu a léčba možných komplikací onemocnění jako fibrotické obstrukce okolních anatomických struktur (žlučových cest, duodena, portomezenterického a lienálního řečiště) nebo pankreatických pseudocyst. Léčbu CHP lze rozdělit na konzervativní, endoskopickou a chirurgickou.
Konzervativní léčba
Nezbytným krokem k úspěšné léčbě CHP obecně je naprostá abstinence od alkoholu, a to nejen u pacientů s alkoholickou CHP. Vyloučení příjmu alkoholu zpomalí progresi onemocnění (mj. míru tvorby kalcifikací a ztráty exokrinní funkce), vede k úlevě od bolesti, snižuje frekvenci exacerbací a prodlužuje život [41 – 43]. Všem pacientům s CHP by rovněž měla být doporučena abstinence od kouření, které je nezávislým rizikovým faktorem rozvoje jak akutní, tak i chronické pankreatitidy. V neposlední řadě kouření tabáku významně zvyšuje riziko vzniku karcinomu pankreatu. Vliv kouření na bolest nebyl doposud studován.
Analgetika
Analgetika jsou základem léčby bolesti u pacientů s CHP. Léčbu začínáme vždy od méně silných analgetik k těm silnějším či zkoušíme jejich kombinace. Cílem je dosáhnout kvalitního tlumení bolesti při co nejnižší dávce co nejslabších analgetik. Terapie by měla být vždy zahájena neopioidními analgetiky. Preferovaným lékem první volby bývá obvykle paracetamol či nesteroidní analgetika, často se v praxi užívají spazmoanalgetika, která kombinují přímý analgetický účinek s relaxačním účinkem na hladkou svalovinu pankreatických vývodů. V další fázi se do medikace přidávají slabé opioidy jako tramadol nebo dextropropoxyfen. Poté následují již silné opioidy jako morfin nebo fentanyl, kterým je ale vhodné se vyhnout co nejdelší možnou dobu z důvodu nemalého rizika rozvoje lékové závislosti. S ohledem na neuropatickou komponentu bolesti u CHP lze předpokládat příznivý účinek léků působících v různých oblastech centrálního nervového systému. Účinnými preparáty v léčbě neuropatické bolesti jsou například tricyklická antidepresiva (amitriptylin, nortriptylin), inhibitory zpětného vychytávání serotoninu (paroxetin, fluoxetyna atd.) či antikonvulziva (pregabalin, gabapentin). Navzdory účinné analgetické terapii bývá mnohdy léčba bolesti u CHP refrakterní. V tom případě by měla být vždy zvážena endoskopická či chirurgická intervence.
Antioxidanty
Aktuálním a velmi diskutovaným tématem v pankreatologii je léčba bolesti u CHP podáváním antioxidantů. Předpokládá se jejich účinek ve smyslu snížení tvorby kyslíkových radikálů, a tím potlačení zánětlivých procesů vedoucích k bolesti. Navzdory slibným výsledkům podávání kombinací antioxidantů nelze však toho času tuto léčbu definitivně doporučit v běžné klinické praxi, k potvrzení příznivého vlivu na úlevu od bolesti u pacientů s CHP je zapotřebí dalších, dobře konstruovaných, randomizovaných studií.
Pankreatické enzymy
Analgetický efekt pankreatických enzymů vychází z předpokladu, že exogenně dodané enzymy degradují CCK ‑ uvolňující faktor (CCK ‑ RF), a tím sníží sekreci CCK. Úleva od bolesti nebyla doposud jednoznačně prokázána, přesto někteří autoři doporučují podání enzymů jako terapeutický pokus na 6 – 8 týdnů. U nás dostupné enterosolventní preparáty nejsou k této léčbě vhodné, neboť dosahují většinu svého účinku až v distálnějších partiích tenkého střeva, a neumožní tak štěpení CCK ‑ RF v duodenu.
Cílem léčby EIP je dosažení eudigesce, úlevy od symptomů asociovaných s EIP a předcházení morbidity a mortality v souvislosti s malnutricí. Substituce pankreatických enzymů kompenzuje nedostatečnou endogenní sekreci a je jednoznačně indikována u všech pacientů s CHP se steatoreou a/ nebo anamnézou hubnutí. Moderní preparáty exogenních pankreatických enzymů jsou primárně extrahovány z vepřových pankreatů a nesou společné pojmenování pankrealipáza nebo pankreatin. V závislosti na výrobci obsahují různé směsi proteázy, lipázy a amylázy zapouzdřené do preparátů s acidorezistentním povrchem, který chrání enzymy před degradací v kyselém prostředí žaludku. Vyšší pH v nižších etážích gastrointestinálního traktu umožní rozložení ochranné vrstvy, což vede k uvolnění enzymů na odpovídajícím místě a k zabezpečení trávení. Důležitá je také malá velikost preparátů, která umožní jejich dokonalé promíchání a postup s potravou.
Léčbu zahajujeme většinou dávkou 25 – 40 000 [44] jednotek lipázy k hlavnímu jídlu, k menším jídlům je ve všeobecnosti doporučována dávka poloviční. V klinické praxi je nejjednodušší zahájit léčbu nejnižší doporučovanou dávkou (25 000 jednotek) k hlavnímu jídlu, kterou pak lze v případě potřeby zvýšit a titrovat na nejnižší možnou efektivní dávku. K dosažení terapeutického efektu je zásadní i dodržování časování užívání léku. Polovinu dávky by měl pacient pozřít na začátku jídla a zbytek pak přibližně v polovině porce [45]. Tento postup pravděpodobně napomáhá adekvátnímu smíchání exogenních enzymů s chymem, a tím umožňuje simultánní evakuaci substrátů i enzymů do duodena. Substituční léčba pankreatickými enzymy je bezpečná a obecně bývá dobře tolerována s minimálním výskytem nežádoucích účinků.
K hodnocení úspěšnosti léčby v běžných klinických podmínkách je dostatečným kritériem klinické zlepšení pacienta, základním sledovaným parametrem je hmotnost [46]. V případě nedostatečného efektu zjistíme adherenci pacienta k léčbě, navýšíme dávku či přidáme inhibitory protonové pumpy. Jejich efekt nahradí sníženou sekreci bikarbonátu pankreatem, a zabrání tak degradaci lipázy v kyselém prostředí.
Dieta
V minulosti obvyklé doporučení nízkotučné diety je dnes již obsolentní, protože vede k akceleraci úbytku hmotnosti a prohloubení deficitu vitaminů rozpustných v tucích [45]. Adekvátní dávka pankreatické substituce přijímaná v adekvátním formě a režimu by měla být dostatečná k tomu, aby byl pacient schopen plnohodnotného stravování. Vedle úpravy dávkování pankreatické substituce může být vhodné nahradit několik málo vysokokalorických jídel větším počtem menších porcí. Redukce příjmu tuků je až posledním krokem u pacientů s přetrvávajícími symptomy EIP.
Imunosuprese
Imunosupresivní léčbu lze na rozdíl od výše a níže uvedených léčebných modalit považovat za jedinou léčbu kauzální. Jejím cílem je potlačení imunopatologických dějů, které jsou příčinou autoimunitní pankreatitidy. V léčbě používáme na prvním místě kortikosteroidy (typicky prednison 40/ d s postupnou redukcí dávky), v případě relapsu pak opět steroidy či azathioprin. Před zahájením imunosupresivní terapie je vždy nutné vyloučit přítomnost karcinomu pankreatu.
Endoskopická léčba
K endoskopické léčbě přistupujeme u pacientů s CHP z indikace bolesti. Spočívá v užití endoskopické retrográdní cholangiopankreatikografie (ERCP), extra ‑ a intrakorporální lithotrypse či endosonograficky asistovaných metod (obr. 1). Indikace musí probíhat s rozmyslem pro nezanedbatelné riziko komplikací a často omezenou účinnost. Efekt léčby by měl být zhodnocen za 6 – 8 týdnů a v případě jeho absence by po poradě s chirurgem měly být zváženy další možnosti léčby. Endoskopická léčba je v současné době doporučena jako invazivní metoda první volby u pacientů s bolestivou CHP [47], přestože dvě randomizované studie srovnávající endoskopickou a chirurgickou léčbu [48,49] ukázaly lepší výsledky v operované skupině. Je tomu tak proto, že endoskopická léčba nevylučuje možnost následné chirurgické léčby a je bezpečnější. Názor pacienta a zkušenosti konkrétního centra jsou nezanedbatelnými faktory při rozhodování o léčbě.
Obr. 1. Endoskopická léčba chronické pankreatitidy. A – obturující wirsungolithiáza v hlavě pankreatu, B – překonání konkrementů pomocí Soehendra retrieveru, C – zavedení pankreatického stentu, D – výsledek léčby po odstranění konkrementů. 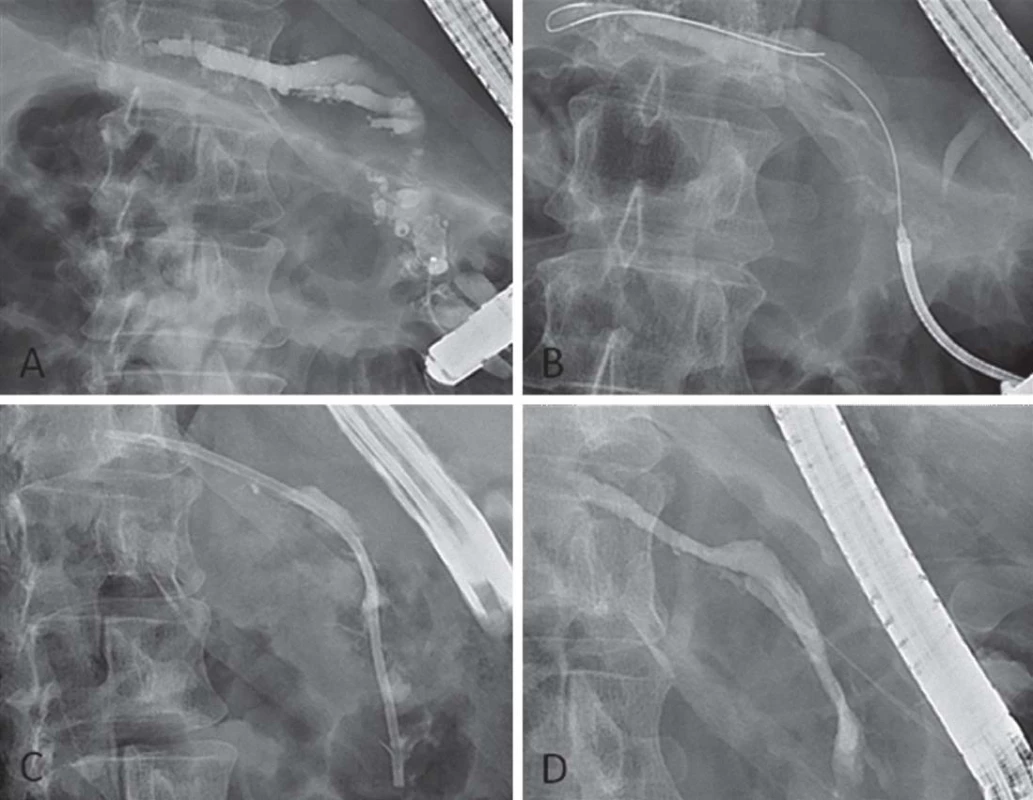
Wirsungolitiáza
Předpokládáme, že konkrementy hlavního pankreatického vývodu působí překážku odtoku pankreatické šťávy a zvyšují intrapankreatický tlak. Pokud jsou konkrementy malé (cca do 5 mm), lze je odstranit endoskopicky, větší či vícečetné konkrementy jsou s výhodou nejprve fragmentovány pomocí extrakorporální lithotrypse (ESWL – Endoscopic Shock Wave Lithotrypsy) a následně většinou odstraněny při ERCP. Hlavní komplikací extrakorporální lithotrypse je akutní pankreatitida, výskyt komplikací však v průměru nepřesahuje 6 % [50]. Efektivita léčby se ve velkých centrech s dostatečnou zkušeností pohybuje kolem 90 % [51].
Stenóza hlavního pankreatického vývodu
Dominantní stenóza hlavního vývodu je většinou provázena prestenotickou dilatací. Předpokládáme, že bolest je u těchto pacientů způsobena zvýšeným intraparenchymovým tlakem ve žláze nad stenózou. Zavedení stentu je vysoce účinné, ústup bolestí se dostaví časně po výkonu u 65 – 95 % pacientů, avšak efekt léčby s průběhem času klesá [47]. Součástí výkonu je sfinkterotomie pankreatického vývodu a často i dilatace stenózy. Optimální je zavedení 10Fr plastikového stentu, který se v intervalech tří měsíců pravidelně vyměňuje [52] po dobu alespoň jednoho roku. Nejčastější komplikací zavedení stentu je pankreatitida, která je však většinou mírná [53]. V případě selhání transpapilárního přístupu je možné drenáž pankreatického vývodu zajistit transduodenální či transgastrickou cestou pod endosonografickou kontrolou [54].
Pseudocysty
Pseudocysta pankreatu je kolekce pankreatické šťávy ohraničená vazivovou stěnou, která vzniká buď akutně (do 4 týdnů) jako následek ataky pankreatitidy, nebo chronicky u pacientů s chronickou pankreatitidou bez akutní ataky [55]. Pseudocysty vznikají u 20 – 40 % pacientů s CHP [56]. Jsou nejčastěji asymptomatické a regredují spontánně. Mohou se však projevit bolestí, útlakem horní části zažívacího traktu a žlučovodů či infekcí. Endoskopická léčba spočívá v drenáži pseudocysty stentem, který je zaveden transpapilárně či transmurálně (skrze žaludek či duodenum).
Endoskopická léčba se stala metodou volby léčby symptomatických pseudocyst. Endoskopická léčba je stejně účinná jako chirurgická, avšak méně invazivní, levnější a zatížená menším množstvím komplikací [57,58]. Transpapilární drenáž je technicky jednodušší, avšak možná jen v případech, kdy pseudocysta přímo komunikuje s hlavním pankreatitickým vývodem a nedosahuje přílišné velikosti. Transmurální drenáž je v současné době prováděna téměř výlučně pod endosonografickou kontrolou s cílem zavedení několika stentů. Účinnost endoskopické léčby (vymizení pseudocysty a ústup symptomů) je mezi 64 % a 90 % s rizikem komplikací kolem 10 % (infekce, perforace, krvácení) [47].
Stenóza žlučových cest
Stenóza žlučových cest komplikuje CHP až u čtvrtiny pacientů a vzniká v důsledku zevního útlaku žlučovodů fibrotickou tkání v hlavě pankreatu. Jinou příčinou může být útlak pseudocystou či karcinomem pankreatu. Na jeho přítomnost a vyloučení bychom měli pomýšlet v případě stenózy žlučových cest vždy . Indikací k léčbě stenózy žlučovodů je přítomnost symptomů, sekundární biliární cirhózy, choledocholitiázy, progrese stenózy v čase či asymptomatické zvýšení ALP (> dvojnásobek normy) a/ nebo bilirubinu po dobu delší než jeden měsíc [47].
Endoskopická léčba stenózy žlučových cest při CHP patří k nejobtížnějším, neboť je málo efektivní a stenóza často rekuruje. Cílem endoskopické léčby by mělo být zavedení vícečetných biliárních stentů, což je technicky možné u více než 90 % pacientů. Zavedení jednoho plastikového stentu úspěšně léčilo stenózu pouze u 24 – 31 % pacientů, zavedení vícečetných stentů však mělo efekt až u 62 – 92 % pacientů [47,59]. Biliární stenty vyžadují pravidelné výměny v intervalu tří měsíců po dobu minimálně jednoho roku. Variantou plastikových stentů je zavedení částečně potahovaného či plně potahovaného metalického stentu s delší patencí.
Chirurgická léčba
Dvě randomizované prospektivní studie srovnávající endoskopickou a chirurgickou léčbu ukázaly lepší dlouhodobé výsledky v operované skupině [48,49]. Obě studie však byly velmi heterogenní. Výhodou endoskopické léčby je větší bezpečnost a zachovalá možnost následné chirurgické léčby.
Indikací chirurgické léčby je bolest refrakterní k medikamentózní či endoskopické léčbě. Jinou indikací jsou komplikace chronické pankreatitidy jako stenóza žlučovodů, pseudocysta, stenóza duodena či podezření na malignitu. Přístupy chirurgické léčby vycházejí ze dvou principů vzniku pankreatické bolesti. Drenážní výkony si kladou za cíl zbavit pacienta bolesti zajištěním drenáže pankreatického vývodu, kdežto resekční vývody předpokládají neurogenní vznik bolesti v zánětlivě změněné hlavě pankreatu.
Drenážní operace je indikována u pacientů s dilatovaným hlavním pankreatickým vývodem ke snížení intraduktálního tlaku, ústupu bolesti a zachování pankreatické funkce [60]. Výkon spočívá v podélném otevření pankreatického vývodu s pankreatikojejunoanastomózou stranou ke straně pomocí Roux ‑ en ‑ Y kličky (Partington – Rochelle, laterální pankreatikojejunostomie) [61] jako modifikace původní drenáže dle Puestowa et al [62]. Mortalita výkonu je nízká a bezprostřední ústup bolestí je pozorován u asi 80 % pacientů [63].
Bolestivá forma pankreatitidy se zvětšenou hlavou pankreatu je indikací k resekčnímu výkonu. Kompletní resekce hlavy pankreatu ve formě duodenopankreatektomie je indikována vždy, pokud nelze ve zvětšené, zánětlivě změněné hlavě vyloučit karcinom pankreatu [64]. S výhodou se však používají výkony s limitovanou resekcí jako duodenum šetřící duodenpankreatektomie (Beger) [65] či její modifikace pylorus šetřící duodenopankreatektomie (Traverso) nebo výkony kombinující limitovanou resekci s drenáží jako operace dle Freye [66]. Rozhodnutí o typu operace do významné míry souvisí se zkušeností provádějícího chirurga [67]. Ve velkých centrech je efekt chirurgické léčby více než 90 % při nízké mortalitě a přiměřené, avšak nezanedbatelné morbiditě [68].
Levostranná pankreatektomie je vzácně indikována u dominantně levostranné pankreatitidy, obstrukční pankreatitidy ocasu či v léčbě pseudocysty. Totální pankreatektomie je u chronické pankreatitidy indikována vzácně, její hlavní komplikací je vznik diabetes mellitus.
Také komplikace chronické pankreatitidy mohou být léčeny chirurgicky. Stenóza žlučovodů bez jiných příznaků může být léčena hepatikojejunoanastomózou, stenóza duodena gastroenteroanastomózou, pseudocysta pankreatu pseudocystogastroanastomózou. V případě symptomatické trombózy v. lienalis je indikována splenektomie.
Doručeno do redakce: 27. 5. 2014
Přijato po recenzi: 17. 6. 2014
MUDr. Tomáš Hucl
www.ikem.cz
tomas.hucl@ikem.cz
Zdroje
1. Lin Y, Tamakoshi A, Matsuno S et al. Nationwide epidemiological survey of chronic pancreatitis in Japan. J Gastroenterol 2000; 35 : 136 – 141.
2. Tinto A, Lloyd DA, Kang JY et al. Acute and chronic pancreatitis – diseases on the rise: a study of hospital admissions in England 1989/ 90 – 1999/ 2000. Aliment Pharmacol Ther 2002; 16 : 2097 – 2105.
3. Dite P, Stary K, Novotny I et al. Incidence of chronic pancreatitis in the Czech Republic. Eur J Gastroenterol Hepatol 2001; 13 : 749 – 750.
4. Mačinga P, Špičák J, Hucl T. Etiopatogeneze chronické pankreatitidy. Gastroent Hepatol 2013; 67 : 275 – 288.
5. Lerch MM, Gorelick FS. Early trypsinogen activation in acute pancreatitis. Med Clin North Am 2000; 84 : 549 – 563.
6. Beer S, Zhou J, Szabo A et al. Comprehensive functional analysis of chymotrypsin C (CTRC) variants reveals distinct loss ‑ of ‑ function mechanisms associated with pancreatitis risk. Gut 2013; 62 : 1616 – 1624. doi: 10.1136/ gutjnl ‑ 2012 ‑ 303090.
7. Szmola R, Sahin‑Toth M. Chymotrypsin C (caldecrin) promotes degradation of human cationic trypsin: identity with Rinderknecht's enzyme Y. Proc Natl Acad Sci U S A 2007; 104 : 11227 – 11232.
8. Etemad B, Whitcomb DC. Chronic pancreatitis: diagnosis, classification, and new genetic developments. Gastroenterology 2001; 120 : 682 – 707.
9. Apte MV, Wilson JS, McCaughan GW et al. Ethanol‑induced alterations in messenger RNA levels correlate with glandular content of pancreatic enzymes. J Lab Clin Med 1995; 125 : 634 – 640.
10. Corrao G, Bagnardi V, Zambon A et al. Exploring the dose‑response relationship between alcohol consumption and the risk of several alcohol‑related conditions: a meta‑analysis. Addiction 1999; 94 : 1551 – 1573.
11. Kristiansen L, Gronbaek M, Becker U et al. Risk of pancreatitis according to alcohol drinking habits: a population‑based cohort study. Am J Epidemiol 2008; 168 : 932 – 937. doi: 10.1093/ aje/ kwn222.
12. Lankisch PG, Lowenfels AB, Maisonneuve P. What is the risk of alcoholic pancreatitis in heavy drinkers? Pancreas 2002; 25 : 411 – 412.
13. Yadav D, Eigenbrodt ML, Briggs MJ et al. Pancreatitis: prevalence and risk factors among male veterans in a detoxification program. Pancreas 2007; 34 : 390 – 398.
14. Spicak J, Pulkertova A, Kralova ‑ Lesna I et al. Alcoholic chronic pancreatitis and liver cirrhosis: coincidence and differences in lifestyle. Pancreatology 2012; 12 : 311 – 316. doi: 10.1016/ j.pan.2012.05.008.
15. Witt H, Luck W, Becker M et al. Mutation in the SPINK1 trypsin inhibitor gene, alcohol use, and chronic pancreatitis. JAMA 2001; 285 : 2716 – 2717.
16. Talamini G, Bassi C, Falconi M et al. Cigarette smoking: an independent risk factor in alcoholic pancreatitis. Pancreas 1996; 12 : 131 – 137.
17. Chowdhury P, Bone RC, Louria DB et al. Effect of cigarette smoke on human serum trypsin inhibitory capacity and antitrypsin concentration. Am Rev Respir Dis 1982; 126 : 177 – 179.
18. Cavallini G, Talamini G, Vaona B et al. Effect of alcohol and smoking on pancreatic lithogenesis in the course of chronic pancreatitis. Pancreas 1994; 9 : 42 – 46.
19. Lindkvist B, Appelros S, Manjer J et al. A prospective cohort study of smoking in acute pancreatitis. Pancreatology 2008; 8 : 63 – 70. doi: 10.1159/ 000114868.
20. Tolstrup JS, Kristiansen L, Becker U et al. Smoking and risk of acute and chronic pancreatitis among women and men: a population‑based cohort study. Arch Intern Med 2009; 169 : 603 – 609. doi: 10.1001/ archinternmed.2008.601.
21. Stevens T, Conwell DL, Zuccaro G. Pathogenesis of chronic pancreatitis: an evidence‑based review of past theories and recent developments. Am J Gastroenterol 2004; 99 : 2256 – 2270.
22. Howes N, Lerch MM, Greenhalf W et al. Clinical and genetic characteristics of hereditary pancreatitis in Europe. Clin Gastroenterol Hepatol 2004; 2 : 252 – 261.
23. Lowenfels AB, Maisonneuve P, DiMagno EP et al. Hereditary pancreatitis and the risk of pancreatic cancer. International Hereditary Pancreatitis Study Group. J Natl Cancer Inst 1997; 89 : 442 – 446.
24. Malka D, Hammel P, Maire F et al. Risk of pancreatic adenocarcinoma in chronic pancreatitis. Gut 2002; 51 : 849 – 852.
25. Yadav D, Timmons L, Benson JT et al. Incidence, prevalence, and survival of chronic pancreatitis: a population‑based study. Am J Gastroenterol 2011; 106 : 2192 – 2199. doi: 10.1038/ ajg.2011.328.
26. Threadgold J, Greenhalf W, Ellis I et al. The N34S mutation of SPINK1 (PSTI) is associated with a familial pattern of idiopathic chronic pancreatitis but does not cause the disease. Gut 2002; 50 : 675 – 681.
27. Cohn JA, Friedman KJ, Noone PG et al. Relation between mutations of the cystic fibrosis gene and idiopathic pancreatitis. N Engl J Med 1998; 339 : 653 – 658.
28. Sharer N, Schwarz M, Malone G et al. Mutations of the cystic fibrosis gene in patients with chronic pancreatitis. N Engl J Med 1998; 339 : 645 – 652.
29. Bombieri C, Claustres M, De Boeck K et al. Recommendations for the classification of diseases as CFTR‑related disorders. J Cyst Fibros 2011; 10 (Suppl 2): S86 – S102. doi: 10.1016/ S1569 ‑ 1993(11)60014 ‑ 3.
30. Chen JM, Ferec C. Genetics and pathogenesis of chronic pancreatitis: the 2012 update. Clin Res Hepatol Gastroenterol 2012; 36 : 334 – 340. doi: 10.1016/ j.clinre.2012.05.003.
31. LaRusch J, Whitcomb DC. Genetics of pancreatitis. Curr Opin Gastroenterol 2011; 27 : 467 – 474. doi: 10.1097/ MOG.0b013e328349e2f8.
32. Chen JM, Ferec C. Chronic pancreatitis: genetics and pathogenesis. Annu Rev Genomics Hum Genet 2009; 10 : 63 – 87. doi: 10.1146/ annurev ‑ genom ‑ 082908 ‑ 150009.
33. Ammann RW, Akovbiantz A, Largiader F et al. Course and outcome of chronic pancreatitis. Longitudinal study of a mixed medical ‑ surgical series of 245 patients. Gastroenterology 1984; 86 : 820 – 828.
34. Dutta SK, Bustin MP, Russell RM et al. Deficiency of fat ‑ soluble vitamins in treated patients with pancreatic insufficiency. Ann Intern Med 1982; 97 : 549 – 552.
35. Duggan SN, Smyth ND, Murphy A et al. High prevalence of osteoporosis in patients with chronic pancreatitis: a systematic review and meta‑analysis. Clin Gastroenterol Hepatol 2014; 12 : 219 – 228. doi: 10.1016/ j.cgh.2013.06.016.
36. Montalto G, Soresi M, Carroccio A et al. Lipoproteins and chronic pancreatitis. Pancreas 1994; 9 : 137 – 138.
37. Gullo L, Tassoni U, Mazzoni G et al. Increased prevalence of aortic calcification in chronic pancreatitis. Am J Gastroenterol 1996; 91 : 759 – 761.
38. Shimosegawa T, Chari ST, Frulloni L et al. International consensus diagnostic criteria for autoimmune pancreatitis: guidelines of the International Association of Pancreatology. Pancreas 2011; 40 : 352 – 358. doi: 10.1097/ MPA.0b013e3182142fd2.
39. Lankisch PG, Schmidt I, Konig H et al. Faecal elastase 1: not helpful in diagnosing chronic pancreatitis associated with mild to moderate exocrine pancreatic insufficiency. Gut 1998; 42 : 551 – 554.
40. Iglesias ‑ García J, Vilariño M, Iglesias ‑ Rey M et al. Accuracy of the optimized 13C ‑ Mixed Triglyceride Breath test for the diagnosis of steatorrhea clinical practice. Gastroenterology 2003; 124 (Suppl 1): A631.
41. Lieb JG 2nd, Forsmark CE. Review article: pain and chronic pancreatitis. Aliment Pharmacol Ther 2009; 29 : 706 – 719. doi: 10.1111/ j.1365 ‑ 2036.2009.03931.x.
42. Chauhan S, Forsmark CE. Pain management in chronic pancreatitis: A treatment algorithm. Best Pract Res Clin Gastroenterol 2010; 24 : 323 – 335. doi: 10.1016/ j.bpg.2010.03.007.
43. Jadad AR, Browman GP. The WHO analgesic ladder for cancer pain management. Stepping up the quality of its evaluation. JAMA 1995; 274 : 1870 – 1873.
44. Hoffmeister A, Mayerle J, Beglinger C et al. S3 – Consensus guidelines on definition, etiology, diagnosis and medical, endoscopic and surgical management of chronic pancreatitis German Society of Digestive and Metabolic Diseases (DGVS). Z Gastroenterol 2012; 50 : 1176 – 1224. doi: 10.1055/ s ‑ 0032 ‑ 1325479.
45. Dominguez ‑ Munoz JE, Iglesias ‑ Garcia J, Iglesias ‑ Rey M et al. Effect of the administration schedule on the therapeutic efficacy of oral pancreatic enzyme supplements in patients with exocrine pancreatic insufficiency: a randomized, three ‑ way crossover study. Aliment Pharmacol Ther 2005; 21 : 993 – 1000.
46. Lohr JM, Oliver MR, Frulloni L. Synopsis of recent guidelines on pancreatic exocrine insufficiency. United Eur Gastroenterol J 2013. doi: 10.1177/ 2050640613476500.
47. Dumonceau JM, Delhaye M, Tringali A et al. Endoscopic treatment of chronic pancreatitis: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Endoscopy 2012; 44 : 784 – 800. doi: 10.1055/ s ‑ 0032 ‑ 1309840.
48. Dite P, Ruzicka M, Zboril V et al. A prospective, randomized trial comparing endoscopic and surgical therapy for chronic pancreatitis. Endoscopy 2003; 35 : 553 – 558.
49. Cahen DL, Gouma DJ, Nio Y et al. Endoscopic versus surgical drainage of the pancreatic duct in chronic pancreatitis. N Engl J Med 2007; 356 : 676 – 684.
50. Dumonceau JM, Costamagna G, Tringali A et al. Treatment for painful calcified chronic pancreatitis: extracorporeal shock wave lithotripsy versus endoscopic treatment: a randomised controlled trial. Gut 2007; 56 : 545 – 552.
51. Tandan M, Reddy DN, Santosh D et al. Extracorporeal shock wave lithotripsy and endotherapy for pancreatic calculi ‑ a large single center experience. Indian J Gastroenterol 2010; 29 : 143 – 148. doi: 10.1007/ s12664 ‑ 010 ‑ 0035 ‑ y.
52. Vitale GC, Cothron K, Vitale EA et al. Role of pancreatic duct stenting in the treatment of chronic pancreatitis. Surg Endosc 2004; 18 : 1431 – 1434.
53. Weber A, Schneider J, Neu B et al. Endoscopic stent therapy for patients with chronic pancreatitis: results from a prospective follow‑up study. Pancreas 2007; 34 : 287 – 294.
54. Francois E, Kahaleh M, Giovannini M et al. EUS ‑ guided pancreaticogastrostomy. Gastrointest Endosc 2002; 56 : 128 – 133.
55. Bradley EL 3rd. A clinically based classification system for acute pancreatitis. Summary of the International Symposium on Acute Pancreatitis, Atlanta, Ga, September 11 through 13, 1992. Arch Surg 1993; 128 : 586 – 590.
56. Andren ‑ Sandberg A, Dervenis C. Pancreatic pseudocysts in the 21st century. Part I: classification, pathophysiology, anatomic considerations and treatment. JOP 2004; 5 : 8 – 24.
57. Varadarajulu S, Lopes TL, Wilcox CM et al. EUS versus surgical cyst ‑ gastrostomy for management of pancreatic pseudocysts. Gastrointest Endosc 2008; 68 : 649 – 655. doi: 10.1016/ j.gie.2008.02.057.
58. Rosso E, Alexakis N, Ghaneh P et al. Pancreatic pseudocyst in chronic pancreatitis: endoscopic and surgical treatment. Dig Surg 2003; 20 : 397 – 406.
59. Catalano MF, Linder JD, George S et al. Treatment of symptomatic distal common bile duct stenosis secondary to chronic pancreatitis: comparison of single vs. multiple simultaneous stents. Gastrointest Endosc 2004; 60 : 945 – 952.
60. Hartel M, Tempia ‑ Caliera AA, Wente MN et al. Evidence‑based surgery in chronic pancreatitis. Langenbecks Arch Surg 2003; 388 : 132 – 139.
61. Partington PF, Rochelle RE. Modified Puestow procedure for retrograde drainage of the pancreatic duct. Ann Surg 1960; 152 : 1037 – 1043.
62. Puestow CB, Gillesby WJ. Retrograde surgical drainage of pancreas for chronic relapsing pancreatitis. AMA Arch Surg 1958; 76 : 898 – 907.
63. Arslanlar S, Jain R. Benign biliary strictures related to chronic pancreatitis: balloons, stents, or surgery. Curr Treat Options Gastroenterol 2007; 10 : 369 – 375.
64. Frulloni L, Falconi M, Gabbrielli A et al. Italian consensus guidelines for chronic pancreatitis. Dig Liver Dis 2010; 42 (Suppl 6): S381 – S406. doi: 10.1016/ S1590 ‑ 8658(10)60682 ‑ 2.
65. Beger HG, Krautzberger W, Bittner R et al. Duodenum ‑ preserving resection of the head of the pancreas in patients with severe chronic pancreatitis. Surgery 1985; 97 : 467 – 473.
66. Frey CF, Smith GJ. Description and rationale of a new operation for chronic pancreatitis. Pancreas 1987; 2 : 701 – 707.
67. Belina F, Fronek J, Ryska M. Duodenopancreatectomy versus duodenum ‑ preserving pancreatic head excision for chronic pancreatitis. Pancreatology 2005; 5 : 547 – 552.
68. Izbicki JR, Bloechle C, Knoefel WT et al. Drainage versus resection in surgical therapy of chronic pancreatitis of the head of the pancreas: a randomized study. Chirurg 1997; 68 : 369 – 377.
Štítky
Detská kardiológia Interné lekárstvo Kardiochirurgia Kardiológia
Článok vyšiel v časopiseKardiologická revue – Interní medicína
Najčítanejšie tento týždeň
2014 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Nech brouka žít… Ať žije astma!
- Intermitentní hladovění v prevenci a léčbě chorob
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- prof. MUDr. Miloš Štejfa, DrSc., FESC (*28. 5. 1929)
- Léčba akutního srdečního selhání
- Pravidelné supraventrikulární tachykardie – diagnóza, léčba a zkušenosti vysokoobjemového kardiocentra
- Moderní trendy v léčbě dlouhodobé perzistující fibrilace síní
- Standardizace ošetřovatelské péče k dekanylaci sheathu na intervenčních pracovištích v České republice
- HOT lines na sjezdu České kardiologické společnosti
- AUTORSKÁ SOUTĚŽ ČASOPISU KARDIOLOGICKÁ REVUE – INTERNÍ MEDICÍNA
- Editorial – Interní medicína
- Perorální endoskopická myotomie (POEM) – nová endoskopická možnost léčby achalázie jícnu
- Refluxní nemoc jícnu
- Léčba inhibitory protonové pumpy
- Celiakie – současný pohled na etiopatogenezi, diagnostiku a terapii
- Dráždivý tračník – diagnostika a léčba
- Divertikulární choroba tlustého střeva – nové trendy v léčbě
- Screening kolorektálního karcinomu
- Idiopatické střevní záněty
- Chronická pankreatitida
- Kardiologická revue – Interní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Divertikulární choroba tlustého střeva – nové trendy v léčbě
- Dráždivý tračník – diagnostika a léčba
- Chronická pankreatitida
- Léčba inhibitory protonové pumpy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



