-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Význam TDM metotrexátu při terapii psoriázy
The role of methotrexate TDM in psoriasis treatment
Methotrexate (MTX) is a conventional immunosuppressive drug of first choice in oral therapy of moderate ‑ to ‑ severe plaque psoriasis. Its use is comfortable and cost effective. The therapy improves the skin status according to the PASI score (psoriasis area and severity index) by 50% or more in up to 75% of patients. However, a high inter ‑ individual variability in pharmacokinetics is one of the major factors responsible for either insufficient efficacy of the therapy or its premature discontinuation due to adverse effects of MTX. The review article critically evaluates the possible benefits of therapeutic drug monitoring (TDM) of MTX as a tool for personalized pharmacotherapy of psoriasis. Prospective clinical studies unraveled a relationship between the pharmacokinetics and the therapeutic effect of MTX. Recommendations on how to perform TDM were worked out and verified, which helped to improve the outcomes of the initial treatment phase (remission induction). Besides the individualization of MTX dosing, supplementation with folic acid was individually tailored only to patients with a proven folate deficit.
Keywords:
methotrexate – psoriasis – therapeutic drug monitoring
Autori: J. Chládek
Pôsobisko autorov: Ústav farmakologie, LF UK v Hradci Králové
Vyšlo v časopise: Kardiol Rev Int Med 2015, 17(1): 92-95
Kategória: Interní medicína
Súhrn
Metotrexát (MTX) je konvenční imunosupresivum první volby k perorální farmakoterapii středně těžké a těžké ložiskové psoriázy. Léčba je komfortní a cenově výhodná. Zlepšuje stav kůže hodnocený pomocí skóre PASI o 50 % nebo více až u 75 % nemocných. Vysoká interindividuální variabilita farmakokinetiky je jednou z hlavních příčin nedostatečného účinku nebo předčasného ukončení terapie z důvodu nežádoucích účinků MTX. Přehledová práce kriticky posuzuje výhody terapeutického monitorování MTX (TDM) jako prostředku personalizace farmakoterapie psoriázy. Prospektivní klinické studie odhalily vztah mezi farmakokinetikou a účinkem MTX. Byl navržen a ověřen postup TDM, který zlepšil výsledky iniciální fáze léčby (indukce remise). Kromě dávkování MTX byla individualizována i suplementace kyselinou listovou, ke které bylo přistupováno pouze u nemocných s prokázaným deficitem folátů při léčbě MTX.
Klíčová slova:
metotrexát – psoriáza – terapeutické monitorování léčivÚvod
Metotrexát (MTX) je analog kyseliny listové. Jedná se o léčivo ze skupiny antimetabolitů, do které se kromě MTX a jiných antagonistů kyseliny listové (antifolátů) řadí antagonisté purinů a pyrimidinů. Do klinické praxe byl MTX zaveden v 50. letech minulého století jako cytostatikum. V protinádorové farmakoterapii se podává různými cestami ve velmi širokém dávkovém rozmezí. Mezi indikace patří akutní lymfoblastická leukemie, nehodgkinský lymfom, osteosarkom, karcinom prsu, invazivní tumor močového měchýře, choriokarcinom a nádory v oblasti hlavy a krku. Neméně důležitá je druhá indikační oblast. Protizánětlivé a imunosupresivní účinky MTX se využívají při farmakoterapii autoimunitních onemocnění, jako jsou revmatoidní artritida u dospělých pacientů, juvenilní idiopatická artritida, středně těžká a těžká psoriáza a psoriatická artritida, Crohnova nemoc, sarkoidóza, vaskulitidy aj.Práce podává základní informace z vybraných oblastí preklinické a klinické farmakologie MTX. V další části je uveden a stručně komentován soubor klinických studií organizovaných Ústavem farmakologie a Klinikou nemocí kožních a pohlavních LF a FN v Hradci Králové. V neposlední řadě práce kriticky posuzuje možné výhody terapeutického monitorování MTX (TDM) jako prostředku personalizace farmakoterapie psoriázy.
Farmakokinetika a farmakodynamika MTX
MTX je slabá dikarboxylová kyselina. V krvi a většině tělních tekutin je přítomný jako aniont a jeho rozpustnost v tucích je nízká. Na bílkoviny plazmy vázaná frakce MTX činí přibližně 50 %. Po perorálním podání nízkých dávek (< 30 mg/ m2) je absorpce léčiva rychlá (maximální plazmatická koncentrace za 1 – 2 hod). Absolutní biologická dostupnost dosahuje průměrně 70 – 80 %, je ale interindividuálně velmi variabilní (30 – 90 %) jako důsledek saturace nosičového transportu v tenkém střevě [1]. V případě nedostatečného účinku, dávek nad 25 mg a gastrointestinálních nežádoucích účinků (nevolnost, bolest břicha, zvracení, průjem) se preferuje intramuskulární nebo subkutánní podání, které charakterizuje vyšší a méně variabilní absolutní biologická dostupnost [2]. Distribuční objem odpovídá objemu celkové tělesné vody (0,4 – 0,8 l/ kg). Dokládá intracelulární distribuci, která je podmínkou terapeutického účinku MTX [3]. Na transmembránovém transportu MTX a jeho metabolitů se podílejí přenašeč redukovaných folátů (RFC ‑ 1 – reduced folate carrier; SLC19A1) a v menší míře i folátové receptory [4]. Transport z buňky je zprostředkován kromě RFC ‑ 1 i transportními systémy závislými na ATP zahrnujícími proteiny spojené s vícečetnou rezistencí (multidrug‑resistance proteins – MRP 1 – 5, ABCC 1 – 5) a BCRP protein (ABCG2) [5]. Méně než 10 % z biologicky dostupné dávky MTX je oxidováno aldehyd oxidázou na neúčinný metabolit 7 - hydroxy MTX. Mateřská látka i metabolit jsou podobně jako foláty biotransformovány na polyglutamáty (MTXPG), které jsou farmakologicky aktivní a dosahují nejvyšších koncentrací v játrech, ledvinách a slezině. V buňkách jsou zadržovány po dobu několika týdnů. Proto je možné podávat léčivo jednou týdně, i když průměrný biologický poločas eliminace MTX je v rozmezí 5 – 8 hod. Eliminace MTX probíhá z 80 – 90 % renálně a podílí se na ní glomerulární filtrace a koncentračně závislá tubulární sekrece a reabsorpce. Jaterní extrakce, hepatobiliární transport a enterohepatální cirkulace mají větší význam pro eliminaci 7 – hydroxy MTX než MTX [6].
MTX a MTXPG ovlivňují celou řadu biochemických pochodů. Inhibují dihydrofolát reduktázu, a tím dochází k úbytku redukovaných folátů účastnících se biochemických reakcí přenosu jednouhlíkových skupin. Snížená metylace homocysteinu na methionin má za následek pokles tvorby polyaminů (spermidin a spermin) a nárůst koncentrace homocysteinu. Inhibice thymidylát syntetázy vede k redukci tvorby deoxythymidin monofosfátu a snížení replikace DNA. Účinkem MTXPG dochází také k zásahu do syntézy purinů a zvýšení koncentrace adenozinu, protože je inhibován enzym 5 - aminoimidazol ‑ 4 - karboxamid transformyláza. Není jednoznačně objasněno, který z výše uvedených molekulárních mechanizmů má hlavní význam pro rozvoj imunosupresivního působení MTX. Některé studie zdůrazňují úlohu adenozinu a jeho imunosupresivního účinku zprostředkovaného vazbou na receptor zahrnujícího zvýšenou syntézu protizánětlivých cytokinů (IL‑10) a sníženou syntézu prozánětlivých transkripčních faktorů (např. NF ‑ κB), cytokinů (TNF‑α) a adhezivních molekul [7].
Klinická farmakologie MTX v léčbě psoriázy
Psoriáza je chronické autoimunitní onemocnění s kožními projevy, při kterém aktivace Langerhansových buněk a T lymfocytů vede ke zvýšené přítomností a aktivaci neutrofilů a lymfocytů, indukci prozánětlivých cytokinů a chemokinů, proliferaci keratinocytů a hypervaskularizaci postižené kůže. V různých formách a tíži postihuje 2 – 3 % populace [8]. Středně těžká a těžká psoriáza (30 % případů) vyžaduje celkovou imunosupresivní léčbu, ve které má MTX pozici léku první volby. Podává se jednou týdně perorálně v nízkých dávkách do 25 mg jako bolus nebo rozděleně do třech dávek po 12 hod. Farmakoterapie MTX zlepšuje až u 75 % nemocných stav kůže o 50 % a více, je komfortní a cenově velmi výhodná. Nicméně se musí předčasně ukončit až u 30 % nemocných z důvodu nežádoucích účinků (hepatotoxicita, útlum krvetvorby) nebo netolerance MTX (nauzea, únava, bolest břicha a hlavy, průjem). Po selhání léčby MTX je zahajováno podávání biologických léčiv inhibujících TNF‑alfa nebo IL‑12/ 23.
Za nedostatečný účinek nebo zvýšené riziko nežádoucích účinků jsou do značné míry zodpovědné velké interindividuální rozdíly ve farmakokinetice MTX. Vliv farmakokinetiky na výsledky léčby a možný přínos farmakokineticky řízeného dávkování MTX byl na našich pracovištích hodnocen v několika prospektivních studiích. Po perorálním podání dávky 15 mg se interindividuální variabilita v absorpci a eliminaci léčiva projevovala až pětinásobnými rozdíly v plazmatických koncentracích MTX a souvisejících farmakokinetických charakteristikách, tj. v hodnotách maximální koncentrace a plochy pod křivkou koncentrace ‑ čas (AUC) [9]. Originálním zjištěním byla těsná korelace mezi AUC v prvním týdnu a výsledky léčby za tři měsíce od zahájení farmakoterapie. Větší hodnotě AUC odpovídal větší procentuální pokles skóre postižení kůže PASI (The Psoriasis Area and Severity Index). Vztah mezi farmakokinetikou a farmakodynamikou umožnil definovat terapeutické rozmezí pro AUC spojené s vysokou pravděpodobností remise onemocnění (obr. 1). Jiným zajímavým poznatkem bylo, že se MTXPG postupně kumulují v erytrocytech a kinetika nárůstu koncentrací má časovou souvislost s farmakodynamikou, tj. zlepšením na škále PASI. Oba děje charakterizoval průměrný poločas čtyři týdny (obr. 2). Ustálené koncentrace MTXPG v erytrocytech po 13 týdnech korelovaly se zlepšením PASI vyjádřeným v procentech hodnoty skóre před léčbou.
Obr. 1. Vztah mezi plochou pod křivkou plazmatických koncentrací metotrexátu (AUC) vyšetřenou v prvním týdnu a tíží psoriázy hodnocenou po třech měsících léčby pomocí skóre PASI (The Psoriasis Area and Severity Index) a vyjádřenou v procentech hodnoty skóre před léčbou. 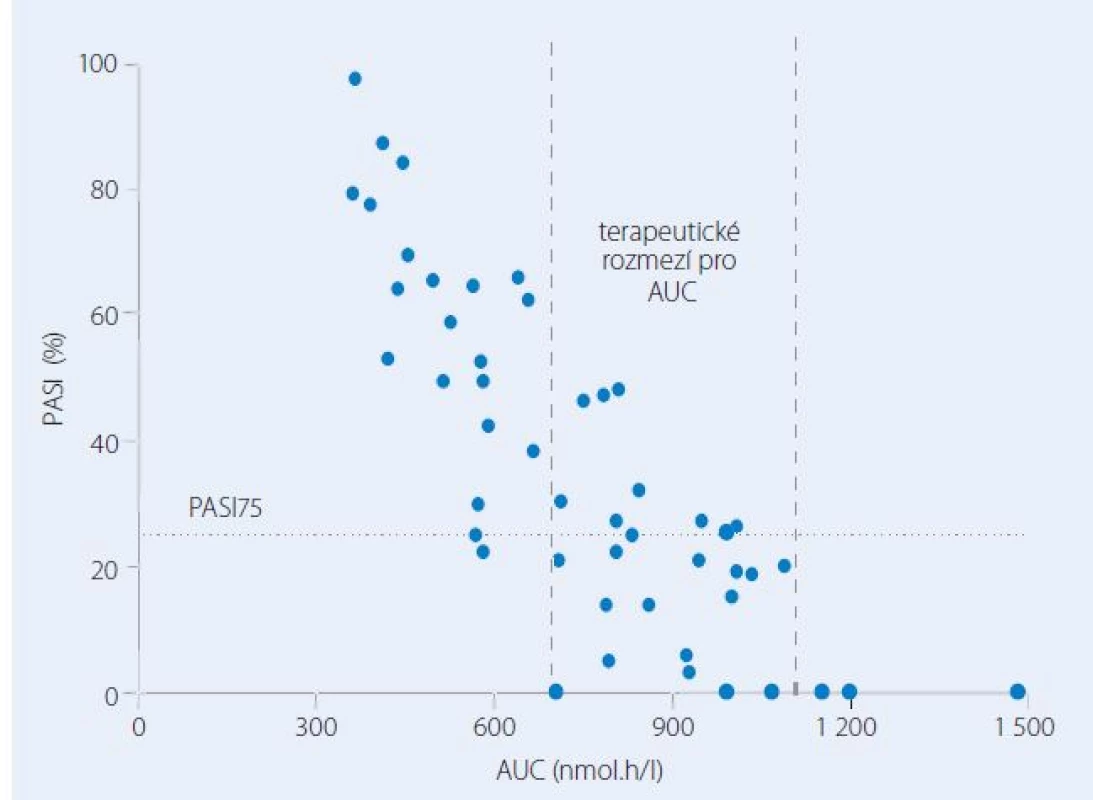
Obr. 2. Průměrné hodnoty koncentrace polyglutamátů methotrexátu v erytrocytech (MTXPG, A) a skóre tíže psoriázy PASI v průběhu léčby metotrexátem. Nárůst koncentrace MTXPG a pokles PASI probíhal podle kinetiky prvního řádu s poločasem 4 týdny. 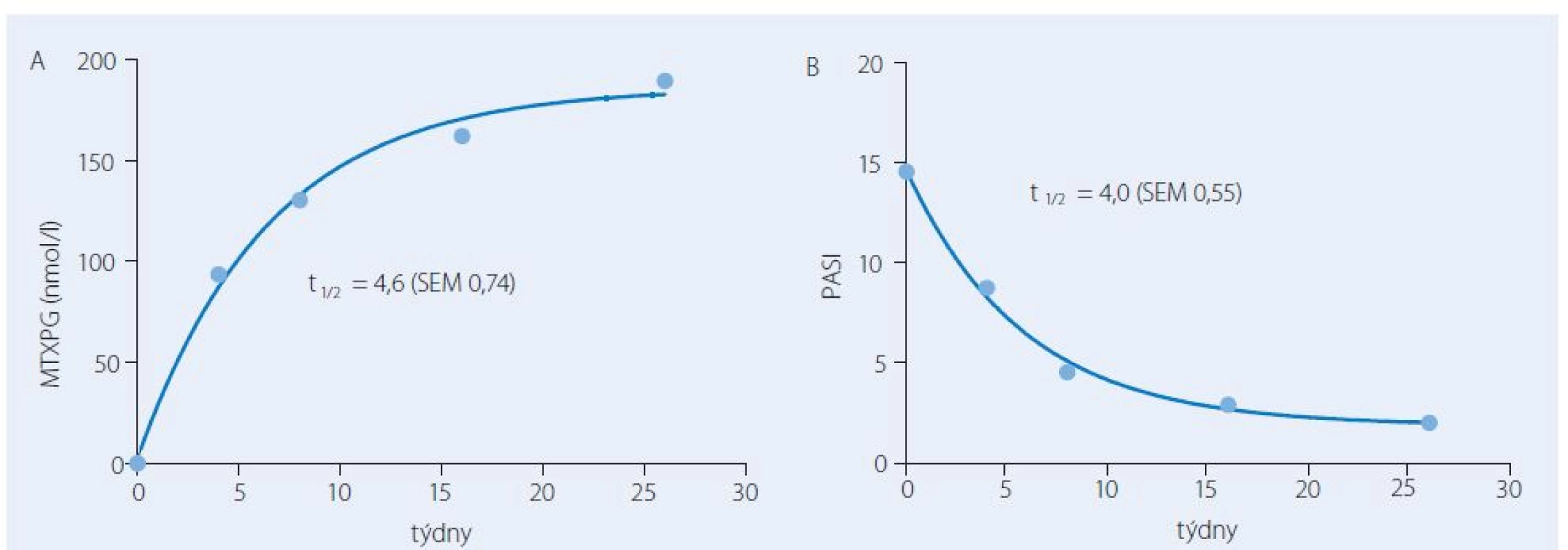
SEM – standardní chyba průměru TDM metotrexátu při terapii psoriázy
Další studie se zaměřily na TDM a individualizaci dávkování spočívající v podání testovací dávky 10 mg MTX p.o. a výpočtu AUC v intervalu 0 – 8 hod po podání pomocí koncentrací v časech 1 hod, 4 hod a 8 hod. Dávka byla upravena tak, aby plocha AUC byla v terapeutickém rozmezí. Ve dvou studiích bylo zaznamenáno u nemocných se středně těžkou a těžkou ložiskovou psoriázou průměrné zlepšení PASI o 67 % a 83 %. Ke zlepšení o 50 % nebo většímu (kritérium PASI50) došlo u 85 % nemocných [10,11]. Současná doporučení European Academy of Dermatovenereology navrhují iniciální dávku 5 – 10 mg MTX a její rychlé zvyšování na udržovací dávku v rozmezí 5 – 30 mg/ týden [12]. Z přehledu kontrolovaných studií je patrné, že výsledky takto vedené léčby byly ve většině studií horší než naše zkušenosti s individualizovaným dávkováním (tab. 1).
Tab. 1. Přehled randomizovaných kontrolovaných studií hodnotících účinek metotrexátu (MTX) v léčbě středně těžké a těžké ložiskové psoriázy. 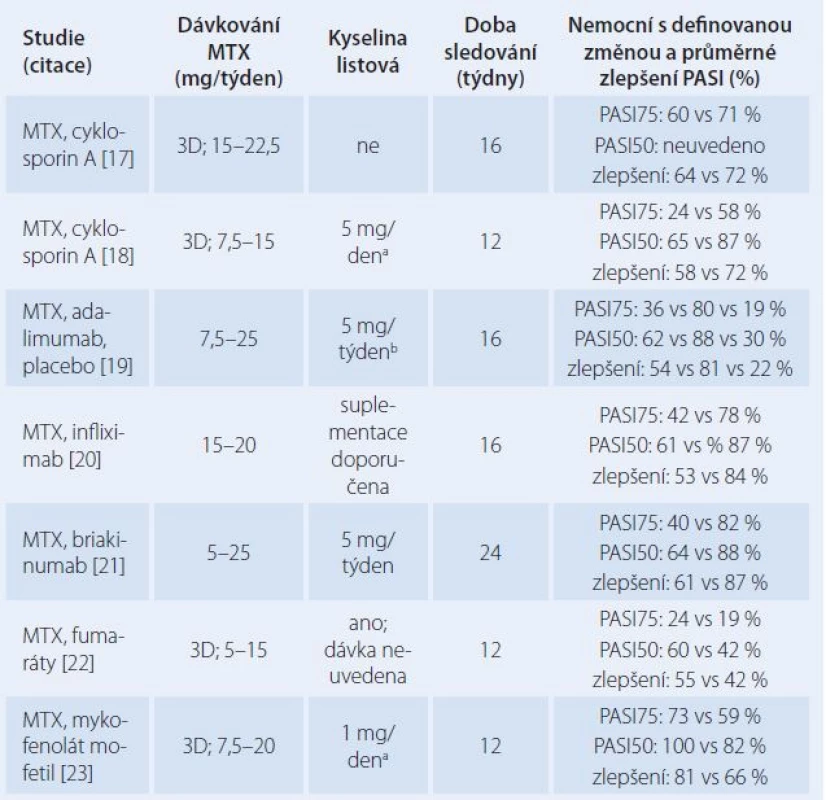
MTX – metotrexát, 3D – týdenní dávka byla rozdělena do 3 dávek po 12 hod, a – s výjimkou dne podání MTX, b – přibližná dávka v potravinovém doplňku, PASI75, PASI50 – zlepšení skóre PASI o 75 % a 50 % oproti stavu před léčbou Podle závěrů většiny studií zaměřených na farmakoterapii revmatoidní artritidy MTX snižuje současná suplementace kyselinou listovou výskyt změn v krevním obraze, nežádoucí účinky v gastrointestinálním traktu a hepatotoxicitu MTX, aniž by ovlivňovala terapeutický účinek [13]. První randomizovaná dvojitě slepá placebem kontrolovaná studie naopak doložila, že u nemocných s psoriázou dlouhodobě užívajících MTX vede zahájení suplementace kyselinou listovou (5 mg/ den) ke zhoršení PASI [14]. Naše zkušenosti ukazují, že kyselina listová v dávce 20 mg/ týden podstatně zhoršuje výsledky léčby také v iniciální fázi indukce remise. V randomizované zkřížené studii bylo pozorováno zlepšení PASI po 16 týdnech o 83 % v rameni studie A s monoterapií MTX a 42 % v rameni B s kombinací MTX a kyselina listová. Po vysazení suplemetace v rameni A v 17. týdnu dosáhlo za dalších 16 týdnů zlepšení PASI o 60 % [11]. Podle těchto zjištění je neracionální zahajovat léčbu kombinací MTX a kyselina listová, pokud není koncentrace folátů v krvi nízká již před léčbou. V další studii současně využívající TDM a selektivní suplementaci kyselinou listovou pouze u nemocných s deficitem folátů byla střední hodnota relativního zlepšení PASI 91 % a četnost zlepšení o 75 % nebo většího (PASI75) 76 %. [15]. To jsou výsledky srovnatelné s léčbou psoriázy biologickými léčivy. Podle recentního celosvětového přehledu jsou postupy vedení léčby značně nejednotné, v používaných týdenních dávkách MTX a kyseliny listové existují překvapivě velké rozdíly a není mezi nimi žádná korelace [16]. I v tomto ohledu má současná farmakoterapeutická praxe léčby psoriázy MTX patrně co zlepšovat.
Závěrem je možné konstatovat, že TDM MTX a racionální postup při suplementaci kyselinou listovou může zlepšit výsledky úvodní fáze léčby středně těžké a těžké ložiskové psoriázy perorálním MTX. Nadějné výsledky z dosavadních studií je nutné posuzovat jako hypotézy generující a vyžadující přímé srovnání s jinými současnými postupy léčby psoriázy ve velkých kontrolovaných studiích.
Finančně podpořeno grantem Prvouk 37/ 05 MŠMT ČR.
Doručeno do redakce: 15. 1. 2015
Přijato po recenzi: 26. 1. 2015
doc. Ing. Jaroslav Chládek, Ph.D.
web.lfhk.cuni.cz/ farmakol
chladekj@lfhk.cuni.cz
Zdroje
1. Grim J, Chládek J, Martínková J. Pharmacokinetics and pharmacodynamics of methotrexate in non‑neoplastic diseases. Clin Pharmacokinet 2003; 42 : 139 – 151.
2. van Roon EN, van de Laar MA. Methotrexate bioavailability. Clin Exp Rheumatol 2010; 28 (Suppl 5): S27 – S32.
3. de Beaumais TA, Jacqz ‑ Aigrain E. Intracellular disposition of methotrexate in acute lymphoblastic leukemia in children. Curr Drug Metab 2012; 13 : 822 – 834.
4. Matherly LH, Wilson MR, Hou Z. The major facilitative folate transporters solute carrier 19A1 and solute carrier 46A1: biology and role in antifolate chemotherapy of cancer. Drug Metab Dispos 2014; 42 : 632 – 649. doi: 10.1124/ dmd.113.055723.
5. Visentin M, Zhao R, Goldman ID. The antifolates. Hematol Oncol Clin North Am 2012; 26 : 629 – 648. doi: 10.1016/ j.hoc.2012.02.002.
6. Petros WP, Evans WE. Anticancer drugs. In: Burton ME, Evans WE, Shaw LM et al (eds). Applied pharmacokinetics and pharmacodynamics: principles of therapeutic drug monitoring, Baltimore, Philadelphia: Lippincott Williams & Wilkins 2005 : 617 – 632.
7. Shen S, O'Brien T, Yap LM et al. The use of methotrexate in dermatology: a review. Australas J Dermatol 2012; 5 : 1 – 18. doi: 10.1111/ j.1440 ‑ 0960.2011.00839.x.
8. Griffiths CE, Barker JN. Pathogenesis and clinical features of psoriasis. Lancet 2007; 370 : 263 – 271.
9. Chladek J, Grim J, Martinkova J et al. Low‑dose methotrexate pharmacokinetics and pharmacodynamics in the therapy of severe psoriasis. Basic Clin Pharmacol Toxicol 2005; 96 : 247 – 248.
10. Hroch M, Chladek J, Simkova M et al. A pilot study of pharmacokinetically guided dosing of oral methotrexate in the initial phase of psoriasis treatment. J Eur Acad Dermatol Venereol 2008; 22 : 19 – 24.
11. Chládek J, Simková M, Vanecková J et al. The effect of folic acid supplementation on the pharmacokinetics and pharmacodynamics of oral methotrexate during the remission ‑ induction period of treatment for moderate ‑ to ‑ severe plaque psoriasis. Eur J Clin Pharmacol 2008; 64 : 347 – 355.
12. Pathirana D, Ormerod AD, Saiag P et al. European S3 – guidelines on the systemic treatment of psoriasis vulgaris. J Eur Acad Dermatol Venereol 2009; 23 (Suppl 2): 1 – 70. doi: 10.1111/ j.1468 ‑ 3083.2009.03389.x.
13. Prey P, Paul C. Effect of folic or folinic acid supplementation on methotrexate‑associated safety and efficacy in inflammatory disease: a systematic review. Br J Dermatol 2009; 160 : 622 – 628. doi: 10.1111/ j.1365 ‑ 2133.2008.08876.x.
14. Salim A, Tan E, Ilchyshyn A et al. Folic acid supplementation during treatment of psoriasis with methotrexate: a randomized, double‑blind, placebo ‑ controlled trial. Br J Dermatol 2006; 154 : 1169 – 1174.
15. Chládek J, Šimková M, Vaněčková J et al. Individualizovaná farmakoterapie ložiskové psoriázy perorálním metotrexátem: fikce nebo reálná možnost? Československá dermatologie 2012; 87 : 221 – 228.
16. Gyulai R, Bagot M, Griffiths CE et al. Current practice of methotrexate use for psoriasis: results of a worldwide survey among dermatologists. J Eur Acad Dermatol Venereol 2014; 29 : 224 – 231. doi: 10.1111/ jdv.12495.
17. Heydendael VM, Spuls PI, Opmeer BC et al. Methotrexate versus cyclosporine in moderate ‑ to ‑ severe chronic plaque psoriasis Methotrexate versus cyclosporine in moderate ‑ to ‑ severe chronic plaque psoriasis. N Engl J Med 2003; 349 : 658 – 665.
18. Flytström I, Stenberg B, Svensson A et al. Methotrexate vs. ciclosporin in psoriasis: effectiveness, quality of life and safety. A randomized controlled trial. Br J Dermatol 2008; 158 : 116 – 121.
19. Saurat JH, Stingl G, Dubertret L et al. Efficacy and safety results from the randomized controlled comparative study of adalimumab vs. methotrexate vs. placebo in patients with psoriasis (CHAMPION). Br J Dermatol 2008; 158 : 558 – 566.
20. Barker J, Hoffmann M, Wozel G et al. Efficacy and safety of infliximab vs. methotrexate in patients with moderate ‑ to ‑ severe plaque psoriasis: results of an open ‑ label, active ‑ controlled, randomized trial (RESTORE1). Br J Dermatol 2011; 165 : 1109 – 1117. doi: 10.1111/ j.1365 ‑ 2133.2011.10615.x.
21. Reich K, Langley RG, Papp KA et al. A 52‑week trial comparing briakinumab with methotrexate in patients with psoriasis. N Engl J Med 2011; 365 : 1586 – 1596. doi: 10.1056/ NEJMoa1010858.
22. Fallah Arani S, Neumann H, Hop WC et al. Fumarates vs. methotrexate in moderate to severe chronic plaque psoriasis: a multicentre prospective randomized controlled clinical trial. Br J Dermatol 2011; 164 : 855 – 861. doi: 10.1111/ j.1365 ‑ 2133.2010.10195.x.
23. Akhyani M, Chams ‑ Davatchi C, Hemami MR et al. Efficacy and safety of mycophenolate mofetil vs. methotrexate for the treatment of chronic plaque psoriasis. J Eur Acad Dermatol Venereol 2010; 24 : 1447 – 1451. doi: 10.1111/ j.1468 ‑ 3083.2010.03667.x.
Štítky
Detská kardiológia Interné lekárstvo Kardiochirurgia Kardiológia
Článek Genetika kardiomyopatií
Článok vyšiel v časopiseKardiologická revue – Interní medicína
Najčítanejšie tento týždeň
2015 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Vyšetření cerebrovaskulární rezervy u asymptomatických pacientů s významnou stenózou vnitřní karotické tepny
- Genetika kardiomyopatií
- Katetrizační léčba chronické stabilní ischemické choroby srdeční v současnosti
- Katetrizační uzávěr foramen ovale patens u potápěčů
- Katetrizační léčba fibrilace síní
- Srdeční resynchronizační terapie – kdy a u koho ji v současnosti indikovat?
- Není perikarditida jako perikarditida – kazuistika
- Studie Pegasus – duální antiagregace (ASA + ticagrelor) dlouhodobě po infarktu myokardu
- Nové studie dávají naději na zlepšení terapie aterosklerózy
-
Hlavolamy 2015
Propojení kardiologie a diabetologie - Vyhlášení výsledků autorské soutěže O nejlepší kazuistiku v roce 2014
- Vývoj a úkoly klinické farmakologie ve zdravotnické péči v ČR
- TDM antibiotik v klinické praxi
- prof. MUDr. Josef Veselka, CSc., FESC, FSCAI, FICA (*23. 3. 1965)
- TDM digoxinu v klinické praxi
- Patofyziologie a diagnóza obstrukce u hypertrofické kardiomyopatie
- Lékové interakce a současná klinická praxe
- Přímá perorální antikoagulancia – perspektivy terapeutického monitorování
- Klinická farmakologie antirevmatik
- Specifika klinických hodnocení léčiv časných fází I a II
- Význam TDM metotrexátu při terapii psoriázy
- Kardiologická revue – Interní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- TDM digoxinu v klinické praxi
- Lékové interakce a současná klinická praxe
- Srdeční resynchronizační terapie – kdy a u koho ji v současnosti indikovat?
- TDM antibiotik v klinické praxi
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



