-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Novinka v intervenční terapii srdečního selhání se zachovalou ejekční frakcí levé komory
A new device in intervention therapy of heart failure with preserved ejection fraction of left ventricle
Chronic heart failure with preserved ejection fraction (HFpEF) is common and yet therapeutic options available to date are limited. Increased left atrial pressure is a key contributor to the symptoms in HFpEF. A novel catheter-based device has been developed, which is designed to lower left atrial pressure by creating a permanent shunt in the atrial septum. Use of this device could reduce the risk of hospitalisation for heart failure and improve the symptomatic status and quality of life in HFpEF patients with advanced symptoms.
Keywords:
heart failure with preserved ejection fraction – left atrium – catheter-based therapy – interatrial septum device
Autoři: F. Málek; M. Mates; T. Mráz; P. Neužil
Působiště autorů: Kardiocentrum, Nemocnice Na Homolce, Praha
Vyšlo v časopise: Kardiol Rev Int Med 2015, 17(3): 202-206
Kategorie: Kardiologická revue
Souhrn
Chronické srdeční selhání se zachovalou ejekční frakcí levé komory (HFpEF) je časté a terapeutické možnosti jsou v současné době omezeny. Za rozvoj příznaků je u pacientů s HFpEF odpovědný vzestup tlaku v levé síni. Bylo vyvinuto zařízení, které se zavádí katetrizační metodou s cílem snížit tlak v levé síni vytvořením trvalé mezisíňové komunikace. Použití tohoto zařízení by mohlo vést ke snížení rizika hospitalizací, zlepšit symptomy a kvalitu života u pacientů s HFpEF a pokročilou symptomatologií.
Klíčová slova:
srdeční selhání se zachovalou ejekční frakcí – levá síň – katetrizační léčba – mezisíňová kominukaceÚvod
Chronické srdeční selhání (CHSS) představuje zásadní a narůstající medicínský problém především kvůli významné nemocnosti, úmrtnosti a nákladům na péči. Historicky bylo srdeční selhání vnímáno jako synonymum snížené srdeční kontraktility a dilatace srdečních oddílů. Srdeční selhání se sníženou systolickou funkcí levé komory je nyní označováno jako HFREF (heart failure with reduced ejection fraction). V posledních desetiletích se ukazuje, že významná část nemocných s klinickým syndromem srdečního selhání má normální ejekční frakci levé komory (EF LK). Prevalence srdečního selhání s normální (heart failure with normal ejection fraction – HFNEF) nebo se zachovalou (heart failure with preserved ejection fraction – HFpEF) EF LK se odhaduje až na 50 %. Prognóza nemocných s HFNEF, resp. HFpEF je po hospitalizaci pro akutní srdeční selhání stejná jako u pacientů s HFREF: riziko úmrtí je 65 % během pěti let [1 – 5].
Hlavní neinvazivní diagnostickou metodou u srdečního selhání je echokardiografie s hodnocením systolické a diastolické funkce LK. HFNEF je typicky charakterizováno přítomností diastolické dysfunkce LK, která je ale přítomna i u pacientů s HFREF.
Léčebné strategie, které byly u pacientů s HFREF spojeny se snížením nemocnosti a se zlepšením prognózy, se ukazaly být u nemocných s HFpEF neúspěšné [6].
Terapie pomocí léků, které inhibují renin‑angiotenzin‑aldosteronový systém, nebyla u pacientů s HFpEF tak efektivní jako u HFREF [7 – 11].
Aktuální doporučení odborných společností se u pacientů s HFpEF zaměřují na léčbu komorbidit: účinná léčba arteriální hypertenze, odstranění ischemie myokardu a kontrola rytmu nebo tepové frekvence u nemocných s fibrilací síní [12,13].
Prognóza pacientů s HFpEF je podobně špatná jako prognóza nemocných s HFREF.
HFpEF je odpovědné za 50 % hospitalizací pro srdeční selhání, incidence HFpEF ve světě stoupá [5,14,15].
Příčiny a faktory odpovědné za rozvoj symptomů u HFpEF
Za rozvoj a přítomnost symptomů je u pacientů s HFpEF odpovědné zvýšení plnicích tlaků levé komory v klidu a při zátěži [16,17]. Zvýšení plnicích tlaků LK a tlaku v levé síni je spojeno se zvýšením rizika hospitaizace z kardiovaskulárních přičin a zvýšení tlaku v plicnici v zaklínění (PCWP) > 12 mm Hg je spojeno se zvýšením mortality [18,19].
K rozvoji symptomů, jako je dušnost, únavnost a retence tekutin, přispívá u HFpEF několik mechanizmů. Hlavním patofyziologickým faktorem je ale zvýšení tlaku v levé síni, který se přenáší do plicního kapilárního řečiště především při zátěži. Modelem zvýšení tlaku v levé síni a jeho následky je mitrální stenóza. Je známo, že u pacientů, kteří měli mitrální stenózu a současně defekt septa síní (Lutembacherův syndrom), byla progrese symptomů při mitrální stenóze pomalejší a méně významná [20]. A naopak. Uzávěr defektu septa síní u pacientů s diastolickou dysfunkcí LK bylo spojeno s rizikem náhlého vzestupu tlaku v levé síni a vznikem plicního edému [21].
Popis nové katetrizační metody léčby HFpEF
Na základě výše uvedených poznatků byl vytvořen společností DC Devices koncept mezisíňové komunikace s definovaným rozměrem s cílem snížit tlak v levé síni bez nežádoucího ovlivnění tlaku v pravé síni a volumového přetížení (Interatrial Septal Device System – IASD®, DC Devices Inc., Tewksbury, MA, USA). Krátkodobé pilotní výsledky studie s IASD byly publikovány v loňském roce [22].
Cílem pilotní studie s vytvořením malé mezisíňové komunikace bylo zjistit, zda u pacientů s HFpEF a se zvýšeným plnicím tlakem LK (PCWP) povede tato metoda k poklesu plnicích tlaků a odstranění nebo zmenšení dušnosti bez hemodynamických nežádoucích účinků. Dále bylo cílem zjistit, zda dojde ke snížení rizika následné hospitalizace pro srdeční selhání a zda dojde ke zlepšení kvality života. Tato pilotní studie předpokládala, že vytvoření mezisíňové komunikace katetrizační metodou bude pro pacienty bezpečné.
Do pilotní studie byli zařazeni pacienti s EF LK ≥ 45 % a alespoň jednou hospitalizací pro srdeční selhání v předchozím roce nebo s dlouhodobou symptomatologií odpovídající funkční třídě NYHA III/ IV. U pacientů s chronickou fibrilací nebo fluterem síní byla nutná dobrá kontrola tepové frekvence (≤ 90/ min v klidu) a stabilní farmakoterapie zahrnující diuretika alespoň dva týdny před zařazením do studie. Hlavním kritériem pro zařazení byl tlak v plicnici v zaklínění (PCWP) v klidu ≥ 15 mm Hg a nebo ≥ 25 mm Hg při zátěži (izometrická zátěž handgrippem).
Dalším kritériem pro zařazení byl průkaz poruchy diastolické funkce levé komory pomocí echokardiografie pomocí pulzní dopplerovské a tkáňové echokardiografie a průkaz zvětšení levé síně. Pacienti s anamnézou cévní mozkové příhody, hluboké žilní trombózy, plicní embolie, nemocní s nálezem trombu v levé síni, pacienti s významnou chlopenní vadou a jedinci s klidovou plicní arteriální hypertenzí a odhadem systolického tlaku v plicnici > 60 mm Hg nebyli do studie zařazeni.
IASD je implantát na bázi sloučeniny niklu (Nitinol) s rozměrem 19 mm, který se zavádí perkutánně do mezisíňového septa a vytváří permanentní komunikaci o velikosti 8 mm.
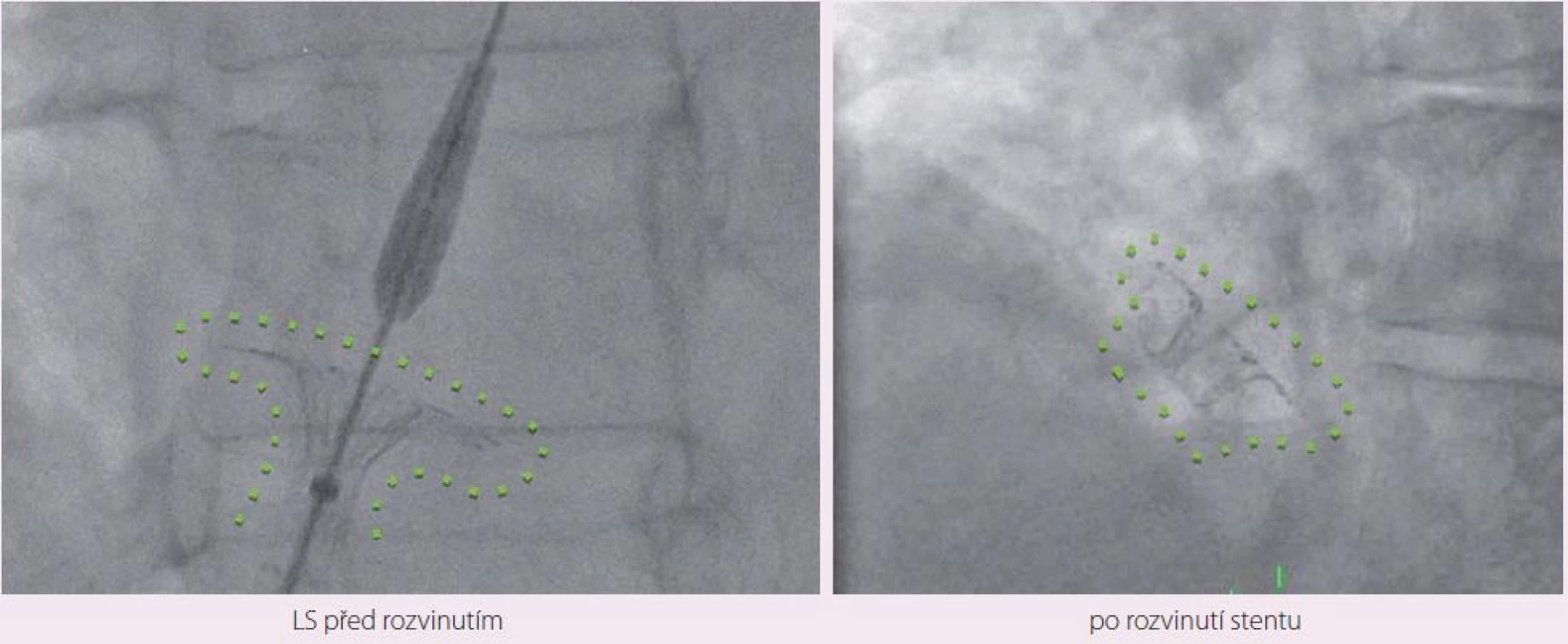
Návrh systému IASD vycházel z hemodynamického modelu, který hodnotil vztah mezi velikostí komunikace a snížením tlaku v levé síni [23]. Nové zařízení je koncipováno tak, aby se snížilo riziko vzniku trombu. K implantaci byl vyvinut také speciání katetr (obr. 1). Vlastní zákrok se provádí v lehké analgosedaci. Do pravé femorální žíly je zaváděň 16F zavaděč. Transseptální punkce je prováděna uprostřed fossa ovalis pod echokardiografickou kontrolou (transezofageální nebo intrakardiální echokardiografie). Vodicí drát se zavádí do horní levé plicní žíly. Zařízení se rozvine po vysunutí ze speciálního katetru nejprve na straně levé síně, poté na straně pravé síně. Správná pozice je ověřována echokardiograficky a skiaskopicky (obr. 2, 3).
Obr. 1. Systém SCD IASD<sup>®</sup> 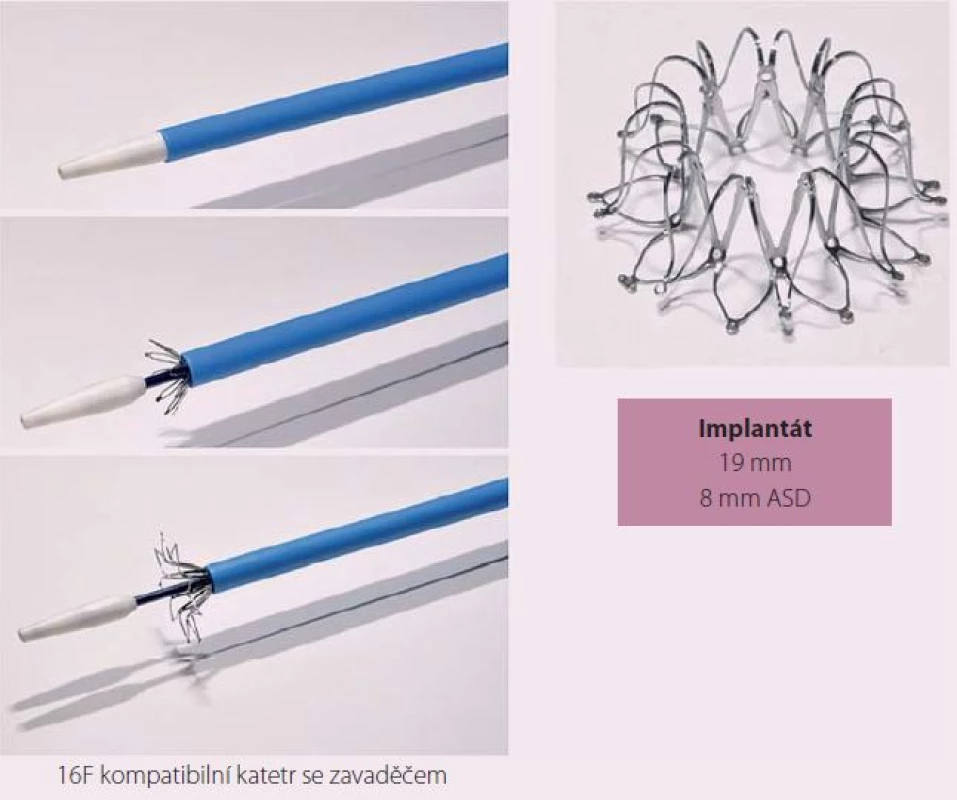
Obr. 3. 3D rekonstrukce IASD<sup>®</sup>. 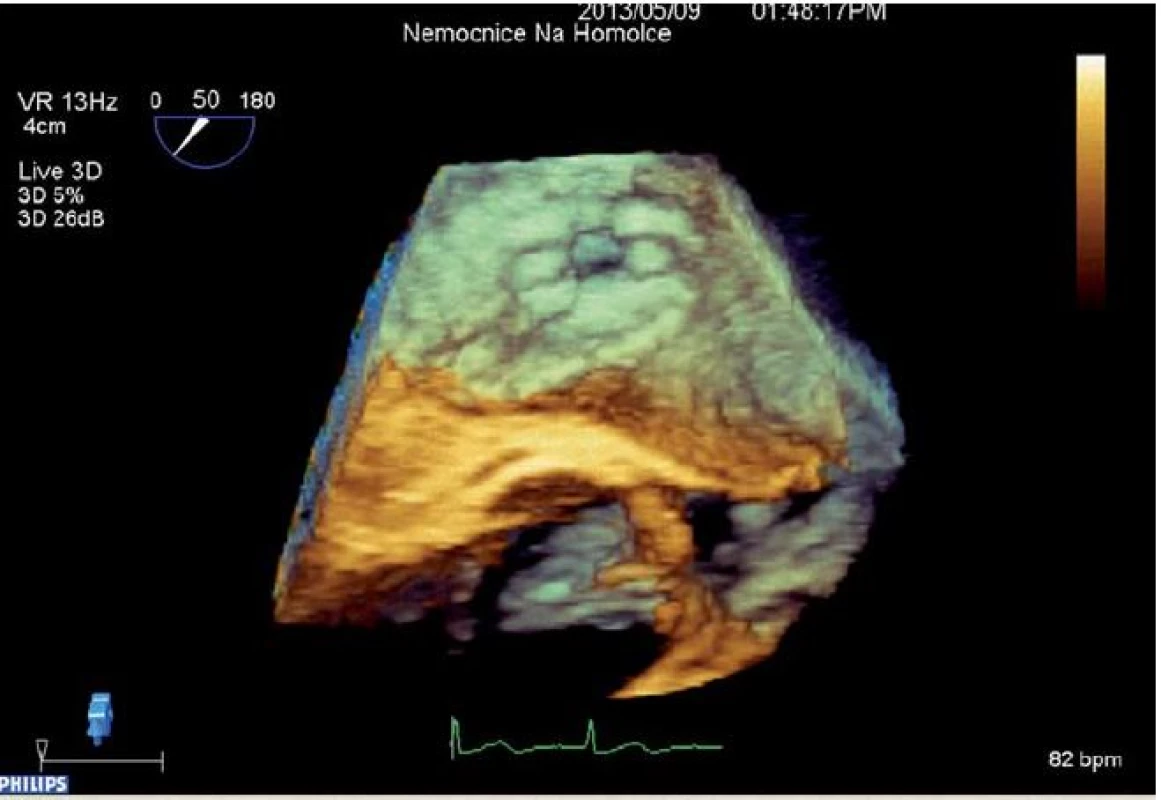
Po zákroku jsou pacienti léčeni kyselinou acetylosalicylovou v dávce 100 mg trvale a duální antiagregační terapií s klopidogrelem po dobu šesti měsíců. Pacienti s fibrilací síní zůstávají na chronické antikoagulační terapii. U pacientů je po výkonu nutná profylaxe infekční endokarditidy po dobu šesti měsíců.
Do multicentrické pilotní studie intervenční léčby HFpEF za pomocí systému IASD bylo zařazeno 11 pacientů, kteří splňovali kritéria pro zařazení. Z toho čtyři pacienti podstoupili zákrok v Nemocnici Na Homolce. Soubor tvořilo šest žen a pět mužů, průměrného věku 70 let a s průměrnou EF LK 57 % (tab. 1). Všichni pacienti měli pokročilou symptomatologii srdečního selhání.
Tab. 1. Charakteristika souboru (n = 11). 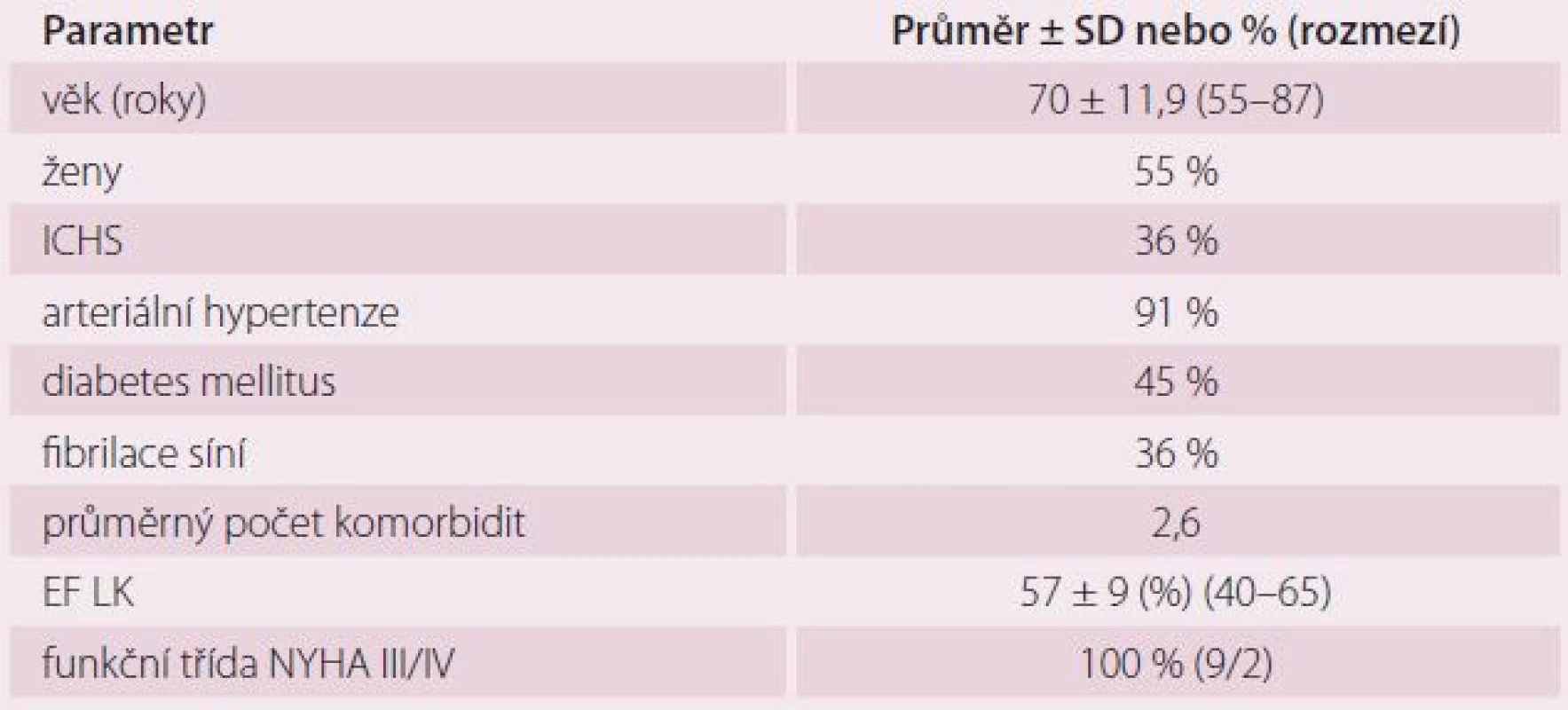
ICHS – prokázaná ischemická choroba srdeční, EF LK – ejekční frakce levé komory, SD – standardní deviace, NYHA – New York Heart Association Výsledky pilotní studie
Výsledky studie byly významné. PCWP během 30 – 90 dnů po implantaci IASD poklesl o 28 % z 19,0 ± 5 na 14 ± 3 mm Hg (p = 0,005). Tlak v pravé síni a systolický tlak v plicnici zůstaly na stejné úrovni jako před zákrokem. Zlepšila se symptomatologie (NYHA III/ IV u 100 % na 45 %; p = 0,044), vzdálenost šestiminutového testu chůze (6MWT) se prodloužila z 322 ± 151 m na 368 ± 123 m (p = 0,025) a došlo i ke zlepšení kvality života (skóre v dotazníku MLWHF (Minnesota Living With Heart Failure Questionnaire) se snížilo z 53 ± 17 na 18 ± 19; p = 0,005).
Symptomatické zlepšení přetrvávalo u většiny pacientů i jeden rok po výkonu. Přetrvával trend k prodloužení vzdálenosti při 6MWT a trend ke zlepšení kvality života, snížil se počet hospitalizací pro srdeční selhání (tab. 2).
Tab. 2. Jednoroční výsledky pilotní studie IASDTM. 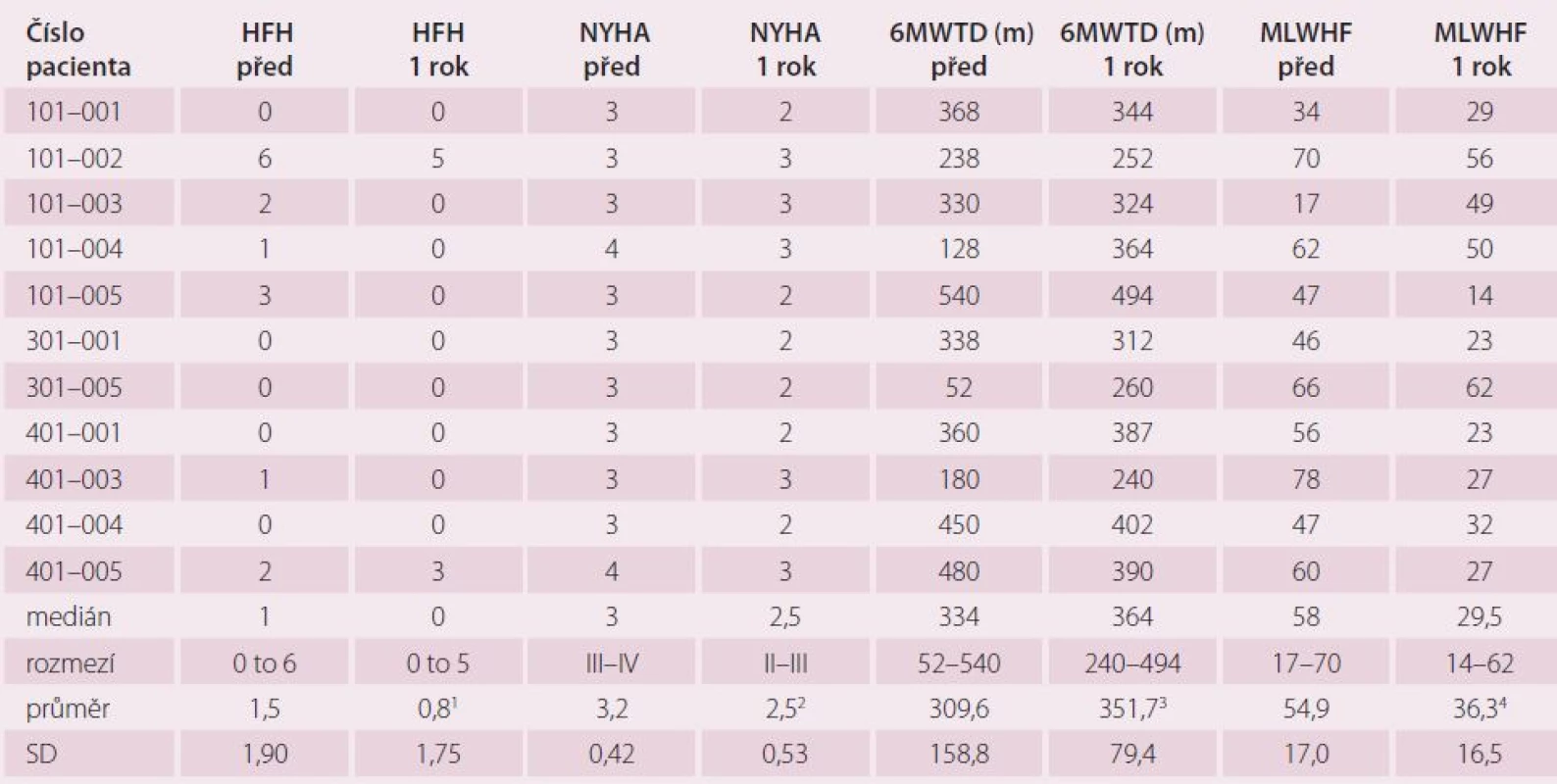
1 p – 0,030, 2 p – 0,017, 3 p – NS, 4 p – 0,057 HFH – hospitalizace pro srdeční selhání, 6MWT – vzdálenost šestiminutového testu chůze v metrech, MLWHF – Minnesota Living With Heart Failure (dotazník kvality života), SD – standardní deviace Průměrná dávka furosemidu se během roku zvýšila z 60 ± 66 mg/ den na 95 ± 143 mg/ den (NS) zejména díky zvýšení dávky u pacientů vyžadujících opakovanou hospitalizaci pro srdeční selhání. U žádného z pacientů se sinusovým rytmem (64 %) nedošlo během 12 měsíců ke vzniku nové fibrilace síní [24].
U žádného z pacientů nedošlo ke vzniku závažné kardiovaskulární příhody (MACE) během 12 měsíců. Bylo hlášeno 17 závažných nežádoucích příhod (SAE) u sedmi pacientů. Sedm z nich (41 %) se týkalo opakovaných hospitalizací téhož pacienta pro srdeční selhání, u kterého bylo zaznamenáno šest hospitalizací před implantací IASD a pět hospitalizací v průběhu sledování po výkonu. U jednoho pacienta s anamnézou bloku levého Tawarrova raménka došlo k rozvoji atrioventrikulární blokády III. stupně s nutností kardiostimulace. Pouze u jednoho z pacientů došlo ke komplikaci v průběhu výkonu: špatné uvolnění systému s nutností odstranění původního IASD přes vodicí drát a následně implantace nového systému.
Závěry
Nový princip léčby srdečního selhání se zachovalou ejekční frakcí levé komory pomocí interatriální komunikace přináší další možnost léčby vybraných nemocných s HFpEF a pokročilou symptomatologií srdečního selhání. Metoda se na základě výsledků pilotní studie jeví jako účinná a bezpečná. V současné době je metoda IASD ověřována v rámci multicentrické studie REDUCE LAP ‑ HF TRIAL (A study to evaluate the DC Devices, Inc. IASD™ System II to REDUCE Elevated Left Atrial Pressure in Patients with Heart Failure).
K zařazení pacientů do studie je použita metoda hemodynamického vyšetření při zátěži na stacionárním ergometru připevněném ke katetrizačnímu stolu se zavedením plicnicového katetru jugulární žilou. Hlavními kritérii pro zařazení je PCWP v klidu ≥ 15 mm Hg nebo ≥ 25 mm Hg při dynamické zátěži při tlaku v pravé síni < 14 mm Hg v klidu nebo < 20 mm Hg při zátěži. Na studii se podílí 25 center z Evropy, Austrálie a Nového Zélandu. Ke dni 16. 4. 2015 bylo do studie zařazeno 93 pacientů (cíl 100) a implantace IASD byla provedena u 50 nemocných. Nemocnice Na Homolce se podílí na studii REDUCE LAP deseti zařazenými pacienty (z toho u sedmi již proběhla implantace IASD). Hlavním sledovaným ukazatelem je dopad systému na snížení PCW v klidu a při zátěži za šest měsíců, změna VO2 max, změna vzdálenosti při 6MWT a změna kvality života. První výsledky studie REDUCE LAP můžeme očekávat v druhé polovině roku 2015.
Práce byla podpořena společností Corvia Medical, Inc. One Highwood Drive Tewksbury, MA 01876 USA a grantem institucionální podpory Nemocnice Na Homolce G140505.
Doručeno do redakce: 11. 5. 2015
Přijato po recenzi: 3. 7. 2015
doc. MUDr. Filip Málek, Ph.D., MBA
www.homolka.cz
filip.malek@homolka.cz
Zdroje
1. Bhatia RS, Tu JV, Lee DS et al. Outcome of heart failure with preserved ejection fraction in a population‑based study. N Engl J Med 2006; 355 : 260 – 269.
2. Redfield MM, Jacobsen SJ, Burnett JC Jr et al. Burden of systolic and diastolic ventricular dysfunction in the community: appreciating the scope of the heart failure epidemic. JAMA 2003; 289 : 194 – 202.
3. Fonarow GC, Stough WG, Abraham WT et al. Characteristics, treatments, and outcomes of patients with preserved systolic function hospitalized for heart failure: a report from the OPTIMIZE ‑ HF Registry. J Am Coll Cardiol 2007; 50 : 768 – 777.
4. Owan TE, Hodge DO, Herges RM et al. Trends in prevalence and outcome of heart failure with preserved ejection fraction. N Engl J Med 2006; 355 : 251 – 259.
5. Steinberg BA, Zhao X, Heidenreich PA et al. Trends in patients hospitalized with heart failure and preserved left ventricular ejection fraction: prevalence, therapies, and outcomes. Circulation 2012; 126 : 65 – 75. doi: 10.1161/ CIRCULATIONAHA.111.080770.
6. McMurray J, Ostergren J, Pfeffer M et al. Clinical features and contemporary management of patients with low and preserved ejection fraction heart failure: baseline characteristics of patients in the Candesartan in Heart failure‑Assessment of Reduction in Mortality and morbidity (CHARM) programme. Eur J Heart Fail 2003; 5 : 261 – 270.
7. Paulus WJ, van Ballegoij JJ. Treatment of heart failure with normal ejection fraction: an inconvenient truth! J Am Coll Cardiol 2010; 55 : 526 – 537. doi: 10.1016/ j.jacc.2009.06.067.
8. Massie BM, Carson PE, McMurray JJ et al. Irbesartan in patients with heart failure and preserved ejection fraction. N Engl J Med 2008; 359 : 2456 – 2467. doi: 10.1056/ NEJMoa0805450.
9. Cleland JG, Tendera M, Adamus J et al. The Perindopril in Elderly People with Chronic Heart Failure (PEP ‑ CHF) study. Eur Heart J 2006; 27 : 2338 – 2345.
10. Campbell RT, Jhund PS, Castagno D et al. What have we learned about patients with heart failure and preserved ejection fraction from DIG ‑ PEF, CHARM ‑ Preserved, and I ‑ PRESERVE? J Am Coll Cardiol 2012; 60 : 2349 – 2356. doi: 10.1016/ j.jacc.2012.04.064.
11. Pitt B, Pffefer MA, Assman SF et al. The TOPCAT Investigators. Spironolactone for Heart Failure with Preserved Ejection Fraction. N Engl J Med 2014, 370 : 1383 – 1392. doi: 10.1056/ NEJMoa1313731.
12. McMurray JJ, Adamopoulos S, Anker SD et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: the Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology – developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J 2012; 33 : 1787 – 1847. doi: 10.1093/ eurheartj/ ehs104.
13. Hradec J, Vítovec J, Špinar J. Souhrn Doporučených postupů ESC pro diagnostiku a léčbu srdečního selhání 2012. Cor Vasa 2013; 55: e25 – e40.
14. Solomon SD, Dobson J, Pocock S et al. Influence of nonfatal hospitalization for heart failure on subsequent mortality in patients with chronic heart failure. Circulation 2007; 116 : 1482 – 1487.
15. Lam CS, Donal E, Kraigher ‑ Krainer E et al. Epidemiology and clinical course of heart failure with preserved ejection fraction. Eur J Heart Fail 2011; 13 : 18 – 28. doi: 10.1093/ eurjhf/ hfq121.
16. Andersen MJ, Ersboll M, Bro‑Jeppesen J et al. Exercise hemodynamics in patients with and without diastolic dysfunction and preserved ejection fraction after myocardial infarction. Circ Heart Fail 2012; 5 : 444 – 451. doi: 10.1161/ CIRCHEARTFAILURE.112.967919.
17. Maeder MT, Thompson BR, Htun N et al. Hemodynamic determinants of the abnormal cardiopulmonary exercise response in heart failure with preserved left ventricular ejection fraction. J Card Fail 2012; 18 : 702 – 710. doi: 10.1016/ j.cardfail.2012.06.530.
18. Holland DJ, Prasad SB, Marwick TH. Prognostic Implications of Left Ventricular Filling Pressure With Exercise. Circ Cardiovasc Imaging 2010; 3 : 149 – 156. doi: 10.1161/ CIRCIMAGING.109.908152.
19. Dorfs S, Zeh W, Hochholzer W et al. Pulmonary capillary wedge pressure during exercise and long‑term mortality in patients with suspected heart failure with preserved ejection fraction. Eur Heart J 2014; 35 : 3103 – 3112. doi: 10.1093/ eurheartj/ ehu315.
20. Lutembacher R. De la stenose mitrale avec communication interauirulaier. Arch Mal Coeur 1916; 9 : 237 – 260.
21. Ewert P, Berger F, Nagdyman N et al. Masked left ventricular restriction in elderly patients with atrial septal defects: a contraindication for closure? Catheter Cardiovasc Interv 2001; 52 : 177 – 180.
22. Søndergaard L, Reddy V, Kaye D et al. Transcatheter treatment of heart failure with preserved or mildly reduced ejection fraction using a novel interatrial implant to lower left atrial pressure. Eur J Heart Fail 2014; 16 : 796 – 801. doi: 10.1002/ ejhf.111.
23. Kaye D, Shah SJ, Borlaug BA et al. Effects of an interatrial shunt on rest and exercise hemodynamics: results of a computer simulation in heart failure. J Card Fail 2014; 20 : 212 – 221. doi: 10.1016/ j.cardfail.2014.01.005.
24. Malek F, Neuzil P, Gustafsson F et al. Clinical outcome of transcatheter treatment of heart failure with preserved or mildly reduced ejection fraction using a novel implant. Int J Cardiol 2015; 187 : 227 – 228. doi: 10.1016/ j.ijcard.2015.03.198.
Štítky
Detská kardiológia Interné lekárstvo Kardiochirurgia Kardiológia
Článok vyšiel v časopiseKardiologická revue – Interní medicína
Najčítanejšie tento týždeň
2015 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Bezdrátová kardiostimulace – budoucnost nebo fikce?
- Novinka v intervenční terapii srdečního selhání se zachovalou ejekční frakcí levé komory
- Novinky v koronárních intervencích
- Mnohočetné postižení věnčitých tepen diagnostikované při pPCI pro STEMI: kompletní revaskularizace nebo konzervativní léčba. Studie Prague‑ 13.
- Erratum - Přímé versus nepřímé metody stanovení intenzity zatížení v kardiovaskulární rehabilitaci
- Farmakologická a nefarmakologická léčba fibrilace síní – současný pohled
- Léčebné postupy u námahové anginy pectoris
- Srdeční zástava a poresuscitační péče
- Komentovaná zkrácená verze evropských doporučení pro diagnostiku a management akutní plicní embolie z roku 2014
- Co přinesla nová evropská guidelines pro trvalou kardiostimulaci a srdeční resynchronizační léčbu (2013) v oblasti diagnostiky arytmií pomocí dlouhodobého monitorování EKG – současné technické aspekty a typy dlouhodobého monitorování EKG
- Fixní trojkombinace antihypertenziv a subklinické orgánové poškození – kazuistika
- Studie IMPROVE‑ IT u pacientů s diabetes mellitus
- Studie TECOS – efekt sitagliptinu na kardiovaskulární příhody u diabetes mellitus 2. typu
- Co zaznělo v HOT lines na ČKS 2015
- Co zaznělo na ESC 2015
- 500 transplantací srdce v Brně
- 25th European Meeting on Hypertension and Cardiovascular Protection, Milan 2015
- Zemřel prof. MUDr. Miloš Štejfa, DrSc., FESC28. 5. 1929– 20. 5. 2015
- Vzpomínka na prof. Miloše Štejfu
- Kardiologická revue – Interní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Srdeční zástava a poresuscitační péče
- Léčebné postupy u námahové anginy pectoris
- Bezdrátová kardiostimulace – budoucnost nebo fikce?
- Novinka v intervenční terapii srdečního selhání se zachovalou ejekční frakcí levé komory
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy