-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Revmatoidní artritida pro kardiologa
Rheumatoid arthritis for cardiologists
Rheumatoid arthritis is a systemic, inflammatory autoimmune disease, primarily affecting the musculoskeletal system, but also other systems which include the cardiovascular system. Current therapy of the disease is able to achieve remission, with a slowdown or prevention of significant damage in the vast majority of patients. The crucial moment seems a timely initiation of disease-modifying drugs and the achievement of sustained remission or at least low activity of the disease. The most significant cardiovascular aspect of rheumatoid arthritis is the acceleration of atherosclerotic changes as a result of general and rheumatoid-arthritis-specific risk factors. The cardiovascular risk in RA patients is about 1.5 times higher than in the general population and needs to be monitored and treated in a timely manner.
Key words:
rheumatoid arthritis – accelerated arteriosclerosis – therapy – biological therapy
Autoři: P. Bradna
Působiště autorů: II. interní gastroenterologická klinika a Subkatedra revmatologie katedry interních oborů LF UK a FN v Hradci Králové
Vyšlo v časopise: Kardiol Rev Int Med 2017, 19(4): 281-284
Souhrn
Revmatoidní artritida je systémové zánětlivé autoimunitní onemocnění postihující především pohybový aparát, ale i další systémy včetně kardiovaskulárního. Současná terapie choroby je u naprosté většiny nemocných schopna docílit remise aktivity se zastavením nebo zásadním zpomalením prognosticky významných postižení. Zásadním momentem se jeví včasné zahájení léčby chorobu modifikujícími léky a dosažení setrvalé remise nebo nízké aktivity nemoci. Z kardiovaskulárních aspektů jsou nejvýznamnější důsledky urychlení aterosklerotických změn působením klasických i pro revmatoidní artritidu specifických rizikových faktorů. Kardiovaskulární riziko je u nemocných revmatoidní artritidou asi 1,5× vyšší než u běžné populace a musí být monitorováno a včas léčeno.
Klíčová slova:
revmatoidní artritida – urychlená arterioskleróza – terapie – biologická léčba
Revmatoidní artritida (RA) je systémové zánětlivé onemocnění. Postihuje pohybový aparát a vede k výraznému snižování kvality života až po ztrátu soběstačnosti (obr. 1). Současně však RA postihuje řadu dalších orgánů a systémů, v neposlední řadě kardiovaskulární (KV) aparát. Právě mimokloubní postižení je převážně odpovědné za fakt, že RA zkracuje přežití [1]. Onemocnění se rozvíjí na geneticky disponovaném terénu, zejména HLA DR antigenů (sdílený epitop). Predisponujících genetických znaků je však rozpoznána celá řada. Nejvýznamnějším vlivem zevního prostředí přispívajícím k zvýšení rizika vzniku i destruktivního průběhu RA je kouření [2].
Obr. 1. Typický vzhled ruky u destruktivní revmatoidní artritidy. 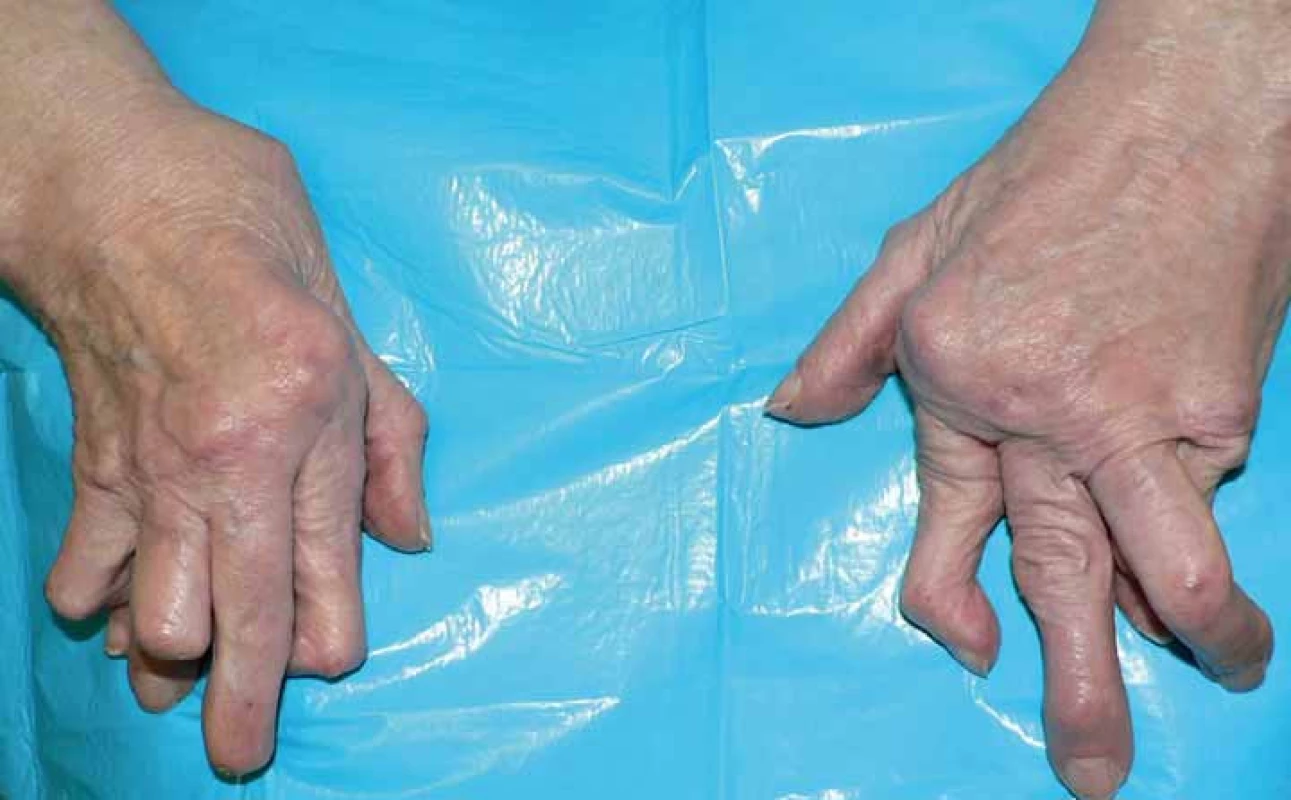
Podstatou patogeneze je autoimunitní reakce na abnormálně změněné proteiny vedoucí ke spuštění zánětlivé kaskády cytokinů a k destrukci postižených tkání. Prvotní změny přitom neprobíhají v pohybovém aparátu, ale nejspíše v plicích nebo gingivách (infekce bakterií Porfyromonas gingivalis) a k těmto procesům zřejmě dochází roky před prvními klinickými projevy. Uvolnění prozánětlivých cytokinů, zejména TNFα, IL-6 a IL-1, pak vede k projevům artritidy, vzniku zánětlivého infiltrátu (pannu) a k destrukci kloubní chrupavky a subchondrální kosti.
RA postihuje kolem 1 % populace v podmínkách vyspělých evropských zemí. Může začít v kterémkoli dospělém věku. Průběh onemocnění může jevit spontánní vzplanutí a ústupy aktivity, u značné části nemocných je progredující v čase. Zatímco zpočátku onemocnění závisí stupeň poškození na zánětlivé aktivitě, v pozdějších fázích na progresi strukturálních změn průkazných zobrazovacími metodami.
Heterogenita onemocnění se projevuje zejména mezi nemocnými s přítomnými autoprotilátkami (zejména revmatoidní faktory (RF) a protilátky proti citrulinovaným nebo karbamylovaným proteinům) a pacienty s negativními nálezy. Obě skupiny se zřejmě významně liší v patogenezi a jistě v odpovědi na terapii a rovněž v riziku postižení mimokloubních tkání.
Významná měnlivost klinického obrazu a absence patognomického nálezu či vyšetření nutí použít k diagnóze RA soubor kritérií obsahující klinické a laboratorní, popřípadě i RTG nálezy. Tato kritéria byla vygenerována jako klasifikační pro účely klinického výzkumu, jsou však široce používána v klinické diagnostice. Klasická kritéria ACR (American college of rheumatology) z roku 1984 [3] jsou i nadále platná, avšak obsahují pozdně vznikající změny, a tak mají nízkou senzitivitu v časných fázích nemoci, kdy je zahájení léčby nejúčinnější. Proto byl vyvinut současně používaný soubor kritérií ACR-EULAR (Evropská liga proti revmatizmu) 2010 (tab. 1) [4] posouvající diagnózu (a tím i začátek léčby) výrazně blíže k prvním klinickým projevům onemocnění.
Tab. 1. ACR/EULAR klasifikační kriteria 2010 pro revmatoidní artritidu. 
RF – revmatoidní faktory, ACPA – protilátky proti citrulinovaným peptidům, CRP a FW – reaktanty akutní fáze Klinické studie časných fází RA jasně prokázaly větší dlouhodobý efekt časně zahájené léčby. Nejpříznivější výsledky léčby byly prokázány při zahájení v prvních 3 měsících od vzniku kloubního otoku. Už zpoždění v řádu měsíců výsledky zhoršuje. První 3 měsíce od vzniku artritidy (tj. otoku kloubu) jsou označovány jako „window of opportunity“, kdy je u části nemocných šance zvrátit vznik chronického destruktivního onemocnění. Naším cílem by mělo být zastižení tohoto „okna“ u co nejvyššího procenta nemocných [5]. První 1 – 2 roky onemocnění bývají označovány jako „časná RA“ a jsou alternativním cílem, pokud už se nepodařilo léčit v prvních 3 měsících, což je někdy z různých důvodů obtížně dosažitelné.
Momentem, který rozhoduje o úspěšnosti terapie, je zahájení léčby chorobu modifikujícím lékem (disease modifyng antirheumatic drug – DMARD), a nikoli tedy například ibuprofenem. DMARDs snižují zánětlivou aktivitu onemocnění, zpomalují destrukci tkání, mohou vést k remisi choroby. Do skupiny DMARDs náleží klasická imunomodulační léčiva (csDMARDs), biologické léky zasahující prozánětlivé cytokiny (TNFα, IL-6) nebo aktivaci imunitních dějů (např. kostimulace T lymfocytů nebo anti-B lymfocytární protilátky) (tab. 2). Nejnověji se na trhu objevují blokátory nitrobuněčných kináz (tsDMARDs), zejména JAK-kinázy blokující nitrobuněčnou prozánětlivou signalizaci. Jejich efekt je obdobný antiTNF terapii, jsou však podávány per os. Řada léčiv zasahujících jiné prozánětlivé mechanizmy je v klinickém zkoušení.
Tab. 2. Biologické a cílené syntetické chorobu modifikující léky. 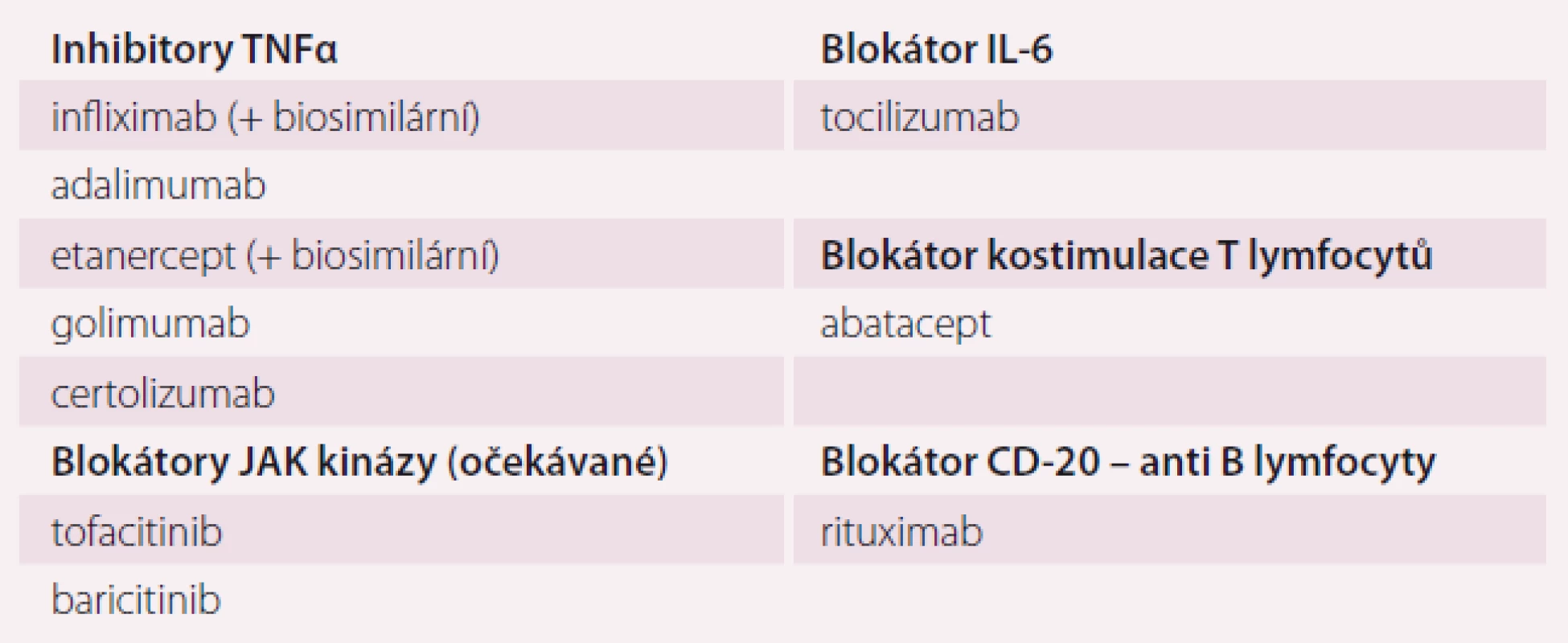
Jen symptomatický efekt mají klasická analgetika a nesteroidní antirevmatika (nonsteroid antiinflammatory drugs – NSAIDs), což jsou blokátory cyklooxigenázy 1 a 2 s krátkodobou protizánětlivou účinností. K jejich hlavním nevýhodám patří nežádoucí KV, gastrointestinální a renální projevy. Mezi symptomatickými léky a DMARDs stojí kortikosteroidy, které zřejmě mají mírnou chorobu modifikující aktivitu a jsou užívány zejména v kombinaci na počátku léčby, kdy lze profitovat z jejich rychlého protizánětlivého působení.
Základním DMARD RA je metotrexát. Jeho vliv na zpomalení kloubních destrukcí je významný, takže u časné RA mnohdy stačí k zábraně destruktivních změn kloubů. Používá se per os nebo s.c. v počátečním dávkování 10 – 15 mg 1× týdně a dávka se eskaluje k dosažení efektu až k 30 mg týdně, pokud se neobjeví vedlejší efekty. Z nich jsou nejvýznamnější dyspepsie, vzestup jaterních enzymů nebo cytopenie. Alternativou může být leflunomid s mírně častějšími vedlejšími účinky nebo sulfasalazin, v monoterapii méně účinný. Málo účinný, ale dobře snášený je hydroxichlorochin. Diskuze o výhodnosti monoterapie proti kombinaci DMARDs intenzivně probíhá.
Při selhání léčby csDMARDs při trvající aktivitě choroby a v přítomnosti negativních prognostických ukazatelů je indikována léčba biologickými preparáty. V současné době nejsou jednoznačná data, která by svědčila pro nadřazenost jednoho preparátu nebo skupiny nad jinou. Nejužívanější první volbou jsou blokátory TNFα, které disponují nejpočetnějšími a nejdelšími daty o účinnosti a rizicích. U novějších preparátů zpravidla probíhá dlouhodobé sledování. Na biologickou léčbu zareaguje pozitivně kolem 60 % nemocných, u nichž selhala léčba klasickými DMARDs. U takových nemocných, stejně jako u těch, kdy terapie zafungovala, ale po čase efekt vyhasl, lze použít jiný preparát se stejným nebo odlišným mechanizmem účinku (switch). K nežádoucím efektům patří zejména zvýšené riziko infekcí, u TNFα blokátorů zejména tuberkulózy, některých malignit nebo demyelinizačních procesů u disponovaných jedinců.
Detailní strategii léčby RA přináší postup obsažený v současných doporučeních EULAR pro léčbu RA [5], v ČR doporučení České revmatologické společnosti [6].
Revmatoidní artritida je v současné době příkladem onemocnění, u nějž je léčba vedena principem tzv. léčby k cíli – „treat to target“. Cílem je dosažení remise nebo alespoň nízké aktivity choroby stanovené pomocí komplexních parametrů aktivity. V Evropě se v současné době nejvíc používá parametr DAS28 vycházející z počtu oteklých, palpačně bolestivých kloubů z 28 typicky postižených a dále z celkového hodnocení stavu pacientem (na vizuální škále 1–10) a laboratorního ukazatele zánětu (sedimentace nebo CRP). Výpočet je matematicky komplikovaný a vyžaduje použití kalkulátoru. Jednodušším výpočtem (součet) ze stejných vstupních dat plus celkový dojem lékaře (1–10) vychází index aktivity SDAI (bez laboratorních dat CDAI). Spojený expertní tým evropské a americké revmatologické asociace definuje remisi pomocí hodnoty SDAI nebo systémem ano-ne pro počet oteklých a bolestivých kloubů, celkové hodnocení nemocného a hodnot zánětlivých ukazatelů (Booleánská definice remise). Ukázalo se totiž, že i část nemocných v remisi podle DAS28 rentgenologicky progreduje [7].
Prognóza RA
Dlouhodobá prognóza RA závisí především na postupu destruktivních změn kloubů a progresi extraartikulárního postižení. Zatímco u etablované choroby vede léčba csDMARDS léky, zejména metotrexátem, k zpomalení progrese destrukcí kloubů, při časném zahájení této terapie lze destruktivním změnám zabránit. Terapie blokátory TNFα a dle dosavadních poznatků i dalšími biologickými léky a blokátory buněčných kináz lze docílit zastavení destruktivních změn. Každopádně podmínkou tohoto chorobu blokujícího efektu je v obou případech docílení setrvalé remise (nebo alespoň nízké aktivity) choroby.
Kardiologické aspekty revmatoidní artritidy
Přímé postižení chorobným procesem
Postižení myokardu u RA je průkazné zejména pomocí pokročilých sonografických metod (speckle tracking ultrasonography) a MRI zobrazení. Převážně subklinické postižení může vést k vzniku arytmogenního substrátu se zvýšeným rizikem náhlé KV smrti. Tímto mechanizmem se spekulativně vysvětluje zvýšený výskyt náhlých úmrtí u nemocných RA [8]. Postižení perikardu je u RA velmi časté, sonografické nálezy prokazují přítomnost výpotku až u třetiny nemocných v průběhu choroby. Přestože existují i případy závažné konstrikční perikarditidy, naprostá většina perikarditid probíhá subklinicky a bývá náhodným sonografickým nálezem. Popisována je rovněž endokarditida s chlopenní vadou [9].
RA a urychlení aterosklerózy
RA i řada dalších systémových chorob pojiva (např. psoriatická artritida, ankylozující spondylitida, systémový lupus erythematodes, systémová sklerodermie) je provázena zvýšenou KV morbiditou a mortalitou.
Na urychlení aterogeneze se krom klasických rizikových faktorů podílí zejména dlouhodobá zánětlivá aktivita detekovaná především zvýšenou hladinou vysokosenzitivního CRP. Autoimunitní procesy, vlastní patogeneze RA, ovlivňují zánětlivou reakci v cévní stěně, apoptózu endotelií, expresi chemokinů a adhezních molekul. Významný se zdá podíl protilátek proti oxidovaným LDL částicím, heat shock proteinu 60 i nukleárním antigenům. Průkazně vyšší je KV riziko u nemocných s přítomností revmatoidních faktorů a/ nebo protilátek proti citrulinovaným proteinům. Vliv těchto specifických rizikových faktorů vede k doporučení násobit KV riziko zjištěné z klasických rizikových faktorů, např. SCORE koeficientem 1,5 (tedy obdobně jako u diabetu) [10].
Antirevmatika a KV efekty
Účinek antirevmatických léků na KV riziko je zpravidla ambivalentní. Zatímco u nesteroidních antirevmatik převažují negativní efekty, kortikosteroidy na jedné straně zhoršují lipidogram, naproti tomu však účinně snižují zánětlivou aktivitu.
Hydroxichlorochin má antiagregační a kardioprotektivní působení [11]. Metotrexát má podle současných poznatků významné kardioprotektivní efekty u nemocných RA a časné zahájení terapie je jednou z možností pozitivního ovlivnění KV rizik u nemocných s RA. Protektivní vliv mají blokátory TNFα, jakkoli mohou zvýšit hladinu LDL a v experimentu zhoršují manifestní srdeční selhávání. Neměly by se rovněž podávat v akutních fázích ischemických koronárních příhod.
Anti-TNFα terapie rovněž snižuje riziko manifestace diabetu. U blokátorů IL-6 a bDMARDs s jiným mechanizmem účinku zatím není diskuse o KV efektech ukončena.
KV léky a antirevmatická medikace
Blokátory HMG CoA zřejmě snižují zánětlivou aktivitu RA, i když výsledky klinických studií nejsou zatím jednoznačné. Podobný efekt se předpokládá u inhibitorů ACE a sartanů (krom antihypertenzního efektu). Podání nesteroidních antirevmatik, např. ibuprofenu, může blokovat pozitivní efekty aspirinu na agregaci destiček. KV léčba může rovněž ovlivnit riziko vedlejších účinků antirevmatik. Zde je třeba především zmínit úzkou vazbu toxicity metotrexátu na renální funkce. Z tohoto pohledu může být kritická i renální insuficience navozená intenzivní léčbou diuretiky. Z hlediska krvácivých operačních komplikací se může nepříznivě uplatnit antiagregační efekt nesteroidních antirevmatik, jejichž podávání je – v závislosti na jejich biologickém poločasu a síle ovlivnění cyklooxigenázy 1 – u plánovaných výkonů třeba včas přerušit [12].
Doporučení Evropské ligy proti revmatizmu k prevenci KV komplikací RA a dalších zánětlivých revmatických chorob
V roce 2017 byla publikována aktuální verze doporučení EULAR pro řízení rizik KV chorob u nemocných RA i dalšími systémovými revmatickými chorobami (ankylozující spondylitidou, psoriatickou artritidou) [13]. Podrobně a na základě extenzivního rozboru dostupných evidence-based pramenů projednávající jednotlivé principy a doporučení k sledování a ovlivnění KV morbidity a mortality u revmatických pacientů. Zastřešující („overarching“) principy potvrzují zvýšené riziko KV komplikací u revmatiků a zavazují revmatology k jeho sledování a používání zejména nesteroidních antirevmatik a kortikosteroidů v souladu se stavem evidence-based poznatků vyjádřených v doporučeních příslušných odborných společností. Z konkrétních doporučení vyjímáme:
- Trvale má být sledována a snižována zánětlivá aktivita choroby i vzhledem ke KV efektům aktivity choroby.
- KV riziko by mělo být stanoveno každých pět let nebo při větších změnách léčby.
- Ke stanovení rizik může být použito systému SCORE nebo platných národních doporučení.
- Výsledné KV riziko by mělo být násobeno koeficientem 1,5 vzhledem ke specifickým rizikům základní choroby.
- Lipidogram by měl být sledován v době stabilního stavu aktivity choroby; stačí stanovení při běžném režimu, nemusí být nalačno.
- Nemocní by měli být povzbuzováni ke zdravému dietnímu pohybovému režimu a k nekouření.
- Nesteroidní antirevmatika by měla být používána opatrně zejména u nemocných s prokázanou KV chorobou nebo jejím zvýšeným rizikem.
- Glukokortikoidy mají být používány v nejmenší nutné dávce a co nejkratší dobu potřebnou z hlediska léčby základní choroby.
- KV léčba má být vedena podle národních doporučení.
Diagnóza RA by měla kardiologa upozornit na zvýšené riziko KV komplikací a lékových interakcí.
Doručeno do redakce: 31. 10. 2017
Přijato po recenzi: 20. 11. 2017
doc. MUDr. Petr Bradna, CSc.
www.fnhk.cz
petr.bradna@fnhk.cz
Zdroje
1. Pinheiro FA, Souza DC, Sato EI. A study of multiple causes of death in rheumatoid arthritis. J Rheumatol 2015; 42(12): 2221 – 2228. doi: 10.3899/ jrheum.150166.
2. Sparks JA, Karlson EW. The roles of cigarette smoking and the lung in the transitions between phases of preclinical rheumatoid arthritis. Curr Rheumatol Rep 2016; 18(3): 15. doi: 10.1007/ s11926-016-0563-2.
3. Arnett FC, Edworthy SM, Bloch DA et al. The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis. Arthritis Rheum 1988; 31(3): 315 – 324.
4. Aletaha D, Neogi T, Silman AJ et al. 2010 Rheumatoid arthritis classification criteria: an American College of Rheumatology/ European League Against Rheumatism collaborative initiative. Ann Rheum Dis 2010; 69(9): 1580 – 1588. doi: 10.1136/ ard.2010.138461.
5. Smolen JS, Landewé R, Bijlsma J et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease--modifying antirheumatic drugs: 2016 update. Ann Rheum Dis 2017; 76(6): 960 – 977. doi: 10.1136/ annrheumdis-2016-210715.
6. Pavelka K, Vencovský J. Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy. Čes Revmatol 2010; 18 : 182 – 191.
7. Smolen JS, Breedveld FC, Burmester GR et al. Treating rheumatoid arthritis to target: 2014 update of the recommendations of an international task force. Ann Rheum Dis 2016; 75(1): 3 – 15. doi: 10.1136/ annrheumdis-2015-207524
8. Lazzerini PE, Capecchi PL, Acampa M et al. Arrhythmic risk in rheumatoid arthritis: the driving role of systemic inflammation. Autoimmun Rev 2014; 13(9): 936 – 944. doi: 10.1016/ j.autrev.2014.05.007.
9. Braun J, Krüger K, Manger B et al. Cardiovascular comorbidity in inflammatory rheumatological conditions. Dtsch Arztebl Int 2017; 114(112): 197 – 203. doi: 10.3238/ arztebl.2017.0197.
10. Oreská S, Tomčík M. KV riziko u revmatických onemocnění. Cas Lek Cesk 2016; 155(6): 324 – 332.
11. Franco AS, Iuamoto LR, Pereira RM. Perioperative management of drugs commonly used in patients with rheumatic diseases: a review. Clinics 2017; 72(6): 386 – 390. doi: 10.6061/ clinics/ 2017(06)09.
12. Rempenault C, Combe B, Barnetche T et al. Metabolic and cardiovascular benefits of hydroxychloroquine in patients with rheumatoid arthritis: a systematic review and meta-analysis. Ann Rheum Dis 2017. pii: annrheumdis-2017-211836. doi: 10.1136/ annrheumdis-2017-211836.
13. Agca R, Heslinga SC, Rollefstad S et al. EULAR recommendations for cardiovascular disease risk management in patients with rheumatoid arthritis and other forms of inflammatory joint disorders: 2015/ 2016 update. Ann Rheum Dis 2017; 76(1): 17 – 28. doi: 10.1136/ annrheumdis-2016-209775.
Štítky
Detská kardiológia Interné lekárstvo Kardiochirurgia Kardiológia
Článek Akutní selhání ledvin
Článok vyšiel v časopiseKardiologická revue – Interní medicína
Najčítanejšie tento týždeň
2017 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Nech brouka žít… Ať žije astma!
- Intermitentní hladovění v prevenci a léčbě chorob
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Antiarytmická léčba u fibrilace síní
- Upstream terapie u fibrilace síní, co nového?
- Úloha intrakardiální echokardiografie při katetrizační ablaci poruch srdečního rytmu
- Moderní pohled na elektrickou kardioverzi fibrilace síní
- Náhlá srdeční smrt a její diagnostika
- Ischemie a infarkt myokardu při poruchách nitrokomorového vedení na elektrokardiogramu
- Význam nových parametrů kontraktility a tepové práce pro hodnocení srdeční funkce a prognózy
- Kvalita života pacientů s dlouhodobou mechanickou srdeční podporou
- Moderní farmakologická léčba diabetes mellitus 2. typu
- Revmatoidní artritida pro kardiologa
- Akutní selhání ledvin
- Súčasné fixné antihypertenzné liekové dvojkombinácie v Slovenskej republike
- MUDr. Pavel Jerie se dožívá 90 let
- Srdíčkáři na Pálavě aneb V. setkání osob žijících s transplantovaným srdcem
- První Kurz srdečního selhání v Brně
- Kardiologická revue – Interní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Ischemie a infarkt myokardu při poruchách nitrokomorového vedení na elektrokardiogramu
- Súčasné fixné antihypertenzné liekové dvojkombinácie v Slovenskej republike
- Moderní farmakologická léčba diabetes mellitus 2. typu
- Akutní selhání ledvin
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



