-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Možná úskalí při laboratorním vyšetřování pacienta s hematologickým onemocněním
Possible pitfalls in laboratory examination of patient with a hematological disease
Aim:
To highlight the main aspects of the laboratory processing of blood samples from hematological patients in both preanalytical and analytical phases, point out to some interpretation pitfalls.Material and Methods:
A retrospective analysis of the routine laboratory results from the large consolidated laboratory with the regard to the diagnosis of hematopoietic disorders.Results:
Preanalytical and analytical phases of testing and interpretation of laboratory findings may be influenced by the patient’s hematological/hemato oncological diagnosis.Conclusion:
In hematological patients individualized approach to the interpretation of laboratory test results in the closest possible clinical context should be followed.Key words:
hematological patient, preanalytical phase, analytical phase.
Autoři: H. Brodská 1; K. Malíčková 1; M. Marková Šťastná 2; A. Kazda 1; H. Benáková 1; T. Zima 1
Působiště autorů: Ústav lékařské biochemie a laboratorní diagnostiky, 1. lékařská fakulta Univerzity Karlovy a Všeobecná fakultní nemocnice v Praze 1; Ústav hematologie a krevní transfuze Praha 2
Vyšlo v časopise: Klin. Biochem. Metab., 22 (43), 2014, No. 1, p. 11-15
Souhrn
Cíl práce:
Upozornit na hlavní specifika laboratorního zpracování vzorků krve hematologických pacientů v preanalytické a analytické fázi, poukázat na některá úskalí interpretace získaných výsledků.Materiál a metodika:
Retrospektivní analýza výsledků z rutinního laboratorního provozu velké konsolidované laboratoře s ohledem na diagnózu nemocí krvetvorby.Výsledky:
Preanalytická i analytická fáze vyšetření, jakož i interpretace laboratorních nálezů mohou být ovlivněny základní hematologickou/hematoonkologickou diagnózou.Závěr:
U hematologických pacientů je nutný individuální přístup k interpretaci výsledků laboratorních vyšetření v co nejužším klinickém kontextu.Klíčová slova:
hematologický pacient, preanalytická fáze, analytická fáze.Úvod
U pacientů s diagnózou hematologického onemocnění, a to jak benigního, tak maligního charakteru se při laboratorním vyšetřování nezřídka setkáváme se specifickými komplikacemi. Již samotný odběr krve bývá často velmi obtížný. U hematoonkologických pacientů se tato situace často řeší využitím odběru z portu či kanyly, zavedené z důvodu podání intravenózní terapie. Další komplikace se mohou objevit po odběru u pacientů s poruchou hemokoagulace, s přítomností patologických bílkovin v krvi, hyperviskózním syndromem, a/nebo nejčastěji s hemolýzou. Také výrazné hyperlipidémie a hyperbilirubinémie, které se druhotně u těchto pacientů často vyskytují, mohou zásadně ovlivnit laboratorní analýzy.
Vzhledem k základnímu onemocnění krvetvorby a podávané imunosupresivní léčbě jsou hematoonkologičtí pacienti významně ohroženi vznikem zánětlivých infekčních komplikací. Vlivem dalších faktorů, ke kterým patří například nefro - či hepatotoxický účinek chemoterapie anebo vysokých dávek antibiotik (často v kombinaci), se základní onemocnění nezřídka komplikuje selháváním orgánů a vznikem systémového, a to jak infekčního, tak neinfekčního zánětu. Specifickou skupinou jsou pacienti podstupující transplantaci hemopoetických buněk. Zde je incidence uvedených komplikací mnohonásobně vyšší. Proto je velice důležité tyto pacienty monitorovat a co nejrychleji reagovat na horšící se stav. Vzhledem k výše uvedenému je u hematologických pacientů nutný ještě přísnější a individuální přístup k interpretaci výsledků laboratorních vyšetření v co nejužším klinickém kontextu.
Cílem předkládané práce je upozornit na hlavní specifika laboratorního zpracování vzorků krve hematologických pacientů v preanalytické a analytické fázi a poukázat na některá úskalí interpretace získaných výsledků.
Preanalytická fáze
Hemolýza
U hematologických pacientů se lze často setkat s opakovanou hemolýzou vzorku krve, a to jak z důvodu ztíženého odběru jako takového, tak z důvodu nejrůznějších hemolytických stavů, tvořících významnou kapitolu mezi hematologickými onemocněními (in vivo přítomné intravaskulární hemolýzy, např. hemolytické anémie). Už slabá hemolýza (do 1g/l hemoglobinu) výrazně ovlivní v rozhodovacích mezích hodnoty LD a AST, a to zvýšením > 20 %, hodnoty kalémie může zvýšit až o 0,2 mmol/l. Naopak hodnoty ALP a AMS v rozhodovacích mezích o 10 % sníží. Silná hemolýza (5 g/l hemoglobinu) až o 100 % zvýší hodnoty LD, AST, K. Hodnoty ALT, HDL-cholesterolu zvýší až o 50 %, CK o 10 %. Naopak hodnoty ALP a AMS mohou být až o 100 % sníženy, GGT o 20 %. Proto je doporučeno rušit stanovení zmíněných analytů, a to bez rozdílu stanovení v séru, či plazmě [13]. Doporučení se mohou mírně odlišovat podle užité diagnostické soupravy.
Pseudohyperkalémie
Kromě samotné hemolýzy může docházet k mechanickému poškození či spontánnímu rozpadu dalších krevních elementů (různě podle charakteru onemocnění vyzrálých leukocytů) a ke zvýšení koncentrace draslíku, tzv. pseudohyperkalémii. My sami jsme u pacienta s chronickou lymfatickou leukémií zaznamenali opakované, po 1 hodině měřené hyperkalémie, které byly dle ošetřujícího lékaře bez klinického korelátu. V době níže uvedených náběrů měl nemocný 80 000 leukocytů v mikrolitru krve. Zkumavky se vzorky byly posílány do laboratoře potrubní poštou. Koncentrace draselných iontů byly analyzovány nepřímou potenciometrií na přístroji Synchron LX 20 Beckman Coulter, kde se kalémie stanovuje s využitím draselné iontově selektivní elektrody ve spojení s referenční elektrodou. Kontrolně byla kalémie změřena elektrodou v plné krvi na ABL acidobazickém analyzátoru, který byl umístěn přímo na oddělení. Podezření na pseudohyperkalémii jsme ve shodě s literaturou [1] potvrdili pokusem, kdy byl jeden vzorek donesen do laboratoře a druhý současně odebraný vzorek zaslán potrubní poštou. Už po centrifugaci byla patrná rozdílná barva plazmy obou vzorků, nejednalo se však o klasickou hemolýzu. Při měření kalémie v obou vzorcích na stejném analyzátoru byl rozdíl ve výsledcích markantní (Tabulka 1).
Tab. 1. Pseudohyperkalemia in patients with severe leukocytosis 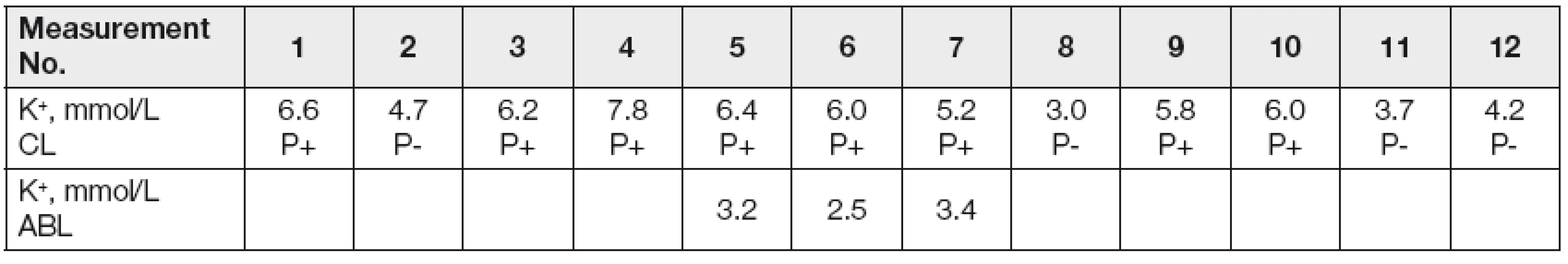
CL - central laboratory, measured on Synchron LX 20 Beckman-Coulter; ABL- bed-side acid-base analyzer; P+ pneumatic post transport; P- personal delivery to the laboratory Z uvedeného vyplývá, že u pacienta s enormní leukocytózou je vždy dobré zvážit možnost pseudohyperkalémie. Hematoonkologičtí pacienti vzhledem k základnímu onemocnění, možné chemoterapii a/nebo protimikrobiální léčbě mohou trpět klinicky významnou hypokalémií a výše popsaným mechanizmem může dojít k nežádoucímu překrytí skutečného laboratorního obrazu.
Hyperbilirubinémie
U hematologických pacientů se často setkáváme s hyperbilirubinémií, a to jak z důvodu zvýšené nabídky rozpadajícího se hemoglobinu, tak z důvodu poškození hepatocytů. Obstrukční forma hyperbilirubinémie není obvyklá. Při extrémních hladinách bilirubinu > 800 µmol/l rušíme stanovení cholesterolu, kyseliny močové a kreatininu, od hladin > 400 µmol/l nelze detekovat prealbumin a troponin I.
Chylozita séra
Zvýšení koncentrace lipidů (cholesterolu a triglyceridů), které často nacházíme u pacientů po transplantaci, vede ke zvýšené chylozitě séra. V chylózních vzorcích jsou opět omezeny některé analytické postupy, i když lze provést vyčeření séra a některé analýzy jsou poté proveditelné. Při silné chylozitě séra neprovádíme ani po vyčeření analýzy CHE, laktát, Mg, myoglobin, amylázu, PCT a prealbumin, po vyčeření lze stanovit glukózu, K, KM, kreatinin, LD, Na, bilirubin a ureu.
Kryoproteiny
U hematoonkologických nemocných s paraprotei-némií je třeba počítat s tím, že patologický monoklonální imunoglobulin se může chovat jako kryoglobulin. Kryoglobulinémie je charakterizována přítomností patologické bílkoviny, která při teplotě nižší než 37°C reverzibilně precipituje in vivo i in vitro (Obr. 1).
Fig. 1. Serum cryoglobulin in patient with paraproteinemia, <sup>©</sup> RNDr. Ivana Janatková, KIA ÚLBLD VFN a 1. LF UK 
Právě na kryoprecipitaci je třeba pomyslet při neobvykle nebo neočekávaně nízkých sérových hladinách imunoglobulinů, autoprotilátek, u symptomatických pacientů s nízkou hodnotou sedimentace erytrocytů nebo při neobvyklé fluktuaci počtu cirkulujících leukocytů. V takovém případě je třeba zásadně změnit preanalytickou fázi vyšetření a provést odběr a zpracování vzorku krve při teplotě 37°C.
Analytická fáze
Prealbuminémie
Během roku 2012 bylo na našem pracovišti provedeno 4388 analýz plazmatických hladin prealbuminu. V drtivé většině je toto vyšetření indikováno pro ozřejmění stavu aktuální proteosyntézy, tedy k diagnóze a monitoraci akutní malnutrice. Výsledky jsme rozdělili dle referenčních mezí. Není překvapením, že téměř všichni pacienti ze skupiny s hladinou prealbuminu < 0,20 g/l byli hospitalizováni na JIP různého zaměření. Překvapivé však bylo zjištění, že ze 191 náběrů od 67 pacientů s prealbuminem > 0,4 g/l bylo 60 pacientů (89 %) s hematoonkologickou diagnózou, povětšinou hospitalizovaných pro těžký stav na hematoonkologické JIP (Obr. 2).
Fig. 2 . Medians of serum albumin and prealbumin levels in different groups of diagnoses. 
Můžeme jen spekulovat, zda je v těchto případech plazmatická hladina prealbuminu (někdy až přes 1,0 g/l) výrazem paradoxně zvýšené proteosyntézy, zvýšeného leaku u hepatotoxického efektu některých farmak, anebo zda dochází k zatím nepopsané a nepoznané lékové interferenci.
Pro imunoturbidimetrické stanovení prealbuminu pomocí soupravy Synchron System žádná zvláštní omezení nejsou - snad jen silná chylozita séra. Ta nebyla v námi realizovaných měřeních nikde ve vzhledech materiálu popsána. Dle našich propočtů nekorelují hladiny cholesterolu ani triglyceridů s dynamikou změn sérových hladin albuminu a prealbuminu (Obr. 3).
Fig. 3 . Serum levels of cholesterol and triglycerides - correlation with prealbuminemia 
Vzhledem ke klinickému stavu pacientů a jejich hladinám albuminu v dotčených vzorcích nepředpokládáme, že by byla hladina prealbuminu obrazem enormní proteosyntézy. Hypoteticky je spíše možné uvažovat o řadě pravděpodobných interferencí se samotnou analýzou, či o kontaminaci - možnými kandidáty na interferující faktory jsou například lipidové složky parenterální výživy v AIO systému, cyklosporin, antibiotika nebo antimykotika. Dále je třeba vzít v potaz možný vliv dlouhodobého podávání kortikosteroidů popsaný v literatuře [9,10], či možný podobný efekt podání farmak s hepatotoxickým efektem, jako byl popsán u alkoholiků. Zde jsou vyšší hladiny prealbuminu vysvětlovány vytvořením leaku při akutní intoxikaci [11]. Efekt paradoxně vyšších hladin prealbuminu byl též popsán při opakovaném podání vyšších dávek cyklosporinu na animálním modelu, a to prodloužením poločasu [12].
Je pozoruhodné, že na rozdíl od jiných skupin diagnóz vykazují séra pacientů s hematologickými malignitami nezávislost sérových hladin prealbuminu na albuminémii. Logickým a nejčastěji se vyskytujícím stavem je totiž vzájemná korelace sérových hladin těchto proteinů (Obr. 4). V každém případě je třeba u těchto pacientů velké ostražitosti při hodnocení hladin prealbuminu - rozhodně je nezbytné posuzovat stav proteosyntézy v širším kontextu, nejen podle aktuální hladiny prealbuminu. Touto problematikou se nadále zabýváme v dalším klinickém výzkumu. Zde jsme uvedli pouze všechny uvažované příčiny, které se mohou na zdánlivě příznivých hladinách podílet.
Fig. 4 . Correlation of albumin and prealbumin serum levels in patients with hematooncological malignancies, comparison to other groups of diagnoses 
Průtoková cytometrie - jak vybrat klinicky užitečné vyšetření a vhodnou laboratoř
Imunofenotypizace leukocytů metodou průtokové cytometrie je v současné době nedílnou součástí diagnostiky, klasifikace a monitorování hematologických malignit. V posledním desetiletí se významně rozšířila nabídka a dostupnost protilátek a fluorochromů, pomocí kterých lze identifikovat řadu normálních buněčných populací, jakož i četné fenotypové aberace krevních elementů. Je proto nanejvýš žádoucí, aby byl dodržován mezinárodní konsenzus pro vyšetřování hematologických pacientů metodou průtokové cytometrie, který byl zformulován v roce 2006 v Bethesdě [2].
Jsou-li vzorky periferní krve a/nebo kostní dřeně těchto nemocných analyzovány v běžné laboratoři, která se nespecializuje na standardní hematoonkologické postupy, je výsledek vyšetření obvykle zavádějící. Běžná (“nemaligní”) kombinace monoklonálních protilátek a fluorochromů totiž může vést k arteficiálním výsledkům, k chybné kvantifikaci míry exprese daného antigenu, k interferenci fluorescence pozadí s měřením apod. Z uvedeného vyplývá, že analýza periferní krve hematoonkologických pacientů dle běžného CDC panelu pro imunomonitoring, obsahujícího T (CD3+) lymfocyty, B (CD19+) lymfocyty, pomocné T (CD3+CD4+) lymfocyty, cytotoxicko-supresorové T (CD3+CD8+) lymfocyty a NK buňky (natural killers) (CD3-CD16+56+), je obvykle ztrátou času i peněz.
U těchto pacientů nemá velkého smyslu ani provádění funkčních testů lymfocytů (např. detekce fagocytární aktivity polymorfonukleárů u nemocných s myeloidní leukémií, detekce intracelulární produkce cytokinů v lymfocytech u pacientů s lymfoidní leukémií) - falešně patologické hodnoty mohou být dány obtížným gatováním (výběr dané populace buněk) leukemických vzorků i atypickou reakcí maligních leukocytů na in vitro zpracování.
Postanalytická fáze
Systémové zánětlivé parametry
Diagnostika a monitorace akutního zánětu, a to jak infekčního, tak neinfekčního, lokálního či systémového, je u hematologických pacientů velice ztížena. Jeden ze základních ukazatelů, tedy počet a diferenciální rozpočet leukocytů, je velmi často naprosto zavádějící. K posunům oběma směry dochází též iatrogenně - od téměř absolutní leukopénie při transplantaci kostní dřeně, přes imunosupresí navozenou leukopénii, po leukocytózu jako následek podání bolusu kortikoidů. Z rutinně vyšetřovaných laboratorních markerů připadají tedy v úvahu jen CRP a PCT.
CRP je nejčastěji indikovaným markerem zánětu, velice dobře zánět identifikuje, vzhledem ke krátkému poločasu velmi dobře popisuje jeho dynamiku. Pomocí CRP však nelze rozlišit, zda se jedná o zánět lokální, či systémový, infekční či neinfekční. Tedy i přítomnost samotné malignity, která není momentálně provázena mikrobiální infekcí, může sama o sobě CRP elevovat. Není to však pravidlem u každého onemocnění. Nelze rozlišit ani tíži stavu. Toto lépe rozlišíme stanovením PCT. S výhodou používáme u pacientů v těžkém stavu k jejich monitoraci kombinaci obou markerů [6,8]. Tak například u reakce štěpu proti hostiteli (GVHD) může být CRP extrémně zvýšeno, zatímco PCT - není-li přítomná septická komplikace - zůstává v normě. PCT má oproti CRP ještě další schopnost rozlišení typu agens u septických komplikací. U původců G - bývají hladiny PCT významně vyšší než u G+ a mykotických afekcí [7]. Kombinaci vysokého CRP a lehce elevovaného PCT vídáme u mykotických sepsí. CRP je u všech typů zvýšeno a statisticky významně se neliší [3,4] (Tabulka 2).
Tab. 2. CRP and PCT levels in different groups of systemic infections according to hemoculture results [3] ![CRP and PCT levels in different groups of systemic infections according to hemoculture results [3]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/2318abf3d4beebeb5eb4b844cdb960d4.png)
Non-parametric Kruskal–Wallis one-way analysis of variance was used to examine whether samples originate from the same distribution. The Kruskal-Wallis test leaded to significant differences between different infectious groups only for PCT measurements. Při hodnocení hladin PCT je třeba dále zohlednit, zda není pacient v přípravě k transplantaci kostní dřeně a nedostává tedy antithymocytární globulin (ATG). Jeho působením dochází ke strmému úbytku leukocytů a pravděpodobně k uvolnění PCT z destruovaných buněk do oběhu. Dochází k jeho výrazné elevaci, která 2. až 3. den kulminuje a pak opět klesá bez klinického korelátu (Tabulka 3). Dynamika CRP je podobná, ale hodnoty jsou zvýšené oproti PCT minimálně. V naší práci [5] jsme zaznamenali hladiny PCT až 183 µg/l u neseptické pacientky.
Tab. 3. Dynamics of PCT a CRP during the anti-thymocyte globulin treatment [5] ![Dynamics of PCT a CRP during the anti-thymocyte globulin treatment [5]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/1d09a8a293d78a752fe2670a4e30f05c.png)
Hladiny imunoglobulinů
U nemocných s monoklonální gamapatií je nutné přistupovat s rozvahou k vyšetření sérových koncentrací imunoglobulinů metodou nefelometrie nebo turbidimetrie. Je třeba si uvědomit, že tyto imunochemické analýzy jsou ovlivněny řadou faktorů, a to zejména kvalitou či vlastnostmi použité specifické protilátky, ředěním biologického vzorku nebo kinetickými vlastnostmi použitého systému. Při kvantifikaci paraproteinu se může stát, že použitá specifická protilátka nemusí být schopna vazby na abnormální imunoglobulin, což může mít za následek falešně nízké hodnoty naměřených koncentrací. Je-li v séru přítomen paraprotein ve vysokém množství, může nadbytek antigenu (“antigen excess”) vést k chybným výsledkům. U vzorků s vysokou koncentrací monoklonálního IgG obvykle nelze počítat s tím, že součet koncentrací jednotlivých podtříd IgG 1 - IgG 4 bude odpovídat hladině celkového IgG. Naopak významná převaha jedné z podtříd IgG a chybění ostatních by mělo klinika upozornit na možnost paraproteinémie.
Závěr
V tomto krátkém přehledu jsme se pokusili upozornit na některá specifika laboratorního vyšetřování vzorků krve pacientů s hematologickou diagnózou. Ve všech uvedených případech, tedy ve všech třech fázích laboratorní diagnostiky, by laboratorní obraz bez klinické korekce vedl ke špatné diagnóze, následně ke špatné terapii a možnému poškození pacienta, nemluvě o zbytečné ekonomické zátěži. Všechny tyto příklady ukazují, že z úzké spolupráce klinika s laboratoří může pacient významně profitovat.
Seznam zkratek
AIO all-in-one
AMS sérová amyláza
ALP alkalická fosfatáza
ALT alaninaminotransferáza
AST aspartátaminotransferáza
ATG anti-thymocyte globulin
CK kreatinkináza
CRP C-reaktivní protein
GGT gamaglutamyltransferáza
GVHD Graft Versus Host Disease
HDL-chol HDL-cholesterol
CHE cholinesteráza
K draslík
KM kyselina močová
LD laktátdehydrogenáza
Mg hořčík
Na sodík
PCT prokalcitonin
T-bil celkový bilirubin
IQR interquartile range (medián)
Práce byla podpořena projekty RVO VFN 64165 a PRVOUK-P25/LF1/2.
Do redakce došlo 31. 12. 2013
Adresa pro korespondenci
MUDr. Helena Brodská, Ph.D.
Ústav lékařské biochemie a laboratorní diagnostiky
1. LF UK a VFN v Praze
U nemocnice 2
128 08 Praha 2
e-mail: helena.brodska@vfn.cz
Zdroje
1. Kellerman, P. S., Thornbery, J., M. Pseudohyperkalemia due to pneumatic tube transport in a leukemic patient. Am. J. Kidney Dis., 2005, 46(4), p. 746-8.
2. Stetler-Stevenson, M., Davis, B., Wood, B., Braylan, R. Bethesda International Consensus Conference on Flow Cytometry Immunophenotyping of Hematolymphoid Neoplasia. Cytometry B. Clin Cytom., 2007, 72B:S3.
3. Brodská, H., Malíčková, K., Adámková, V., Benáková, H., Marková Šťastná, M., Zima, T. Significantly higher procalcitonin levels could differentiate Gram-negative sepsis from Gram-positive and fungal sepsis. Clin. Exp. Med., 2013, 13(3), p.165-170.
4. Marková, M., Brodská, H., Malíčková, K., Válková, V. et al. Substantially elevated C-reactive protein (CRP), together with low levels of procalcitonin (PCT), contri-butes to diagnosis of fungal infection in immunocompromised patients. Support Care Cancer, 2013, 21, p. 2733-2742.
5. Brodská, H., Drábek, T., Malíčková, K., Kazda, A. et al. Marked increase of procalcitonin after the administration of anti-thymocyte globulin in patients before hematopoietic stem cell transplantation does not indicate sepsis: a prospective study. Crit. Care, 2009, 13(2), R37.
6. Reinhart, K., Meisner, M. Biomarkers in the critically ill patient: Procalcitonin. Crit. Care Clin., 2011, 27, p. 253-263.
7. Gao, H., Evans, T. W., Finney, S. J. Bench-to-bedside review: Sepsis, severe sepsis and septic shock – does the nature of the infecting organism matter? Crit. Care, 2008, 12(3), p. 213.
8. Pierrakos, Ch., Vincent, J. L. Sepsis Biomarkers: A review. Crit. Care, 2010, 14(1), R15.
9. Burtis, C. A., Aschwood, E. R., .Bruns, D. E., Tietz, T. Text Book of Clinical Chemistry and Molecular Diagnostics, Elsevier, Fifth edition, 2011.
10. Kinoshita, H., Zasuda, M., Mori, M., Zakushiji, F. Ele-vated prealbumin level following high thyroid hormones levels. Endocrinology Studies, DOI: 10.4081/es.2013.
11. Staley, M. J., Naidoo, D., Pridmore, S. A. Concentrations of transthyretin (prealbumin) and retinol-binding protein in alcoholics during alcohol withdrawal, Clin. Chem., 1984, 30, p. 1887.
12. Zeledon R., Ando Y., Asemuma K. et al: Effect of tacrolimus and cyclosporine on thranstyretin (TTR) metabolism in rats: A long term study. in Skinner M, Beck J. V.et al: XIth. International Symposium on Amyloidosis CRC Press 12/2010 pp 214-216
13. Guder W.D., Narayanan S., Wisser H., Zawta B. : Samples: From the Patient to the Laboratory. GITVERLAG 2nd edition 2001
Štítky
Biochémia Nukleárna medicína Nutričný terapeut
Článok vyšiel v časopiseKlinická biochemie a metabolismus
Najčítanejšie tento týždeň
2014 Číslo 1
-
Všetky články tohto čísla
- Možná úskalí při laboratorním vyšetřování pacienta s hematologickým onemocněním
- Možnost predikce závažnosti akutní pankreatitidy stanovením adipokinů (adiponektinu, FGF-21 a A-FABP) při přijetí
- Doporučení k využití nádorových markerů v klinické praxi
- Nová doporučení k diagnóze a klasifikaci chronických ledvinových onemocnění
- Odhad glomerulární filtrace u pacientů s diabetem
- Provádění všeobecného prenatálního screeningu vrozených vývojových vad
- prof. MUDr. Miroslav Engliš, DrSc.
-
eGFR a problémy interpretace rovnic CKD-EPI
Krátké sdělení - datové rozšíření a komentář k článku „Estimated glomerular filtration rate in diabetic patients“ autorů Šálek, T. a Ponížil, P.
- Klinická biochemie a metabolismus
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Doporučení k využití nádorových markerů v klinické praxi
-
eGFR a problémy interpretace rovnic CKD-EPI
Krátké sdělení - datové rozšíření a komentář k článku „Estimated glomerular filtration rate in diabetic patients“ autorů Šálek, T. a Ponížil, P. - Možnost predikce závažnosti akutní pankreatitidy stanovením adipokinů (adiponektinu, FGF-21 a A-FABP) při přijetí
- Provádění všeobecného prenatálního screeningu vrozených vývojových vad
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



