-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
23 případů metforminem indukované metabolické laktátové acidózy
23 cases of Metformin-induced Metabolic Lactic Acidosis in Patients treated with Metformin
Metformin is currently the cornerstone of treatment of Type-2 diabetes mellitus with obesity (DM2). Its most serious side effect is metabolic acidosis referred to as metformin-induced lactic acidosis (MILA). The aim of our paper was to provide an overview of patients with MILA treated in a hospital serving a catchment area of 90 000.
Overall, 23 cases of MILA were identified over a period of 18 years (0.2 a year per 1000 patients). Most patients were shown to have developed a mixed disturbance of acid-base balance (with other acidifying but, also, alkalizing disorders). Blood pH was on average low (pH 7.13), with the lowest and highest values being 6.81 and 7.47, respectively. Significant hypocapnia was present (average pCO2, 2.80 kPa), Lactate levels were 10.10 mmol/l (max. 19.8 mmol/l). Levels of BE were on average lowered (-19.25 mmol/l) as were bicarbonate levels (10.10 mmol/l). Levels of AG were high: 36.55 mmol/l. Patients’ partial pressure of oxygen was relatively high (pO2, 13.25 kPa). Patients were usually diagnosed to have pre-renal acute renal failure (ARF), whose causes were later fully corrected in most survivors. In 17 patients, we were able to track down their creatinine levels before the pre-renal ARF, which were significantly higher in two cases only. Levels of glycemia were on average higher (15.85 mmol/l), with hypoglycemia detected in only three cases.
The first significant disturbance and, probably, also the cause of MILA development in our patients was gastrointestinal tract involvement. While common infection – or the effect of metformin itself – caused vomiting and diarrhea, subsequent hypovolemia resulted in pre-renal ARF, which in turn led to an increase in metformin levels up to toxic values. Development of kidney failure was often unexpected and fast. The prognosis of patients with MILA was rather grim, with death rates reaching 48%. Administration of bicarbonates failed to improve the clinical status of most patients. The prognosis was poor in ventilated patients, with a 75 % death rate. Hypercapnia seems to be the underlying mechanism preventing the development of critical intracellular acidosis in MILA. The low respiratory volumes limiting hypocapnia appear to pose a risk in MILA patients. The most effective therapeutic option in our group of patient was elimination of metformin from the body (using hemodialysis or CVVHD).
Limitation of aerobic metabolism is likely not only to be an undesirable but, also, the main therapeutic effect of metformin. Decreased energy income, ATP deficiency affect the underlying mechanisms determining basic mechanism of cells. The resultant effect is increased influx of glucose into the cell enabling ATP formation (via anaerobic glycolysis). This mechanism explains why metformin decreases production of glucose by liver cells and restores glucose consumption by muscle cells from blood, even if not responding adequately to insulin-stimulated impulses. The unique kinetics of metformin enables limited auto regulation. At present, metformin belongs to the safest medications of its class. Nevertheless - if we are forced to take medication that reduces the effect of unwanted chronic energy surplus in T2DM treatment, the risk of development of the MILA persists.Keywords:
lactic acidosis; metformin; T2DM; Type-2 diabetes mellitus; AMPK, AMP-activated protein kinase; respiratory complex I.
Autoři: K. Kubát 1; M. Zbořil 1; M. Semrádová 1; V. Kaňák 2
Působiště autorů: Interní oddělení, Městská nemocnice v Litoměřicích 1; OKL, Městská nemocnice v Litoměřicích 2
Vyšlo v časopise: Klin. Biochem. Metab., 25, 2017, No. 2, p. 77-85
Souhrn
Metformin je v současné době základním lékem v léčbě diabetes mellitus 2. typu s obezitou (DM2). Jeho nejzávažnějším nežádoucím účinkem je metabolická laktátová acidóza (MLAC), v anglické literatuře nazývaná metformin-induced lactic acidosis (MILA). Tato práce si vzala za úkol podat přehled nemocných s MILA zachycených v nemocnici se spádovým územím 90 000 obyvatel.
Celkově bylo zachyceno 23 případů MILA během 18 let (0,2 za rok na 1000 léčených). U většiny nemocných byla zjištěna kombinovaná porucha acidobazické rovnováhy. Hodnota pH krve byla snížená (průměr pH 7,13), nejnižší 6,81, nejvyšší 7,47. Byla přítomna významná hypokapnie (průměr pCO2 2,80 kPa.). Laktátémie byla 10,10 mmol/l (maximum 19,8 mmol/l). Hodnoty base excess (BE) byly snížené (-19,25 mmol/l), podobně jako hodnoty hydrogenuhličitanů (9,43 mmol/l). Hodnoty anion gap (AG) byly vysoké: 36,55 mmol/l. Parciální tlak kyslíku (pO2) byl relativně vysoký (13,25 kPa). Obvykle bylo prokázáno prerenální selhávání. Hodnoty glykémie byly v průměru zvýšené (15,85 mmol/l), hypoglykémie byla zjištěna jen u tří nemocných.
První poruchou (a pravděpodobně příčinou vzniku MILA) bylo obvykle postižení gastrointestinálního traktu. Běžná infekce či samotný efekt metforminu vyvolaly zvracení a průjmy. Následná hypovolemie způsobila prerenální selhání, které zpětně vedlo ke zvýšení koncentrací metforminu na toxické hodnoty. Prognóza nemocných s MILA byla nepříznivá, úmrtnost byla 48%. Podání bikarbonátů u většiny léčených nevedlo ke zlepšení klinického stavu. Nepříznivá prognóza byla u ventilovaných nemocných, zemřelo 75 %. Hypokapnie zřejmě představuje základní mechanismus, který při MILA brání vzniku kritické acidózy intracelulárně. Nízké dechové objemy omezující hypokapnii jsou u nemocných s MILA zřejmě rizikové. Nejúčinnější léčebnou metodou ve sledovaném souboru bylo odstranění metforminu z organismu (hemodialýzou, či CVVHD).
Omezení aerobního metabolismu pravděpodobně není jen nežádoucí, ale i hlavní léčebný efekt metforminu. Snížený zisk energie, nedostatek ATP ovlivňuje základní mechanismy určující energetiku buněk. Konečný efekt spočívá ve zvýšení příjmu glukózy buňkou, což umožní tvorbu dalších molekul ATP anaerobně a zároveň i snížení hyperglykémie. Unikátní kinetika metforminu umožňuje do určité míry autoregulaci. Metformin dnes patří k nejbezpečnějším lékům ve své kategorii. Přesto – pokud jsme v léčbě DM2 nuceni užívat léky, které omezují vliv nežádoucího chronického přebytku energie – je nutné očekávat výskyt MILA i nadále.Klíčová slova:
laktátová acidóza, metformin, diabetes mellitus 2. typ, DM2, AMP-aktivovaná protein kináza, respirační komplex I.Úvod
Metformin je v současné době – vedle změn životního stylu – považován za základní prostředek v léčbě diabetes mellitus 2. typu s obezitou (dále DM2) [1]. Opakovaně bylo prokázáno, že léčba metforminem zlepšuje vyhlídky nemocných trpících diabetem, snižuje výrazně kardiovaskulární riziko a prodlužuje život diabetiků [2].
Další dvě látky ze skupiny biguanidů, které byly užívány v léčbě DM2 (fenformin a buformin), již nejsou v současné době k dispozici. Počet nemocných, kteří zemřeli na následky nežádoucích účinků těchto látek, byl natolik vysoký, že je jejich užívání v současné době zakázáno. Riziko metabolické laktátové acidózy (dále MLAC) při terapii biguanidy publikoval jako první v naší literatuře Rosival již v roce 1985 [3]. I na našem pracovišti bylo zachyceno 31 případů MLAC způsobených užíváním buforminu [4], podobně jako na jiných pracovištích v České republice [5]. Očekávali jsme, že po změně léčby z buforminu na metformin toto riziko odezní. Předpoklad, že metformin je zcela bezpečný preparát, se plně nepotvrdil. I nadále existuje určité riziko podmíněné rozvojem metabolické acidózy související s užíváním tohoto biguanidu [6].
Laktátová acidóza může být vyvolána u pacientů léčených metforminem touto samotnou látkou, ale také jinou příčinou: nedostatkem kyslíku, thiaminu, postižením jater a mnoha dalšími poruchami. Tyto stavy jsou označovány zkratkou MALA (metformin-associated lactic acidosis). Případy, kdy byla porucha pouze „asociována“ s podáváním metforminu, nejsou zařazeny. Uvádíme zde pouze případy, kdy porucha byla pravděpodobně vyvolána jen samotným vlivem metforminu. V anglické literatuře je používán termín metformin-induced lactic acidosis (dále MILA). Alarmující je fakt, že velký počet takto postižených osob i přes intenzivní léčbu umírá. Tato práce si dala za úkol vypracovat přehled nemocných zachycených v nemocnici se spádovým územím cca 90 000 obyvatel během posledních 18 let. Cílem bylo posoudit, jaké byly pravděpodobné vyvolávající příčiny rozvoje MILA a jaké byly nejčastější klinické projevy tohoto onemocnění.
Metody
Soubor byl vybírán průběžně z nemocných přijímaných v Městské nemocnici v Litoměřicích. Do studie byli zařazeni nemocní, kteří byli léčeni metforminem, u kterých byla prokázána zvýšená hladina laktátu (nad 5 mmol/l), kteří však současně neměli žádné jiné poruchy (choroby) zvyšující koncentraci laktátu. Kritériem pro zařazení byl závažný klinický stav a známky jednoduché či kombinované poruchy acidobazické rovnováhy (s odchylkami parametrů anion gap, či parametru residual anions, neměřených anionů). Hodnota pH krve nebyla určujícím kritériem pro zařazení nebo vyřazení ze souboru, rovněž tak hodnota BE.
Do souboru nebyli zařazováni nemocní po resuscitaci, pacienti s manifestními známkami dušení, s nízkým parciálním tlakem kyslíku (pO2), s nízkou saturací kyslíku. Zařazováni nebyli ani pacienti s významně sníženým množstvím přenášeného kyslíku v důsledku nedostatku funkčního hemoglobinu při anemii či vlivem otravy oxidem uhelnatým. Dále nebyli zařazováni nemocní s těžkým septickým šokem, s jaterním selháváním, či s hematologickými malignitami. Do hodnoceného souboru nebyli zařazeni nemocní s nedostatečnou dokumentací, u kterých nebylo k dispozici vyšetření ABR při příjmu nebo krátce po něm. Pokud bylo při prvním odběru provedeno hodnocení kapilární krve, byl použit výsledek kyslíkových parametrů z následného vzorku arteriální krve. Acidobazická rovnováha byla vyšetřena na přístroji Radiometer Copenhagen ABL 500 (do roku 2009) a Radiometer Copenhagen ABL 820 FLEX. Hodnota laktátémie byla vyšetřována fotometrickou metodou stanovení látkové koncentrace v plazmě analyzátorem Siemens ADVIA1800.
Všechny vzorky byly zpracovány v laboratoři. Hodnoty tO2c a BE byly stanoveny výpočtem analyzátoru acidobazické rovnováhy. Ionty byly hodnoceny potenciometricky pomocí iontově selektivní elektrody, rovněž analyzátorem ADVIA1800. V tabulkách je uvedeno datum vyšetření. Metodika zpracování a hodnocení vzorků odpovídá situaci příslušného data.
Výsledky
Celkově bylo během 18 let zachyceno 23 případů, kdy podávání metforminu bylo pravděpodobně jedinou příčinou vzniku poruchy metabolismu – MILA. V sledovaném období bylo v okresu léčeno metforminem na počátku přibližně 3000 osob a na konci přes 7000 nemocných [7]. Počet případů MILA byl tedy přibližně 0,2 případy na 1000 léčených za rok.
Klinické projevy
V klinickém obrazu dominoval stav bezvědomí (3 pacienti, 13,6 %), nebo delirantní stav. Postižení byli schopni říci pouze několik nesouvislých slov (16 pa-cientů, 69,6 %). V anamnéze – tam, kde to bylo možné od pacienta nebo dle doprovodu získat relevantní informace – bylo prakticky vždy uvedeno omezení příjmu potravy pro nauzeu (17 z 19 pacientů, což činilo 89,4 % nemocných, u kterých bylo možno získat anamnestické údaje). Obvyklý byl údaj o zvracení (17 z 18 pacientů, tj. 94 %), a průjmu (11 ze 17 pacientů, 64,7 %). K nejčastějším subjektivním pocitům patřil pocit výrazné dušnosti (13 z 19 pacientů, tj. 70 %), přes vysoké hodnoty saturace hemoglobinu kyslíkem a pO2. Objektivně bylo přítomno typické Kussmaulovo (intenzivní, zrychlené a prohloubené) dýchání. U řady nemocných nebyl klinikem údaj o hyperventilaci uveden, nicméně hodnoty vyšetření acidobazické rovnováhy (ABR) krve svědčí pro intenzivní dýchání u všech 23 nemocných. Průměrná denní dávka podávaného metforminu byla 1826 mg. U jedné pacientky nebyla zjištěna užitá dávka, předpokládáme jednorázové požití vysoké dávky ze zásob léku v úmyslu snížit svoji hmotnost. Celkově zemřelo velmi krátce po příjmu devět nemocných (39 %), později dva, celkově tedy v souvislosti s vývojem MILA zemřelo 11 pacientů (47,8 %). Ze skupiny léčených hemodialýzou (12 pacientů) zemřeli časně 4 (25 %), z ventilovaných zemřeli časně 3 ze 4 (75 %).
Laboratorní nálezy
Hodnoty pH krve byly v průměru snížené (pH 7,131), byly však v poměrně velkém rozptylu: od nemocných s těžkou acidémií až po nemocné s hodnotami pH v normě. Průměrná hodnota laktátémie byla 10,10 mmol/l. Hodnoty BE byly snížené (průměrná hodnota -19,25 mmol/l při normě 0 mmol/l). Podobně hodnoty hydrogenuhličitanů byly významně snížené (9,43 mmol/l). Oproti „normě“ laboratoře 24 mmol/l byly hladiny snížené o 14,57 mmol/l. Hodnoty AG byly vysoké: 37,12 mmol/l (při normě 16 mmol/l dle původního výpočtu), 37,88 mmol/l dle výpočtu korigovaného na efekt albuminu. U všech sledovaných (až na jednu výjimku) byla významná hypokapnie. Průměrný pCO2 byl 2,80 kPa. Parciální tlak kyslíku (pO2) byl u nemocných relativně vysoký: 13,25 kPa (vysoký, pokud bereme v úvahu, že se jednalo o nemocné s pocitem dušnosti, s rozvíjejícím se kardiopulmonálním selháním). Tato hodnota odpovídá výběru nemocných: do souboru nebyli zařazeni nemocní trpící hypoxií, u kterých bylo nutno považovat právě hypoxii za základní příčinu zvýšené hodnoty kyseliny mléčné. Průměrná natrémie byla 130,83 mmol/l při „normě“ laboratoře 140,5 mmol/l. Byla prokázána významná hypochlorémie (89,52 mmol/l). Při přepočtu na korigované chloridy je tato odchylka menší (96 mmol/l). V souboru byl zařazen jeden nemocný s extrémně vysokou hodnotou glykémie: 63,9 mmol/l. Výsledky hodnot minerálů u tohoto nemocného jsou ovlivněny hyperglykémií (hyperglykemická hyponatrémie), nicméně ne příliš významně: při vyřazení tohoto nemocného z hodnocení souboru byly průměrné hodnoty natrémie 131,5 mmol/l, chlorémie 90,5 mmol/l, AG 37 mmol/l. U nemocných bylo obvykle prokázáno renální selhávání. Průměrná hodnota hladin kreatininu byla 529 μmol/l. U 17 nemocných se podařilo zjistit hodnoty před vznikem poruchy, významně zvýšené byly ve dvou případech. U většiny nemocných byly fyziologické hodnoty prokázány ještě poměrně krátce před vývojem poruchy, průměrná kreatininémie byla 111,4 μmol/l. Po léčbě byla hodnota kreatininémie 143,57 μmol/l. Hodnoty glykémie byly v průměru zvýšené, 15,85 mmol/l. Po vyřazení pacienta s extrémně vysokou hyperglykémií byla průměrná hodnota 13,66 mmol/l. Hypoglykémie byla zjištěna překvapivě pouze u tří osob. Hladiny metforminu vyšetřeny u posledních čtyř nemocných: 9,1; 15,1; 19.7 a 44,5 μg/ml, průměr 22,1 μg/ml při normě 0,1 až 1,3 μg/ml. Jednotlivé nálezy u pacientů a referenční hodnoty místní laboratoře přibližují Tabulky a obr. 1 a 2.
Tab. 1. Basic Acid-Base Parameters 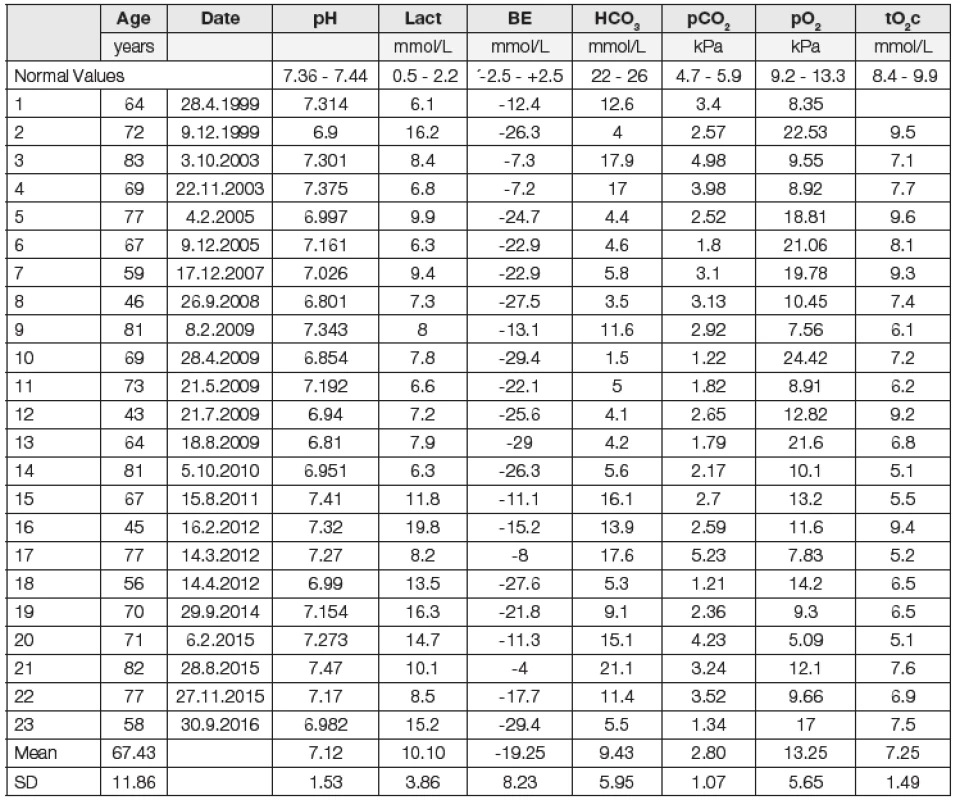
pH: (Arterial) Blood pH; Lact: Plasma Lactate Level; BE: Base Excess; HCO3: Plasma Hydrogen Carbonate Level; pCO2: (Arterial) Partial Carbon Dioxide Pressure; pO2: (Arterial) Partial Oxygen Pressure; Hb: Blood Hemoglobin Concentration; tO2c: Total Oxygen Content of the Arterial Blood Tab. 2. Basic Biochemical Data of the Examined Group 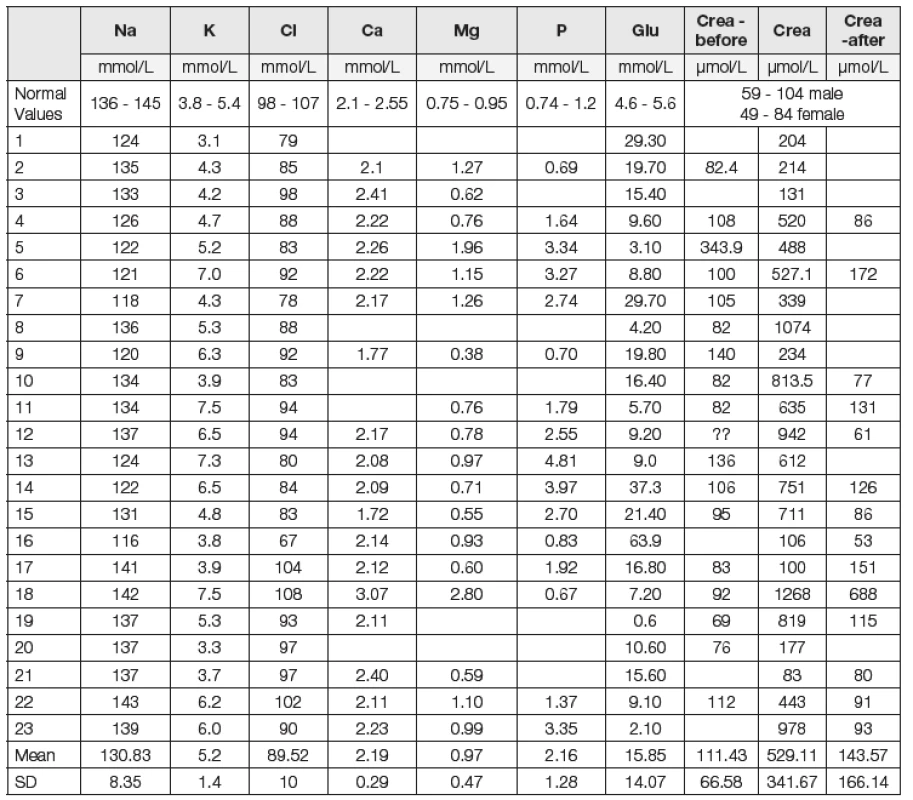
Glu: Plasma Glucose Level; Na: Plasma Sodium Level; K: Plasma Potassium Level; Cl: Plasma Chloride Level; Ca: Plasma Calcium Level; Mg: Plasma Magnesium Level; P: Plasma Phosphorus Level; AG: Anion Gap; Crea: Plasma Creatinine Level – Actual Day; Crea before: The Latest Value before; Crea after: The Value after Treatment of the MILA Fig. 1. Acid – base chart 
*Double Circle: mean value; Numbered points – values of the individual patients; NH: Normal Values; AMAc: Acute Metabolic Acidosis; ARAlk: Acute Respiratory Alkalosis; UMAc: Sustained Metabolic Acidosis; pCO2: Partial Pressure of the Carbon Dioxide Fig. 2. Relation between Plasma Sodium (P-Na+) and Chloride (Cl-) by Kazda and Jabor [30] ![Fig. 2. Relation between Plasma Sodium (P-Na<sup>+</sup>) and Chloride (Cl<sup>-</sup>) by Kazda and Jabor [30]](https://pl-master.mdcdn.cz/media/image/04f65874710771fccffc87e35a1fc6f2.png?version=1537792033)
*Points: Measured Values; Double Circle: Mean Value; Symbol „N“ denotes Normal Range; P-Cl Measured: Measured Plasma Chloride Level; P_Na Measured: Measured Plasma Sodium Level; P_Cl Corrected: Corrected Chloride (to Ideal Plasma Sodium) Diskuse
Gastrointestinální postižení: možná příčina MILA
Ve většině případů bylo v popředí postižení gastrointestinálního traktu (dále GIT), a to zvracení či průjmy [5]. Je známo, že metformin se významně kumuluje v GIT [8]. Může významněji omezovat energetický zisk buněk GIT [9]. Běžná infekční gastroenteritida nebo vlastní nežádoucí účinek léku na GIT stály pravděpodobně na začátku postižení u většiny našich pacientů. Následoval řetězec, respektive kruh dalších poruch – omezení průtoku ledvinami a prerenální selhání. Postižení ledvinných funkcí zpětně zhoršovalo projevy postižení GIT, nauzeu, zvracení. Obvyklé bylo postižení kardiovaskulárního systému, pokles arteriálního tlaku, rytmové poruchy. Poslední v řetězci nastává zhroucení funkce orgánů, které pro svoji činnost vyžadují vysoký příjem energie. Pozorovali jsme známky postižení CNS – zmatenost, letargii, bezvědomí. Stav zmatenosti byl v některých případech poměrně bizarní – neschopnost porozumět jednoduché větě, opakování několika slov. Život nemocných, kteří zemřeli, ukončilo těžké, obvykle rychle progredující kardiální selhání. Rozvoj těžké hypotenze byl varovným signálem, odpověď na katecholaminy byla nízká. Při pitvě bylo prokazováno kardiopulmonální selhání, aniž by bylo prokázáno čerstvé postižení koronárních tepen. Stav jsme proto hodnotili jako zhroucení energetického metabolismu, selhání srdce při přetrvávajícím zásobení kyslíkem a při zachovaném průtoku krve myokardem.
U sledovaných pacientů v tomto souboru byla prokázána renální insuficience, ta však byla obvykle nově vzniklá, obvykle charakteru prerenálního selhání. U nemocných, kteří přežili, byla v naprosté většině případů reverzibilní. Byla tedy vyvolána prerenálně, ztrátami tekutin při jejich nedostatečném příjmu, při zvracení či průjmech.
Nálezy acidobazické rovnováhy při MILA – kombinované poruchy ABR
Celkovou poruchu acidobazické rovnováhy (ABR) v souboru lze charakterizovat slovy: acidémie, převažující ustálená metabolická acidóza. Při podrobném rozboru jednotlivých odchylek je nutné blíže specifikovat termíny. Byla prokázána kombinovaná porucha ABR, metabolická laktátová acidóza kombinovaná s diluční acidózou, dále acidózou při renálním selhávání, dále komplikovaná hypochloremickou alkalózou a dalšími alkalizujícími poruchami, plně respiračně kompenzovaná významnou hypokapnií.
U nemocných byly klinické známky hypovolémie a dehydratace. Nebyla však prokázána hypernatrémie. Ztráty minerálů byly tedy obvykle vyšší než ztráty vody. Průměrná odchylka natrémie byla cca -9,67 mmol/l. Vliv diluce byl cca 3,07 mmol/l, rovněž ve smyslu acidifikující odchylky. Vliv odchylky rozdílu koncentrace základních tří silných iontů (Na+K)-Cl byl naopak ve smyslu alkalizace, a to o +4,05 mmol/l. Vliv hypochlorémie byl cca 13 mmol/l (při normě udávané v daném období). Vliv všech souběžných metabolických poruch kromě hyperlaktátémie byl přibližně 9,15 mmol/l ve smyslu acidifikace, tedy přibližně stejně významný jako vliv samotné zvýšené hladiny anionu kyseliny mléčné (který činil 10,1 mmol/l).
Intoxikace metforminem způsobuje řadu poruch ABR: vliv přebytku kyseliny mléčné způsobuje metabolickou acidózu (MAc). Souběžná metabolická acidóza při renálním selhání byla v našem souboru při-bližně stejné významnosti. Snížená koncentrace natria a relativní přebytek vody způsoboval další acidifikující odchylku, zde pravděpodobně s menší významností. Gastrointestinální postižení, zvracení a těžší průjmy s hypochlorémií a s hypokalémií ovlivňující ledviny způsobují naopak metabolickou alkalózu (MAl). Při hodnocení možných odchylek ABR bychom neměli zapomínat na vliv dehydratace. Pokud by byla natolik závažného stupně, že by již znemožňovala dostatečný průtok krve, měla by za následek – na podkladě šokového stavu – další produkci kyseliny mléčné.
Souběžné poruchy, MAc a MAl, mají protichůdný vliv na hodnoty pH a BE. Významná hypokapnie měla výrazný alkalizující vliv. V souboru jsme v průměru nalezli významné snížení pH. U jednotlivých případů však byly hodnoty velmi rozdílné, významně snížené, ale i zvýšené. Je proto otázkou, zda by hodnoty pH krve či BE měly být považovány za základní kritéria pro diagnostiku MILA. Je pravděpodobné, že samotná hladina metforminu a hladina plazmatického laktátu přinášejí informaci s vyšší výpovědní hodnotou.
Problém incidence MILA
Rozvoj MILA je v současné době považován za vzácné onemocnění. Literárně udávaný průměr incidence MILA [31] je asi desetinásobně nižší, než byla skutečná incidence ve sledované spádové oblasti. U většiny postižených ve sledovaném souboru nebyly známy jasné kontraindikace podávání metforminu ještě krátkou dobu před rozvojem MILA. U 22 postižených došlo ke vzniku nežádoucích účinků při užívání běžné dávky, jedna nemocná (trpící těžkou obezitou a schizofrenií) pravděpodobně požila velké množství léku ve snaze o rychlé zhubnutí. Rozdíl od literárních údajů si vysvětlujeme cíleným vyhledáváním dané poruchy a velmi dobrou spoluprací laboratoře s klinickým pracovištěm.
Současné možnosti léčby MILA
Léčba podáváním hydrogenuhličitanu sodného (takzvaného „bikarbonátu“) nebyla většinou úspěšná. Stav zlepšilo provedení hemodialýzy či kontinuální venózní dialýzy (CVVHD), přežilo 75 % léčených. Tento fakt svědčí pro hypotézu, že samotná úprava ABR krve či extracelulární tekutiny neřeší hlavní poruchu, která ohrožuje život nemocného, tedy ztrátu produkce energie na úrovni mitochondrie, na úrovni produkce ATP. Teprve odstranění metforminu z organismu umožní opětný zisk energie, a tím i úpravu ABR – v první řadě intramitochondriálně, intracelulárně, následně i v krvi. Napojení na ventilátor s použitím nízkých dechových objemů nebylo přínosné, tito nemocní zemřeli. Domníváme se, že zhoršení stavu nastalo vlivem odstranění (fyziologicky vyvolané) hypokapnie, a tedy vlivem nežádoucí změny pH intracelulárně. Nastavení ventilátoru na parametry ochraňující plíce znemožnilo hyperventilaci. Odstranilo tak hypokapnii, která jako jediná omezovala acidifikující vliv laktátu intracelulárně. Bude nutno provést další studie, které zhodnotí vliv umělé ventilace respektující potřebu udržování hyperventilační hypokapnie u nemocných s ustálenou metabolickou acidózou.
Rozdíly koncentrace metforminu v plazmě a v buňkách
V některých přehledových studiích nebyla popsána zvýšená hladina laktátu po podávání metforminu [11]. Jiné práce naopak prokazují výrazný vzestup tvorby kyseliny mléčné [12]. Rozdíly mezi výsledky jednotlivých autorů vznikají především vlivem odlišné metodiky pokusů. Experimentální práce z poslední doby dokazují, že metformin, podobně jako jiné biguanidy (fenformin a buformin), prokazatelně a významně omezuje aerobní metabolismus. Blokuje komplex 1 respiračního řetězce [12-14]. Odlišné výsledky však získáváme u vzorků s nepoškozenými buňkami či mitochondriemi a u vzorků, ve kterých byla poškozena (zprůchodněna) membrána buněk nebo mitochondrií.
U léčených osob se dle literárních údajů obvyklé hladiny pohybují v rozmezí 10 až 20 μmol/l. U nás uváděné doporučené rozmezí hladin metforminu dle Ústavu soudního lékařství toxikologie Všeobecné fakultní nemocnice v Praze je 0,1–1,3 μg/ml, neboli 0,8–10 μmol/l.
Takto nízké koncentrace nijak významně neovlivňují metabolické děje přímo v mitochondriích. Nejsou účinné při hodnocení vzorků tkání, ve kterých byly vnitřní membrány mitochondrií poškozeny ultrazvukovými vlnami. Inhibice respiračního komplexu I homogenátů kosterního svalu byla prokázána až po dosažení extrémně vysoké koncentrace metforminu, a to 30 mmol/l [14]. Podobně vysoká koncentrace metforminu (5 až 20 mmol/l) byla zapotřebí k ovlivnění metabolismu jaterního homogenátu [12]. Zcela jiné výsledky však byly získány při hodnocení vlivu metforminu na nepoškozené, intaktní mitochondrie. Zde byly koncentrace metforminu potřebné k omezení aerobního metabolismu mnohonásobně – asi tisícinásobně – nižší, než byly koncentrace potřebné na ovlivnění submitochondriálních partikulí. Efekt závisel na délce expozice mitochondrií roztoku s metforminem. Dle práce Owena et al. bylo dosaženo po 24 hodinách při koncentraci pouhých 50 μmol/l metforminu inhibice mitochondriální oxidace malátu a glutamátu o 12,6 %, po 60 hodinách bylo dosaženo inhibice o 29,4 % [12]. Při zvyšování koncentrace metforminu a prodloužení doby expozice se inhibice respirace významně zvyšovala: v práci Owena byla při koncentraci 100 μmol/l 25,8 % po 24 hodinách, a dokonce 37 % po 60 hodinách [12].
Rozdíly lze vysvětlit na základě aktivního přenosu metforminu do mitochondrií. Metformin je v tělesných tekutinách v ionizované formě; nemůže proto volně procházet přes membrány. Na rozdíl od buforminu či fenforminu, které přecházejí díky své lipofilitě snadno a neřízeně [12], je jeho přenos na membránách aktivně řízen. Metformin je do buněk přenášen transportéry organických kationů [10] v závislosti na rozdílech pH. Metformin se v roztoku chová jako kladně nabitý kation. Vlivem svého náboje je postupně aktivně koncentrován v mitochondriální matrix. Vzhledem k náboji Δ ψ na vnitřní membráně mitochondrií, cca –180 mV, je předpokládán postupný vzestup jeho koncentrace v matrix mitochondrií až na tisícinásobek koncentrace v plasmě [12, 14]. K plnému rozvoji jeho efektu je proto zapotřebí delšího časového úseku. V mitochondrii metformin omezuje metabolické děje. Omezením přenosu elektronů a protonů přes vnitřní membránu mitochondrií však významně klesá membránový potenciál [ze –175 mV na –141 mV [13]], což následně omezuje aktivní koncentrování metforminu do matrix mitochondrie. Probíhá tedy záporná zpětná vazba: zvýšený efekt metforminu omezuje další přenos této látky přes mitochondriální membránu.
Odlišný vliv inzulinu a biguanidů na hyperglykémii
Ačkoli je metformin v léčbě DM2 užíván již řadu let, přesný mechanismus jeho působení dosud není plně vysvětlen. Obvykle udávaný účinek je popisován slovy „zlepšení inzulínové sensitivity“ respektive „potlačení inzulínové rezistence“ [15, 16]. Tyto názory vycházejí z faktu, že díky metforminu dochází v organismu ke snížení hladiny glykémie. V jednotlivých podrobnostech se však vliv metforminu a inzulinu zásadně liší. Inzulin zvyšuje hmotnost léčených, metformin ji snižuje. Inzulin zvyšuje lipogenezi a snižuje lipolýzu, metformin naopak snižuje tvorbu triacylglycerolů a snižuje množství uloženého tuku [17]. Teorii založené na „zlepšení efektu inzulinu metforminem“ neodpovídají projevy pozorované při předávkování tímto lékem [18, 19].
Je pravděpodobné, že léčebný (fyziologický) účinek metforminu využívaný v léčbě DM2 s obezitou je založen na tomto principu: metformin snižuje efektivitu aerobního metabolismu. Klesá zisk energie, klesá produkce ATP. Zvyšuje se koncentrace adenosinmonofosfátu (AMP). Změna poměru AMP/ATP vyvolává řadu reakcí. Mimo jiné významně ovlivňuje aktivitu enzymu adenosinmonofosfátem aktivované protein kinázy (dále AMP-kináza) [20-22]. Vliv tohoto enzymu, který patří mezi centrální regulátory energetických dějů v buňce, má za následek řetězec reakcí, jejichž výsledkem je zvýšení vstupu energeticky bohatých látek do buněk. Dochází k nárůstu vstupu glukózy do buněk, do svalu. V játrech dochází vlivem AMP-kinázy k omezení produkce a výdeje glukózy buňkami, ke snížení tvorby glykogenu, ke snížení syntézy tuků a k zvýšení lipolýzy. Vznikají energetické ztráty, a to neúčelným přeměňováním glukózy na laktát a zpět z laktátu na glukózu v Coriho cyklu. Při tomto procesu vzniká ztráta 4 ATP na 1 molekulu glukózy. Všechny výše uvedené účinky metforminu umožňují nemocnému dlouhodobě tolerovat vysoký příjem živin, aniž by se začaly v jeho organismu – a především v jeho krvi – hromadit energeticky bohaté látky, tedy cukry a tuky.
Efekt metforminu na AMP-kinázu je (částečně) zprostředkován vzestupem koncentrace AMP [22]. Existují práce, které popisují ovlivnění i dalších systémů zvyšujících koncentraci AMP snížením jeho odbourávání [23]; lze předpokládat průkaz ovlivnění uncoupling proteinu [24], řady dalších enzymů, hormonů či receptorových kaskád [25]. V poslední době byla otevřena otázka vlivu metforminu na blokádu mitochondriální glycerol-3-fosfát dehydrogenázy A [26]. Nicméně klinické projevy při otravě metforminem svědčí o základní poruše: postižení aerobního metabolismu [27], omezení zisku energie, omezení produkce konečného metabolitu, oxidu uhličitého (CO2) [28]. Proč umírají nemocní na otravu biguanidy? Pro těžké omezení energetického zisku. Pro snížení množství vytvářených molekul ATP. Za aerobních podmínek je získáváno při metabolismu jedné molekuly glukózy 36 (až 38) molekul ATP. Při anaerobním metabolismu jsou získány pouze dvě molekuly ATP. Kritický nedostatek ATP, potřebného pro energeticky náročné děje, již plně vysvětluje klinické projevy otrav biguanidy.
Příznivý efekt metforminu na DM2 nás nutí měnit pohled na příčiny tohoto typu diabetu. Podle dosud přetrvávajících názorů by DM2 měl být důsledkem nedostatečného efektu inzulinu. Za příčinu onemocnění je předpokládána nadměrná produkce glukózy játry. Jestliže však vycházíme z předpokladu, že játra mohou živiny vytvářet pouze z energeticky bohatých látek, které byly do jater přeneseny, pak je nutno hledat příčinu DM2 v odlišném mechanismu: zvýšená produkce glukózy je následkem přebytečného vstupu energeticky bohatých látek do jater. Postižení jater tedy není skutečnou příčnou onemocnění DM2 – tou je chronický overfeeding, vleklé přejídání. Vysoká produkce glukózy je podmíněna vysokým příjmem laktátu, bílkovin, tuků a dalších energeticky bohatých látek, nikoli dysfunkcí jater. Obdobně i omezovaný vstup glukózy do svalu je opět jen druhotný, regulační děj, chránící sval před dalším zatížením energeticky bohatými látkami. DM2 s obezitou je onemocnění způsobené přebytkem energie, přebytečným příjmem potravy a nedostatečným energetickým výdejem, který poškodil regulační mechanismy [29]. Nicméně vliv hyperglykémie, zvýšené koncentrace cukru v krvi, má natolik zhoubné následky, že prakticky jakýkoli lék, který umožní úpravu glykémie na fyziologické hodnoty, je pro nemocné přínosný. V současné době začínáme více užívat léky, které místo snížení účinnosti metabolismu omezují touhu po jídle – inkretiny [29] či léky způsobující přímé ztráty glukózy močí – glifloziny.
Závěr
Během 18 let bylo zachyceno v městské nemocnici v Litoměřicích 23 případů MILA. Příčinou rozvoje MILA u sledovaných nemocných bylo pravděpodobně postižení GIT, zvracení a průjmy vzniklé vlivem běžné infekce či samotného efektu metforminu na GIT. Následná hypovolémie a prerenální selhání vedly ke zvýšení koncentrací metforminu na toxické hodnoty. Prognóza nemocných s MILA byla nepříznivá, úmrtnost v souboru byla 48 %. Nejúčinnější léčebnou metodou bylo odstranění metforminu z organismu (hemodialýzou či CVVHD), a to bez omezování hyperventilace. Hlavní léčebný efekt metforminu, podobně jako jeho nežádoucí účinek, pravděpodobně spočívá v omezení aerobního metabolismu. Metformin je pro obézní diabetiky velmi přínosný. Patří dnes k nejbezpečnějším lékům ve své kategorii. Přesto je nutné i nadále brát v úvahu riziko vzniku MILA, onemocnění charakterizovaného zhroucením aerobního metabolismu. Cílené vyhledávání poruchy vedlo k zachycení významně vyššího počtu případů MILA, než odpovídá dosud uváděným statistickým datům, a to -ve sledovaném souboru - 20 případů na 100 000 léčených za rok.
Do redakce došlo 20. 3. 2016
Adresa pro korespondenci:
Prim. MUDr. Karel Kubát
Městská nemocnice v Litoměřicích
Žitenická 2084
412 01 Litoměřice
E-mail: k.kubat@nemocnice-lt.cz
Zdroje
1. Standards of Medical Care in Diabetes – 2011. Diabetes Care January 2011, vol. 34, no. Supplement 1, p. 11-61.
2. Prospective Diabetes Study Group. Effective intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet, 1998, 352, p. 854-865.
3. Rosival, V., Tibenský, T., Dečkov, J. Fatálna metabolická acidóza u diabetičky liečenej buforminom. Prakt. Lék., 1985, 65(17), p. 634-636.
4. Kubát, K., Zbořil, M. Undesirable effect of biguanides: 31 cases of lactic acidosis in patients treated with buformin in the course of 10 years. Klin. Biochem. Metab., 2000, 8(29), No 2, p. 103-107.
5. Vambera, M., Čížková, M., Petr, P. Laktátová acidóza jako komplikace léčby biguanidy Čas. Lék. Čes., 1990, 129(18).
6. Musil, F., Šmahelová, A., Zajíc, J., Maňák, J., Mádlová, E., Sobotka, L. Závažná laktátová acidóza provázená akutním renálním selháním u diabetičky léčené metforminem. Praktický lékař, 2006, 86(12), p. 707-709.
7. ÚZIS ČR, Informace ze zdravotnictví Ústeckého kraje č. 1/2010, 2014.
8. Bailey, C. J., Wilcock, C., Scarpello, J. H. Metformin and the intestine. Diabetologia, 2008, 51, p. 1552-1553.
9. Bailey, C. J., Wilcock, C., Day, C. Effect of metformin on glucose metabolism in the splanchnic bed. Br. J. Pharmacol., 1992, 105(4), p. 1009–1013.
10. Zhou, M., Xia, L., Wang, J. Metformin Transport by a Newly Cloned Proton-Stimulated Organic Cation Transporter (Plasma Membrane Monoamine Transpor-ter) Expressed in Human Intestine. Drug Metabolism and Disposition, 2007, 35, p. 1956–1962.
11. Páleníčková, E., Cahová, M., Drahota, Z., Kazdová, L., Kalous, M. Inhibitory effect of metformin on oxidation of NADH-dependent substrates in rat liver homogenate. Physiol. Res., 2011, 60(5), p. 835-839.
12. Owen, M. R., Doran, E., Halestrap, A. P. Evidence that metformin exerts its anti-diabetic effects through inhibition of complex 1 of the mitochondrial respiratory chain. Biochem. J., 2000, 348, p. 607–614.
13. El-Mir, M. Y., Nogueira, V., Fontaine, E., Averet, N., Rigoulet, M., Leverve, X. Dimethylbiguanide inhibits cell respiration via an indirect effect targeted on the respiratory chain complex I. J. Biol. Chem., 2000, 275, p. 223–228.
14. Brunmair, B., Staniek, K., Gras, F., Scharf, N., Althaym, A., Clara, R., Roden, M., Gnaiger, E., Nohl, H., Waldhausl, W. et al. Thiazolidinediones, like metformin, inhibit respiratory complex I: a common mechanism contributing to their antidiabetic actions? Diabetes, 2004, 53, p. 1052–1059.
15. Nosadini, R., Avogaro, A., Trevisan, R., Valerio, A., Tessari, P., Duner, E., Tiengo, A., Velussi, M., Del Prato, S., De Kreutzenberg, S., Muggeo, M., Crepaldi, G. Effect of metformin on insulin-stimulated glucose turnover and insulin binding to receptors in type II diabetes. Diabetes Care, 1987, 10, p. 62-67.
16. Nagi, D. K., Yudkin, J. S. Effects of Metformin on Insulin Resistance, Risk Factors for cardiovascular disease, and plasminogen activator inhibitor in NIDDM subjects. A study of two ethnic groups. Diabetes Care, 1993, 16, P. 621–629.
17. Collier, C. A., Bruce, C. R., Smith, A. C., Lopaschuk, G., Dyck, D. J. Metformin counters the insulin-induced suppression of fatty acid oxidation and stimulation of triacylglycerol storage in rodent skeletal muscle. Am J Physiol. Endocrinol. Metab., 2006, 291(1), p. 182-189.
18. Suchard, J. R., Grotsky, T. A. Fatal metformin overdose presenting with progressive hperglycemia. West J. Emerg. Med., 2008, 9(3), p. 160-164.
19. Gura, M., Devrim, S., Sagirogluy, A. E., Orhon, Z., Sen, B. Severe Metformin Intoxication With Lactic Acidosis in An Adolescent: A Case Report. The Internet Journal of Anesthesiology, 2010, Vol. 27, No 2.
20. Zhou, G., Myers, R., Li, Y., Chen, Y., Shen, X., Fenyk-Melody, J., Wu, M., Ventre, J., Doebber, T., Fujii, N. et al. Role of AMP-activated protein kinase in mechanism of metformin action. J. Clin. Invest., 2001, 108, p. 1167–1174.
21. Fryer, L. G., Parbu-Patel, A., Carling, D. The anti-diabetic drugs rosiglitazone and metformin stimulate AMP-activated protein kinase through distinct signaling pathways. J. Biol. Chem., 2002, 277, p. 25226–25232.
22. Stephenne, X., Foretz, M., Taleux, N., van der Zon, G. C., Sokal, E., Hue, L., Viollet, B., Guigas, B. Metformin activates AMP-activated protein kinase in primary human hepatocytes by decreasing cellular energy status. Diabetologia, 2011, 54(12), p. 3101-10. doi: 10.1007/s00125-011-2311-5.
23. Ouyang, J., Parakhia, R. A., Ochs, R. S. Metformin activates AMP-Kinase through inhibition of AMP deaminase. J. Biol. Chem., 2010, 286, p. 1-11.
24. Anedda, A., Rial, E., Gonzalez-Barroso, M. M. Metformin induces oxidative stress in white adipocytes and raises uncoupling protein 2 levels. J. Endocrinol., 2008, 199, p. 33–40.
25. Hawley, S. A., Gadalla, A. E., Olsen, G. S., Hardie, D. G. The antidiabetic drug metformin activates the AMP-activated protein kinase cascade via an adenine nucleotide-independent mechanism. Diabetes, 2002, 51, p. 2420–2425.
26. Ferrannini, E. The Target of Metformin in Type 2 Diabetes. New Engl. J. Med., 2014, 371(16), p. 1547-1548.
27. Bridges, H. R., Jones, A. J. Y., Pollak, M. N., Hirst, J. Effects of Metformin and other Biguanides on Oxidative Phosphorylation in Mitochondria. Biochem. J., 2014, 462, p. 475-487.
28. Protti, A., Russo, R., Tagliabue, P., Vecchio, S., Singer, M., Rudiger, A., Foti, G., Rossi, A., Mistraletti, G., Gattinoni, L. Oxygen consumption is depressed in patients with lactic acidosis due to biguanide intoxication. Crit. Care, 2010, 14(1), R22. Epub Feb. 19.
29. Kubát, K. Model of Diabetes Mellitus Type 2, T2DM. J Nutr. Food Sci., 2015, 5, p. 344. doi:10.4172/2155-9600.1000344
30. Kazda, A., Jabor, A. Hodnocení vztahů mezi ionty natria a chloridů při posuzování nálezů acidobazické rovnováhy. Klin. Biochem. Metab., 2001, 9(30), No 4, p. 199-201.
31. Salpeter, S. R., Greyber, E., Pasternak, G. A. et al. Risk of fatal and nonfatal lactic acidosis with metformin use in type 2 diabetes mellitus: systematic review and meta-analysis. Arch. Intern. Med., 2003, 163, p. 2594–602.
Štítky
Biochémia Nukleárna medicína Nutričný terapeut
Článok vyšiel v časopiseKlinická biochemie a metabolismus
Najčítanejšie tento týždeň
2017 Číslo 2
-
Všetky články tohto čísla
-
Projekt MED PED v České republice
Make Early Diagnosis – Prevent Early Deaths in Medical Pedigrees - Projekt MedPed v České republice
- Laboratorní aspekty systémové AA amyloidózy
- Obtížně interpretovatelné nálezy elektroforéz a imunofixací u pacientů s mnohočetným myelomem po autologní transplantaci
- Programy externího hodnocení kvality v čase harmonizace výsledků laboratorních vyšetření
- Rabdomyolýza vyvolaná nadměrnou svalovou zátěží – častá příčina chybné diagnózy
- 23 případů metforminem indukované metabolické laktátové acidózy
- POCT a diabetes - potřeba komplexních a aktuálních informací
-
Projekt MED PED v České republice
- Klinická biochemie a metabolismus
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Rabdomyolýza vyvolaná nadměrnou svalovou zátěží – častá příčina chybné diagnózy
- 23 případů metforminem indukované metabolické laktátové acidózy
- Projekt MedPed v České republice
- Obtížně interpretovatelné nálezy elektroforéz a imunofixací u pacientů s mnohočetným myelomem po autologní transplantaci
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



