-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Příprava protinádorové vakcíny pro pacienty s mnohočetným myelomem na bázi dendritických buněk naložených monoklonálním imunoglobulinem
The preparation of anticancer vaccine for patients with multiple myeloma on the base of monoclonal immunoglobulin loaded dendritic cells
Backgrounds:
On June 2006, phase II clinical trial focused on anticancer vaccination of multiple myeloma patients, was started. On September 2007, the immune and clinical response evaluation of first four patients was finished. The anticancer vaccine contained dendritic cells loaded with monoclonal immunoglobulin produced by myeloma cells.
Methods and Patients:
Within the frame of phase II clinical trial were vaccinated four myeloma patients with stable disease. It was administered six vaccines for each patient, monthly. The dendritic cells were cultured from the patient’s peripheral blood mononuclear cells and loaded with autologous monoclonal immunoglobulin under the good manufacturing practice conditions. After the safety and quality control, the satisfactory vaccine was administered to the patient. The functional characteristic of dendritic cells was evaluated using flow cytometry, the immune response was evaluated using ELISpot. The clinical response was monitored using monoclonal immunoglobulin concentration in patient’s sera.Results and Conclusion:
The immune response detected using ELISpot was observed in 3/4 patients. The monoclonal immunoglobulin concentration was changeable for all twelve months, but never exceeded the range of 25% for minimal clinical response achievement. During the vaccination, no significant toxicities or negative side-effects were observed. The clinical trial is going on with vaccination other patients with multiple myeloma.Key words:
multiple myeloma – cancer vaccines – dendritic cells
Autoři: D. Očadlíková 1,2; L. Zahradová 2,3; L. Kovářová 1,2; J. Smejkalová 1,2; L. Pour 2,3; P. Vidláková 1,2; D. Kyjovská 1; J. Moravcová 1; M. Rycová 1; H. Novotná 4; I. Jelínková 5; M. Penka 1; J. Michálek 2; R. Hájek 1,2,3
Působiště autorů: Laboratoř experimentální hematologie a buněčné imunoterapie, Oddělení klinické hematologie, FN Brno 2Univerzitní centrum buněčné imunoterapie a Česká myelomová skupina – Univerzitní výzkumné centrum, MU Brno 3Interní hematoonkologická klinika, FN Brno 4Od 1
Vyšlo v časopise: Klin Onkol 2009; 22(2): 67-72
Kategorie: Původní práce
Souhrn
Východiska:
V červnu 2006 byla zahájena na našem pracovišti klinická studie fáze II zaměřená na podání protinádorové vakcíny pacientům s mnohočetným myelomem. V září 2007 bylo dokončeno vyhodnocení imunitní a klinické odpovědi u prvních čtyř pacientů. Vakcína obsahovala dendritické buňky pacienta naložené autologním monoklonálním imunoglobulinem produkovaným myelomovými buňkami.
Metody a soubor pacientů:
V rámci klinické studie fáze II byly vakcinováni čtyři pacienti s mnohočetným myelomem ve fázi stabilního či mírně aktivního onemocnění. Každému pacientovi bylo podáno šest vakcín s odstupem jednoho měsíce. Vakcína obsahovala dendritické buňky kultivované z mononukleárních buněk periferní krve pacienta naložené autologním monoklonálním imunoglobulinem podle podmínek správné výrobní praxe. Vakcína splňující kritéria bezpečnosti a jakosti byla podána pacientovi. Maturace dendritických buněk byla prokázána pomocí imunofenotypizace na průtokovém cytometru, imunologická odpověď byla hodnocena metodou ELISpot. Klinická odpověď byla sledována pomocí koncentrace monoklonálního imunoglobulinu v séru pacientů.Výsledky a závěr:
Metodou ELISpot byla zaznamenána imunologická odpověď u 3/4 pacientů. Hladina monoklonálního imunoglobulinu kolísala po celých dvanáct měsíců sledování, avšak nepřesáhla 25% pokles pro dosažení minimální odpovědi. Vakcína byla velmi dobře snášena bez závažných vedlejších účinků. Klinická studie pokračuje vakcinací dalších pacientů s mnohočetným myelomem.Klíčová slova:
mnohočetný myelom – protinádorová vakcína – dendritické buňkyÚvod
Mnohočetný myelom (MM) je charakterizován zhoubnou klonální proliferací B lymfocytů. Myelomové buňky produkují monoklonální imunoglobulin (M-Ig), který obsahuje na svém povrchu idiotypové (Id) proteinové struktury (Id-protein). Jedná se o specifickou antigenní determinantu, kterou je možno využít v imunoterapii MM jako antigen asociovaný s nádorem [1]. Id-protein může být předkládán jako vysoce specifický antigen asociovaný s nádorem prostřednictvím antigen prezentujících buněk [2].
Jako nejúčinnější antigen prezentující buňky jsou v protinádorové imunoterapii využívány dendritické buňky (dendritic cells; DCs), které sehrávají klíčovou roli v aktivaci cytotoxických T lymfocytů (T lymphocytes; TLs) [3]. Vakcinace Id-proteinem naloženými DCs je jednou z možností imunoterapie u MM s cílem navodit specifickou imunitní odpověď proti nádorovým buňkám. Vzniklá protilátková i buněčná imunitní odpověď pak kontroluje růst populace myelomových buněk [1].
V roce 2003 proběhla v našem výzkumném centru první klinická studie, kde byl pacientům s MM podáván samotný Id-protein. Jednalo se o první protinádorovou vakcínu připravenou v České republice [4]. Z výsledků klinické studie však vyplynulo, že Id-protein samotný má slabý imunogenní potenciál a není schopen navodit pozorovatelnou klinickou odpověď [5]. Byla však zaznamenána imunologická odpověď (pozitivita kožního testu, zvýšení počtu paměťových B lymfocytů) a vakcinace proběhla bez nežádoucích vedlejších účinků [5]. Vzhledem k těmto skutečnostem vzrostla snaha o nalezení antigenu se silnějším imunogenním potenciálem a o zvýšení účinnosti vakcín prostřednictvím DCs jako velmi silného adjuvans.
Při použití DCs dochází k výraznější odpovědi TLs ve srovnání se samotným Id-proteinem [6], proto jsme na našem pracovišti připravili další klinickou studii fáze II využívající DCs naložené autologním Id-proteinem, která byla zahájena v červnu 2006. Vakcinační protokol dosud dokončili čtyři pacienti.
V tomto sdělení popisujeme naše první zkušenosti s buněčnou protinádorovou vakcínou podávanou pacientům s MM.
Metody a soubor pacientů
Soubor pacientů
Z plánovaného počtu 12 pacientů byla vakcína aplikována 4 pacientům s MM. Pro zařazení do klinické studie musela být naplněna následující vstupní kritéria:
- Předléčený nemocný se stabilním či mírně aktivním onemocněním, u kterého není indikována standardní léčba.
- Aby mohl být přesně zaznamenán případný léčebný efekt, je vyžadován nejméně tříměsíční odstup od ukončení chemoterapie nebo udržovací léčby.
- Vybraný pacient musí mít měřitelné množství M-Ig v séru či plazmě.
Každému pacientovi bylo intradermálně podáno celkem šest vakcín do levého ramene. Vakcína obsahující DCs naložené autologním Id-proteinem byla podávána jednou měsíčně.
Před začátkem vakcinace, 3. a 6. měsíc od začátku vakcinace a dále 3. a 6. měsíc po ukončení vakcinace je pacientovi intradermálně do levého ramene podáván také samotný Id-protein. Po 24 a 48 hodinách od aplikace vakcíny či samotného Id-proteinu je sledována kožní reakce, zarudnutí či zatvrdnutí v okolí vpichu. Jedná se o specifickou imunitní reakci IV. typu [7]. Po dobu 12 měsíců od začátku vakcinace je jednou měsíčně pacientům odebíráno sérum na měření koncentrace M-Ig a periferní krev na standardní vyšetření a monitorování imunitní odpovědi pomocí průtokové cytometrie. Vzorky periferní krve na monitorování specifické imunitní odpovědi metodou ELISpot jsou odebírány před začátkem vakcinace, 3. a 6. měsíc od začátku vakcinace a dále 3. a 6. měsíc po ukončení vakcinace. Sternální punkce se provádí v 1. a 6. měsíci od začátku vakcinace a 6. měsíc po jejím ukončení. Pro zhodnocení rizika autoimunitní reakce je před zahájením vakcinace a po jejím ukončení odebrán základní panel autoimunity. Studie byla schválena etickou komisí FN Brno.
Příprava protinádorové vakcíny podle podmínek správné výrobní praxe
Izolace Id-proteinu
Id protein byl izolován z plazmy/séra pacientů s MM metodou afinitní chromatografie na protein G koloně [7,8]. Z koncentrace M-Ig uvedené na žádance (údaj starý maximálně jeden měsíc, koncentrace stanovena imunoturbidimetricky na přístroji Modular (Roche, Cobos), bylo vypočítáno množství plazmy/séra k nanesení na kolonu (Econo-Pac Column, BioRad, USA) s afinitním sorbentem (protein G, Sigma-Aldrich, Česká republika) tak, aby byla zachována vazebná kapacita kolony (30mg Ig/1ml proteinu G). Eluované frakce Id-proteinu byly spojeny po 5ml a koncentrace M-Ig v jednotlivých frakcích byla stanovena pomocí imunoelektroforézy na Oddělení klinické biochemie ve Fakultní nemocnici Brno (FN Brno). Požadavek na množství Id-proteinu pro vakcinaci jednoho pacienta bylo připravit šest frakcí o koncentraci 0,8–1,2mg Id-proteinu/ml. Frakce Id-proteinu byly zamraženy po 1ml do –80°C. Čistota získaných frakcí byla ověřena pomocí elektroforézy na polyakrylamidovém gelu v přítomnosti dodecylsulfátu sodného (SDS-PAGE) ve Výzkumném ústavu veterinárního lékařství (VÚVeL, Brno). Požadavek na čistotu Id-proteinu byl ≥ 90%. Sterilita izolovaného Id-proteinu byla ověřena na Oddělení klinické mikrobiologie ve FN Brno (aerobní a anaerobní kultivace, Gramm-Giemsovo barvení) s negativním výsledkem jako podmínkou podání vakcíny pacientovi a testováním přítomnosti bakteriálního endotoxinu ve vzorku [9] pomocí LAL testu (Limulus Amebocyte Lysate PYROGENT 06 Plus US License, Cambrex, USA) s limitem ≤ 350 U/ml Id-proteinu.
Kultivace dendritických buněk
DCs byly získány ze 60ml periferní krve pacienta s MM kultivací mononukleárních buněk v přítomnosti interleukinu 4 (IL 4), faktoru stimulujícího kolonie granulocytů a makrofágů (GM CSF) a tumor nekrotizujícího faktoru α jako maturačního cytokinu podle postupu standardně využívaného na našem pracovišti [10]. V den +5 kultivace byly nezralé DCs naloženy autologním Id-proteinem v množství 50 µg/ml. Zralé DCs byly sesbírány v den +9 kultivace.
Kontrola bezpečnosti a jakosti protinádorové vakcíny
V rámci SVP byly provedeny testy bezpečnosti a jakosti připravené protinádorové vakcíny. Bezpečnost pro pacienta byla ověřena pomocí následujících vyšetření: a) aerobní a anaerobní kultivace a Gramm-Giemsovo barvení na OKM ve FN Brno (výsledek pro podání musí být negativní), b) kontrola přítomnosti mykoplazmat pomocí metody PCR ve firmě Genex Brno (výsledek pro podání musí být negativní), c) vyšetření přítomnosti bakteriálního endotoxinu pomocí LAL testu (limit pro podání je ≤ 350 U/ml).
Kvalita připravené vakcíny byla ověřena pomocí následujících měření: a) vitalita buněk v den 0 a +9 kultivace (limit pro podání je ≥ 80%), b) buněčnost (limit pro podání je ≥ 0,5 × 106 DCs), c) morfologie buněk sledovaná mikroskopicky (buněčná kultura bez známek kontaminace a přítomnost panožek na DCs), d) stupeň maturace DCs pomocí imunofenotypizace na průtokovém cytometru (limit pro podání je ≥ 40% HLADR/CD80 nebo CD86 pozitivních DCs). Maturace DCs byla hodnocena mírou exprese následujících povrchových antigenů: CD3 a CD14 pro odlišení TLs a monocytů, HLADR nutný pro prezentaci antigenu, CD83 vypovídající o zralosti DCs a přispívající k interakci s TLs [11], CD80 a CD86 jako kostimulační molekuly a dále jejich kombinace HLADR/CD80 a HLADR/CD86 [12].
Měření na průtokovém cytometru bylo prováděno v den 0, +5 a +9 kultivace. DCs byly inkubovány 15 min s monoklonální protilátkou, poté byl přidán PBS stabilizovaný azidem sodným a fixovány 1% paraformaldehydem. K měření byl využit průtokový cytometr FC 500 CytomicsTM (Beckman Coulter, Hialeah, USA). U DCs byly analyzovány následující povrchové antigeny a jejich kombinace: CD3-FITC/CD14-PE, HLA DR-FITC/CD80-PE/CD83-PC5, HLA DR-FITC/CD86-PE/CD83-PC5 (vše Immunotech, Marseille, Francie).
Vakcína vyhovující parametrům bezpečnosti a jakosti pro podání pacientovi byla po centrifugaci buněk přenesena do 1ml fyziologického roztoku a po schválení ošetřujícím lékařem podána pacientovi.
Monitorování klinické a imunologické odpovědi
Vyšetření zahrnovala monitorování imunitního systému a jeho reakci na vakcínu. Klíčové bylo hodnocení léčebné účinnosti. Léčebná odpověď byla hodnocena dle EBMT kritérií [13]. Za léčebnou odpověď je považována minimální odpověď (pokles M-Ig v séru pacienta alespoň o 25%) [13].
Specifická imunitní odpověď byla hodnocena metodou ELISpot na přístroji AID EliSpot Reader System (AID, Německo). Byla měřena specifická aktivace imunitního systému DCs naloženými Id-proteinem na základě produkce intracelulárního interferonu gama (IFN-γ) na úrovni jednotlivé buňky [14]. K testování byl využit komerční kit EliSpot Interferon-γ Assay Kit (AID, Německo) a postupováno bylo dle pokynů výrobce [15].
Nespecifická imunitní odpověď byla hodnocena pomocí diferenciálního krevního obrazu a průtokové cytometrie.
Specifická imunitní reakce IV. typu byla hodnocena pomocí kožního testu s Id-proteinem [7].
Výsledky
Pro klinické aplikace je klíčová standardizace laboratorních postupů a dodržování zásad správné výrobní praxe. Na našem pracovišti bylo v podmínkách SVP připraveno a podáno celkem 24 protinádorových vakcín, šest vakcín pro jednotlivého pacienta s MM.
U 3/4 pacientů byla zaznamenána imunologická odpověď. Hladina monoklonálního imunoglobulinu kolísala po celých 12 měsíců sledování, avšak nepřesáhla 25% pokles pro dosažení minimální odpovědi. Vakcína byla velmi dobře snášena bez závažných vedlejších účinků.
Parametry vakcíny
Id-protein
Id-protein izolovaný metodou afinitní chromatografie podle podmínek SVP byl testován z hlediska bezpečnosti a jakosti. U každého pacienta bylo připraveno a zamraženo 12 frakcí Id-proteinu o koncentraci 1mg/ml (0,85–1,04mg/ml) s čistotou 95,91% (91,42–96,94%), medián (min max). Požadavek na koncentraci a čistotu Id-proteinu byl splněn u všech 4 pacientů (tab. 1).
Tab. 1. Výroba Id-proteinu. Koncentrace Id-proteinu byla stanovena imunoelektroforeticky, čistota pomocí imunoelektroforézy na SDS-PAGE. Z hlediska bezpečnosti byl izolovaný Id-protein testován také na přítomnost bakteriálního endotoxinu a byla provedena aerobní a anaerobní kultivace a Gramm-Giemsovo barvení. Výsledky jsou shrnuty v tabulce, u koncentrace a čistoty Id-proteinu je uveden medián u všech 4 pacientů s jeho minimem a maximem. 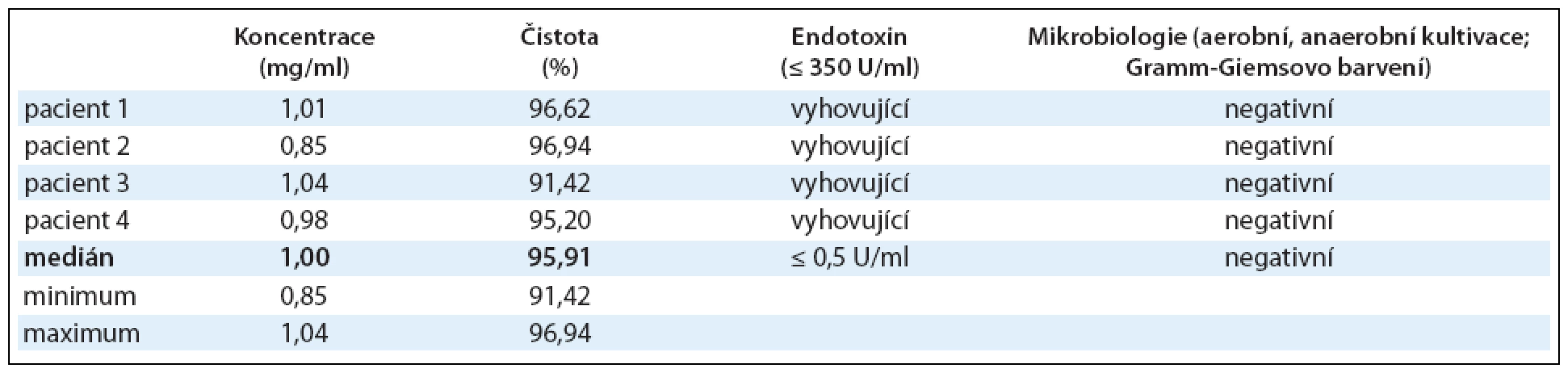
V rámci kontroly bezpečnosti byly provedeny také testy sterility izolovaného Id-proteinu. Testována byla přítomnost bakteriálního endotoxinu, aerobní a anaerobní kultivace a Gramm-Giemsovo barvení. Limit pro přítomnost bakteriálního endotoxinu a požadavky na negativní výsledky testů sterility byly splněny u všech 24 podaných vakcín (tab. 1).
Kultivace dendritických buněk
DCs pacientů byly kultivovány podle podmínek SVP po dobu devíti dnů v přítomnosti GM CSF a IL 4. V den +5 kultivace byly DCs naloženy Id-proteinem a v den +6 maturovány pomocí TNF α. V den 0 a +9 kultivace byla měřena vitalita buněk a buněčnost kultury. V den 0, +5 a +9 byla sledována morfologie DCs.
Vitalita DCs u všech 24 vakcín v den +9 byla 90% (66,0–98,0%), medián (min max). U jedné vakcíny byla vitalita nižší než její limit pro podání (≥ 80%), a to pouhých 66%. Přesto byla vakcína ošetřujícím lékařem pacienta schválena k podání vzhledem k naplnění celkové podmínky podání (obsahuje li alespoň 0,5 × 106 živých DCs, z nichž minimálně 40% je HLADR/CD80 nebo CD86 pozitivních). Množství získaných DCs bylo velmi různorodé a lišilo se jak mezi pacienty, tak mezi jednotlivými experimenty u téhož pacienta. Ze 60 × 106 mononukleárních buněk periferní krve bylo získáno 8,7 × 106 DCs (0,9–32,0 × 106), medián (min max). Výsledky vitality a buněčnosti jsou shrnuty v tab. 2.
Tab. 2. Dendritické buňky naložené Id-proteinem. Pro klinické podání DCs naložených Id-proteinem je důležitá vitalita buněk v den podání (den +9) a počet buněk. Hodnoty jsou vyjádřeny pomocí mediánu, minima a maxima. 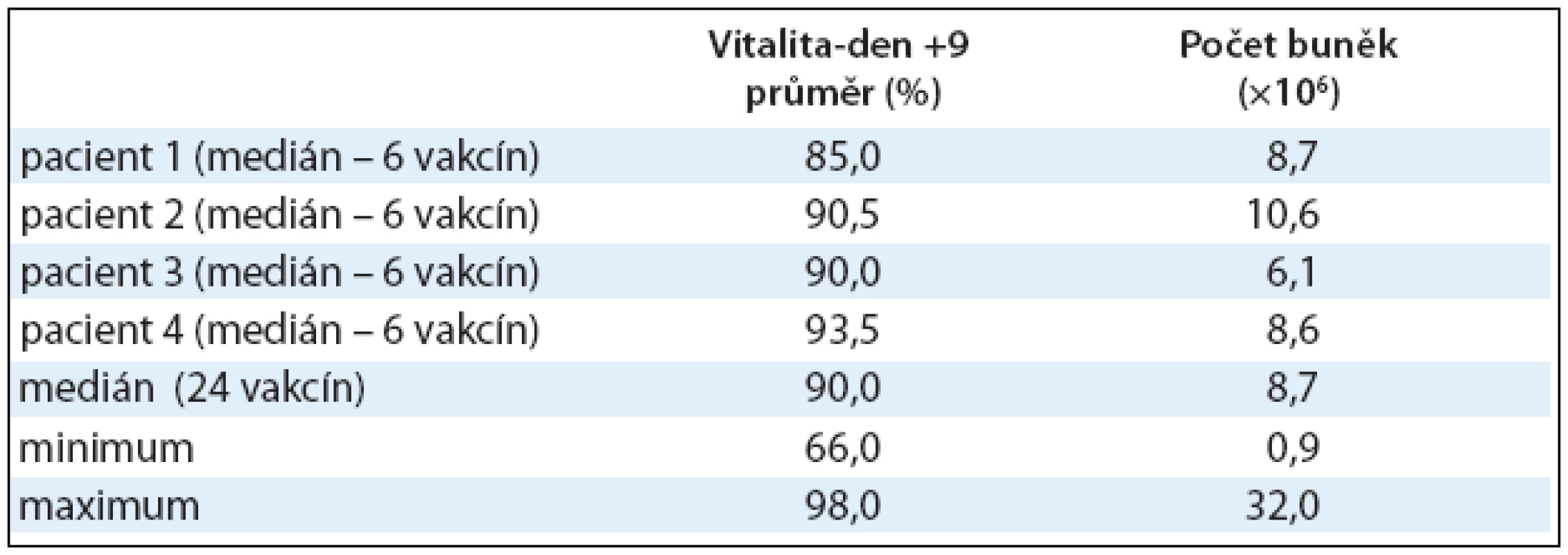
V rámci testování bezpečnosti vakcíny bylo v den +8 kultivace prováděno testování na přítomnost mykoplazmat a bakteriálního endotoxinu ve vakcíně. Dále byly provedeny testy sterility jako Gramm-Giemsovo barvení (den +8), aerobní a anaerobní kultivace (den +5) a aerobní kultivace supernatantu odebraného po sklizení buněk (den +9). Limitní množství endotoxinu ≤ 350 U/ml bylo splněno u 100% (24/24) vakcín. Ostatní testy sterility splňovaly u 100% (24/24) vakcín požadavek na negativní výsledek.
Imunofenotypizace DCs vypovídající o jejich zralosti byla hodnocena na průtokovém cytometru. V kultuře během 9denní kultivace dochází k přeměně monocytů na DCs, což se projevuje statisticky významnou ztrátou exprese antigenu CD14 z 3,5% (1,0–12,9%) v den 0 na 0,2% (0–6,7%) v den +9, p = 0,020. DCs postupně vyzrávají, o čemž vypovídá také statisticky významné zvýšení exprese antigenu CD83 z 0,3% (0–0,9%) v den 0 na 30% (5,0–91,3%) v den +9 s p = 0,019 a statisticky významným zvýšením exprese kombinace antigenů HLA DR/CD86 ze 4,7% (1,5–14,0%) v den 0 na 95% (50,1–99,3%) v den +9, p = 0,021. Výsledky jsou shrnuty v tab. 3, kde jsou zaznamenány mediány procentuálních hodnot exprimovaných antigenů v den 0 a +9 kultivace DCs s jejich minimy a maximy a statistická významnost.
Tab. 3. Imunofenotypizace dendritických buněk naložených Id-proteinem. Po celou dobu kultivace v den 0, +5 a +9 byl monitorován imunofenotyp DCs na průtokovém cytometru. V tabulce jsou zaznamenány vybrané povrchové antigeny a změny v jejich expresi v den 0 a +9 pro 24 vyrobených vakcín. Hodnoty jsou vyjádřeny pomocí mediánu, minima a maxima. 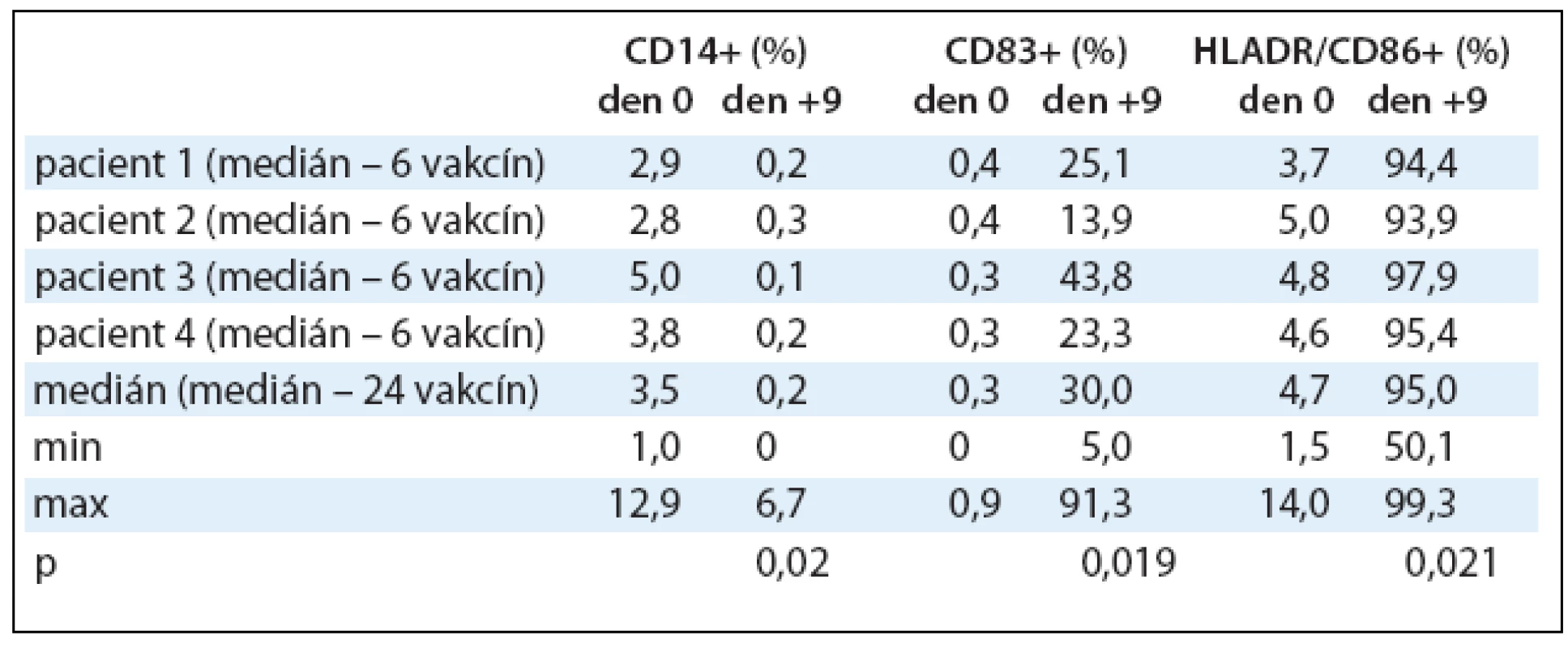
Klinická a imunologická odpověď na vakcínu
Imunologická odpověď
Specifická aktivace imunitního systému na základě produkce aktivačního markeru IFN-γ hodnocená na úrovni jednotlivé buňky metodou ELISpot byla pozitivní u 3/4 pacientů. U pacienta č. 4 nebyla zaznamenána žádná imunitní odpověď, pouze pokles průměrného počtu spotů oproti vstupní hodnotě (obr. 1). U pacienta č. 2 se objevila pozitivita již na počátku vakcinace (průměrně 357 spotů), avšak došlo ke zvýšení počtu spotů 6. měsíc (průměrně 404 spotů) a 9. měsíc (445 spotů) od začátku vakcinace (obr. 1). U pacienta č. 3 byla zaznamenána pozitivní odpověď ve 3.–12. měsíci sledování s maximem ve 12. měsíci (průměrně 85 spotů), u pacienta č. 1 byla rovněž zaznamenána pozitivní odpověď ve 3.–12. měsíci sledování s maximem v 6. měsíci sledování (průměrně 300 spotů) (obr. 1).
Obr. 1. Měření specifické imunitní odpovědi metodou ELISpot. Metodou ELISpot byl měřen „počet spotů“, tedy počet TLs aktivovaných DCs naložených autologním Id-proteinem u 4 pacientů. Aktivace TLs je měřena na začátku vakcinace, 3. a 6. měsíc od začátku vakcinace, dále 3. a 6. měsíc po ukončení vakcinace. Imunitní odpověď byla zaznamenána u pacientů č. 1, 2 a 3, kde počet spotů v průběhu vakcinace přesáhl počet spotů na začátku vakcinace. 
Nespecifickou reakci imunitního systému na základě flow cytometrického panelu nelze zatím statisticky hodnotit vzhledem k malému počtu pacientů, kteří dokončili vakcinační protokol.
Oddálený test hypersenzitivity po podání samotného Id-proteinu byl zcela negativní u pacienta č. 2, pozitivní u pacienta č. 1 a 3 a nehodnotitelný u pacienta č. 4, u kterého byla reakce pozitivní již při zahájení vakcinace.
Klinická odpověď
Základním parametrem pro sledování klinické odpovědi na vakcínu byla hladina M-Ig v séru pacientů. Během vakcinace a po dobu šesti měsíců po jejím ukončení nebyla zaznamenána klinická odpověď u žádného pacienta, avšak zároveň nedošlo ani k progresi nemoci u žádného z pacientů. Hladina M-Ig kolísala po celou dobu sledování, pokles koncentrace oproti vstupní hodnotě se pohyboval v rozmezí 0–14,6% s mediánem 9,3%, avšak nikdy nepřesáhl 25% pro dosažení minimální odpovědi. U všech čtyř vakcinovaných pacientů trvalo stabilní onemocnění po celou dobu sledování (12 měsíců).
Nežádoucí účinky a reakce na vakcínu
U prvních 4 pacientů, resp. 24 podaných vakcín, jsme v průběhu vakcinační studie nezaznamenali závažnou toxickou reakci. U 29% (7/24) aplikací došlo po podání vakcíny ke vzniku zarudnutí v místě aplikace, u 63% (15/24) aplikací došlo i ke vzniku zatvrdnutí. Medián vymizení lokální reakce byl 4 dny (2–6). U jednoho pacienta byly zaznamenány subfebrilie do 37,2°C po každém podání vakcíny.
Závěr a diskuze
Pro klinické aplikace je klíčová standardizace laboratorních postupů a dodržování zásad správné výrobní praxe. V červnu 2006 byla na našem pracovišti zahájena klinická studie fáze II nazvaná „Vakcinace pacientů dendritickými buňkami naloženými monoklonálním imunoglobulinem“, v rámci níž jsou v podmínkách SVP připravovány protinádorové vakcíny pro pacienty s MM. Tato klinická studie byla schválena Státním ústavem kontroly léčiv (SÚKL) České republiky. Do studie bude zařazeno celkem 12 pacientů s MM se stabilním onemocněním. Vakcinační protokol byl ukončen u prvních 4 pacientů.
Pro každého pacienta bylo připraveno šest vakcín obsahujících DCs naložené autologním Id-proteinem, celkem bylo tedy připraveno a podáno 24 vakcín. Vakcína byla aplikována jednou měsíčně po dobu půl roku.
V této práci jsou shrnuty výsledky především laboratorní části studie, která probíhala podle podmínek SVP. Laboratorní příprava protinádorové vakcíny zahrnovala izolaci Id-proteinu s využitím afinitní chromatografie, kontrolu bezpečnosti a jakosti, dále přípravu zralých DCs naložených autologním Id-proteinem s kontrolou bezpečnosti a jakosti celé vakcíny a kontrolu funkční charakteristiky DCs pomocí imunofenotypizace na průtokovém cytometru. U všech 24 podaných vakcín byla splněna kritéria testů bezpečnosti a jakosti pro podání vakcíny pacientovi stanovená institucí SÚKL České republiky. Pouze u jedné vakcíny byla nižší vitalita buněk oproti stanovenému limitu, avšak vzhledem ke splnění celkového kritéria k podání (alespoň 0,5 × 106 živých DCs minimálně 40% HLADR+CD80/86 pozitivních) byla vakcína schválena ošetřujícím lékařem k podání.
U 3/4 pacientů byla zaznamenána imunologická odpověď na vakcínu metodou ELISpot. Při hodnocení kožního testu došlo u 3/4 pacientů po podání k zarudnutí v místě injekce, u 3/4 pacientů k místnímu zatvrdnutí. Medián vymizení lokální reakce byl čtyři dny (2–6). Monitorování imunitního systému pomocí průtokové cytometrie nelze zatím statisticky hodnotit vzhledem k malému počtu pacientů. Dosud získaná data a literární údaje svědčí o tom, že přes prokázání imunologické odpovědi na vakcínu tato nekoreluje s odpovědí klinickou [6,16].
U prvních 4 pacientů nebyla zaznamenána klinická odpověď na vakcínu ve smyslu poklesu M-Ig v periferní krvi pacientů. Tyto výsledky korelují s výsledky ostatních pracovišť, kde probíhaly klinické studie s DCs naloženými Id-proteinem pro pacienty s MM [6,16,17].
Velmi důležitá je skutečnost, že po celou dobu vakcinace nebyly zaznamenány žádné závažné negativní vedlejší účinky či projevy toxicity a kvalita vakcíny byla srovnatelná se zahraničními klinickými studiemi [6,17,18]. Navíc po celou dobu sledování pacientů (šest měsíců vakcinace + šest měsíců imunomonitoring) nedošlo k progresi ani u jednoho ze čtyř vakcinovaných pacientů, u všech trvalo stabilní onemocnění. Vzhledem k prokázané imunitní reakci organizmu na vakcínu a k zanedbatelným nežádoucím účinkům je tedy nezbytné pokračovat ve vývoji účinnějších protinádorových vakcín.
Tato práce byla podpořena projektem MŠMT LC06027.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, pruducts, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Mgr. Darina Očadlíková Ph.D.
Laboratoř experimentální hematologie a buněčné imunoterapie
Oddělení klinické hematologie FN Brno
Jihlavská 20
625 00 Brno
e-mail: jennynka@seznam.cz
Zdroje
1. Österborg A, Yi Q, Bergenbrant S et al. Idiotype immunization combined with granulocyte-macrophage colony-stimulating factor in myeloma patients induced type I, major histocompatibility complex-restricted, CD8 - and CD4-specific T-cell responses. Blood 1998; 91 : 2459–2466.
2. Titzer S, Christensen O, Bohlen H et al. Vaccination of multiple myeloma patints with idiotype-pulsed dendritic cells. Immunological and clinical aspects. Br J Haematol 2000; 108 : 805–816.
3. Brossart P, Wirths S, Kanz L et al. Dendritic cells in cancer vaccines. Exp Hematol 2001; 29 : 1247–1255.
4. Büchler T, Hanák L, Smejkalová J et al. Využití monoklonálního imunoglobulinu k přípravě protinádorové vakcíny u nemocných s mnohočetným myelomem – první zkušenosti z klinické studie. Klin Onkol 2004; 17 : 64–67.
5. Zahradová L, Büchler T, Hájek Ret al. Protinádorová vakcína s využitím monoklonálního imunoglobulinu u nemocných s mnohočetným myelomem – výsledky klinické studie fáze II. Klin Onkol 2006; 1 : 26–29.
6. Reichardt V, Okada CY, Levy R et al. Idiotype vaccination using dendritic cells after autologous peripheral blood stem cell transplantation for multiple myeloma-a feasibility study. Blood 1999; 93 : 2411–2419.
7. Massaia M, Borrione P, Battaglio S et al. Idiotype vaccination in human myeloma: generation of tumor-specific immune responses after high dose chemotherapy. Blood 1999; 94 : 673–683.
8. Kwak LW, Taub DD, Bryant EM et al. Transfer of myeloma idiotype-specific immunity from an actively immunised marrow donor. Lancet 1995; 345 : 1016–1020.
9. Friberger P, Knos M, Mellstam L. Endotoxin and their detection with the Limulus Amebocyte Lysate Test. New York: Alan R. Liss 1982 : 195–206.
10. Očadlíková D, Kovářová L, Michálek J et al. Identifikace myelom-specifických T lymfocytů na základě produkce interferonu gama. Edukační sborník XXVIII. brněnské onkologické dny a XVIII. konference pro sestry a laboranty 26.–28.května 2004; 53 : 113–116.
11. Zhou LJ, Tedder TF. Human blood dendritic cells selectively express CD83, a member of the immunoglobulin superfamily. J Immunol 1995; 154 : 3821–3835.
12. Schulze J, Nadler LM, Gribben JG. B7-mediated costimulation and the immune response. Blood Rev 1996; 10 : 111–127.
13. Blade J, Samson D, Reece D et al. Criteria for evaluating disease response and progression in patients with multiple myeloma treated by high dose therapy and haemopoietic stem cell transplantation. Br J Haematol 1998; 102 : 1115–1123.
14. Bergenbrant S, Yi Q, Osterborg A et al. Modulation of anti idiotypic immune response by immunization with the autologous M-component protein in multiple myeloma patients. Br J Haematol 1996; 92 : 840–846.
15. Titzer S, Christensen O, Bohlen H et al. Vaccination of multiple myeloma patients with idiotype-pulsed dendritic cells: immunological and clinical aspects. Br J Haematol 2000; 108 : 805–816.
16. Yi Q, Desikan R, Munshi N et al. Optimizing dendritic cell based immunotherapy in multiple myeloma. Br J Haematol 2002; 117 : 297–305.
17. Ridgway D. The first 1000 dendritic cells vaccines. Cancer Invest 2003; 21 : 873–886.
18. Zeis M, Frenzke H, Steinmann J et al. Dendritic cells pulsed with idiotypic determinants induce anti tumor immunity against established multiple myeloma. Blood 1998; 92 : 4229–4237.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2009 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Vážení čtenáři,
- Trastuzumab v liečbe karcinómu prsníka: mechanizmy účinku a rezistencie
- Epidemiologické charakteristiky nádorov testis v Slovenskej republike – retrospektívna štúdia
- Klinický význam chromozomálních změn u nádorů kostí a měkkých tkání dětí a mladistvých
- Příprava protinádorové vakcíny pro pacienty s mnohočetným myelomem na bázi dendritických buněk naložených monoklonálním imunoglobulinem
- Bevacizumab v kombinaci s kapecitabinem a irinotekanem (XELIRI) v léčbě metastatického kolorektálního karcinomu
- Jedinci v dlouhodobé remisi po ukončení léčby pro nádorové onemocnění dětského věku: vyléčení a následná péče. Prohlášení z ERICE.
- Vybrané diagnosticko léčebné problémy u vysoce maligních gliomů – závěry multidisciplinárního pracovního setkání „Winter GLIO TRACK Meeting“ 2009
- Zápis ze schůze výboru České onkologické společnosti dne 17. 2. 2009 v Ústavu radiační onkologie v Praze
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Příprava protinádorové vakcíny pro pacienty s mnohočetným myelomem na bázi dendritických buněk naložených monoklonálním imunoglobulinem
- Trastuzumab v liečbe karcinómu prsníka: mechanizmy účinku a rezistencie
- Klinický význam chromozomálních změn u nádorů kostí a měkkých tkání dětí a mladistvých
- Jedinci v dlouhodobé remisi po ukončení léčby pro nádorové onemocnění dětského věku: vyléčení a následná péče. Prohlášení z ERICE.
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



