-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Místo permanentní brachyterapie v léčbě lokalizovaného karcinomu prostaty
The Role of Permanent Brachytherapy in the Treatment of Localized Prostate Carcinoma
The popularity of permanent brachytherapy is now growing dramatically. The development of several new technologies has led to an improvement in dose distribution and results and can also return the patients to normal daily activities. The role of permanent brachytherapy in the treatment of localized prostate carcinoma is described in the present article. Indications and contraindications and a comparison of the results with other modalities of treatment are discussed. Emphasis is also placed on the morbidity of the treatment and the quality of life, which plays a very important role in the process of making a decision as to which therapy should be applied. Permanent brachytherapy is most often used separately, but in certain cases may be combined with external radiotherapy and hormonal treatment.
Key words:
prostate cancer – implant radiotherapy – morbidity
Autoři: R. Soumarová; L. Homola; H. Perková; M. Bulik
Působiště autorů: Oddělení radioterapie a onkologie, Komplexní onkologické centrum Nový Jičín
Vyšlo v časopise: Klin Onkol 2010; 23(3): 141-145
Kategorie: Přehledy
Souhrn
Obliba permanentní brachyterapie dramaticky roste. Vývoj nových technologií vede k neustálému zlepšování techniky provedení, a tím ke zlepšení dávkové distribuce a výsledků, ale i k rychlému návratu pacienta zpět k běžným aktivitám. V článku je přehledně zpracováno postavení brachyterapie v léčbě lokalizovaného karcinomu prostaty. Jsou popsány indikace a kontraindikace a srovnání výsledků s ostatními modalitami léčby. Důraz je kladen i na vedlejší účinky léčby a kvalitu života, což hraje v rozhodovacím procesu, jakou terapii zvolit, velmi důležitou roli. Permanentní brachyterapie se nejčastěji používá samostatně, ale v některých případech se může kombinovat se zevní radioterapií nebo s hormonální léčbou.
Klíčová slova:
karcinom prostaty – permanentní brachyterapie – morbiditaVýchodiska
Optimální léčba lokalizovaného karcinomu prostaty není přesně definována a v současné době zahrnuje radikální prostatektomii, zevní radioterapii (external - beam - radiotherapy – EBRT), dočasnou (high dose rate – HDR) brachyterapii, permanentní brachyterapii (PBRT), androgenní supresivní léčbu nebo metodu aktivního sledování (watchful waiting – WW) [1]. Volba léčebné metody vyjma velikosti a charakteristik nádoru závisí na mnoha dalších faktorech, včetně institucionálních standardů, individuálního soudu lékaře, preference pacienta nebo dostupnosti zdrojů.
Brachyterapie je metoda sloužící k dodání vysoké dávky do prostaty. Její výhodou je prudký pokles dávky do okolí. Permanentní brachyterapie se stala v posledních desetiletích velmi populární díky možnosti rychlého návratu k běžným aktivitám, dobrým výsledkům a nízké toxicitě. K dispozici již máme dlouhodobá data, která potvrzují excelentní výsledky této metody u určité skupiny pacientů [2 – 4]. Desetiletá biochemická kontrola u pacientů s nízkým rizikem rekurence se pohybuje v rozmezí 80 – 98 % [5].
Doporučení ABS (American Brachytherapy Society) pro indikaci samostatné permanentní implantace v souladu s doporučením Evropské společnosti pro radiační onkologii a Evropské urologické společnosti (ESTRO/ EAU/ EORTC) [6,7] považuje za nejvhodnější kandidáty pacienty s: PSA < 10 ng/ ml, Gleasonovo skóre (GS) 5 – 6 a objemem prostaty < 40 ml, čili s nízkým rizikem rekurence. Pro kombinaci zevní radioterapie a permanentní brachyterapie jsou indikováni pacienti s: T2b, T2c nebo GS 8 – 10 nebo PSA > 20 ng/ ml. Kontraindikací provedení PBRT je velký objem prostaty a předchozí transuretrální resekce prostaty (TURP), jelikož je zde vyšší riziko uretrální toxicity (tab. 1). Prostatitida a obstrukční symptomatologie patří ke kontraindikacím relativním (tab. 2).
Tab. 1. ESTRO/EAU doporučení pro permanentní implantaci. 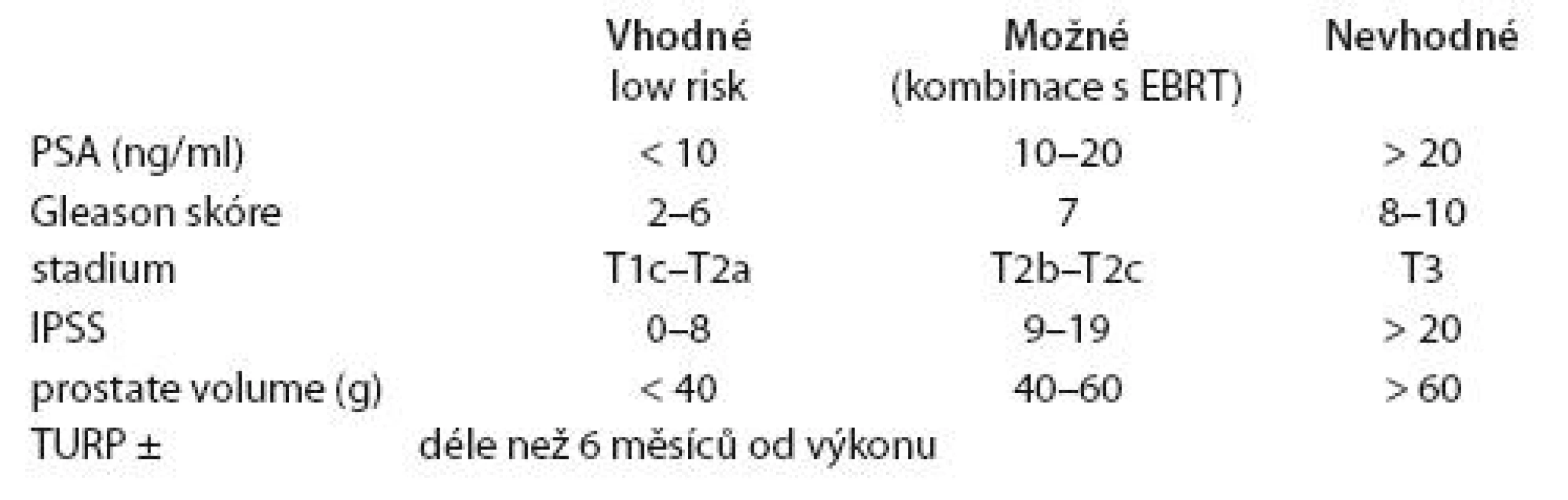
PSA – prostatický specifi cký antigen, IPSS (International prostate symptom score) – mezinárodní skórovací systém příznaků onemocnění prostaty, TURP – transuretrální resekce prostaty Tab. 2. Kontraindikace permanentní implantace. 
Některé práce však publikují velmi dobré výsledky i u vhodně vybraných pacientů se středním rizikem rekurence [8,9]. V Cossetově studii bylo pětileté přežití bez nemoci 97 % u pacientů splňujících definici ABS, u ostatních 94 %. Výsledky byly lepší u podskupiny pacientů s PSA 10 – 15 ve srovnání s pacienty s Gleasonovým skóre 7.
Historie
Permanentní brachyterapie prošla dramatickými změnami od první aplikace, kterou provedl v roce 1910 sir Young [10]. Radiové tuby byly implantovány transuretrálně do prostaty. Pozdější obnovení zájmu o brachyterapii bylo způsobeno objevem nových radioizotopů a přesnějšími implantačními technikami. V roce 1952 byla poprvé zavedena zlatá zrna [11] a v 60. letech Whitmore a Hilaris použili k aplikaci radioizotopu jódu břišní přístup [12]. Otevřené retropubické přístupy však byly spojeny s nehomogenní dávkovou distribucí, a proto bylo zaznamenáno vysoké procento selhání [13]. V roce 1983 Holm popsal transperineální přístup pomocí transrektální sonografie [14]. Ten znamenal výrazné zpřesnění rozmístění zrn a používá se dodnes (obr. 1). Další prudký rozvoj PBRT, zejména v USA, způsobený novými technologiemi pro navigaci a výpočet dávky datujeme do počátku 90. let.
Obr. 1. Transperineální přístup – zavádění jehel do prostaty pod kontrolou trasrektální sonografie. 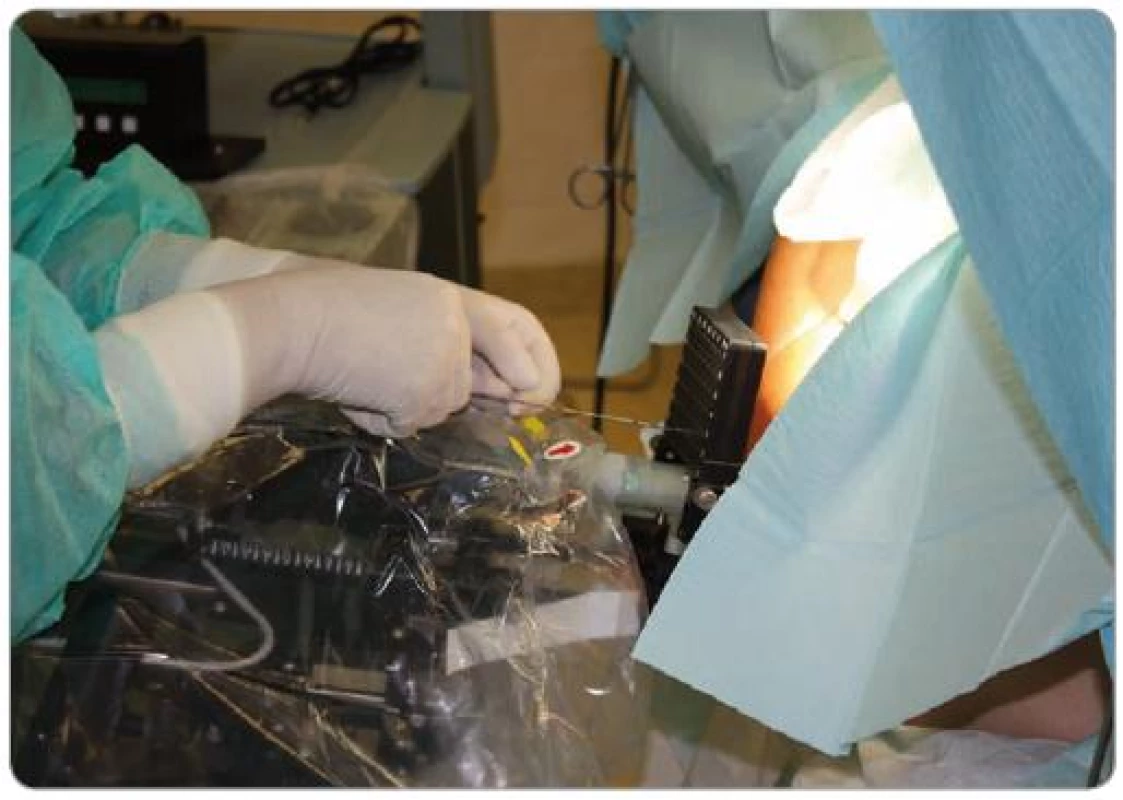
V současnosti se používá permanentní implantace s paladiovými (Pd103) nebo jodovými zrny (I125). Paladium je vhodnější pro rychleji rostoucí tumory, jód pro tumory pomalu rostoucí. Nicméně se jedná pouze o teoretické předpoklady, jelikož klinické studie neprokázaly žádné rozdíly ve výsledcích u žádných podskupin pacientů.
Srovnání PBRT s jinými metodami léčby
Randomizované prospektivní studie srovnávající brachyterapii s dalšími metodami neexistují. Dle retrospektivních analýz a metaanalýz jsou klinické výsledky jednotlivých léčebných modalit srovnatelné [15,16]. Je ovšem vysoce nepravděpodobné, že bude v budoucnu provedena perfektní randomizovaná studie, proto se dále musíme opírat o data ze studií retrospektivních.
PBRT vs IMRT
Srovnání PBRT a nové techniky zevní radioterapie umožňující dávkovou eskalaci – intenzitně modulované RT (IMRT) – ukázalo lepší biochemickou kontrolu onemocnění pro rameno s PBRT – 94 % vs 87 % [17]. Genitourinární (GU) toxicita léčby byla vyšší u PBRT, u techniky IMRT byla zaznamenána vyšší gastrointestinální (GIT) toxicita. Nižší akutní i pozdní toxicita stupně 2 u techniky IMRT ve srovnání s PBRT byla uvedena i v práci filadelfských autorů [18].
PBRT vs 3D zevní RT vs protonová terapie
Protonová terapie je další metodou zevní radioterapie vhodnou pro dávkovou eskalaci v oblasti prostaty. Srovnání PBRT s konformní zevní RT a konformní protonovou terapií ukázalo ekvivalentní biochemickou kontrolu a větší procento mužů s nižším nadirem prostatického specifického antigenu (PSA) ve skupině s PBRT [19].
HDR vs PBRT
Srovnání permanentní BRT se samostatnou dočasnou HDR brachyterapií provedl Martinez a nyní byly publikovány již pětileté výsledky [20]. HDR brachyterapií s iridiem 192 bylo léčeno 248 pacientů, permanentní BRT s paladiem 103 (low dose rate – LDR) 206 pacientů. Pětiletá biochemická kontrola byla 91 % pro LDR skupinu a 89 % pro HDR skupinu. Akutní i pozdní GU toxicita byla signifikantně vyšší v rameni s LDR. Impotence v rameni s HDR byla 20 %, s LDR 30 %.
PBRT u mladších mužů
Studie hodnotící výsledky u více než 2 000 mužů s karcinomem prostaty T1 – T2, N0, M0 analyzovala, zda je věk spojen s progresí onemocnění. Pacientů mladších než 60 let zde bylo 11 %. Nebyl však nalezen signifikantní rozdíl v době bez progrese u mužů mladších 60 let nebo starších [21]. Výsledky u mužů ještě mladších (méně než 50 let) hodnotila další práce s podobným závěrem [22]. Tato metoda léčby by tedy mohla být v některých případech používána i u mladších pacientů.
Kombinace PBRT se zevní RT
Hlavním důvodem pro kombinaci BRT se zevní RT je potřeba aplikovat dávku záření za prostatickou kapsulu u pacientů s vyšším rizikem extrakapsulárního šíření. Kombinace permanentní brachyterapie se zevní RT je doporučena dle ESTRO/ EAU u pacientů se středním rizikem rekurence (PSA 10 – 20, GS 7)[23], mírnou obstrukční symptomato-logií (IPSS 9 – 19) a objemnější prostatou (tab. 1) [24]. Pětileté přežití bez biochemické recidivy onemocnění (disease free survival – DFS) se pohybovalo ve větších studiích od 72 % do 88 % [25,26]. Konsenzus pro sekvenci jednotlivých modalit neexistuje.
Toxicita léčby a kvalita života
Při rozhodování, kterou léčebnou modalitu zvolit, hraje významnou roli toxicita léčby a její vliv na kvalitu života. Vyhodnocování kvality života je relativně mladá disciplina, a prospektivních dat je proto zatím velmi málo. Roeloffzenova prospektivní studie ukázala, že kvalita života se vrací k původním hodnotám po jednom roce po PBRT a i po 6 letech se neliší od vstupního hodnocení [27]. Permanentní BRT tedy neovlivňuje dlouhodobou kvalitu života.
Dočasné akutní močové nežádoucí účinky po PBRT jsou běžné a očekávané. Patří k nim častější močení, urgentní mikce a slabší proud moči. Tyto nežádoucí účinky se projeví nejvíce jeden měsíc po léčbě, přibližně po jednom roce se opět vrací k původnímu stavu [28]. Někteří pacienti v období několika týdnů po PBRT si stěžují i na mírnou inkontinenci, avšak u pacientů bez předchozí TURP se objeví v méně než 1 %. Akutní retence se popisuje od 2 % do 34 % a koreluje s předléčebným objemem prostaty a s vyšším vstupním mezinárodním skóre prostatických symptomů (International Prostatic Symptom Score – IPSS) v důsledku benigní hyperplazie prostaty [29]. Retence je pravděpodobně více ovlivněna vlastním umístěním jehel než dávkou na uretru [30]. Návrat IPSS k původním hodnotám je popisován do jednoho roku po léčbě [31].
Pozdní komplikace zahrnují strikturu uretry, hemoragickou cystitidu, inkontinenci, a to zejména u mužů, kteří prodělali v minulosti trasuretrální resekci prostaty [32]. Riziko striktury uretry je popisováno v 5 letech od 5 % do 12 % a je v korelaci s aplikovanou dávkou na uretru [33].
Střevní funkce jsou ovlivněny pouze asi u 10 % pacientů a u většiny z nich jsou minimálního stupně [34]. Jedná se většinou o radiační proktitidu stupně 1 nebo 2bez nutnosti další terapie. Kombinace se zevní RT může riziko rektální toxicity zvýšit.
Sexuální funkce jsou brachyterapií taktéž ovlivněny. Důležitou roli hraje věk pacienta, komorbidity, jako např. diabetes mellitus, předléčebné erektilní funkce. Její etiologie je multifaktoriální. Pravděpodobnost udržení erektilní funkce dle metaanalýzy byla po BRT 0,76, po kombinaci BRT a zevní RT 0,60, po zevní RT 0,55, po nerve - sparing radikální prostatektomii 0,34, po standardní prostatektomii 0,25 a po kryoterapii 0,13 [35]. Novější analýza 31 prací, kterou provedl panel Americké urologické společnosti, ukázala velmi široký rozptyl dat a potřebu lepší metodologie hodnocení: kompletní erektilní dysfunkce po RAPE v rozmezí 26 – 100 %, 8 – 85 % po zevní RT, 14 – 61 % po BRT, částečná erektilní dysfunkce po RAPE 16 – 48 %, 21 – 47 % po zevní RT a 21 % po BRT [36]. Rozdíl je ovšem mezi sexuální funkcí a sexuální aktivitou. Feigenberg ukazuje, že erekce po jednom roce od léčby mohlo dosáhnout 78 % mužů, ale 50 % popisuje sníženou sexuální aktivitu [37]. Erektilní dysfunkce po RT často dobře reaguje na sildenafil.
Brachyterapie nabízí vysokou pravděpodobnost udržení kontinence, potence a rektální funkce. Přidání HT a zevní RT k BRT může zvýšit genitourinární, gastrointestinální a sexuální toxicitu léčby [38].
Nevýhodou radioterapie je zvýšené riziko radiačně indukovaných sekundárních tumorů rekta a močového měchýře. Po permanentní brachyterapii je však toto riziko velmi nízké a prakticky srovnatelné s pacienty po radikální prostatektomii (1,10 u močového měchýře a 1,08 pro karcinom rekta) [39,40].
PBRT a HT
Není prokázán vliv na lokální kontrolu a přežití pro kombinaci hormonální terapie a PBRT u časného karcinomu prostaty, který je indikován k samostatné PBRT. Neoadjuvantní podání hormonální léčby před PBRT může pomoci redukovat objem prostaty a tím usnadnit transperineální implantaci pod pubickými kostmi. Objem prostaty se po 3 – 7měsíčním podání HT sníží v průměru o 33 % [41].
PSA bounce fenomén
Jedná se o přechodné benigní zvýšení hladiny PSA, zpravidla jeden až dva roky po skončení léčby. Hodnota PSA se nejčastěji zvýší o 0,2 – 1,0 ng/ ml, nicméně asi u 20 % pacientů se zvýší i o 1,0 – 2,0 ng/ ml [42]. Dle nedávno publikované studie až 44 % zvýšení PSA odpovídající selhání léčby dle Phoenix definice (nadir + 2 ng/ ml) je zvýšením benigním (tzv. bounce fenoménem) [43]. Bounce fenomén se častěji objevuje u mladších mužů. Jelikož neexi-stuje žádný způsob, jak rozeznat bounce fenomén od selhání, je nutné záchranou léčbu nezahajovat ihned a vyčkat dalších odběrů. Na druhou stranu může být bounce fenomén prediktorem úspěšnosti léčby [44].
PBRT jako salvage terapie
Ideální léčba lokální recidivy po zevní radioterapii je kontroverzní. Je možné použít radikální prostatektomii, kryo-terapii nebo brachyterapii. S použitím PBRT je možné dosáhnout velmi dobré lokální kontroly s akceptovatelným stupněm komplikací [45]. Nejčastějšími komplikacemi v případě PBRT je obstrukční uropatie. Studie s velmi dlouhou dobou sledování (86 měsíců) ukazuje desetiletý interval bez biochemické recidivy nemoci (FFbF) 54 % a specifické přežití 96 %. Přičemž FFbF bylo signifikantně delší u mužů s hodnotou PSA < 6 ng/ ml před zahájením BRT [46]. GU toxicita léčby byla vyšší (stupně ≥ 2) u pacientů, kteří před zahájením terapie prodělali pánevní lymfadenektomii. PBRT může představovat efektivní a bezpečný postup léčby lokální recidivy po předchozí radioterapii. Zlepšení výsledků a snížení toxicity je možné dosáhnou opatrným výběrem pacientů vhodných k této metodě.
Budoucnost PBRT
Tato technika prodělává velmi rychlý vývoj. Implantace jsou již navigovány pomocí kombinace UZ, CT a magnetické rezonance (MR). Provádí se intraoperační plánování, implantují se zrna z jednoho vpichu. Vyvíjí se robotické systémy, jejichž výhodou je zejména schopnost manipulace jehel v 3D [47].
Závěr
Permanentní brachyterapie je relativně jednoduchá procedura s velmi krátkou dobou hospitalizace, s brzkým zotavením a s rychlým návratem k běžným aktivitám. U vhodně indikovaných pacientů má dlouhodobé excelentní výsledky a nízkou morbiditu. Je možné ji použít i jako salvage terapii po zevní radioterapii. Neustále se zdokonalují techniky provedení a její obliba rychle roste.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, pruducts, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.doc. MUDr. Renata Soumarová, Ph.D.
Oddělení radioterapie a onkologie
Komplexní onkologické centrum
Máchova 30740 01 Nový Jičín
e-mail: renata.soumarova@onkologickecentrum.cz
Zdroje
1. Aus G, Abbou CC, Bolla M et al. European Association of Urology. EAU guidelines on prostate cancer. Eur Urol 2005; 48(4): 546 – 551.
2. Potters L, Morgenstern C, Calugaru E et al. 12‑year outcomes following permanent prostate brachytherapy in patients with clinically localized prostate cancer. J Urol 2005; 173(5): 1562 – 1566.
3. Zelefsky MJ, Kuban DA, Levy LB et al. Multi‑institutional analysis of long‑term outcome for stages T1 – T2 prostate cancer treated with permanent seed implantation. Int J Radiat Oncol Biol Phys 2007; 67(2): 327 – 333.
4. Battermann JJ, Boon TA, Moerland MA. Results of permanent prostate brachytherapy: 13 years of experience at a single institution. Radiother Oncol 2004; 71(1): 23 – 28.
5. Grimm PD, Blasko JC, Sylvester JE et al. 10 - Year biochemic (prostate ‑ specific antigen) control of prostate cancer with (125)I brachytherapy. Int J Radiat Oncol Biol Phys 2001; 51(1): 31 – 40.
6. Ash D, Flynn A, Battermann J et al. ESTRA/ EAU Urological Brachytherapy Group; EORTC Radiotherapy Group. ESTRO/ EAU/ EORTC recommendations on permanent seed implantation for localized prostate cancer. Radiother Oncol 2000; 57(3): 315 – 321.
7. Nag S, Beyer D, Friedland J et al. American Brachytherapy Society (ABS) recommendations for transperineal permanent brachytherapy of prostate cancer. Int J Radiat Oncol Biol Phys 1999; 44(4): 789 – 799.
8. Henry AM, Al ‑ Qaisieh B, Gould K et al. Outcomes following iodine ‑ 125 monotherapy for localized prostate cancer: the results of leeds 10‑year single‑center brachytherapy experience. Int J Radiat Oncol Biol Phys 2010; 76(1): 50 – 56.
9. Cosset JM, Flam T, Thiounn N et al. Selecting patients for exclusive permanent implant prostate brachytherapy: the experience of the Paris Institut Curie/ Cochin Hospital/ Necker Hospital group on 809 patients. Int J Radiat Oncol Biol Phys 2008; 71(4): 1042 – 1048.
10. Young HH. Treatment of carcinoma of the prostate. In: Young HH, Davis DM (eds). Young’s practice of urology: Based on a study of 12,500 cases. 1st ed. Philadelphia: WB Saunders 1926; 644 – 671.
11. Flocks R, Kerr H, Elkins H et al. The treatment of carcinoma of the prostate by interstitial radiation with radioactive gold: A Follow up report. J Urol 1959; 71 : 628 – 633.
12. Whitmore W jr, Hilaris B, Grabstald H. Retropubic implantation of iodine ‑ 125 in the treatment of prostate cancer. J Urol 1972; 108(6): 918 – 920.
13. Zelefsky MJ, Whitmore WF Jr. Long‑term results of retropubic permanent 125iodine implantation of the prostate for clinically localized prostatic cancer. J Urol 1997; 158(1): 23 – 29.
14. Holm HH, Juul N, Pedersen JF et al. Transperineal I ‑ 125 iodine seed implantation in prostatic cancer guided by transrectal ultrasonography. J Urol 1983; 130 : 283 – 286.
15. Norderhaug I, Dahl O, Høisaeter PA at al. Brachytherapy for prostate cancer: a systematic review of clinical and cost effectiveness. Eur Urol 2003; 44(1): 40 – 46. Review.
16. D‘Amico AV, Whittington R, Malkowicz SB et al. Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. JAMA 1998; 280(11): 969 – 974.
17. Wong WW, Vora SA, Schild SE et al. Radiation dose escalation for localized prostate cancer: intensity ‑ modulated radiotherapy versus permanent transperineal brachytherapy. Cancer 2009; 115(23): 5596 – 5606.
18. Eade TN, Horwitz EM, Ruth K et al. A comparison of acute and chronic toxicity for men with low ‑ risk prostate cancer treated with intensity ‑ modulated radiation therapy or (125)I permanent implant. Int J Radiat Oncol Biol Phys 2008; 71(2): 338 – 345.
19. Jabbari S, Weinberg VK, Shinohara K et al. Equivalent biochemical control and improved prostate ‑ specific antigen nadir after permanent prostate seed implant brachytherapy versus high‑dose three ‑ dimensional conformal radiotherapy and high‑dose conformal proton beam radiotherapy boost. Int J Radiat Oncol Biol Phys 2010; 76(1): 36 – 42.
20. Martinez AA, Demanes J, Vargas C et al. High‑Dose‑Rate Prostate Brachytherapy: An Excellent Accelerated ‑ Hypofractionated Treatment for Favorable Prostate Cancer. Am J Clin Oncol 2009 Nov 30. [Epub ahead of print]
21. Shapiro EY, Rais ‑ Bahrami S, Morgenstern C et al. Long‑term outcomes in younger men following permanent prostate brachytherapy. J Urol 2009; 181(4): 1665 – 1671; discussion 1671.
22. Merrick GS, Wallner KE, Galbreath RW et al. Biochemical and functional outcomes following brachytherapy with or without supplemental therapies in men < or = 50 years of age with clinically organ ‑ confined prostate cancer. Am J Clin Oncol 2008; 31(6): 539 – 544.
23. Lee WR, DeSilvio M, Lawton C et al. A phase II study of external beam radiotherapy combined with permanent source brachytherapy for intermediate ‑ risk, clinically localized adenocarcinoma of the prostate: preliminary results of RTOG P ‑ 0019. Int J Radiat Oncol Biol Phys 2006; 64(3): 804 – 809.
24. Zelefsky MJ, Nedelka MA, Arican ZL et al. Combined brachytherapy with external beam radiotherapy for localized prostate cancer: reduced morbidity with an intraoperative brachytherapy planning technique and supplemental intensity ‑ modulated radiation therapy. Brachytherapy 2008; 7(1): 1 – 6.
25. Dattoli M, Wallner K, True L et al. Long‑term outcomes after treatment with brachytherapy and supplemental conformal radiation for prostate cancer patients having intermediate and high‑risk features. Cancer 2007; 110(3): 551 – 555.
26. Critz FA, Levinson AK, Williams WH et al. Simultaneous radiotherapy for prostate cancer: 125I prostate implant followed by external ‑ beam radiation. Cancer J Sci Am 1998; 4(6): 359 – 363.
27. Roeloffzen EM, Lips IM, van Gellekom MP et al. Health ‑ Related Quality of Life up to Six Years After (125)I Brachytherapy for Early ‑ Stage Prostate Cancer. Int J Radiat Oncol Biol Phys 2010; 76(4): 1054 – 1060.
28. Ash D, Bottomley D, Al Qaisieh B et al. A prospective analysis of long‑term quality of life after permanent I ‑ 125 brachytherapy for localised prostate cancer. Radiother Oncol 2007; 84(2): 135 – 139.
29. Bottomley D, Ash D, Al ‑ Qaisieh B et al. Side effects of permanent I125 prostate seed implants in 667 patients treated in Leeds. Radiother Oncol 2007; 82(1): 46 – 49.
30. Eapen L, Kayser C, Deshaies Y et al. Correlating the degree of needle trauma during prostate brachytherapy and the development of acute urinary toxicity. Int J Radiat Oncol Biol Phys 2004; 59 : 1392 – 1394.
31. Lee WR, McQuellon RP, Harris ‑ Henderson K et al. A preliminary analysis of health‑related quality of life in the first year after permanent source interstitial brachytherapy (PIB) for clinically localized prostate cancer. Int J Radiat Oncol Biol Phys 2000; 46(1): 77 – 81.
32. Kleinberg L, Wallner K, Roy J et al. Treatment‑related symptoms during the first year following transperineal 125I prostate implantation. Int J Radiat Oncol Biol Phys 1994; 28(4): 985 – 990.
33. Zelefsky MJ, Hollister T, Raben A et al. Five‑year biochemical outcome and toxicity with transperineal CT ‑ planned permanent I ‑ 125 prostate implantation for patients with localized prostate cancer. Int J Radiat Oncol Biol Phys 2000; 47(5): 1261 – 1266.
34. Merrick GS, Butler WM, Wallner KE et al. Long‑term rectal function after permanent prostate brachytherapy. Cancer J 2007; 13(1): 95 – 104.
35. Robinson JW, Moritz S, Fung T. Meta‑analysis of rates of erectile function after treatment of localized prostate carcinoma. Int J Radiat Oncol Biol Phys 2002; 54(4): 1063 – 1068.
36. Burnett AL, Aus G, Canby - Hagino ED et al. American Urological Association Prostate Cancer Guideline Update Panel. Erectile function outcome reporting after clinically localized prostate cancer treatment. J Urol 2007; 178(2): 597 – 601.
37. Feigenberg SJ, Lee WR, Desilvio ML et al. Health‑related quality of life in men receiving prostate brachytherapy on RTOG 98 – 05. Int J Radiat Oncol Biol Phys 2005; 62(4): 956 – 964.
38. Henderson A, Laing RW, Langley SE. Quality of life following treatment for early prostate cancer: does low dose rate (LDR) brachytherapy offer a better outcome? A review. Eur Urol 2004; 45(2): 134 – 141. Review.
39. Baxter NN, Tepper JE, Durham SB et al. Increased risk of rectal cancer after prostate radiation: a population‑based study. Gastroenterology 2005; 128(4): 819 – 824.
40. Nieder AM, Porter MP, Soloway MS. Radiation therapy for prostate cancer increases subsequent risk of bladder and rectal cancer: a population based cohort study. J Urol 2008; 180(5): 2005 – 2009; discussion 2009 – 2010.
41. Kucway R, Vicini F, Huang R et al. Prostate volume reduction with androgen deprivation therapy before interstitial brachytherapy. J Urol 2002; 167(6): 2443 – 2447.
42. Mitchell DM, Swindell R, Elliott T et al. Analysis of prostate ‑ specific antigen bounce after I(125) permanent seed implant for localised prostate cancer. Radiother Oncol 2008; 88(1): 102 – 107.
43. Thompson A, Keyes M, Pickles T et al. Evaluating the Phoenix definition of biochemical failure after (125)I prostate brachytherapy: Can PSA kinetics distinguish PSA failures from PSA bounces? Int J Radiat Oncol Biol Phys 2010 Feb 2. [Epub ahead of print].
44. Patel C, Elshaikh MA, Angermeier K et al. PSA bounce predicts early success in patients with permanent iodine ‑ 125 prostate implant. Urology 2004; 63(1): 110 – 113.
45. Aaronson DS, Yamasaki I, Gottschalk A et al. Salvage permanent perineal radioactive ‑ seed implantation for treating recurrence of localized prostate adenocarcinoma after external beam radiotherapy. BJU Int 2009; 104(5): 600 – 604.
46. Burri RJ, Stone NN, Unger P et al. Long‑Term Outcome and Toxicity of Salvage Brachytherapy for Local Failure After Initial Radiotherapy for Prostate Cancer. Int J Radiat Oncol Biol Phys 2010 Feb 4. [Epub ahead of print].
47. Wei Z, Wan G, Gardi L et al. Robot ‑ assisted 3D ‑ TRUS guided prostate brachytherapy: system integration and validation. Med Phys 2004; 31(3): 539 – 548.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2010 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Místo permanentní brachyterapie v léčbě lokalizovaného karcinomu prostaty
- Určování rozsahu onemocnění u non‑Hodgkinových lymfomů – doporučení Kooperativní lymfomové skupiny
- Současné postavení transplantace krvetvorných buněk v léčbě lymfomů – přehled
- Vliv onkologické léčby na lidskou reprodukci
- Analýza sérových hladin vybraných biologických ukazatelů u monoklonální gamapatie nejistého významu a mnohočetného myelomu
- Co je postup „lege artis“ u onkologického pacienta v terminálním stavu?
- Klinický registr pro hepatocelulární karcinom
- Průběh a závěry mezioborového setkání „Winter GLIO TRACK Meeting“ 2010
- Zápis ze schůze výboru České onkologické společnosti dne 21. 5. 2010 v Brně
- Cetkovský P, Kouba M et al.Diferenciální diagnostika plicních infiltrátů a pokroky v léčbě mykotických infekcí u imunokompromitovaných pacientů.Praha: Triton 2009. 259 s. ISBN 978- 80- 7387- 343- 1.
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Určování rozsahu onemocnění u non‑Hodgkinových lymfomů – doporučení Kooperativní lymfomové skupiny
- Současné postavení transplantace krvetvorných buněk v léčbě lymfomů – přehled
- Vliv onkologické léčby na lidskou reprodukci
- Co je postup „lege artis“ u onkologického pacienta v terminálním stavu?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



