-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Určování rozsahu onemocnění u non‑Hodgkinových lymfomů – doporučení Kooperativní lymfomové skupiny
Staging of Non ‑ Hodgkin’s Lymphoma – Recommendations of the Czech Lymphoma Study Group
Backgrounds:
The Ann Arbor system is typically used for the staging of Non ‑ Hodgkin‘s lymphomas. This classification was nevertheless originally developed in the 1970s for Hodgkin‘s lymphoma, a disease usually confined to the lymph nodes with less frequent dissemination to extralymphatic organs/ tissues and extremely rare primary extranodal involvement. Non - Hodgkin‘s lymphomas, however, are more often associated with extralymphatic involvement and primary extranodal lymphomas are relatively common (approximately 1/ 3 of cases). Therefore, the value of the Ann Arbor staging system appears to be limited in these cases. An analysis of data from centres participating within the Czech Lymphoma Study Group showed that staging of Non - Hodgkin‘s lymphomas with extranodal involvement is not uniform.Design:
At the end of 2009, a draft for a Non - Hodgkin‘s lymphomas staging system was put forward for use by the lymphoma register of the Czech Lymphoma Study Group with special regard paid to the involvement of extralymphatic organs/ tissues. This draft was further refined following comments from members of the Czech Lymphoma Study Group committee and the final form was accepted at the meeting of the Czech Lymphoma Study Group committee in January 2010. Results: A consensus was reached at the meeting of the Czech Lymphoma Study Group committee regarding the staging of various combinations of nodal and extranodal involvement. For the purpose of suitable staging and appropriate treatment intensity, extranodal organs were divided into ”major” – liver, lungs, bones, mesothelium (pleura, peritoneum, pericardium) and soft tissues. All other organs were defined as “minor”.Conclusion:
The Ann Arbor staging system is suitable for the staging of Non ‑ Hodgkin‘s lymphomas with lymph node/ lymphatic tissue involvement. As regards the extralymphatic spread of the disease or primary extranodal lymphomas, this classification should rather be adapted to practical needs. The validity of the updated classification system will be assessed in both prospective and retrospective Czech Lymphoma Study Group studies.Key words:
lymphoma – lymph nodes – staging – classification – recommendations
Autori: A. Sýkorová 1; D. Belada 1; L. Smolej 1; R. Pytlík 2; K. Benešová 2; I. Vášová 3; T. Papajík 4; D. Šálek 3; V. Procházka 4
; M. Matuška 5; M. Brejcha 6; K. Kubáčková 7; E. Kabíčková 8; H. Mociková 9; V. Campr 10; M. Trněný 2
Pôsobisko autorov: Oddělení klinické hematologie, II. interní klinika FN HK a LF UK, Hradec Králové 1; I. interní klinika 1. LF UK a VFN, Praha 2; Interní hematoonkologická klinika, FN Brno 3; Hemato-onkologická klinika, FN Olomouc 4; Ústav klinické hematologie, FN Ostrava 5; Onkologické centrum J. G. Mendela, Nový Jičín 6; Radioterapeuticko‑onkologické oddělení, FN Motol, Praha 7; Klinika dětské hematologie a onkologie 2. LF UK a FN Motol, Praha 8; Oddělení klinické hematologie, FN Královské Vinohrady, Praha 9; Ústav patologie a molekulární medicíny 2. LF UK a FN Motol, Praha 10
Vyšlo v časopise: Klin Onkol 2010; 23(3): 146-154
Kategória: Přehledy
Súhrn
Východiska:
Rozsah nemoci non‑Hodgkinových lymfomů se obvykle stanovuje podle rozšířené Ann Arbor klasifikace. Tato klasifikace byla původně vytvořena pro Hodgkinův lymfom, který postihuje převážně lymfatické uzliny. U Hodgkinova lymfomu se neobjevuje tak časté šíření do extralymfatických orgánů a tkání a primární vznik v extralymfatické tkáni je vzácný. Non ‑ Hodgkinovy lymfomy jsou ovšem mnohem častěji spojeny s extralymfatickým šířením a asi 1/ 3 případů se řadí mezi primárně extranodální lymfomy. Proto je použití rozšířené Ann Arbor klasifikace v těchto případech u non‑Hodgkinových lymfomů omezené. V rámci zpracovávání dat registru non‑Hodgkinových lymfomů Kooperativní lymfomové skupiny bylo zjištěno, že určení rozsahu postižení u non‑Hodgkinových lymfomů není v České republice jednotné v těch případech, kdy se jedná o diseminaci onemocnění do extranodálního orgánu nebo tkáně.Cíl:
Na konci roku 2009 byl vypracován návrh určení klinického stadia u non‑Hodgkinových lymfomů se zvláštním zřetelem k postižení extralymfatických orgánů/ tkání pro potřeby lymfomového registru Kooperativní lymfomové skupiny. K tomuto návrhu se vyjádřili členové výboru Kooperativní lymfomové skupiny. Návrh byl přijat na zasedání výboru v Brně v lednu roku 2010. Výsledky: Na zasedání výboru Kooperativní lymfomové skupiny byla přijata dohoda týkající se určení klinického stadia non‑Hodgkinových lymfomů s nodálním i extranodálním šířením. Pro účely určení klinického stadia a tomu odpovídající léčebné intenzity byly extralymfatické orgány rozděleny na „velké“ orgány – játra, plíce, kosti, mezotel (pleura, peritoneum, perikard) a měkké tkáně. Všechny ostatní orgány byly definovány jako „malé“.Závěr:
U postižení lymfatických orgánů je k určení rozsahu nemoci non‑Hodgkinových lymfomů vhodná rozšířená Ann Arbor klasifikace. Pro extralymfatické šíření nemoci či u primárně extranodálních lymfomů je vhodné tuto klasifikaci lépe přizpůsobit praktickým potřebám. Validita vypracované klasifikace bude hodnocena v prospektivních i retrospektivních studiích Kooperativní lymfomové skupiny.Klíčová slova:
lymfom – lymfatické uzliny – určování stadia – klasifikace – doporučeníVýchodiska
Non - Hodgkinovy lymfomy (NHL) jsou heterogenní skupinou hematologických malignit vznikajících z lymfatické tkáně [1].
NHL může vzniknout ve spojení s chronickými zánětlivými procesy (Helicobacter pylori, chlamydie), v souvislosti s imunosupresí (vrozené nebo získané poruchy imunity), s virovou infekcí (HIV, EBV, HHV ‑ 8) či s dědičnou zátěží (2 – 3krát vyšší riziko vzniku lymfomu u příbuzných první linie) [1 – 3]. WHO (World Health Organization) klasifikace z roku 2008 rozděluje NHL na skupinu prekurzorových lymfomů a na skupinu, která vzniká ze zralých lymfocytů [1 – 5].
V současné době je možno více než polovinu případů non‑Hodgkinových lymfomů charakterizovat pomocí prognostických indexů. K základním prognostickým charakteristikám agresivních NHL patří mezinárodní prognostický index IPI (International Prognostic Index) [1 – 3,6]. Používá se klasický index IPI nebo věkově upravený index AA IPI (Age Adjusted International Prognostic Index) pro nemocné ≤ 60 let [1 – 3,6]. V éře imunochemoterapie se jeví jako lepší prediktor léčebné odpovědi revidovaný index IPI (Revised International Prognostic Index) [7].
Použitím těchto prognostických indexů je možno vyjádřit procentuální počet pacientů, kteří dosáhnou kompletní remise, a určit medián celkového přežití [6,7].
Pro folikulární lymfomy se používá index FLIPI (Follicular Lymphoma International Prognostic Index) [8]. V roce 2009 publikovali Federico et al práci, která představuje nově upravený mezinárodní prognostický index pro folikulární lymfomy FLIPI2 používaný v éře imunochemoterapie [9]. Podobně byl vypracován index MIPI (Mantle cell lymphoma International Prognostic Index) pro lymfomy z buněk plášťové zóny, prognostický index pro blíže nespecifikované periferní T‑lymfomy a primární lymfomy centrálního nervového systému (CNS) [10 – 12]. Přehled mezinárodních prognostických indexů ukazuje tab. 1.
Tab. 1. Přehled mezinárodních prognostických indexů. 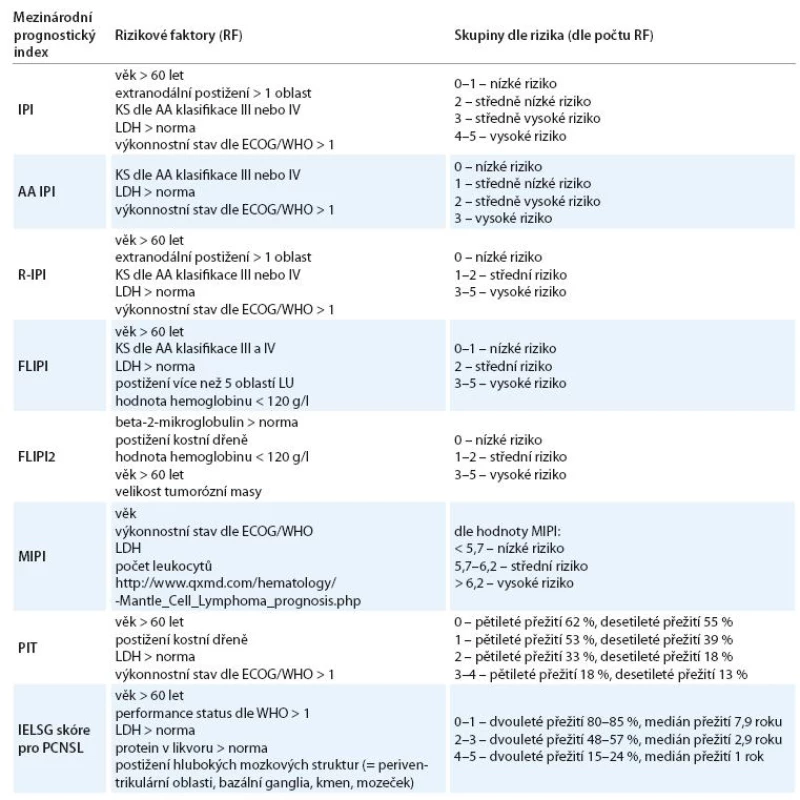
RF – rizikové faktory, IPI (International Prognostic Index) – mezinárodní prognostický index, AA IPI (Age Adjusted) – věkově upravené IPI, R-IPI (Revised-International Prognostic Index) – revidované IPI, FLIPI (Follicular Lymphoma International Prognostic Index) – mezinárodní prognostický index pro folikulární lymfomy, FLIPI2 – nově upravený mezinárodní prognostický index pro folikulární lymfomy, KS – klinické stadium, AA klasifi kace – Ann Arbor klasifi kace, LDH – laktátdehydrogenáza, ECOG/WHO – Eastern Cooperative Oncology Group/World Health Organization, PIT – mezinárodní prognostický index pro periferní T-lymfomy, IELSG skóre pro PCNSL – International Extranodal Lymphoma Study Group, PCNSL – primární lymfom centrálního nervového systému Pro stanovení individuální prognózy nemocného s lymfomem je proto nutné stanovit přesnou diagnózu, zhodnotit výkonnostní stav nemocného, věk, stanovit hodnotu laktátdehydrogenázy (LDH), určit rozsah choroby a zjistit další charakteristiky v závislosti na diagnóze nemocného [1 – 3,13 – 15].
Základem pro stanovení diagnózy je histologie reprezentativní tkáně. Velmi důležitá je správná diagnóza specifického podtypu NHL, ke které přispívají imunofenotypizační, imunohistochemické, cytogenetické a molekulárněgenetické metody [1 – 3].
Mezi rutinně prováděná vstupní vyšetření patří: 1) anamnéza se zaměřením na ,,B - příznaky“; 2) základní fyzikální vyšetření – výkonnostní stav dle ECOG/ WHO, vyšetření periferních lymfatických uzlin, velikost jater a sleziny; 3) laboratorní vyšetření – sedimentace erytrocytů, krevní obraz s manuálním diferenciálním rozpočtem, biochemické vyšetření včetně LDH, beta‑2 - mikroglobulin, sérologické vyšetření na hepatitidy A, B, C a HIV 1,2 (se souhlasem nemocného); 4) vyšetření kostní dřeně (cytologie, imunofenotypizace, histologie); 5) zobrazovací metody: CT vyšetření u indolentních lymfomů či PET/ CT u agresivních lymfomů a Hodgkinova lymfomu, ultrazvukové vyšetření krku (není‑li provedeno CT) [1 – 3].
Dle rozsahu onemocnění na základě diagnostických vyšetření stanovujeme klinické stadium, které se určuje podle rozšířené Ann Arbor klasifikace (AA klasifikace) (tab. 2) [1 – 3,13 – 18].
Tab. 2. Ann Arbor klasifi kace [16,18]. ![Ann Arbor klasifi kace [16,18].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/48554e103f5ff1fa0f454440e9fad8b7.jpg)
LU – lymfatické uzliny, E – extranodální postižení, S – postižení sleziny AA klasifikace byla pojmenována podle místa vzniku ve státě Michigan v USA a byla vytvořena dohodou mezi experty z USA, Velké Británie, Německa a Francie v roce 1971 [16]. Byla tak nahrazena Reyova klasifikace z roku 1965 [17]. AA klasifikace byla následně upravena na setkání v Cotswolds (1988), kde byla projednávána role zobrazovacích metod při určování rozsahu nemoci, kritéria pro postižení jater a sleziny, bulky onemocnění a kritéria odpovědi na léčbu [18].
AA klasifikace byla původně vytvořena pro Hodgkinův lymfom (HL), který je v převážné většině charakterizován infiltrací lymfatických orgánů. Primárně extranodální postižení je u HL vzácné a diseminace do extralymfatických orgánů a tkání není častá [1 – 3,14,15,18]. NHL vzniká také často v lymfatických uzlinách (LU), ale část postižení je spojena s extranodálním šířením a 20 – 34 % případů se řadí mezi primárně extranodální lymfomy v závislosti na definici primárně extranodálního postižení [19 – 21].
Současně pozorujeme u NHL odlišné biologické i klinické chování – primárně extranodální lymfomy jsou delší dobu lokalizovány. U vysoce agresivních lymfomů může docházet k diseminaci extralymfaticky, např. i do centrálního nervového systému (CNS), s čímž se u HL prakticky nesetkáváme [22,23].
Z výše uvedených důvodů je použití původní a rozšířené AA klasifikace pro stanovení rozsahu onemocnění v případech infiltrace extralymfatických tkání či orgánů omezené a pro dané případy matoucí a nepřehledné. Proto se u NHL pro zařazování do klinických stadií používají různé modifikace AA klasifikace s dělením na primárně nodální a primárně extranodální formy (tab. 3 a 4) [19 – 21,23 – 25].
Tab. 3. Modifi kovaná Ann Arbor klasifi kace pro NHL [23]. ![Modifi kovaná Ann Arbor klasifi kace pro NHL [23].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/d57d3811722eb17023353af4aafeddf3.jpg)
NHL – Non-Hodgkinův lymfom, LU – lymfatické uzliny, S – postižení sleziny, E – extranodální postižení Tab. 4. Klasifikace pro extranodální lymfomy [21]. ![Klasifikace pro extranodální lymfomy [21].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c5d0791b5ddabf3b16ce8e279e05eed1.jpg)
LU – lymfatické uzliny V rámci zpracování dat registru Ko-operativní lymfomové skupiny (KLS) bylozjištěno, že určení rozsahu postižení u lymfomů není v České republice konzistentní v těch případech, kdy se jedná o postižení extranodálního orgánu nebo tkáně. Z praktického pohledu totiž není vždy jednoznačné, zda se jedná o primárně nodální či primárně extranodální postižení, pokud jsou postiženy LU a současně extranodální orgány [19,20]. Dochází tak k různým interpretacím určení stadia lymfomu. Je však nutno podotknout, že nejasné pojmy z původní a rozšířené AA klasifikace týkající se extralymfatického postižení nejsou v dostupné literatuře definovány [16,18,19,26].
Proto došlo na schůzi výboru KLS dne 27. 1. 2010 v Brně k dohodě, která sjednocuje určování rozsahu NHL se zaměřením na extralymfatické šíření.
Doporučení Kooperativní lymfomové skupiny
Lymfatické orgány
Při postižení lymfatických orgánů se určuje rozsah onemocnění NHL pomocí rozšířené AA klasifikace. Mezi lymfatické orgány řadíme lymfatické uzliny, slezinu, thymus, Waldeyerův mízní okruh, apendix a Peyerovy plaky [15,18].
AA klasifikace používá při určování rozsahu lymfomu pojem jedna oblast lymfatických uzlin (LU), který byl definován v Reyově klasifikaci [15]. Pokud je postižena jedna oblast LU, jde o stadium I,při postižení dvou oblastí o stadium II (obr. 1, tab. 2) [15,17,18].
Obr. 1. Schéma jednotlivých lymfatických oblastí (pro lymfomy vyjma folikulárních lymfomů). 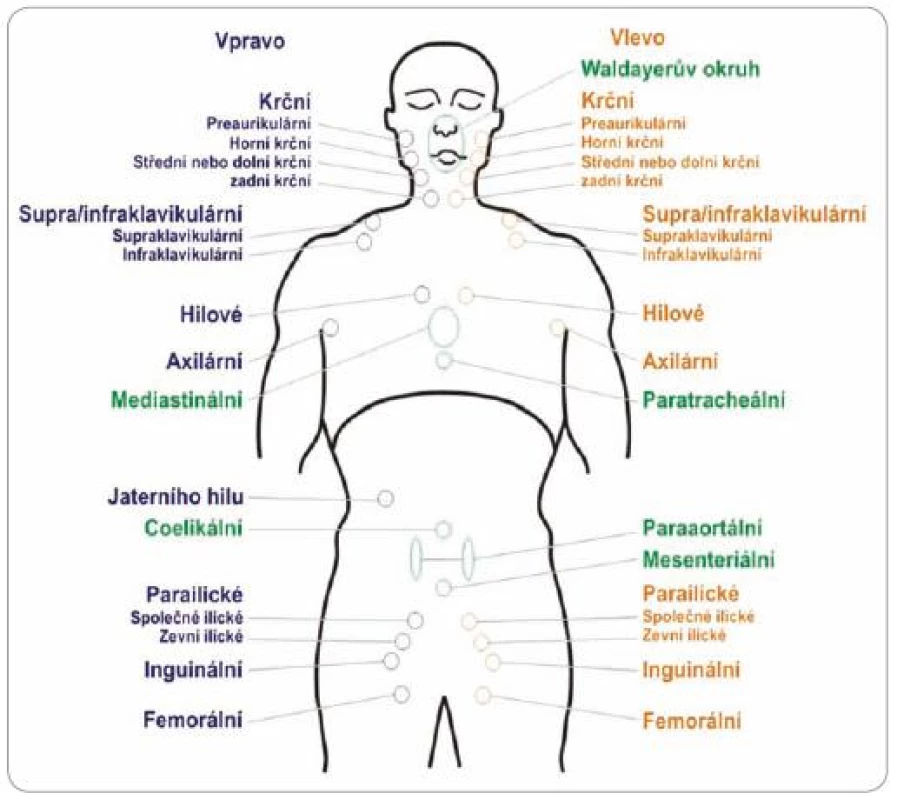
Rozdělení do jednotlivých oblastí lymfatických uzlin znázorňuje obr. 1. Oblasti byly výborem KLS mírně upraveny. U párových uzlinových lokalizací (např. oboustranné postižení krční uzlin atd.) se počítá levostranná a pravostranná lokalizace zvlášť.
U folikulárních lymfomů, kde se po-užívá prognostický index FLIPI, se počet oblastí stanovuje odlišně [8]. U párových uzlinových lokalizací se také počítá levostranná a pravostranná lokalizace zvlášť.
Waldeyerův okruh řadíme k nodálním lokalizacím, i když se nejedná o uzlinu, nýbrž o lymfatický orgán. Infiltrace jednotlivých částí i postižení celého okruhu se řadí do klinického stadia I dle rozšířené AA klasifikace. Přídatné postižení dalších nodálních lokalizací mění stadium dále dle AA klasifikace (např. postižení Waldeyerova okruhu a postižení krčních uzlin – stadium II atd.).
Slezina je označena za postiženou lymfomem, pokud je přítomna PET pozitivita a/ nebo jsou přítomna ložiska ve slezině a/ nebo proběhla histologická verifikace. Samotná splenomegalie zjištěná dle radiologických metod nestačí pro označení sleziny za postiženou. O postižení sleziny se však jedná v případě, že je hmatná a současně zvětšená dle radiologických metod. Postižení sleziny se označuje písmenem „S“ [1 – 3,15,16,18].
Extranodální postižení
Jelikož původní ani rozšířená AA klasifikace nevysvětluje základní pojmy týkající se extranodálního postižení (EN) (lokalizované, diseminované a difuzní postižení EN orgánu), bylo nutné tyto pojmy na zasedání KLS definovat.
Lokalizované postižení EN orgánu nebo tkáně: přítomnost jednoho ložiska v EN orgánu nebo tkáni (např. jedno ložisko v plíci).
Diseminované postižení EN orgánu či tkáně: přítomnost dvou a více ložisek v EN orgánu či tkáni (např. dvě a/ nebo více ložisek v játrech).
Difuzní postižení EN orgánu či tkáně: rozptýlené postižení po celém EN orgánu (např. rozptýlený záchyt PET pozitivity ve štítné žláze, drobná ložiska v celé štítné žláze).
Z praktického hlediska jsme extranodální orgány rozdělili na tzv. „malé“ a „velké“ orgány, pro které byl zvolen odlišný přístup k určování rozsahu onemocnění z důvodu rozdílného klinického dopadu při jejich postižení.
„Velké“ EN orgány (plíce, játra, kostra, měkké tkáně, mezotel – pleura, perikard, pobřišnice)
Rozsah nemoci u postižení „velkých“ orgánů se hodnotí dle rozšířené AA klasifikace takto: při lokalizovaném postižení „velkého“ orgánu (jedno ložisko) se stadium určuje dle rozsahu postižení LU a přidává se označení „E“. Přítomnost dvou a více ložisek v orgánu nebo difuzní postižení orgánu se hodnotí jako stadium IV bez ohledu na postižení LU.
Klinické stadium – postižení „velkých“ EN orgánů
Stadium IE – lokalizované postižení „velkého“ EN orgánu bez průkazu lymfomu jinde (např. jedno ložisko v plíci).
Stadium IIE – lokalizované postižení „velkého“ EN orgánu a postižení LU na stejné straně bránice (např. jedno ložisko v plíci a postižení mediastinálních uzlin).
Stadium IIIE – lokalizované postižení „velkého“ EN orgánu a postižení LU na obou stranách bránice (např. jedno ložisko v plíci a postižení mediastinálních a retroperitoneálních uzlin).
Stadium IV – diseminované či difuzní postižení „velkého“ EN orgánu či jakékoliv postižení více než jednoho EN orgánu nezávisle na postižení LU (např. 1. dvě a více ložisek v plíci, 2. difuzní postižení plic, 3. postižení plic, štítné žlázy a retroperitoneální postižení).
U stadia IV se neudává označení „E“.
Pozn.: Při průkazu jednoho ložiska ve „velkém“ orgánu je doporučena bioptická verifikace.
Postižení jater
Játra jsou označena za postižená lymfomem tehdy, pokud je přítomna PET pozitivita a/ nebo jsou přítomna ložiska a/ nebo proběhla histologická verifikace.
Hepatomegalie zjištěná dle samotných radiologických metod nestačí pro označení postižení jater, stejně tak nestačí průkaz klinicky hmatných jater s potvrzenou hepatomegalií zobrazovacími metodami. Radiologicky a klinicky zvětšená játra neřadíme k postižení z důvodu možné ptózy orgánu, tělesné konstituce, možné přítomnosti pravostranné kardiální dekompenzace atd., což by v opačném případě mohlo vést k nadhodnocení klinického stadia, a tím ke změně prognózy nemocného. Při izolovaném postižení jater je nutná bioptická verifikace.
Postižení pleury
Postižení pleury se může manifestovat přítomností pleurálního výpotku. Výpotek je hodnocen jako samostatná EN lokalizace pouze při cytologickém či imunofenotypizačním průkazu nádorových buněk. Pokud se jedná o ověřený, byť i jednostranný výpotek s přítomností lymfomových buněk, jde o stadium IV.
U postižení pobřišnice a perikardu platí stejné definice jako u postižení pleury, včetně přítomnosti výpotku.
Infiltrace „malých“ EN orgánů (štítná žláza, děloha, slinivka břišní, jednostranné postižení slinné žlázy, nadledviny, ledviny, prsu, varlete, očních adnex atd.) se označuje jako příslušné stadium dle postižení uzlin + „E“ bez ohledu na počet ložisek (lokalizované, diseminované, difuzní postižení).
To znamená, že zde vycházíme z klasifikace pro primárně extranodální lymfomy [21,23].
Klinické stadium – postižení „malých“ EN orgánů
Stadium IE – jakékoliv postižení „malého“ EN orgánu bez průkazu lymfomu jinde (např. 3 ložiska ve štítné žláze).
Stadium IIE – jakékoliv postižení „malého“ EN orgánu s postižením LU na téže straně bránice jako se nachází EN orgán (např. dvě ložiska ve štítné žláze a postižení krčních LU).
Stadium IIIE – jakékoliv postižení „malého“ EN orgánu s postižením LU po obou stranách bránice (např. difuzní postižení štítné žlázy a současné postižení krčních, retroperitoneálních a mezenteriálních LU).
Stadium IV – jakékoliv postižení více než jednoho EN orgánu bez ohledu na postižení LU (např. postižení ledviny a nadledviny). Opět se u stadia IV neudává označení „E“.
Doporučení pro určování rozsahu NHL s extralymfatickým šířením do „velkých“ a „malých“ orgánů znázorňuje tab. 5.
Tab. 5. Dohoda KLS pro určování klinických stadií u NHL s extralymfatickým šířením dle AA klasifikace a modifikované AA klasifikace. 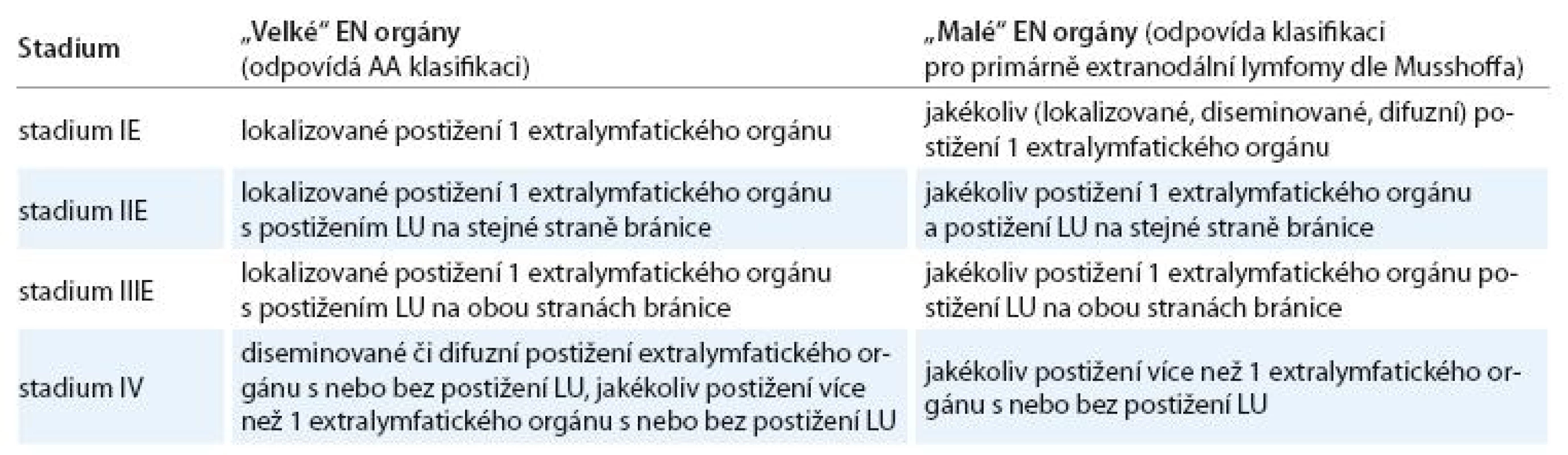
„velké“ EN orgány – játra, plíce, mezotel (pleura, pobřišnice, perikard), kostra, měkké tkáně; „malé“ EN orgány – jiné než „velké“ orgány; E – extranodální postižení Postižení kostní dřeně, periferní krve, párových EN orgánů a postižení CNS
Postižení kostní dřeně
Pro určení postižení kostní dřeně je zásadní histologické vyšetření včetně imunohistochemických metod k průkazu klonality a původu nádorových buněk. Cytologické a imunofenotypizační vyšetření, event. vyšetření molekulárněgenetickými metodami, jsou považovány za metody pomocné, které mohou při negativním histologickém nálezu vyslovit podezření na přítomnost minimální reziduální nemoci. V tomto případě je ale výsledek vyšetření kostní dřeně považován za negativní. Pouze při průkazu přítomnosti maligních buněk ve dřeni histologickými metodami hodnotíme kostí dřeň jako postiženou lymfomem. Při postižení kostní dřeně či periferní krve se jedná vždy o klinické stadium IV, bez označení „E“. Kostní dřeň a periferní krev jsou považovány za jeden kompartment, a tudíž se jejich společné postižení hodnotí jako jedna extranodální lokalizace.
Postižení párových orgánů
Postižení obou párových orgánů (např. obě ledviny, oba prsy, obě varlata, oba vaječníky) se hodnotí vždy jako sta-dium IV.
Postižení CNS
Sem patří i postižení oka (sítnice, sklivec, oční nerv) na rozdíl od postižení očních adnex, která patří k samostatné extranodální lokalizaci.
- U primárního lymfomu CNS (PCNSL) se klinické stadium neuvádí.
- Pokud dojde k diseminaci lymfomu (metastatickému šíření) do CNS (mozek a/ nebo meningy a/ nebo mícha a/ nebo postižení oka), jde vždy o klinické stadium IV. Jakékoliv postižení CNS s různým rozsahem postižení LU se tedy hodnotí jako stadium IV.
Pro vyšetření likvoru je podstatné cytologické a především imunofenotypizační vyšetření pro záchyt maligních buněk. Pozitivní záchyt v cytologii a/ nebo imunofenotypizaci je považován za doklad o postižení CNS lymfomem.
Postižení EN orgánů a šíření per continuitatem
Postižení oblastí LU a prorůstání více EN orgány na téže straně bránice se označí jako klinické stadium IIE (např. mediastinální uzliny + prorůstání do pleury + prorůstání do perikardu + prorůstání do sterna).
Pro úplnost uvádíme, dle jakých klasifikací hodnotíme rozsah nemoci u specifických primárně extranodálních lymfomů:
U primárního postižení gastrointestinálního traktu (GIT) stanovujeme rozsah nemoci podle modifikované Black-ledge klasifikace z roku 2007 [27,28].
Primární kožní lymfomy se klasifikují dle TNM klasifikace dle ISCL/ EORTC 2007 [29,30].
Mycosis fungoides a Sézaryho syndrom jsou nyní po zásluze každý oddělenou jednotkou, byť byly tradičně kategorizovány společně pro téměř shodný histologický obraz [5]. Rozsah nemoci obou jednotek se hodnotí dle TNMB klasifikace dle ISCL/ EORTC 2007 [31].
Mezinárodní prognostické indexy – otázka definice věku > 60 let
Mezi rizikové faktory většiny prognostických indexů (IPI, R ‑ IPI, FLIPI, FLIPI2, PIT, IELSG skóre pro PCNSL) patří věk > 60 let.
Na schůzi KLS byla stanovena definice věku > 60 let jako 1. den po dosažení 60. narozenin.
B - příznaky (intenzivní noční pocení, febrilie neinfekčního původu > 38 °C trvající alespoň 1 měsíc, neobjasněný úbytek váhy > 10 % za posledních 6 měsíců):
Přítomnost alespoň jednoho z B - příznaků se označuje písmenem „B“, absence příznaků písmenem „A“ [16,18].
Hodnocení léčebné odpovědi lymfomů
Léčebná odpověď se hodnotí dle Chesonových kritérií z roku 2007 jak u NHL, tak i HL [32]. Léčebná odpověď u PCNSL jako specifického postižení se hodnotí dle léčebných odpovědí dle Abreye et al [33].
Diskuze
Určení rozsahu nemoci je stěžejním prognostickým a prediktivním faktorem u agresivních i indolentních lymfomů [6 – 8]. Proto je důležité správně rozlišit limitované stadium I a II od pokročilých stadií III nebo IV. AA klasifikace upravená na setkání v Cotswolds v roce 1988 se používá v současné době jak pro určování rozsahu nemoci u HL, tak i u NHL. Je vhodná pro určování rozsahu nemoci u izolovaného postižení lymfatických orgánů/ tkání.
Zvláštní pozornost zasluhuje hodnocení postižení Waldeyerova okruhu a sleziny, kde definice pro postižení nejsou zcela jednoznačné.
Waldeyerův okruh (WO) zahrnuje lymfatickou tkáň nosohltanových mandlí, patrových mandlí, jazykové mandle, Gerlachových mandlí, zadní stěny hltanu a vchodu do hrtanu. Není zcela jasné, zda by se měl WO řadit mezi nodální nebo extranodální lokalizace [34]. Dle AA klasifikace se WO řadí k nodálním lokalizacím [18]. Z toho vychází doporučení KLS.
Postižení sleziny: Doporučení KLS se řídí definicí pro postižení sleziny podle rozšířené AA klasifikace [18]. Slezina je považována za postiženou při PET pozitivitě a/ nebo přítomnosti ložisek.
Méně vhodné až nevyhovující se nám zdá použití rozšířené AA klasifikace při určování klinických stadií u nemocných, kde se lymfom šíří extralymfaticky.
V AA klasifikaci je několik problematických míst pro interpretaci extralymfatického šíření nemoci:
- Definice pro stadium I a stadium IV se při extranodálním postižení překrývají. V AA klasifikaci je uvedeno, že izolované postižení extralymfatického orgánu znamená stadium IE. Na druhou stranu stadium IV je definováno jako diseminované či difuzní postižení jednoho či více extranodálních orgánů nebo tkání s postižením LU nebo bez něho [16,18].
- Není jasné, co přesně znamená v sou-časné době pojem extranodální „E“ léze [18,26]. Extranodální šíření je definováno jako přímé šíření lymfomu do EN orgánu nebo tkáně z přilehlých LU či lokalizované postižení EN orgánu s postižením regionálních uzlin. Nebylo nikde prokázáno, že postižení EN orgánu a regionální (blízké) uzliny by mělo horší prognózu než postižení EN orgánu a vzdálené uzliny. S rostoucím významem systémové chemo(imuno)terapie a se snižováním významu radioterapie pojem „blízkých“ a „vzdálených“ uzlin ztrácí smysl.
Neexistují jasné hranice mezi „E“ lézí, mnohočetnou „E“ lézí a stadiem IV, a to ani při hodnocení experty [18]. Hodnocení klinického stadia IIE vs IV u kazuistik čtyř nemocných s HL nebylo jednotné [26].
Tato nejasnost vede k ovlivnění prognostických indexů, vede k riziku nadhodnocení či podhodnocení stadia a z toho plynoucího rizika nadléčení nebo podléčení nemocných [26].
Při vytváření dohody KLS jsme se snažili být v souladu s historicky zavedenými klasifikacemi, od kterých se odvozovaly prognostické indexy (IPI, FLIPI). Pokud by totiž náš návrh byl založen na jiném systému určování rozsahu nemoci, nemohli bychom tyto indexy na naše léčebné analýzy vztahovat. Z výše uvedených důvodů však nebylo možné se řídit pouze rozšířenou AA klasifikací.
K nepřehlednosti přispívá i rozšiřující se postavení metody PET, která zobrazí řadu extranodálních lézí, jež jsou často nepřístupné biopsii a nemusí být ani maligní.
Pracovní rozdělení na „velké“ a „malé“ EN orgány plyne z klinické závažnosti postižení daných orgánů a z agresivnějšího biologického chování lymfomu ve „velkých“ orgánech. Předpokládáme, že příznivější prognózu bude mít např. diseminované nebo difuzní postižení štítné žlázy na rozdíl od diseminovaného či difuzního postižení plic.
Rozsah postižení „velkých“ EN orgánů (játra, plíce, kostra, mezotel, měkké tkáně) určujeme dle rozšířené AA klasifikace s tím, že do klinického stadia IE řadíme pouze lokalizované postižení „velkého“ EN orgánu bez průkazu lymfomu jinde. Jinak by se definice pro stadium I a IV překrývaly. Průkaz dvou a více ložisek ve „velkém“ orgánu a/ nebo jakékoliv postižení více než jednoho EN orgánu se vždy hodnotí jako stadium IV [21] (tab. 4).
Mezi tzv. „malé“ EN orgány patří ostatní extranodální orgány – viz výše. Zde se řídíme klasifikací pro primárně extranodální lymfomy dle Musshoffa [23]. Stejným problémem je opět překrývání definic pro stadium I a IV. Bylo dosaženo konsenzu, že jakékoliv postižení více než jednoho extranodálního orgánu/ tkáně se hodnotí jako stadium IV [21].
V některých studiích autoři uvádějí použití rozšířené AA klasifikace i při postižení „malých“ EN orgánů [35 – 38]. Při analýze uváděných prací však většinou není dohledatelné, jakým způsobem rozsah nemoci u extralymfatického šíření skutečně určují.
Samostatnou otázkou je postižení CNS spojené vždy s nepříznivou prognózou nemocných.
Postižení CNS zahrnuje buď samostatné postižení mozku a/ nebo leptomening a/ nebo míchy a/ nebo oka, a pak se jedná o PCNSL, samostatnou jednotku dle WHO klasifikace [4,39 – 41].
Problémem je, že současné radiologické metody s jistotou nerozliší diseminované postižení CNS, vyšetření likvoru může být falešně negativní. Klinické stadium se u PCNSL dle doporučení KLS neuvádí.
Přínos doporučení KLS spočívá v tom, že díky stanoveným definicím pro staging je sníženo riziko nadhodnocení či podhodnocení klinického stadia. Jsou vytvořeny jasné definice pro limitovaná stadia IE, IIE a pokročilá stadia IIIE, IV. Jen tak lze nemocné správně zařadit do skupin dle mezinárodních prognostických indexů zohledňujících klinické stadium nemoci a adekvátně je léčit.
Závěr
Naše práce představuje doporučení KLS pro určení rozsahu nemoci u non‑Hodgkinových lymfomů. Hlavním důvodem vzniku projektu byl fakt, že AA klasifikace je v současné době nevyhovující pro určení klinického stadia lymfomů s extranodálním šířením.
Doporučení KLS umožňuje zjednodušené a praktické určení klinického stadia u extralymfatického šíření s ohledem na prognózu postižení „velkých“ a „malých“ extranodálních orgánů. To by mělo přispět ke správnému určování rozsahu NHL s důrazem na odlišení limitovaných/ pokročilých stadií, snížení rizika nadhodnocení/ podhodnocení stadia a z toho plynoucí neadekvátní intenzity léčby. Dále by doporučení mělo vést ke sjednocení určení rozsahu nemoci NHL v České republice a současně ke zkvalitnění dat registru KLS pro NHL využívaných k analýzám diagnostiky a léčby.
Poděkování
Velké poděkování za spolupráci patří všem členům Kooperativní lymfomové skupiny České republiky.
Projekt byl podporován výzkumnými záměry MZO 00179906 MZ ČR a MSM 0021620808 MZ ČR.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, pruducts, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Sýkorová Alice, Ph.D.
Oddělení klinické hematologie
II. interní klinika FN HK a LF UK Sokolská 581
500 05 Hradec Králové
e-mail: ali.sykorova@gmail.com
Zdroje
1. Little RF, Wilson W. Non - Hodgkin‘s lymphoma. In: Rodgers G, Young N (eds). The Bethesda handbook of clinical hematology. 2nd ed. Philadelphia: Lippincott Williams & Wilkins 2009 : 196 – 216.
2. Adam Z, Krejčí M, Vorlíček J et al. Maligní non‑hodgkinské lymfomy. In: Adam Z, Krejčí M, Vorlíček J et al (eds). Hematologie – přehled maligních hematologických nemocí. 2. vyd. Praha: Grada 2008 : 105 – 167.
3. Belada D, Trněný M et al. Léčebná doporučení KLS. 4. vyd. Hradec Králové: HK CREDIT s.r.o. 2009 : 17 – 21.
4. Swerdlov SH, Campo E, Harris NL et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. 4. vyd. Lyon: IARC 2008.
5. Fabián P, Boudová L. Poznámky ke 4. vydání klasifikace lymfomů WHO. Klin Onkol 2009; 22(3): 121 – 22.
6. Shipp MA. Prognostic factors in aggressive non‑Hodgkin’s lymphoma: who has “high‑risk” disease? Blood 1994; 83(5): 1165 – 1173.
7. Sehn LH, Berry B, Chhanabhai M et al. The revised International Prognostic Index (R ‑ IPI) is a better predictor of outcome than the standard IPI for patients with diffuse large B ‑ cell lymphoma treated with R ‑ CHOP. Blood 2007; 109(5): 1857 – 1861.
8. Solal ‑ Céligny P, Roy P, Colombat P et al. Follicular lymphoma international prognostic index. Blood 2004; 104(5): 1258 – 1265.
9. Federico M, Bellei M, Marcheselli L. Follicular lymphoma international prognostic index 2: a new prognostic index for follicular lymphoma developed by the international follicular lymphoma prognostic factor project. J Clin Oncol 2009; 27(27): 4555 – 4562.
10. Hoster E, Dreyling M, Klapper W et al. German Low Grade Lymphoma Study Group (GLSG); European Mantle Cell Lymphoma. A new prognostic index (MIPI) for patients with advanced‑stage mantle cell lymphoma. Blood 2008; 111(2): 558 – 565.
11. Gallamini A, Stelitano C, Calvi R et al. Intergruppo Italiano Linfomi. Peripheral T ‑ cell lymphoma unspecified (PTCL ‑ U): a new prognostic model from a retrospective multicentric clinical study. Blood 2004; 103(7): 2474 – 2479.
12. Ferreri AJ, Blay JY, Reni M et al. Prognostic scoring system for primary CNS lymphomas: The International Extranodal Lymphoma Study Group Experience. J Clin Oncol 2003; 21(2): 266 – 272.
13. Adam Z, Vorlíček J et al. Vyjádření rozsahu nemoci (klinického stadia) u maligních lymfoproliferativních nemocní a hodnocení léčebné odpovědi. In: Adam Z, Vorlíček J et al (eds). Hematologie II – přehled maligních hematologických nemocí. 1. vyd. Praha: Grada 2001 : 245 – 250.
14. Gupta RK, Gospodarowicz MK, Lister TA. Clinical evaluation and staging of Hodgkin’s disease. In: Mauch PM, Armitage JO, Diehl V et al (eds). Hodgkin’s disease. 1st ed. Philadelphia: Lippincott Williams & Wilkins 1999 : 223 – 240.
15. American Joint Committee on Cancer. Lymphoid neoplasms. AJCC Cancer Staging Manual. 6th ed. New York: Springer 2002 : 393 – 406.
16. Carbone PP, Kaplan HS, Musshoff K et al. Report of the Committee on Hodgkin’s Disease Staging Classification. Cancer Res 1971; 31(11): 1860 – 1861.
17. Rosenberg SA. Report of the committee on the staging of Hodgkin’s disease. Cancer Res 1966; 26 : 1310.
18. Lister TA, Crowther D, Sutcliffe SB et al. Report of a commitee convened to discuss the evaluation and staging of patients with Hodgkin’s disease: Cotswolds Meeting. J Clin Oncol 1989; 7(11): 1630 – 1636.
19. Zucca E. Extranodal lymphoma: a reappraisal. Ann Oncol 2008; 19(4): iv77 – iv80.
20. Krol AD, le Cessie S, Snijder S et al. Primary extranodal non‑Hodgkin’s lymphoma (NHL): the impact of alternative definitions tested in the Comprehensive Cancer Centre West population‑based NHL registry. Ann Oncol 2003; 14(1): 131 – 139.
21. Rudders RA, Ross ME, DeLellis RA. Primary extranodal lymphoma: response to treatment and factors influencing prognosis. Cancer 1978; 42(2): 406 – 416.
22. Peters MV, Bush RS, Brown TC et al. The place of radiotherapy in the control of non‑Hodgkin‘s lymphoma. Br J Cancer Suppl 1975; 2 : 386 – 401.
23. Musshoff K. Klinische Stadienteilung der Nicht‑ - Hodgkin‑Lymphome. Strahlentherapie 1977; 53 : 218 – 221.
24. Thieblemont C, Mayer A, Dumontet C et al. Primary thyroid lymphoma is a heterogeneous disease. J Clin Endocrinol Metab 2002; 87(1): 105 – 111.
25. Toufarová P, Hora M, Boudová L et al. Lymfomy varlat. Urologie pro praxi 2004; 5(3): 125 – 126.
26. Connors JM, Klimo P. Is It an E Lesion or Stage IV? An Unsettled Issue in Hodkin’s Disease Staging. J Clin Oncol 1984; 2(12): 1421 – 1423.
27. Al ‑ Akwaa AM, Siddiqui N, Al ‑ Mofleh IA. Primary gastric lymphoma. World J Gastroenterol 2004; 10(1): 5 – 11.
28. Rohatiner A, d’Amore F, Coiffier B et al. Report on a workshop convened to discuss the pathological and staging classifications of gastrointestinal tract lymphoma. Ann Oncol 1994; 5(5): 397 – 400.
29. Golling P, Cozzio A, Dummer R et al. Primary cutaneous B ‑ cell lymphomas – clinicopathological, prognostic and therapeutic characterisation of 54 cases according to the WHO ‑ EORTC classification and the ISCL/ EORTC TNM classification system for primary cutaneous lymphomas other than mycosis fungoides and Sezary syndrome. Leuk Lymphoma 2008; 49(6): 1094 – 1103.
30. Kim YH, Willemze R, Pimpinelli N et al. ISCL and the EORTC. TNM classification system for primary cutaneous lymphomas other than mycosis fungoides and Sezary syndrome: a proposal of the International Society for Cutaneous Lymphomas (ISCL) and the Cutaneous Lymphoma Task Force of the European Organization of Research and Treatment of Cancer (EORTC). Blood 2007; 110(2): 479 – 484.
31. Olsen E, Vonderheid E, Pimpinelli N et al. ISCL/ EORTC. Revisions to the staging and classification of mycosis fungoides and Sézary syndrome: a proposal of the International Society for Cutaneous Lymphomas (ISCL) and the cutaneous lymphoma task force of the classification of mycosis fungoides and European Organization of Research and Treatment of Cancer (EORTC). Blood 2007; 110(6): 1713 – 1722.
32. Cheson BD, Pfistner B, Juweid ME et al. International Harmonization Project on Lymphoma. Revised response criteria for malignant lymphoma. J Clin Oncol 2007; 25(5): 579 – 586.
33. Abrey LE, Batchelor TT, Ferreri AJ et al. International Primary CNS Lymphoma Collaborative Group. Report of an international workshop to standardize baseline evaluation and response criteria for primary CNS lymphoma. J Clin Oncol 2005; 23(22): 5034 – 5043.
34. Krol AD, Le Cessie S, Snijder S et al. Waldeyer’s ring lymphomas: a clinical study from the Comprehensive Cancer Center West population based NHL registry. Leuk Lymphoma 2001; 42(5):1005 – 1013.
35. Lyons JA, Myles J, Pohlman B et al. Treatment of prognosis of primary breast lymphoma: a review of 13 cases. Am J Clin Oncol 2000; 23(4): 334 – 336.
36. Stein ME, Kuten A, Gez E et al. Primary lymphoma of bone – a retrospective study. Experience at the Northern Israel Oncology center (1979 – 2000). Oncology 2003; 64(4): 322 – 327.
37. Economopoulos T, Papageorgiou S, Rontogianni D et al. Hellenic Cooperative Oncology Group. Multifocal extranodal non‑Hodgkin Lymphoma: A clinicopathologic study of 37 cases in Greece, a Hellenic Cooperative Oncology Group Study. Oncologist 2005; 10(9): 734 – 738.
38. Zinzani PL, Martelli M, Poletti V et al. Practice guidelines for the management of extranodal non‑Hodgkin’s lymphomas of adult non‑immunodeficient patients. Part I: primary lung and mediastinal lymphomas. A project of the Italian Society of Hematology, the Italian Society of Experimental Hematology and the Italian Group for Bone Marrow Transplantation. Haematologica 2008; 93(9): 1364 – 1371.
39. Connors JM. Problems in lymphoma management: special sites of presentation. Oncology 1998; 12(2): 185 – 195.
40. van der Sanden GA, Schouten LJ, van Dijck JA et al. Primary central nervous system lymphomas: incidence and survival in the Southern and Eastern Netherlands. Cancer 2002; 94(5): 1548–1556.
41. DeAngelis LM. Current management of primary central nervous system lymphoma. Oncology 1995; 9(1): 63–78.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2010 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Nejasný stín na plicích – kazuistika
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Místo permanentní brachyterapie v léčbě lokalizovaného karcinomu prostaty
- Určování rozsahu onemocnění u non‑Hodgkinových lymfomů – doporučení Kooperativní lymfomové skupiny
- Současné postavení transplantace krvetvorných buněk v léčbě lymfomů – přehled
- Vliv onkologické léčby na lidskou reprodukci
- Analýza sérových hladin vybraných biologických ukazatelů u monoklonální gamapatie nejistého významu a mnohočetného myelomu
- Co je postup „lege artis“ u onkologického pacienta v terminálním stavu?
- Klinický registr pro hepatocelulární karcinom
- Průběh a závěry mezioborového setkání „Winter GLIO TRACK Meeting“ 2010
- Zápis ze schůze výboru České onkologické společnosti dne 21. 5. 2010 v Brně
- Cetkovský P, Kouba M et al.Diferenciální diagnostika plicních infiltrátů a pokroky v léčbě mykotických infekcí u imunokompromitovaných pacientů.Praha: Triton 2009. 259 s. ISBN 978- 80- 7387- 343- 1.
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Určování rozsahu onemocnění u non‑Hodgkinových lymfomů – doporučení Kooperativní lymfomové skupiny
- Současné postavení transplantace krvetvorných buněk v léčbě lymfomů – přehled
- Vliv onkologické léčby na lidskou reprodukci
- Co je postup „lege artis“ u onkologického pacienta v terminálním stavu?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



