-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Preimplantační genetická diagnostika (PGD) hereditárních nádorových syndromů
Preimplantation Genetic Diagnosis (PGD) of Hereditary Cancer Syndromes
Advances in molecular biology techniques made possible genotype analysis from one or several cells. This can be used in preimplantation genetic diagnosis (PGD) not only of chromosomal aneuploidy but also of single gene diseases as well as hereditary cancer syndromes. PGD can be a benefit for those cases when the risk of transfer of pathological alteration from parent to offspring is unwelcome. We submit three cases of PGD with the results.
Key words:
preimplantation genetic diagnosis – single gene disease – hereditary cancer syndromes – in vitro fertilization
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
27. 4. 2012Accepted:
25. 6. 2012
Autoři: L. Raszyková; V. Hořínová; P. Texl
Působiště autorů: Laboratoř lékařské genetiky, Sanatorium Helios, Brno
Vyšlo v časopise: Klin Onkol 2012; 25(Supplementum): 84-86
Souhrn
Pokroky v molekulárně biologických metodách umožňují analýzu genotypu z jedné či několika buněk, což přináší rozsáhlé využití v preimplantační genetické diagnostice (PGD) nejen chromozomálních aneuploidií, ale i monogenních nemocí, tudíž i hereditárních nádorových syndromů. PGD tak může být přínosná v těch případech, kdy je riziko přenosu patologické vlohy z rodiče na potomka z různých důvodů nežádoucí. Předkládáme tři případy rodin s PGD a dosavadní výsledky.
Klíčová slova:
preimplantační genetická diagnostika – monogenní onemocnění – hereditární nádorové syndromy – in vitro fertilizaceÚvod
Preimplantační genetická diagnostika (PGD) zahrnuje soubor molekulárně - -biologických metod umožňujících popsat genetický stav embrya před jeho implantací v děloze, tzn. že do dělohy jsou transferována pouze „zdravá embrya“ (ta, u kterých nebyla prokázána sledovaná abnormalita). Cílem je tedy zabránit přenosu závažného genetického onemocnění do další generace. Mezi nejčastější indikace k provedení PGD patří chromozomové aberace (vyšetřované pomocí metod: fluorescenční in situ hybridizace FISH, metoda mikročipové komparativní hybridizace aCGH) nebo monogenně podmíněné choroby děděné dominantně, recesivně či vázané na pohlaví (vyšetřované pomocí metody polymerázové řetězové reakce – PCR). PGD je vázána na asistovanou reprodukci (IVF) [1].
V PGD monogenních onemocnění včetně hereditárních nádorových syndromů je využívána již zmíněná polymerázová řetězová reakce (PCR), konkrétně multiplex PCR, s následnou analýzou. Principielně se v PGD PCR diagnostice uplatňují dva přístupy. Jednak tzv. vazebná analýza (nepřímá DNA diagnostika s použitím polymorfních mikrosatelitních markerů) a analýza vlastního místa genové alterace. Kombinace obou přístupů zvyšuje přesnost genotypizace [2,3].
V Sanatoriu Helios se PGD PCR provádí na embryích ve stadiu blastocysty, tj. po pětidenní a/nebo šestidenní kultivaci. Rutinní biopsii blastocyst provádí Sanatorium Helios jako jedno z mála IVF center v Evropě. Její hlavní výhoda spočívá jednak v tom, že na rozdíl od biopsie třídenních embryí se bioptují a vyšetřují pouze embrya nejvyšší kvality, s největší pravděpodobností implantace (což ušetří nemalé finanční prostředky), jednak v získání většího počtu buněk, a tím vyšetřovaného materiálu, což významně ovlivňuje přesnost výsledku genotypizace (klesá pravděpodobnost selhání amplifikace a alelického drop-outu) [4].
Dodržení veškerých opatření minimalizujících (a de facto vylučujících) kontaminaci vzorku je samozřejmostí.
V naší PGD PCR laboratoři bylo řešeno sedm případů PGD z důvodu výskytu dědičných nádorových onemocnění v rodině. Pět případů se týkalo nosičů různých mutací v BRCA1 genu (hereditární karcinom prsu a ovárií), po jednom pak mutace v MSH2 genu (hereditární nepolypózní karcinom tlustého střeva – Lynchův syndrom) a mutace v CDH1 genu (hereditární difuzní karcinom žaludku). Vývoj testu v případě mutace v CDH1 genu byl přerušen z důvodu neúplné diagnózy, všechny ostatní byly dokončeny. Žadatelky jsou v různých fázích celého procesu (vývoj testu, hormonální stimulace, odběr vajíček a kultivace embryí, transfer a/nebo kryoembryotransfer, potvrzení biochemické gravidity, klinická gravidita (Asp+)). Jedna žadatelka již porodila zdravou holčičku.
Všechny případy PGD PCR jsou konzultovány týmem odborníků (onkolog, klinický genetik, molekulární biolog, gynekolog, embryolog). V případech indikovaných klinickým genetikem je PGD PCR v Sanatoriu Helios hrazeno některými zdravotními pojišťovnami.
Ambulance lékařské genetiky v Sanatoriu Helios zajišťuje především komplexní genetickou péči pro páry s poruchou reprodukce. V souvislosti s léčbou poruch plodnosti zajišťuje genetické vyšetření pro páry, které mají problémy otěhotnět nebo trpí opakovanými samovolnými potraty. V indikovaných případech je nabízena preimplantační genetická diagnostika monogenních onemocnění a chromozomálních vad u embryí. Do této kategorie patří i páry, kde je jeden z partnerů nositelem mutace, která významně zvyšuje onkologické riziko a je prokázán hereditární nádorový syndrom.
Kazuistiky
- Do genetické poradny se dostavil pár, kde byla nositelkou mutace v genu BRCA1 žena-probandka (obr. 1). Její matka zemřela na nádor prsu a vaječníku ve 45 letech. Protože na našem pracovišti vyšetřujeme nejen konkrétní mutaci, ale využíváme i vazebnou analýzu, byl zahájen tzv. work up, kdy jsme porovnávali polymorfní markery probandky, jejího partnera, její zdravé sestry a otce – viz rodokmen. Rodina byla pro použité markery informativní. Provedli jsme vyšetření pětidenních embryí. Embryo s negativním nálezem bylo transferováno. 18. 11. 2011 porod zdravé dcery p.v. 3 950/52 cm.
- Druhá kazuistika již byla komplikovanější. Jednalo se o Lynchův syndrom, kde probandem byl partner nesoucí mutaci v genu MSH2 (obr. 2). Matka mu zemřela ve 47 letech na ca žlučového systému a ca uteru. Opět byl zahájen work up, kdy jsme porovnávali markery jeho, jeho tety, jeho partnerky a otce. Ukázalo se, že rodina není pro sledované markery plně informativní. Proto jsme se snažili získat další materiál – od zdravé sestry probanda, která žije ve Švýcarsku. Po porovnání všech markerů vyplynulo, že u probanda došlo k rekombinaci mutace s přilehlým markerem. Byla zahájena hormonální stimulace, proběhl IVF cyklus. Kultivovaná embrya bohužel nedosáhla stadia biopsie – embrya nemohla být vyšetřena. Nyní je plánován druhý cyklus.
- Nejzajímavější a nejkomplikovanější je třetí případ, kdy probandkou je partnerka-nositelka mutace v genu pro cadherin (CDH) IVS15-6C>G – splicingová mutace v exonu 16, zapsaná do databáze mutací poprvé (obr. 3). Její sestra zemřela ve 30 letech na ca žaludku, její matka ve 46 letech na ca pankreatu, matka matky v 63 letech na ca žaludku. Předpokládali jsme, že probandka zdědila mutaci v CDH1 genu po matce. Zahájili jsme tedy work up a hodnotili markery a mutaci u probandky, jejího partnera a jejího zdravého otce. Genetický materiál od ostatních členů rodiny není dostupný. Po sekvenování v rámci přímého stanovení mutace jsme k našemu velkému překvapení zjistili, že nositelem výše uvedené mutace je otec probandky! Veškerá vysvětlení jsou spekulativní. Jedná se pouze o klinicky nezávažný polymorfizmus (otec je v 62 letech zdravý)? Nebo se jedná o mutaci a onemocnění se u otce dosud neprojevilo a snad ani neprojeví? Existuje vůbec a event. jaká (vzácná?) mutace ze strany matky (všichni zemřeli)? Byla sestra probandky složený heterozygot? Po konzultaci s kolegy ze Sydney IVF byl work up přerušen pro nedostatek informací. Z uvedeného případu vyplývá nutnost důsledné klinické interpretace kauzální mutace v laboratoři, kde genetické testování rodiny probíhá.
Obr. 1. Rodina s úspěšnou PGD, v listopadu 2011 se narodila zdravá dcera. Probandka je nosička mutace v BRCA1 genu, její matka zemřela ve 45 letech na nádor prsu a ovaria. U sestry probandky byla přítomnost mutace vyloučena molekulárně-biologickou analýzou BRCA1 genu. 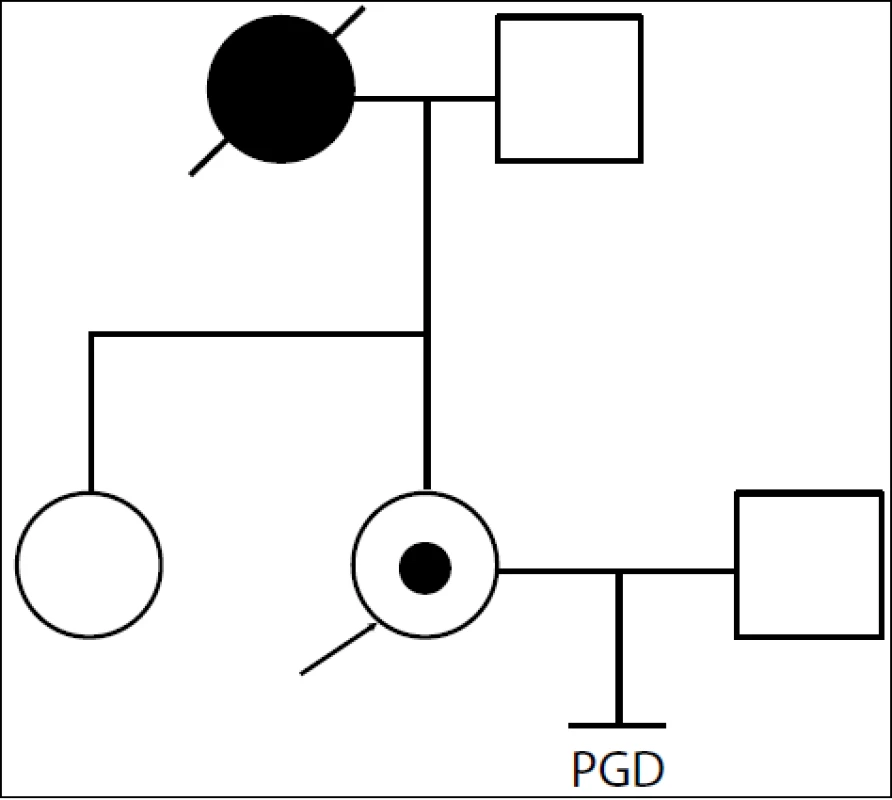
Obr. 2. Proband s Lynchovým syndromem, mutací v genu MSH2. Matka zemřela v 47 letech na nádor žlučových cest a uteru. Teta probanda (sestra matky) nese stejnou mutaci jako proband, předpokládáme tudíž, že tuto nese i matka probanda. U sestry probanda byla přítomnost mutace vyloučena molekulárně-biologickou analýzou MSH2 genu. První pokus IVF se nezdařil, embrya nemohla být vyšetřena, cyklus bude opakován. 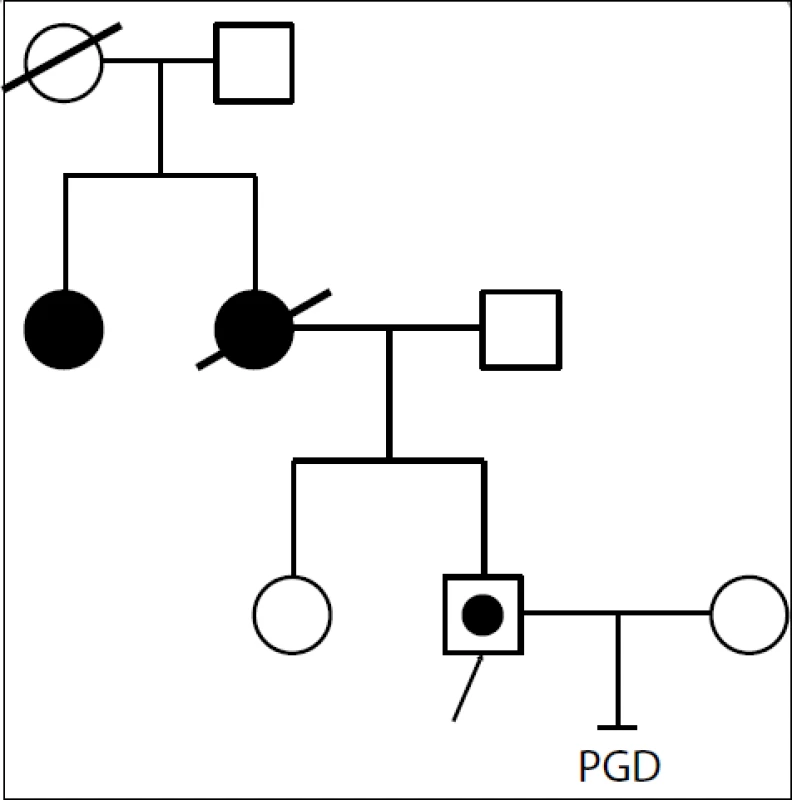
Obr. 3. Rodina s předpokládanou dědičnou formou difuzního karcinomu žaludku. Probandka nese mutaci v CDH1 genu. Sestra probandky zemřela ve 30 letech na nádor žaludku, matka ve 46 letech na nádor slinivky, matka matky v 63 letech na nádor žaludku. Ani u jedné ze zemřelých nebyla provedena analýza CDH1 genu, DNA není dostupná. Předpokládali jsme, že probandka zdědila mutaci po matce. Ukázalo se však, že mutaci v CDH1 genu nese „zdravý“ otec. Proces byl zastaven. 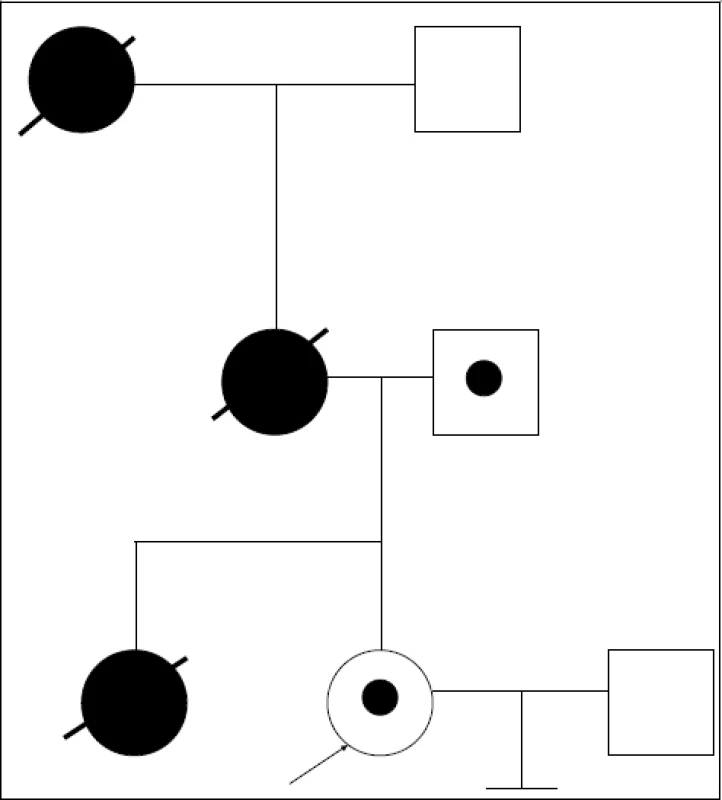
Závěr
Pro mnoho párů s výskytem genetického onemocnění v rodině představuje PGD možnost mít dítě, které patologickou vlohu neponese. Přes veškerá úskalí a etická dilemata tak představuje unikátní alternativu prenatální diagnostiky.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Lenka Raszyková
Laboratoř lékařské genetiky
Sanatorium Helios
Štefánikova 12
602 00 Brno
e-mail: lraszykova@sanatoriumhelios.cz
Obdrženo: 27. 4. 2012
Přijato: 25. 6. 2012
Zdroje
1. Wells D, Delhanty JD. Preimplantation genetic diagnosis: applications for molecular medicine. Trends Mol Med 2001; 7(1): 23–30.
2. Harton GL, De Rycke M, Fiorentino F et al. ESHRE PGD consortium best practise guidelines for amplification-based PGD. Hum Reprod 2011; 26(1): 33–40.
3. Hüttelová R, Kleibl Z, Řezáčová J et al. Předpoklady pro preimplantační genetickou diagnostiku (PGD) u nosičů mutací v nádorových predispozičních genech. Klin Onkol 2009; 22 (Suppl): 69–74.
4. De Boer K, MacArthur S, Murray C et al. First live birth following blastocyst biopsy and PGD analysis. Reprod Biomed Online 2002; 4 : 35.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Juvenilný polypózny syndrómČlánek Syndrom Birt-Hogg-DubéČlánek Soutěž o nejlepší práciČlánek EditorialČlánek Rhabdoidné nádory
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2012 Číslo Supplementum- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Centra plastické chirurgie v ČR provádějící profylaktické operace prsů s rekonstrukcí u žen s vysokým (dědičným) rizikem nádorů prsu
- CLAUSův model k odhadu celoživotního kumulativního rizika vzniku nádorů prsu u žen s pozitivní rodinnou anamnézou
- Juvenilný polypózny syndróm
- Syndrom Birt-Hogg-Dubé
- Hereditární feochromocytom a paragangliom
- Rhabdoidné nádory
- Hereditární difuzní karcinom žaludku
- Syndróm konštitučného deficitu mismeč opravného systému (CMMR-D) – kazuistika rodiny s bialelickou MSH6 mutáciou
- Klinické dysmorfické syndrómy s tumorigenézou
- Li-Fraumeni syndrom – návrh komplexní preventivní péče o nosiče TP53 mutace s použitím celotělové magnetické rezonance
- Soutěž o nejlepší práci
- Hereditární leiomyomatóza a renální karcinom – HLRCC / Mnohočetná kožní a děložní leiomyomatóza – MCUL
- Klinický význam analýz genů středního rizika pro hodnocení rizika vzniku karcinomu prsu a dalších nádorů v České republice
- Editorial
- Genetické poradenství u mužů nosičů mutací v genech BRCA1 a BRCA2
- Seznam onkologických pracovišť a onkologů zajišťujících prevence pro osoby (i zdravé) s dědičným rizikem nádorů
- Vliv profylaktické mastektomie s rekonstrukcí na kvalitu života žen s BRCA pozitivitou
- Chirurgická prevence karcinomu prsu u pacientek s dědičným rizikem
- Preimplantační genetická diagnostika (PGD) hereditárních nádorových syndromů
- Hodnocení variant nejasného významu v genu BRCA2
- Diagnostika nádorů prsu ve skupině rizikových žen – vlastní zkušenosti
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Syndrom Birt-Hogg-Dubé
- Klinický význam analýz genů středního rizika pro hodnocení rizika vzniku karcinomu prsu a dalších nádorů v České republice
- Hereditární difuzní karcinom žaludku
- Klinické dysmorfické syndrómy s tumorigenézou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



