-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Role mikroRNA v molekulární patologii karcinomu jícnu a jejich potenciální využití v klinické onkologii
The Role of MicroRNAs in Molecular Pathology of Esophageal Cancer and Their Potential Usage in Clinical Oncology
MicroRNAs are an abundant class of non‑coding RNAs (approx. 18 – 25 nucleotides in length) that suppress translation through binding to their target mRNAs, eventually leading to mRNAs degradation. Sequences of these endogenous RNA molecules are highly conserved, even among unrelated species, indicating their involvement in basic biological processes, such as development, differentiation, proliferation or apoptosis. MiRNAs also participate on regulation of cancer stem cell functioning, immune system and malignant transformation. This review provides a comprehensive overview of miRNAs functions in esophageal cancer, their roles in key pathogenetic pathways and disease development, as well as their potential usage in clinical routine as biomarkers improving diagnosis, prognosis and prediction of therapeutic response. Through regulation of signaling pathways important in malignant transformation, miRNAs present also promising therapeutic targets.
Key words:
microRNAs – esophageal cancer – Barrett‘s esophagus – regulation of gene expression – diagnosis – prognosis
Autori: A. Kovaříková 1; R. Héžová 1,2; J. Srovnal 3; M. Rédová‑ lojová 1,2; O. Slabý 1,2
Pôsobisko autorov: CEITEC – Středoevropský technologický institut, MU, Brno 1; Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 2; Ústav molekulární a translační medicíny, LF UP v Olomouci 3
Vyšlo v časopise: Klin Onkol 2014; 27(2): 87-96
Kategória: Přehledy
Súhrn
MikroRNA (miRNA) jsou početnou skupinou krátkých nekódujících RNA (cca 18 – 25 nukleotidů), které tlumí translaci vazbou na cílové mRNA, případně vedou k jejich degradaci. Tyto endogenní molekuly RNA jsou vysoce sekvenčně konzervované, a to i napříč nepříbuznými organizmy, což poukazuje na jejich roli v základních biologických procesech, jako je vývoj, diferenciace, proliferace a apoptóza. Rovněž se podílejí na regulaci kmenových vlastností buněk, imunitního systému nebo nádorové transformaci. Tento přehled podává ucelené informace o miRNA u karcinomu jícnu, a to jak o jejich roli v základních pochodech vzniku a rozvoje nádorového onemocnění, tak o možnostech jejich využití v klinické praxi při zpřesnění diagnózy, stanovení prognózy onemocnění a predikci léčebné odpovědi. Díky regulaci klíčových signálních drah v maligní transformaci představují miRNA rovněž slibné terapeutické cíle.
Klíčová slova:
mikroRNA – karcinom jícnu – Barrettův jícen – regulace genové exprese – diagnostika – prognózaÚvod
Ezofageální karcinom je celosvětově osmým nejběžnějším maligním onemocněním a šestou nejčastější příčinou úmrtí v důsledku nádorového onemocnění. Tvoří přibližně 20 % všech zhoubných nádorů trávicí soustavy [1]. Na základě odlišného buněčného původu a anatomické lokalizace rozlišujeme dva základní typy karcinomu jícnu – spinocelulární karcinom (squamous cell carcinoma of the esophagus – SCCE) vznikající přeměnou dlaždicového epitelu a adenokarcinom (esophageal adenocarcinoma – EAC), jehož výskyt souvisí s prekancerózním syndromem nazývaným Barrettův jícen (Barrett‘s esophagus – BE). Klinicky je vývoj karcinomu jícnu spojován s dysfagií, chronickým zánětem a achalázií. Ezofageální karcinom postihuje nejčastěji muže ve věku 50 – 54 let, u žen je frekvence nižší, s posunutou věkovou hranicí (65 – 69 let) [2 – 5]. V poslední době jeho incidence a mortalita narůstá, a to pravděpodobně v důsledku špatných stravovacích návyků, kouření a zvýšené konzumace alkoholu. Pacientů s adenokarcinomem přibývá především ve vyspělých zemích Severní Ameriky a Evropy, naproti tomu prudký nárůst spinocelulárního karcinomu registrují především rozvojové země jihovýchodní Asie, Jižní Ameriky a Afriky [6 – 8]. Incidence karcinomu jícnu v České republice je sice nižší, než je udáván celosvětový průměr, ovšem většina pacientů s touto diagnózou brzy umírá, což je dáno především diagnostikou onemocnění v pokročilém stadiu s rozvinutým metastatickým postižením. Léčebné postupy v těchto pozdních fázích onemocnění jsou vzhledem k anatomické lokalizaci a biologickým vlastnostem nádoru značně omezené. Právě tyto okolnosti řadí karcinom jícnu mezi nádory s velmi špatnou prognózou [6,9].
Významnou úlohu v etiologii nádoru hrají genetické a epigenetické změny, zejména somatické mutace a epimutace v onkogenech a tumor supresorových genech. Přes značný pokrok v cytogenetické, biochemické a genomické charakterizaci nádorových buněk se spolehlivý biomarker včasné diagnostiky karcinomu jícnu dosud odhalit nepodařilo [10].
MikroRNA (miRNA) jsou krátké nekódující RNA, které jsou obecně přijímány jako vysoce specifický epigenetický regulátor genové exprese působící v nejrůznějších mnohobuněčných organizmech. Ukázalo se, že miRNA sehrávají v organizmu důležitou roli v buněčných procesech, jako je regulace vývoje, diferenciace tkání nebo apoptóza [11,12]. Mechanizmus jejich působení je dvojí. Vazbou na cílovou mRNA mohou indukovat jev RNA interference a iniciovat jejich degradaci, nebo – a to je u živočichů častější efekt – inhibovat jejich translaci, to je přepis mRNA do proteinového produktu [13]. V nádorových buňkách se miRNA mohou vyskytovat v mutované formě nebo mohou být aberantně exprimované. Nedávné studie naznačují, že řada miRNA je přímo zapojená do procesu maligní transformace, a to již v raných stadiích, a mohly by se tak stát hledaným biomarkerem časné diagnostiky [14]. Velmi slibné jsou i výsledky poukazující na možnost ovlivnění aktivity miRNA jako potenciálních terapeutických cílů.
Tento přehled pojednává o funkčním významu miRNA a jejich úloze v karcinogenezi nádorů jícnu. Pokusíme se shrnout dosavadní poznatky o diagnostickém, prognostickém a prediktivním významu miRNA u nádorů jícnu a nastínit možné terapeutické využití těchto krátkých molekul.
Význam miRNA v molekulární patologii karcinomu jícnu
Molekuly miRNA mohou v průběhu kancerogeneze vystupovat jako onkogeny nebo nádorové supresory v závislosti na charakteru cílových mRNA, které regulují, a jsou tak zapojené do mnoha signálních drah, které souvisejí s proliferací, apoptózou, metastazováním, angiogenezí či regulací buněčného cyklu (obr. 1, 2).
Obr. 1. Schéma zapojení vybraných miRNA do progrese karcinomu jícnu od BE k EAC. 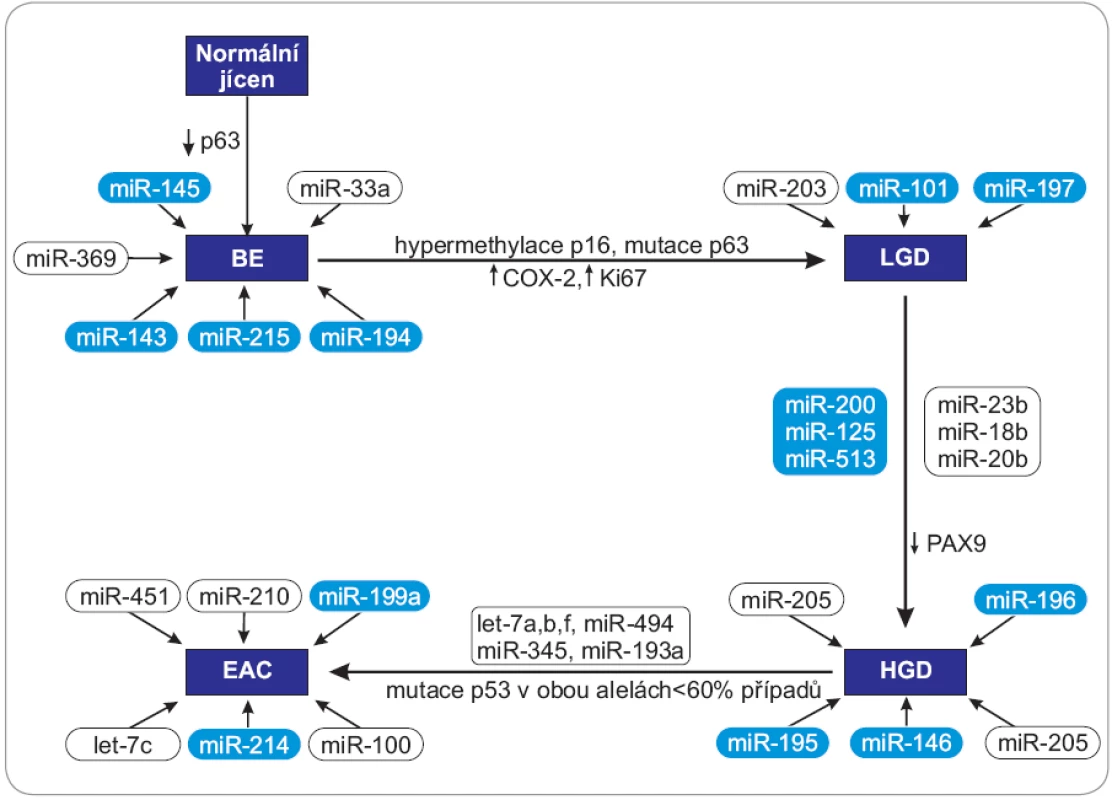
Přechod BE do LGD je doprovázen zvýšenou expresí COX-2 a Ki-67, mutací p63 a hypermetylací p16, při přechodu ze stadia LGD do HGD dochází ke snížení exprese PAX9, ve stadiu EAC se objevuje mutace p53 v obou alelách u 60 % případů. BE – Barrettův jícen, LGD – lehká forma dysplazie, HGD – těžká forma displazie, EAC – adenokarcinom jícnu, PAX – homeotický gen – paired box, COX-2 – cyklooxygenáza 2
Obr. 2. Schéma zapojení vybraných miRNA do patogeneze SCCE. 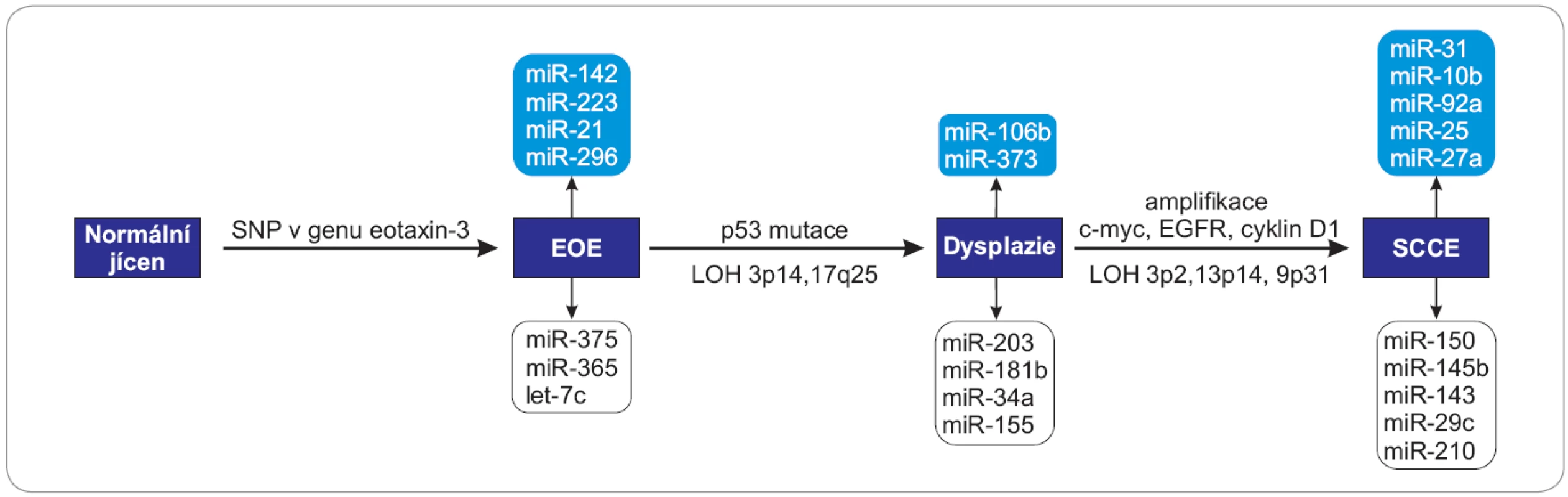
Tento děj čato provází mutace v genu p53, SNP genu eotaxin-3, dále LOH 3p21.3 a 9p31 a LOH 17p13 a 9p22. EOE – eozinofilní ezofagitida, SCCE – spinocelulární karcinom, SNP – jednonukleotidový polymorfizmus, c-myc – lidský homolog genu v-MYC izolovaný z viru ptačí myelocytomatózy, EGFR – receptor pro epidermální růstový faktor, LOH – ztráta heterozygozity
MiRNA a apoptóza
Apoptóza je nezbytný a evolučně velmi starý mechanizmus, prostřednictvím kterého dochází k řízenému odstranění starých, nefunkčních či mutovaných buněk (tzv. programovaná buněčná smrt). Rozlišujeme dva základní způsoby programované buněčné smrti. Vnější, receptorová cesta, začíná navázáním ligandů na specifická místa v cytoplazmatické membráně, tzv. receptory smrti. Tím je spuštěna kaskáda reakcí, jejichž výsledkem je aktivace proteolytického enzymu kaspázy 8. Další typy kaspáz pak následně štěpí buněčné struktury, což vede k zániku buňky. Druhá, vnitřní cesta, nazývaná též mitochondriální, je aktivována působením stresových faktorů na buňku, což vede k uvolnění proapoptotické molekuly (cytochromu c)do cytoplazmy. Vzniká multiproteinový komplex, tzv. apoptozóm, který aktivuje kaspázu 9, v důsledku čehož dochází k aktivaci dalších kaspáz a proteolytickému štěpení buněk [15].
Proteinová rodina BCL ‑ 2 sehrává klíčovou roli v navození programované buněčné smrti a působí buď pro‑, nebo antiapoptoticky. Členové proteinové rodiny BCL ‑ 2 jsou často cílem různých miRNA. Důležitou úlohu u BE a EAC sehrává např. polycistronní klastr miR ‑ 106b ‑ 25a, jehož hladina bývá zvýšená v pokročilých stadiích nádoru, a tudíž lze usuzovat na jeho onkogenní charakter. Klastr miR ‑ 106b ‑ 25 působí rozdílným mechanizmem na expresi proteinu p21 a Bim, což je člen proteinové rodiny BCL ‑ 2. Zralé formy miR ‑ 93 a miR ‑ 106b rozkládají p21 mRNA vazbou na 3‘ UTR, zatímco miR ‑ 25a působí translační inhibici proteinu Bim. Polycistron miR ‑ 106b ‑ 25a prostřednictvím inhibice svých efektorových molekul (BIM, p21) vykazuje antiapoptotické účinky a zvyšuje proliferaci buněk tím, že ovlivňuje přechod G1/ S fáze buněčného cyklu [16]. Z nejnovějšího výzkumu vyplývá, že miR ‑ 25 může též negativně regulovat transkripční faktor KLF4, který inhibuje proliferaci buněk potlačením cyklinu D1 a cyklinu B1 [17].
Dalším regulátorem apoptózy u buněk SCCE je klastr miR ‑ 17-92, jehož zvýšená exprese byla detekována až u 75 % případů SCCE [18]. Konkrétně se pak jedná o miR ‑ 19a, která negativně působí na apoptotický protein TNF-α. Inhibice této miRNA je pak schopna vyvolat zvýšení expresní hladiny TNF‑α, což v důsledku vede k navození apoptózy.
Jako onkogen stimulující u SCCE proliferaci a inhibující apoptózu byla identifikována miR ‑ 373, která na posttranskripční úrovni ovlivňuje supresorový gen LATS2. V nádorových buňkách byla prokázána inverzní korelace mezi množstvím LATS2 a expresí miR ‑ 373 [19].
Mezi další miRNA, které mohou ovlivňovat apoptózu, patří také miR ‑ 27a. U karcinomu jícnu bylo experimentálně prokázáno, že cílené snížení exprese miR ‑ 27a způsobuje pokles hladiny antiapoptotického proteinu BCL ‑ 2 a naopak zvyšuje produkci proapoptotického proteinu BAX [20].
Další studie zabývající se možnostmi regulace apoptózy v nádorových buňkách prostřednictvím miRNA vedla k pozorování, že ve tkáních SSCE často dochází k epigenetickému umlčování promotoru miR ‑ 375 (hypermetylací cytosinových zbytků), což vede ke snížení hladin genového produktu. Epigenetické umlčení miR ‑ 375 indukovalo zvýšenou hladinu cílové molekuly kinázy PDK1, prostřednictvím které dochází k nadměrné aktivaci signální dráhy Akt a tím k antiapoptotickému působení u nádorových buněk. V in vitro experimentech vedlo umělé navýšení hladin miR ‑ 375 ke snížené produkci PDK1 a následně snížené fosforylaci/ aktivaci dráhy Akt. Vnesení exogenní miR ‑ 375 vyvolalo apoptózu a potlačilo růst nádorových buněk [21]. Recentní studie potvrdily nádorově supresorický charakter miR ‑ 375 u karcinomu jícnu. Ukázalo se také, že tato molekula má v buňce více cílových míst. MiR ‑ 375 se může vázat např. i na 3‘ UTR genu IGF1R a tím potlačovat jeho expresi. IGF1R patří do skupiny receptorů pro inzulinu podobné růstové faktory a jeho exprese bývá u nádorů zvýšena. Lze tedy usuzovat, že prostřednictvím miR ‑ 375 bude možno snižovat množství IGF1R v nádorových buňkách a tím omezit jejich proliferaci [22].
MiRNA a regulace buněčného cyklu
K příčinám vzniku maligní transformace také patří deregulace buněčného cyklu, na které se mimo jiné podílí rovněž nádorový supresor p53. Gen pro p53 je frekventně mutován u celé řady nádorových onemocnění [23]. U mnoha nádorů včetně SSCE byl prokázán vztah mezi deficiencí p53 a sníženou hladinou miR ‑ 34a. Regulace transkripce genu pro miR ‑ 34a závisí na koordinaci p53 s transkripčním faktorem NF ‑ κB. Ačkoliv p53 je nejdůležitějším aktivátorem transkripce miR ‑ 34a, je třeba zmínit, že defekty v p53 ne vždy souvisejí s její sníženou hladinou. Umělé navýšení hladin miR ‑ 34a vedlo k potlačení exprese cyklinu D i c ‑ MET a tím inhibice buněčné proliferace [24].
Na regulaci buněčného cyklu se dále podílí miR ‑ 203. U SCCE bylo prokázáno, že miR ‑ 203 ovlivňuje proliferaci nádorových buněk prostřednictvím posttranskripční regulace endogenního proteinu ∆Np63, který je zapojen do signální dráhy Wnt/β ‑ katenin. Tato dráha hraje důležitou roli především v raných fázích vývoje nádoru. Experimenty in vitro ukázaly, že exprese miR ‑ 203 a snížená hladina proteinu ∆Np63 významně potlačují dělení nádorových buněk [25].
Skupina Ding et al [26] se zabývala úlohou miR ‑ 29c v buněčném cyklu. Ve tkáních i v buněčných liniích je exprese této miRNA výrazně snížena v porovnání s tkání zdravou, a to především u pokročilých stadií nádoru. Autoři došli k závěru, že zvýšená exprese miRNA ‑ 29c negativně reguluje hladinu cyklinu E vazbou na 3‘ UTR. K interakci dochází během G1 fáze, což vede k zastavení buněčného cyklu ve fázi G1/ G0. Hladiny cyklinu D1,cyklinu D2 či závislých kináz důležitých pro růst buněk však ovlivněny nebyly. Funkci miR ‑ 29c jako inhibitoru buněčného dělení potvrdily experimenty in vitro i in vivo. Předpokládá se, že příčinou deregulace miR ‑ 29c v SCCE buňkách může být vazba onkogenu c ‑ myc na promotorovou oblast této miRNA.
Podobně jako miR ‑ 29c, tak i miR ‑ 210 má schopnost zastavit buněčný cyklus ve fázi G1/ G0, a to tím, že se váže na 3‘ UTR genu FGFRL1, jehož proteinový produkt bývá v nádorových tkáních zvýšený. In vitro pokusy ukázaly, že tímto mechanizmem miR ‑ 210 negativně ovlivňuje proliferaci buněk a vede k apoptóze či nekróze. Nižší exprese této miRNA souvisí se stupněm diferenciace nádoru [27].
Schopnost proliferace buněk karcinomu jícnu může být dále regulována prostřednictvím miR ‑ 1322, jejíž snížená hladina ovlivňuje expresi nádorového supresoru ECRG2 (Sping 7) [28]. MiR ‑ 1322 se váže na gen ECRG2 v oblasti krátkého tandemového opakovaní 3‘ UTR a tím snižuje hladinu proteinu ECRG2. Regulace exprese ECRG2 prostřednictvím miR ‑ 1322 je alelicky závislá, přičemž nejvyšší afinitu k miR ‑ 1322 vykazovala alela TCA3, zatímco alela TCA4 měla afinitu podstatně nižší. Hladina miR ‑ 1322 je významně zvýšená v séru i ve tkáni pacientů SCCE, přičemž pacienti s alelou TCA3 mají horší prognózu než pacienti s alelou TCA4 [28].
Karcinogenezi SCCE ovlivňuje také let ‑ 7, jejíž exprese je u SCCE výrazně snížena. Experimentálně bylo ověřeno, že nižší úroveň let ‑ 7 stimuluje proliferaci buněk SCCE a tvorbu lymfatických metastáz. Tato miRNA posttranskripčně reguluje celou řadu významných genů, včetně HMGA2, jehož zvýšená hladina souvisí s chemorezistencí a metastazováním [29].
Li et al [30] dospěli k závěru, že miR ‑ 223 snižuje invazivní a migrační potenciál nádorových buněk prostřednictvím neurotropního faktoru Arteminu (ART). Zdá se, že miR ‑ 223 funguje jako supresor, neboť jeho snížená hladina způsobuje vyšší expresi ART, a tak se miR ‑ 223 jeví jako potenciální terapeutický cíl [30]. MiR ‑ 223 byla u SCCE rovněž potvrzena jako regulátor ubiquitin ligázy FBXW7, přičemž zvýšená hladina miR ‑ 223 v nádorové tkáni korelovala se sníženou hladinou FBXW7 [31]. FBXW7 má supresní charakter a reguluje důležité geny buněčného cyklu, jako jsou MYC, cyklin E, c ‑ Jun a další. Důležitým závěrem této studie bylo zjištění, že skupina pacientů se zvýšenou expresí miR ‑ 223 měla horší prognózu než skupina s nižší hladinou. Vzhledem k protichůdným závěrům obou uvedených prací ovšem zůstává úloha miR ‑ 223 v etiologii karcinomu jícnu nejasná [30,31].
Jako další miRNA se schopností ovlivnit proliferaci nádorových buněk byla ve vysokokapacitní analýze potvrzena miR ‑ 145 [32]. Tato práce prokázala, že spektrum miRNA se liší u tří typů tkání odvozených od normálního dlaždicového epitelu jícnu (SQ), BE a EAC. Autoři se pak dále zabývali nižší expresí miR ‑ 145, která byla zjištěna u BE, v porovnání s SQ a EAC. Pomocí in vitro experimentů prokázali, že miR ‑ 145 inhibuje expresi genu SOX ‑ 9 a GATA4. Buňky se zvýšenou expresí miR ‑ 145 vykazovaly snížený proliferační potenciál, což je pravděpodobně spojené s regulací signální dráhy BMP4.
Další studie se zabývala vlivem miR ‑ 21 na fosfatázu PTEN. V experimentech in vitro po cílené inhibici exprese miR ‑ 21 došlo k nárůstu hladin supresorického proteinu PTEN a k potlačení buněčné proliferace. Vyšší hladina miR ‑ 21 tedy stimuluje růst nádorových buněk jícnu. Výrazně zvýšená hladina miR ‑ 21 byla zaznamenána u pacientů s vysoce invazivním typem nádoru, což potvrzuje její onkogenní charakter [33].
MiRNA a metastazování
Důležitým krokem v procesu rozvoje nádorového onemocnění je získání schopnosti zakládat vzdálené metastázy. Je známo, že karcinom jícnu zakládá metastázy již v časných stadiích. Za podmínku diseminace je dnes považován tzv. epiteliálně‑mezenchymální přechod (epithelial ‑ mesenchymal transition – EMT). Důležitým atributem EMT je pokles exprese epiteliálních markerů (E ‑ kadherin, gamma ‑ katenin ad.), naopak narůstá exprese proteinů chrakteristických pro motilní mezenchymální buňky (N ‑ kadherin, vimentin, matrixové metaloproteinázy, integriny ad.). Průběh EMT reguluje řada transkripčních faktorů, z nichž prominentní úlohu hrají ZEB1/ ZEB2 reprimující expresi E ‑ kadherinu. Jejich hladiny ovlivňuje rodina miR ‑ 200 (miR ‑ 200a, miR ‑ 200b, miR ‑ 429, miR ‑ 200c, miR ‑ 141). Bylo prokázáno, že buňky v EMT fázi vykazují výrazně zvýšenou hladinu ZEB2 a současně sníženou expresi rodiny miR ‑ 200. Zároveň bylo potvrzeno, že narušením signální dráhy NOTCH3, která za fyziologických podmínek reguluje diferenciaci prostřednictvím mezibuněčných komunikací, je spuštěna exprese ZEB2 [34].
U BE byla detekována snížená exprese rodiny miR ‑ 200 v porovnání s normálním epitelem jícnu a dvanáctníku, u adenokarcinomu byl pak patrný další pokles hladin rodiny miR ‑ 200 oproti BE. Byl rovněž popsán vliv miR ‑ 141 a miR ‑ 200c na molekulární komplexy, které zodpovídají za antiapoptotické a proliferační vlastnosti buněk BE. Jedná se především o skupiny kináz MAP, p38, c ‑ Jun, proteinkinázu C, PI3K, Akt, NF ‑ κB a p1. Konkrétně miR ‑ 200c je schopna podporovat apoptózu a potlačovat proliferaci snížením exprese lektinového receptoru, který hraje klíčovou roli v aktivaci dráhy Akt. Rodina miR ‑ 200 se také účastní dráhy regulující β ‑ katenin [35].
Dalším klíčovým faktorem v procesu EMT je pravděpodobně miR ‑ 205, jejíž exprese se zdá být specifická právě pro dlaždicobuněčný karcinom jícnu. Exprese zralé miR ‑ 205 je nutná pro udržování nízké hladiny transkripčních faktorů ZEB1 i ZEB2 a vysoké exprese E ‑ kadherinu. Výsledky studie Matsushima et al [36] prokázaly zapojení miR ‑ 205 do invaze, migrace a metastazování nádoru. Zdá se, že transkripční faktor ZEB1 by mohl být také ovlivněn prostřednictvím miR ‑ 150 [37].
Významnou úlohu v rozvoji SCCE sehrává miR ‑ 10b, jejíž cílovou molekulou je nádorově supresorový gen KLF4. Pokusy in vitro prokázaly, že zvýšená exprese miR ‑ 10b zodpovídá za invazivitu nádorových buněk, pravděpodobně tím, že vyřazuje z funkce gen KLF4 [38]. Invazivitu a migraci SCCE buněk dále podporuje miR ‑ 92a. Vazbou na 3‘ UTR supresorového genu pro E ‑ kadherin (CDH1) dochází k výraznému poklesu hladiny proteinu a následnému snížení buněčné adheze. Abnormální exprese miR ‑ 92a také koreluje s metastazováním nádoru do lymfatických uzlin [39]. Obdobnou funkci jako miR ‑ 92a má v případě SCCE i miR ‑ 25 [40]. Další miRNA podporující metastatický potenciál buněk SCCE je miR ‑ 31, jejíž zvýšená hladina byla detekována jak v nádorové tkáni, tak v séru pacientů. Pokusy in vitro prokázaly stimulační efekt miR ‑ 31 na tvorbu kolonií, migraci a invazivitu buněk. Onkogenní charakter této miRNA potvrzuje i její schopnost inaktivovat nádorové supresory EMP1, KRS2 a RGS4 [41].
MiRNA v diagnostice karcinomu jícnu
Četné studie z poslední doby ukazují, že miRNA by se mohly stát vhodnými biologickými markery a jejich detekce by mohla sloužit k diagnostickým účelům. Molekuly miRNA jsou na rozdíl od mRNA mnohem stabilnější, což je dáno především jejich malou velikostí a vlásenkovou strukturou. Další výhodou použití miRNA je jejich stabilita ve formalínem fixovaných tkáních uložených v parafínových blocích (FFPE), což umožňuje využití biologického materiálu uloženého na odděleních patologie, a tak i rozsáhlé retrospektivní studie [42].
V poslední době se výzkum zaměřuje i na tzv. cirkulující miRNA. Jedná se o miRNA nalézající se v krevní plazmě či v séru, popřípadě v dalších tělesných tekutinách, jejichž nespornou výhodou je minimalizace invazivity při získávání vzorků, a tedy i možnost opakovaného vyšetřování. Širší využití těchto miRNA by tak mohlo přinést značné zlepšení diagnostiky, a to nejen u onkologických onemocnění [43,44].
MiRNA mohou být uvolňovány do tělních tekutin v zásadě třemi způsoby: a) pasivní uvolnění z poškozených buněk, ke kterému dochází převážně za patologických podmínek, jakými jsou např. poškození tkáně, chronický zánět, případně metastazování [45]; b) aktivní a selektivní uvolnění miRNA za spotřeby energie v podobě ATP podobné např. uvolnění hormonů či cytokinů [46]; c) aktivní uvolnění miRNA v mikrovezikulech, mikročásticích či exozomech [47].
U pacientů se SCCE byly v plazmě detekovány onkogenní miR ‑ 21, miR ‑ 221, miR ‑ 184, miR ‑ 223, miR ‑ 25 a supresorová miR ‑ 375 [48,49]. V nedávné studii Liu et al identifikovali u pacientů s karcinomem jícnu snížené plazmatické hladiny miR ‑ 155 a miR ‑ 183 [50]. V séru pacientů se SCCE byly jako specifické markery identifikovány zvýšeně exprimované následující miRNA: miR ‑ 10a, miR ‑ 22, miR ‑ 100, miR ‑ 148b, miR ‑ 223, miR ‑ 133a a miR ‑ 127‑3p [51]. Změny v hladinách těchto miRNA se lišily v různých stadiích nádorů, z čehož je patrné, že tyto miRNA mohou být využity rovněž k diagnostice rozsahu onemocnění. Zvýšené hladiny exprese u miR ‑ 133 a miR ‑ 100 se ovšem rozcházejí s výsledky jiných vědeckých skupin, které u těchto miRNA prokázaly hladiny snížené [3,52]. Tento rozpor může být způsoben skutečností, že miRNA detekované v séru nemusejí mít původ výhradně v nádorové tkánijícnu.
Bylo prokázáno, že řada miRNA vykazuje odlišnou expresi v nádoru v porovnání s okolní nenádorovou tkání (tab. 1). Těchto odlišností v expresních profilech lze využít k časné diagnostice onemocnění a právě analýza profilu miRNA může poskytnout informace o původu a histologické klasifikaci nádoru [53], stupni malignity a míře diferenciace nádorové tkáně [54]. Srovnávací studie ukázaly, že některé miRNA se vyskytují společně jak u SCCE, tak u EAC, na druhé straně jiné miRNA jsou specifické pro daný histologický typ [55]. Na základě expresního profilu miRNA u různých histologických typů karcinomu jícnu můžeme miRNA rozdělit do několika skupin.
Tab. 1. Přehled miRNA zapojených do patogeneze karcinomu jícnu. 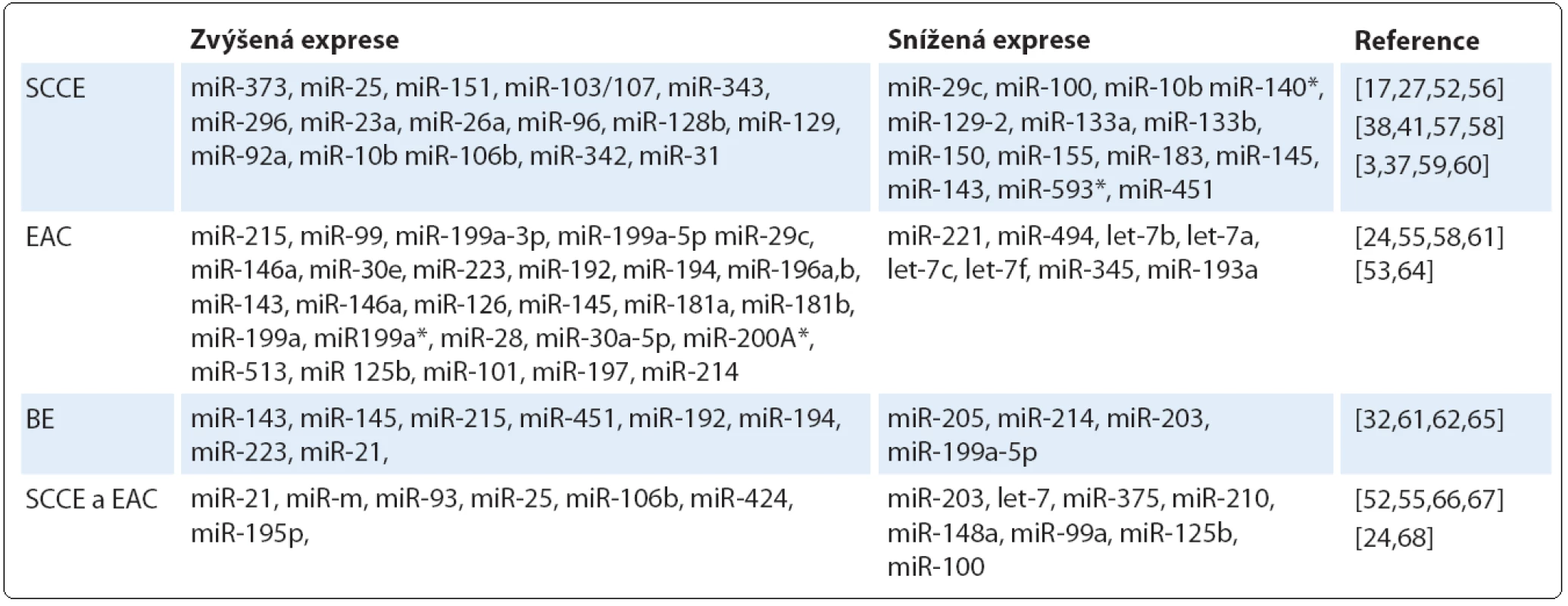
První skupinu tvoří miRNA, u nichž u SCCE došlo ke změně exprese v porovnání se zdravou tkání. Zvýšené hladiny byly pozorovány u miR ‑ 373 [17], miR ‑ 25, miR ‑ 151, miR ‑ 103/ 107 [52], miR ‑ 343, miR ‑ 296 [56], miR ‑ 23a, miR ‑ 26a, miR ‑ 96, miR ‑ 128b, miR ‑ 129 [57], miR ‑ 92a [39], miR ‑ 10b [38], miR ‑ 106b, miR ‑ 342 [58] a miR ‑ 31, jejichž zvýšená hladina byla specifická právě pro SCCE v porovnání s jinými nádory jícnu [41]. Naopak ke snížení exprese dochází v buňkách SSCE u miR ‑ 210 [27], miR ‑ 133a, miR ‑ 133b, miR ‑ 145, miR ‑ 143 [3], miR ‑ 451 [59], miR ‑ 150 [37], miR ‑ 593* [60], miR ‑ 29c, miR ‑ 100 a miR ‑ 140* [52].
Do druhé skupiny patří miRNA, jejichž exprese souvisí s dysplazií a EAC. Pro těžké formy dysplazie (HGD) a EAC jsou typické zvýšené hladiny miR ‑ 199a ‑ 3p, miR ‑ 199a ‑ 5p [58], miR ‑ 30e, miR ‑ 16-2 [24], miR ‑ 195, miR ‑ 199b, miR ‑ 146a, miR ‑ 29c a miR ‑ 424 [55]. Detailnější pohled ukázal výrazně vyšší expresní hladinu miR ‑ 126, miR ‑ 143, miR ‑ 145, miR ‑ 181a, miR ‑ 181b, miR ‑ 199a, miR ‑ 196b, miR ‑ 199a*, miR ‑ 28 a miR ‑ 30a ‑ 5p u EAC v porovnání s těžkou dysplazií, a dále možnost odlišení lehké a těžké formy dysplazie na základě odlišné exprese miR ‑ 200a*, miR ‑ 125b, miR ‑ 101 a miR ‑ 197 [55]. Již vyvinutý adenokarcinom lze charakterizovat zvýšenou mírou exprese miR ‑ 223, miR ‑ 192 a miR ‑ 194 [61]. Velmi zajímavá se z pohledu časné diagnostiky jeví především miR ‑ 196, jejíž exprese se zvyšuje v průběhu progrese nádoru od BE přes různé formy dysplazie až po adenokarcinom [53]. Naproti tomu snížené hladiny v buňkách EAC byly prokázány u miR ‑ 221, miR ‑ 205, miR ‑ 494, let ‑ 7b, let ‑ 7a, let ‑ 7c, let ‑ 7f, miR ‑ 345 a miR ‑ 193a. K odlišení EAC od HGD by mohly sloužit miR ‑ 149, miR ‑ 203, miR ‑ 210, miR ‑ 27b, miR ‑ 513 a miR ‑ 617, jejichž exprese byla v případě EAC výrazně nižší v porovnání s HGD [55].
Ve třetí skupině jsou zahrnuty miRNA, které se vyskytují u BE. Mezi ně patří miR ‑ 143, miR ‑ 145, miR ‑ 215 a miR ‑ 205, které jsou více vyjádřeny u BE v porovnání s EAC [62]. Naopak u EAC dochází více než k dvojnásobnému nárůstu hladin miR ‑ 214 a miR ‑ 199a ‑ 5p oproti BE [63]. U pacientů s BE a následně vyvinutým EAC byla detekována vyšší exprese miR ‑ 192, miR ‑ 194, miR ‑ 196a, miR ‑ 196b, miR ‑ 223 a miR ‑ 21 [61,64]. Bansal et al [65] ve své práci analyzovali vzorky BE a zjistili, že u pacientů se sníženou hladinou miR ‑ 15b, miR ‑ 203, miR ‑ 486 - 5p a let ‑ 7 došlo k těžkým dysplaziím nebo již k rozvoji nádoru. Tyto miRNA tak pravděpodobně hrají důležitou roli při progresi onemocnění.
Konečně do čtvrté skupiny náleží ty miRNA, jejichž exprese je podobná u obou histologických typů nádorů. Ke zvýšení hladin dochází u miR ‑ 21, miR ‑ 93, miR ‑ 25, miR ‑ 106b, miR ‑ 424 a miR ‑ 196a [52,55,66]. Na druhé straně snížená exprese byla zaznamenána u miR ‑ 203, let ‑ 7, miR ‑ 375, miR ‑ 210, miR ‑ 148a, miR ‑ 29c [67], miR ‑ 99a, miR ‑ 100, miR ‑ 125b [52,68], miR ‑ 34a a miR ‑ 195p [24].
Mezi nezařazené typy patří miR ‑ 205, která se v dlaždicovém epitelu exprimuje, ale její role u SCCE je do značné míry kontroverzní. Studie Matsushima et al [36] detekovala zvýšenou hladinu miR ‑ 205, na druhou stranu Ferber et al [58] uvádějí nižší expresi této miRNA u SCCE. Podobně i úloha miR ‑ 145 a miR ‑ 143 je v patologii SCCE stále nejasná. V některých studiích je popisována snížená exprese těchto miRNA [32,69], zatímco výsledky práce Akagi et al [70] ukázaly jejich zvýšené hladiny. Nejvýznamnější diagnostické miRNA a jejich cílové molekuly jsou shrnuty v tab. 2.
Tab. 2. MiRNA významné v diagnostice a prognóze karcinomu jícnu a jejich cílové molekuly. 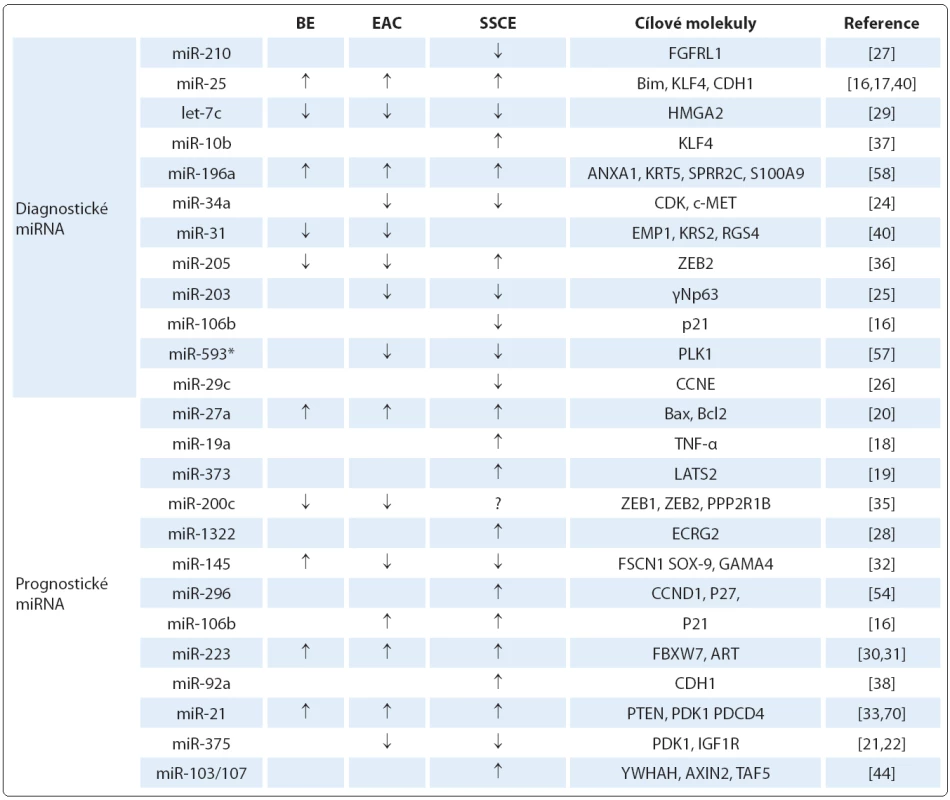
MiRNA v prognóze onemocnění
V poslední době rychle přibývá důkazů o tom, že různé miRNA jsou charakteristické pro různé molekulární podtypy nebo pro odlišná klinická stadia onemocnění. Této skutečnosti lze potenciálně využít ke stanovení prognózy, což v současné době potvrdila i řada studií. Jednou z takto využitelných miRNA u SCCE by mohla být miR ‑ 31, jejíž snížená hladina u pacientů s chirurgickým odstraněním nádoru korelovala s delší dobou přežívání [41]. Další prognosticky významnou miRNA by mohla být miR ‑ 21, která u pacientů s pokročilým stadiem onemocnění (T3, T4) vykazovala výrazně zvýšenou expresi v porovnání se stadii T1 a T2, což souvisí s invazivním potenciálem nádoru [67,71]. Hladina miR ‑ 21 také koreluje se vznikem vzdálených metastáz, vyšší vaskulární invazivitou a špatnou prognózou [72]. Bylo zjištěno, že po chirurgickém odstranění nádoru došlo k poklesu exprese miR ‑ 21. Prognostický a případný terapeutický potenciál byl prokázán i u miRNA přítomných v plazmě, konkrétně u miR ‑ 21 a miR ‑ 375 [48]. Z prognostického hlediska je též významná vyšší sérová hladina miR ‑ 1322, která alelickým způsobem reguluje supresorový gen ECRG2. Pacienti s TCA3 alelou měli horší prognózu než pacienti s alelou TCA4 [28].
Klinické stadium nádoru rovněž korelovalo s miR ‑ 92a, jejíž zvýšená exprese byla prokázána u pacientů s metastatickým postižením lymfatických uzlin [39]. S tvorbou lymfatických metastáz a s mírou diferenciace nádoru souvisí také vyšší hladina exprese miR ‑ 25 [40]. U pacientů s metastázami v lymfatických uzlinách, popřípadě s relapsem onemocnění, byly nalezeny nižší hladiny maturovaných miR ‑ 143, jejichž snížená exprese má souvislost se zvýšenou konzumací alkoholu, a miR ‑ 145, jejíž snížená exprese má souvislost s kouřením, přičemž riziko vzniku onemocnění vzrůstá s kombinovanou změnou obou těchto miRNA [69,70]. Také nižší exprese miR ‑ 375 souvisí u pacientů s SCCE s přítomností metastatického onemocnění a se špatnou prognózou [22]. Souvislost s metastatickým postižením lymfatických uzlin a zvýšeným proliferačním potenciálem nádorových buněk byla rovněž prokázána v případě nižší hladiny let ‑ 7 [29].
Prognostický význam má i miR ‑ 129, jejíž zvýšená exprese koreluje s kratší dobou přežití po operaci [57]. Obdobný trend byl pozorován i v případě miR ‑ 296 – pacienti s karcinomem jícnu a metastázami do lymfatických uzlin, u kterých byla detekována zvýšená exprese miR ‑ 296, měli medián přežití po resekci nádoru 12,9 měsíce, přičemž pacienti s nižší hladinou miR ‑ 296 se dožívali více než 20 měsíců [56]. S kratší dobou přežití též koreluje exprese miR ‑ 200a, miR ‑ 16 - 2 a miR ‑ 30e, a to především u pacientů s EAC [24].
Pacienti s SCCE, kteří měli nižší hladiny exprese miR ‑ 148a a miR ‑ 106a, vykazovali vyšší riziko recidivy onemocnění s dopadem na celkové přežití (overall survival – OS). Sníženou expresi miR ‑ 148 také vykazovaly špatně diferencované nádory [67]. S horší prognózou onemocnění jsou též spojeny exprese těchto miRNA: miR ‑ 142 - 3p [73], miR ‑ 23a, miR ‑ 26a, miR ‑ 27b, miR ‑ 96, miR ‑ 128B, miR ‑ 129 a miR ‑ 200c [74].
Prognostický význam může mít i pohled na regulaci biogeneze miRNA. Sugito et al [75] se zaměřili na studium změn v hladinách transkriptu genu RNASEN, který se jako enzym Drosha podílí právě na regulaci biogeneze miRNA. Autoři dospěli k závěrům, že vyšší hladina RNASENu je spojena s rizikem metastatického postižení lymfatických uzlin a kratší dobou přežití.
MiRNA jako prediktivní biomarkery u karcinomu jícnu
Tak jako se miRNA podílejí na regulaci procesů maligní transformace, participují na mechanizmech ovlivňujících senzitivitu a rezistenci k chemoterapii a radioterapii a dnes také k cílené léčbě. Mohou tedy teoreticky sloužit jako prediktivní biomarkery, které umožní předpovídat léčebnou odpověď u dané terapie a povedou k vyšší míře individualizace léčby [76]. Jako prediktivní biomarkery u SCCE mohou sloužit miR ‑ 483 a miR ‑ 214, jejichž zvýšená hladina predikuje sníženou odpověď na chemoterapii. Snížená hladina miR ‑ 483 a miR ‑ 214 by naopak mohla zvýšit senzitivitu na léčbu karcinomu jícnu spojenou jak s multilékovou rezistencí, tak bez ní a může také indukovat zvýšenou akumulaci doxorubicinu [77].
Autoři další studie ukázali signifikantně sníženou expresi miR ‑ 192, miR ‑ 194 a miR ‑ 622 po neoadjuvantní chemoterapii lokálně pokročilého karcinomu jícnu. Navíc exprese miR ‑ 192 a miR ‑ 194 v biopsii před zahájením léčby jsou považovány za indikátory patologické regrese tumoru po neoadjuvanci [78]. Prediktivní miRNA a jejich působení je shrnuto v tab. 3.
Tab. 3. MiRNA významné v predikci léčebné odpovědi karcinomu jícnu. 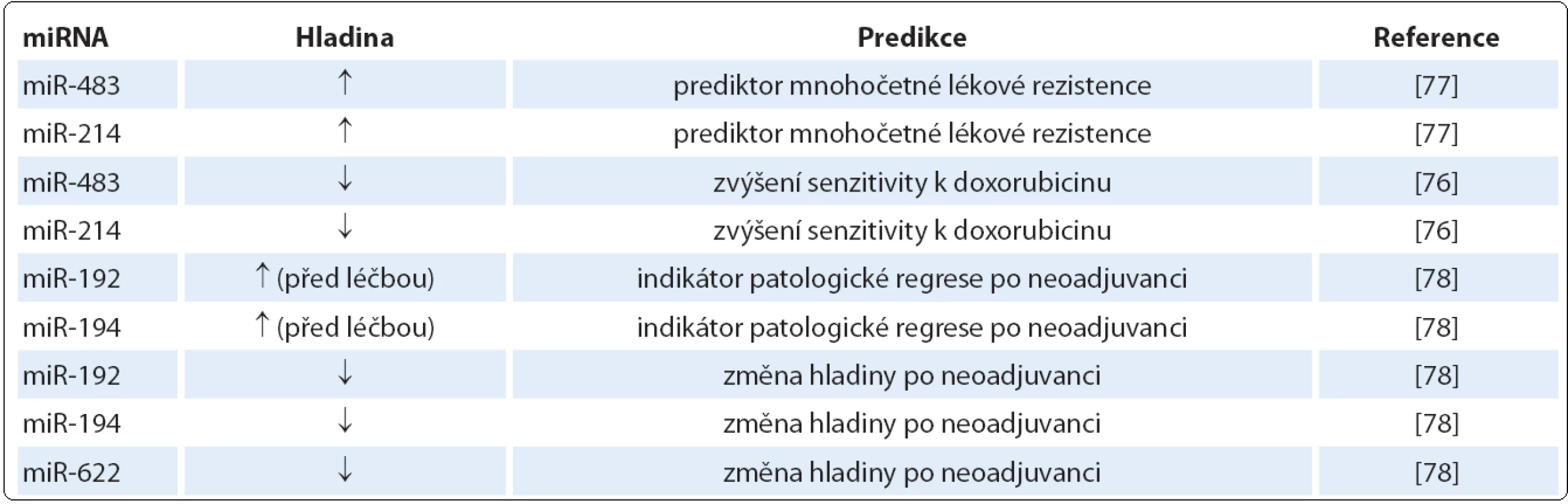
MiRNA jako terapeutické cíle
Na začátku kapitoly byly popsány některé molekulární dráhy v patogenezi karcinomu jícnu, které jsou ovlivňovány pomocí miRNA. Každá miRNA působí na jednu nebo více cílových molekul, které mohou vykonávat funkci onkogenů nebo nádorově supresorových genů. Ovlivnění těchto genů představuje potenciální terapeutické využití miRNA. Jednou z cest je záměrné zvyšování exprese suprimovaných miRNA pomocí transfekce syntetických pre‑miRNA. Na druhé straně miRNA s onkogenním účinkem můžeme potlačit aplikací umělých oligonukleotidů, tzv. anti‑miRs (AMOs), které komplementární vazbou vyřadí příslušnou miRNA z funkce [79]. Snížit produkci miRNA lze také prostřednictvím inhibice ribonukleáz Drosha a Dicer, ale tento způsob je méně vhodný, neboť není specifický.
Jedna z mála studií zkoumajících působení AMOs in vivo studovala vliv anti‑miR ‑ 19a na myším modelu SCCE. U myší, kterým byla aplikována tato anti‑miR, došlo k pozastavení vývoje nádoru [18]. Jak už bylo uvedeno dříve, existuje souvislost mezi zvýšenou a sníženou hladinou exprese určité miRNA a odpovědí na chemoterapii nebo délkou OS. Hummel et al [67] se zabývali expresí miRNA a chemorezistencí u pokročilého karcinomu jícnu. Zjistili, že buňky rezistentní na cisplatinu, ale citlivé na 5 - fluorouracil vykazovaly zvýšenou hladinu miR ‑ 106a. U 70 % buněčných linií odvozených od karcinomu jícnu byla prokázána pozitivní korelace mezi citlivostí nádorových buněk na cytostatika a vyšší hladinou miR ‑ 148a. Tato miRNA může fungovat jako potenciální terapeutický cíl, který ovlivňuje citlivost nádorových buněk na chemoterapii, především na cisplatinu.
Také Hamano et al [74] dospěli k závěrům, že miRNA mohou ovlivňovat citlivost nádoru na cytostatika a sloužit tak jako potenciální terapeutický cíl. Zjistili, že buňky chemorezistentní na cisplatinu se vyznačují vysokou expresí miR ‑ 200c. V in vitro pokusech při použití anti‑miR ‑ 200c došlo ke zvýšení senzitivity k cisplatině. Umělé snížení hladin miR ‑ 200c mělo za následek nárůst hladin proteinu PPP2R1B a následnou inhibici signální dráhy Akt. Autoři předpokládají, že na rezistenci vůči chemoterapii se u nádorů jícnu může podílet právě hyperaktivace dráhy Akt. Podobná situace byla popsána u miR ‑ 141 [80].
Výzkumný tým Zhang et al [20] ukázal, že exprese miR ‑ 27a ovlivňuje terapeutickou odpověď prostřednictvím regulace genu MDR1 (multidrug resistence protein 1), který zodpovídá za mnohočetnou lékovou rezistenci. Expresní analýzou miRNA v nádorové tkáni pacientů, kteří podstoupili neoadjuvantní chemoradioterapii, byla zjištěna odlišná exprese miR ‑ 21, miR ‑ 223, miR ‑ 192 a miR ‑ 194 ve srovnání s pacienty bez této léčby [61].
MiRNA mají také schopnost působit na základní procesy v kmenových buňkách, jako je např. sebeobnova, pluripotence a diferenciace. Tento fakt otevírá možnost pro využití těchto miRNA k regulaci vlastností nádorových kmenových buněk, které se na chemoradiorezistenci rovněž významně podílejí [74].
Závěr
Na rozdíl od protein‑kódujících genů, jako jsou onkogeny nebo tumor supresorové geny, je postavení miRNA v biologii nádorové buňky poměrně komplexnější. Na základě bioinformatických modelů se předpokládá, že miRNA mají potenciál regulovat více než polovinu kódujících genů v lidském genomu a každá miRNA může regulovat řádově stovky cílových mRNA. Proto není překvapující, že miRNA jsou zapojeny prakticky do všech významných buněčných procesů podílejících se na patogenezi nádorových onemocnění, včetně karcinomu jícnu. U karcinomu jícnu byla provedena celá řada studií založených na vysokokapacitních analýzách miRNA v nádorové a příslušné nenádorové tkáni, přičemž zohledňovala její histologické podtypy. MiRNA identifikované v těchto studiích jsou shrnuty v tab. 1. Z dosavadních pozorování vyplynulo, že diagnostický, případně prognostický význam budou mít pravděpodobně miR ‑ 205, miR ‑ 29c nebo miR ‑ 21. Poměrně velké množství rozporuplných výsledků ovšem poukazuje na skutečnost, že aplikace miRNA v diagnostice a terapii jsou teprve v začátcích a jejich praktické využití bude ještě vyžadovat řadu rozsáhlých a nezávislých validací.
Práce byla podpořena granty IGA MZČR č. NT/13585 a MZ ČR – RVO (MOÚ, 00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. RNDr. Ondřej Slabý, Ph.D.
Klinika komplexní onkologické péče
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: on.slaby@gmail.com
Obdrženo: 5. 12. 2013
Přijato: 24. 2. 2014
Zdroje
1. Klener P (ed.). Protinádorová chemoterapie. Praha: Galén 1996.
2. Klener P (ed.). Klinická onkologie. Praha: Galén 2002.
3. Kano M, Seki N, Kikkawa N et al. MiR ‑ 145, miR ‑ 133a and miR ‑ 133b: tumor ‑ suppressive miRNAs target FSCN1 in esophageal squamous cell carcinoma. Int J Cancer 2010; 127(12): 2804 – 2014.
4. Adam Z, Krejčí M, Vorlíček J et al. Speciální onkologie. 3. vyd. Praha: Galén 2010.
5. Zemanova M, Petruzelka L, Pazdro A et al. Prospective non‑randomized study of preoperative concurrent platinum plus 5 - fluorouracil‑based chemoradiotherapy with or without paclitaxel in esophageal cancer patients: long‑term follow‑up. Dis Esophagus 2010; 23(2): 160 – 167.
6. Jemal A, Siegel R, Ward E et al. Cancer statistics, 2008. CA Cancer J Clin 2008; 58(2): 71 – 96.
7. Lopes AB, Fagundes RB. Esophageal squamous cell carcinoma – precursor lesions and early diagnosis. World J Gastrointest Endosc 2012; 4(1): 9 – 16.
8. Holmes RS and Vaughan TL. Epidemiology and pathogenesis of esophageal cancer. Semin Radiat Oncol 2007; 17(1): 2 – 9.
9. Roth MJ, Liu SF, Dawsey SM et al. Cytologic detection of esophageal squamous cell carcinoma and precursor lesions using balloon and sponge samplers in asymptomatic adults in Linxian, China. Cancer 1997; 80(11): 2047 – 2059.
10. Kolář Z (ed.). Molekulární patologie nádorů. Olomouc: Epava 2003.
11. Zhao Y, Srivastava D. A developmental view of microRNA function. Trends Biochem Sci 2007; 32(4): 189 – 197.
12. Stark A, Brennecke J, Russell RB et al. Identification of Drosophila MicroRNA targets. PLoS Biol 2003; 1(3): E60.
13. Liu X, Fortin K, Mourelatos Z. MicroRNAs: biogenesis and molecular functions. Brain Pathol 2008; 18(1): 113 – 121.
14. Volinia S, Calin GA, Liu CG et al. A microRNA expression signature of human solid tumors defines cancer gene targets. Proc Natl Acad Sci U S A 2006; 103(7): 2257 – 2261.
15. Klener P, Klener P jr (eds). Nová protinádorová léčiva a léčebné strategie v onkologii. Praha: Grada 2010.
16. Kan T, Sato F, Ito T et al. The miR ‑ 106b ‑ 25 polycistron, activated by genomic amplification, functions as an oncogene by suppressing p21 and Bim. Gastroenterology 2009; 136(5): 1689 – 1700.
17. Zhu L, Yan W, Rodriguez ‑ Canales J et al. MicroRNA analysis of microdissected normal squamous esophageal epithelium and tumor cells. Am J Cancer Res 2011; 1(5): 574 – 584.
18. Liu M, Wang Z, Yang S et al. TNF‑alpha is a novel target of miR ‑ 19a. Int J Oncol 2011; 38(4): 1013 – 1022.
19. Lee KH, Goan YG, Hsiao M et al. MicroRNA ‑ 373 (miR ‑ 373) post‑transcriptionally regulates large tumor suppressor, homolog 2 (LATS2) and stimulates proliferation in human esophageal cancer. Exp Cell Res 2009; 315(15): 2529 – 2538.
20. Zhang H, Li M, Han Y et al. Down ‑ regulation of miR ‑ 27a might reverse multidrug resistance of esophageal squamous cell carcinoma. Dig Dis Sci 2010; 55(9): 2545 – 2551.
21. Li X, Lin R, Li J. Epigenetic silencing of microRNA ‑ 375 regulates PDK1 expression in esophageal cancer. Dig Dis Sci 2011; 56(10): 2849 – 2856.
22. Kong KL, Kwong DL, Chan TH et al. MicroRNA ‑ 375 inhibits tumour growth and metastasis in oesophageal squamous cell carcinoma through repressing insulin‑like growth factor 1 receptor. Gut 2012; 61(1): 33 – 42.
23. MacCallum DE, Hupp TR, Midgley CA et al. The p53 response to ionising radiation in adult and developing murine tissues. Oncogene 1996; 13(12): 2575 – 2587.
24. Hu Y, Correa AM, Hoque A et al. Prognostic significance of differentially expressed miRNAs in esophageal cancer. Int J Cancer 2011; 128(1): 132 – 143.
25. Yuan Y, Zeng ZY, Liu XH et al. MicroRNA ‑ 203 inhibits cell proliferation by repressing DeltaNp63 expression in human esophageal squamous cell carcinoma. BMC Cancer 2011; 11 : 57.
26. Ding DP, Chen ZL, Zhao XH et al. miR ‑ 29c induces cell cycle arrest in esophageal squamous cell carcinoma by modulating cyclin E expression. Carcinogenesis 2011; 32(7): 1025 – 1032.
27. Tsuchiya S, Fujiwara T, Sato F et al. MicroRNA ‑ 210 regulates cancer cell proliferation through targeting fibroblast growth factor receptor‑like 1 (FGFRL1). J Biol Chem 2011; 286(1): 420 – 428.
28. Zhang T, Zhao D, Wang Q et al. MicroRNA ‑ 1322 regulates ECRG2 allele specifically and acts as a potential biomarker in patients with esophageal squamous cell carcinoma. Mol Carcinog 2013; 52(8): 581 – 590.
29. Liu Q, Lv GD, Qin X et al. Role of microRNA let ‑ 7 and effect to HMGA2 in esophageal squamous cell carcinoma. Mol Biol Rep 2012; 39(2): 1239 – 1246. doi: 10.1007/ s11033‑011‑0854‑7.
30. Li S, Li Z, Guo F et al. miR ‑ 223 regulates migration and invasion by targeting Artemin in human esophageal carcinoma. J Biomed Sci 2011; 18 : 24. doi: 10.1186/ 1423‑0127‑18‑24.
31. Kurashige J, Watanabe M, Iwatsuki M et al. Overexpression of microRNA ‑ 223 regulates the ubiquitin ligase FBXW7 in oesophageal squamous cell carcinoma. Br J Cancer 2012; 106(1): 182 – 188. doi: 10.1038/ bjc.2011.509.
32. van Baal JW, Verbeek RE, Bus P et al. MicroRNA ‑ 145 in Barrett‘s oesophagus: regulating BMP4 signalling via GATA6. Gut 2013; 62(5): 664 – 675. doi: 10.1136/ gutjnl ‑ 2011 - 301061.
33. Ma WJ, Lv GD, Tuersun A et al. Role of microRNA ‑ 21 and effect on PTEN in Kazakh‘s esophageal squamous cell carcinoma. Mol Biol Rep 2011; 38(5): 3253 – 3260. doi: 10.1007/ s11033 - 010 - 0480 - 9.
34. Ohashi S, Natsuizaka M, Naganuma S et al. A NOTCH3 - mediated squamous cell differentiation program limits expansion of EMT ‑ competent cells that express the ZEB transcription factors. Cancer Res 2011; 71(21): 6836 – 6847. doi: 10.1158/ 0008 - 5472.CAN ‑ -11 - 0846.
35. Smith CM, Watson DI, Leong MP et al. MiR ‑ 200 family expression is downregulated upon neoplastic progression of Barrett‘s esophagus. World J Gastroenterol 2011; 17(8): 1036 – 1044. doi: 10.3748/ wjg.v17.i8.1036.
36. Matsushima K, Isomoto H, Yamaguchi N et al. MiRNA ‑ 205 modulates cellular invasion and migration via regulating zinc finger E ‑ box binding homeobox 2 expression in esophageal squamous cell carcinoma cells. J Transl Med 2011; 9 : 30. doi: 10.1186/ 1479 - 5876 - -9-30.
37. Yokobori T, Suzuki S, Tanaka N et al. MiR ‑ 150 is associated with poor prognosis in esophageal squamous cell carcinoma via targeting the EMT inducer ZEB1. Cancer Sci 2013; 104(1): 48 – 54. doi: 10.1111/ cas.12030.
38. Tian Y, Luo A, Cai Y et al. MicroRNA ‑ 10b promotes migration and invasion through KLF4 in human esophageal cancer cell lines. J Biol Chem 2010; 285(11): 7986 – 7994. doi: 10.1074/ jbc.M109.062877.
39. Chen ZL, Zhao XH, Wang JW et al. MicroRNA ‑ 92a promotes lymph node metastasis of human esophageal squamous cell carcinoma via E ‑ cadherin. J Biol Chem 2011; 286(12): 10725 – 10734. doi: 10.1074/ jbc.M110.165654.
40. Xu X, Chen Z, Zhao X et al. MicroRNA ‑ 25 promotes cell migration and invasion in esophageal squamous cell carcinoma. Biochem Biophys Res Commun 2012; 421(4): 640 – 645. doi: 10.1016/ j.bbrc.2012.03.048.
41. Zhang T, Wang Q, Zhao D et al. The oncogenetic role of microRNA ‑ 31 as a potential biomarker in oesophageal squamous cell carcinoma. Clin Sci (Lond) 2011; 121(10): 437 – 447. doi: 10.1042/ CS20110207.
42. Xi Y, Nakajima G, Gavin E et al. Systematic analysis of microRNA expression of RNA extracted from fresh frozen and formalin‑fixed paraffin‑embedded samples. RNA 2007; 13(10): 1668 – 1674.
43. Taylor DD, Gercel ‑ Taylor C. MicroRNA signatures of tumor ‑ derived exosomes as diagnostic biomarkers of ovarian cancer. Gynecol Oncol 2008; 110(1): 13 – 21. doi: 10.1016/ j.ygyno.2008.04.033.
44. Lawrie CH, Gal S, Dunlop HM et al. Detection of elevated levels of tumour‑associated microRNAs in serum of patients with diffuse large B ‑ cell lymphoma. Br J Haematol 2008; 141(5): 672 – 675. doi: 10.1111/ j.1365 - 2141.2008.07077.x.
45. Zen K, Zhang CY. Circulating microRNAs: a novel class of biomarkers to diagnose and monitor human cancers. Med Res Rev 2010; 32(2): 326 – 348. doi: 10.1002/ med.20215.
46. Han C, Chen Z, Yang M et al. Human SCAMP5, a novel secretory carrier membrane protein, facilitates calcium ‑ triggered cytokine secretion by interaction with SNARE machinery. J Immunol 2009; 182(5): 2986 – 2996. doi: 10.4049/ jimmunol.0802002.
47. Lodes MJ, Caraballo M, Suciu D et al. Detection of cancer with serum miRNAs on an oligonucleotide microarray. PloS One 2009; 4(7): e6229. doi: 10.1371/ journal.pone.0006229.
48. Komatsu S, Ichikawa D, Takeshita H et al. Circulating microRNAs in plasma of patients with oesophageal squamous cell carcinoma. Br J Cancer 2011; 105(1): 104 – 111. doi: 10.1038/ bjc.2011.198.
49. Wu C, Li M, Hu C et al. Clinical significance of serum mir ‑ 223, mir ‑ 25 and mir ‑ 375 in patients with esophageal squamous cell carcinoma. Mol Biol Rep 2014; 41(3): 1257 – 1266. doi: 10.1007/ s11033 - 013 - 2970 - z.
50. Liu R, Liao J, Yang M et al. Circulating miR ‑ 155 expression in plasma: a potential biomarker for early diagnosis of esophageal cancer in humans. J Toxicol Environ Health A 2012; 75(18): 1154 – 1162. doi: 10.1080/ 15287394.2012.699856.
51. Zhang C, Wang C, Chen X et al. Expression profile of microRNAs in serum: a fingerprint for esophageal squamous cell carcinoma. Clin Chem 2010; 56(12): 1871 – 1879. doi: 10.1373/ clinchem.2010.147553.
52. Guo Y, Chen Z, Zhang L et al. Distinctive microRNA profiles relating to patient survival in esophageal squamous cell carcinoma. Cancer Res 2008; 68(1): 26 – 33. doi: 10.1158/ 0008 - 5472.CAN ‑ 06 - 4418.
53. Maru DM, Singh RR, Hannah C et al. MicroRNA ‑ 196a is a potential marker of progression during Barrett‘s metaplasia ‑ dysplasia ‑ invasive adenocarcinoma sequence in esophagus. Am J Pathol 2009; 174(5): 1940 – 1948. doi: 10.2353/ ajpath.2009.080718.
54. Drakaki A, Iliopoulos D. MicroRNA gene networks in oncogenesis. Curr Genomics 2009; 10(1): 35 – 41. doi: 10.2174/ 138920209787581299.
55. Yang H, Gu J, Wang KK et al. MicroRNA expression signatures in Barrett‘s esophagus and esophageal adenocarcinoma. Clin Cancer Res 2009; 15(18): 5744 – 5752. doi: 10.1158/ 1078 - 0432.CCR ‑ 09 - 0385.
56. Hong L, Han Y, Zhang H et al. The prognostic and chemotherapeutic value of miR ‑ 296 in esophageal squamous cell carcinoma. Ann Surg 2010; 251(6): 1056 – 1063. doi: 10.1097/ SLA.0b013e3181dd4ea9.
57. Ogawa R, Ishiguro H, Kuwabara Y et al. Expression profiling of micro‑RNAs in human esophageal squamous cell carcinoma using RT‑PCR. Med Mol Morphol 2009; 42(2): 102 – 109. doi: 10.1007/ s00795 - 009 - 0443 - 1.
58. Feber A, Xi L, Pennathur A et al. MicroRNA prognostic signature for nodal metastases and survival in esophageal adenocarcinoma. Ann Thorac Surg 2011; 91(5): 1523 – 1530. doi: 10.1016/ j.athoracsur.2011.01.056.
59. Wang T, Zang WQ, Li M et al. Effect of miR ‑ 451 on the biological behavior of the esophageal carcinoma cell line EC9706. Dig Dis Sci 2013; 58(3): 706 – 714. doi: 10.1007/ s10620 - 012 - 2395 - x.
60. Ito T, Sato F, Kan T et al. Polo‑like kinase 1 regulates cell proliferation and is targeted by miR ‑ 593* in esophageal cancer. Int J Cancer 2011; 129(9): 2134 – 2146. doi: 10.1002/ ijc.25874.
61. Mathé EA, Nguyen GH, Bowman ED et al. MicroRNA expression in squamous cell carcinoma and adenocarcinoma of the esophagus: associations with survival. Clin Cancer Res 2009; 15(19): 6192 – 6200. doi: 10.1158/ 1078 - 0432.CCR ‑ 09 - 1467.
62. Wijnhoven BP, Hussey DJ, Watson DI et al. MicroRNA profiling of Barrett‘s oesophagus and oesophageal adenocarcinoma. Br J Surg 2010; 97(6): 853 – 861. doi: 10.1002/ bjs.7000.
63. Huang SD, Yuan Y, Zhuang CW et al. MicroRNA ‑ 98 and microRNA ‑ 214 post transcriptionally regulate enhancer of zeste homolog 2 and inhibit migration and invasion in human esophageal squamous cell carcinoma. Mol Cancer 2012; 11 : 51. doi: 10.1186/ 1476 - 4598 - 11 - 51.
64. Revilla ‑ Nuin B, Parrilla P, Lozano JJ et al. Predictive value of microRNAs in the progression of Barrett esophagus to adenocarcinoma in a long‑term follow‑up study. Ann Surg 2013; 257(5): 886 – 893. doi: 10.1097/ SLA.0b013e31826ddba6.
65. Bansal A, Lee IH, Hong X et al. Feasibility of microRNAs as biomarkers for Barrett‘s esophagus progression: a pilot cross ‑ sectional, phase 2 biomarker study. Am J Gastroenterol 2011; 106(6): 1055 – 1063. doi: 10.1038/ ajg.2011.37.
66. Luthra R, Singh RR, Luthra MG et al. MicroRNA ‑ 196a targets annexin A1: a microRNA ‑ mediated mechanism of annexin A1 downregulation in cancers. Oncogene 2008; 27(52): 6667 – 6678. doi: 10.1038/ onc.2008.256.
67. Hummel R, Hussey DJ, Michael MZ et al. MiRNAs and their association with locoregional staging and survival following surgery for esophageal carcinoma. Ann Surg Oncol 2011; 18(1): 253 – 260. doi: 10.1245/ s10434 - 010 - 1213-y.
68. Fassan M, Volinia S, Palatini J et al. MicroRNA expression profiling in human Barrett‘s carcinogenesis. Int J Cancer 2011; 129(7): 1661 – 1670. doi: 10.1002/ ijc.25823.
69. Liu R, Liao J, Yang M et al. The cluster of miR ‑ 143 and miR ‑ 145 affects the risk for esophageal squamous cell carcinoma through co ‑ regulating fascin homolog 1. PLoS One 2012; 7(3): e33987. doi: 10.1371/ journal.pone.0033987.
70. Akagi I, Miyashita M, Ishibashi O et al. Relationship between altered expression levels of MIR21, MIR143, MIR145, and MIR205 and clinicopathologic features of esophageal squamous cell carcinoma. Dis Esophagus 2011; 24(7): 523 – 530. doi: 10.1111/ j.1442 - 2050.2011.01177.x.
71. Mori Y, Ishiguro H, Kuwabara Y et al. MicroRNA ‑ 21 induces cell proliferation and invasion in esophageal squamous cell carcinoma. Mol Med Report 2009; 2(2): 235 – 239. doi: 10.3892/ mmr_00000089.
72. Hiyoshi Y, Kamohara H, Karashima R et al. MicroRNA ‑ 21 regulates the proliferation and invasion in esophageal squamous cell carcinoma. Clin Cancer Res 2009; 15(6): 1915 – 1922. doi: 10.1158/ 1078 - 0432.CCR ‑ 08 - 2545.
73. Lin DC, Zhang Y, Pan QJ et al. PLK1 Is transcriptionally activated by NF ‑ kappaB during cell detachment and enhances anoikis resistance through inhibiting beta‑catenin degradation in esophageal squamous cell carcinoma. Clin Cancer Res 2011; 17(13): 4285 – 4295. doi: 10.1158/ 1078 - 0432.CCR ‑ 10-3236.
74. Hamano R, Miyata H, Yamasaki M et al. Overexpression of miR ‑ 200c induces chemoresistance in esophageal cancers mediated through activation of the Akt signaling pathway. Clin Cancer Res 2011; 17(9): 3029 – 3038. doi: 10.1158/ 1078 - 0432.CCR ‑ 10 - 2532.
75. Sugito N, Ishiguro H, Kuwabara Y et al. RNASEN regulates cell proliferation and affects survival in esophageal cancer patients. Clin Cancer Res 2006; 12(24): 7322 – 7328.
76. Slabý O, Svoboda M et al (eds). MikroRNA v onkologii. 1. vyd. Praha: Galén 2012.
77. Zhou Y, Hong L. Prediction value of mir ‑ 483 and mir ‑ 214 in prognosis and multidrug resistance of esophageal squamous cell carcinoma. Genet Test Mol Biomarkers 2013; 17(6): 470 – 474. doi: 10.1089/ gtmb.2012.0518.
78. Odenthal M, Bollschweiler E, Grimminger PP et al. Microrna profiling in locally advanced esophageal cancer indicates a high potential of mir ‑ 192 in prediction of multimodality therapy response. Int J Cancer 2013; 133(10): 2454 – 2463. doi: 10.1002/ ijc.28253.
79. Krützfeldt J, Rajewsky N, Braich R et al. Silencing of microRNAs in vivo with ‚antagomirs‘. Nature 2005; 438(7068): 685 – 689.
80. Imanaka Y, Tsuchiya S, Sato F et al. MicroRNA ‑ 141 confers resistance to cisplatin‑induced apoptosis by targeting YAP1 in human esophageal squamous cell carcinoma. J Hum Genet 2011; 56(4): 270 – 276. doi: 10.1038/ jhg.2011.1.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2014 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Aplikace poznatků psychoneuroimunologie v kontextu komplexní onkologické léčby karcinomu prsu
- Mamografický screening u brazilských žen z hlediska socio‑ ekonomické stratifikace
- Léčba anakinrou u Schnitzler‑ syndromu – výsledky první retrospektivní multicentrické studie šesti pacientů z České republiky
- Význam standardizace v hodnocení populačního přežití onkologických pacientů v ČR – metodický koncept a výsledky analýzy dat Národního onkologického registru
- Adenokarcinóm rete testis – zriedkavý prípad testikulárnej malignity
- Informace z České onkologické společnosti
- Renálny onkocytóm s histologickými črtami invázie – kazuistika
- Další postupný ústup od axilární disekce u časného karcinomu prsu
- Zajímavé případy z nutriční péče v onkologii
- Massive Cutaneous Metastasis of a Renal Cell Carcinoma
- Soutěž o nejlepší práci
- Editorial
- Role mikroRNA v molekulární patologii karcinomu jícnu a jejich potenciální využití v klinické onkologii
- Lobulární karcinom prsu u muže – kazuistika a přehled literatury
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Aplikace poznatků psychoneuroimunologie v kontextu komplexní onkologické léčby karcinomu prsu
- Renálny onkocytóm s histologickými črtami invázie – kazuistika
- Další postupný ústup od axilární disekce u časného karcinomu prsu
- Lobulární karcinom prsu u muže – kazuistika a přehled literatury
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



