-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vliv předoperační chemoradioterapie na změnu exprese receptoru pro epidermální růstový faktor u pacientů léčených předoperační chemoradioterapií pro lokálně pokročilý karcinom rekta
Influence of Preoperative Chemoradiotherapy on Changes of Epidermal Growth Factor Receptor Expression in Patients Treated by Preoperative Chemoradiotherapy for Local Advanced Rectal Carcinoma
Aim:
The aim of this retrospective study was to determine the prognostic impact of expression of epidermal growth factor receptor (EGFR) changes during neoadjuvant chemoradiotherapy in patients with locally advanced rectal adenocarcinoma.Material and Methods:
One hundred and three patients with locally advanced rectal adenocarcinoma of stage II and III were evaluated. All patients were administered the total dose of 44 – 50.4 Gy. Concomitantly, the patients received capecitabine in the dose 825 mg/ m2 in two daily oral administrations or 5 - fluorouracil in the dose 200 mg/ m2 in continuous infusion. Surgery was indicated at intervals of 4 – 8 weeks from chemoradiotherapy completion. EGFR expression in the pretreatment biopsies and in resected specimens was assessed with immunohistochemistry.Results:
All of 103 patients received radiotherapy without interruption up to the total planned dose. Downstaging was described in 64 patients. Six patients had complete pathologic remission. Recurrence occurred in 49 patients. Local recurrence was found in 22 patients, generalization of disease was reported in 27 patients. A total of 51 patients died. Increased EGFR expression was found in 26 patients. The statistically significantly shorter overall survival (p < 0.001) and disease-free survival (p < 0.001) was found in patients with increased expression of EGFR compared with patients where no increase in the expression of EGFR was observed during neoadjuvant chemoradiotherapy.Conclusions:
The overexpression of EGFR during neoadjuvant chemoradiotherapy for locally advanced rectal adenocarcinoma is associated with significant shorter overall survival and disease-free survival.Key words:
rectal cancer – neoadjuvant therapy – chemoradiotherapy – monoclonal antibodies – epidermal growth factor receptor
This study was supported by the Scientific Council of the Regional Hospital Liberec, plc VR130304 and by project PRVOUK P37/01.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Submitted:
12. 8. 2014Accepted:
26. 8. 2014
Autoři: I. Richter 1; J. Dvořák 2
; A. Blüml 3; Eva Čermáková 4
; J. Bartoš 1; M. Urbanec 5; V. Sitorová 6; A. Ryška 6; I. Sirák 7; D. Buka 7; A. Ferko 8; B. Melichar 9; J. Petera 7
Působiště autorů: Onkologické oddělení, Krajská nemocnice Liberec, a. s. 1; Onkologická klinika 1. LF UK a Thomayerova nemocnice, Praha 2; Oddělení patologie, Krajská nemocnice Liberec, a. s. 3; Ústav biofyziky a informatiky, LF UK v Hradci Králové 4; Oddělení patologie, Nemocnice s poliklinikou Česká Lípa, a. s. 5; Fingerlandův patologický ústav, LF UK v Hradci Králové 6; Klinika onkologie a radioterapie LF UK a FN Hradec Králové 7; Chirurgická klinika LF UK a FN Hradec Králové 8; Onkologická klinika LF UP a FN Olomouc 9
Vyšlo v časopise: Klin Onkol 2014; 27(5): 361-366
Kategorie: Původní práce
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2014361Souhrn
Cíl:
Cílem předkládané práce je zhodnocení vlivu neoadjuvantní chemoradioterapie na expresi receptoru pro epidermální růstový faktor (epidermal growth factor receptor – EGFR) u pacientů s lokálně pokročilým adenokarcinomem rekta.Pacienti a metody:
Celkem bylo hodnoceno 103 pacientů s adenokarcinomem rekta II. a III. klinického stadia. Byla aplikována dávka 44 – 50,4 Gy zevní radioterapie, potenciace byla kapecitabinem 825 mg/ m2 ve dvou denních dávkách po celou dobu radioterapie nebo 5 - fluorouracilem v dávce 200 mg/ m2 v kontinuální infuzi. Chirurgický výkon byl indikován s odstupem 4 – 8 týdnů od ukončení chemoradioterapie. Exprese EGFR byla stanovena imunohistochemicky v endobiopsii a v chirurgickém resekátu.Výsledky:
Všech 103 pacientů podstoupilo po neoadjuvantní chemoradioterapii operační výkon. Downstaging byl popsán u 64 pacientů, z toho u šesti byla popsána kompletní patologická remise. U 49 pacientů byla popsána recidiva onemocnění. U 22 pacientů se objevila lokální recidiva, u 27 generalizace. Celkem zemřelo 51 pacientů. Zvýšení exprese EGFR během neoadjuvantní chemoradioterapie bylo pozorováno u 26 pacientů. Bylo zjištěno statisticky významně kratší celkové přežití (p < 0,001) a statisticky významně kratší přežití bez známek recidivy (p < 0,001) u pacientů se zvýšenou expresí EGFR během neoadjuvantní chemoradioterapie ve srovnání s pacienty bez zvýšení exprese EGFR.Závěr:
Zvýšená exprese EGFR během neoadjuvantní chemoradioterapie u pacientů s lokálně pokročilým adenokarcinomem rekta je spojena se statisticky významně kratším celkovým přežitím i přežitím bez známek recidivy.Klíčová slova:
nádory rekta – neoadjuvantní léčba – chemoradioterapie – monoklonální protilátky – receptor pro epidermální růstový faktorÚvod
Zhoubné nádory tlustého střeva a konečníku patří mezi nejčastěji se vyskytující nádorová onemocnění v naší populaci [1]. Adenokarcinom rekta představuje z tohoto počtu přibližně 30 %. Základním postupem léčby lokálně pokročilého adenokarcinomu rekta je neoadjuvantní chemoradioterapie s následnou totální mesorektální excizí [2 – 6]. Neoadjuvantní chemoradioterapie prokázala nižší výskyt lokálních recidiv a lepší profil toxicity než léčba adjuvantní [7]. Potenciace léčby 5 - fluorouracilem (5 - FU) nebo kapecitabinem prokázala vyšší procento patologické kompletní remise a nižší procento lokální recidivy než léčba samotnou radioterapií [8 – 12]. Celkové přežití nebylo ovlivněno, zřejmě v souvislosti s časnou subklinickou diseminací onemocnění již v době diagnózy. S rozvojem molekulární biologie se hledají další prediktivní faktory na celkové léčebné výsledky. Mezi nejvýznamnější patří receptor pro epidermální růstový factor (epidermal growth factor receptor – EGFR) [13]. U kolorektálního karcinomu je zvýšená exprese EGFR popsána v 60 – 80 % a je spojena s horší prognózou onemocnění [14 – 16]. Radiobiologické studie potvrdily EGFR kritickou úlohu cytoprotektivních a pro-proliferativních reakcí nádorových buněk po ozáření. Indukované zvýšení exprese EGFR po radioterapii souvisí s akcelerovanou repopulací nádorových buněk [17,18]. Zvýšení nádorové repopulace v průběhu radioterapie vede k obnově klonogenních nádorových buněk, čímž působí kontraproduktivně vůči samotné léčbě zářením [19 – 21]. Na podkladě výše zmíněných skutečností patří inhibice funkce EGFR v průběhu onkologické léčby mezi nejvíce studované postupy. V neoadjuvantní léčbě adenokarcinomu rekta proběhlo několik klinických prací, které hodnotily přínos monoklonálních protilátek proti EGFR v kombinaci s chemoradioterapií. Nejvíce dat je s cetuximabem. Celkově ale procento patologické kompletní odpovědi nepřesahovalo procento samostatné chemoradioterapie [22]. Proto se dále hledají možnosti, jak zlepšovat léčebné výsledky v dnešní éře individualizované léčby. Jednou z možností je studium dynamiky změny exprese EGFR během neadjuvantní chemoradioterapie adenokarcinomu rekta [23,24]. Předkládaná práce je retrospektivní společné zpracování dvou publikovaných souborů pacientů léčených ve dvou komplexních onkologických centrech pro karcinom rekta. Cílem předkládané práce je zhodnocení vlivu neoadjuvantní chemoradioterapie na dynamiku EGFR. Dynamika EGFR byla hodnocena srovnáním exprese EGFR v diagnostické biopsii s expresí EGFR v resekátu po chirurgickém výkonu.
Pacienti a metody
Soubor pacientů
Bylo hodnoceno celkem 103 pacientů léčených neadjuvantní chemoradioterapií pro karcinom rekta. Léčba probíhala od února 2001 do prosince 2009 ve dvou komplexních onkologických centrech (Klinika onkologie a radioterapie FN Hradec Králové a Onkologické centrum Krajské nemocnice Liberec). Mužů bylo 72, žen 31. Medián věku byl 63 let (rozmezí 40 – 78 let). Ve II. klinickém stadiu dle TNM klasifikace bylo 44 pacientů, ve III. stadiu bylo 59 pacientů. Podle anatomické sublokalizace nádoru mělo 43 pacientů distální okraj tumoru uložen do 5 cm od vnitřního svěrače, 52 pacientů mezi 5,1 a 10 cm. Distální okraj tumoru nad 10 cm byl popsán u osmi pacientů. Histologicky se jednalo o tubulární adenokarcinom u všech 103 pacientů. U třech pacientů byla popsaná mucinózní složka. Histologicky byl nádor dobře diferencovaný adenokarcinom u šesti pacientů, středně diferencovaný u 70 pacientů a málo diferencovaný u 27 pacientů. Medián předléčebné koncentrace hemoglobinu byl 139 (79 – 169) g/ l, medián předléčebné koncentrace leukocytů byl 8,0 (3,5 – 15,8) × 109/ l, medián předléčebné koncentrace trombocytů 268,5 (145 – 508) × 109/ l. Předoperační koncentrace CEA byla stanovena u 82 pacientů (79,6 % všech hodnocených pacientů). Medián předoperační koncentrace CEA byl 3,9 (0 – 377) µg/ l.
Terapie
Zdrojem záření byl lineární urychlovač (Varian Clinac 600, Varian Clinac 2100, Elekta Precise nebo Elekta Synergy). Bylo využito fotonové ionizující záření o energii 6, 15 nebo 18 MeV. Pacienti byli ozařovaní technikou 3D konformní radioterapií nebo IMRT s využitím segmentovaných polí. U všech pacientů byla aplikována dávka 44 – 45 Gy (frakcionace po 1,8 nebo 2 Gy) na oblast tumoru, mesorekta a pánevních spádových lymfatických uzlin. Boost 5,4 Gy ve třech frakcích byl použit u 53 pacientů. Konkomitantně byl aplikován 5 - FU v dávce 200 mg/ m2 v kontinuální infuzi po celou dobu radioterapie kromě víkendů nebo kapecitabin v dávce 825 mg/ m2 ve dvou denních perorálních aplikacích po celou dobu radioterapie včetně víkendů. Chirurgický výkon byl indikován s odstupem 4 – 8 týdnů od ukončení chemoradioterapie.
Imunohistochemické vyšetření (IHC)
Zpracované parafinové bloky byly nakrájeny mikrotonem na řezy o tloušťce 3 µm. Proběhla standardní deparafinace xylénem s následnou rehydratací. Následně proběhla proteolytická reakce tkáně po přidání proteázy. Endogenní peroxidázová reakce byla inhibovaná aplikací 3% roztoku peroxidu vodíku. Tkáňové řezy byly následně inkubovány při pokojové teplotě s myší monoklonální protilátkou IgG1 proti EGFR. Monoklonální protilátka byla součástí komerčně dodávaného kitu (EGFR PharmDxTM, Dako, Dánsko). Vzorek byl dále inkubován přibližně 30 min se značeným HRP polymerem a dalších 10 min s roztokem barviva DAB+. Posléze byly vzorky obarveny hematoxylinem. Jako negativní kontrola exprese EGFR byly použity kontrolní preparáty dodávané v komerčním kitu. Odečtení bylo provedeno ve světelném mikroskopu. Preparáty byly odečteny zkušeným patologem, který nebyl obeznámen s léčebnými výsledky pacientů. Hodnocení bylo semikvantitativní a byla hodnocena intenzita zbarvení minimálně 1 % nádorových buněk: 0 = žádná, 1 = slabá, 2 = střední, 3 = silná (obr. 1 – 3). U pacientů byly hodnoceny jednak endobioptické nálezy před zahájením léčby, jednak chirurgické resekáty po neoadjuvantní chemoradioterapii a operačním řešení.
Obr. 1. Hodnocení intenzity exprese EGFR pomocí IHC: EGFR 1+, zvětšení 200×. 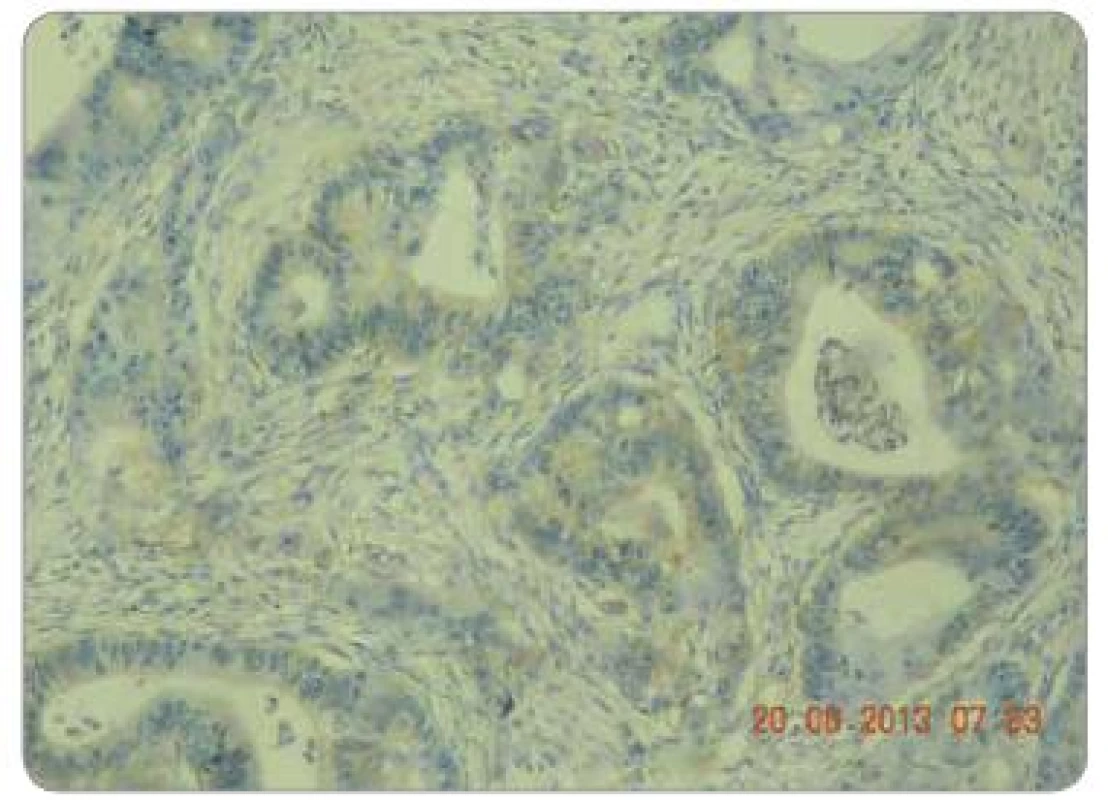
Obr. 2. Hodnocení intenzity exprese EGFR pomocí IHC: EGFR 2+, zvětšení 200×. 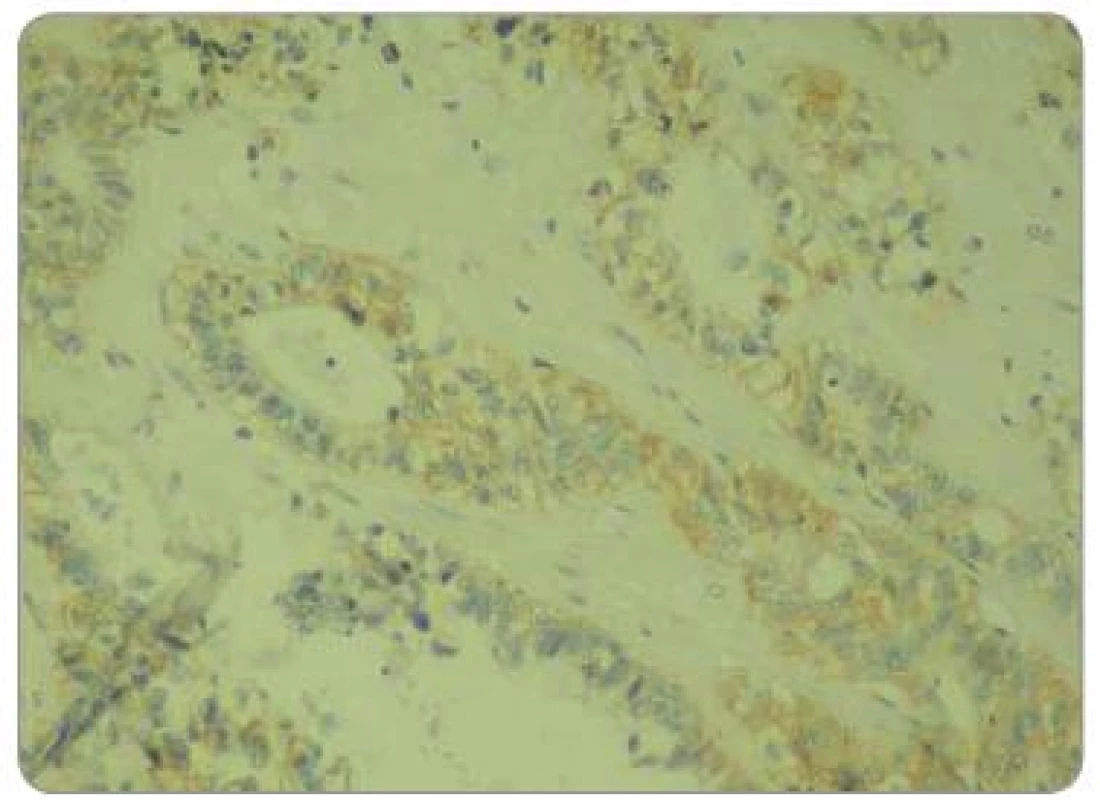
Obr. 3. Hodnocení intenzity exprese EGFR pomocí IHC: EGFR 3+, zvětšení 200×. 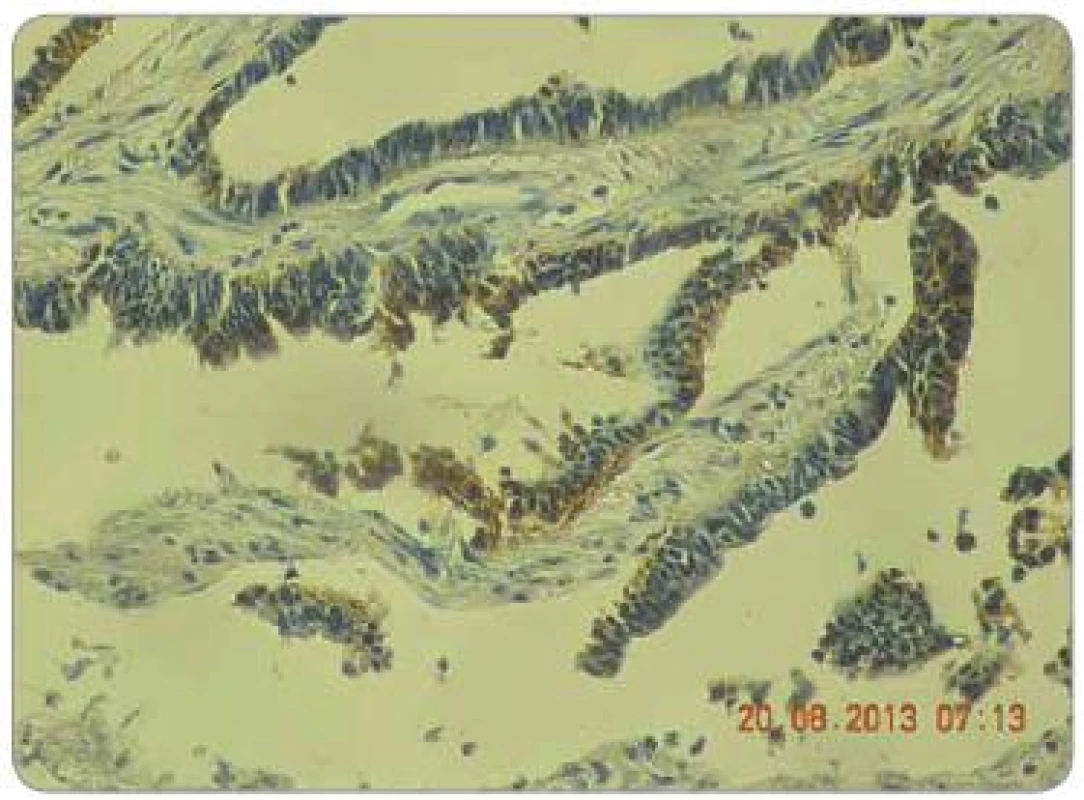
Statistika
Ke statistickému zhodnocení byl použit program Number Cruncher Statistical Systems NCSS 9 (Kaysville, Utah, USA). Celková doba přežití (overall survival – OS) = doba od stanovení diagnózy po úmrtí nebo do dne poslední kontroly u přeživších. Přežití bez známek recidivy (disease free survival – DFS) = doba od operace do objevení recidivy nebo poslední kontroly u pacienta bez recidivy. OS a DFS bylo hodnoceno pomocí Kaplan-Meierovy analýzy. Při zhodnocení vlivu exprese EGFR na léčebné výsledky (OS, DFS) byl použit log-rank test. Všechny statistické testy byly hodnoceny na hladině významnosti α = 0,05.
Výsledky
Všech 103 pacientů absolvovalo radioterapii bez přerušení do celkové plánované dávky. Ani jeden pacient v průběhu léčby nezemřel. Konkomitantní chemoterapie byla předčasně ukončena u šesti pacientů z důvodů hematologické a gastrointestinální toxicity. Nejčastějším typem toxicity byla gastrointestinální toxicita, převážně stupně I a II. Průjem stupně III byl pozorován u tří pacientů. Anémie stupně III byla zjištěna u jednoho nemocného, leukopenie stupně III byla zjištěna ve dvou případech. Medián nadiru koncentrace hemoglobinu byl 120 (79 – 152) g/ l, medián nadiru koncentrace leukocytů byl 4,4 (1,6 – 14,5) × 109/ l, medián nadiru koncentrace trombocytů 189 (93 – 266) × 109/ l. Hand-foot syndrom nebyl pozorován u žádného nemocného. Radikální operace (R0 resekce) byla provedena u 98 pacientů. Pozitivní rekční okraj 1 mm a méně (R1 resekce) byla popsána u pěti pacientů. U 53 pacientů byl proveden svěrač šetřící výkon, 50 pacientů podstoupilo amputaci konečníku. Ani u jednoho pacienta nebyl lokální nález posouzen chirurgem jako inoperabilní. Podle patologické TNM klasifikace bylo po operaci v I. klinickém stadiu 32 pacientů, ve II. klinickém stadiu 42 pacientů, ve III. klinickém stadiu 20 pacientů. U šesti pacientů byla dosažena kompletní patologická remise onemocnění. Patologická kompletní remise byla definována jako absence nádorové tkáně v preparátu. U tří pacientů byla popsána peroperačně generalizace onemocnění do jater. Downstaging byl popsán u 64 pacientů (62,1 %). V době hodnocení (k 31. 12. 2013) se objevila recidiva u 49 pacientů, 54 pacientů bylo bez známek recidivy. U 22 pacientů byla popsána lokální recidiva, generalizace onemocnění byla popsána u 27 pacientů. Nejčastějším místem výskytu metastáz byla játra. Celkem zemřelo 51 pacientů, v době hodnocení žilo 52 pacientů. Pětileté přežití bez známek recidivy onemocnění (DFS) představovalo 52 % (95% CI 42 – 62 %). Pětileté celkové přežití (OS) představovalo 59 % (95% CI 49 – 68 %). V endobiopsii byla EGFR vyšetřena u 100 pacientů. Exprese EGFR 1+ byla zjištěna u 30 pacientů, exprese EGFR 2+ u 21 pacientů a exprese EGFR 3+ u 9 pacientů. U 40 pacientů v endobiopsii nebyla zjištěna exprese EGFR. Exprese EGFR v resekátu byla vyšetřena a zhodnocena u 97 pacientů. U šesti pacientů nebyla exprese EGFR vyšetřena v resekátu, protože byla dosažena patologická kompletní remise po neoadjuvantní chemoradioterapii. V resekátu byla zjištěna exprese EGFR 1+ u 28 pacientů, EGFR 2+ u 20 pacientů a EGFR 3+ u 10 pacientů. U 39 pacientů nebyla zjištěna exprese EGFR v resekátu. Dynamika EGFR byla hodnocena u 95 pacientů. U 29 pacientů byla pozorována snížená exprese EGFR, u 40 pacientů byla exprese EGFR beze změn. Zvýšení exprese EGFR bylo popsáno u 26 pacientů. U osmi pacientů nebyla dynamika exprese EGFR hodnocena jednak z důvodu dosažení patologické kompletní remise, jednak z nemožnosti určit expresi EGFR v biop-tickém preparátu z důvodu menšího množství vzorku. U pacientů bez zvýšení exprese EGFR bylo významně delší DFS ve srovnání s pacienty, u kterých došlo ke zvýšení exprese EGFR: HR 3,51 (95% CI 1,62 – 7,61), p < 0,001. Podobně i OS bylo významně delší u pacientů bez zvýšení exprese EGFR: HR 3,40 (95% CI 1,64 – 7,04), p < 0,0001 (graf 1, 2). U pacientů se zvýšením exprese EGFR bylo významně menší procento 5letého DFS: 20,9 % (95% CI 4,6 – 37,7 %) vs 63,3 % (95% CI 51,7 – 74,9 %), log-rank: p < 0,0001. Podobné údaje jsou i u 5letého OS: 23,3 % (95% CI 6,4 – 40,2 %) vs 68,8 % (95% CI 57,6 – 80,0 %), log-rank: p < 0,001.
Graf 1. Vliv změny exprese EGFR na přežití bez známek recidivy. 
Graf 2. Vliv změny exprese EGFR na celkové přežití. 
Diskuze
Naše retrospektivní práce potvrdila svůj cíl a demonstrovala, že pacienti se zvýšenou expresí EGFR během neoadjuvantní chemoradioterapie prokázali významně kratší OS a DFS. Retrospektivní zhodnocení je společnou analýzou již dvou publikovaných souborů pacientů [23,24]. Obě práce prokázaly prognostický vliv změny exprese EGFR u dvou různých skupin pacientů léčených ve dvou různých komplexních onkologických centrech. EGFR bylo hodnoceno v různých laboratořích patologie. V jednom souboru byla radioterapie potencovaná kontinuálním 5-FU, ve druhém souboru kapecitabinem, dle zvyklosti příslušného onkologického centra. V obou pracích se potvrdil prognostický význam dynamiky EGFR, proto se nejedná o náhodu, ale o prokázanou souvislost. Analýza společného souboru je také příkladem spolupráce onkologických center nejenom při konzultaci léčebných postupů, ale i při výzkumné činnosti. Prognostický význam exprese EGFR, ale ne její dynamiky, v průběhu neadjuvantní chemoradioterapie zkoumalo také několik dalších studií. Zvýšená exprese EGFR byla spojená se zvýšeným výskytem lokálních recidiv, kratší OS, kratší DFS či vznikem vzdálených metastáz, nižším procentem patologické kompletní remise [25 – 32]. Jiné klinické práce ale nepotvrdily prognostický vliv zvýšené exprese EGFR na léčebné výsledky [33,34]. Na podkladě uvedených skutečností je jedním z léčebných cílů inhibice EGFR. Monoklonální protilátky proti EGFR cetuximab a panitumumab prokázaly účinnost v léčbě metastatického karcinomu tlustého střeva a konečníku [35 – 42]. V neoadjuvantní léčbě adenokarcinomu rekta proběhlo podobně několik klinických prací, které hodnotily přínos monoklonálních protilátek proti EGFR v kombinaci s chemoradioterapií. Nejvíce dat je s cetuximabem. Celkově ale procento patologické kompletní odpovědi nepřesahovalo procento samostatné chemoradioterapie [22]. K ozřejmění této skutečnosti bude nutné bližší porozumění vzájemné interakce mezi radioterapií, inhibitory EGFR a cytostatiky. Nyati et al ve své prácí diskutují, zda by příčinou nemohla být suboptimální sekvence podávané léčby, která může vyústit spíše v antagonistický než potenciační efekt [43]. Bylo zjištěno, že EGFR inhibitory způsobují redistribuci buněčného cyklu blokádou v G1 fázi [44]. Po podání EGFR inhibitorů před aplikací cytostatické léčby dochází k zastavení buněčného cyklu v G1 fázi, což může mít vliv na zeslabení účinku následně podaných cytostatik s účinkem v dalších fázích buněčného cyklu (převážně fáze G2).Další příčinou nižší patologické kompletní remise po předoperační radiochemoterapii v kombinaci s inhibitory EGFR může být snížení tumorové proliferace po aplikaci inhibitorů EGFR s následnou nižší odpovědí méně proliferujících buněk na ionizující záření [45]. Podobně i využití antiEGFR terapie v adjuvantní léčbě zatím nepřineslo očekávané výsledky. Proběhla klinická studie III. fáze, která u 2 686 pacientů hodnotila přínos podání cetuximabu k režimu FOLFOX v adjuvantní léčbě zhoubného nádoru tlustého střeva. Jako primární cíl bylo zvoleno DFS. Při mediánu sledování 28 měsíců nebyly prokázány lepší výsledky kombinace režimu FOLFOX a cetuximabu ve srovnání se samotným režimem FOLFOX [46]. Je proto nezbytný další výzkum, který by lépe identifikoval pacienty, kteří mohou mít léčebný prospěch z antiEGFR terapie. Pomoci by mohl prezentovaný soubor 103 pacientů, kde byla hodnocena dynamika EGFR během neoadjuvantní chemoradioterapie karcinomu rekta. Na podkladě výsledků by mohli být vhodnými pacienti se zvýšením exprese EGFR, kteří mají horší prognózu zřejmě v souvislosti s akcelerovanou repopulací nádorových kmenových buněk [17,18]. Tato skupina pacientů by mohla mít benefit z další terapie inhibitory EGFR po chirurgickém výkonu. Prospektivní studie by v budoucnu mohly využít nejen imunohistochemii ex vivo, ale i imunohistochemii in vivo s využitím PET EGFR, která by mohla hodnotit dynamiku exprese EGFR nejen před radiochemoterapií a po ní, ale i v průběhu radiochemoterapie s časným zařazením antiEGFR terapie do léčebného algoritmu [47].
Závěr
Zvýšená exprese EGFR během neoadjuvantní chemoradioterapie pro lokálně pokročilý adenokarcinom rekta je významně spojena s kratší OS a DFS. Výsledky práce jsou příkladem spolupráce dvou komplexních onkologických center.
Práce byla podpořena fondem Vědecké rady Krajské nemocnice Liberec VR130304 a projektem PRVOUK P37/01.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Igor Richter
Onkologické oddělení
Krajská nemocnice Liberec, a. s.
Husova 10
460 63 Liberec
e-mail: igor.richter@seznam.cz
Obdrženo: 12. 8. 2014
Přijato: 26. 8. 2014
Zdroje
1. Dušek L, Mužík J, Kubásek M et al (eds). Epidemiologie zhoubných nádorů v České republice [online]. Brno: Masarykova univerzita; 2005 [citováno 13. července 2009]. Dostupné z: http:/ / www.svod.cz.
2. Doleželová-Horová H, Ondrová B, Šlampa P et al. Karcinom konečníku. In: Šlampa P, Petera J et al (eds). Radiační onkologie. 1. vyd. Praha: Galén 2007 : 153 – 162.
3. Kocáková I, Soumarová R. Chemoradioterapie karcinomu konečníku. In: Šlampa P, Soumarová R, Kocáková Iet al (eds). Konkomitantní chemoradioterapie solidních nádorů. Praha: Galén 2005 : 62 – 72.
4. Šlampa P, Lovas P, Lovasová Z et al. Karcinomy konečníku. In: Šlampa P et al (eds). Radiační onkologie v praxi. 3. vyd. Brno: Masarykův onkologický ústav 2011 : 70 – 78.
5. Dvořák J, Richter I, Buka D et al. Chemoradioterapie lokálně pokročilých karcinomů rekta. Farmakoterapie 2013; Suppl: 42 – 46.
6. Richter I, Dvořák J, Bartoš J. Neoadjuvantní léčba karcinomu rekta. Onkologie 2013; 7 : 287 – 290.
7. Sauer R, Becker H, Hohenberger W et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 2004; 351(17): 1731 – 1740.
8. Bosset JF, Calais G, Mineur L et al. Enhanced tumorocidal effect of chemotherapy with preoperative radiotherapy for rectal cancer: preliminary results – EORTC 22921. J Clin Oncol 2005; 23(24): 5620 – 5627.
9. Gerard JP, Conroy T, Bonnetain F et al. Preoperative radiotherapy with or without concurrent fluorouracil and leucovorine in T3 – 4 rectal cancers: results of FFCD 9203. J Clin Oncol 2006; 24(28): 4620 – 4625.
10. Ceelen WP, Van Nieuwenhove Y, Fierens K et al. Preoperative chemoradiation versus radiation alone for stage II and III resectable rectal cancer. Cochrane Database Syst Rev 2009; 1: CD006041. doi: 10.1002/ 14651858.CD006041.pub2.
11. Hofheinz RD, Wenz F, Post S et al. Chemoradiotherapy with capecitabine versus fluorouracil for locally advanced rectal cancer: a randomised, multicentre, non-inferiority, phase 3 trial. Lancet Oncol 2012; 13(6): 579 – 588. doi: 10.1016/ S1470-2045(12)70116-X.
12. De Caluwé L, van Nieuwenhove Y, Ceelen WP et al. Preoperative chemoradiation versus radiation alone for stage II and III resectable rectal cancer. Cochrane Database Syst Rev 2013; 2: CD006041. doi: 10.1002/ 14651858.CD006041.pub3.
13. Sirák I, Hatlová J, Petera J et al. Receptor pro epidermální růstový faktor a jeho úloha v radioterapii. Klin Okol 2008; 21(6): 338 – 347.
14. Steele RJ, Kelly P, Ellul B et al. Epidermal growth factor receptor expression in colorectal cancer. Br J Surg 1990; 77(12): 1352 – 1354.
15. Mayer A, Takimoto M, Fritz E et al. The prognostic signifikance of proliferating cell nuclear antigen, epidermal growth factor receptor, and MDR gene expression in colorectal cancer. Cancer 1993; 71(8): 2454 – 2460.
16. Khorana AA, Ryan CK, Cox et al. Vascular endothelial growth factor, CD68, and epidermal growth factor receptor expression and survival in patients with stage II and stage III colon carcinoma: a role for the host response in prognosis. Cancer 2003; 97(4): 960 – 968.
17. Withers HR, Taylor JM, Maciejewski B et al. The hazard of accelerated tumor clonogen repopulation during radiotherapy. Acta Oncol 1988; 27(2): 131 – 146.
18. M, Petersen C, Eichler W et al. Mechanism of repopulation in experimental squamous cell carcinoma. In: Kogelnik HD, Lukas P, Sedlmayer F (eds). Progress in radiation-oncology. 7th ed. Bologna: Monduzzi: 2002 : 417 – 422.
19. Begg AC. Prediction of repopulation rates and radiosensitivity in human tumours. Int J Radiat Biol 1994; 65(1): 103 – 108.
20. Fowler JF. Rapid repopulation in radiotherapy: a debate on mechanism. The phantom of tumor treatment-continually rapid proliferation inmasked. Radiother Oncol 1991; 22(3): 156 – 158.
21. Schmitdt-Ullrich RK, Contessa JN, Dent P et al. Molecular mechanism of radiation-induced accelerated repopulation. Radiat Oncol Investig 1999; 7(6): 321 – 330.
22. Richter I, Dvořák J, Bartoš J. Neoadjuvantní chemoradioterapie karcinomu rekta v kombinaci s inhibitory receptoru pro růstový epidermální faktor. Klin Onkol 2014; 27(3): 166 – 172.
23. Dvořák J, Sitorová V, Ryška A et al. The prognostic signifikance of changes of tumor epidermal growth factor receptor expression after neoadjuvant chemoradiation in patiens with rectal adenocarcinoma. Strahlenter Onkol 2012; 10 : 145 – 147.
24. Richter I, Dvořák J, Urbanec M et al. The prognostic significance of change tumor epidermal growth factor receptor expression after neoadjuvant chemoradiation in patients with rectal adenocarcinoma. Contemporary Oncology, accepted 16. 7. 2014.
25. Azria D, Bibeau F, Barbier N et al. Prognostic impact of epidermal growth factor receptor (EGFR) expression on loco-regional recurrence after preoperative radiotherapy in rectal cancer. BMC Cancer 2005; 5 : 62.
26. Li S, Kim JS, Cho MJ et al. Epidermal growth factor receptor as a prognostic factor in locally advanced rectal-cancer patiens treated with preoperative chemoradiation. Int J Radiat Oncol Biol Phys 2006; 65(3): 705 – 712.
27. Giralt J, de las Heras M, Cerezo L et al. The expression of epidermal growth factor receptor results in a worse prognosis for patients with rectal cancer treated with preoperative radiotherapy. Radiother Oncol 2005; 74(2): 101 – 108.
28. Kopp R, Rothbauer E, Ruge M et al. Clinical implications of the EGF receptor ligand systém for tumour progression and survival in gastrointestinal carcinomas: evidence for new therapeutic options. Recent Results Cancer Res 2003; 162 : 115 – 132.
29. Li S, Kim JS, Kim JM et al. Epidermal growth factor receptor as a prognostic factor in locally advanced rectal cancer patiens treated with preoperative chemoradiotion. Int J Radiat Oncol Biol Phys 2006; 65(3): 1019 – 1028.
30. Kim JS, Kim JM, Li S et al. Epidermal growth factor receptor as a predictor of tumour downstaging in locally advanced rectal cancer patients treated with preoperative radiotherapy. Int J Radiation Oncol Biol Phys 2006; 66(1): 195 – 200.
31. Bertolini F, Bengala C, Losi L et al. Prognostic and predictive value of baseline and post-treatment molecular marker expression in locally advanced rectal cancer treated with neoadjuvant chemoradiotherapy. Int J Radiat Oncol Biol Phys 2007; 68 : 1455 – 1468.
32. Zlobec I, Vuong T, Compton CC et al. Combined analysis of VEGF and EGFR predicts komplete tumour response in rectal cancer treated with preoperative radiotherapy. Br J Cancer 2008; 98(2): 450 – 456. doi: 10.1038/ sj.bjc.6604172.
33. Bengala C, Bettelli S, Bertolini F et al. Prognostic role of EGFR gene copy number and KRAS station in patiens with locally advanced rectal cancer treated with preoperative chemoradiotherapy. Br J Cancer 2010; 103(7): 1019 – 1024. doi: 10.1038/ sj.bjc.6605853.
34. Spindler KL, Nielsen JN, Lindebjerg J et al. Prediction of response to chemoradiation in rectal cancer by a gene polymorphism in the epidermal growth factor receptor promotera region. Int J Radiat Oncol Biol Phys 2006; 66(2): 500 – 504.
35. Cunningham D, Humblet Y, Siena S et al. Cetuximab monotherapy and cetuximab plus irinotekan in irinotekan-refractory metastatic colorectal cancer. N Engl J Med 2004; 351(4): 337 – 345.
36. Finocchiaro G, Capuzzo F, Janne PA et al. EGFR HER2, and K-ras as predictive factors for cetuximab sensitivity in colorectal cancer. Proc Am Soc Clin Oncol 2007; 25 : 168.
37. Van Cutsem E, Kohne CH, Láng I et al. Cetuximab plus irinotecan, fluorouracil, and leucovorine as first-line treatment for metastatic colorectal cancer: update analysis of overall survival according to tumor KRAS and BRAF station status. J Clin Oncol 2011; 29(15): 2011 – 2019. doi: 10.1200/ JCO.2010.33.5091.
38. Bokemeyer C, Bondarenko I, Makhson A et al. Fluorouracil, leucovorin, and oxaliplatin with and without cetuximab in the first-line treatment of metastatic colorectal cancer. J Clin Oncol 2009; 27(5): 663 – 671. doi: 10.1200/ JCO.2008.20.8397.
39. Maugham TS, Adams RA, Smith CG et al. Addition of cetuximab to oxaliplatine-based first-line combination chemotherapy for treatment of advanced colorectal cancer: results of the randomised phase 3 MRC COIN trial. Lancet 2011; 377(9783): 2013 – 2114. doi: 10.1016/ S0140-6736(11)60613-2.
40. Tveit KM, Guren T, Glimelius B et al. Phase III trial of cetuximab with continuous or intermittent fluorouracil, luecovorine, and oxaliplatine (Nordic FLOX) versus FLOX alone in first-line treatment of metstatic colorectal cancer: the NORDIC-VII study. J Clin Oncol 2012; 30(15): 1755 – 1762. doi: 10.1200/ JCO.2011.38.0915.
41. Van Cutsem E, Peeters M, Siena S et al. Open-label phase III trial of panitumumab plus bets supportive care compared with best supportive care alone in patiens with chemotherapy-refractory metastatic colorectal cancer. J Clin Oncol 2007; 25(1): 1658 – 1664.
42. Oliner KS, Douillard JY, Siena S et al. Analysis of KRAS/ NRAS and BRAF station in the phase III PRIME study of panitumumab (pmab) plus FOLFOX versus FOLFOX as first-line treatment (tx) for metastatic colorectal cancer (mCRC). J Clin Oncol 2013; 31 (Suppl): abstr. 3511.
43. Nyati MK, Morgan MA, Feng FY et al. Integration of EGFR inhibitors with radiochemotherapy. Nat Rev Cancer 2006; 6 : 876 – 885.
44. Chinnaiyan P, Huang S, Vallabhaneni G et al. Mechanism of enhanced radiation response following epidermal growth factor receptor signaling inhibition by erlotinib (Tarceva). Cancer Res 2005; 65(8): 3328 – 3335.
45. Rau B, Sturm I, Lage H et al. Dynamic expression profile of p21WAF1/ CIP1 and Ki-67 predicts survival in rectal carcinoma treated with preoperative radiochemotherapy. J Clin Oncol 2003; 21(18): 3391 – 3401.
46. Alberts SR, Sargent DJ, Nair S et al. Effect of oxaliplatine, fluorouracil, and leucovorine with or without cetuximab on survival among patiens with resected stage IIIcolon cancer: a randomised trial. JAMA 2012; 307(13): 1383 – 1393. doi: 10.1001/ jama.2012.385.
47. Mishani E, Abourbeh G. Cancer molecular imaging: radionuclide-based biomarkers of the epidermal growth factor receptor (EGFR). Curr Top Med Chem 2007; 7(18): 1755 – 1772.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek EditorialČlánek Soutěž o nejlepší práciČlánek Prof. Žaloudík šedesátiletýČlánek Aktuality z odborného tisku
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2014 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Editorial
- Soutěž o nejlepší práci
- Pomalidomid v liečbe relabujúceho a refraktérneho mnohopočetného myelómu
- Cereblon – nový terapeutický cieľ v liečbe mnohopočetného myelómu
- Role mikroRNA v patofyziologii neuroblastomu a možnosti jejich využití pro diagnostiku, odhad prognózy a terapii
- Úloha CDK12 v iniciaci a rozvoji nádorů a její klinické konsekvence
- Informace z České onkologické společnosti
- Prognostické markery pokročilého nemalobunkového karcinómu pľúc – hodnotenie významu onkomarkerov pomocou data-miningovej metódy RPA
- Spokojenost onkologických pacientek s okamžitou dvoudobou aloplastickou rekonstrukcí prsu
- Soutěž na podporu autorských týmů publikujících v zahraničních odborných titulech
- Vliv předoperační chemoradioterapie na změnu exprese receptoru pro epidermální růstový faktor u pacientů léčených předoperační chemoradioterapií pro lokálně pokročilý karcinom rekta
- Neobvyklá nádorová infiltrace ušního lalůčku
- Těm, které by to mohlo zajímat – fotodiagnostika a fotodynamická léčba
- Aktuality z odborného tisku
- Prof. Žaloudík šedesátiletý
- Karcinomová lymfangiopatie při pokročilém karcinomu prsu
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Karcinomová lymfangiopatie při pokročilém karcinomu prsu
- Prognostické markery pokročilého nemalobunkového karcinómu pľúc – hodnotenie významu onkomarkerov pomocou data-miningovej metódy RPA
- Spokojenost onkologických pacientek s okamžitou dvoudobou aloplastickou rekonstrukcí prsu
- Cereblon – nový terapeutický cieľ v liečbe mnohopočetného myelómu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



