-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Prognostické markery pokročilého nemalobunkového karcinómu pľúc – hodnotenie významu onkomarkerov pomocou data-miningovej metódy RPA
Prognostic Markers of Advanced Non-small Cell Lung Carcinoma – Assessing the Significance of Oncomarkers Using Data-mining Techiques RPA
Introduction:
Identification of new prognostic factors can help in designing future clinical studies. In the case of advanced non-small cell lung cancer, there might be good candidates – tumor markers CYFRA 21-1, CEA or NSE [1–8]. It is possible to evaluate the relationship between their expression and prognosis by data mining technique recursive partitioning and amalgamation.Patients and Methods:
We analyzed retrospective data of 162 patients of Oncology clinics in Trnava. All of these patients were admitted between 2008 and 2012 for the administration of first-line chemotherapy according to current recommendations. We evaluated the impact of known pretreatment prognostic markers – performance status, weight loss, smoking, age, sex, stage, histologic subtype, comorbidity and oncomarkers CYFRA 21-1, CEA or NSE, as well as combinations of these factors on survival.Results:
Our analyses showed that there are three subgroups of patients with good, intermediate and unfavorable prognosis. Oncomarkers played an important role in formation of a subgroup of 49 patients with good prognosis – including patients with no pretreatment weight loss and low levels of CEA (≤ 4.1 ng/ml) or NSE (≤ 11.1 ng/ml). In this subgroup, the median survival time was at least 16 months (not achieved) and the difference in survival compared to the rest of the group was highly statistically significant (risk ratio 5.21, 95% CI 1.41–19.28; p < 0.0001).Conclusion:
We showed the prognostic significance of low levels of NSE and CEA oncomarkers in the group of patients with no pretreatment weight loss. Recursive partitioning and amalgamation is a useful data mining method, but the generated hypothesis needs to be confirmed by further clinical study designed for this purpose.Key words:
non-small cell lung cancer – oncomarkers – data mining – regression tree – neuron-specific enolase (NSE) – carcinoembryonal antigen (CEA)
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Submitted:
19. 3. 2014Accepted:
25. 9. 2014
Autoři: S. Cingelova 1; V. Labudová 2; D. Berkešová 3; M. Dienerová 4; A. Dammak 4; E. Grmanová 4; O. Nádaská 4; I. Vasilenková 4; E. Najšelová 4; V. Skarbová 4; M. Migašová 4; Z. Viktorínová 4; Ľ. Jurga 4
Působiště autorů: II. onkologická klinika LF UK a NOÚ, Bratislava, Slovensko 1; Fakulta hospodárskej informatiky, Ekonomická univerzita, Bratislava, Slovensko 2; AnalytX s. r. o., Trnava, Slovensko 3; Onkologická klinika FN Trnava, Slovensko 4
Vyšlo v časopise: Klin Onkol 2014; 27(5): 347-352
Kategorie: Původní práce
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2014347Souhrn
Úvod:
Pri dizajnovaní klinických štúdií môže pomôcť identifikácia nových prognostických faktorov prežívania. V prípade diagnózy pokročilého nemalobunkového karcinómu pľúc môžu byť vhodnými kandidátmi onkomarkery CYFRA 21 - 1, CEA alebo NSE [1 – 8]. Súvislosť ich expresie s prognózou umožňuje hodnotiť aj dataminingová metóda rekurzívneho delenia a zlučovania skupín.Metódy:
Analyzovali sme údaje 162 pacientov Onkologickej kliniky FN Trnava. Všetci títo pacienti boli prijatí v rokoch 2008 – 2012 na podávanie prvej línie chemoterapie podľa platných odporúčaní. Hodnotili sme vplyv známych predliečebných prognostických markerov – výkonnostného stavu, úbytku hmotnosti, fajčenia, veku, pohlavia, štádia, histologického subtypu, komorbidity a onkomarkerov CYFRA 21 - 1, CEA alebo NSE, ako aj kombinácií týchto faktorov, na prežívanie.Výsledky:
Výsledkom našej analýzy sú tri podskupiny pacientov s dobrou, strednou a nepriaznivou prognózou. Onkomarkery mali významnú úlohu pri utvorení podskupiny 49 pacientov s dobrou prognózou – sem patrili pacienti bez úbytku hmotnosti pred začatím liečby a nízkymi hladinami onkomarkerov CEA (≤ 4,1 ng/ ml) alebo NSE (≤ 11,1 ng/ ml). V tejto podskupine bol medián prežívania najmenej 16 mesiacov (nebol dosiahnutý) a rozdiel prežívania v porovnaní so zvyškom súboru bol vysoko štatisticky signifikantný (pomer rizík 5,21, 95% CI 1,41 – 19,28; p < 0,0001).Záver:
V našom súbore sme preukázali prognostický význam nízkych hladín NSE a CEA v skupine pacientov bez úbytku hmotnosti v predchorobí. Rekurzívne delenie a spájanie skupín predstavuje užitočnú dataminingovú metódu; takto vygenerovanú hypotézu je však potrebné potvrdiť ďalšou klinickou štúdiou dizajnovanou na tento účel.Kľúčové slová:
nemalobunkový karcinóm pľúc – onkomarkery – data mining – regresný strom – neurón-špecifická enoláza (NSE) – karcinoembryonálny antigén (CEA)Úvod
V liečbe pokročilého nemalobunkového karcinómu pľúc (non-small cell lung cancer – NSCLC) dochádza k zásadným zmenám z pohľadu vývoja nových liekov, ale aj vo výbere pacientov, ktorým je táto liečba určená. Pacienti s pokročilým NSCLC netvoria homogénnu skupinu – existujú niektoré kritériá, podľa ktorých ich možno rozdeliť na podskupiny vzhľadom na prognózu. Štandardnými prognostickými faktormi sú štádium ochorenia, histologický typ, výkonnostný stav, mužské pohlavie, fajčenie, úbytok hmotnosti a pridružené ochorenia (prezentované napr. ako index komorbidity, atď.). K prognostickým faktorom možno zaradiť aj anémiu, hladinu enzýmu laktát dehydrogenázy (LDH) v krvi, leukocytózu a iné. Vek (okrem extrémnych hodnôt) nie je považovaný za nezávislý prognostický faktor [1].
Význam niektorých nádorových markerov – onkomarkerov (neurón-špecifická enoláza – NSE, karcinoembryonálny antigén – CEA a cytokeratínový fragment 21 - 1 – CYFRA 21 - 1) – pri stanovení prognózy pacientov s NSCLC sa overoval vo viacerých štúdiách [1 – 8] pomocou Coxovho regresného modelu, pričom autori Barlési et al [7] poukázali na vplyv kombinácie týchto troch markerov na prežívanie. Autori Maeda et al [8] okrem spomínaného Coxovho modelu využili aj metódu rekurzívne delenie a spájanie skupín (recursive partitioning and amalgamation – RPA; t.j. vytvorenie stromov prežívania rekurzívnym delením a následného spájania skupín s podobnou prognózou), pri ktorej sa marker NSE ukázal ako najvýznamnejší prognostický faktor, pacienti s NSE viac ako 10 ng/ ml mali významne horšiu prognózu ako pacienti s NSE ≤ 10,0 ng/ ml. Štandardne sa elevácia NSE v sére popisuje pri malobunkových karcinómoch pľúc, elevácia CYFRA 21 - 1 pri málo a stredne diferencovaných epidermoidných karcinómoch pľúc, v menšej miere pri adenokarcinómoch pľúc a zvýšená hladina CEA najmä pri adenokarcinómoch pľúc. Autori štúdií [2,4,7] však poukázali na zvýšenie hladín uvedených markerov pri všetkých histologických subtypoch, pričom tieto výsledky pripisovali nižšej diferenciácii nádoru, ktorá nemusí byť vždy zachytená pri histologickom vyšetrení.
Informácie o prognostických faktoroch a prognóze jednotlivých skupín pacientov možno využiť napr. pri testovaní nových terapeutických postupov – pri randomizovaných klinických štúdiách. Obvykle sa pri pokročilých NSCLC randomizuje s ohľadom na štádium ochorenia, výkonnostný stav a pohlavie, prípadne niektoré ďalšie parametre (prítomnosť mozgových metastáz, investigatívne centrum, atď.). Vzhľadom na povahu randomizácie je možné pri tomto procese použiť len najvýznamnejšie prognostické faktory a onkomarkery zatiaľ medzi ne nepatria.
Intenzívne sa pátra po ďalších prognostických faktoroch, ktoré môžu byť detegované v samotnom nádore, v telových tekutinách alebo periférnej krvi chorých. V odbornej literatúre narastá počet publikácií, v ktorých autori hľadajú nové prognostické alebo prediktívne faktory aj pomocou metód exploratívnej analýzy.
Strom prežívania generovaný metódou RPA (autori Ciampi et al [9] a LeBlanc a Crowley [10]) je typ multivariačnej exploratívnej analýzy. Rozdelí súbor údajov na prognostické skupiny definované kombináciou prognostických faktorov. Ide o komplementárny nástroj ku klasickým metódam analýzy prežívania (Kaplan-Meierova krivka, log-rank test rozdielu v celkovom prežívaní a Coxov regresný model).
Špecializovaným data-miningovým postupom sa generuje grafová štruktúra vo forme rozhodovacieho stromu, obsahujúca vetvy, nelistové a listové uzly. Koncový uzol, ktorý sa už ďalej nedelí, sa nazýva listový. Ak je výstupná premenná spojitá, každý uzol reprezentuje odhadnutú hodnotu výstupnej premennej. Je veľa metód výberu najlepšieho rozdelenia v uzle (split) [11]. V našej práci sme použili log-rank test. Pri delení uzla sa najprv vypočíta log-rank štatistika pre všetky potenciálne deliace premenné a parameter s najvyššou hodnotou log-rank štatistiky sa vyberie ako deliaci.
Výhodou je, že na rozdiel od Kaplan-Meierovej analýzy a Coxovho regresného modelu počíta regresný strom aj s chýbajúcimi hodnotami.
Pri metóde rekurzívneho delenia a spájania skupín (RPA) najskôr vznikne rekurzívnym delením štruktúra stromu a potom sa spoja listové uzly, medzi ktorými nie je štatisticky významný rozdiel v prežívaní, do skupín [12]. Cieľom predkladanej práce je stanoviť v našom súbore vzťah dostupných prognostických faktorov a prežívania pomocou univariačnej analýzy, určiť nezávislé prediktory prežívania pomocou Coxovho regresného modelu a definovať prognostické skupiny pacientov s podobným prežívaním metódou RPA.
Metódy
Charakteristika súboru
V retrospektívnej analýze sme hodnotili lekárske záznamy 162 pacientov s inoperabilným NSCLC, ktorí boli liečení 1. líniou indukčnej chemoterapie na Onkologickej klinike a onkologických ambulanciách FN Trnava v období od októbra 2008 do septembra 2012 a sledovaní do mája 2013. Z uvedených 162 pacientov malo v 1. línii indukčnej chemoterapie 83 pacientov gemcitabín, 59 pacientov vinorelbín, 11 pacientov paklitaxel a 9 pacientov pemetrexed. Okrem toho malo 146 (90,12 %) pacientov aj derivát platiny a 18 pacientov bevacizumab. Šesťdesiatosem pacientov dostávalo aj 2. líniu chemoterapie – 26 pacientov erlotinib, 23 pacientov docetaxel, šesť pacientov pemetrexed, päť pacientov vinorelbín, päť pacientov paklitaxel a traja pacienti gemcitabín. Dvadsaťtri pacientov absolvovalo 3. líniu – 11 pacientov erlotinib, päť pacientov docetaxel, štyria pacienti vinorelbín, dvaja pacienti gemcitabín a jeden pacient paklitaxel. Štyridsaťdeväť z celkového počtu pacientov absolvovalo aj rádioterapiu na oblasť primárneho tumoru a len dvaja z nášho súboru boli operovaní (obaja štádium IIIA).
Do analýzy sme zaradili prognostické faktory dostupné z lekárskych záznamov: vek, pohlavie, fajčenie, úbytok hmotnosti, cukrovka, prítomnosť pridruženého ochorenia ako Charlson comorbidity score, histologický typ, štádium ochorenia a výkonnostný stav. Vzhľadom na povahu metódy stromu prežívania a jej softvérovej podpory sme prognostické faktory dichotomizovali. Premennú pohlavie sme kódovali ako 0 = ženy, 1 = muži. Klinické štádium ochorenia sme najskôr kódovali na základe TNM klasifikácie podľa Goldstrawa [13]. Klinické štádiá sme vzhľadom na početnosť kategórií zoskupili ako 0 = štádiá I – IIIB, 1 = štádium IV). Pacienti pôvodne štádiovaní podľa TNM klasifikácie platnej pred rokom 2009 (spolu 52) mali spätne stanovené štádium podľa novej TNM klasifikácie, pričom len u dvoch z nich sa týmto zmenila skupina „0“ na skupinu „1“. Výkonnostný stav (performance status – PS) pacienta sme kódovali podľa kritérií Eastern Cooperative Oncology Group [14] a zoskupili sme ho klasickým prístupom podľa [15], (0 = výkonnostný stav 0 alebo 1, 1 = výkonnostný stav 2 a iné). Histologický typ nádoru sme vzhľadom na početnosť kategórií kódovali: epidermoidný typ ako 0 a ostatné ako 1. U 36 pacientov bol subtyp stanovený cytologicky a u štyroch pacientov spôsob stanovenia nebol v záznamoch. U 16 pacientov nebol subtyp nádoru jednoznačný (najčastejšie z dôvodu malého množstva materiálu alebo aj nižšej diferenciácie), podľa záveru nášho patológa boli títo zaradení ako pravdepodobný adenokarcinóm do skupiny 1, alebo pravdepodobný epidermoidný karcinóm do skupiny 0. Prítomnosť fajčenia alebo úbytku hmotnosti sme kódovali ako 1, neprítomnosť ako 0; Charlson comorbidity score ≤ 8 ako 0, ostatné 1. Sledovanými onkomarkermi boli neurón-špecifická enoláza NSE, karcinoembryonálny antigén CEA a cytokeratínový fragment 21 - 1 CYFRA 21 - 1. Keďže sa v literatúre hraničné hodnoty týchto onkomarkerov ako prognostických faktorov NSCLC značne líšia (napr. pre NSE je to rozpätie 10,0 – 21,4), rozhodli sme sa ich nekategorizovať. Nami zistené hraničné hodnoty vzhľadom na prognózu sa totiž môžu líšiť od laboratóriom stanovených fyziologických hodnôt, pretože tieto neboli stanovované za účelom určovania prognózy NSCLC.
Štatistické metódy
V univariačnej analýze sme hodnotili vplyv jednotlivých prognostických faktorov na prežívanie pomocou chí-kvadrát testu alebo Fisherovho exaktného testu. Na vyhodnotenie vplyvu jednotlivých onkomarkerov sme použili univariačný Coxov regresný model. Vplyv všetkých faktorov na prežívanie bol hodnotený pomocou multivariačnej analýzy Coxovým regresným modelom. Chýbajúce hodnoty onkomarkerov boli vynechané z analýzy. Prežívanie sme definovali ako čas od dátumu začiatku liečby pacienta po dátum úmrtia z akejkoľvek príčiny, alebo dátum cenzovania. Distribúciu hodnôt onkomarkerov vzhľadom na histológiu sme hodnotili pomocou Mann-Whitney U-testu. Všetky p-hodnoty sme považovali za štatisticky významné, ak boli menšie ako 0,05.
Na definovanie prognostických podskupín s podobným prežívaním sme použili metódu stromov prežívania, popísanú v publikácii autorov Zhang et al [16]. Uzly boli rozdeľované na základe maximalizácie log-rank štatistiky. Strom bol orezaný softvérom podľa kritéria zložitosti a následne bol orezaný empiricky. Pri zohľadnení mnohonásobného porovnávania a interpretovateľnosti výsledkov bola ponechaná najväčšia p-hodnota rozdelenia 0,005. Následne sme spojili skupiny (listové uzly) s podobným prežívaním, pričom prežívanie v rámci spájaných skupín sa štatisticky významne nelíšilo na základe hodnôt log-rank testu a vznikli tak tri prognostické skupiny s vysokým, stredným a nízkym rizikom. Na spracovanie údajov sme použili softvér MS Excel 2007, Statgraphics CENTURION XV (chí-kvadrát test, Fisherov exaktný test, Kaplan-Meierov odhad funkcie prežívania, log-rank test a Coxov regresný model) a softvér STREE pre Windows (konštrukcia stromu prežívania).
Výsledky
Charakteristika nášho súboru je popísaná v tab. 1. Ide o súbor pacientov s pokročilým NSCLC, iniciálne v priemere s veľmi zlou prognózou, kde viac ako 80 % pacientov malo štádium IV, približne polovica pacientov s významnou komorbiditou, a asi 50 % výkonnostný stav 2 a viac a 50 % pacientov zaznamenalo úbytok hmotnosti v predchorobí. Hodnoty onkomarkerov v našom súbore sa nachádzajú tab. 2, chýbajúce hodnoty onkomarkerov boli z analýzy vynechané.
Tab. 1. Charakteristika súboru – klasické prognostické markery. 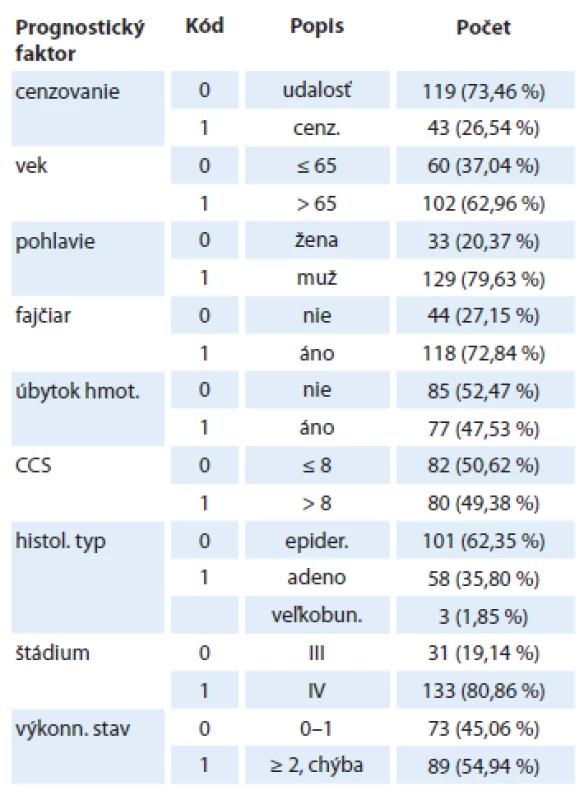
Tab. 2. Charakteristika súboru – onkomarkery. 
Celkový medián prežívania v našom súbore bol 8 mesiacov, čo je približne očakávaná hodnota pri tomto type nádorového ochorenia. V univariačnej analýze (tab. 3) sme hodnotili vplyv klasických prognostických faktorov na prežívanie. Štatisticky významný vplyv mali najmä úbytok hmotnosti pred liečbou, výkonnostný stav a štádium ochorenia. V multivariačnej analýze sa vplyv na prognózu potvrdil len pri úbytku hmotnosti (p = 0,0002) a výkonnostnom stave (p = 0,0485). Distribúcia onkomarkerov vzhľadom na subtyp nádoru je popísaná v tab. 4. Vidíme, že pacienti s adenokarcinómom mali hodnoty CEA podstatne vyššie ako pacienti s epidermoidným karcinómom (p = 0,01). CYFRA 21 - 1 a NSE mali pacienti zvýšené bez ohľadu na histologický subtyp.
Tab. 3. Vplyv jednotlivých prognostických faktorov na prežívanie. 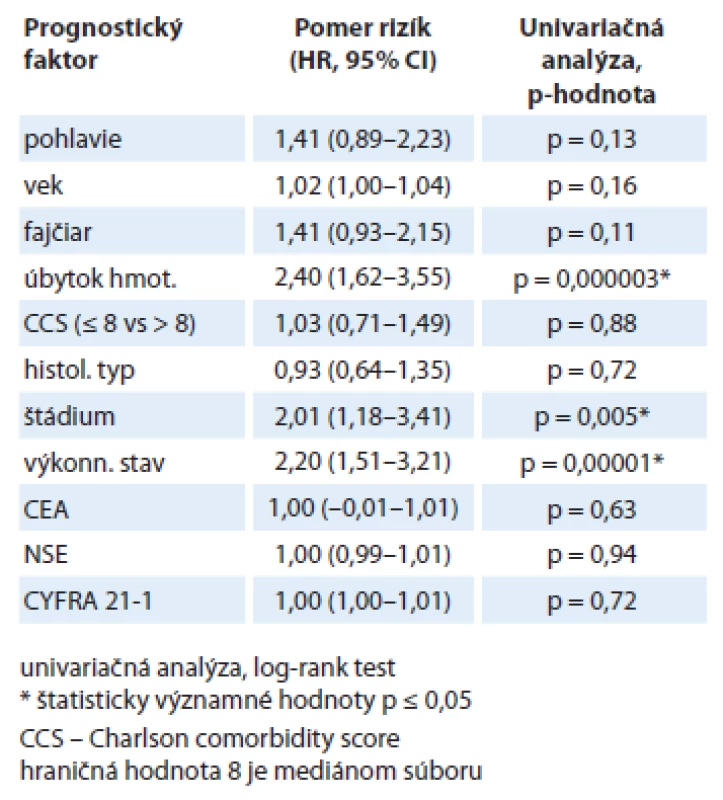
Tab. 4. Distribúcia jednotlivých onkomarkerov v našom súbore vzhľadom na histologický subtyp, chýbajúce hodnoty boli z analýzy vynechané, *štatisticky významné hodnoty p ≤ 0,05. 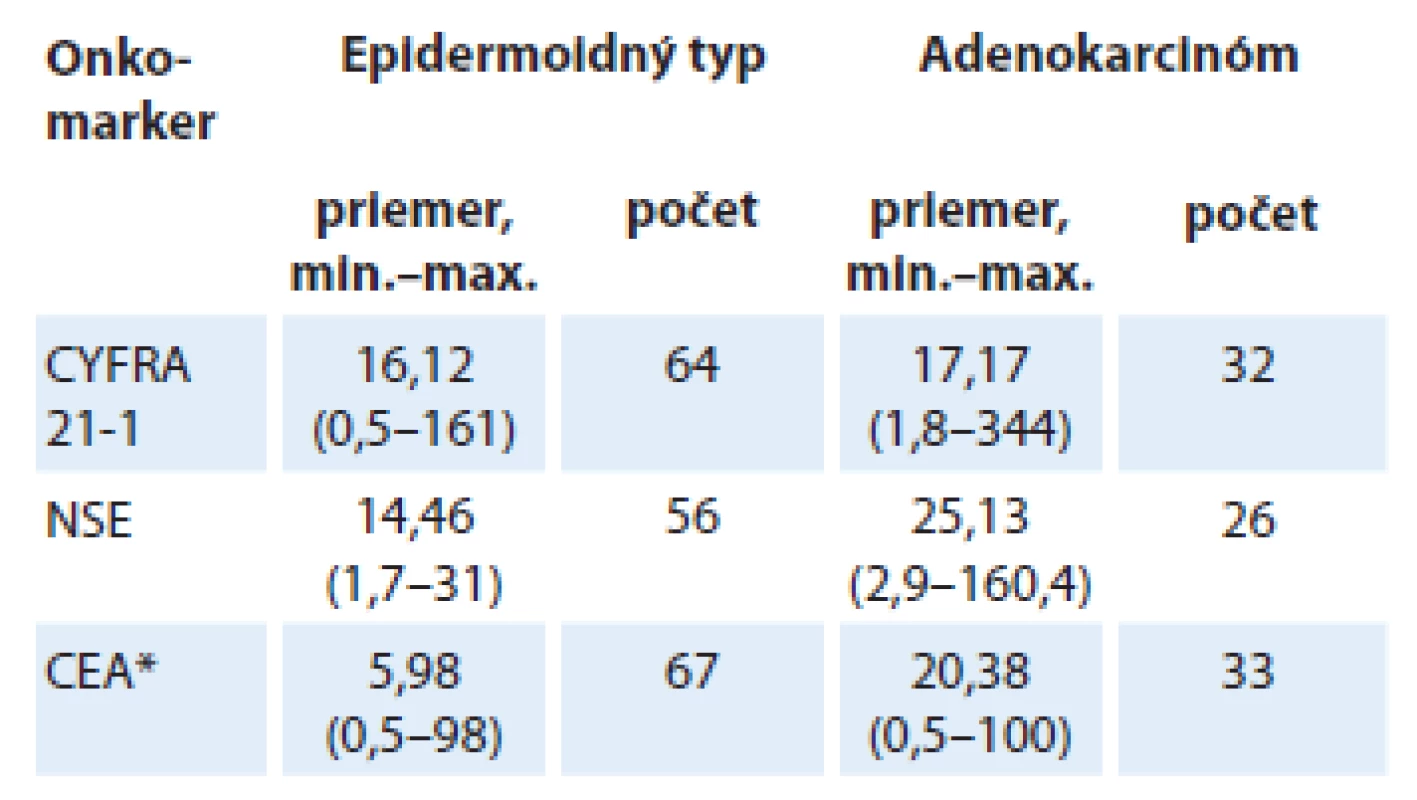
Strom prežívania (schéma 1) má deväť uzlov. Zlúčením piatich listových uzlov na základe podobného mediánu prežívania, použiteľnosti a interpretovateľnosti výsledkov, vznikli prognostické skupiny č. I, II a III (s dobrou, intermediárnou a nepriaznivou prognózou). Rozdiel v prežívaní medzi nimi bol vysoko štatisticky významný (risk ratio 5,2058, 95% CI 1,4055 – 19,2820, χ2 = 55,9, p = 7,4 × 10– 13). Priebeh ich kriviek prežívania je na grafe 1. V prognostickej skupine Ije 49 pacientov bez úbytku hmotnosti a zároveň s nízkou hodnotou onkomarkerov NSE ≤ 11,1 alebo CEA ≤ 4,1, medián prežívania v tejto skupine nebol dosiahnutý, medián sledovania bol 16 mesiacov. V skupine pätnástich pacientov s nízkou hodnotou onkomarkeru NSE bol medián prežívania minimálne 27 mesiacov (χ2 = 59,7, p = 6,7 × 10– 13). Naopak v prognostickej skupine III sa nachádza 44 pacientov s mediánom prežívania len 3,5 mesiacov; išlo o pacientov s nepriaznivým výkonnostným stavom a zároveň úbytkom hmotnosti. Ostatných 69 pacientov tvorilo početnú prognostickú skupinu so stredným rizikom – s úbytkom hmotnosti, pri dobrom výkonnostnom stave alebo bez úbytku hmotnosti a súčasne tiež s vyššou hodnotou NSE >11,1 alebo CEA > 4,1.
Graf 1. Porovnanie prežívania výsledných troch prognostických skupín. 
MST – median survival time, medián prežívania *MST nebol dosiahnutý, bol nahradený mediánom sledovania Schéma 1. Výsledný strom prežívania. 
Dopočítané hodnoty log-rank štatistiky a návrh spájania skupín (prognostická skupina I (uzly 4 + 8), II (uzly 9 + 6) a III (uzol 7)). n – počet subjektov v uzle/počet udalostí, MST – medián prežívania, median survival time. Pri údajoch označených * nebol medián prežívania dosiahnutý, preto bol nahradený mediánom sledovania. NSE, CEA, PS, UBYTOK HM. – názov deliacej premennej. χ2 hodnota log-rank štatistiky pri rozdelení uzla, p – zodpovadajúca p-hodnota Diskusia
Význam onkomarkerov neurón-špecifická enoláza NSE, karcinoembryonálny antigén CEA a cytokeratínový fragment 21 - 1 CYFRA 21 - 1 pri stanovení prognózy pacientov s NSCLC bol dokázaný vo viacerých štúdiách [1 – 8]. CEA je markerom voľby pri sledovaní efektivity liečby a v prognóze adenokarcinómu pľúc, ale jeho zvýšenie je však možné pozorovať aj pri ostatných subtypoch NSCLC [6]. Naopak, typický onkomarker spinocelulárneho karcinómu pľúc CYFRA 21 - 1 môže byť zvýšený aj pri adenokarcinómoch. NSE je známym diferenciačným onkomarkerom malobunkového karcinómu pľúc, no časť pacientov s NSCLC (11,7 – 28 %) má NSE tiež zvýšené [4]. Expresia NSE je nepriaznivým prognostickým znakom, pretože NSCLC s neuroendokrinnou diferenciáciou (i keď nie vždy zachytenou histologickým vyšetrením) sú agresívnejšie. Využitie onkomarkerov u pacientov s NSCLC je predmetom mnohých diskusií. V dostupnej literatúre prevláda názor, že hladiny onkomarkerov pred liečbou môžu popri klasických prognostických markeroch tiež významne prispieť k stanoveniu prognózy.
Náš model stromu prežívania vybral z uvedenej trojice onkomarkerov dva – NSE a CEA, ktoré pomohli vyčleniť skupinu pacientov s prognózou výrazne lepšou, ako býva zvyčajne pri tomto type nádorov. Pričom ani u jedného z nich nebola preukázaná štatisticky významná súvislosť s prežívaním ani v univariačnej analýze ani v klasickej Coxovej regresnej analýze. Zrejme príčinou môže byť ošetrenie chýbajúcich hodnôt regresným stromom, ako aj výraznejší súvis onkomarkerov s prežívaním u prognosticky dobrých pacientov (bez úbytku hmotnosti). Ak majú onkomarkery významný vplyv na prežívanie nezávisle od ostatných prognostických faktorov, bolo by vhodné tento fakt zakomponovať do dizajnu budúcich klinických štúdií. Naše výsledky by mali byť potvrdené v rozsiahlejšej štúdii s vyšším počtom pacientov, vedenej prospektívne, s dlhším sledovaním. Tiež zatiaľ nie je jasné, aké deliace (cut-off) hodnoty by sa mali použiť v prípade kategorizácie hodnôt onkomarkerov, keďže údaje v literatúre sa rôznia a odlišujú sa aj od u nás platných fyziologických hodnôt (NSE ≤ 16,3, CEA ≤ 2,5 a CYFRA 21 - 1 ≤ 3,3). Deliaca hodnota je kľúčová pre praktickú použiteľnosť onkomarkerov.
Záver
Výsledkom našej analýzy sú tri podskupiny pacientov s dobrou, strednou a nepriaznivou prognózou. Onkomarkery hrali významnú úlohu vo formovaní skupiny pacientov s dobrou prognózou – bez úbytku hmotnosti a nízkymi hladinami CEA a NSE. Medián prežívania bol v tejto skupine najmenej 16 mesiacov (nebol dosiahnutý) a výsledok bol vysoko štatisticky signifikantný (χ2 = 55,9, p = 7,4 × 10– 13). Prognostické skupiny sú definované kombináciou prognostických faktorov (na rozdiel od bežne používanej Coxovej regresnej analýzy). V dizajne budúcich klinických štúdií by sa prípadne mohlo uvažovať s takouto alternatívou randomizácie alebo analýzy podskupín. Napriek nesporným výhodám metódy RPA, jej výsledky by mali byť ešte potvrdené prospektívnou rozsiahlejšou štúdiou.
Poďakovanie
Ďakujeme doc. MU Dr. Michalovi Megovi, PhD., a kolektívu Onkologickej kliniky FN Trnava.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Silvia Cingelová, Ph.D.
II. onkologická klinika LF UK a NOÚ
Klenová 1
833 10 Bratislava
Slovensko
e-mail: silvia.cingelova@nou.sk
Obdrženo: 19. 3. 2014
Přijato: 25. 9. 2014
Zdroje
1. Molina R, Filella X, Augé JM et al. Tumor markers (CEA, CA 125, CYFRA 21-1, SCC and NSE) in patients with non-small cell lung cancer as an aid in histological diagnosis and prognosis. Comparison with the main clinical and pathological prognostic factors. Tumour Biol 2003; 24(4): 209 – 218.
2. Pujol JL, Boher JM, Grenier J et al. Cyfra 21 - 1, neuron specific enolase and prognosis of non-small cell lung cancer: prospective study in 621 patients. Lung Cancer 2001; 31(2 – 3): 221 – 231.
3. van Zandwijk N, Mooi WJ, Rodenhuis S. Prognostic factors in NSCLC. Recent experiences. Lung Cancer 1995; 12 (Suppl 1): S27 – S33.
4. Kulpa J, Wójcik E, Reinfuss M et al. Carcinoembryonic antigen, squamous cell carcinoma antigen, CYFRA 21 - 1, and neuron-specific enolase in squamous cell lung cancer patients. Clin Chem 2002; 48(11): 1931 – 1937.
5. Ferrigno D, Buccheri G, Giordano C. Neuron-specific enolase is an effective tumour marker in non-small cell lung cancer (NSCLC). Lung Cancer 2003; 41(3): 311 – 320.
6. Pujol JL, Molinier O, Ebert W et al. CYFRA 21 - 1 is a prognostic determinant in non-small-cell lung cancer: results of a meta-analysis in 2063 patients. Br J Cancer 2004; 90(11): 2097 – 2105.
7. Barlési F, Gimenez C, Torre JP et al. Prognostic value of combination of Cyfra 21-1, CEA and NSE in patients with advanced non-small cell lung cancer. Respir Med 2004; 98(4): 357 – 362.
8. Maeda T, Ueoka H, Tabata M et al. Prognostic factors in advanced non-small cell lung cancer: elevated serum levels of neuron specific enolase indicate poor prognosis. Jpn J Clin Oncol 2000; 30(12): 534 – 541.
9. Ciampi A, Hogg SA, McKinney S et al. A computer program for recursive partition and amalgamation for censored survival data. Comput Methods Programs Biomed 1988; 26(3): 239 – 256.
10. LeBlanc M, Crowley J. Relative risk trees for censored survival data. Biometrics 1992; 48(2): 411 – 425.
11. Terek M, Horníková A, Labudová V. Hĺbková analýza údajov. Bratislava: Iura Edition 2010 : 265.
12. Ciampi A, Lawless JF, McKinney SM et al. Regression and recursive partition strategies in the analysis of medical survival data. J Clin Epidemiol 1988; 41(8): 737 – 748.
13. Goldstraw P. IASLC Staging Manual in Thoracic oncology. USA: IASLC publication, Editorial ExPress 2009 : 157.
14. Oken MM, Creech RH, Tormey DC et al. Toxicity and response criteria of the eastern cooperative oncology group. Am J Clin Oncol 1982; 5(6): 649 – 655.
15. Jacot W, Colinet B, Bertrand D et al. Quality of life and comorbidity score as prognostic determinants in NSCLC patients. Ann Oncol 2008; 19(8): 1458 – 1464.
16. Zhang HP, Singer B. Recursive partitioning in the health sciences. New York: Springer 1999 : 223.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek EditorialČlánek Soutěž o nejlepší práciČlánek Prof. Žaloudík šedesátiletýČlánek Aktuality z odborného tisku
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2014 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Editorial
- Soutěž o nejlepší práci
- Pomalidomid v liečbe relabujúceho a refraktérneho mnohopočetného myelómu
- Cereblon – nový terapeutický cieľ v liečbe mnohopočetného myelómu
- Role mikroRNA v patofyziologii neuroblastomu a možnosti jejich využití pro diagnostiku, odhad prognózy a terapii
- Úloha CDK12 v iniciaci a rozvoji nádorů a její klinické konsekvence
- Informace z České onkologické společnosti
- Prognostické markery pokročilého nemalobunkového karcinómu pľúc – hodnotenie významu onkomarkerov pomocou data-miningovej metódy RPA
- Spokojenost onkologických pacientek s okamžitou dvoudobou aloplastickou rekonstrukcí prsu
- Soutěž na podporu autorských týmů publikujících v zahraničních odborných titulech
- Vliv předoperační chemoradioterapie na změnu exprese receptoru pro epidermální růstový faktor u pacientů léčených předoperační chemoradioterapií pro lokálně pokročilý karcinom rekta
- Neobvyklá nádorová infiltrace ušního lalůčku
- Těm, které by to mohlo zajímat – fotodiagnostika a fotodynamická léčba
- Aktuality z odborného tisku
- Prof. Žaloudík šedesátiletý
- Karcinomová lymfangiopatie při pokročilém karcinomu prsu
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Karcinomová lymfangiopatie při pokročilém karcinomu prsu
- Prognostické markery pokročilého nemalobunkového karcinómu pľúc – hodnotenie významu onkomarkerov pomocou data-miningovej metódy RPA
- Spokojenost onkologických pacientek s okamžitou dvoudobou aloplastickou rekonstrukcí prsu
- Cereblon – nový terapeutický cieľ v liečbe mnohopočetného myelómu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



