-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
„Techneciová krize“ – příčiny, možná řešení a dopad na diagnostiku planární scintigrafií a SPECT
„Technetium Crisis“ – Causes, Possible Solutions and Consequences for Planar Scintigraphy and SPECT Diagnostics
Nuclear medicine is an important field of nuclear medicine, especially thanks to its role in in vivo imaging of important processes in human organism. An overwhelming majority of nuclear medicine examinations comprises of planar scintigraphy and single photon emission computed tomography, for decades relying on the labeling by metastable technetium nuclide (99mTc), used with a great diversity of ligands for various applications. Nuclear medicine departments utilize commercially available molybdenum ‑ technetium generators, being able to elute the nuclide at any time and prepare the radiopharmaceutical. The mother nuclide, molybdenum-99 (99Mo), is produced in just a handful of places around the world. The production places are without exception research nuclear reactors working far past their life expectancy. A concurrent temporary shutdown of two of them in the year 2009 caused a critical worldwide shortage of 99mTc. An unavoidable permanent shutdown of part of these capacities in the second decade of the 21st century will cause the second, and this time rather permanent ”technetium crisis”. The article focuses on history, present, potential future and possible solutions in regard to SPECT diagnostics.
Key words:
nuclear medicine – tomography, emission-computed, single-photon – radiopharmaceuticals – technetium – technetium crisis
This work was supported by the European Regional Development Fund and the State Budget of the Czech Republic (RECAMO, CZ.1.05/2.1.00/03.0101) and by MH CZ – DRO (MMCI, 00209805).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
11. 1. 2014Accepted:
3. 4. 2014
Autoři: Ing. Jan Adam 1,2; J. Kadeřávek 2; F. Kužel 2; J. Vašina 3; Z. Řehák 1,3
Působiště autorů: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno 1; ÚJV Řež, a. s., Husinec‑ Řež, Česká republika 2; Oddělení nukleární medicíny, Masarykův onkologický ústav, Brno 3
Vyšlo v časopise: Klin Onkol 2014; 27(Supplementum): 137-142
Souhrn
Nukleární medicína je důležitý obor moderní medicíny, zejména díky své roli v in vivo zobrazování důležitých dějů a procesů v lidském organizmu. Drtivou většinu vyšetření nukleární medicíny tvoří planární scintigrafie a jednofotonová emisní tomografie (SPECT), jejímž základem je již několik desítek let značení nuklidem metastabilního technecia (99mTc), využívaným v kombinaci s nespočtem ligandů pro různé účely. Oddělení nukleární medicíny pracují s komerčně dostupnými molybdeno‑techneciovými generátory, ze kterých je možno dle potřeby eluovat nuklid a připravit radiofarmakum. Matečný nuklid, molybden-99 (99Mo), je připravován na pouhých několika místech na světě. Produkční místa jsou ovšem vesměs přestárlé výzkumné reaktory a souběžný výpadek dvou z nich v roce 2009 způsobil kritický celosvětový nedostatek 99mTc. Neodvratné uzavření části produkčních kapacit v druhé dekádě 21. století bude znamenat druhou a tentokrát trvalou „techneciovou krizi“. V článku informujeme o historii, současnosti, potenciální budoucnosti a možných řešeních situace s ohledem na diagnostiku SPECT.
Klíčová slova:
nukleární lékařství – tomografie emisní, počítačová, jednofotonová – radiofarmaka – technecium – techneciová krizeÚvod
Technecium bylo objeveno v roce 1937 jako vůbec první uměle připravený prvek, odtud i jeho název. Stalo se tak na Kalifornské univerzitě v Berkeley. Již o rok později pak Emilio Segré a Glenn T. Seaborg připravili izotop metastabilního technecia-99m prostřednictvím bombardování přírodního molybdenu deuteronovým paprskem [1]. O tři roky později popsal Emilio Segré společně s Chien ‑ Shiung Wuem analýzu štěpných produktů uranu-235, které obsahovaly molybden-99 (99Mo) [2]. I zde objevili přítomnost prvku s protonovým číslem 43 s 6hodinovým poločasem rozpadu. Tomuto izotopu se následně dostalo označení technecium-99m (99mTc).
Izotop 99mTc přesto zůstával vědeckou kuriozitou až do 50. let minulého století, kdy začal být poprvé rozeznáván jeho potenciál pro medicínu. Vědci z Brookhavenské národní laboratoře, kteří pracovali na projektu optimalizace eluce a purifikace jodu-132 z matečného teluru-132 připravovaného na místním reaktoru objevili ve svém materiálu stopové množství kontaminantu, jenž se ukázal být právě 99mTc pocházející z přítomného 99Mo. Jelikož chemie molybden ‑ techneciového páru byla velmi podobná zkoumanému teluro‑jodovému, byl v roce 1958 na základě těchto znalostí zkonstruován první „techneciový generátor“ [3]. V 60. letech začala myšlenka využití technecia pro medicínské účely získávat stále více příznivců.
První studie v USA byla zveřejněna v roce 1963 [4]. Injektovaný 99Mo se koncentroval v játrech, kde vytvořil v podstatě interní generátor. Játra bylo možno vizualizovat pomocí gama skeneru. V následujících třech letech demonstrovaly užitečnost 99mTc coby diagnostického nástroje či radiotraceru početné další studie [5 – 10]. Společně s rapidním rozvojem planárních gamakamer a prvních SPECT gamakamer tak byl položen základní kámen nukleární medicíny – oboru, který zejména v diagnostické aplikaci čekal v budoucnu strmý růst. Technecium se stalo nepostradatelným radiofarmakem pro 2D scintigrafii a později i pro SPECT – jednofotonovou emisní tomografii, zvláště kombinovanou s výpočetní tomografií. V kombinaci s různě zvolenými ligandy ‑ nosiči dokázalo technecium vizualizovat velké spektrum dějů a orgánů. Nejdůležitější aplikace 99mTc v nukleární medicíně shrnuje tab. 1.
Tab. 1. Příklady využívaných SPECT radiofarmak na bázi <sup>99m</sup>Tc. 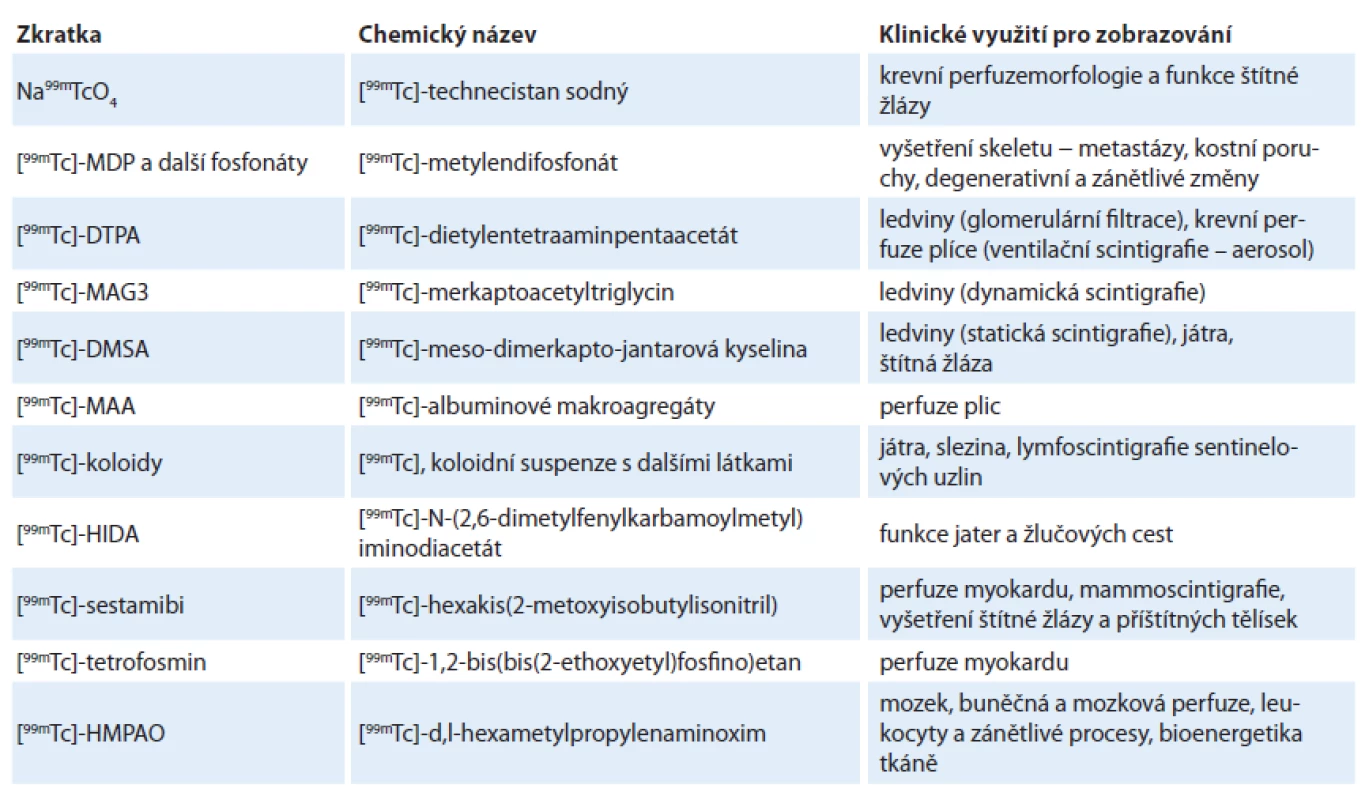
Technecium mělo všechny vlastnosti, které si lékař mohl přát. V reaktoru byl neutrony ostřelován uranový terč za produkce velkého počtu dceřiných izotopů včetně 6% 99Mo. Jeho poločas rozpadu, 66 hodin, stačil právě tak na jeho extrakci z reaktoru, separaci od zbytku izotopů a uzavření do generátorů, jež byly rozváženy do nemocnic po celém světě. Jak se molybden postupně rozkládal, produkoval stabilní zásobu 99mTc, která se dala z generátoru kdykoli eluovat či – jak se v medicínské obci ustálilo říkat – generátor „podojit“. Díky vynikajícím komplexotvorným vlastnostem technecia pak bylo možno s eluovaným roztokem technecistanu připravovat radiofarmaka na místě, většinou s použitím lyofilizovaných, práškových kitů obsahujících příslušné ligandy plus pomocné látky [11,12]. Generátory byly snadno dostupné, technecium, vztaženo na jednotku aktivity, výrazně levnější než jiná radiofarmaka a zobrazovací instrumentace, scintigrafy nebo SPECT či SPECT/ CT skenery taktéž levnější než např. PET alternativa. Mnoho diagnostických metod bylo nahrazeno techneciovými skeny a lékaři po celém světě si nedokázali představit provoz bez tohoto izotopu. Pak udeřila první techneciová krize.
První techneciová krize
V roce 2009 čítal celkový počet vyšetření na světě provedených s pomocí 99mTc zhruba 30 milionů, přičemž jen USA se na tomto výsledku podílely cca 20 miliony vyšetřeními. Není se proto čemu divit, že situace, kdy prakticky „přes noc“ došlo k poklesu objemu dodávek generátorového materiálu o 30 – 70 % (v závislosti na místě a času), zasáhla medicínskou scénu velice tvrdě [13,14]. Jak k takové situaci mohlo dojít? Důvod je prostý. Z přibližně 250 výzkumných reaktorů fungujících po celém světě bylo schopno radionuklidy produkovat v průmyslovém měřítku pouze pět – reaktor National Research Universal (NRU) v Chalk River, Kanada, High Flux Reactor (HFR) v Pettenu, Nizozemí, SAFARI ‑ 1 v Pelindabě, Jižní Afrika, BR2 v Mol, Belgie a OSIRIS v Saclay, Francie. Zpracování ozářeného materiálu bylo prováděno v pouhých čtyřech centrech (Belgie, Kanada, Nizozemí a Jižní Afrika).
Všechny zmíněné reaktory měly mnohé společného. 99Mo zde byl vyráběn ozařováním terčů z obohaceného uranu. Vesměs se jednalo o výzkumné reaktory, které byly v provozu více než 40 let. S tím se pojila nutnost pravidelných odstávek k údržbě, jež musely být mezi jednotlivými reaktory precizně synchronizovány. V půli roku 2008 došlo k plánované odstávce reaktoru HFR v Pettenu, v této době zastávajícího přibližně 33 % světové produkce. Následovaly plánované odstávky reaktorů NRU, BR2 a OSIRIS. Díky objevené korozi a netěsnostem nebyl reaktor HFR znovu včas spuštěn. V jednu chvíli tak fungoval jediný produkční reaktor na celé planetě – jihoafrické SAFARI ‑ 1. Nezávisle na tom muselo být kvůli úniku radioaktivního jodu uzavřeno belgické zpracovatelské centrum IRE. Reaktor HFR byl uveden znovu do provozu v únoru 2009, vzápětí ovšem vysadil kanadský reaktor NRU zajišťující 40 % světové produkce, a ačkoliv byl poměrně rychle uveden do provozu, únik těžké vody si vyžádal další odstavení v květnu 2009 trvající 15 měsíců. Opravy HFR způsobily další měsíc odstávky v roce 2009 a šest jiných v roce 2010 [15]. V krizové situaci bylo nutno prověřit možnosti ostatních reaktorů a nasadit alternativní logistické řetězce – zapojily se např. OPAL v Austrálii, FRM ‑ II v Německu, MARIA v Polsku či reaktor LVR ‑ 15 v Řeži u Prahy (s nutností transportu materiálu ke zpracování do Nizozemí anebo Belgie). Až do restartování obou reaktorů v srpnu, resp. září 2010 se tak celý svět musel ve značné míře obejít bez dostatečného množství 99mTc. Díky této krizi muselo být statisícům pacientů odepřeno vyšetření pomocí tohoto radioizotopu. Některá z vyšetření mohla být nahrazena alternativními metodami, např. PET, avšak za mnohem vyšší cenu, jiná za cenu použití méně etablovaných radioizotopů. Většina vyšetření však musela být odložena či zrušena a není vyloučeno, že pro některé pacienty mohlo být takové zdržení klíčové až fatální. Dle tehdejších slov amerických odborníků se „nukleární diagnostika v USA propadla prakticky zpět do 60. let minulého století“.
Poučení z krize
Na sklonku roku 2010 byla tedy první techneciová krize zažehnána. Zůstalo po ní ale mnoho otázek, z nichž primární je – bude se krize opakovat? Odpověď je jasná. Velmi pravděpodobně, a to brzy. Hlavní důvody jsou následující:
1. Zastaralost produkčních reaktorů
Jak již bylo uvedeno, hlavní pětice reaktorů výrazně přesluhuje. Reaktor NRU v Chalk River, Ontario, Kanada, je v roce 2013 v provozu již 56 let, HFR v Pettenu 52 let, francouzský OSIRIS v Saclay 47 let. Chvíle, kdy nebude dále možno tyto reaktory udržovat v provozu, se nezadržitelně blíží. Plánované uzavření NRU se mělo odehrát v roce 2005 a pouze díky intervenci kanadské vlády, která přehlasovala doporučení bezpečnostních inspektorů, se tak nestalo. Jak HFR, tak OSIRIS by měly být definitivně uzavřeny v letech 2014 – 2016. Kanadská vláda nicméně oznámila plán na definitivní uzavření reaktoru NRU v říjnu 2016.
2. Ekonomická neudržitelnost spolehlivosti dodávek
Produkční reaktory vesměs sloužily ke státem plně financovanému výzkumu. 99Mo byl vedlejším produktem normální činnosti reaktoru, nic tedy nebránilo nasazení iracionálně nízké ceny pokrývající prakticky jen cenu ozářeného materiálu, která nereflektovala ani pozdější nárůst významu produkovaného materiálu. Stát se tak ocitl na počátku i konci logistického řetězce (produkce 99Mo a vyšetření 99mTc) s odpovídající motivací udržet ceny v celém řetězci nereálně nízko. Tyto praktiky ve svém důsledku nejen nepokryly cenu provozování a údržby reaktoru, ale též účinně bránily budování nových infrastruktur – uměle nízká cena již v základu odradila jakékoli komerční subjekty od snah budovat a provozovat alternativní zdroje.
3. Nucený přechod na nízkoobohacené uranové terče
Veškerá zatím zmíněná produkce 99Mo využívala původní technologie vyvinuté v 60. letech 20. století – tedy ozařování vysokoobohacených uranových terčů (obsahujících více než 20 % uranu-235 – přírodní uran obsahuje méně než 1 %). Nicméně vysokoobohacený uran (HEU) je materiál pro výrobu jaderných zbraní. USA, jediný dodavatel HEU produkčním reaktorům, v současnosti zastavuje veškerý export HEU s plánem totálního zrušení v roce 2020, a to jako součást strategie boje proti nukleárnímu zbrojení [16]. Belgie, Nizozemí a Francie se k této iniciativě připojily také a souhlasily s přechodem na nízkoobohacené uranové terče do konce roku 2015. Co to bude znamenat pro produkci? Nižší výtěžky 99Mo, vyšší množství odpadu – oba faktory přispějí k dalšímu navýšení ceny 99Mo [17]. Situaci lze tedy shrnout následovně – cena 99Mo/ 99mTc je iracionálně nízká, logistické řetězce křehké, produkční kapacity nedostatečné a zastaralé – situace neudržitelná, a to již v krátkodobém horizontu.
Možnosti řešení
Existuje v této situaci řešení? Na to se v uplynulých letech snažilo najít odpověď mnoho lékařů, specialistů či odborných komisí včetně IAEA (International Atomic Energy Association – Mezinárodní agentura pro atomovou energii) nebo OECD (Organisation for Economic Co ‑ operation and Development – Organizace pro hospodářskou spolupráci a rozvoj). Odpověď na tuto otázku? Ano, ale v žádném případě ne takové, které navrátí vše do situace před rokem 2008.
1. Vybudování nových reaktorů či upgrade stávajících
Do této kategorie spadají snahy udržet současné reaktory ještě nějakou dobu v chodu či vybudovat jim adekvátní náhrady. První projekt tohoto typu byl kanadský Multipurpose Applied Physics Lattice Experiment (MAPLE), dva reaktory dedikované přímo výrobě izotopů, přičemž každý ze dvou plánovaných měl zajistit produkci odpovídající 100 % světové potřeby 99Mo. Reaktory MAPLE Ia MAPLE II byly vybudovány v Chalk River (lokace NRU) v roce 2000, nicméně v průběhu jejich testování vyšla na povrch zásadní designová pochybení vedoucí k závažným bezpečnostním nedostatkům, které modelové studie neodhalily. Nejvýraznějším problémem byl pozitivní koeficient reaktivity, potenciálně hrozící nekontrolovatelným rozvojem řetězové reakce, jehož možný extrémní důsledek ilustrovala exploze černobylského reaktoru. To v konečném důsledku vedlo v roce 2008 k ukončení celého projektu MAPLE za cenu obrovských finančních ztrát, aniž by reaktory byly uvedeny do ostrého provozu [18]. Nespuštění reaktorů MAPLE nicméně vedlo k předběžným studiím budoucnosti molybden ‑ techneciové produkce bez těchto reaktorů, které se ukázaly být velmi užitečné již necelý rok poté. Kanada tímto ztratila možnost nahradit zavírající NRU. V Evropě měly podobné záložní projekty více štěstí. Francouzský OSIRIS (plánované ukončení provozu 2016) by měl plně nahradit právě dokončovaný Jules Horowitz reaktor s plánovaným uvedením do provozu roku 2019. Nizozemí plánuje do roku 2024 uvést do chodu reaktor PALLAS jako náhradu za HFR. Belgický reaktor BR2 bude upgradován tak, aby byl schopen fungovat až do roku 2026. Vesměs ale půjde o přechod na nízkoobohacené uranové terče se všemi z toho vyplývajícími důsledky.
2. Rozšíření sítě s využitím stávajících nízkokapacitních reaktorů
Některé z reaktorů, které byly zapojeny do výroby 99Mo v době první techneciové krize, byly nyní zařazeny natrvalo do výrobní a distribuční sítě. V současnosti sdružuje Pracovní skupina reaktorů a izotopů asociace AIPES (Association of Imaging Producers and Equipment Suppliers – Asociace výrobců a dodavatelů vybavení pro zobrazování) celkem 10 reaktorů – mimo již zmíněných pěti dále polský reaktor MARIA, český LVR ‑ 15, argentinský RA ‑ 3 a australský OPAL využívající již nyní nízkoobohacené uranové terče a německý FRM ‑ II, který ovšem v současnosti neozařuje terče pro 99Mo. Potenciální roční produkce těchto reaktorů (bez FRM ‑ II) přibližně odpovídá ročnímu objemu produkce reaktoru HFR.
3. Alternativní způsoby výroby 99Mo
Další cestou je výroba matečného generátorového nuklidu (99Mo) jiným způsobem než bombardováním uranových (nízko ‑ či vysokoobohacených) terčů. Spojené státy, které, ačkoli jsou největším odběratelem 99Mo, nedisponují od uzavření reaktoru Cintichem v roce 1989 vlastním zdrojem tohoto izotopu, podporují projekty nevyužívající vysokoobohacený uran. GE Hitachi a Babcock & Wilcox, dvě největší společnosti, své plány zrušily z důvodu nerentability při současném stavu trhu. Další společnosti zahájily výzkum zcela nových metod produkce. Společnost NorthStar plánuje jednak od roku 2014 ozařovat přírodní molybden neutrony a konvertovat 98Mo na 99Mo na výzkumném reaktoru Univerzity v Missouri, jednak produkovat 99Mo gama‑ozařováním 100Mo s cílem pokrýt 10 – 50 % potřeby 99Mo v USA. Zároveň probíhají jednání o možné recyklaci 99Mo z použitých generátorů. V neposlední řadě jsou prověřovány možnosti produkce 99Mo na vysokoenergetických cyklotronech [19 – 21].
Kanada se především snaží pokrýt vlastní potřeby. Jednadvacet milionů kanadských dolarů bylo vládou uvolněno na tři projekty, které by mohly nahradit NRU. Prairie Isotope Production Enterprise využívá technologie lineárních urychlovačů elektronů z přírodního molybdenu. Univerzita v Albertě a projekt TRIUMF ve Vancouveru spoléhají zase na cyklotronové technologie – nicméně nikoli k produkci 99Mo, ale přímo 99mTc.
4. Alternativní způsoby výroby 99mTc
Kanadský program TRIUMF patří mezi průkopníky přímé výroby 99mTc ostřelováním molybdenových terčů na cyklotronech. Ačkoliv optimální energie se zdá být vyšší než 18 MeV, tj. standardní maximální energie klasických cyklotronů používaných pro produkci PET radiofarmak, i tyto cyklotrony jsou schopny produkovat technecium v dostatečné míře pro uspokojení potřeb nemocnic [22 – 25]. Nutnou podmínkou bude ovšem dostatečně hustá síť cyklotronů (pro Kanadu přibližně 24 cyklotronů). Jelikož kanadský model plánu nahrazení centralizované výroby 99Mo decentralizovanou přímou výrobou technecia eliminuje závislost na reaktorech, jsou možnosti přímé cyklotronové výroby technecia prověřovány jinde na světě včetně Ústavu jaderné fyziky Akademie věd ČR či ÚJV, a. s. v Řeži [26 – 28]. Tento způsob nicméně bude vyžadovat jistý kompromis ze strany lékařských zařízení – 99mTc by bylo dodáváno namísto trvanlivějších a dle libosti kdykoli „podojitelných“ generátorů přímo ve formě roztoku technecistanu, podobně jako např. nyní fluordeoxyglukóza pro PET, což s sebou ponese náročnější proces časového plánování vyšetření – v ideálním případě by mělo docházet ke koordinaci objednávek mezi nemocnicemi. V neposlední řadě bude cena takto vyrobeného technecia samozřejmě vyšší než doposud. Alternativní způsoby výroby 99Mo i 99mTc budou nicméně muset zdolat další překážku, tentokrát administrativní – bude si vyžadovat nové schválení, rozšíření či doplnění u příslušných státních kontrolních úřadů.
5. Nahrazení vyšetření 99mTc jiným vyšetřením
V době první techneciové krize bylo mnoho lékařských institucí nuceno přistoupit k alternativním způsobům vyšetření, ne vždy je však bylo možné provádět na SPECT gamakamerách. Jednou z výjimek bylo kardiologické vyšetření – detekce ischemie pomocí [99mTc] - sestamibi. Zde bylo v době krize „znovuobjeveno“ thallium-201 využívané do pozdních 80. let 20. století [29 – 31]. Vrátily se ovšem i nevýhody, kvůli kterým bylo thallium opuštěno ve prospěch technecia – nižší energie emitovaných fotonů a delší poločas rozpadu, vedoucí k vyšší radiační zátěži pacienta a v některých případech, zejména u obézních pacientů, k méně ostrým obrazům. Obrodu zažila také některá z PET radiofarmak, která nebyla díky vyšší ceně výroby i instrumentace schopná konkurovat techneciu – jednalo se zejména o [18F] - fluoridsodný pro kostní skeny, pole drtivě ovládané [99mTc] - medronátem (MDP), viz obr. 1 [32,33] či jisté zvýšení využití [18F] - FDG PET pro viabilitu myokardu. Tato alternativa byla nicméně využitelná pouze pro pracoviště vybavená PET a PET/ CT skenery, jejichž pořizovací i provozní cena je výrazně vyšší a jejich četnost logicky výrazně nižší. Nicméně je záhodno na tomto místě konstatovat, že za jistý pozitivní přínos první techneciové krize lze považovat výraznou optimalizaci a zefektivnění některých 99mTc diagnostických protokolů vynucené drasticky omezenou dostupností izotopu v době krize.
Obr. 1. Příklad porovnání [<sup>99m</sup>Tc]-MDP scintigrafie (dvojice vlevo, přední a zadní projekce) a [<sup>18</sup>F]-NaF PET (vpravo, 3D sumovaný obraz, tzv. MIP) u téhož pacienta. Obě vyšetření jsou provedena zhruba ve stejném období, PET vykazuje vyšší senzitivitu (detekuje více ložisek), ale nižší specifitu (některá z ložisek nemusejí souviset s onkologickým postižením, může jít o příčinu jinou). Navíc je patrný i vyšší (lepší) kontrast v PET obrazu, menší aktivita v tělovém pozadí (background). ![Příklad porovnání [<sup>99m</sup>Tc]-MDP scintigrafie (dvojice vlevo, přední a zadní projekce) a [<sup>18</sup>F]-NaF PET (vpravo, 3D sumovaný obraz, tzv. MIP) u téhož pacienta. Obě vyšetření jsou provedena zhruba ve stejném období, PET vykazuje vyšší senzitivitu (detekuje více ložisek), ale nižší specifitu (některá z ložisek nemusejí souviset s onkologickým postižením, může jít o příčinu jinou). Navíc je patrný i vyšší (lepší) kontrast v PET obrazu, menší aktivita v tělovém pozadí (background).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/e9ab586f3dd5bc13858af1bc29d9e764.jpg)
Závěr
Od první techneciové krize uplynulo pět let. V jejich průběhu jasně vykrystalizovala fakta o situaci a budoucnosti ohledně využití tohoto, pro nukleární medicínu prakticky nepostradatelného, izotopu.
Následujících cca pět let bude poměrně kritických díky nevyhnutelnému uzavření reaktorů HFR a NRU. Zvýšeným zapojením volných kapacit menších reaktorů nebude dopad uzavření natolik tvrdý, nicméně i zde dojde k přechodnému snížení dodávek. Přibližně po pěti letech lze očekávat spuštění nových reaktorových kapacit ve Francii a Nizozemí.
Za účelem zajištění udržitelnosti a spolehlivosti produkčního a zpracovatelského řetězce bude nutno zásadním způsobem revidovat dlouholetou cenovou politiku spojenou s 99Mo, která efektivně bránila včasné přípravě na takovou krizi ve smyslu budování alternativních zdrojů či náhradních kapacit. Nová cena bude muset odpovídajícím způsobem zohledňovat celý zpracovatelský řetězec, bude muset být akceptována státními autoritami, plátci zdravotní péče, nemocnicemi a zohledněna při plánování lékařské péče.
Alternativní produkce 99Mo je možná stejně jako přímá produkce 99mTc. V obou případech s sebou opět přinese zvýšení ceny vyšetření využívajících 99mTc (planární scintigrafie či SPECT), v případě přímé výroby technecia pak přizpůsobení se nemocnic jiné formě dodávek materiálu a event. součinnost mezi nemocnicemi při plánování objednávek a vyšetření.
Lze očekávat, podobně jako za první techneciové krize, přesun části vyšetření k jiným metodám, nukleární magnetické rezonanci nebo pozitronové emisní tomografii. Zde bude výrazně záviset na stupni rozvoje dané metody v dané oblasti a možnostech zásobování PET radiofarmaky. Za exemplární příklad může posloužit zvýšený zájem o 18F ‑ fluorid sodný v době první krize jako náhradu za [99mTc] - MDP skeny.
SPECT byl doposud velmi levnou metodou nukleární medicíny – pořizovací cena gamakamery se pohybovala v řádu jednotek milionů korun, u SPECT/ CT kolem 10 milionů, zatímco u PET/ CT v řádu desítek milionů. Se zvýšením ceny technecia lze očekávat, že bude muset dojít k optimalizaci v síti pokrytí gamakamerami na odděleních nukleární medicíny – některé provozy doposud tuto metodu využívající by se po změně cen mohly stát nerentabilními.
První techneciová krize ukázala světu, že i v dnešním světě je možné, že majoritní zobrazovací metoda nukleární medicíny stojí na hliněných nohách. 99mTc bude mít v novém světě stále důležité místo, i s ohledem na stávající zobrazovací infrastruktury, jejichž kompletní přebudování např. na PET by bylo ekonomicky i geograficky nereálné. Je nutné si přiznat, že toto odvětví mohlo po dlouhá léta existovat a prosperovat na základě nepřímé podpory státu zajišťující umělé – a dále neudržitelné – ekonomické podmínky. Nyní je zapotřebí tento účet splatit, ať již nemalými investicemi do záchranných programů nebo zásadní cenovou reformou. K záchraně a zajištění dalšího hladkého fungování tohoto medicínského oboru bude nicméně nutná koordinovaná snaha na všech úrovních – produkční, zpracovatelské, uživatelské i kontrolní.
Práce byla podpořena Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky (OP VaVpI – RECAMO, CZ.1.05/2.1.00/03.0101) a MZ ČR – RVO (MOÚ, 00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
Ing. et Ing. Jan Adam, Ph.D.
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: adam@mou.cz
Obdrženo: 11. 1. 2014
Přijato: 3. 4. 2014
Zdroje
1. Segrè E, Seaborg GT. Nuclear Isomerism in Element 43. Phys Rev 1938; 54(9): 772 – 772.
2. Segrè E, Wu CS. Some fission products of uranium. Phys Rev 1940; 57 : 552 – 552.
3. Richards P, Tucker WD, Srivastava SC. Technetium ‑ 99m: an historical perspective. Int J Appl Radiat Isot 1982; 33(10): 793 – 799.
4. Sorensen LB, Archambault M. Visualization of the liver by scanning with Mo99 (molybdate) as tracer. J Lab Clin Med 1963; 62 : 330 – 340.
5. Herbert R, Kulke W, Shepherd RT. The use of technetium 99m as a clinical tracer element. Postgrad Med J 1965; 41(481): 656 – 662.
6. Stang LG, Richards P. Tailoring the isotope to the need. Nucleonics 1964; 22(1): 146 – 148.
7. Harper PV, Andros G, Lathrop K. Preliminary observations on the use of six ‑ hour 99mTc as a tracer in biology and medicine. Semiannual Report of the Argonne Cancer Research Hospital 1962; 18 : 76 – 87.
8. Harper PV, Beck R, Charleston D et al. Optimization of a scanning method using Tc99m. Nucleonics 1964; 22 : 50 – 54.
9. Smith EM. Properties, uses, radiochemical purity and calibration of Tc ‑ 99m. J Nucl Med 1964; 5(11): 871 – 882.
10. Smith EM. Internal dose calculation for 99mTc. J Nucl Med 1965; 6(4): 231 – 251.
11. Eckelman WC, Coursey BM (eds). Technetium – 99m: generators, chemistry and preparation of radiopharmaceuticals. Oxford: Pergamon 1982.
12. Eckelman WC. Unparalleled contribution of technetium ‑ 99m to medicine over 5 decades. JACC Cardiovasc Imaging 2012; 2(3): 364 – 368. doi: 10.1016/ j.jcmg.2008.12.013.
13. Ruth T. Accelerating production of medical isotopes. Nature 2009; 457(7229): 536 – 537. doi: 10.1038/ 457536a.
14. Thomas GS, Maddahi J. The technetium shortage. J Nucl Cardiol 2010; 17(6): 993 – 998. doi: 10.1007/ /s12350 - 010 - 9281 - 8.
15. de Aidy EJ. The high flux reactor in petten resumes the vital roles of production of medical radioisotopes and nuclear research. Tijdschrift voor nucleaire geneeskunde 2010; 32(4): 586 – 591.
16. Hansell C. Nuclear medicine‘s double hazard: imperiled treatment and the risk ofterrorism“. The Nonproliferation Review 2008; 15(2): 185 – 208.
17. Pillai MR, Dash A, Knapp FF Jr. Sustained availability of 99mTc: possible paths forward. J Nucl Med 2013; 54(2): 313 – 323. doi: 10.2967/ jnumed.112.110338.
18. Magnus B. Over budget, overdue and, perhaps, overdesigned. CMAJ 2008; 178(7): 813 – 814. doi: 10.1503/ cmaj.080320.
19. Scholten B, Lambrecht RM, Cogneau M et al. Excitation functions for the cyclotron production of 99mTc and 99Mo. Appl Radiat Isot 1999; 51(1): 69 – 80.
20. Takács S, Szűcs Z, Tárkányi F et al. Evaluation of proton induced reactions on 100Mo: New cross sections for production of 99mTc and 99Mo. Radioanal Nucl Ch 2003; 257(1): 195 – 201.
21. Celler A, Hou X, Bénard F et al. Theoretical modeling of yields for proton‑induced reactions on natural and enriched molybdenum targets. Phys Med Biol 2011; 56(17): 5469 – 5484. doi: 10.1088/ 0031 - 9155/ 56/ 17/ 002.
22. Beaver JE, Hupf HB. „Production of 99mTc on a medical cyclotron: a feasibility study. J Nucl Med 1971; 12(11): 739 – 741.
23. Guérin B, Tremblay S, Rodrigue S et al. Cyclotron production of 99mTc: an approach to the medical isotope crisis. J Nucl Med 2010; 51(4): 13N–16N.
24. Alary B (ed.). Cyclotron facility revolutionizes medical isotope manufacturing [monograph on the Internet]. Canada: University of Alberta; 2013 [cited 2014 February]. Available from: http:/ / news.ualberta.ca/ newsarticles/ 2013/ july/ cyclotron ‑ facility ‑ revolutionizes ‑ medical ‑ isotope ‑ manufacturing.
25. Lougheed T. Cyclotron production of medical isotopes scales up. CMAJ 2013; 185(11): 947. doi: 10.1503/ cmaj.109 – 4525.
26. Lebeda O, Fikrle M. New measurement of excitation functions for (d,x) reactions on (nat)Mo with special regard to the formation of (95m)Tc, (96m+ g)Tc, (99m)Tc and (99)Mo. Appl Radiat Isot 2010; 68(12): 2425 – 2432. doi: 10.1016/ j.apradiso.2010.07.007.
27. Lebeda O, Pruszyński M. New measurement of excitation functions for (p,x) reactions on (nat)Mo with special regard to the formation of (95m)Tc, (96m+ g)Tc, (99m)Tc and (99)Mo. Appl Radiat Isot 2010; 68(12): 2355 – 2365. doi: 10.1016/ j.apradiso.2010.05.011.
28. Lebeda O, van Lier EJ, Štursa J et al. Assessment of radionuclidic impurities in cyclotron produced (99m)Tc. Nucl Med Biol 2012; 39(8): 1286 – 1291. doi: 10.1016/ j.nucmedbio.2012.06.009.
29. Marcassa C, Galli M, Temporelli PL et al. Technetium ‑ 99m sestamibi tomographic evaluation of residual ischemia after anterior myocardial infarction. J Am Coll Cardiol 1995; 25(3): 590 – 596.
30. Dilsizian V, Narula J. Seeking remedy for Molly‘s woe: time for a thallium pill? JACC Cardiovasc Imaging 2009; 2(3): 375 – 377. doi: 10.1016/ j.jcmg.2008.12.008.
31. Strauss HW, Bailey D. Resurrection of thallium ‑ 201 for myocardial perfusion imaging. JACC Cardiovasc Imaging 2009; 2(3): 283 – 285. doi: 10.1016/ j.jcmg.2009.01.002.
32. Damle NA, Bal C, Bandopadhyaya GP et al. The role of 1899mTc ‑ MDP bone scan. Jpn J Radiol 2013; 31(4): 262 – 269. doi: 10.1007/ s11604 - 013 - 0179 - 7.
33. Iagaru A, Mittra E, Dick DW et al. Prospective evaluation of (99m)Tc MDP scintigraphy, (18)F NaF PET/ CT, and (18
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2014 Číslo Supplementum- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Analýza proteinů pomocí hmotnostní spektrometrie
- p‑ SRM, SWATH a HRM – cílené proteomické přístupy na hmotnostním spektrometru TripleTOF 5600+ a jejich aplikace v onkologickém výzkumu
- Analýza fosfoproteínov a signálnych dráh kvantitatívno‑ proteomickými metódami
- Nové trendy ve studiu glykosylace proteinů u onkologických onemocnění
- Současné trendy ve využívání PET radiofarmak k onkologické diagnostice
- „Techneciová krize“ – příčiny, možná řešení a dopad na diagnostiku planární scintigrafií a SPECT
- Vitamin D jako významný steroidní hormon u karcinomu prsu
- Využití průtokové cytometrie pro analýzu mitochondriální buněčné smrti
- Soutěž o nejlepší práci
- Metody studia buněčné migrace a invazivity nádorových buněk
- Možnosti studia transendoteliální migrace in vitro
- Editorial
- Mechanizmy lékové rezistence a nádorové kmenové buňky
- Funkční testy pro detekci nádorových kmenových buněk
- Mikroprostředí nádoru – možnosti výzkumu v podmínkách in vitro
- Elektrochemická analýza nukleových kyselin, bílkovin a polysacharidů v biomedicíně
- Sekvenování nové generace a možnosti jeho využití v onkologické praxi
- Vývoj metod založených na PCR a jejich aplikace v onkologickém výzkumu a praxi
- Programovaná buněčná smrt v nádorových buňkách
- Metody pro studium protein‑proteinových a protein‑ligandových interakcí
- Detekce protein‑proteinových interakcí metodami FRET a BRET
- Detekce proteinů, proteinových interakcí a modifikací s využitím „proximity ligation assay“ in situ
- Exprese a purifikace proteinů
- Kvantitativní hmotnostní spektrometrie a její využití v onkologii
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Exprese a purifikace proteinů
- Metody studia buněčné migrace a invazivity nádorových buněk
- Sekvenování nové generace a možnosti jeho využití v onkologické praxi
- Analýza proteinů pomocí hmotnostní spektrometrie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



