-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Hodnocení klinického stadia a léčebné odpovědi u maligních lymfomů – doporučení Kooperativní lymfomové skupiny na základě revidovaných kritérií z roku 2014 (Luganská klasifikace)
Staging and Treatment Response Evaluation in Malignant Lymphomas – Czech Lymphoma Study Group Recommendations According to Criteria Revised in 2014 (Lugano Classification)
Background:
Recent advances in the use of the imaging modalities, especially PET/CT, and their utilization for determining clinical stage (CS) and assessment treatment response (TR) in malignant lymphomas, along with development of prognostic tools and new treatment modalities, formed the basis for the revised criteria for evaluating CS and TR (published as the Lugano classification, 2014).Materials and Methods:
The authors summarize the new Lugano recommendations (published in 2014) and the changes from the criteria published in 2007. Moreover, discussion of the changes places emphasis on practical use. The practicality of the Lugano classification, 2014 was the subject of consensus meeting at the annual meeting of the Cooperative Lymphoma Study Group (CLSG) in March 2015. This study reports the final consensus. The CLSG recommends use of the Lugano classification, 2014, but recommends some modifications.Conclusions:
Standardization of the criteria used to determine CS and TR in malignant lymphomas has led to improvements in initial staging and assessment of TR. The criteria are helpful for unifying response assessment in clinical trials and simplify the work of regulatory agencies (e.g., the EMA and the Czech State Institute for Drug Control) when registering new drugs. It also allows evaluation of treatment outcomes outside clinical trials, for example within the CLSG prospective registry of patients with newly diagnosed lymphoma.Key words:
malignant lymphoma – computed tomography – positron emission tomography – staging – treatment response
This work was supported by the grant Prvouk P27/2012 of the Third Faculty of Medicine, Charles University in Prague and by the grant of the Czech Lymphoma Study Group No. NT12193-5/2011.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
24. 1. 2016Accepted:
16. 2. 2016
Autoři: A. Sýkorová 1; R. Pytlík 2; H. Mociková 3; D. Belada 1; K. Benešová 2; T. Papajík 4; A. Janíková 5; D. Šálek 5; V. Procházka 4
; S. Vokurka 6; V. Campr 7; P. Klener 2; K. Kubáčková 8; M. Trněný 2
Působiště autorů: IV. interní hematologická klinika LF UK a FN Hradec Králové 1; I. interní klinika 1. LF UK a VFN v Praze 2; Interní hematologická klinika 3. LF UK a FN Královské Vinohrady, Praha 3; Hematoonkologická klinika LF UP a FN Olomouc 4; Interní hematologická a onkologická klinika LF MU a FN Brno 5; Hematologicko-onkologické oddělení, FN Plzeň 6; Ústav patologie a molekulární medicíny, 2. LF UK a FN v Motole, Praha 7; Onkologická klinika 2. LF UK a FN v Motole, Praha 8
Vyšlo v časopise: Klin Onkol 2016; 29(4): 295-302
Kategorie: Sdělení
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2016295Souhrn
Východiska:
Současné pokroky zobrazovacích metod, zejména pozitronové emisní tomografie v kombinaci s počítačovou tomografií (PET/CT) a kumulace dat o jejich využití při určování klinického stadia (KS) a hodnocení léčebné odpovědi (LO) u maligních lymfomů, inovace řady prognostických indexů a rozvoj nových léčebných modalit, byly podkladem pro vypracování revize kritérií určování KS a hodnocení LO, která byla publikována pod názvem Luganská klasifikace v roce 2014. Některá doporučení v ní obsažená jsou však stále předmětem diskuze.Metodika a výsledky:
Autoři shrnují revidovaná doporučení z roku 2014 a jejich změny oproti kritériím z roku 2007. Tato Luganská klasifikace 2014 byla podrobena diskuzi a konsenzuálnímu stanovisku k jejímu praktickému použití v březnu 2015 na výročním zasedání Kooperativní lymfomové skupiny (KLS) a předkládaná souhrnná práce je výsledkem tohoto konsenzu. KLS doporučuje její použití, nicméně v některých bodech ji pro svoji práci upravuje a modifikuje.Závěr:
Standardizace kritérií pro určování KS a LO u maligních lymfomů a její revidování na základě dostupných poznatků je důležité z pohledu nemocných, neboť umožňuje správné hodnocení rozsahu nemoci a její odpovědi. Slouží k jednotnému hodnocení výsledků klinických studií a současně zjednodušuje práci regulačním agenturám (EMA, SÚKL) v procesu registrace nových léčiv. Zároveň umožňuje i hodnocení léčebných výsledků mimo klinické studie, např. v rámci lymfomového projektu KLS – prospektivně vedené databázi nově diagnostikovaných pacientů s lymfomy.Klíčová slova:
maligní lymfom – počítačová tomografie – pozitronová emisní tomografie – určování stadia – léčebná odpověďÚvod
Prognóza nemocných s maligním lymfomem je závislá na histologickém/ molekulárně-genetickém podtypu lymfomu, prognostických faktorech a významně ji ovlivňuje kvalita dosažené léčebné odpovědi (LO). Základem je histologické stanovení subtypu lymfomu s možným zpřesněním pomocí biologických markerů. V běžné praxi však tyto markery dosud nemodifikovaly klasické klinické prognostické indexy, které jsou stále základem pro vstupní hodnocení a stratifikaci léčby [1–14]. Prognostické faktory jsou specifické pro určité typy lymfomů a většinou zahrnují klinické stadium (KS), věk, tělesnou kondici (performance status – PS) a hodnotu laktátdehydrogenázy (LDH). V jednotlivých indexech jsou dále užívány hodnoty beta-2 mikroglobulinu, počet leukocytů a lymfocytů, hodnota hemoglobinu či přítomnost masivního „bulky“ postižení. Použitím těchto indexů je možno odhadnout pravděpodobnost dosažení kompletní remise a pravděpodobnost přežití pacientů s lymfomy [1–4,14]. Důležitým rizikovým faktorem ve většině prognostických indexů je rozsah onemocnění. Jeho redukce je pak základem pro hodnocení LO. Vstupně je rozsah onemocnění lymfomu určován podle stážovacího systému – modifikované Ann Arbor (AA) klasifikace [15 – 18]. Původní AA klasifikace byla vytvořena pouze pro Hodgkinův lymfom (HL) [19–22]. V současné době slouží tato klasifikace po četných modifikacích pro vstupní určování rozsahu HL i non-Hodgkinova lymfomu (NHL) [15–18]. Stanovení rozsahu onemocnění před léčbou je základem pro hodnocení LO, které prodělalo řadu změn a stále se vyvíjí. V roce 1999 Mezinárodní pracovní skupina (International Working Group – IWG) publikovala první doporučené postupy [17]. S ohledem na vývoj nových citlivých zobrazovacích vyšetřovacích metod, jako je PET/CT (kombinace pozitivní emisní tomografie – PET a počítačové tomografie – CT), které nahradilo u 18F-fluorodeoxyglukózy (18F-FDG) avidních lymfomů samostatné CT vyšetření, byla nutná revize kritérií v roce 2007 [23,24]. Vzhledem k širokému použití PET/ CT u lymfomů došlo publikací v roce 2014 k další revizi kritérií a PET/CT vyšetření je v současnosti standardní vyšetřovací metodou pro všechny 18F-FDG avidní lymfomy [18,25]. V souhrnném přehledu se snažíme přiblížit v roce 2014 publikovaná revidovaná kritéria pro vstupní hodnocení a pro hodnocení LO u maligních lymfomů, tzv. Luganskou klasifikaci 2014. Tato klasifikace byla podrobena diskuzi a konsenzuálnímu stanovisku k jejímu praktickému použití v březnu 2015 na výročním zasedání Kooperativní lymfomové skupiny (KLS) a předkládaná souhrnná práce je výsledkem tohoto konsenzu.
Diagnóza
Základem pro stanovení diagnózy zůstává hematopatologické vyšetření. K určení subtypu NHL přispívají imunofenotypizační, imunohistochemické, cytogenetické a molekulárně-genetické metody [26,27]. Využití tzv. profilu genové exprese (gene expression profiling – GEP) k přesnější diagnostice podtypů difuzního velkobuněčného B lymfomu (diffuse large B-cell lymphoma – DLBCL) je zatím nedostupné pro běžnou klinickou praxi a používá se pouze v rámci klinických studií [28].
Určování rozsahu onemocnění
K určování rozsahu onemocnění se používá fyzikální vyšetření společně se zobrazovacími metodami. Fyzikální vyšetření slouží pro orientační určení rozsahu postižení, zobrazovací vyšetření je podkladem pro určení KS onemocnění [22,23,29,30]. Dominantní postavení má PET/ CT vyšetření, které nahradilo samostatné CT vyšetření, a to nejen u DLBCL a HL, ale i u řady dalších lymfomů (zejména folikulárního lymfomu – FL, lymfomu z plášťových buněk (mantle-cell lymphoma – MCL)) [31–33]. Na podkladě rozsahu onemocnění určeného zobrazovacími metodami se určuje KS dle modifikované AA klasifikace. V Luganské klasifikaci z roku 2014 je představena nová modifikace AA klasifikace, kdy KS I a II je lokalizovaným, KS III a IV pokročilým onemocněním a navíc je zvlášť vyčleněno KS II s přítomností masivního postižení (tzv. KS II s „bulky“ postižením). Toto „intermediární“ KS však nemá jednotný význam. Neexistuje jednotná definice pro „bulky“ postižení a i terapeutický přístup může podle typu lymfomu a dalších prognostických kritérií kolísat. Dle Německé studijní skupiny pro HL bylo za negativní prognostický faktor u HL považováno tzv. masivní mediastinální postižení, které mělo velikost > 1/3 maximálního rozměru hrudníku. Dle nynější klasifikace se za rizikový faktor považuje u HL tumorózní masa > 10 cm, a to v jakékoliv lokalizaci [18]. V rámci českých pracovišť se pro definici „bulky“ postižení u NHL nejčastěji používá hranice 7,5 cm (je možné použít i hranici 5 nebo 10 cm).
Určování extranodálního postižení
Revize kritérií z roku 2014 nepřispěla k určování rozsahu onemocnění s extralymfatickým postižením. Proto KLS doporučuje řídit se konsenzem z roku 2010, kdy extranodální orgány jsou z praktického hlediska rozděleny na tzv. malé a velké, pro které byl zvolen odlišný přístup k určování rozsahu onemocnění z důvodu rozdílného klinického dopadu při jejich postižení [34]. Tabulka 1 ukazuje revidovanou AA klasifikaci z roku 2014 pro primárně nodální lymfomy. Tabulka je modifikována na základě doporučení KLS pro určování rozsahu onemocnění s ohledem na extralymfatické postižení [16,18,34]. Tabulka 2 ukazuje znázornění postižení „velkých“ a „malých“ orgánů.
Tab. 1. Revidovaná Ann Arbor (AA) klasifikace dle IWG z roku 2014 a doplněná, resp. modifikovaná klasifikace dle Kooperativní lymfomové skupiny (KLS) (toto označené kurzívou). 
„velké“ extralymfatické orgány – játra, plíce, mezotel (pleura, pobřišnice, perikard), kostra, měkké tkáně, gastrointestinální trakt, „malé“ extralymfatické orgány – jiné než „velké“ orgány, E – extranodální postižení, LU – lymfatické uzliny, S – postižení sleziny, KS – klinické stadium Tab. 2. Dohoda Kooperativní lymfomové skupiny (KLS) pro určování klinického stadia u NHL s extralymfatickým šířením dle Ann Arbor (AA) klasifikace a modifikované AA klasifikace. 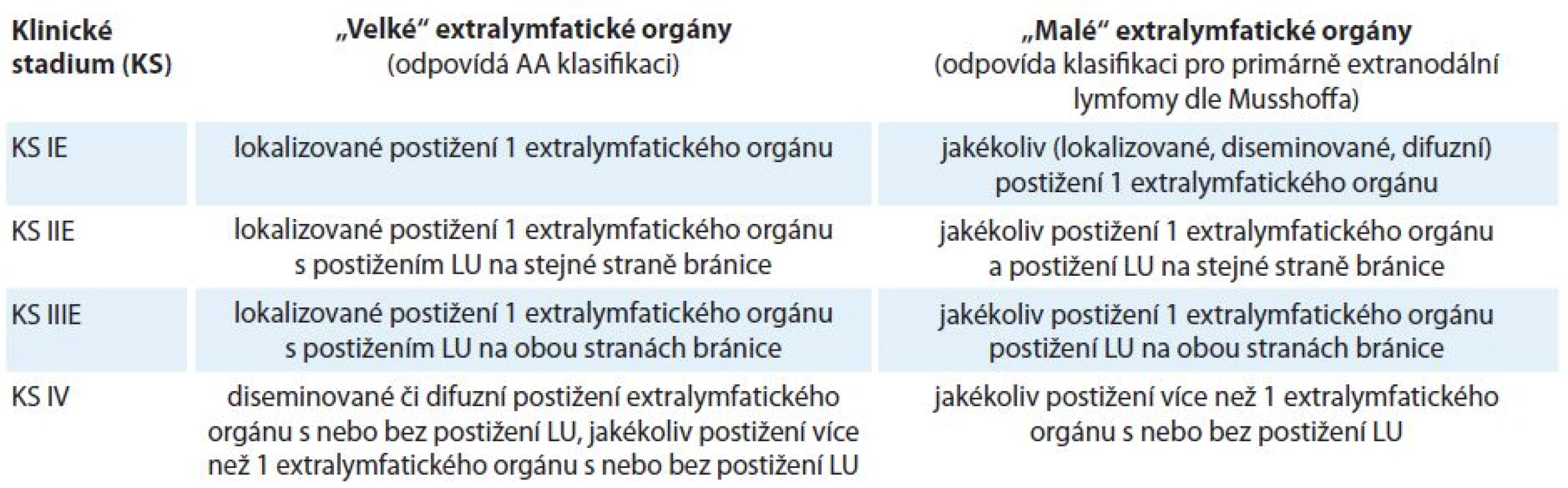
„velké“ extralymfatické orgány – játra, plíce, mezotel (pleura, pobřišnice, perikard), kostra, měkké tkáně, gastrointestinální trakt, „malé“ extralymfatické orgány – jiné než „velké“ orgány, E – extranodální postižení, LU – lymfatické uzliny Velikost sleziny
Normální délka sleziny se uvádí mezi 10 a 12 cm. Měření longitudinálního rozměru je jednoduché a zdá se být dostačující pro měření splenomegalie. Dvourozměrné či volumometrické měření není třeba provádět [35–37]. Jako splenomegalie je dle revidovaných kritérií z roku 2014 označována slezina měřící ve své dlouhé ose > 13 cm [18]. Tato definice je však diskutabilní, neboť velikost sleziny souvisí např. s výškou a rasou [38]. I když je určování velikosti sleziny a tomu odpovídající event. postižení lymfomem z výše uvedených důvodů nadále problematické, doporučujeme řídit se současnými kritérii z roku 2014 [18]. Postižení sleziny se označuje nadále písmenem „S“ [21,22,29,30].
Velikost jater
Normální velikost jater nebyla v revidované klasifikaci 2014 definována. Definice postižení odpovídá kritériím z roku 2007.
Vyšetření kostní dřeně
Dle revidovaných kritérií z roku 2014 došlo ke změně požadované velikosti vzorku kostní dřeně (KD) z 20 mm na 25 mm z jednostranné biopsie [18]. Vysoká senzitivita PET/ CT vyšetření při postižení KD vedla k otázce, zda je nadále třeba provádět histologické vyšetření KD u všech typů lymfomů.
Hodgkinův lymfom
Standardním vstupním vyšetřením u HL je PET/CT. Fokální 18F-FDG avidita je vysoce senzitivní pro postižení KD. Difuzní 18F-FDG avidita se může kombinovat s fokální aktivitou, ale nesmí se zaměnit s difuzní pozitivitou bez fokálního nálezu v rámci reaktivní hyperplazie bez postižení lymfomem. Literárně jsou publikovány studie, které dokazují, že difuzní pozitivitu v KD způsobují aktivované T lymfocyty, a nejedná se tudíž o postižení lymfomem. Systematická metaanalýza devíti studií s nově diagnostikovaným HL vyhodnotila senzitivitu PET/CT vyšetření při diagnostice postižení KD. Podíl PET/CT negativních pacientů s pozitivním histologickým nálezem v KD tvořil 1,1 %. Podle této metaanalýzy vstupní vyšetření PET/CT plně nahrazuje dosud prováděnou biopsii KD, kterou je možné vynechat při určení KS před zahájením 1. linie léčby [39,40]. V běžné praxi se tedy biopsie KD neprovádí. KLS doporučuje provádět histologické vyšetření KD pouze v individuálních případech, že by výsledek biopsie KD ovlivnil strategii terapie. Například u KS IIA s difuzní aktivitou v KD dle PET/ CT je vhodné toto vyšetření provést, přestože se s největší pravděpodobností může jednat o reaktivní záležitost. U starších nemocných lze trepanobioptickým vyšetřením posoudit rezervy KD nebo cytologickým vyšetřením diagnostikovat přítomnost dysplazie před zahájením chemoterapie v rámci 1. linie.
Non-Hodgkinův lymfom
Některé studie dokládaly, že u DLBCL je konkordantní postižení KD (tj. postižení KD lymfomem s vysokým stupněm malignity) prognostickým faktorem nezávislým na mezinárodním prognostickém indexu (international prognostic index – IPI), přestože v žádném prognostickém systému (IPI, revidovaný IPI) není postižení KD zahrnuto mezi faktory s nezávislým prognostickým dopadem [41–43]. V každém případě však postižení KD znamená KS IV. Postižení KD u DLBCL by mělo být zachytitelné pomocí PET vyšetření, a dle nových doporučení není tedy nutné histologické vyšetření u DLBCL provádět, pokud nás nezajímá event. diskordantní nález v KD a pokud není pacient zařazen do klinické studie, kde je trepanobioptické vyšetření požadováno. Toto doporučení automaticky předpokládá, že diskordantní postižení KD (tj. postižení lymfomem s nízkým stupněm malignity) u DLBCL prognostický význam nemá. Tato problematika je ovšem poněkud komplikovanější. Diskordantní postižení KD skutečně nemá prognostický význam nezávislý na IPI, ovšem tam, kde by postižení KD zvyšovalo IPI (při změně KS z I–II na IV nebo pokud by byl postižen mimo KD ještě další extranodální orgán), by se prognóza měnila.
Ve studiích se uniformně popisuje vyšší výskyt postižení KD zachytitelné pomocí PET/CT proti trepanobiopsii, např. 24 vs. 15 % [44]. Podobné výsledky byly publikovány v práci Khana et al a Bertheta et al [45,46]. PET/CT tedy může nahradit histologické vyšetření u fokálního záchytu 18F-FDG a v případě difuzní PET pozitivity se doporučuje provést histologické vyšetření KD pro vyloučení falešné pozitivity PET/ CT [47]. KLS na základě dostupných výsledků studií doporučuje nadále histologické vyšetření KD u nemocných s DLBCL provádět paralelně s PET/CT vyšetřením pro možnost přítomnosti diskordantního nálezu v KD či pro možnost falešně pozitivního/ negativního výsledku PET/CT. U všech lymfomů s nízkým stupněm malignity a u lymfomů z buněk pláště je nadále nutné bioptické vyšetření KD provádět [18].
B symptomy
Mezi B symptomy patří noční poty s nutností se převlékat, teploty neinfekčního původu > 38 °C a váhový úbytek > 10 % tělesné hmotnosti za posledních šest měsíců před diagnózou lymfomu.
V případě přítomnosti příznaků se za číslo KS uvádí označení „B“, v případě jejich nepřítomnosti „A“. Dle nových doporučení z roku 2014 se doporučuje přítomnost B příznaků uvádět pouze u HL, kde mají prognostický význam. U NHL se nově uvádět nemusí, neboť nejsou součástí žádného prognostického indexu, a tak nemají žádný vliv na prognózu [18]. KLS ale doporučuje přítomnost či nepřítomnost B symptomů do dokumentace zaznamenávat i u NHL. Jsou součástí kritérií, na jejichž základě se zahajuje léčba u indolentních lymfomů, jejich přetrvávání v průběhu léčby může být známkou nedostatečné klinické odpovědi a jejich znovuobjevení může předcházet jiným zjevným projevům relapsu.
Úloha zobrazovacích metod při určování rozsahu onemocnění a hodnocení léčebné odpovědi
PET/ CT
PET/CT při úvodním určování rozsahu onemocnění
PET/ CT vyšetření má vyšší senzitivitu a specificitu u 18F-FDG avidních lymfomů oproti CT vyšetření, stává se tak standardní metodou pro určování rozsahu onemocnění a hodnocení LO [18,23,25]. Podle Luganské klasifikace z roku 2014 se plnohodnotné PET/ CT vyšetření s i.v. kontrastem doporučuje provést jako vstupní standardní vyšetření u všech 18F-FDG avidních lymfomů (na rozdíl od dřívějších doporučení omezujících PET/CT pouze na HL a DLBCL) [18,23,25]. Naopak se nedoporučuje provádět u 18F-FDG neavidních lymfomů – tj. u lymfomů z malých lymfocytů, kožních lymfomů, Waldenströmovy makroglobulinemie, lymfoplazmocytárního lymfomu, lymfomu z marginální zóny, pokud u těchto diagnóz není suspekce na transformaci onemocnění nebo mimokožní postižení (v případě primárně kožních lymfomů) [25]. PET/CT má dále význam při plánování radioterapie, a to především u HL, dále má PET/CT vysokou senzitivitu pro extralymfatické postižení a může být využito např. i pro výběr vhodného místa k histologickému vyšetření. U MCL se ale suspekce na postižení gastrointestinálního traktu dle PET/CT vyšetření doporučuje ověřit jinými metodami vzhledem k vysokému počtu falešně pozitivních výsledků, zejména po léčbě [47]. Pro postižení CNS nemusí být PET/CT vyšetřením zachyceno leptomeningeální postižení a u indikovaných pacientů se doporučuje přednostní provedení magnetické rezonance (MRI), kombinovaného PET/MRI, event. společně s lumbální punkcí [18].
Načasování PET/CT
Vyšetření je vhodné provádět před léčbou a po léčbě, v některých případech se provádí i v průběhu terapie (doporučeno ve studiích a tam, kde může ovlivnit léčebný postup i ve standardní klinické praxi) [17,18,23,25,31]. Vzhledem k možnému falešně pozitivnímu výsledku po léčbě je nutné správné načasování vyšetření po skončení léčby [23,48]. Doporučení KLS je provádět PET/CT za 3–4 týdny po ukončení chemoterapie u agresivních lymfomů, do 6–8 týdnů u 18F-FDG avidních indolentních lymfomů a nejméně tři měsíce po skončení radioterapie u všech 18F-FDG avidních typů lymfomů. Dle individuálního zvážení se při hodnocení časné odpovědi na léčbu PET/ CT provádí po dvou cyklech terapie u HL a po 3–4 cyklech (v polovině léčby) u NHL. Na základě výsledku pozitivního PET/ CT nálezu po ukončené chemoterapii je v závislosti na typu lymfomu a rozsahu onemocnění indikováno dokončení plánované terapie (udržovací terapie biologickou léčbou – např. u FL nebo MCL), sledování, doplňující radioterapie a event. záchranná léčba. V případě indikace záchranné léčby by měla předcházet histologická verifikace onemocnění, pokud je technicky schůdná.
Hodnocení PET/CT
Pro hodnocení LO jak v průběhu léčby (v současnosti především v klinických studiích), tak po jejím skončení je důležité srovnání s úvodním vyšetřením. 18F-FDG záchyt ve tkáních se nedoporučuje posuzovat samostatně [23,49]. Výsledek metabolické odpovědi se posuzuje individuálně v kontextu s načasováním vyšetření, v závislosti na typu lymfomu a léčby, s ohledem na klinické a laboratorní vyšetření a v souvislosti s anamnestickými daty nemocného. Hodnocení PET nálezu je v současné době doporučeno hodnotit vizuální pětistupňovou škálou, tzv. Deauvillskými kritérii [50–52]. Definice těchto kritérií je uvedena v tab. 3. Deauvillská kritéria dobře korelují s klinickými výsledky, některé práce však ukazují, že kvantitativní, resp. semikvantitativní hodnocení změny utilizace 18F-FDG vedou k přesnějším výsledkům [49]. V současné době však chybí konsenzus a validace, které by umožňovaly doporučení pro obecné použití [25]. Semikvantitativní ukazatel utilizace 18F-FDG SUV (standardized uptake values) je totiž pro značné závislosti na parametrech pacienta (hmotnost, glykemie), na průběhu vyšetření (čas mezi aplikací a vyšetřením), na nastavení přístroje a na sběru a zpracování dat hůře použitelný [25,52–54].
Tab. 3. Deauvillská kritéria pro hodnocení metabolické odpovědi u PET/CT vyšetření. 
Definice čísla škály 5: > 2–3násobek maximální hodnoty SUV jater Vstupní hodnocení a hodnocení léčebné odpovědi u 18F-FDG PET avidních lymfomů – kvalitativní hodnocení PET/CT dle Deauvillských kritérií, rok 2014 [25]
Vstupní hodnocení k určení rozsahu onemocnění
Vstupně při určování rozsahu onemocnění je skóre 1 a 2 považováno za negativní (bez postižení lymfomem) a skóre 3–5 představuje pozitivitu nálezu.
Hodnocení léčebné odpovědi dle PET/CT během léčby a po léčbě
Předběžné výsledky studií s úpravou léčby dle „interim“ PET/CT vyšetření jsou slibné především u HL, ale změna (eskalace/deeskalace) na základě tohoto vyšetření není zatím rutinně indikována. Úprava léčby u HL i NHL na základě výsledků „interim“ PET/CT je v současné době doporučována v rámci klinických studií [18]. Hodnocení léčebné odpovědi dle PET/ CT během léčby a po léčbě ukazuje tab. 4.
Tab. 4. Revidovaná kriteria léčebné odpovědí z roku 2014 dle PET/CT a CT vyšetření. 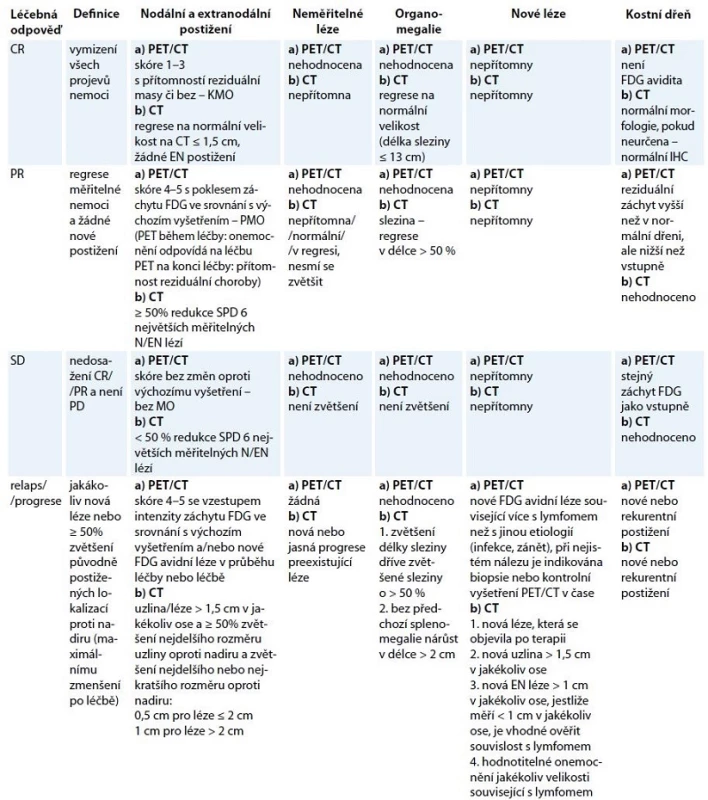
CT – počítačová tomografie, PET – pozitronová emisní tomografie, FDG – fluorodeoxyglukoza, IHC – imunohistochemie, SPD – součet násobků dvou na sebe kolmých největších rozměrů mnohočetných lézí, CR – kompletní remise, PR – parciální remise, SD – stabilizace onemocnění, PD – progresivní choroba, EN – extranodální = extralymfatické, N – nodální Hodnocení FDG avidity – Deauvillské skóre 1–5: skóre 1 – bez záchytu FDG oproti pozadí, skóre 2 – záchyt FDG ≥ mediastinum, skóre 3 – záchyt FDG > mediastinum ≤ játra, skóre 4 – záchyt FDG > játra, skóre 5 – záchyt FDG výrazně vyšší než nad játry a/nebo přítomnost nových lézí, KMO – kompletní metabolická odpověď, PMO – parciální metabolická odpověď, MO – metabolická odpověď CT vyšetření
Samostatné CT vyšetření a tzv. CT kritéria se užívají u 18F-FDG neavidních či variabilně 18F-FDG avidních subtypů lymfomů u nemocných bez vstupního 18F-FDG PET/CT vyšetření nebo se vstupně negativním 18F-FDG PET/ CT vyšetřením.
Vstupní vyšetření k určení rozsahu onemocnění
Při CT vyšetření se vstupně hodnotí až šest největších dvojrozměrně měřitelných lézí z různých oblastí ve dvou na sebe nejdelších kolmých rozměrech. Do hodnocení musí být zahrnuto mediastinální a retroperitoneální postižení, pokud je přítomno. Vstupně tedy zjistíme velikost SPD (sum of products diameters), který je definován jako součet násobků dvou na sebe kolmých největších rozměrů u šesti největších uzlin nebo uzlinových infiltrátů/ extranodálních měřitelných lézí [17,18,23]. Za neměřitelnou lézi se považuje postižení KD a postižení dalších extranodálních tkání (např. kůže, játra, ledviny, mezotel, slezina atp.).
Hodnocení léčebné odpovědi
Hodnocení léčebné odpovědi po léčbě se provádí v průběhu terapie nebo na konci léčby. Dle nových doporučení z roku 2014 je simplifikována velikost normální uzliny (≤ 1,5 cm). Obrázek 1 znázorňuje měření lézí pro regresi tumorózní masy po léčbě. Hodnocení léčebné odpovědi dle CT během léčby a po ní ukazuje tab. 4.
Obr. 1. Znázornění měření lézí pro regresi tumorózní masy. Výpočet regrese tumorózní masy – rozdíl SPD před léčbou a po léčbě: Δ SPD = [(a<sub>1</sub> × b<sub>1</sub>) + (c<sub>1</sub> × d<sub>1</sub>)…] – [(a<sub>2</sub> × b<sub>2</sub>) + (c<sub>2</sub> × d<sub>2</sub>)…] ![Znázornění měření lézí pro regresi tumorózní masy.
Výpočet regrese tumorózní masy – rozdíl SPD před léčbou a po léčbě:
Δ SPD = [(a<sub>1</sub> × b<sub>1</sub>) + (c<sub>1</sub> × d<sub>1</sub>)…] – [(a<sub>2</sub> × b<sub>2</sub>) + (c<sub>2</sub> × d<sub>2</sub>)…]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/43c7d36d1a2ab80885b3e1fdb46c7e0e.jpg)
Závěr
Současná Luganská klasifikace 2014 vznikla s ohledem na široké používání metody PET/CT, kdy léčebná odpověď dle PET/ CT je v současné době nejvýznamnějším prognostickým faktorem u nemocných s lymfomy. Standardizace kritérií pro určování KS a léčebné odpovědi u maligních lymfomů vede ke zlepšenému hodnocení rozsahu onemocnění a odpovědi na léčbu a napomáhá hledání účinnějšího způsobu terapie ke zlepšení prognózy pacientů s tímto onemocněním. Slouží k jednotnému hodnocení výsledků klinických studií a současně zjednodušuje práci regulačním agenturám (EMA, SÚKL) v procesu registrace nových léčiv. Zároveň umožňuje i hodnocení léčebných výsledků mimo klinické studie, např. v rámci lymfomového projektu KLS – prospektivně vedené databázi nově diagnostikovaných pacientů s lymfomy. Revize kritérií v roce 2014 přinesla řadu zjednodušení a upřesnění v hodnocení rozsahu onemocnění a hodnocení léčebné odpovědi, ale současně zůstávají nezodpovězené otázky k diskuzi, které by měly být předmětem další revize v budoucnu.
Práce byla podpořena grantem Prvouk P27/2012 3. LF UK v Praze a grantem Kooperativní lymfomové skupiny České republiky č. NT12193-5/2011.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Alice Sýkorová, Ph.D.
IV. interní hematologická klinika LF UK a FN Hradec Králové
Sokolská 581
500 03 Hradec Králové
e-mail: ali.sykorova@seznam.cz
prof. MUDr. Marek Trněný, CSc.
I. interní klinika
1. LF UK a VFN v Praze
U Nemocnice 2
128 08 Praha 2
e-mail: trneny@cesnet.cz
Obdrženo: 24. 1. 2016
Přijato: 16. 2. 2016
Zdroje
1. Shipp MA. Prognostic factors in aggressive non-Hodgkin‘s lymphoma: who has „high-risk“ disease? Blood 1994; 83(5): 1165 – 1173.
2. Sehn LH, Berry B, Chhanabhai M et al. The revised International Prognostic Index (R-IPI) is a better predictor of outcome than the standard IPI for patients with diffuse large B-cell lymphoma treated with R-CHOP. Blood 2007; 109(5): 1857 – 1861.
3. Solal-Céligny P, Roy P, Colombat P et al. Follicular lymphoma international prognostic index. Blood 2004; 104(5): 1258 – 1265.
4. Federico M, Bellei M, Marcheselli L. Follicular lymphoma international prognostic index 2: a new prognostic index for follicular lymphoma developed by the international follicular lymphoma prognostic factor project. J Clin Oncol 2009; 27(27): 4555 – 4562. doi: 10.1200/ JCO.2008.21.3991.
5. Hoster E, Dreyling M, Klapper W et al. A new prognostic index (MIPI) for patients with advanced-stage mantle cell lymphoma. Blood 2008; 111(2): 558 – 565.
6. Gallamini A, Stelitano C, Calvi R et al. Peripheral T-cell lymphoma unspecified (PTCL-U): a new prognostic model from a retrospective multicentric clinical study. Blood 2004; 103(7): 2474 – 2479.
7. Ferreri AJ, Blay JY, Reni M et al. Prognostic scoring system for primary CNS lymphomas: the International Extranodal Lymphoma Study Group Experience. J Clin Oncol 2003; 21(2): 266 – 272.
8. Buske C, Leblond V. How to manage Waldenstrom’s macroglobulinemia. Leukemia 2013; 27(4): 762 – 772. doi: 10.1038/ leu.2013.36.
9. Owen RG, Kyle RA, Stone MJ et al. Response assessment in Waldenstrom macroglobulinaemia: update from the VIth International Workshop. Br J Haematol 2013; 160(2): 171 – 176. doi: 10.1111/ bjh.12102.
10. Hartmann S, Eichnauer DA, Plutschow A et al. The prognostic impact of variant histology in nodular lymphocyte-predominant Hodgkin lymphoma: a report from the German Hodgkin Study Group (GHSG). Blood 2013; 122(26): 4246 – 4252. doi: 10.1182/ blood-2013-07-515825.
11. Fanale M. A novel prognostic scoring system for NLPHL. Blood 2013; 122(26): 4154 – 4155. doi: 10.1182/ blood-2013-11-533109.
12. Savage KJ, Zeynalova S, Kansara RR et al. Validation of prognostic model to assess the risk of CNS disease in patients with agressive B-cell lymphoma. 56th ASH Annual Meeting and Exposition 2014, abstr. 394. CA: San Francisko, December 6 – 9, 2014.
13. Procházka V, Pytlík R, Janíková A et al. A new prognostic score for elderly patients with diffuse large B-cell lymphoma treated with R-CHOP: the prognostic role of blood monocyte and lymphocyte counts is absent. PLOS One 2014; 9: e102594. doi: 10.1371/ journal.pone.0102594.
14. Hasenclever D, Diehl V. A prognostic score for advanced Hodgkin’s disease. International Prognostic Factors Project on Advanced Hodgkin’s Disease. N Engl J Med 1998; 339(21): 1506 – 1514.
15. Rosenberg SA. Validity of the Ann Arbor staging classification for the non-Hodgkin‘s lymphomas. Cancer Treat Rep 1977; 61(6): 1023 – 1027.
16. Musshoff K. Clinical staging classification of non-Hodgkin‘s lymphomas (author‘s transl). Strahlentherapie 1977; 153(4): 218 – 221.
17. Cheson BD, Horning SJ, Coiffier B et al. Report of an international workshop to standardize response criteria for non-Hodgkin’s lymphomas: NCI Sponsored International Working Group. J Clin Oncol 1999; 17(4): 1244 – 1253.
18. Cheson BD, Fisher RI, Barrington SF et al. Recommendation for initial evaluation, staging, and response assessment of Hodgkin and Non-Hodgkin lymphoma: the Lugano Classification. J Clin Oncol 2014; 32(27): 3059 – 3068.
19. Rosenberg SA. Report of the committee on the staging of Hodgkin’s disease. Cancer Res 1966; 26 : 1310.
20. Gupta RK, Gospodarowicz MK, Lister TA. Clinical evaluation and staging of Hodgkin’s disease. In: Mauch PM, Armitage JO, Diehl V et al (eds). Hodgkin’s disease. 1st ed. Philadelphia: Lippincott Williams & Wilkins 1999 : 223 – 240.
21. Carbone PP, Kaplan HS, Musshoff K et al. Report of the committee on Hodgkin’s disease staging classification. Cancer Res 1971; 31(11): 1860 – 1861.
22. Lister TA, Crowther D, Sutcliffe SB et al. Report of a commitee convened to discuss the evaluation and staging of patients with Hodgkin’s disease: Cotswolds meeting. J Clin Oncol 1989; 7(11): 1630 – 1636.
23. Cheson BD, Pfistner B, Juweid ME et al. Revised response criteria for malignant lymphoma. J Clin Oncol 2007; 25(5): 579 – 586.
24. Moog F, Bangerter M, Diederichs CG et al. Lymphoma: role of whole-body 2-deoxy-2-[F-18]fluoro-D-glucose (FDG) PET in nodal staging. Radiology 1997; 203(3): 795 – 800.
25. Barrington SF, Mikhaeel NG, Kostakoglu L et al. Role of imaging in the staging and response assessment of lymphoma: consensus of the International conference on malignant lymphomas imaging working group. J Clin Oncol 2014; 32(27): 3048 – 3058.
26. Zhang XM, Aguilera N. New immunohistochemistry for B-cell lymphoma and Hodgkin lymphoma. Arch Pathol Lab Med 2014; 138(12): 1666 – 1672. doi: 10.5858/ arpa.2014-0058-RA.
27. Arber DA. Molecular diagnostic approach to non-Hodgkin’s Lymphoma. J Mol Diagn 2000; 2(4): 178 – 190.
28. Lenz G, Wright GW, Emre NC et al. Molecular subtypes of diffuse large B-cell lymphoma arise by distinct genetic pathways. Proc Natl Acad Sci U S A 2008; 105(36): 13520 – 13525. doi: 10.1073/ pnas.0804295105.
29. Adam Z, Krejčí M, Vorlíček J et al. Maligní non-Hodgkinské lymfomy. In: Adam Z, Krejčí M, Vorlíček J et al (eds). Hematologie – přehled maligních hematologických nemocí. 2. vyd. Praha: Grada 2008 : 105 – 167.
30. Belada D, Trněný M, Campr V et al. Léčebná doporučení Kooperativní lymfomové skupiny. 5. vyd. Hradec Králové: HK CREDIT s.r.o. 2013 : 17 – 40.
31. Hutchings M, Loft A, Hansen M et al. Position emission tomography with or without computed tomography in the primary staging of Hodgkin’s lymphoma. Haematologica 2006; 91(4): 482 – 489.
32. Elstrom R, Leonard JP, Coleman M et al. Combined PET and low-dose, noncontrast CT scanning obviates the need for additional diagnostic contrast-enhanced CT scans in patients undergoing staging or restaging for lymphoma. Ann Oncol 2008; 19(10): 1770 – 1773. doi: 10.1093/ annonc/ mdn282.
33. Pelosi E, Pregno P, Penna D et al. Role of whole-body [18F] fluorodeoxyglucose positron emission tomography/ computed tomography (FDGPET/ CT) and conventional techniques in the staging of patients with Hodgkin and aggressive non Hodgkin lymphoma. Radiol Med 2008; 113(4): 578 – 590. doi: 10.1007/ s11547-008-0264-7.
34. Sýkorová A, Belada D, Smolej L et al. Určování rozsahu onemocnění u non-Hodgkinových lymfomů – doporučení Kooperativní lymfomové skupiny. Klin Onkol 2010; 23(3): 146 – 154 .
35. Saboo SS, Krajewski KM, O’Regan KN et al. Spleen in haematological malignancies: spectrum of imaging findings. Br J Radiol 2012; 85(1009): 81 – 92. doi: 10.1259/ bjr/ 31542964.
36. Lamb PM, Lund A, Kanagasabay RR et al. Spleen size: how well do linear ultrasound measurements correlate with three-dimensional CT volume assessments? Br J Radiol 2002; 75(895): 573 – 577.
37. Bezerra AS, D’Ippolito G, Faintuch S et al. Determination of splenomegaly by CT: is there a place for a single measurement? AJR Am J Roentgenol 2005; 184(5): 1510 – 1513.
38. Spielmann AL, DeLong DM, Kliewer MA. Sonographic evaluation of spleen size in tall healthy athletes. Am J Roentgenol 2005; 184(1): 45 – 49.
39. Adams HJ, Kwee TC, de Keizer B et al. Systematic review and meta-analysis on the diagnostic performance of FDG-PET/ CT in detecting bone marrow involvement in newly diagnosed Hodgkin lymphoma: is bone marrow biopsy still necessary? Ann Oncol 2014; 25(5): 921 – 927. doi: 10.1093/ annonc/ mdt533.
40. Salau PY, Gastinne T, Bodet-Milin C et al. Analysis of 18F-FDG PET diffuse bone marrow uptake and splenic uptake in staging of Hodgkin‘s lymphoma: a reflection of disease infiltration or just inflammation? Eur J Nucl Med Mol Imaging 2009; 36(11): 1813 – 1821. doi: 10.1007/ s00259-009-1183-0.
41. Chung R, Lai R, Wei P et al. Concordant but not diskordant bone marrow involvement in diffuse large B-cell lymphoma predicts a poor clinical outcome independent of the International Prognostic Index. Blood 2007; 110(4): 1278 – 1282.
42. Sehn LH, Scott DW, Chhanabhai M. Impact of concordant and discordant bone marrow involvement on outcome in diffuse large B-cell lymphoma treated with R-CHOP. J Clin Oncol 2011; 29(11): 1452 – 1457. doi: 10.1200/ JCO.2010.33.3419.
43. Shim H, Oh JI, Park SH et al. Prognostic impact of concordant and discordant cytomorphology of bone marrow involvement in patients with diffuse, large, B-cell lymphoma treated with R-CHOP. J Clin Pathol 2013; 66(5): 420 – 425. doi: 10.1136/ jclinpath-2012-201158.
44. Ptacnik V, Benesova K, Cmunt E et al. What do we miss and get if we replace bone marrow biopsy in DLBCL with paging PET/ CT. Hematol Oncol 2015; 33 : 3125.
45. Khan AB, Barrington SF, Mikhaeel NG et al. PET-CTstaging of DLBCL accurately identifies and provides new insight into the clinical significance of bone marrow involvement. Blood 2013; 122(1): 61 – 67. doi: 10.1182/ blood-2012-12-473389.
46. Berthet L, Cochet A, Kanoun S et al. In newly diagnosed diffuse large B-cell lymphoma, determination of bone marrow involvement with 18F-FDGPET/ CT provides better diagnostic performance and prognostic stratification than does biopsy. J Nucl Med 2013; 54(8): 1244 – 1250. doi: 10.2967/ jnumed.112.114710.
47. Han HS, Escalón MP, Hsiao B et al. High incidence of false-positive PET scans in patients with aggressive non-Hodgkin‘s lymphoma treated with rituximab-containing regiment. Ann Oncol 2009; 20(2): 309 – 318. doi: 10.1093/ annonc/ mdn629.
48. Juweid M, Cheson BD. Positron emission tomography (PET) in post-therapy assessment of cancer. N Engl J Med 2006; 354(5): 496 – 507.
49. Lin C, Itti E, Haioun C et al. Early 18F-FDG PET for prediction of prognosis in patients with diffuse large B-cell lymphoma: SUV-based assessment versus visual analysis. J Nucl Med 2007; 48(10): 1626 – 1632.
50. Boellaard R, Oyen WJ, Hoekstra CJ et al. The Netherlands protocol for standardisation and quantification of FDG whole body PET studies in multi-centre trials. Eur J Nucl Med Mol Imaging 2008; 35(12): 2320 – 2333. doi: 10.1007/ s00259-008-0874-2.
51. Barrington SF, Qian W, Somer EJ et al. Concordance between four European centres of PET reporting criteria designed for use in multicentre trials in Hodgkin lymphoma. Eur J Nucl Med Mol Imaging 2010; 37(10): 1824 – 1833. doi: 10.1007/ s00259-010-1490-5.
52. Meignan M, Gallamini A, Haioun C et al. Report on the First international workshop on interim-PET scan in lymphoma. Leuk Lymphoma 2009; 50(8): 1257 – 1260. doi: 10.1080/ 10428190903040048.
53. Barrington SF, Mikhaeel NG. When should FDG-PET be used in the modern management of lymphoma? Br J Haematol 2014; 164(3): 315 – 328. doi: 10.1111/ bjh.12601.
54. Kinahan PE, Fletcher JW. Positron emission tomography-computed tomography standardized uptake values in clinical practice and assessing response to therapy. Semin Ultrasound CT MR 2010; 31(6): 496 – 505. doi: 10.1053/ j.sult.2010.10.001.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Dva pohledy na vývoj nádorůČlánek SOUTĚŽ O NEJLEPŠÍ PRÁCI
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2016 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Současné postavení systémové chemoterapie v léčbě karcinomu žaludku – přínos, či zhoršení kvality života?
- Antiproliferační účinek analog somatostatinu – analýza dat a klinické aplikace v kontextu výsledků studie CLARINET
- Dva pohledy na vývoj nádorů
- Vplyv liečby na kognitívne funkcie a kvalitu života u pacientov s karcinomom semenníkov
- Sentinelová uzlina u melanomu – studie provedená v jižní Brazílii
- SOUTĚŽ NA PODPORU AUTORSKÝCH TÝMŮ PUBLIKUJÍCÍCH V ZAHRANIČNÍCH ODBORNÝCH TITULECH
- Vliv paliativní chemoterapie na kvalitu života nemocných s karcinomem žaludku
- Vícenásobné nádorové onemocnění plic – kazuistika a přehled literatury
- Primární mukoepidermoidní karcinom slzného vaku – kazuistika a přehled literatury
- Hodnocení klinického stadia a léčebné odpovědi u maligních lymfomů – doporučení Kooperativní lymfomové skupiny na základě revidovaných kritérií z roku 2014 (Luganská klasifikace)
- SOUTĚŽ O NEJLEPŠÍ PRÁCI
-
52nd Annual Meeting of ASCO
3.–7. června 2016, Chicago, USA
Výsledky léčby pembrolizumabem u maligního melanomu a nemalobuněčného plicního karcinomu - Klinické hodnocení fáze III posuzující regorafenib u pacientů s neresekovatelným karcinomem jater splnilo primární cíl – zlepšení celkového přežití
-
Průvodce mladého onkologa infuzní terapií a výživou
Díl 4 – Enterální a parenterální výživa. Chloridy. Kazuistika 4 - Indikace radioterapie u pacientů s hematologickými malignitami v průběhu pěti let provozu modernizovaného centra Onkologické a radioterapeutické kliniky v Plzni
-
Onkologie v obrazech
Echinokoková cysta primárně považovaná za sarkom
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vliv paliativní chemoterapie na kvalitu života nemocných s karcinomem žaludku
- Dva pohledy na vývoj nádorů
- Vplyv liečby na kognitívne funkcie a kvalitu života u pacientov s karcinomom semenníkov
- Primární mukoepidermoidní karcinom slzného vaku – kazuistika a přehled literatury
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



