-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Proteiny Rab, vnitrobuněčný transport a nádorová onemocnění
Rab Proteins, Intracellular Transport and Cancer
Background:
Rab proteins are small monomeric enzymes which belong to the large Ras protein superfamily and allow hydrolysis of guanosine triphosphate (GTP) to guanosine (GDP). Up to now more than 60 proteins have been described that act primarily as regulators of intracellular transport. Rab GTPases are mostly located at the intracellular membranes, where they provide connections to motor proteins and to the cytoskeleton and control various steps of the traffic pathways including the formation and movement of vesicles or membrane fusion controlling secretion, endocytosis, recycling and degradation of proteins. Today, the deregulated expression of Rab protein is discussed in different types of malignancies. The number of identified diseases associated with mutations in Rab proteins or their cooperating partners increases and the evidence for the involvement of Rab to the human pathologies such as the immune failure, obesity and diabetes, Alzheimer‘s disease or hereditary genetic diseases is growing. The malfunctions of Rab proteins caused by mutations or aberrant posttranslational modifications lead to changes in the protein and vesicle trafficking, which play a crucial role in the formation and development of cancer and the deregulation of Rab expression frequently influences the migration, invasion, proliferation and drug resistance of the tumor cells.Aims:
This article summarizes the main functions of Rab proteins in the cells, describes the mechanism of their activity and focuses on the current knowledge about the roles of these GTPases in carcinogenesis.Key words:
Rab GTPases – protein transport – carcinogenesis
This work was supported by the project MEYS – NPS I – LO1413.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
13. 5. 2016Accepted:
31. 5. 2016
Autoři: R. Černochová; M. Nekulová; J. Holčáková
Působiště autorů: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
Vyšlo v časopise: Klin Onkol 2016; 29(Supplementum 4): 31-39
Kategorie: Přehled
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko20164S31Souhrn
Východiska:
Proteiny Rab jsou malé monomerní enzymy umožňující hydrolýzu guanozintrifosfát (GTP) na guanozindifosfát (GDP) a se řadí se do rozsáhlé nadrodiny proteinů Ras. Dosud bylo popsáno více než 60 těchto proteinů, které působí především jako regulátory vnitrobuněčného transportu. Většina Rab GTPáz je umístěna specificky na vnitrobuněčných membránách, kde zajišťují napojení na motorické proteiny a cytoskelet a řídí různé kroky transportních drah vč. formování a pohybu vezikulů či membránových fúzí kontrolujících sekreci, endocytózu, recyklaci a degradaci proteinů. V posledních letech je stále častěji zmiňována deregulace exprese proteinů Rab u různých typů malignit. Zvyšuje se počet onemocnění, u kterých byla zjištěna souvislost s mutacemi v proteinech Rab či v proteinech s nimi spolupracujících a přibývají důkazy o zapojení Rab do patologických stavů lidského organizmu, jako je selhání imunity, obezita a diabetes, Alzheimerova choroba nebo dědičná genetická onemocnění. Funkční poruchy Rab způsobené mutacemi nebo aberantními posttranslačními modifikacemi vedou ke změnám v transportu proteinů a vezikulů, které hrají zásadní úlohu při vzniku a vývoji nádorových onemocnění a deregulace exprese Rab často ovlivňuje migraci, invazivitu, proliferaci a lékovou rezistenci nádorových buněk.Cíle:
Tento článek shrnuje základní funkce proteinů Rab v buňce, popisuje mechanizmus jejich působení a zaměřuje se na současné poznatky o úloze těchto GTPáz při karcinogenezi.Klíčová slova:
proteiny Rab – transport proteinů – karcinogenezeÚvod
Proces maligní transformace buňky je ovlivněn řadou buněčných pochodů a studium procesů probíhajících v nádorových buňkách je nezbytné pro pochopení vlastností malignit a hledání vhodných přístupů při jejich léčbě. Správný průběh životního cyklu buňky je podmíněn uplatněním funkcí jednotlivých proteinů, k čemuž je nezbytná nejen jejich správná syntéza, ale i třídění uvnitř buňky a doprava k cílovým místům působení. Je zřejmé, že vnitrobuněčný transport proteinů zahrnuje široké spektrum procesů a je ovlivňován mnoha faktory. Na těchto komplikovaných procesech se značnou měrou podílejí i proteiny rodiny Rab. Proteiny Rab se účastní hned několika kroků intracelulárního transportu proteinů a jsou zapojeny i do regulace sekrece a endocytózy [1]. Odchylky v endocytóze, nepřesné cílení transportních váčků či nesprávná recyklace buněčných receptorů se následně projevují v procesech buněčné adheze, migrace a proliferace, v polaritě buněk a v jejich přežívání. Abnormality v intracelulárním transportu proteinů poté mohou iniciovat některá onemocnění, vč. nádorového bujení, Alzheimerovy choroby či autoimunitních onemocnění [2].
Vnitrobuněčný transport proteinů
Vnitrobuněčný transport je tradičně dělen na dvě základní dráhy – exocytickou a endocytickou. Exocytóza zahrnuje transport materiálu syntetizovaného buňkou k plazmatické membráně směřující k sekreci makromolekul ven z buňky a také distribuci syntetizovaných makromolekul k organelám vlastního endomembránového systému. Endocytóza naopak označuje příjem molekul menších než 500 nm z vnějšího prostředí buňky [3]. Nejčastěji se jedná o složky plazmatické membrány, povrchové receptory a také živiny. Část endocytovaného materiálu může být recyklována a transportována zpět na povrch buňky, čímž dochází k propojení obou drah [4]. Jednotlivé transportní kroky jsou uskutečňovány prostřednictvím váčků nazývaných vezikuly. Celý transportní proces zahrnuje vytvoření vezikulu, jeho pohyb směrem k akceptoru, připojení a závěrečnou fúzi s akceptorovou membránou. Pohyb váčku probíhá za účasti cytoskeletu nebo pomocí difuze [5].
Exocytická dráha
Drsné endoplazmatické retikulum (ER) je buněčná organela zodpovědná za syntézu transmembránových a sekretovaných proteinů. Aby mohly nově syntetizované proteiny plnit své funkce, je nutný jejich transport k cílovým místům v buňce. Po složení proteinu, případných posttranslačních modifikacích a kontrole kvality jsou proteiny shromážděny a baleny do anterográdních (směřujících vpřed) transportních vezikulů, jejichž povrch je tvořen obalovými proteiny COPII (coat protein II) [6]. Tyto transportní váčky přenášejí proteiny z ER na přilehlou, cis stranu Golgiho aparátu (GA). Soustava GA je zodpovědná za úpravu a třídění proteinů a dalších buněčných makromolekul.
Některé z proteinů, hlavně ty s cílovou lokalizací v ER, mohou být z cis strany GA vráceny zpět do ER pomocí retrográdních (zpětných) transportních vezikulů, které jsou tvořeny obalovými proteiny COPI (coat protein I) [6]. Většina proteinů je však v GA dále modifikována, případně skladována a následně přemisťována z cis-GA do odvrácené, trans strany GA, resp. až na okrajovou část nazývanou trans Golgiho síť (trans-Golgi network – TGN), ve které dochází k hlavnímu třídění proteinů [7].
V oblasti TGN se rozhoduje o dalším osudu proteinů. Jednou z možností je dráha konstitutivní sekrece, kdy jsou proteiny nepřetržitě transportovány k plazmatické membráně a vylučovány ven z buňky. Možná je také exocytóza využívající transportní nosiče, které proteiny převzaté z TGN na určitý čas zadržují v cytozolu a vylučují je z buňky až po přijetí signálu stimulujícího exocytózu. Třetí možností je pohyb molekul z TGN anterográdním směrem do cílového místa jejich působení a poté, co splní svoji funkci, následný transport přes endozom až do lysozomu (Lys), kde jsou degradovány [8].
Endocytická dráha
Vznik endocytického váčku z komponent plazmatické membrány je zprostředkován specifickými obalovými proteiny, mezi které patří např. klatrin a kaveolin [3]. Endocytický váček následně fúzuje s raným endozomem (EE). Odtud většina proteinů postupuje přes pozdní endozom (LE) až k Lys, kde jsou degradovány. Některé proteiny však mohou být z EE recyklovány a transportovány zpět na plazmatickou membránu. Tímto procesem dochází k propojení endocytické a exocytické dráhy a vznikají tzv. endocytické a exocytické cykly (EECs) [4].
EECs se velkou měrou zapojují do regulace signálních buněčných drah. Je-li receptor nebo jeho ligand endocytován a následně degradován, dochází k oslabení signální dráhy, naopak transport receptorů na buněčnou membránu vede k zesílení buněčné signalizace. Příkladem může být signalizace zprostředkovaná receptorem pro epidermální růstový faktor (epidermal growth factor receptor – EGFR) [4].
Z důvodu velkého množství různorodých molekul směřujících do jednotlivých cílových destinací v buňce je nezbytná dokonalá regulace jednotlivých transportních drah. Klíčovými regulátory těchto pochodů jsou proteiny rodiny Rab.
Rab proteiny
Proteiny Rab jsou jedny z klíčových faktorů řídících vnitrobuněčný vezikulární transport. Jejich hlavními funkcemi je zajištění specificity transportu vazbou na transportní váček a definování identity jednotlivých buněčných organel. Umožňují také napojení na motorové proteiny (myozin) a cytoskelet, čímž usnadňují pohyb vezikulů s transportovaným materiálem k příslušným cílovým organelám [9]. Proteiny rodiny Rab jsou malé monomerní GTPázy, tedy enzymy hydrolyzující guanozintrifosfát (GTP) na guanozindifosfát (GDP), které se spolu s příbuznými rodinami ARF, Ran a Rho řadí do proteinové nadrodiny Ras [3]. Jejich vlastní GTPázová aktivita umožňující přechod mezi aktivními a neaktivními stavy proteinu je předurčuje k roli důležitých regulačních molekul.
Struktura proteinů Rab
Dosud bylo v lidském genomu identifikováno přibližně 70 genů pro proteiny Rab [8], které jsou lokalizovány na různých chromozomech [10]. Produkty těchto genů regulují jednotlivé kroky třídění a přenosu proteinů v různých částech buňky. Jednotlivé geny kódující různé proteiny Rab mohou podléhat alternativnímu sestřihu, což vede ke vzniku proteinových izoforem s odlišnými funkcemi [10]. U mnohých proteinů Rab není jejich přesná funkce zatím známa [2].
Proteiny rodiny Rab vykazují průměrně pouze 30% sekvenční homologii [2]. Jsou tvořeny přibližně 220 aminokyselinami a jejich molekulová hmotnost se pohybuje okolo 24 kDa [3].
Pro strukturu těchto proteinů je typická přítomnost několika vysoce konzervovaných oblastí vyskytujících se i u dalších zástupců nadrodiny Ras. Důležitá je guanin nukleotid vazebná doména obecně se vyskytující u GTPáz. Pět krátkých oblastí označovaných RabF1–5 bylo naopak identifikováno pouze u rodiny Rab [11]. Rodina proteinů Rab je dále dělena na tzv. podrodiny, pro které byly definovány čtyři charakteristické proteinové motivy označované RabSF1–4 [3]. Celkem bylo definováno 10 podrodin – Rab1, Rab3, Rab4, Rab5, Rab6, Rab8, Rab11, Rab22, Rab27 a Rab40, nicméně mnoho proteinů Rab není možné do těchto podrodin zařadit. V zásadě se jednotlivé proteiny Rab odlišují především v C-terminální oblasti, která je nezbytná pro správnou lokalizaci proteinu Rab v buňce [12]. Nacházejí se zde proteinové motivy XXXCC, XXCCX, XCCXX, CCXXX a XXCXC (kde X je libovolná aminokyselina) obsahující dva cysteinové zbytky nezbytné pro prenylaci proteinu (viz níže) (obr. 1) [13].
Obr. 1. Schéma struktury proteinu Rab. Struktura proteinu Rab s označenými motivy specifickými pro celou rodinu Rab (RabF) a pro jednotlivé podrodiny Rab (RabSF), které se podílejí na protein-proteinových interakcích. Na C-konci proteinu je hypervariabilní doména s dicysteinylovým prenylačním signálem (CC). 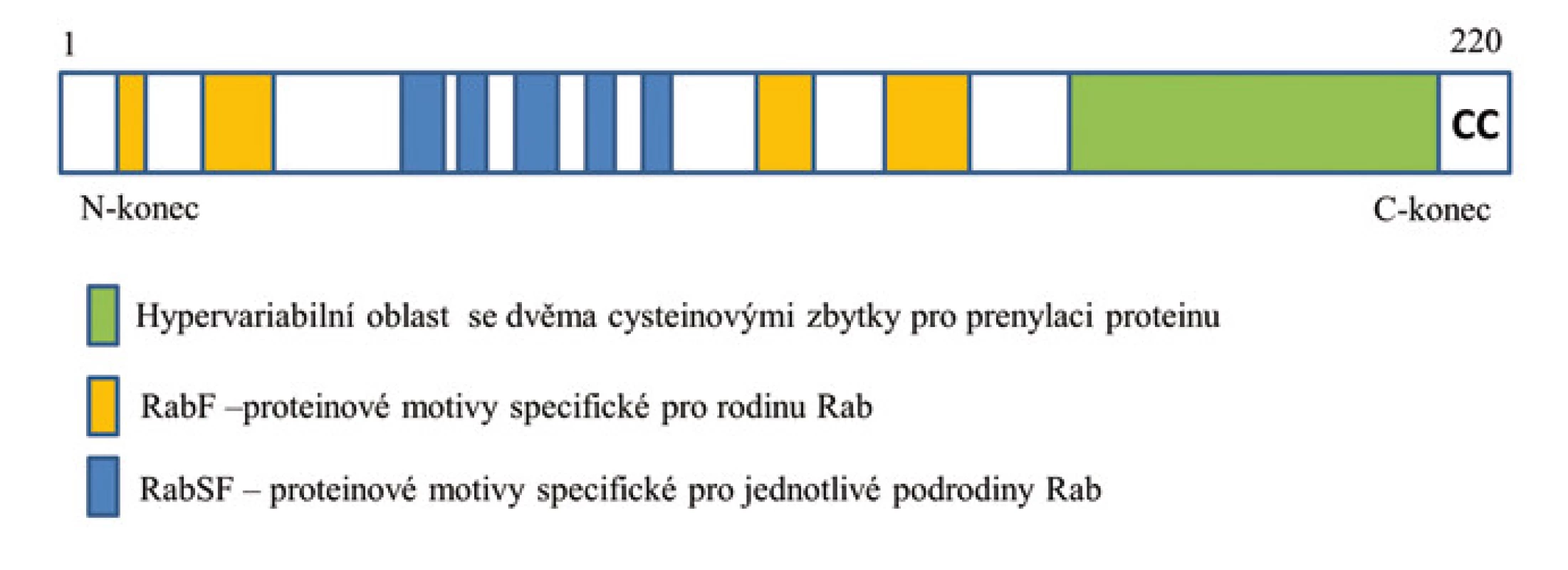
Cyklus Rab proteinů v buňce
Obdobně jako jiné GTPázy, mohou se proteiny Rab vyskytovat v buňce ve dvou formách, a to v aktivní formě s navázaným GTP (Rab-GTP) a neaktivní formě s navázaným GDP (Rab-GDP). V cytozolu se vyskytují v neaktivní konformaci v komplexu s disociačním inhibitorem (GDI) [10]. Pro aktivaci Rab a umožnění jeho fúze s membránou je nutné odstranění GDI a následná výměna GDP za GTP (obr. 2).
Obr. 2. Schematické znázornění aktivace proteinů Rab v buňce. Proteiny Rab se vyskytují v buňce ve dvou formách – v aktivní formě s navázaným GTP a neaktivní formě s navázaným GDP. V cytozolu jsou proteiny Rab neaktivní v komplexu s disociačním inhibitorem (GDI). Pro aktivaci Rab a jeho připojení k membráně je nezbytné odstranění GDI a výměna GDP za GTP. 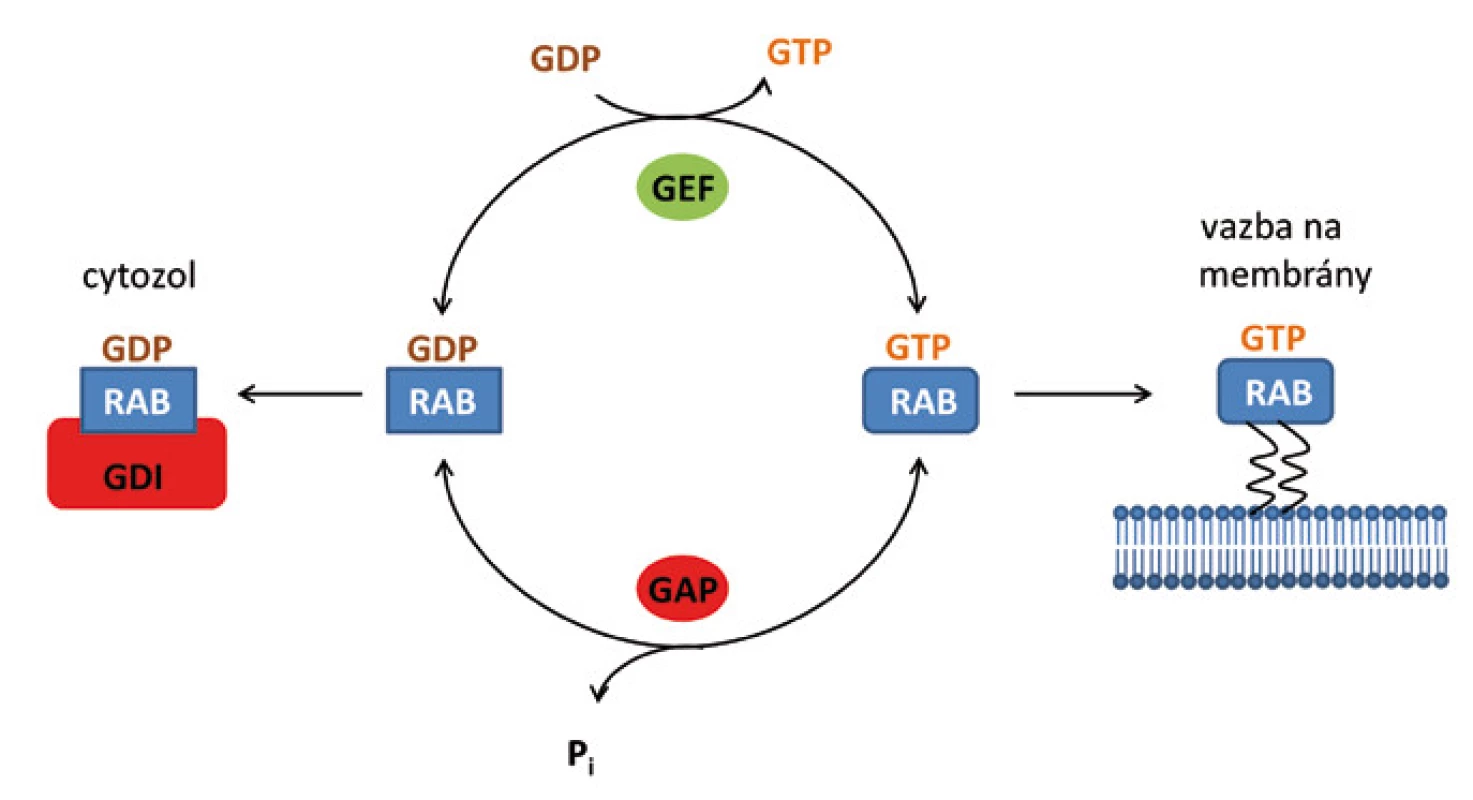
Syntéza proteinů Rab de novo probíhá na ribozomech v cytozolu a vede ke vzniku neaktivních forem Rab-GDP [2]. Pro jejich aktivaci je zapotřebí procesu prenylace. Prenylace proteinů je posttranskripční modifikace, při které jsou na cysteinové zbytky obsažené v proteinových motivech C-terminální oblasti připojeny izoprenoidní zbytky, které molekule dodají hydrofobní charakter a usnadní pozdější spojení daného proteinu s konkrétními místy v cílové membráně. V případě proteinů Rab se jedná o kovalentní připojení geranylové skupiny na dva cysteinové zbytky pomocí enzymu Rab geranylgeranyl transferázy (RGGT) [14]. Pokud není protein Rab prenylován, resp. geranylován, zůstává i nadále v cytozolu buňky. Nově syntetizované proteiny Rab však mají nízkou afinitu k enzymu RGGT. Z tohoto důvodu cytozolický Rab-GDP interaguje s Rab doprovodným proteinem (REP), který napomáhá interakci s RGGT a umožní tak potřebnou modifikaci proteinu [15].
V případě potřeby jsou proteiny Rab směřovány k membráně a dochází k jejich přeměně na aktivní formu. Pro tuto aktivaci je potřeba odstranění GDI a následná výměna GDP za GTP. Regulační protein označovaný GDF podporuje připojení Rab-GDP k membráně. Po připojení může výměna guanozin nukleotidů proběhnout samovolně vlastní aktivitou Rab GTPázy, obvykle je však uskutečněna pomocí regulačního proteinu GEF, který tento proces značně urychluje [16]. Na aktivní komplex Rab-GTP se následně mohou vázat další efektorové molekuly.
Po splnění své funkce je protein Rab inaktivován hydrolýzou GTP, která může proběhnout opět samovolně vlastní GTPázovou aktivitou proteinu Rab nebo s pomocí regulačního proteinu GAP, který hydrolýzu usnadňuje a také urychluje [16]. Po inaktivaci může být Rab-GDP recyklován zpět do donorového kompartmentu za účasti inhibičního regulátoru GDI, kde může být reaktivován a opětovně tak plnit svou funkci (obr. 3) [10].
Obr. 3. Cyklus proteinů Rab v buňce. 1. Nově syntetizovaný protein Rab a průběh prenylace. 2. Odstranění disociačního inhibitoru, aktivace Rab a jeho připojení na membránu. 3. Zapojení jednotlivých regulačních molekul a efektorů, vznik, navedení a transport vezikulu k akceptorové membráně. 4. Hydrolýza GTP a deaktivace Rab proteinu. 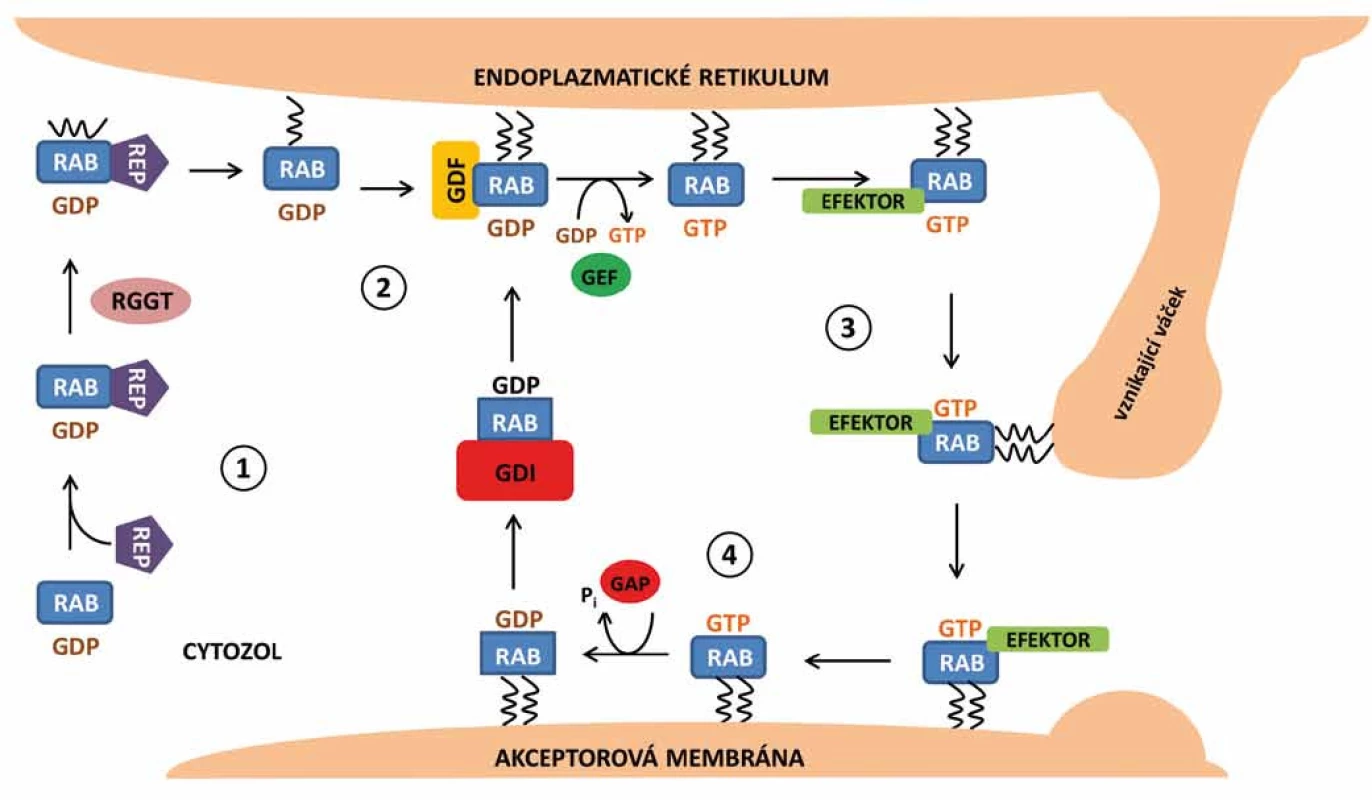
Molekuly regulující aktivitu proteinů Rab
GEFs a GAPs
GEFs vystupují jako pozitivní regulátory cyklu Rab proteinů stimulují výměnu GDP za GTP u proteinu Rab na membráně donorového kompartmentu, čímž podporují vznik jeho aktivní formy [2]. GAPs (GTPase activating proteins) jsou naopak negativní regulátory způsobující hydrolýzu GTP aktivního proteinu, a tedy jeho přeměnu na neaktivní formu [17]. Obsahují regulační doménu TBC s konzervovanou oblastí obsahující aminokyseliny arginin a glutamin, které přispívají ke zrychlení katalytické aktivity GTPázy Rab [18]. Dosud bylo identifikováno nejméně 38 různých lidských GAPs [19]. Většina GEFs a GAPs jsou periferní membránové proteiny, které regulují aktivitu určitých proteinů Rab, a jiné proteiny z rodiny Rab zase mohou řídit jejich funkci. Vzniká tak síť vzájemných pozitivních a negativních interakcí mezi jednotlivými proteiny Rab [1].
GDIs a GDFs
Funkce GDI se uplatňuje po ukončení procesu vezikulárního transportu, resp. po deaktivaci proteinu Rab a jeho disociaci z membrány. GDI preferuje vazbu na neaktivní konformaci Rab-GDP. Váže se na jeho C-terminální prenylovanou část, čímž zabraňuje interakci s membránou a protein je tak udržován v cytozolu buňky [20]. V případě potřeby opětovné aktivace proteinu Rab se uplatní funkce proteinů GDFs, které katalyzují disociaci GDI z proteinu Rab [21].
Mechanizmus působení Rab proteinů
Efektorové molekuly proteinů Rab
Proteiny Rab mohou být k transportním váčkům přidruženy hned při jejich formování na donorové membráně nebo až po určité době od jejich vzniku. Následně jsou vezikuly přemisťovány k cílovým místům pomocí difuze nebo za účasti motorových proteinů cytoskeletu [5].
Proteiny Rab ve své GTP vázané aktivní formě interagují v blízkosti svých cílových membrán s řadou efektorových molekul. Jednotlivé komplexy Rab-efektor se liší svou strukturou a podle typu proteinu Rab také svou lokalizací v buňce [22]. Obecně jsou tyto efektory označovány jako proteiny SNAREs (sol - uble N-ethylmaleimide sensitive factor attachment protein receptors) [19]. Se SNAREs dále interagují SM proteiny (Sec1/Munc18-like proteins) a jiné uvazující (tethering) faktory [23].
Jako uvazující faktory jsou označovány proteiny potřebné k ukotvení váčku k membráně před samotným procesem fúze. Dělí se na dvě hlavní skupiny, které se vyskytují napříč endocytickou i sekreční dráhou [24]. První skupinou jsou homodimerické šroubovicové proteiny (coiled-coil tethering proteins), které díky své délce přibližně 200 nm mohou transportní vezikul vázat na poměrně dlouhou vzdálenost [25]. Druhou skupinu tvoří proteinové komplexy složené z několika podjednotek (multisubunit tethering complexes), které s váčkem interagují na vzdálenost pouze 30 nm po jeho předchozí vazbě s coiled-coil proteinem [26].
SNAREs jsou malé membránové proteiny, které se podle své lokalizace dělí na v-SNAREs (vesicle-SNAREs) a t-SNAREs (target-SNAREs). Při formování transportních vezikulů na donorové membráně jsou do obalu váčku začleňovány v-SNAREs proteiny. Proteiny t-SNAREs jsou naopak lokalizovány na cílových membránách. Při fúzování váčku s membránou dochází k tvorbě šroubovicových trans-komplexů mezi zmiňovanými typy SNAREs [19]. Při iniciaci fúzování hrají důležitou úlohu také rozpustné SM proteiny, které řídí vznik komplexů SNAREs [27].
Fúzování vezikulů s cílovou membránou
Proces splynutí váčku s cílovou membránou je uskutečňován pomocí fúzního aparátu. Předpokladem fúze je dostatečné přiblížení transportního váčku k cílové membráně pomocí uvazujících proteinů. Proteiny Rab se následně uplatňují při řízení a zrychlování interakcí mezi příbuznými v - a t-SNAREs. Jejich vzájemná vazba vede k vytvoření trans-komplexů přibližujících membrány do těsné blízkosti [27]. Mechanizmus následného svázání obou membrán za současného vytvoření fúzního póru dosud není zcela objasněn [12]. Vytvořeným fúzním pórem může rozpustný náklad z vezikulu pronikat do cílové organely [23]. Již během procesu fúze, případně následně po přesunu nákladu do akceptorové organely, dochází k inaktivaci proteinu Rab a k jeho disociaci z membrány.
Vnitrobuněčná lokalizace proteinů Rab
Za podmínek dynamické rovnováhy buňky jsou proteiny Rab akumulovány u svých cílových organel, a mohou být proto považovány za markery těchto jednotlivých buněčných kompartmentů [12]. Distribuce jednotlivých proteinů Rab je z velké části ovlivněna výskytem jejich efektorových molekul [28]. Pro jednotlivé zástupce rodiny Rab je však dosud popsáno jen málo konkrétních efektorů a ty byly nejčastěji identifikovány pomocí kvasinkového dvouhybridního systému nebo metodou afinitní chromatografie. U některých zástupců proteinů Rab nebyly efektory zatím vůbec popsány a jejich funkce tak zůstávají nejasné [29].
Proteiny Rab a nádorová onemocnění
V posledních desetiletích se zvyšuje počet onemocnění, u kterých byla zjištěna souvislost s mutacemi v proteinech Rab či proteinech s nimi spolupracujících. Přibývají důkazy o zapojení proteinů Rab do patologických stavů lidského organizmu, jako jsou selhání imunity, výskyt obezity a diabetu, Alzheimerova choroba, dědičná genetická onemocnění (Carpenterův syndrom, Griscelliho syndrom, Heřmanského-Pudlákův syndrom apod.) nebo nádorová onemocnění [29].
Proteiny Rab jsou klíčové pro proliferaci a migraci nádorových buněk a jejich invazi do extracelulární matrix (ECM), komunikaci se stromálními buňkami a rezistenci vůči léčivům [30]. Z pohledu karcinogeneze se jako zásadní jeví zapojení proteinů Rab do přepravy buněčných povrchových receptorů. V tomto ohledu je pozornost věnována např. EGFR a receptoru pro mannosa-6-fosfát (M6PR) [8]. Transport těchto endocytovaných receptorů a s nimi asociovaných molekul mezi cytoplazmatickou membránou a membránami buněčných organel má za následek selektivní degradaci, recyklaci a sekreci signálních molekul. Deregulace této endocytické dráhy může bránit normální degradaci receptorů nebo naopak vést k jejich nadměrné recyklaci a transportu zpět na buněčný povrch. Následkem těchto odchylek od běžných procesů může být narušení homeostázy buňky a změny proliferace, adhezivity, polarity i dalších vlastností buněk, které úzce souvisejí s procesem karcinogeneze [2]. Přehled vybraných proteinů Rab a jejich exprese u nádorových onemocnění jsou shrnuty v tab. 1 [31–68].
Dosud bylo popsáno několik mechanizmů, jakými mohou proteiny Rab ovlivňovat maligní transformaci buněk a růst nádorů.
Změny exprese proteinů Rab v nádorových buňkách
U nádorových buněk zatím nebyla nalezena žádná aktivující mutace genů RAB, u různých typů nádorů však byly identifikovány odchylky v expresi proteinů Rab, které souvisejí se změnami v membránovém přenosu [69]. Příkladem jsou proteiny Rab1b, Rab4b, Rab10, Rab22a nebo Rab24, jejichž exprese je zvýšena u hepatocelulárního karcinomu [70].
Hladiny proteinů Rab1 a Rab2, které zajišťují transport mezi ER a GA, jsou zvýšeny u karcinomu jazyka [31] a vysoká hladina Rab20 byla zjištěna u karcinomu pankreatu a triple negativního karcinomu prsu [71,72].
Ze studií expresních profilů mikroRNA (miRNA) u nádorových vzorků je zřejmé, že snížení hladiny některých miRNA je spojeno s vysokou expresí proteinů Rab. Příkladem je miR-9 a Rab34, let-7a a Rab40c u karcinomu žaludku [73,74] nebo has-miR-373 a Rab22a u karcinomu střeva [75]. Zároveň mohou být geny RAB hypermetylovány a jejich exprese potlačena, příkladem je Rab32 u karcinomu střeva a žaludku [63,64] nebo Rab37 u metastazujícího karcinomu plic [66].
Z veřejně dostupných databází expresního profilování vyplývá, že exprese genů RAB je snížena nebo zvýšena u všech typů nádorů kromě myelomů [76]. Pro správnou funkci intracelulárního transportu je patrně nutné udržení správné hladiny proteinů Rab, exprese téhož proteinu totiž může být u jednoho typu nádorového onemocnění zvýšena, zatímco u jiného typu snížena. Příkladem je protein Rab3, který patří do podrodiny Rab5 a je lokalizován především do TGN, kde reguluje membránový přenos z TGN do raných endozomů [77]. Rab31 je silně produkován u karcinomu prsu a je považován za potenciální marker metastáz [62]. Zvýšená exprese Rab31 byla identifikována také u nádorů mozku, kůže, slinných žláz, pankreatu, ledvin či hlavy a krku, nicméně u buněk nádoru plic a střeva a u leukemií byla nalezena výrazně snížená hladina Rab31 [76].
Tab. 1. Přehled deregulace exprese proteinů Rab u různých typů nádorů. 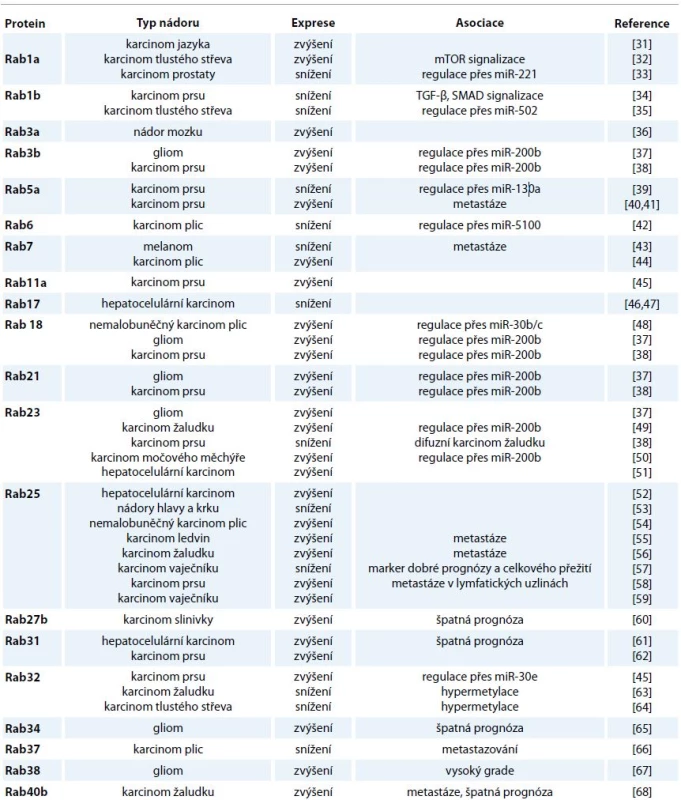
Regulace přenosu integrinu a migrace buněk
Základní charakteristikou metastazujících buněk je jejich schopnost migrace, vniknutí do ECM a formování metastáz ve vzdálených orgánech. Proteiny podrodiny Rab11 (Rab11a, Rab11b, Rab25) a jejich efektory hrají klíčovou úlohu v migraci buněk prostřednictvím regulace transportu a recyklace integrinů.
Nejlépe charakterizovaný je protein Rab25, který je spojován s nádory epiteliálního původu. Vysoká hladina Rab25 byla identifikována u agresivních forem karcinomu prsu a vaječníku [78]. Zvýšená hladina Rab25 v nádorových buňkách (A2780 a HEY) podporuje růst xenograftů v myších [79], naopak snížení hladiny Rab25 pomocí RNA interference (RNAi) vede k potlačení růstu nádoru [80]. Zvýšení hladiny Rab25 u buněk odvozených od karcinomu prsu a vaječníků podporuje růst buněk bez závislosti na ukotvení k povrchu, zvyšuje jejich viabilitu, snižuje expresi proapoptotického genu BAX a zvedá fosforylaci proteinu Akt. Při odstranění Rab25 pomocí RNAi dochází k opačnému efektu – k nárůstu apoptózy vyvolané hladověním buněk nebo působením UV záření [79]. Vysoká hladina Rab25 u buněk A2780 odvozených od karcinomu vaječníku podporuje recyklaci integrinu α5β1 prostřednictvím vazby s podjednotkou β1, zvyšuje invazi buněk v 3D matrix, a tím potenciálně ovlivňuje metastazování nádorů [81]. Nadměrná exprese Rab25 u buněk SKOV-3 (odvozených od karcinomu vaječníku) podporuje signalizaci PI3K/Akt a zvyšuje odolnost buněk vůči cisplatině [82].
Vysoká hladina Rab25 je spojena i s dalšími typy nádorů, jako je testikulární karcinom [83], Wilmsův karcinom [84], karcinom močového měchýře nebo hepatocelulární karcinom [70,85]. Naopak ztráta exprese Rab25 byla zaznamenána u triple negativních karcinomů prsu [86] nebo adenokarcinomů tlustého střeva, kde je spojena se špatnou prognózou onemocnění [87].
Rab25 je úzce příbuzný s Rab11 a může se vázat s jeho efektorem (Rab11FIP1/ /RCP) [88], který řídí recyklaci integrinu α5β1 a EGFR a ovlivňuje tak buněčnou migraci [89]. V této souvislosti byla popsána úloha Rab11 v recyklaci integrinu α6β4 a invazivitě buněk karcinomu prsu vyvolané hypoxií [90].
I další proteiny Rab jako Rab5 a Rab21 regulují transport integrinů. Rab5 a Rab21 jsou lokalizovány především v raných endozomech a plazmatické membráně, kde podporují endocytózu a recyklaci integrinů β1, které ovlivňují adhezi a migraci buněk karcinomu prsu a prostaty (MDA-MB-231 a PC3) [91,92]. Další studie ukázaly, že snížení Rab5 a Rab21 u fibroblastů asociovaných s nádory vede k poklesu hladiny integrinů α5 v plazmatické membráně a k inhibici remodelace ECM, která je nezbytná pro invazi buněk karcinomu dlaždicového epitelu [93]. Navíc se Rab5 a Rab21 vážou s dalším efektorem APPL1, který zprostředkovává EGF signalizaci a buněčnou proliferaci [94]. Zvýšená exprese Rab5 byla popsána u adenokarcinomů plic a hepatocelulárního karcinomu [95,96].
Sekrece proteolytických enzymů a invaze buněk do ECM
Nádorové buňky sekretují mnoho typů proteáz, vč. matrix-metaloproteináz (MMP), které pomáhají buňkám proniknout bazální membránou a ECM a migrovat do vzdálených orgánů. Některé z proteinů Rab ovlivňují sekreci a aktivaci MMP. Příkladem je Rab8, který podporuje sekreci MT1-MMP (membrane-type 1 MMP) a podílí se na invazi a migraci buněk karcinomu prsu [97,98]. Podobně utváří mikroprostředí nádoru Rab4, který kontroluje sekreci prokatepsinu-L. Vysoká hladina Rab4 byla nalezena u melanomů [99]. Naopak Rab7, který snižuje sekreci katepsinu B a ovlivňuje degradaci a recyklaci receptoru c-Met, byl popsán jako negativní regulátor růstu a invazivity buněk karcinomu prostaty [100].
Buněčný cyklus
Aberantní exprese Rab také ovlivňuje průběh buněčného cyklu. Příkladem je Rab27b, který podporuje progresi buněčného cyklu a proliferaci u MCF-7 bu - něk [101], nebo Rab6c lokalizovaný na centrozomech buňky, jehož nadměrná exprese vede k zástavě v G1 fázi buněčného cyklu a naopak odstranění způsobuje vznik tetraploidních buněk [102]. Podobně snížená exprese Rab21 podporuje vznik mnohojaderných buněk a genomovou nestabilitu [103].
Mnohočetná léková rezistence
Změna hladin proteinů Rab může iniciovat vznik mnohočetné lékové rezistence nádorových buněk. Rab4 reguluje hladinu P-gp, glykoproteinu lokalizovaného v membráně, který funguje jako transportér cizorodých látek a může tak snižovat koncentraci a toxicitu protinádorových léčiv v buňce a zvyšovat odolnost nádorových buněk vůči terapii. Hladina Rab4 bývá u rezistentních buněk snížena, stejně jako hladina Rab6c [104]. Naopak nadměrná exprese Rab8 podporuje odolnost buněk vůči působení cisplatiny zvýšením sekrece TMEM205 (cisplatin-resistance associated transmembrane protein 205) [105].
Regulační proteiny GAP/GEF u nádorových buněk
Podobně jako hladiny proteinů Rab mohou být u nádorových buněk pozměněny i hladiny jejich regulačních molekul GAP a GEF. Vysoká hladina PRC17 (GAP pro Rab5) je spojena s karcinomem prostaty a transformací NIH 3T3 fibroblastů [106], TBC1D7, GAP pro Rab17, podporuje růst nádorových buněk a je asociována se špatnou prognózou u karcinomu plic [107]. Narušení funkce p85α (další GAP pro Rab5) způsobuje deregulaci transportu a recyklace PDGFR (platelet-derived growth factor receptor), což vede k zesílení signalizace přes Akt, ztrátě kontaktní inhibice a nádorové transformaci buněk, která se projevuje např. jejich schopností tvořit nádory u „nude“ myší [108].
Závěr
Mutace genů RAB nebo jejich regulátorů byly nalezeny především u vzácných genetických poruch s autozomálně recesivní dědičností [109], nicméně je stále častěji popisován význam deregulace proteinů Rab u nádorových onemocnění. Funkční vnitrobuněčný transport proteinů je nezbytný pro správnou koordinaci signálních drah řídících proliferaci, migraci a invazi buněk a proteiny Rab jsou nezbytné pro komunikaci nádorových a stromálních buněk a formování mikroprostředí nádorů. Proto jsou proteiny Rab slibným terapeutickým cílem, které by v budoucnosti mohly být využívány při léčbě nádorových či jiných onemocnění.
Práce byla podpořena projektem MŠMT – NPU I – LO1413.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Jitka Holčáková, Ph.D.
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: holcakova@mou.cz
Obdrženo: 13. 5. 2016
Přijato: 31. 5. 2016
Zdroje
1. Hutagalung AH, Novick PJ. Role of Rab GTPases in membrane traffic and cell physiology. Physiol Rev 2011; 91 (1): 119–149. doi: 10.1152/physrev.00059.2009.
2. Mitra S, Cheng KW, Mills GB. Rab GTPases implicated in inherited and acquired disorders. Semin Cell Dev Biol 2011; 22 (1): 57–68. doi: 10.1016/j.semcdb.2010.12.005.
3. Brighouse A, Dacks JB, Field MC. Rab protein evolution and the history of the eukaryotic endomembrane system. Cell Mol Life Sci 2010; 67 (20): 3449–3465. doi: 10.1007/s00018-010-0436-1.
4. Scita G, Di Fiore PP. The endocytic matrix. Nature 2010; 463 (7280): 464–473. doi: 10.1038/nature08910.
5. Cottam NP, Ungar D. Retrograde vesicle transport in the Golgi. Protoplasma 2012; 249 (4): 943–955.
6. Beck R, Rawet M, Wieland FT et al. The COPI system: molecular mechanisms and function. FEBS Lett 2009; 583 (17): 2701–2709. doi: 10.1016/j.febslet.2009.07.032.
7. Nakano A, Luini A. Passage through the Golgi. Curr Opin Cell Biol 2010; 22 (4): 471–478. doi: 10.1016/j.ceb.2010.05.003.
8. Ng EL, Gan BQ, Ng F et al. Rab GTPases regulating receptor trafficking at the late endosome-lysosome membranes. Cell Biochem Funct 2012; 30 (6): 515–523. doi: 10.1002/cbf.2827.
9. Zhang J, Fonovic M, Suyama K et al. Rab35 controls actin bundling by recruiting fascin as an effector protein. Science 2009; 325 (5945): 1250–1254. doi: 10.1126/science.1174921.
10. Seabra MC, Mules EH, Hume AN. Rab GTPases, intracellular traffic and disease. Trends Mol Med 2002; 8 (1): 23–30.
11. Pereira-Leal JB, Seabra MC. The mammalian Rab family of small GTPases: definition of family and subfamily sequence motifs suggests a mechanism for functional specificity in the Ras superfamily. J Mol Biol 2000; 301 (4): 1077–1087.
12. Bhuin T, Roy JK. Rab proteins: the key regulators of intracellular vesicle transport. Exp Cell Res 2014; 328 (1): 1–19. doi: 10.1016/j.yexcr.2014.07.027.
13. Li F, Yi L, Zhao L et al. The role of the hypervariable C-terminal domain in Rab GTPases membrane targeting. Proc Natl Acad Sci U S A 2014; 111 (7): 2572–2577. doi: 10.1073/pnas.1313655111.
14. Gomes AQ, Ali BR, Ramalho JS et al. Membrane targeting of Rab GTPases is influenced by the prenylation motif. Mol Biol Cell 2003; 14 (5): 1882–1899.
15. Wu YW, Tan KT, Waldmann H et al. Interaction analysis of prenylated Rab GTPase with Rab escort protein and GDP dissociation inhibitor explains the need for both regulators. Proc Natl Acad Sci U S A 2007; 104 (30): 12294–12299.
16. Barr F, Lambright DG. Rab GEFs and GAPs. Curr Opin Cell Biol 2010; 22 (4): 461–470. doi: 10.1016/j.ceb.2010.04.007.
17. Dumas JJ, Zhu Z, Connolly JL et al. Structural basis of activation and GTP hydrolysis in Rab proteins. Structure 1999; 7 (4): 413–423.
18. Pan X, Eathiraj S, Munson M et al. TBC-domain GAPs for Rab GTPases accelerate GTP hydrolysis by a dual-finger mechanism. Nature 2006; 442 (7100): 303–306.
19. Stenmark H. Rab GTPases as coordinators of vesicle traffic. Nat Rev Mol Cell Biol 2009; 10 (8): 513–525. doi: 10.1038/nrm2728.
20. Epp N, Rethmeier R, Kramer L et al. Membrane dynamics and fusion at late endosomes and vacuoles-Rab regulation, multisubunit tethering complexes and SNAREs. Eur J Cell Biol 2011; 90 (9): 779–785. doi: 10.1016/j.ejcb.2011.04.007.
21. Dirac-Svejstrup AB, Sumizawa T, Pfeffer SR. Identification of a GDI displacement factor that releases endosomal Rab GTPases from Rab-GDI. EMBO J 1997; 16 (3): 465–472.
22. Kawasaki M, Nakayama K, Wakatsuki S. Membrane recruitment of effector proteins by Arf and Rab GTPases. Curr Opin Struct Biol 2005; 15 (6): 681–689.
23. Sztul E, Lupashin V. Role of tethering factors in secretory membrane traffic. Am J Physiol Cell Physiol 2006; 290 (1): C11–C26.
24. Chia PZ, Gleeson PA. Membrane tethering. F1000Prime Rep 2014; 6 : 74. doi: 10.12703/P6-74.
25. Brocker C, Engelbrecht-Vandre S, Ungermann C. Multisubunit tethering complexes and their role in membrane fusion. Curr Biol 2010; 20 (21): R943–R952. doi: 10.1016/j.cub.2010.09.015.
26. Yu IM, Hughson FM. Tethering factors as organizers of intracellular vesicular traffic. Annu Rev Cell Dev Biol 2010; 26 : 137–156. doi: 10.1146/annurev.cellbio.042308.113327.
27. Jahn R, Lang T, Sudhof TC. Membrane fusion. Cell 2003; 112 (4): 519–533.
28. Ortiz Sandoval C, Simmen T. Rab proteins of the endoplasmic reticulum: functions and interactors. Biochem Soc Trans 2012; 40 (6): 1426–1432. doi: 10.1042/BST20120158.
29. Gillingham AK, Sinka R, Torres IL et al. Toward a comprehensive map of the effectors of rab GTPases. Dev Cell 2014; 31 (3): 358–373. doi: 10.1016/j.devcel.2014.10.007.
30. Recchi C, Seabra MC. Novel functions for Rab GTPases in multiple aspects of tumour progression. Biochem Soc Trans 2012; 40 (6): 1398–1403. doi: 10.1042/BST20120199.
31. Shimada K, Uzawa K, Kato M et al. Aberrant expression of RAB1A in human tongue cancer. Br J Cancer 2005; 92 (10): 1915–1921.
32. Thomas JD, Zhang YJ, Wei YH et al. Rab1A is an mTORC1 activator and a colorectal oncogene. Cancer Cell 2014; 26 (5): 754–769. doi: 10.1016/j.ccell.2014.09.008.
33. Sun T, Wang X, He HH et al. MiR-221 promotes the development of androgen independence in prostate cancer cells via downregulation of HECTD2 and RAB1A. Oncogene 2014; 33 (21): 2790–2800. doi: 10.1038/onc.2013.230.
34. Jiang HL, Sun HF, Gao SP et al. Loss of RAB1B promotes triple-negative breast cancer metastasis by activating TGF-beta/SMAD signaling. Oncotarget 2015; 6 (18): 16352–16365.
35. Zhai H, Song B, Xu X et al. Inhibition of autophagy and tumor growth in colon cancer by miR-502. Oncogene 2013; 32 (12): 1570–1579. doi: 10.1038/onc.2012.167.
36. Kim JK, Lee SY, Park CW et al. Rab3a promotes brain tumor initiation and progression. Mol Biol Rep 2014; 41 (9): 5903–5911. doi: 10.1007/s11033-014-3465-2.
37. Liu Q, Tang H, Liu X et al. miR-200b as a prognostic factor targets multiple members of RAB family in glioma. Med Oncol 2014; 31 (3): 859. doi: 10.1007/s12032-014-0859-x.
38. Ye F, Tang H, Liu Q et al. miR-200b as a prognostic factor in breast cancer targets multiple members of RAB family. J Transl Med 2014; 12 : 17. doi: 10.1186/1479-5876-12-17.
39. Pan Y, Wang R, Zhang F et al. MicroRNA-130a inhibits cell proliferation, invasion and migration in human breast cancer by targeting the RAB5A. Int J Clin Exp Pathol 2015; 8 (1): 384–393.
40. Yang PS, Yin PH, Tseng LM et al. Rab5A is associated with axillary lymph node metastasis in breast cancer patients. Cancer Sci 2011; 102 (12): 2172–2178. doi: 10.1111/j.1349-7006.2011.02089.x.
41. Chen Q, Liu WY, Zhao Z et al. Expression and significance of Rab5a and APPL1 in breast cancer. Zhonghua Zhong Liu Za Zhi 2012; 34 (11): 838–841. doi: 10.3760/ cma.j.issn.0253-3766.2012.11.009.
42. Huang H, Jiang Y, Wang Y et al. miR-5100 promotes tumor growth in lung cancer by targeting Rab6. Cancer Lett 2015; 362 (1): 15–24. doi: 10.1016/j.canlet.2015.03.004.
43. Alonso-Curbelo D, Osterloh L, Canon E et al. RAB7 counteracts PI3K-driven macropinocytosis activated at early stages of melanoma development. Oncotarget 2015; 6 (14): 11848–11862.
44. Nakano T, Shimizu K, Kawashima O et al. Establishment of a human lung cancer cell line with high metastatic potential to multiple organs: gene expression associated with metastatic potential in human lung cancer. Oncol Rep 2012; 28 (5): 1727–1735. doi: 10.3892/or.2012.1 972.
45. Lin Z, Li JW, Wang Y et al. Abnormal miRNA-30e expression is associated with breast cancer progression. Clin Lab 2016; 62 (1–2): 121–128.
46. Qi J, Zhao P, Li F et al. Down-regulation of Rab17 promotes tumourigenic properties of hepatocellular carcinoma cells via Erk pathway. Int J Clin Exp Pathol 2015; 8 (5): 4963–4971.
47. Wang K, Mao Z, Liu L et al. Rab17 inhibits the tumourigenic properties of hepatocellular carcinomas via the Erk pathway. Tumour Biol 2015; 36 (8): 5815–5824. doi: 10.1007/s13277-015-3251-3.
48. Zhong K, Chen K, Han L et al. MicroRNA-30b/c inhibits non-small cell lung cancer cell proliferation by targeting Rab18. BMC Cancer 2014; 14 : 703. doi: 10.1186/1471-2407-14-703.
49. Hou Q, Wu YH, Grabsch H et al. Integrative genomics identifies RAB23 as an invasion mediator gene in diffuse-type gastric cancer. Cancer Res 2008; 68 (12): 4623–4630. doi: 10.1158/0008-5472.CAN-07-5870.
50. Jiang Y, Han Y, Sun C et al. Rab23 is overexpressed in human bladder cancer and promotes cancer cell proliferation and invasion. Tumour Biol 2015; 37 (6): 8131–8138. doi: 10.1007/s13277-015-4590-9.
51. Liu YJ, Wang Q, Li W et al. Rab23 is a potential biological target for treating hepatocellular carcinoma. World J Gastroenterol 2007; 13 (7): 1010–1017.
52. Geng D, Zhao W, Feng Y et al. Overexpression of Rab25 promotes hepatocellular carcinoma cell proliferation and invasion. Tumour Biol 2015; 37 (6): 7713–7718. doi: 10.1007/s13277-015-4606-5.
53. Amornphimoltham P, Rechache K, Thompson J et al. Rab25 regulates invasion and metastasis in head and neck cancer. Clin Cancer Res 2013; 19 (6): 1375–1388. doi: 10.1158/1078-0432.CCR-12-2858.
54. Ma YF, Yang B, Li J et al. Expression of Ras-related protein 25 predicts chemotherapy resistance and prognosis in advanced non-small cell lung cancer. Genet Mol Res 2015; 14 (4): 13998–14008.
55. Li Y, Jia Q, Zhang Q et al. Rab25 upregulation correlates with the proliferation, migration, and invasion of renal cell carcinoma. Biochem Biophys Res Commun 2015; 458 (4): 745–750. doi: 10.4238/2015.
56. Liu L, Ding G. Rab25 expression predicts poor prognosis in clear cell renal cell carcinoma. Exp Ther Med 2014; 8 (4): 1055–1058.
57. No JH, Kim K, Park KH et al. Cell-free DNA level as a prognostic biomarker for epithelial ovarian cancer. Anticancer Res 2012; 32 (8): 3467–3471.
58. Yin YX, Shen F, Pei H et al. Increased expression of Rab25 in breast cancer correlates with lymphatic metastasis. Tumour Biol 2012; 33 (5): 1581–1587. doi: 10.1007/s13277-012-0412-5.
59. Gomez-Roman N, Sahasrabudhe NM, McGregor F et al. Hypoxia-inducible factor 1 alpha is required for the tumourigenic and aggressive phenotype associated with Rab25 expression in ovarian cancer. Oncotarget 2016; 7 (16): 22650–22664. doi: 10.18632/oncotarget.7998.
60. Zhao H, Wang Q, Wang X et al. Correlation between RAB27B and p53 expression and overall survival in pancreatic cancer. Pancreas 2016; 45 (2): 204–210. doi: 10.1097/MPA.0000000000000453.
61. Sui Y, Zheng X, Zhao D. Rab31 promoted hepatocellular carcinoma (HCC) progression via inhibition of cell apoptosis induced by PI3K/AKT/Bcl-2/BAX pathway. Tumour Biol 2015; 36 (11): 8661–8670. doi: 10.1007/s13277-015-3626-5.
62. Kotzsch M, Sieuwerts AM, Grosser M et al. Urokinase receptor splice variant uPAR-del4/5-associated gene expression in breast cancer: identification of rab31 as an independent prognostic factor. Breast Cancer Res Treat 2008; 111 (2): 229–240.
63. Shibata D, Mori Y, Cai K et al. RAB32 hypermethylation and microsatellite instability in gastric and endometrial adenocarcinomas. Int J Cancer 2006; 119 (4): 801–806.
64. Mori Y, Yin J, Sato F et al. Identification of genes uniquely involved in frequent microsatellite instability colon carcinogenesis by expression profiling combined with epigenetic scanning. Cancer Res 2004; 64 (7): 2434–2438.
65. Wang HJ, Gao Y, Chen L et al. RAB34 was a progression - and prognosis-associated biomarker in gliomas. Tumour Biol 2015; 36 (3): 1573–1578. doi: 10.1007/s13277-014-2732-0.
66. Wu CY, Tseng RC, Hsu HS et al. Frequent down-regulation of hRAB37 in metastatic tumor by genetic and epigenetic mechanisms in lung cancer. Lung Cancer 2009; 63 (3): 360–367. doi: 10.1016/j.lungcan.2008.06.014.
67. Wang H, Jiang C. RAB38 confers a poor prognosis, associated with malignant progression and subtype preference in glioma. Oncol Rep 2013; 30 (5): 2350–2356. doi: 10.3892/or.2013.2730.
68. Li Y, Jia Q, Wang Y et al. Rab40b upregulation correlates with the prognosis of gastric cancer by promoting migration, invasion, and metastasis. Med Oncol 2015; 32 (4): 126. doi: 10.1007/s12032-015-0562-6.
69. Rhodes DR, Kalyana-Sundaram S, Mahavisno V et al. Oncomine 3.0: genes, pathways, and networks in a collection of 18,000 cancer gene expression profiles. Neoplasia 2007; 9 (2): 166–180.
70. He H, Dai F, Yu L et al. Identification and characterization of nine novel human small GTPases showing variable expressions in liver cancer tissues. Gene Expr 2002; 10 (5–6): 231–242.
71. Amillet JM, Ferbus D, Real FX et al. Characterization of human Rab20 overexpressed in exocrine pancreatic carcinoma. Hum Pathol 2006; 37 (3): 256–263.
72. Turner N, Lambros MB, Horlings HM et al. Integrative molecular profiling of triple negative breast cancers identifies amplicon drivers and potential therapeutic targets. Oncogene 2010; 29 (14): 2013–2023. doi: 10.1038/onc.2009.489.
73. Luo H, Zhang H, Zhang Z et al. Down-regulated miR-9 and miR-433 in human gastric carcinoma. J Exp Clin Cancer Res 2009; 28 : 82. doi: 10.1186/1756-9966-28-82.
74. Yang Q, Jie Z, Cao H et al. Low-level expression of let-7a in gastric cancer and its involvement in tumorigenesis by targeting RAB40C. Carcinogenesis 2011; 32 (5): 713–722. doi: 10.1093/carcin/bgr035.
75. Tanaka T, Arai M, Wu S et al. Epigenetic silencing of microRNA-373 plays an important role in regulating cell proliferation in colon cancer. Oncol Rep 2011; 26 (5): 1329–1335. doi: 10.3892/or.2011.1401.
76. Li G. Rab GTPases, membrane trafficking and diseases. Curr Drug Targets 2011; 12 (8): 1188–1193.
77. Rodriguez-Gabin AG, Cammer M, Almazan G et al. Role of rRAB22b, an oligodendrocyte protein, in regulation of transport of vesicles from trans Golgi to endocytic compartments. J Neurosci Res 2001; 66 (6): 1149–1160.
78. Cheng KW, Lahad JP, Gray JW et al. Emerging role of RAB GTPases in cancer and human disease. Cancer Res 2005; 65 (7): 2516–2519.
79. Cheng KW, Lahad JP, Kuo WL et al. The RAB25 small GTPase determines aggressiveness of ovarian and breast cancers. Nat Med 2004; 10 (11): 1251–1256.
80. Fan Y, Xin XY, Chen BL et al. Knockdown of RAB25 expression by RNAi inhibits growth of human epithelial ovarian cancer cells in vitro and in vivo. Pathology 2006; 38 (6): 561–567.
81. Caswell PT, Spence HJ, Parsons M et al. Rab25 associates with alpha5beta1 integrin to promote invasive migration in 3D microenvironments. Dev Cell 2007; 13 (4): 496–510.
82. Fan Y, Wang L, Han X et al. Rab25 is responsible for phosphoinositide 3-kinase/AKTmediated cisplatin resistance in human epithelial ovarian cancer cells. Mol Med Rep 2015; 11 (3): 2173–2178. doi: 10.3892/mmr.2014.2963.
83. Korkola JE, Heck S, Olshen AB et al. In vivo differentiation and genomic evolution in adult male germ cell tumors. Genes Chromosomes Cancer 2008; 47 (1): 43–55.
84. Agarwal R, Jurisica I, Mills GB et al. The emerging role of the RAB25 small GTPase in cancer. Traffic 2009; 10 (11): 1561–1568. doi: 10.1111/j.1600-0854.2009.00969.x.
85. Mor O, Nativ O, Stein A et al. Molecular analysis of transitional cell carcinoma using cDNA microarray. Oncogene 2003; 22 (48): 7702–7710.
86. Cheng JM, Ding M, Aribi A et al. Loss of RAB25 expression in breast cancer. Int J Cancer 2006; 118 (12): 2957–2964.
87. Nam KT, Lee HJ, Smith JJ et al. Loss of Rab25 promotes the development of intestinal neoplasia in mice and is associated with human colorectal adenocarcinomas. J Clin Invest 2010; 120 (3): 840–849. doi: 10.1172/JCI40728.
88. Hales CM, Griner R, Hobdy-Henderson KC et al. Identification and characterization of a family of Rab11-interacting proteins. J Biol Chem 2001; 276 (42): 39067–39075.
89. Caswell PT, Chan M, Lindsay AJ et al. Rab-coupling protein coordinates recycling of alpha5beta1 integrin and EGFR1 to promote cell migration in 3D microenvironments. J Cell Biol 2008; 183 (1): 143–155. doi: 10.1083/jcb.200804140.
90. Yoon SO, Shin S, Mercurio AM. Hypoxia stimulates carcinoma invasion by stabilizing microtubules and promoting the Rab11 trafficking of the alpha6beta4 integrin. Cancer Res 2005; 65 (7): 2761–2769.
91. Pellinen T, Arjonen A, Vuoriluoto K et al. Small GTPase Rab21 regulates cell adhesion and controls endosomal traffic of beta1-integrins. J Cell Biol 2006; 173 (5): 767–780.
92. Mendoza P, Diaz J, Silva P et al. Rab5 activation as a tumor cell migration switch. Small GTPases 2014; 5 (1).
93. Hooper S, Gaggioli C, Sahai E. A chemical biology screen reveals a role for Rab21-mediated control of actomyosin contractility in fibroblast-driven cancer invasion. Br J Cancer 2010; 102 (2): 392–402. doi: 10.1038/sj.bjc.6605469.
94. Rink J, Ghigo E, Kalaidzidis Y et al. Rab conversion as a mechanism of progression from early to late endosomes. Cell 2005; 122 (5): 735–749.
95. Li Y, Meng X, Feng H et al. Over-expression of the RAB5 gene in human lung adenocarcinoma cells with high metastatic potential. Chin Med Sci J 1999; 14 (2): 96–101.
96. Fukui K, Tamura S, Wada A et al. Expression of Rab5a in hepatocellular carcinoma: possible involvement in epidermal growth factor signaling. Hepatol Res 2007; 37 (11): 957–965.
97. Bravo-Cordero JJ, Marrero-Diaz R, Megias D et al. MT1-MMP proinvasive activity is regulated by a novel Rab8-dependent exocytic pathway. EMBO J 2007; 26 (6): 1499–1510.
98. Williams KC, Coppolino MG. Phosphorylation of membrane type 1-matrix metalloproteinase (MT1-MMP) and its vesicle-associated membrane protein 7 (VAMP7) -dependent trafficking facilitate cell invasion and migration. J Biol Chem 2011; 286 (50): 43405–43416. doi: 10.1074/jbc.M111.297069.
99. Barbarin A, Frade R. Procathepsin L secretion, which triggers tumour progression, is regulated by Rab4a in human melanoma cells. Biochem J 2011; 437 (1): 97–107. doi: 10.1042/BJ20110361.
100. Steffan JJ, Dykes SS, Coleman DT et al. Supporting a role for the GTPase Rab7 in prostate cancer progression. PLoS One 2014; 9 (2): e87882. doi: 10.1371/journal.pone.0087882.
101. Hendrix A, Braems G, Bracke M et al. The secretory small GTPase Rab27B as a marker for breast cancer progression. Oncotarget 2010; 1 (4): 304–308.
102. Young J, Menetrey J, Goud B. RAB6C is a retrogene that encodes a centrosomal protein involved in cell cycle progression. J Mol Biol 2010; 397 (1): 69–88. doi: 10.1016/j.jmb.2010.01.009.
103. Pellinen T, Tuomi S, Arjonen A et al. Integrin trafficking regulated by Rab21 is necessary for cytokinesis. Dev Cell 2008; 15 (3): 371–385. doi: 10.1016/j.devcel.2008.08.001.
104. Ferrandiz-Huertas C, Fernandez-Carvajal A, Ferrer - -Montiel A. Rab4 interacts with the human P-glycoprotein and modulates its surface expression in multidrug resistant K562 cells. Int J Cancer 2011; 128 (1): 192–205. doi: 10.1002/ijc.25310.
105. Shen DW, Gottesman MM. RAB8 enhances TMEM205-mediated cisplatin resistance. Pharm Res 2012; 29 (3): 643–650. doi: 10.1007/s11095-011-0562-y.
106. Pei L, Peng Y, Yang Y et al. PRC17, a novel oncogene encoding a Rab GTPase-activating protein, is amplified in prostate cancer. Cancer Res 2002; 62 (19): 5420–5424.
107. Sato N, Koinuma J, Ito T et al. Activation of an oncogenic TBC1D7 (TBC1 domain family, member 7) protein in pulmonary carcinogenesis. Genes Chromosomes Cancer 2010; 49 (4): 353–367. doi: 10.1002/gcc.20747.
108. Chamberlain MD, Chan T, Oberg JC et al. Disrupted RabGAP function of the p85 subunit of phosphatidylinositol 3-kinase results in cell transformation. J Biol Chem 2008; 283 (23): 15861–15868. doi: 10.1074/jbc.M800941200.
109. Jenkins D, Seelow D, Jehee FS et al. RAB23 mutations in Carpenter syndrome imply an unexpected role for hedgehog signaling in cranial-suture development and obesity. Am J Hum Genet 2007; 80 (6): 1162–1170.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Editorial
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2016 Číslo Supplementum 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Vícestupňový proces vzniku vzdálených metastáz u karcinomů
- Mechanizmy regulace proteinové homeostázy ve vývoji nádorových onemocnění
- Chaperony endoplazmatického retikula na povrchu nádorové buňky a v extracelulárním prostředí
- Editorial
- Proteiny Rab, vnitrobuněčný transport a nádorová onemocnění
- Vplyv inhibície HSP90 na viabilitu a bunkový cyklus v závislosti od stavu p53
- Molekulární podstata kancerogeneze epiteliálních ovariálních karcinomů
- Tvorba hmotnostne spektrometrických spektrálnych knižníc nádorových bunečných línií
- Využití metody vodík/deuteriové výměny v biofarmaceutickém průmyslu
- Nádorové buňky jako dynamický systém – molekulární a fenotypové změny v průběhu vzniku, progrese a šíření nádoru
- Nové metody studia metylace DNA – MS-HRM analýza a elektrochemie
- Úloha PD-1/PD-L1 signalizace v protinádorové imunitní odpovědi
- Nemalobuněčný karcinom plic – od imunobiologie k imunoterapii
- Nové technologie používané pro in vivo diagnostiku nádorů
- Pokroky ve vývoji PET radiofarmak pro pacienty v České republice
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Úloha PD-1/PD-L1 signalizace v protinádorové imunitní odpovědi
- Nemalobuněčný karcinom plic – od imunobiologie k imunoterapii
- Nádorové buňky jako dynamický systém – molekulární a fenotypové změny v průběhu vzniku, progrese a šíření nádoru
- Nové metody studia metylace DNA – MS-HRM analýza a elektrochemie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



