-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Chaperony endoplazmatického retikula na povrchu nádorové buňky a v extracelulárním prostředí
Endoplasmic Reticulum Chaperones at the Tumor Cell Surface and in the Extracellular Space
Background:
Endoplasmic reticulum chaperones are stress induced proteins capable of translocation into cytosol, cell membrane or extracellular space. The chaperones are transported from the endoplasmic reticulum particularly under endoplasmic reticulum stress conditions, while their constitutive extracellular expression was found in many cancers. Cell surface or extracellular endoplasmic reticulum chaperones take up distinct functions compared to their endoplasmic reticulum resident variants because they act like multifunctional receptors and thus affect cell signaling and proliferation.Aim:
The presented review focuses primarily on endoplasmic reticulum chaperones expression on the cell surface of cancer cells and into extracellular space. The work describes possible mechanisms of chaperones translocation to the cancer cell surface, including KDEL transport mechanism and retrotranslocation and the influence of chaperone posttranslation modifications on their localization within the cell. Well described cancer cell surface endoplasmic reticulum chaperones include GRP78, GRP94, calreticulin and calnexin that are involved in cancer cell signaling in different ways. The attention is also paid to immunogenic properties of membrane-localized chaperones for their ability to participate in immune reactions. They can take part in innate and adaptive immune response through their interaction with toll-like receptors or during the antigen presentation as well as in tumor-specific immunity. The expression of endoplasmic reticulum chaperones on the cancer cells surface is potentially exploitable in specific antitumor therapy as well as vaccine therapy, thus the final part of this review is dedicated to this topic.Key words:
endoplasmic reticulum – glucose-regulated proteins – molecular chaperones – KDEL sequence – immunobiology
This work was supported by the project MEYS – NPS I – LO1413.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
17. 5. 2016Accepted:
20. 7. 2016
Autoři: V. Brychtová; B. Vojtěšek
Působiště autorů: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
Vyšlo v časopise: Klin Onkol 2016; 29(Supplementum 4): 25-30
Kategorie: Přehled
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko20164S25Souhrn
Východiska:
Chaperony endoplazmatického retikula jsou stresem indukované proteiny, které mohou být translokovány mimo endoplazmatické retikulum do cytozolu, buněčné membrány, případně extracelulárního prostředí. K transportu chaperonů z endoplazmatického retikula dochází především za podmínek stresu endoplazmatického retikula, přičemž konstitutivní extracelulární exprese chaperonů byla zaznamenána u nádorových onemocnění. Chaperony endoplazmatického retikula lokalizované na povrchu buněk nebo v extracelulárním prostředí zastávají odlišné funkce ve srovnání s jejich endoplazmaticko-retikulárně rezidentní variantou, neboť se chovají jako multifunkční receptory a ovlivňují tak buněčnou signalizaci a proliferaci.Cíl:
Předkládaná přehledová práce se zaměřuje především na expresi chaperonů endoplazmatického retikula na povrchu nádorových buněk a v extracelulárním prostředí. Popisuje možné mechanizmy translokace chaperonů endoplazmatického retikula na povrch nádorových buněk zahrnující KDEL transportní mechanizmus a retrotranslokační dráhu a dále vliv posttranslačních modifikací chaperonů na jejich lokalizaci v buňce. K nejvíce popsaným chaperonům endoplazmatického retikula detekovaným na membráně nádorových buněk patří GRP78, GRP94, kalretikulin a kalnexin, které se různým způsobem podílejí na signalizaci nádorových buněk. Pozornost je dále věnována imunogenním vlastnostem membránově lokalizovaných chaperonů, neboť tyto chaperony se mohou účastnit imunitních reakcí buněk. Prostřednictvím interakcí s toll-like receptory nebo při prezentaci antigenů se tak mohou podílet na vrozené i adaptivní imunitní odpovědi organizmu a také nádorově-specifické imunitě. Exprese chaperonů na povrchu nádorových buněk je potenciálně využitelná ve specificky cílené protinádorové léčbě, stejně tak jako při přípravě léčebných vakcín, proto je závěrečná část práce věnována tomuto tématu.Klíčová slova:
endoplazmatické retikulum – glukózou regulované proteiny – molekulární chaperony – KDEL sekvence – imunobiologieÚvod
Endoplazmatické retikulum (ER) a navazující Golgiho komplex je nepostradatelný buněčný aparát, ve kterém probíhá velké množství procesů vč. biosyntézy proteinů, jejich sbalení do stabilního prostorového uspořádání a následné posttranslační modifikace. Globulární proteiny se v buňkách mohou za určitých podmínek vyskytovat v nesbalené nebo jen částečně sbalené formě, a to bezprostředně po vlastní biosyntéze nebo při průchodu buněčnými membránami. K denaturaci proteinu nebo nedokonalému skládání naopak dochází za stresových podmínek, jako je vyšší teplota, změna pH nebo hypoxie. Základní ochranu buňky před vznikem denaturovaných a agregujících proteinů zajišťují molekulární chaperony. Chaperony lze zařadit do několika vzájemně nepříbuzných rodin proteinů, které se kromě prevence vzniku amorfních proteinových agregátů podílejí i na regulaci vápníkového metabolizmu buňky. Mezi nejvíce abundantní luminální chaperony ER patří glukózou regulované proteiny (GRP), které zahrnují protein GRP78 kódovaný genem HSPA5, dále protein GRP94 kódovaný genem HSP90B1, protein GRP170 kódovaný genem HYOU1 a protein GRP75 kódovaný genem HSPA9 z rodiny proteinů teplotního šoku (heat shock proteins – HSP) a multifunkční protein kalretikulin. Molekulární chaperony se dělí do několika rodin na základě molekulové hmotnosti (pro přehlednost tab. 1). Kromě chaperonů obsahuje lumen ER množství enzymů, které se také účastní formování prostorového uspořádání proteinů. Patří mezi ně enzymy z rodiny protein disulfid izomeráz (PDI) s nejvíce zastoupenými ERP57 a PDI a skupina protein prolyl izomeráz [1,2].
Tab. 1. Rozdělení molekulárních chaperonů do rodin. 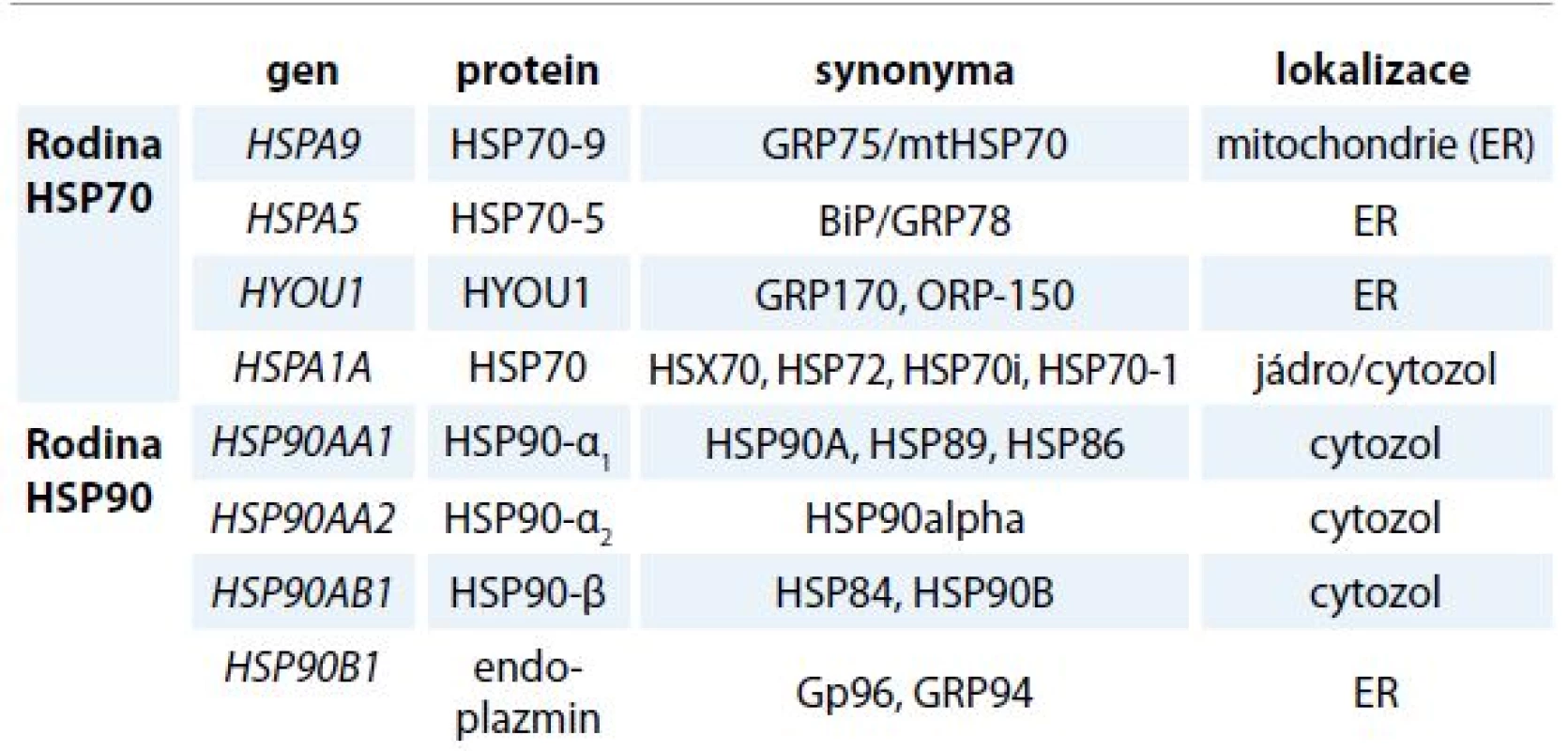
ER – endoplazmatické retikulum Vysoká intracelulární hladina chaperonů je typická pro většinu nádorů a je dána zvýšenou proteosyntézou a nároky na kapacitu ER u proliferujících nádorových buněk. Udržováním homeostázy ER přispívají chaperony ER k přežívání nádorových buněk a jejich proliferaci. Proteomickou analýzou bylo zjištěno, že buněčná membrána nádorových buněk obsahuje poměrně velké množství HSP a GRP [3], které jsou preferenčně exprimovány na povrchu nádorových buněk ve srovnání s buňkami zdravé tkáně (např. GRP78) [4–6]. Ukazuje se, že funkce luminálních chaperonů přesahují hranice ER a kromě skládání proteinů zahrnují i další procesy, jako je regulace proliferace, apoptóza a imunitní reakce buněk [7–10].
Lokalizace chaperonů ER
Molekulární chaperony byly dlouhou dobu považovány za typické intracelulární proteiny s charakteristickou subcelulární lokalizací. Později se ukázalo, že se vyskytují i v buněčné membráně a v extracelulárním prostoru. V současnosti je známo, že za normálních podmínek se chaperony vyskytují téměř ve všech buněčných kompartmentech, kde se podílejí na skládání nově vznikajících proteinů, jejich transportu přes membrány a také brání agregaci proteinů [11].
Chaperony ER jsou solubilní proteiny, které se v lumen ER a v organelách podél celé sekreční dráhy (cis-Golgiho aparát) účastní posttranslačních úprav proteinů. Z cis-Golgiho komplexu jsou „recyklovány“ a navraceny zpět do ER tzv. COPI (Coat protein 1) transportním systémem prostřednictvím transportních váčků. Tento mechanizmus rozpoznává ER rezidentní proteiny na základě charakteristické sekvence na C-konci obsahující aminokyseliny Lys-Asp-Glu-Leu (zkracováno KDEL) [12]. Chaperony mohou nést různé alternativy KDEL sekvence, které však mají obdobnou funkci [13]. Proteiny vybavené KDEL sekvencí nebo její alternativou se pak účastní vezikulárního transportu proteinů mezi ER, ER-Golgiho komplexem a trans-Golgiho komplexem, aniž by docházelo k jejich uvolňování ven z buňky a ztrátám. Chaperony nesoucí KDEL sekvenci jsou vychytávány pomocí KDEL receptorů přítomných v organelách sekreční dráhy a následně vraceny zpět do ER [14]. Doposud byly popsány tři typy KDEL receptorů (KDEL1, KDEL2, KDEL3), přičemž každý z nich interaguje s jedinečnými retenčními motivy chaperonů ER [13].
Přestože jsou chaperony ER aktivně zadržovány v ER, vyskytují se i v ostatních organelách, jako je buněčné jádro, mitochondrie a buněčná membrána. Mimo ER se množství chaperonů z rodiny HSP běžně nachází v cytozolu [15]. Některé z nich mohou asociovat s fosfolipidy na luminální straně buněčné membrány a asistovat při exportu proteinů z buňky [16]. V mitochondriích jsou zase nejvíce zastoupeny chaperony z rodin HSP60 a HSP70, které se zde účastní biogeneze mitochondriálních proteinů [17]. Chaperony se dále účastní transportu proteinů z cytozolu do mitochondrií a ER [18]. Jaderné chaperony se naopak podílejí na interakcích DNA s kompletně sbalenými proteiny, a to při vzniku multiproteinových komplexů v průběhu remodelace chromatinu [18]. V extracelulárním prostředí byly chaperony detekovány v extracelulární matrix a tělních tekutinách, jako je krevní sérum a moč (tab. 2) [19].
Tab. 2. Lokalizace chaperonů ER mimo ER/Golgiho komplex. 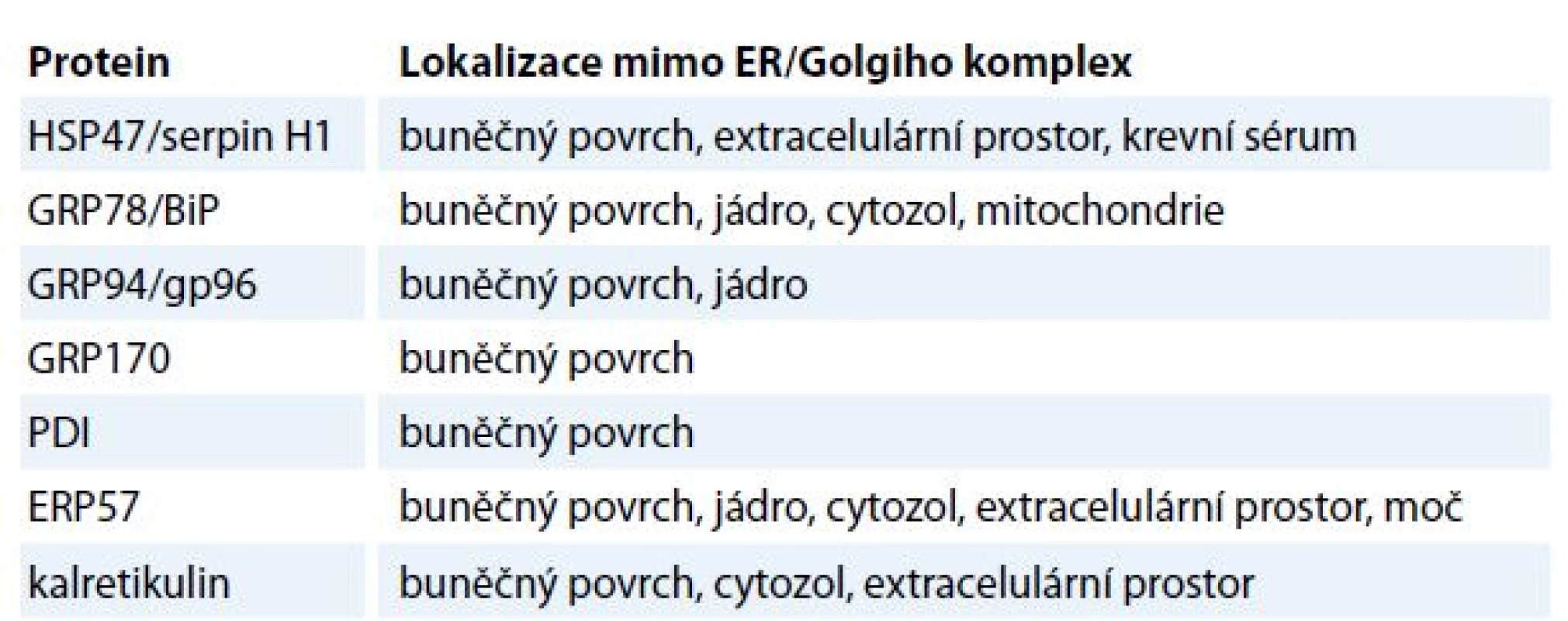
ER – endoplazmatické retikulum Mechanizmus translokace chaperonů ER na buněčný povrch a do extracelulárního prostoru
Mechanizmus transportu chaperonů ER nesoucích KDEL sekvenci na povrch živočišných buněk je vysvětlován několika teoriemi. Za normálních podmínek se chaperony ER dostávají do extracelulárního prostředí pomocí KDEL receptorů cestou tzv. anterográdního transportu. Za podmínek buněčného stresu tento systém naopak napomáhá zadržování chaperonů v ER-Golgiho komplexu obráceným, tzv. retrográdním způsobem, kdy jsou nároky buňky na aktivitu chaperonů ER zvýšené [20]. Dále se chaperony ER mohou směrem ven z buňky dostávat jako součást sekrečních váčků, přičemž retence pomocí KDEL receptorů je překonána z důvodu: 1. nasycení kapacity KDEL receptorů např. v důsledku stresu ER v průběhu tumorigeneze, 2. mutace v oblasti KDEL sekvence nebo KDEL receptorů [14,19], nebo 3. maskování KDEL retenčního motivu asociovaným proteinem [21]. Další způsoby, jakými mohou chaperony ER „uniknout“ z prostředí ER, zahrnují uvolňování pomocí extracelulárních váčků (případně exozomů) [22], případně za podmínek buněčného stresu to může být transport prostřednictvím tzv. retrotranslokační dráhy. Tato dráha je součástí ER-asociované degradace proteinů (ERAD), která zbavuje buňku nestabilních proteinů cestou ubikvitinace a degradace proteazomem [23]. Chaperony relokalizované tímto způsobem (např. kalretikulin) se dostávají z ER do cytozolu, avšak není zcela jasné, zdali je tato dráha současně i zdrojem membránových nebo extracelulárních variant chaperonů ER [19].
Lokalizaci chaperonů ER může kromě výše zmiňovaných transportních drah ovlivňovat také jejich posttranslační modifikace, jak je to známo u kalretikulinu. Extracelulárně se vyskytující forma kalretikulinu je glykosylovaná, naopak neglykosylovaná forma je výhradně intracelulární, neboť není schopná projít anterográdní sekreční dráhou ven z buňky [20]. Glykosylace nebo jiná modifikace tak může maskovat signální tetrapeptid KDEL a zabránit tak jeho vazbě s receptorem. U proteinu GRP78 bylo v blízkosti KDEL sekvence identifikováno potenciální glykosylační místo (Thr648) [24,25]. Současně byly popsány další odlišně lokalizované posttranslačně modifikované varianty kalretikulinu v buňce zahrnující arginylovanou formu na buněčné membráně a v cytozolu [26] a citrullinovanou formu související s imunitní aktivitou u revmatoidní artritidy [27,28].
Imunogenní vlastnosti chaperonů ER
Chaperony ER se mohou díky lokalizaci do buněčné membrány nebo extracelulárního prostředí přímo podílet na modulaci imunitní odpovědi buněk [29]. Imunogenní vlastnosti extracelulárních chaperonů ER jsou spjaté s proteiny, které se na povrchu buňky chovají jako „signál označující nebezpečí“ a jsou schopné interagovat s receptory buněk imunitního systému. Je známo, že extracelulární chaperony, jako jsou HSP27, HSP60, HSP70, GRP94, HSP90 nebo GRP170, se mohou vázat s TLR (toll like receptor) receptory, které jsou obvykle exprimovány dendritickými buňkami a makrofágy, a tudíž se účastní vrozené imunitní odpovědi organizmu [29]. Jako chaperony ER schopné aktivovat imunitní systém na povrchu buňky nebo v extracelulárním prostředí byly popsány kalretikulin, GRP78 a GRP94 [30–34]. Kromě toho je známo, že GRP96 je schopný aktivovat nádorově-specifickou imunitu [35].
GRP94 a GRP170 se podílejí na prezentaci antigenu a jejich sekretované formy jsou schopné vyvolat vrozenou a adaptivní imunitní odpověď [2]. Na základě výše uvedených vlastností se vybrané chaperony ER ukazují jako potenciálně vhodné cíle pro vývoj protinádorových léčebných vakcín.
Chaperony ER na povrchu nádorových buněk
ER je jednou z klíčových organel pro udržení stavu buněčné homeostázy. Pokud jsou funkce ER narušeny v důsledku nedostatku živin, hypoxie, změn v metabolizmu vápníku, změn v oxido-redukční rovnováze nebo změn v hodnotě pH, dochází ke stresu ER a následnému hromadění nesbalených nebo špatně sbalených proteinů.
V mikroprostředí nádoru jsou buňky vystaveny stresu ER v důsledku změn buněčného metabolizmu na mnoha úrovních. Na tyto podmínky pak reagují mimo jiné i extracelulární expresí chaperonů ER.
GRP78/BiP
Jedním z nejlépe popsaných chaperonů ER je GRP78 (BiP). GRP78 patří do rodiny HSP70 a je považován za hlavní chaperon ER, který zprostředkovává skládání proteinů vč. jejich kontroly, účastní se vápníkového metabolizmu udržováním jeho homeostázy a podílí se na signalizaci během stresu ER. V prostředí nádoru nebo za podmínek stresu ER je exprese GRP78 výrazně indukovaná. GRP78 byl kromě ER detekován také na membráně nádorových buněk, přičemž buňky zdravé tkáně povrchový GRP78 normálně neexprimují. Mechanizmus, kterým se GRP78 dostává na povrch, nebyl doposud přesně popsán. K relokalizaci dochází pravděpodobně v důsledku přesycení kapacity retenčního systému ER, nebo je GRP78 transportován společně s klientními proteiny (může se jednat o adaptivní mechanizmus nádorových buněk). Povrchový GRP78 má také zcela jiné funkce než jeho ER varianta, protože se chová jako multifunkční receptor, jehož aktivovaná forma podporuje nádorové bujení. GRP78 je schopný vázat α2-makroglobulin a podporovat tak proliferaci, přežívání a metastazování nádorových buněk [36–38]. Interakce s α2-makroglobulinem dále vede k aktivaci signálních kaskád ERK1/2, p38 MAPK, Akt, PI3K a NF-κB [37,39–42]. Kromě výše uvedeného může GRP78 membránový receptor jako povrchový protein podporovat tvorbu autoprotilátek, které mají vlastnosti agonistické s α2-makroglobulinem a po interakci s receptorem vedou k indukci proliferace nádorových buněk [43,44].
GRP94/Gp96
GRP94 je nejvíce abundantním proteinem ER a podobně jako u GRP78 jeho zvýšená exprese souvisí s nádorovou transformací [45]. Jako chaperon ER nese C-koncový ER retenční peptid KDEL, který však nefunguje absolutně. Z toho důvodu byl GRP94 detekován i na membráně nádorových buněk a v extracelulární tekutině (pankreatické šťávě) [46–48]. Jeho funkce na membráně však není zcela jasná, ale je známo, že GRP94 je schopný aktivovat dendritické buňky a nádorově specifické T buňky [49].
Kalretikulin a kalnexin
Kalretikulin je vysoce konzervovaný chaperon ER, který ačkoliv je majoritně lokalizován do ER, vykazuje množství dalších intra - i extracelulárních lokalizací. V ER je jeho hlavní úlohou asistovat společně se svým homologem kalnexinem při skládání a kontrole nově syntetizovaných glykoproteinů. Povrchově lokalizovaný kalretikulin má různé funkce, které zahrnují podporu rozpadu fokálních adhezí a migrace [50,51], dále zprostředkování fagocytózy umírajících nádorových buněk [52–54]. Kalnexin patří stejně jako kalretikulin mezi proteiny ER detekované na buněčné membráně. Funkcí povrchově lokalizovaného kalnexinu je zřejmě modulace adhezivních vlastností a integrinem řízené buněčné signalizace [55].
Extracelulární HSP70 a HSP90
Přestože HSP70 a HSP90 nejsou chaperony ER, uvádíme je zde z toho důvodu, že jejich extra - i intracelulární funkce jsou poměrně dobře popsány a současně se jedná o homology ER rezidentních chaperonů (GRP78, GRP94), které jsou nádorovými buňkami uvolňovány.
HSP70
Členové rodiny HSP70 asistují při skládání nascentních proteinů a jsou důležitou součástí procesů zajišťujících buněčnou homeostázu. V nádorových buňkách je exprese HSP70 často zvýšena a koreluje s horší prognózou onemocnění [56]. Extracelulární HSP70 se vyskytuje jako solubilní protein, dále potom v komplexu s antigenními peptidy nebo jako součást exozomů. Tyto odlišné varianty interagují s povrchovými receptory nádorových buněk, buněk imunitního systému, endotelovými a epitelovými buňkami. Extracelulární HSP70 v komplexu s nádorovými peptidy interaguje s receptory na povrchu antigen-prezentujících buněk (CD91, SREC-1) [57,58] a je schopný aktivovat NK buňky [37]. Samotný extracelulární HSP70 spouští nespecifické imunitní reakce (signalizace prostřednictvím aktivace TLR2/4 receptoru) [58], ovlivňuje invazivitu nádorových buněk regulací aktivity matrix-metaloproteázy [59] a aktivací zánětlivého mikroprostředí (produkce reaktivních kyslíkových radikálů) [60].
HSP90
HSP90 je vysoce exprimovaný chaperon, který ovlivňuje funkci a stabilitu velkého množství klientních proteinů. V jaderných buňkách obratlovců se vyskytuje ve dvou cytozolárních variantách – HSP90α a HSP90β. HSP90 se ve zdravých buňkách za fyziologických podmínek vyskytuje nejčastěji v cytoplazmě, malá frakce je přítomna také v jádře.
V klidovém stavu buňky HSP90 extracelulárně neuvolňují, ačkoliv k jeho sekreci dochází v důsledku stresových podmínek, jako je hypoxie, hladovění, virová infekce, γ-záření nebo v přítomnost reaktivních kyslíkových radikálů [61–65]. Naopak nádorové buňky vykazují konstitutivní extracelulární expresi HSP90, obzvlášť v případě nádorů s abnormálně vysokou expresí HIF-1α [66]. Mezi popsané buněčné regulátory sekrece HSP90 patří nádorový supresor p53, HIF-1α a ubikvitin ligáza Hectd1 [65].
HSP90 nenese sekreční signální peptid a je uvolňovaný z buněk prostřednictvím exozomální sekreční dráhy [67]. Jeho hlavní funkcí je podpora motility a nádorové progrese, za což je odpovědný 115 aminokyselin dlouhý peptid (aminokyseliny 236-350) na povrchu proteinu. Mezi extracelulární interakční partnery HSP90 patří HER2 receptor, matrix metaloproteázy, LRP-1 [68].
HSP90 byl podobně jako i další HSP proteiny detekován jako molekula cirkulující v krvi. Zvýšené hladiny plazmatického HSP90α byly popsány u pacientů s karcinomem prsu, plic, pankreatu a jater. Přesto diagnostický význam detekce HSP90 v krvi zatím není zcela jednoznačný [66].
Povrchové a extracelulární chaperony ER a protinádorová léčba
Preferenční exprese GRP78 na povrchu nádorových buněk umožňuje využití specificky cílené protinádorové léčby s minimálním nežádoucím účinkem na zdravé buňky. Potenciálním cílem této léčby jsou současně podpůrné buňky nádorové tkáně, na jejichž povrchu byl GRP78 také identifikován [2]. Léčebné strategie zaměřené na GRP78 využívají např. peptidových ligandů konjugovaných s cytotoxickým agens. Aplikace specifické IgG monoklonální protilátky (Mab159) spouští endocytózu a degradaci povrchového GRP78 a současně apoptózu nádorových buněk (xenograftů karcinomu plic, tlustého střeva, metastáz karcinomu prsu a melanomu) prostřednictvím inhibice PI3K signalizace [39]. Tato protilátka je potenciálně využitelná pro in vivo zobrazování při výběru vhodného pacienta pro léčbu protinádorovou Mab159 protilátkou nebo pro sledování progrese onemocnění a odpovědi na léčbu.
Další léčebnou strategií je protinádorová vakcinace, která umožňuje personalizovanou léčbu pacientů s nádorovým onemocněním. Doposud bylo testováno využití autologního sekrečního fúzního proteinu GRP94 s nádorovými antigenními peptidy. Tato vakcína měla na myších modelech antiproliferativní a antimetastatický efekt, avšak v klinických testech byl její imunogenní účinek velmi variabilní [69–71]. Využití GRP170 fúzního proteinu s plnodélkovými antigeny se ukázalo jako efektivní při léčbě nádorů prostaty na myších modelech [72]. Aktivace dendritických buněk a protinádorová imunitní odpověď byla posílena při syntéze fúzního proteinu GRP170 s NF-κB aktivující doménou bakteriálního proteinu flagelinu u metastazujících nádorů u myší [73].
Závěr
Hlavní složky extracelulárního prostředí zahrnují metaloproteázy a signální molekuly extracelulárního prostředí s jejich receptory. Z pohledu nádorové biologie mohou extracelulární chaperony působit jako na membránu vázané proteiny, které interakcí s povrchovými receptory spouštějí intracelulární signalizaci. Jako extracelulární solubilní proteiny interagují se složkami extracelulární matrix a podporují tak metastazování a invazivitu nádorů. Současně mohou sloužit jako onkogenní proteiny aktivní v mezibuněčné komunikaci. Obecně tedy mohou chaperony ER hrát dvojí biologickou a imunologickou roli, která vychází především z jejich buněčné lokalizace. Intracelulární chaperony ER mají ochrannou funkci podporující přežití nádorových buněk za nepříznivých podmínek, zatímco na membránu vázané a extracelulární chaperony ER usnadňují imunologické rozpoznání nádorových buněk a jejich likvidaci.
Přes značné množství odborných prací stále zůstávají nezodpovězené otázky ohledně mechanizmu exportu chaperonů ER do extracelulárního prostředí nádoru a jejich přesné extracelulární funkce. Je však zřejmé, že chaperony ovlivňují jak samotné nádorové buňky, tak i nádorové mikroprostředí. Jako stresem indukované proteiny mohou přispívat k tumorigenezi a lékové rezistenci, ale současně díky možnosti své specifické inhibice jsou zároveň i nadějnými cíli protinádorové terapie.
Práce byla podpořena projektem MŠMT – NPU I – LO1413.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Veronika Brychtová, Ph.D.
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: vebrychtova@mou.cz
Obdrženo: 17. 5. 2016
Přijato: 20. 7. 2016
Zdroje
1. Gidalevitz T, Stevens F, Argon Y. Orchestration of secretory protein folding by ER chaperones. Biochim Biophys Acta 2013; 1833 (11): 2410–2424. doi: 10.1016/j.bbamcr.2013.03.007.
2. Lee AS. Glucose-regulated proteins in cancer: molecular mechanisms and therapeutic potential. Nat Rev Cancer 2014; 14 (4): 263–276. doi: 10.1038/nrc3701.
3. Shin BK, Wang H, Yim AM et al. Global profiling of the cell surface proteome of cancer cells uncovers an abundance of proteins with chaperone function. J Biol Chem 2003; 278 (9): 7607–7616.
4. Arap MA, Lahdenranta J, Mintz PJ et al. Cell surface expression of the stress response chaperone GRP78 enables tumor targeting by circulating ligands. Cancer Cell 2004; 6 (3): 275–284.
5. Kim Y, Lillo AM, Steiniger SC et al. Targeting heat shock proteins on cancer cells: selection, characterization, and cell-penetrating properties of a peptidic GRP78 ligand. Biochemistry 2006; 45 (31): 9434–9444.
6. Liu Y, Steiniger SC, Kim Y et al. Mechanistic studies of a peptidic GRP78 ligand for cancer cell-specific drug delivery. Mol Pharm 2007; 4 (3): 435–447.
7. Gonzalez-Gronow M, Selim MA, Papalas J et al. GRP78: a multifunctional receptor on the cell surface. Antioxid Redox Signal 2009; 11 (9): 2299–2306. doi: 10.1089/ARS.2009.2568.
8. Gray PC, Vale W. Cripto/GRP78 modulation of the TGF-beta pathway in development and oncogenesis. FEBS Lett 2012; 586 (14): 1836–1845. doi: 10.1016/j.febslet.2012.01.051.
9. Ni M, Zhang Y, Lee AS. Beyond the endoplasmic reticulum: atypical GRP78 in cell viability, signalling and therapeutic targeting. Biochem J 2011; 434 (2): 181–188. doi: 10.1042/BJ20101569.
10. Sato M, Yao VJ, Arap W et al. GRP78 signaling hub a receptor for targeted tumor therapy. Adv Genet 2010; 69 : 97–114. doi: 10.1016/S0065-2660 (10) 69006-2.
11. Horvath I, Multhoff G, Sonnleitner A et al. Membrane-associated stress proteins: more than simply chaperones. Biochim Biophys Acta 2008; 1778 (7–8): 1653–1664. doi: 10.1016/j.bbamem.2008.02.012.
12. Munro S, Pelham HR. A C-terminal signal prevents secretion of luminal ER proteins. Cell 1987; 48 (5): 899–907.
13. Raykhel I, Alanen H, Salo K et al. A molecular specificity code for the three mammalian KDEL receptors. J Cell Biol 2007; 179 (6): 1193–1204.
14. Capitani M, Sallese M. The KDEL receptor: new functions for an old protein. FEBS Lett 2009; 583 (23): 3863–3871. doi: 10.1016/j.febslet.2009.10.053.
15. Basu S, Binder RJ, Ramalingam T et al. CD91 is a common receptor for heat shock proteins gp96, hsp90, hsp70, and calreticulin. Immunity 2001; 14 (3): 303–313.
16. Arispe N, De Maio A. ATP and ADP modulate a cation channel formed by Hsc70 in acidic phospholipid membranes. J Biol Chem 2000; 275 (40): 30839–30843.
17. Voos WK, Rottgers K. Molecular chaperones as essential mediators of mitochondrial biogenesis. Biochim Biophys Acta 2002; 1592 (1): 51–62.
18. Philpott A, Krude T, Laskey RA. Nuclear chaperones. Semin Cell Dev Biol 2000; 11 (1): 7–14.
19. Wiersma VR, Michalak M, Abdullah TM et al. Mechanisms of translocation of ER chaperones to the cell surface and immunomodulatory roles in cancer and autoimmunity. Front Oncol 2015; 5 : 7. doi: 10.3389/fonc.2015.00007.
20. Cancino J, Jung JE, Luini A. Regulation of Golgi signaling and trafficking by the KDEL receptor. Histochem Cell Biol 2013; 140 (4): 395–405. doi: 10.1007/s00418-013-1130-9.
21. Marzec M, Eletto D, Argon Y. GRP94: an HSP90-like protein specialized for protein folding and quality control in the endoplasmic reticulum. Biochim Biophys Acta 2012; 1823 (3): 774–787. doi: 10.1016/j.bbamcr.2011.10.013.
22. De Maio A, Vazquez D. Extracellular heat shock proteins: a new location, a new function. Shock 2013; 40 (4): 239–246. doi: 10.1097/SHK.0b013e3182a185ab.
23. Stolz A, Wolf DH. Endoplasmic reticulum associated protein degradation: a chaperone assisted journey to hell. Biochim Biophys Acta 2010; 1803 (6): 694–705. doi: 10.1016/j.bbamcr.2010.02.005.
24. Jakobsen CG, Rasmussen N, Laenkholm AV et al. Phage display derived human monoclonal antibodies isolated by binding to the surface of live primary breast cancer cells recognize GRP78. Cancer Res 2007; 67 (19): 9507–9517.
25. Zhang Y, Liu R, Ni M et al. Cell surface relocalization of the endoplasmic reticulum chaperone and unfolded protein response regulator GRP78/BiP. J Biol Chem 2010; 285 (20): 15065–15075. doi: 10.1074/jbc.M109.087445.
26. Decca MB, Carpio MA, Bosc C et al. Post-translational arginylation of calreticulin: a new isospecies of calreticulin component of stress granules. J Biol Chem 2007; 282 (11): 8237–8245.
27. Ling S, Cheng A, Pumpens P et al. Identification of the rheumatoid arthritis shared epitope binding site on calreticulin. PLoS One 2010; 5 (7): e11703. doi: 10.1371/journal.pone.0011703.
28. Ling S, Pi X, Holoshitz J. The rheumatoid arthritis shared epitope triggers innate immune signaling via cell surface calreticulin. J Immunol 2007; 179 (9): 6359–6367.
29. Graner MW, Lillehei KO, Katsanis E. Endoplasmic reticulum chaperones and their roles in the immunogenicity of cancer vaccines. Front Oncol 2014; 4 : 379. doi: 10.3389/fonc.2014.00379.
30. Eggleton P, Reid KB, Kishore U et al. Clinical relevance of calreticulin in systemic lupus erythematosus. Lupus 1997; 6 (7): 564–571.
31. Kishore U, Sontheimer RD, Sastry KN et al. The systemic lupus erythematosus (SLE) disease autoantigen-calreticulin can inhibit C1q association with immune complexes. Clin Exp Immunol 1997; 108 (2): 181–190.
32. Panaretakis T, Joza N, Modjtahedi N et al. The co-translocation of ERp57 and calreticulin determines the immunogenicity of cell death. Cell Death Differ 2008; 15 (9): 1499–1509. doi: 10.1038/cdd.2008.67.
33. Tarr JM, Winyard PG, Ryan B et al. Extracellular calreticulin is present in the joints of patients with rheumatoid arthritis and inhibits FasL (CD95L) -mediated apoptosis of T cells. Arthritis Rheum 2010; 62 (10): 2919–2929. doi: 10.1002/art.27602.
34. Weber CK, Haslbeck M, Englbrecht M et al. Antibodies to the endoplasmic reticulum-resident chaperones calnexin, BiP and Grp94 in patients with rheumatoid arthritis and systemic lupus erythematosus. Rheumatology (Oxford) 2010; 49 (12): 2255–2263. doi: 10.1093/rheumatology/keq272.
35. Tamura Y, Hirohashi Y, Kutomi G et al. Tumor-produced secreted form of binding of immunoglobulin protein elicits antigen-specific tumor immunity. J Immunol 2011; 186 (7): 4325–4330. doi: 10.4049/jimmunol.1004048.
36. Misra UK, Deedwania R, Pizzo SV. Binding of activated alpha2-macroglobulin to its cell surface receptor GRP78 in 1-LN prostate cancer cells regulates PAK-2-dependent activation of LIMK. J Biol Chem 2005; 280 (28): 26278–26286.
37. Misra UK, Deedwania R, Pizzo SV. Activation and cross - -talk between Akt, NF-kappaB, and unfolded protein response signaling in 1-LN prostate cancer cells consequent to ligation of cell surface-associated GRP78. J Biol Chem 2006; 281 (19): 13694–13707.
38. Misra UK, Gonzalez-Gronow M, Gawdi G et al. A novel receptor function for the heat shock protein Grp78: silencing of Grp78 gene expression attenuates alpha2M*-induced signalling. Cell Signal 2004; 16 (8): 929–938.
39. Liu R, Li X, Gao W et al. Monoclonal antibody against cell surface GRP78 as a novel agent in suppressing PI3K/AKT signaling, tumor growth, and metastasis. Clin Cancer Res 2013; 19 (24): 6802–6811. doi: 10.1158/1078-0432.CCR-13-1106.
40. Misra UK, Gonzalez-Gronow M, Gawdi G et al. The role of Grp 78 in alpha 2-macroglobulin-induced signal transduction. Evidence from RNA interference that the low density lipoprotein receptor-related protein is associated with, but not necessary for, GRP 78-mediated signal transduction. J Biol Chem 2002; 277 (44): 42082–42087.
41. Misra UK, Pizzo SV. Receptor-recognized alpha (2) -macroglobulin binds to cell surface-associated GRP78 and activates mTORC1 and mTORC2 signaling in prostate cancer cells. PLoS One 2012; 7 (12): e51735. doi: 10.1371/journal.pone.0051735.
42. Zhang Y, Tseng CC, Tsai YL et al. Cancer cells resistant to therapy promote cell surface relocalization of GRP78 which complexes with PI3K and enhances PI (3,4,5) P3 production. PLoS One 2013; 8 (11): e80071. doi: 10.1371/journal.pone.0080071.
43. Gonzalez-Gronow M, Cuchacovich M, Llanos C et al. Prostate cancer cell proliferation in vitro is modulated by antibodies against glucose-regulated protein 78 isolated from patient serum. Cancer Res 2006; 66 (23): 11424–12431.
44. Tsunemi S, Nakanishi T, FujitaY et al. Proteomics-based identification of a tumor-associated antigen and its corresponding autoantibody in gastric cancer. Oncol Rep 2010; 23 (4): 949–956.
45. Fu Y, Lee AS. Glucose regulated proteins in cancer progression, drug resistance and immunotherapy. Cancer Biol Ther 2006; 5 (7): 741–744.
46. Altmeyer A, Maki RG, Feldweg AM et al. Tumor-specific cell surface expression of the-KDEL containing, endoplasmic reticular heat shock protein gp96. Int J Cancer 1996; 69 (4): 340–349.
47. Bruneau N, Lombardo D, Bendayan M. Participation of GRP94-related protein in secretion of pancreatic bile salt-dependent lipase and in its internalization by the intestinal epithelium. J Cell Sci 1998; 111 (Pt 17): 2665–2679.
48. Frasson M, Vitadello M, Brunati AM et al. Grp94 is Tyr-phosphorylated by Fyn in the lumen of the endoplasmic reticulum and translocates to Golgi in differentiating myoblasts. Biochim Biophys Acta 2009; 1793 (2): 239–252. doi: 10.1016/j.bbamcr.2008.10.001.
49. Zheng H, Dai J, Stoilova D et al. Cell surface targeting of heat shock protein gp96 induces dendritic cell maturation and antitumor immunity. J Immunol 2001; 167 (12): 6731–6735.
50. Orr AW, Elzie CA, Kucik DF et al. Thrombospondin signaling through the calreticulin/LDL receptor-related protein co-complex stimulates random and directed cell migration. J Cell Sci 2003; 116 (Pt 14): 2917–2927.
51. Orr AW, Pedraza CE, Pallero MA et al. Low density lipoprotein receptor-related protein is a calreticulin coreceptor that signals focal adhesion disassembly. J Cell Biol 2003; 161 (6): 1179–1189.
52. Eggleton P, Lieu TS, Zappi EG et al. Calreticulin is released from activated neutrophils and binds to C1q and mannan-binding protein. Clin Immunol Immunopathol 1994; 72 (3): 405–409.
53. Ogden CA, deCathelineau A, Hoffmann PR et al. C1q and mannose binding lectin engagement of cell surface calreticulin and CD91 initiates macropinocytosis and uptake of apoptotic cells. J Exp Med 2001; 194 (6): 781–795.
54. Vandivier RW, Ogden CA, Fadok VA et al. Role of surfactant proteins A, D, and C1q in the clearance of apoptotic cells in vivo and in vitro: calreticulin and CD91 as a common collectin receptor complex. J Immunol 2002; 169 (7): 3978–3986.
55. Okazaki Y, Ohno H, Takase K et al. Cell surface expression of calnexin, a molecular chaperone in the endoplasmic reticulum. J Biol Chem 2000; 275 (46): 35751–35758.
56. Nimmervoll B, Chtcheglova LA, Juhasz K et al. Cell surface localised Hsp70 is a cancer specific regulator of clathrin-independent endocytosis. FEBS Lett 2015; 589 (19 Pt B): 2747–2753. doi: 10.1016/j.febslet.2015.07.037.
57. Delneste Y, Magistrelli G, Gauchat J et al. Involvement of LOX-1 in dendritic cell-mediated antigen cross-presentation. Immunity 2002; 17 (3): 353–362.
58. Theriault JR, Mambula SS, Sawamura T et al. Extracellular HSP70 binding to surface receptors present on antigen presenting cells and endothelial/epithelial cells. FEBS Lett 2005; 579 (9): 1951–1960.
59. Sims JD, McCready J, Jay DG. Extracellular heat shock protein (Hsp) 70 and Hsp90alpha assist in matrix metalloproteinase-2 activation and breast cancer cell migration and invasion. PLoS One 2011; 6 (4): e18848. doi: 10.1371/journal.pone.0018848.
60. Ellerman JE, Brown CK, de Vera M et al. Masquerader: high mobility group box-1 and cancer. Clin Cancer Res 2007; 13 (10): 2836–2848.
61. Hung CY, Tsai MC, Wu YP et al. Identification of heat-shock protein 90 beta in Japanese encephalitis virus-induced secretion proteins. J Gen Virol 2011; 92 (Pt 12): 2803–2809. doi: 10.1099/vir.0.033993-0.
62. Chen JS, Hsu YM, Chen CC et al. Secreted heat shock protein 90alpha induces colorectal cancer cell invasion through CD91/LRP-1 and NF-kappaB-mediated integrin alphaV expression. J Biol Chem 2010; 285 (33): 25458–25466. doi: 10.1074/jbc.M110.139 345.
63. Li W, Li Y, Guan S et al. Extracellular heat shock protein-90alpha: linking hypoxia to skin cell motility and wound healing. EMBO J 2007; 26 (5): 1221–1233.
64. Liao DF, Jin ZG, Baas AS et al. Purification and identification of secreted oxidative stress-induced factors from vascular smooth muscle cells. J Biol Chem 2000; 275 (1): 189–196.
65. Yu X, Harris SL, Levine AJ. The regulation of exosome secretion: a novel function of the p53 protein. Cancer Res 2006; 66 (9): 4795–4801.
66. Li W, Tsen F, Sahu D et al. Extracellular Hsp90 (eHsp90) as the actual target in clinical trials: intentionally or unintentionally. Int Rev Cell Mol Biol 2013; 303 : 203–235. doi: 10.1016/B978-0-12-407697-6.00005-2.
67. McCready J, Sims JD, Chan D et al. Secretion of extracellular hsp90alpha via exosomes increases cancer cell motility: a role for plasminogen activation. BMC Cancer 2010; 10 : 294. doi: 10.1186/1471-2407-10-294.
68. Eustace BK, Jay DJ. Extracellular roles for the molecular chaperone, hsp90. Cell Cycle 2004; 3 (9): 1098–1100.
69. Colaco C. Autologous heat-shock protein vaccines. Hum Vaccin Immunother 2013; 9 (2): 275–276.
70. Randazzo M, Terness P, Opelz G et al. Active-specific immunotherapy of human cancers with the heat shock protein Gp96-revisited. Int J Cancer 2012; 130 (10): 2219–2231. doi: 10.1002/ijc.27332.
71. Reitsma DJ, Combest AJ. Challenges in the development of an autologous heat shock protein based anti-tumor vaccine. Hum Vaccin Immunother 2012; 8 (8): 1152–1155. doi: 10.4161/hv.21382.
72. Gao P, Sun X, Chen X et al. Secretion of stress protein grp170 promotes immune-mediated inhibition of murine prostate tumor. Cancer Immunol Immunother 2009; 58 (8): 1319–1328. doi: 10.1007/s00262-008-0647-6.
73. Yu X, Guo C, Yi H et al. A multifunctional chimeric chaperone serves as a novel immune modulator inducing therapeutic antitumor immunity. Cancer Res 2013; 73 (7): 2093–2103. doi: 10.1158/0008-5472.CAN-12-1740.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Editorial
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2016 Číslo Supplementum 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Vícestupňový proces vzniku vzdálených metastáz u karcinomů
- Mechanizmy regulace proteinové homeostázy ve vývoji nádorových onemocnění
- Chaperony endoplazmatického retikula na povrchu nádorové buňky a v extracelulárním prostředí
- Editorial
- Proteiny Rab, vnitrobuněčný transport a nádorová onemocnění
- Vplyv inhibície HSP90 na viabilitu a bunkový cyklus v závislosti od stavu p53
- Molekulární podstata kancerogeneze epiteliálních ovariálních karcinomů
- Tvorba hmotnostne spektrometrických spektrálnych knižníc nádorových bunečných línií
- Využití metody vodík/deuteriové výměny v biofarmaceutickém průmyslu
- Nádorové buňky jako dynamický systém – molekulární a fenotypové změny v průběhu vzniku, progrese a šíření nádoru
- Nové metody studia metylace DNA – MS-HRM analýza a elektrochemie
- Úloha PD-1/PD-L1 signalizace v protinádorové imunitní odpovědi
- Nemalobuněčný karcinom plic – od imunobiologie k imunoterapii
- Nové technologie používané pro in vivo diagnostiku nádorů
- Pokroky ve vývoji PET radiofarmak pro pacienty v České republice
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Úloha PD-1/PD-L1 signalizace v protinádorové imunitní odpovědi
- Nemalobuněčný karcinom plic – od imunobiologie k imunoterapii
- Nádorové buňky jako dynamický systém – molekulární a fenotypové změny v průběhu vzniku, progrese a šíření nádoru
- Nové metody studia metylace DNA – MS-HRM analýza a elektrochemie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



