-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Effect of Erlotinib in 2nd and 3rd Line Anticancer Treatment in Patients with Squamous Cell Lung Cancer – Case Series
Effect of Erlotinib in 2nd and 3rd Line Anticancer Treatment in Patients with Squamous Cell Lung Cancer – Case Series
Background:
Squamous cell carcinoma of the lung (SCC) represents cca 30–40% of new cases of non-small cell lung cancer (NSCLC) in the Czech Republic. The tyrosine kinase inhibitor erlotinib is indicated as a 1st line treatment for patients with locally advanced and metastatic disease and activating mutations in endothelial growth factor receptor (EGFR), or as a 2nd or 3rd line treatment in EGFR-negative NSCLC patients after chemotherapeutic failure.Observation:
We present three case reports of patients with SCC treated with erlotinib as a 2nd or 3rd line of treatment. All patients were verified by histological analysis of tumor samples. EGFR mutation status was negative in one patient, while the other samples were not suitable for genetic screening. Results: The therapeutic response to erlotinib lasted for 68, 40, and 13 months, resp. The patient with the longest therapeutic response (patient no. 1) is still continuing erlotinib treatment (as of December 2016). The overall survival of the two patients who died was 50 and 43 months, resp. One patient died of an unknown cause with no signs of progression of the disease on CT scans. The other patient died of terminal progression of the oncological disease. All three patients experienced major therapeutic benefit from erlotinib treatment as shown by the long periods of progression-free survival and prolonged overall survival.Conclusion:
The three case reports demonstrate that erlotinib may be effective as a 2nd or 3rd line treatment in patients with SCC, especially in patients with limited alternative anticancer treatment options.Key words:
non-small cell lung cancer – squamous cell carcinoma – erlotinib – treatment – tyrosine kinase inhibitor
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
5. 8. 2016Accepted:
14. 12. 2016
Autori: M. Šatánková 1; K. Brat 1; M. Tomíšková 1; B. Robešová 2; J. Skřičková 1
Pôsobisko autorov: Klinika nemocí plicních a tuberkulózy LF MU a FN Brno 1; Interní hematologická a onkologická klinika LF MU a FN Brno 2
Vyšlo v časopise: Klin Onkol 2017; 30(2): 131-135
Kategória: Kazuistika
doi: https://doi.org/10.14735/amko2017131Súhrn
Východiska:
Spinocelulární karcinom plic tvoří v současnosti cca 30–40 % z nově zjištěných případů nemalobuněčného karcinomu plic (non-small lung cancer – NSCLC) v České republice. Tyrozinkinázový inhibitor – erlotinib – je v České republice indikován v 1. linii protinádorové léčby u pacientů s NSCLC ve stadiu lokálně pokročilém a metastatickém s prokázanými aktivačními mutacemi genu pro receptor endoteliálního růstového faktoru (EGFR). Erlotinib je dále indikován k léčbě EGFR negativních pacientů ve 2. a 3. linii protinádorové léčby, po zdokumentovaném selhání chemoterapie.Pozorování:
Naše tři prezentované kazuistiky dokumentují léčebný efekt erlotinibu ve 2. a 3. linii protinádorové léčby u pacientů se spinocelulárním karcinomem plic. Všichni pacienti byli verifikováni histologicky. Jejich EGFR mutační status v době zahájení léčby nebyl vyšetřen. Zpětně bylo možné vyšetřit pouze vzorek pacienta č. 2 (EGFR negativní), dostupný biologický materiál ostatních dvou nemocných nebyl vhodný k molekulárně-genetické analýze. Doba do progrese nemoci při léčbě erlotinibem byla 68, 40 a 14 měsíců, přičemž pacient č. 1 k prosinci 2016 v léčbě stále pokračuje. Celkové přežití u dvou zemřelých pacientů bylo 50 a 43 měsíců. Jeden pacient zemřel z neznámé příčiny, bez zdokumentované progrese onkologického onemocnění. Jeden pacient zemřel na terminální progresi onkologického onemocnění. Všem třem pacientům erlotinib výrazně prodloužil celkové přežití.Závěr:
Naše kazuistiky i literární data dokazují, že erlotinib může mít významný efekt i u pacientů se spinocelulárním karcinomem plic. Erlotinib ve 2. a 3. linii protinádorové léčby může být alternativou pro pacienty s omezenými možnostmi jiné léčby, v některých případech pak léčba může vést ke dlouhodobé stabilizaci onemocnění.Klíčová slova:
nemalobuněčný karcinom plic – spinocelulární karcinom plic – erlotinib – léčba – tyrozinkinázový inhibitorÚvod
Spinocelulární karcinom (squamous cell carcinoma – SCC) plic tvoří v současnosti cca 30–40 % z nově zjištěných případů výskytu nemalobuněčného karcinomu plic (non-small cell lung cancer – NSCLC) v ČR [1]. SCC je typický svým pomalým růstem a menší tendencí k metastazování (ve srovnání s jinými typy NSCLC) [2]. Je také spojen s lepší prognózou, než jakou vídáme u adenokarcinomů plic [2].
Mnohem častěji než u adenokarcinomu je nalézán větší počet kopií a nadměrná exprese genu pro receptor pro endoteliální růstový faktor (EGFR) [3]. Tyto nálezy však byly v klinických studiích spíše ukazatelem špatné prognózy [3]. U SCC se uvažuje o mnoha dalších kandidátních onkogenech, jejichž klinický význam zatím není objasněn (FGFR1, SOX1, PIK3CA, MDM2, PDGFRA, NRF2, MET, P53, PTEN, EPHA2, LKB1, AKT, EGFRvIII) [4,5]. Aktivační mutace genu pro EGFR jsou u SCC popsány pouze ojediněle [3].
Tyrozinkinázový inhibitor – erlotinib – je v ČR indikován v 1. linii protinádorové léčby u pacientů s NSCLC ve stadiu lokálně pokročilém a metastatickém [6]. Podmínkou zahájení léčby v 1. linii je průkaz aktivačních mutací genu pro EGFR [6]. Erlotinib je dále indikován k léčbě EGFR negativních pacientů ve 2. a 3. linii protinádorové léčby, po zdokumentovaném selhání chemoterapie [6].
Výhodami léčby tyrozinkinázovými inhibitory jsou především možnost perorálního podávání a příznivý bezpečnostní profil léku. Nejčastější nežádoucí účinky zahrnují rash, průjem, konjunktivitidu, paronychia a hepatopatie [6]. Díky tomuto faktu tak můžeme erlotinibem léčit i pacienty se závažnějšími komorbiditami (např. ICHS, CHRI), pro které by podávání systémové chemoterapie bylo příliš rizikové.
Léčebné úspěchy tyrozinkinázových inhibitorů byly prokázány u pacientů s NSCLC s prokázanou pozitivitou aktivačních mutací EGFR [6]. Nicméně efekt erlotinibu byl prokázán také ve 2. linii léčby EGFR negativních pacientů s NSCLC [6,7].
Naše tři prezentované kazuistiky dokumentují léčebný efekt erlotinibu ve 2. a 3. linii protinádorové léčby u pacientů se SCC. Všichni pacienti byli verifikováni histologicky. Jejich EGFR mutační status v době zahájení léčby nebyl vyšetřen. Zpětně bylo možné vyšetřit pouze vzorek pacienta č. 2 (EGFR negativní), dostupný biologický materiál ostatních dvou nemocných nebyl vhodný k molekulárně-genetické analýze.
Kazuistika 1
Muž ve věku 67 let, kuřák, s chronickou obstrukční plicní nemocí měl v září 2009 na základě histologie z endobronchiálního nálezu tumoru diagnostikován středně diferencovaný (grade 2) SCC horního laloku pravé plíce na Klinice nemocí plicních a tuberkulózy (KNPT) FN Brno. Diagnostika onemocnění byla zahájena již v červenci 2009 na pneumologickém pracovišti okresní nemocnice, kde se dle stagingových vyšetření jednalo o stadium IIA (T2 N0 M0). V mezidobí došlo k rychlé progresi onemocnění a v době zahájení léčby na KNPT FN Brno se dle aktuálního CT nálezu jednalo o stadium IIIB (T4 N0 M0). Pacient byl léčen sekvenčně chemoterapií (paklitaxel + karboplatina, říjen 2009 až leden 2010, bez komplikací) a radioterapií hrudníku (duben až květen 2010, bez komplikací) v celkové dávce 64 Gy (32 × 2 Gy) s efektem parciální regrese nemoci. Dle CT hrudníku po radioterapii došlo k parciální regresi velikosti tumoru (do klinického stadia IIA), známky poradiační pneumonitidy nebyly na CT přítomny. Následně byl zvažován resekční výkon, který byl ale kontraindikován pro limitující spiroergometrické výsledky. Pro progresi onemocnění v lednu 2011 (progrese tumoru dle CT hrudníku a progrese endobronchiálního nálezu) byla zahájena 2. linie chemoterapie docetaxelem, která byla ale po dvou cyklech ukončena pro další progresi velikosti nádoru jednoznačně patrnou již na skiagramu hrudníku (únor 2011). Následně byla zahájena léčba erolotinibem ve 3. linii protinádorové léčby (únor 2011) (CT hrudníku – obr. 1). Klinické stadium nemoci v době zahájení léčby erlotinibem bylo IIIA, léčba byla schválena zdravotní pojišťovnou mimo platná indikační kritéria, s ohledem na vyčerpané možnosti onkologické léčby. Pacient byl v době zahájení léčby erlotinibem v dobrém klinickém stavu, performance status (PS) 0. Příznivý efekt léčby erlotinibem (stabilizace onemocnění – SD) byl poprvé zdokumentován v květnu 2011 pomocí skiagramu hrudníku a trvající SD opakovaně pomocí CT hrudníku (únor 2013, květen 2014, květen 2015). Léčba byla tolerována bez významných nežádoucích účinků. V září 2015 byla na CT vyšetření detekována expanze pravé ledviny. Ve spolupráci s urologem byla indikována pravostranná nefrektomie (provedena v září 2015), histologicky byl prokázán primární adenokarcinom ledviny. Až na krátké přerušení v době operace a bezprostředně po ní nemocný pokračoval v užívání erlotinibu. K prosinci 2016 efekt léčby v podobě stabilizace nemoci trvá, aktuálně po dobu 68 měsíců od zahájení léčby erlotinibem (CT hrudníku – obr. 2), přičemž nemocný stále v léčbě erlotinibem pokračuje.
Obr. 1. CT hrudníku pacienta č. 1 v době zahájení léčby erlotinibem (únor 2011). Obrázek zobrazuje tumor horního laloku pravé plíce a související dys-/atelektatické změny v oblasti horního laloku pravé plíce. 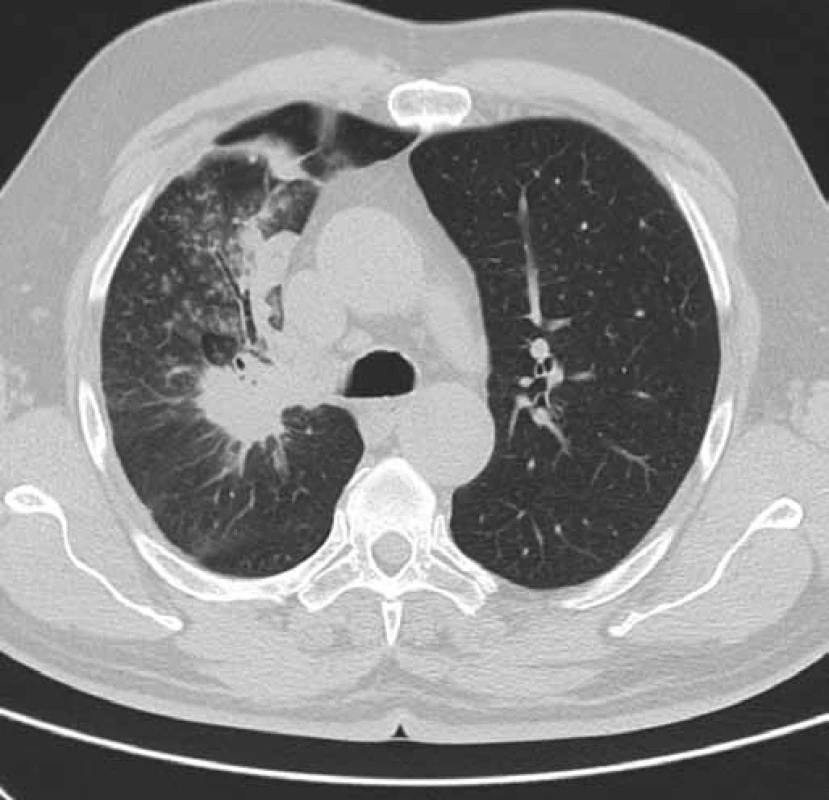
Obr. 2. Kontrolní CT hrudníku pacienta č. 1 v době probíhající léčby erlonitibem. Obrázek zobrazuje stacionární velikost tumoru horního laloku pravé plíce a regresi dys-/atelektatických změn horního laloku pravé plíce. Efekt léčby erlotinibem – stabilizace nemoci (červenec 2016). 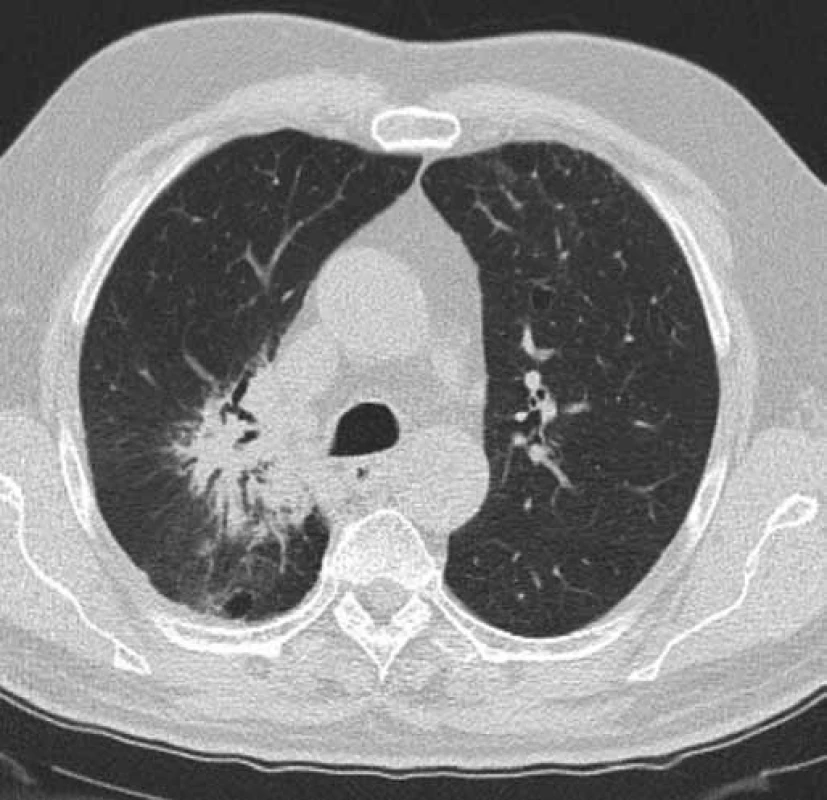
Kazuistika 2
Muž ve věku 68 let, bývalý kuřák, v předchorobí po radikální laryngektomii pro SCC v únoru 2006, s hypertenzní nemocí, chronickou obstrukční plicní nemocí a diabetem měl v březnu 2009 diagnostikován středně až nízce diferencovaný (grade 2–3) SCC levé plíce, T3 N0 M0, klinické stadium IIIA. Diagnóza byla stanovena histologicky z endobronchiálního nálezu tumoru v levém dolním lobárním bronchu. Nemocný byl v dubnu až červnu 2009 léčen neoadjuvantní chemoterapií (paklitaxel + karboplatina), která byla po třech cyklech ukončena pro výraznou endobronchiální progresi tumoru. V srpnu až září 2009 následovala radioterapie hrudníku v dávce 60 Gy (30 × 2 Gy, bez komplikací) s efektem stabilizace nemoci. Pro rychlou progresi nemoci v listopadu 2009 (nově hemoptýza a dle CT progrese velikosti tumoru a nově lymfadenopatie) byla brzy poté zahájena 2. linie protinádorové léčby docetaxelem. Dle CT hrudníku nebyly přítomny známky poradiační pneumonitidy. I léčba docetaxelem byla již po dvou cyklech podání ukončena pro progresi tumorózního infiltrátu vlevo (dle skiagramu i CT hrudníku) a pro zhoršení klinického stavu (nechutenství, recidiva hemoptýzy, váhový úbytek). V lednu 2010 byla zahájena 3. linie léčby erlotinibem (CT hrudníku – obr. 3). V době zahájení terapie erlotinibem bylo klinické stadium nemoci IIIB. Pro četné nežádoucí účinky léčby (exantém, průjem, paronychia, konjunktivitida, hepatopatie) byla denní dávka léku redukována. První léčebný efekt erlotinibu byl dokumentován v březnu 2010 dle skiagramu hrudníku (parciální regrese tumorózního infiltrátu). V říjnu 2011 i v březnu 2013 byla dle CT hrudníku dokumentována nadále stabilizace onemocnění, nemocný byl v dobrém klinickém stavu (CT hrudníku – obr. 4). Záhy po poslední klinické kontrole v březnu 2013 byl pacient ztracen ze sledování. Zpětně bylo zjištěno úmrtí v dubnu 2013, příčina smrti nebyla zjištěna. Doba do progrese při léčbě erlotinibem byla 40 měsíců, celkové přežití (overall survival – OS) od stanovení diagnózy nemocného bylo 50 měsíců.
Obr. 3. CT hrudníku pacienta č. 2 v době zahájení léčby erlotinibem (leden 2010). Obrázek znázorňuje tumor dolního laloku levé plíce cirkulárně zužující průsvit dolního lobárního bronchu a související dys-/atelektatické změny dolního laloku levé plíce 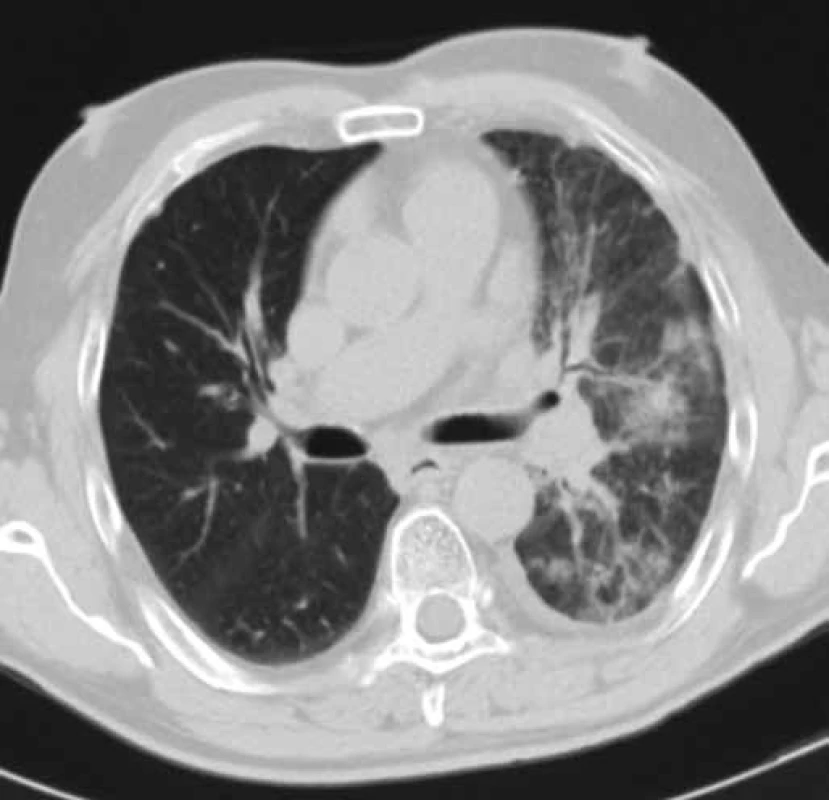
Obr. 4. CT hrudníku pacienta č. 2 v době probíhající léčby erlotinibem (duben 2013). Obrázek zobrazuje částečné zmenšení velikosti tumoru levé plíce a téměř úplné vymizení dys-/atelektatických změn dolního laloku levé plíce. Efekt léčby erlotinibem – parciální regrese. 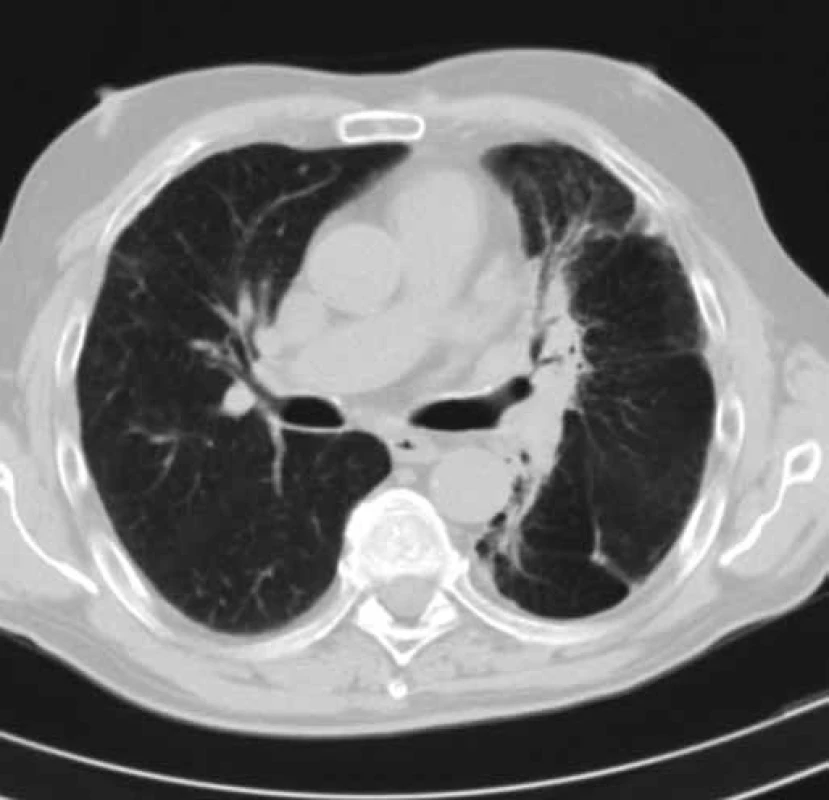
Kazuistika 3
Muž ve věku 70 let, bývalý kuřák, s ischemickou chorobou srdeční a diabetem II. typu měl v říjnu 2009 z bioptického odběru pod CT kontrolou diagnostikován středně diferencovaný (grade 2) SCC dolního laloku levé plíce, T3 N1 M0, klinické stadium IIIA. Byl léčen sekvenčně neoadjuvantní chemoterapií (paklitaxel + karboplatina) v listopadu 2009 až březnu 2010 a radioterapií hrudníku v květnu až červenci roku 2010 v celkové dávce 76 Gy (38 × 2 Gy, bez akutních komplikací). Dle kontrolního CT hrudníku v listopadu 2010 byly patrny poradiační změny v dorzobazálních segmentech levé plíce a efekt radioterapie byl SD. V červnu 2011 byl pacientovi diagnostikován adenokarcinom colon ascendens, který byl radikálně odoperován pravostrannou hemikolektomií. Stabilizace plicního onkologického onemocnění trvala do ledna 2012, kdy byly dle CT vyšetření nově detekovány solitární metastáza v horním laloku pravé plíce, paramaligní fluidotorax vpravo a perikardiální výpotek (klinické stadium IV) a byl zhoršen klinický stav pacienta (dušnost, váhový úbytek, bolesti na hrudi). Ve stejné době byl proveden ultrazvuk břicha i ultrazvuk střev, které byly bez patologie, ani dle CT hrudníku nebyly v části břišní dutiny (játra, nadledviny, přehledná část retroperitonea) přítomny ložiskové změny. Laboratorně byla hladina CEA v normě. Pro hraniční výkonnostní stav pacienta (PS 1–2) nebyla histologická verifikace provedena a s ohledem na výše zmíněné nálezy byl stav uzavřen jako progrese plicního nálezu. Ani v dalším průběhu v letech 2012 a 2013 žádné z nálezů (sonografie břicha, CT hrudníku, tumor markery) nesvědčily pro recidivu adenokarcinomu tlustého střeva. V rámci další (pneumo-) onkologické léčby byla s ohledem na stav výkonnosti zvolena v 2. linii protinádorové léčby šetrnější léčba erlotinibem. Pacient až na mírné nežádoucí účinky léčbu toleroval dobře. V dubnu 2013 byla léčba erlotinibem pro progresi nemoci ukončena (dle CT hrudníku v dubnu 2013 dvojnásobné zvětšení metastázy pravé plíce, nově další nodularity pravé plíce). Následovala 3. linie protinádorové léčby docetaxelem (květen až červenec), která již byla bez efektu, a pacient v únoru 2014 zemřel. Doba do progrese nemoci při léčbě erlotinibem byla 14 měsíců, OS nemocného bylo 43 měsíců od stanovení diagnózy.
Diskuze
U třech námi popsaných pacientů byl pozorován významný efekt léčby erlotinibem. Doba do progrese nemoci při léčbě erlotinibem byla 68, 40 a 14 měsíců, přičemž pacient č. 1 k prosinci 2016 v léčbě stále pokračuje. OS u dvou zemřelých pacientů bylo 50 a 43 měsíců od stanovení diagnózy.
Vysvětlením pro tak dobrý léčebný efekt erlotinibu u námi popsaných pacientů by mohl být pomalý vývoj nemoci, který je u SCC popisován. Dalším možným vysvětlením je, že již v úvodu nemoci se mohlo jednat o smíšené typy nádoru, u nichž složka adenokarcinomu nebyla zachycena. Teoreticky mohlo dojít ke změně histologické povahy nádoru v průběhu léčby (žádný z nemocných nebyl v době zahájení léčby erlotinibem histologicky reverifikován ani vyšetřen na přítomnost mutací EGFR). Průkaz mutací genu pro EGFR není pro SCC typická, naopak v případě průkazu EGFR mutace ve vzorku zhodnoceném jako SCC se při podrobnějším zhodnocení obvykle prokáže přítomnost složky adenokarcinomu [8]. Recentní studie Sette et al pak poodhaluje potenciální molekulárně-genetické mechanizmy účinku erlotinibu u SCC [9]. U pacienta č. 1 může vysvětlovat dlouhotrvající efekt léčby erlotinibem i nižší stadium nemoci v době zahájení léčby erlotinibem (IIIA).
Pětileté OS pacientů s neléčeným NSCLC napříč všemi stadii je kolem 12 % [10], ve stadiích IIIB a IV pak v intervalu 1–7 % [11,12]. Použitím chemoterapeutického režimu platinovým dubletem (kombinace cisplatina nebo karboplatina + paklitaxel/docetaxel/vinorelbin/gemcitabin) lze u cca 30 % pacientů v pokročilých stadiích NSCLC dosáhnout léčebné odpovědi trvající v průměru 4–5 měsíců [7].
Výhody léčby erlotinibem byly prokázány ve studii TITAN – stejná léčebná odpověď i doba OS (5,3 měsíce s erlotinibem vs. 5,5 měsíce ve skupině s chemoterapií; p = 0,73) u nemocných se SCC léčených erlotinibem vs. platinovým dubletem ve 2. linii [7]. Při léčbě erlotinibem byl ale zaznamenán nižší výskyt závažnějších nežádoucích účinků. Ve studii BR21 byl prokázán příznivý vliv erlotinibu na dobu do progrese (2,2 vs. 1,8 měsíce pro placebo; p < 0,001) i na celkovou dobu přežití (6,7 vs. 4,7 měsíce pro placebo; p < 0,001) ve 3. linii léčby SCC [13].
Recentně publikovaná studie LUX-Lung 8 srovnávající efekt erlotinibu a afatinibu u pacientů ve 2. linii léčby pokročilého SCC prokázala delší dobu do progrese (2,6 vs. 1,9 měsíce; p = 0,01) i delší dobu OS (7,9 vs. 6,8 měsíce; p = 0,007) ve prospěch afatinibu [14]. Afatinib by tak v budoucnu mohl rozšířit terapeutické možnosti léčby SCC.
Závěr
Naše kazuistiky i dostupné literární údaje dokládají, že léčba erlotinibem může mít významný léčebný efekt také u pacientů se SCC. Erlotinib ve 2. a 3. linii protinádorové léčby SCC může být alternativou i u pacientů, u kterých nelze zahájit chemo-či radioterapii. V individuálních případech pak léčba erlotinibem může vést ke dlouhodobé stabilizaci onemocnění, a tím i k několikaletému přežívání pacientů.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 5. 8. 2016
Přijato: 14. 12. 2016
MUDr. Kristián Brat
Klinika nemocí plicních a tuberkulózy LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: Brat.Kristian@fnbrno.cz
Zdroje
1. Dušek L, Májek O, Mužík J et al. Morfologie zhoubných nádorů průdušnice, průdušek a plic. In: Skřičková J, Kolek V (eds). Základy moderní pneumoonkologie. 1. vyd. Praha: Maxdorf 2012 : 22–24.
2. Skřičková J, Tomíšková M, Kaplanová J. Nemalobuněčný karcinom plic. Onkologická péče 2008; 12 (4): 5–9.
3. Hirsch FR, Varella-Garcia M, Bunn PA Jr et al. Epidermal growth factor receptor in non-small-cell lung carcinomas: correlation between gene copy number and protein expression and impact on prognosis. J Clin Oncol 2003; 21 (20): 3798–3807.
4. Robešová B. Molekulárně genetické vyšetření v diagnostice karcinomu plic. In: Skřičková J, Kolek V (eds). Základy moderní pneumoonkologie. 1. vyd. Praha: Maxdorf 2012 : 87–95.
5. Heist RS, Sequist LV, Engelman JA. Genetic changes in squamous cell lung cancer: a review. J Thorac Oncol 2012; 7 (5): 924–933. doi: 10.1097/JTO.0b013e31824cc334.
6. Skřičková J, Jakubíková L, Kadlec B. Biologická léčba nemalobuněčného karcinomu plic. In: Skřičková J, Kolek V (eds). Základy moderní pneumoonkologie. 1. vyd. Praha: Maxdorf 2012 : 235–254.
7. Ciuleanu T, Stelmakh L, Cicenas S et al. Efficacy and safety of erlotinib versus chemotherapy in second-line treatment of patients with advanced, non-small-cell lung cancer with poor prognosis (TITAN): a randomised multicentre, open-label, phase 3 study. Lancet Oncol 2012; 13 (3): 300–308. doi: 10.1016/S1470-2045 (11) 70 385-0.
8. Paik PK, Varghese AM, Sima CS et al. Response to erlotinib in patients with EGFR mutant advanced non-small cell lung cancers with a squamous or squamous-like component. Mol Cancer Ther 2012; 11 (11): 2535–2540. doi: 10.1158/1535-7163.MCT-12-0163.
9. Sette G, Salvati V, Mottolese M et al. Tyr1068-phosphorylated epidermal growth factor receptor (EGFR) predicts cancer stem cell targeting by erlotinib in preclinical models of wild-type EGFR lung cancer. Cell Death Dis 2015; 6 (8): e1850. doi: 10.1038/cddis.2015.217.
10. Non-Small Cell Lung Cancer Collaborative Group. Chemotherapy in non-small cell lung cancer: a meta-analysis using updated data on individual patients from 52 randomised clinical trials. BMJ 1995; 311 (7010): 899–909.
11. Favaretto AG, Pasello G, Magro C. Second and third line treatment in advanced non-small cell lung cancer. Discov Med 2009; 8 (43): 204–209.
12. Mountain CF. Revisions in the International System for Staging Lung Cancer. Chest 1997; 111 (6): 1710–1717.
13. Shepherd FA, Rodrigues Pereira J, Ciuleanu T et al. Erlotinib in previously treated non-small-cell lung cancer. N Engl J Med 2005; 353 (2): 123–132.
14. Soria JC, Felip E, Cobo M et al. Afatinib versus erlotinib as second-line treatment of patients with advanced squamous cell carcinoma of the lung (LUX-Lung 8): an open-label randomised controlled phase 3 trial. Lancet Oncol 2015; 16 (8): 897–907. doi: 10.1016/S1470-2045 (15) 00006-6.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Aktuální doporučení pro prevenci a terapii venózní trombembolické nemoci u onkologicky nemocnýchČlánek Káva v chemoprevenci nádorůČlánek Vybrané epidemiologické ukazovatele karcinómu prostaty na Slovensku v porovnaní so zahraničímČlánek SOUTĚŽ O NEJLEPŠÍ PRÁCIČlánek Aktuality z odborného tiskuČlánek Onkologie v obrazech
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2017 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Aktuální doporučení pro prevenci a terapii venózní trombembolické nemoci u onkologicky nemocných
- Káva v chemoprevenci nádorů
- Vybrané epidemiologické ukazovatele karcinómu prostaty na Slovensku v porovnaní so zahraničím
- Stereotaktická radioterapie karcinomu prostaty – efektivita a toxicita
- Autoimunní hemolytická anémie způsobená léčbou ipilimumabem
- Effect of Erlotinib in 2nd and 3rd Line Anticancer Treatment in Patients with Squamous Cell Lung Cancer – Case Series
- Palbociklib v kombinaci s fulvestrantem prodlužuje přežití bez progrese u pacientek s hormonálně dependentním, HER2 negativním metastatickým karcinomem prsu po progresi na předchozí hormonální terapii – komentář ke studii PALOMA-3
- Aktuality z odborného tisku
- Prof. MUDr. Pavel Klener, DrSc., se v dubnu 2017 dožívá 80 let
- MUDr. Tačo Tačev, DrSc. – významné životní jubileum
- Spomienka na prof. MUDr. Juraja Šveca, DrSc.
- Onkologie v obrazech
- Z historie časopisu Klinická onkologie
- Slovo má zakladatel a první šéfredaktor časopisu Klinická onkologie
- SOUTĚŽ O NEJLEPŠÍ PRÁCI
- Poškození kognitivních funkcí po chemoterapii u pacientů s Hodgkinovým lymfomem – patofyziologie a rizikové faktory
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Poškození kognitivních funkcí po chemoterapii u pacientů s Hodgkinovým lymfomem – patofyziologie a rizikové faktory
- Káva v chemoprevenci nádorů
- Stereotaktická radioterapie karcinomu prostaty – efektivita a toxicita
- Vybrané epidemiologické ukazovatele karcinómu prostaty na Slovensku v porovnaní so zahraničím
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



