Imunoterapie nádorů dolní části trávicí trubice
Immunotherapy of Colorectal and Anal Carcinoma
Background:
The lower part of the digestive tract includes the large intestine, rectum and anus. Treatment algorithms of cancers in these localities have significant differences in both early and advanced stages. The vast majority of metastatic cases are incurable. A few years ago, it was generally accepted that gastrointestinal tumors are poorly immunogenic and modern immunotherapy would not work in gastrointestinal cancers. The breakthrough has become the recognition of the mismatch repair system (MMR) that affects the microsatellite instability (MSI) and it‘s role in the development of colorectal carcinoma (CRC). Metastatic colorectal carcinoma (mCRC) with defect MMR (dMMR) and MSI-H, resp. is immunogenic and can be a target of modern imunotherapy directed on the PD1/PD-L1 axis. Such a treatment can improve prognosis and life quality od patients with mCRC MSI-H. Immunotherapy effectiveness was shown also in a subgroup of patients with a BRAF mutation where the effectiveness of existing systemic treatment is low. The proven predictive factor is dMMR/MSI-H. PD-1 expression does not have this significance. Results of clinical studies with nivolumab and pembrolizumab result in the inclusion of these drugs in mCRC treatment algorithms. Phase II study shows nivolumab effectiveness also in pretreated metastatic anal cancer.
Purpose:
An overview of basic information on the possibilities of immunotherapy in CRC and anal cancers.
Key words:
cancer immunotherapy – checkpoint inhibitors – colorectal cancer – anal cancer – nivolumab – pembrolizumab
Supported by MH CZ – DRO (MMCI, 00209805)
I declare that, in connection with the abovementioned contribution, which I am an author, I have a conflict of interest with the following companies: BMS, Roche, Merck, Amgem and Bayer.
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted:
7. 9. 2017
Accepted:
5. 11. 2017
Autoři:
J. Tomášek
; I. Kiss
Působiště autorů:
Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno
Vyšlo v časopise:
Klin Onkol 2017; 30(Supplementum3): 62-65
Kategorie:
Přehled
prolekare.web.journal.doi_sk:
https://doi.org/10.14735/amko20173S62
Souhrn
Východiska:
Dolní část trávicího traktu zahrnuje tlusté střevo, konečník a řiť. Algoritmy léčby nádorů v těchto lokalitách mají zásadní odlišnosti jak v časných, tak v pokročilých stadiích. Ve stadiu metastáz se jedná v naprosté většině případů o nevyléčitelné onemocnění. Ještě před několika lety byl obecně přijímán názor, že nádory trávicího traktu jsou málo imunogenní a moderní imunoterapie zaměřená na kontrolní body imunitní reakce nebude mít v této oblasti zásadní význam. Přelomovým se stalo poznání role systému oprav chybného párování bází DNA (mismatch repair – MMR), který ovlivňuje míru mikrosatelitové nestability (microsatellite instability – MSI). Metastatický kolorektální karcinom (colorectal cancer – CRC) s defektem MMR (dMMR), a tedy vysokou mírou MSI (MSI-H), je imunogenní a moderní imunoterapie zaměřená na osu PD-1/PD-L1 může zásadně zlepšit prognózu takových pacientů a udržet nebo zlepšit kvalitu jejich života. Ukazuje se, že imunoterapie je účinná také u podskupiny pacientů s mutací BRAF, kde je účinnost dosavadní protinádorové farmakoterapie malá. Prokázaným prediktivním faktorem účinnosti je průkaz dMMR, resp. MSI-H, průkaz exprese PD-1 tento význam nemá. Výsledky klinických studií s nivolumabem a pembrolizumabem vedou k zařazování těchto léků do algoritmů léčby metastatického CRC. Studie fáze II prokázaly aktivitu nivolumabu a pembrolizumabu také u předléčených pacientů s metastatickým nádorem anu.
Cíl:
Přehled základních informací o možnostech imunoterapie u CRC a karcinomu anu.
Klíčová slova:
imunoterapie – checkpoint inhibitory – kolorektální karcinom – anální karcinom – nivolumab – pembrolizumab.
Úvod
Možnosti léčby metastatického kolorektálního karcinomu (colorectal cancer – CRC) jsou velmi komplexní. Jen u menší části pacientů je možná radikální resekce metastáz s kurativním záměrem. Ve většině případů jde o léčbu paliativní s cílem prodloužit celkové přežití (overall survival – OS) při zachování dobré kvality života. Základem systémové léčby je kombinovaná chemoterapie, jejíž účinnost zvyšuje cílená léčba zaměřená především na signální dráhu receptoru vaskulárního endoteliálního růstového faktoru (vascular endothelial growth factor receptor – VEGFR) nebo signální dráhu receptoru epidermálního růstového faktoru (epidermal growth factor receptor – EGFR). Prediktivní faktory umožňují zpřesnit indikaci cílených léků, především inhibitorů EGFR. Medián OS pacientů s metastatickým CRC, kteří jsou schopni intenzivní chemoterapie v různých souborech, přesahuje 30 měsíců, 5leté přežití se ale pohybuje jen kolem 13,5 % [1]. Moderní imunoterapie rozšiřuje možnosti léčby pro část pacientů s tímto závažným onemocněním.
Mikrosatelitová nestabilita
Mikrosatelity jsou krátké repetitivní sekvence DNA s jednotnou délkou od jedné do šesti bází. Vyskytují se v nekódujících oblastech genomu a méně často také v kódujících oblastech. Jsou vysoce polymorfní mezi jednotlivými subjekty, avšak u jednoho jedince stabilní (mají jednotnou délku). Mutace v genech pro opravu chybného párování bází DNA (mismatch repair – MMR) se manifestují vysokou mírou nestability mikrosatelitů v DNA nádoru. Termín mikrosatelitová nestabilita (microsatellite instability – MSI) znamená nestálý počet opakování repetičních úseků v mikrosatelitních sekvencích DNA, tedy různou délku mikrosatelitů. MSI-H (MSI-high) lze chápat jako marker defektu MMR (dMMR) a charakterizuje buňky s vysokou mutační náloží. Nádor s MSI-H má tisíce mutací. Právě u těchto MSI-H nádorů byla prokázána vysoká míra infiltrace nádorové tkáně tumor infiltrujícími leukocyty (tumor infiltrating lymphocytes – TIL). Zároveň byla v nádorové tkáni prokázána vysoká míra exprese proteinů, které mají funkci tzv. imunitních kontrolních bodů (PD-1, PD-L1, CTLA-4, LAG-3), což brání imunitnímu dohledu zničit nádorové buňky a zároveň je to předpokladem účinnosti imunoterapie [2]. Druhou a větší skupinou jsou nádory bez defektu MMR (pMMR).
Vyšetření MSI má klinické využití u sporadických i hereditárních nádorů. Jde o významný prediktivní biomarker účinnosti imunoterapie. V zásadě je možné vyšetření stavu MMR dvěma způsoby:
- Molekulární vyšetření MSI pomocí sekvenování DNA znamená vyšetření DNA nádorové tkáně (nativní, zamražené nebo fixované v parafinu) a detekuje variabilitu v délce sekvencí. Jde o přímé potvrzení dMMR. Vyšetření ale nedetekuje, zda je MSI-H výsledkem zděděné gametické mutace, jako je tomu např. u hereditárního nepolypózního kolorektálního karcinomu (Lynchova syndromu), nebo jde o mutaci somatickou, která se vyskytuje pouze v nádorové tkáni. K rozlišení, zda jde o hereditárně podmíněnou malignitu, je tedy nutné vyšetření také nenádorové tkáně.
- Imunohistochemický průkaz chybění exprese MMR proteinů je nepřímým důkazem dMMR.
MSI-H je přítomna až u 90 % karcinomů tlustého střeva u osob s Lynchovým syndromem, u sporadických nádorů to je jen asi 15 %, v podskupině pacientů s metastatickým CRC to je jen 5 %. Hlavními geny MMR jsou MLH1, MSH2, MSH6, PMS2 a PMS1, vzácněji může jít o mutace v genech MLH3 nebo EXO1. Nádory metastatického CRC MSI-H mají špatnou prognózu při léčbě konvenční chemoterapií.
Imunoterapie v léčbě kolorektálního karcinomu
Již v roce 2006 byla publikována práce prokazující, že v tkáni CRC lze zjistit a měřit rozdílnou míru infiltrace imunitními buňkami a různé profily genové exprese mohou predikovat OS [3]. Nádorové mikroprostředí je tvořeno jednak vlastními nádorovými buňkami, jednak ostatními buňkami, které jsou asociovány s nádorem. Významnou část těchto buněk tvoří imunitní buňky, které infiltrují nádor. Jde o T lymfocyty, dendritické buňky, granulocyty, makrofágy i NK (natural killer) buňky. Charakter nádorového mikroprostředí daný typem, množstvím a lokalizací imunitních buněk v infiltrátu primárního nádoru má prognostický význam, byl popsán vztah k OS [4]. Tento infiltrát lze popsat pomocí tzv. imunoskóre [5].
Progrese nádorového onemocnění je dána porušením rovnováhy mezi invazivním nádorovým procesem a obrannými systémy, ve kterých hraje imunitní dohled zásadní roli.
Pembrolizumab v léčbě dMMR metastatického CRC
V roce 2016 byla na kongresu ASCO publikována data o účinnosti pembrolizumabu u pacientů s metastatickým CRC dMMR/MSI-H. Pembrolizumab je inhibitor PD-1 (membránový protein programované buněčné smrti) a důvodem pro jeho testování u CRC byl předpoklad, že nádory MSI-H vč. CRC mohou reagovat na inhibici kontrolních bodů imunitní reakce. Doktorka Le zahrnula do své studie tři kohorty pacientů. V první skupině byli pacienti s metastatickým CRC dMMR, v druhé skupině byli nemocní s mCRC pMMR a v třetí kohortě byli zahrnuti pacienti s nádory dMMR, ale nešlo o CRC. Pacienti s metastatickým CRC byli předléčeni nejméně dvěma liniemi systémové terapie. Všichni byli léčeni pembrolizumabem v dávce 10 mg/kg každé 2 týdny. V kohortě CRC dMMR byla pozorována vysoká míra regrese onemocnění, míra objektivní léčebné odpovědi byla (objective response rate – ORR) 57 % (95% CI 39–73) vs. 0 % (95% CI 0–13) v kohortě metastatického CRC pMMR. Ve skupině dMMR bylo také často dosaženo stabilizace onemocnění (stabel disease – SD). V kohortě metastatického CRC dMMR bylo dosaženo kompletní remise (complete remission – CR) v 11 %, parciální regrese (partial regretion – PR) v 46 % a SD 32 % ve 12. týdnu léčby. V kohortě metastatického CRC pMMR to bylo 0 a 16 %. Toto bylo zřejmým důkazem, že podskupina pacientů s metastatickým CRC s dMMR má prospěch z léčby inhibitory PD-1. Vysoká míra ORR se promítla také do prodloužení OS a přežití bez progrese (progression-free survival – PFS). Data jsou zatím málo zralá a medián OS a PFS nebyl ve skupině metastatického CRC dMMR zatím dosažen. Naproti tomu byl u pacientů s metastatickým CRC pMMR medián OS 5,98 měsíce a PFS 2,3 měsíce. Bezpečnostní data pembrolizumabu odpovídala údajům ze studií u jiných nádorů, léčba byla dobře tolerovaná. Většina nežádoucích příhod byla mírná (stupeň 1/ 2), v malé podskupině se projevily autoimunitně podmíněné nežádoucí příhody [6]. Tyto pozitivní výsledky vedly k zařazení checkpoint inhibitorů do algoritmu léčby metastatického CRC dMMR (MSI-H) v NCCN (National Comprehensive Cancer Network) doporučeních (platné ve Spojených státech) [7]. V Evropě tato léčba zatím pro metastatický CRC registrována není. Určitě je pozoruhodné, že se jedná o první protinádorovou léčbu, která je ve Spojených státech registrována pro léčbu nádorů podle jejich molekulárního profilu a ne podle lokalizace primárního nádoru.
Samotná exprese PD-L1 nemá prediktivní význam pro účinnost pembrolizumabu u metastatického CRC. Bylo to prokázáno již na předběžných výsledcích klinické studie KEYNOTE-028, která testovala pembrolizumab u metastatického CRC s expresí PD-L1. ORR a SD bylo dosaženo jen ve 4 %, resp. 22 %, pouze jeden pacient s MSI-H dosáhl regrese onemocnění [8]. Ukazuje se, že prediktorem účinnosti imunoterapie založené na blokaci imunitních kontrolních bodů je stav MSI spíše než exprese PD-L1.
Nivolumab a ipilimumab v léčbě dMMR metastatického CRC
Nivolumab je monoklonální protilátka anti-PD-1, která selektivně blokuje jeho vazbu na ligandy PD-L1 a PD-L2 a tím obnovuje protinádorovou imunitu. Ipilimumab je monoklonální protilátka IgG1, která se selektivně váže na CTLA-4 (cytotoxic T-lymphocyte antigen-4), což je antigen exprimovaný na povrchu T lymfocytů a má funkci negativního regulátoru adaptivní imunitní odpovědi. Účinnost kombinace nivolumab + ipilimumab byla prokázána v terapii pokročilého maligního melanomu (malignant melanoma – MM), kdy má kombinovaná léčba větší efekt než blokáda kontrolních bodů monoterapií [9].
Klinická studie fáze II CheckMate 142 testovala účinnost a bezpečnost samotného nivolumabu a jeho kombinaci s ipilimumabem u předléčených pacientů s metastatickým CRC [10]. Pacienti byli rozděleni do dvou kohort, první dMMR (dMMR/MSI-H), druhá s funkčním (proficientním) MMR a s mikrosatelitovou stabilitou (microsatellite stable – MSS). Do studie bylo zahrnuto 120 pacientů s MSI-H metastatickým CRC, kteří byli předléčeni nejméně jednou linií protinádorové terapie a byli v dobrém výkonnostním stavu (ECOG PS 0 a 1). Ve fázi I studie byli všichni pacienti léčeni nivolumabem v dávce 3 mg/kg každé 2 týdny a ve fázi II studie byli léčeni buď dále nivolumabem, nebo kombinací nivolumab + ipilimumab (1 mg/kg každé 3 týdny), přičemž byly podány čtyři cykly kombinované léčby a následovala opět monoterapie nivolumabem. Primárním cílem studie byla ORR podle RECIST 1.1 stanovená investigátory. Publikovány byly výsledky první interim analýzy 27 pacientů s kombinovanou léčbou a mediánem sledování nejméně 12 týdnů. Bylo dosaženo vysoké ORR – 33,3 % (95% CI 18,6–50,9). Nebylo dosaženo žádné CR, ale 9 pacientů dosáhlo PR a u 14 byla SD. ORR byly stabilní, medián jejich trvání nebyl zatím dosažen. Jakékoliv regrese nádoru (tedy i malé, nesplňující kritéria pro PR) bylo při kombinované léčbě dosaženo u 81 % pacientů proti 56 % při léčbě nivolumabem v monoterapii. Také PFS byl zlepšen při kombinované léčbě proti monoterapii nivolumabem, 6měsíční PFS bylo 66,6 % (95% CI 45,5–81,1) vs. 45,9 % (95% CI 29,8–60,7). Data studie nejsou zatím zralá a medián PFS kombinované léčby zatím nebyl dosažen. Medián PFS u nivolumabu v monoterapii byl 5,3 měsíce (95% CI 1,5–nedosaženo). Zdá se, že kombinovaná léčba prodlužuje PFS, což je parametr zastupující ve studiích OS. Kombinovaná léčba byla provázena podle očekávání vyšší četností nežádoucích příhod. Nežádoucí příhody stupně 3 nebo 4 byly zaznamenány u 26,3 % pacientů s kombinovanou léčbou a u 14,3 % pacientů v rameni se samotným nivolumabem. Nežádoucí příhoda vedoucí k přerušení léčby se vyskytla ve 13,3 vs. 2,9 %.
Podrobnější výsledky monoterapie nivolumabem ze zmíněné studie CheckMate 142 byly recentně publikovány [11]. Z celkového počtu 74 pacientů bylo 54 % předléčeno ≥ 3 liniemi protinádorové léčby, 31,1 % (95% CI 20,8–42,9) dosáhlo ORR a 69 % (95% CI 57–79) kontroly onemocnění na nejméně 12 týdnů, medián trvání ORR nebyl dosažen, všichni respondéři byli naživu, u osmi z nich trvala celková léčebná odpověď déle než 12 měsíců. Výsledky byly nezávislé na stupni exprese PD-L1, mutačním stavu KRAS a BRAF. Podobně jako ve studiích s pembrolizumabem, nebyla zaznamenána žádná léčebná odpověď u pacientů s metastatickým CRC pMMR.
Pozoruhodné je, že ORR v podskupině pacientů s BRAF mutací (BRAFmt) byl 25 %, což je nejlepší výsledek jak ve srovnání s chemoterapií (< 10 %), tak s kombinovanou léčbou inhibitory BRAF, EGFR nebo MEK (10–16 %). Je tak dokladovaná účinnost nivolumabu v podskupině pacientů s BRAFmt, která má jinak velmi špatnou prognózu, proti podskupině bez této mutace (BRAFwt). Důležité je, že trvání celkové léčebné odpovědi i stabilizace jsou dlouhodobé, medián ve studii nebyl ještě dosažen.
Během léčby nivolumabem docházelo k ústupu symptomů a byla zlepšena kvalita života. Jde o léčbu s dobrým bezpečnostním profilem. Nejběžnější nežádoucí příhody stupně 3 a 4 byly zvýšení koncentrace lipázy (8 %) a amylázy (3 %). Nebylo zaznamenáno žádné úmrtí pacienta se vztahem k podání nivolumabu.
Imunoterapie v léčbě karcinom anu
Imunoterapie se prosazuje také v léčbě pokročilého a metastatického análního karcinomu. V jednoramenné klinické studii fáze II byl testován nivolumab u pacientů s metastatickým análním karcinomem, kteří byli refrakterní na běžnou systémovou chemoterapii. Do studie bylo zařazeno 37 pacientů a byly zaznamenány 2 CR a 7 PR – ORR 24 % (95% CI 15–33) [12]. Podobně příznivé výsledky byly zaznamenány ve studii KEYNOTE-028 s pembrolizumabem, kdy u obdobné skupiny pacientů se spinocelulárním karcinomem anu byl ORR 17 % (95% CI 5–37), kontroly onemocnění bylo dosaženo u 58 % [13]. Toxicita léčby v obou studiích byla dobře zvladatelná. Obě studie jsou zmíněny v algoritmech léčby NCCN pro léčbu análního karcinomu. Je zřejmé, že realizovat klinické studie fáze III u této vzácnější diagnózy je obtížné.
Pokračující klinické studie
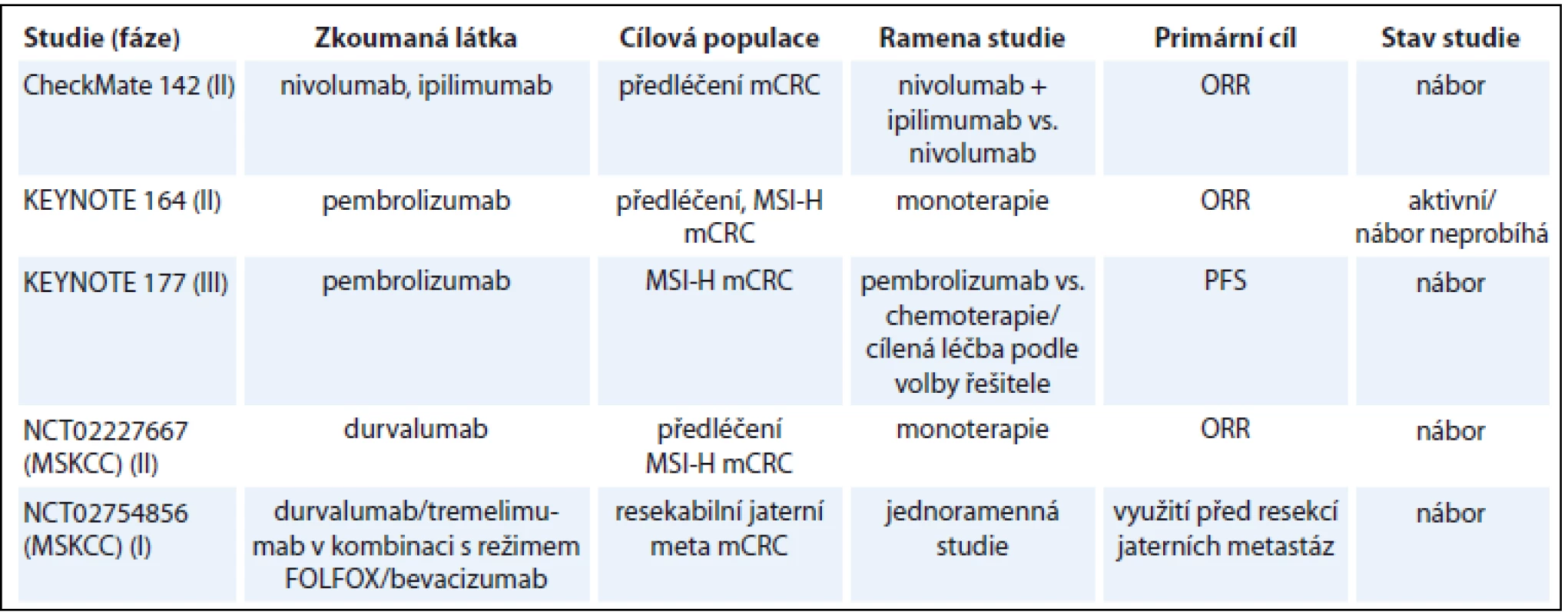
V současné době probíhá řada klinických studií s různými checkpoint inhibitory, a to jak v monoterapii (tab. 1) [14], tak v kombinaci s jinými checkpoint inhibitory [15], cílenou léčbou [16] nebo chemoterapií [17–18]. Imunoterapie u metastatického CRC dMMR je testována také v 1. linii léčby v klinické studii fáze III KEYNOTE-177, ve které je pembrolizumab testován proti chemoterapii podle volby investigátora.
Závěr
Účinnost systémové chemoterapie u pacientů s metastatickým CRC dMMR je malá a výsledky klinických studií s checkpoint inhibitory naději na lepší prognózu pro pacienty přinášejí. Účinnost imunoterapie zaměřené na osu PD-1/PD-L1 u této skupiny nemocných není vázána na expresi PD-L1, mutační stav KRAS nebo BRAF, jediným prokázaným prediktorem účinnosti nivolumabu a pembrolizumabu je dMMR/MSI-H. V dohledné době lze reálně očekávat registraci těchto léků pro léčbu metastatických CRC dMMR/MSI-H také v Evropské unii. Pro tuto menší podskupinu pacientů s metastatickým CRC to bude přínos mimořádný.
Podpořeno MZ ČR – RVO (MOÚ, 00209805) Supported by MH CZ – DRO (MMCI, 00209805)
Prohlašuji, že v souvislosti s výše uvedeným příspěvkem, jehož jsem autorem/spoluautorem, mám střet zájmů s níže vypsanými společnostmi: BMS, Roche, Merck, Amgen, Bayer – podpora účasti na kongresu, placená přednáška na satelitním sympoziu, školicí akce pro zaměstnance firmy.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Jiří Tomášek, Ph.D.
Klinika komplexní onkologické péče
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: tomasek@mou.cz
Obdrženo: 7. 9. 2017
Přijato: 5. 11. 2017
Zdroje
1. National Cancer Institute. Surveillance, Epidemiology, and End Results Program. Cancer stat facts: colon and rectum cancer. [online]. Available from: http: //seer.cancer.gov/statfacts/html/colorect.html.
2. Llosa NJ, Cruise M, Tam A et al. The vigorous immune microenvironment of microsatellite instable colon cancer is balanced by multiple counter-inhibitory checkpoints. Cancer Discov 2015; 5 (1): 43–51. doi: 10.1158/2159-8290.CD-14-0863.
3. Galon J, Costes A, Sanchez-Cabo F et al. Type, density, and location of immune cells within human colorectal tumors predict clinical outcome. Science 2006; 313 (5795): 1960–1964. doi: 10.1126/science.1129139.
4. Pages F, Berger A, Camus M et al. Effector memory T cells, early metastasis, and survival in colorectal cancer. N Engl J Med 2005; 353 (25): 2654–2666. doi: 10.1056/NEJMoa051424.
5. Závadová E, Špaček J, Vočka M et al. Imunoscore a jeho prediktivní hodnota u kolorektálního karcinomu. Klin Onkol 2015; 28 (Suppl 4): 82–85. doi: 0.14735/amko20154S82.
6. Le DT, Uram JN, Wang H et al. Programmed death-1 blockade in mismatch repair deficient colorectal cancer. J Clin Oncol 2016; 34 (Suppl 15): abstr 103.
7. National Comprehensive Cancer Network. Guidelines Version 2.2017 Colon Cancer. [online]. Available from: https: //www.nccn.org/professionals/physician_gls/default.aspx.
8. O‘Neil BH, Wallmark J, Lorente D et al. Pembrolizumab (MK-3475) for patients with advanced colorectal carcinoma (CRC): Preliminary results from KEYNOTE-028. Eur J Cancer 2015; 51 (Suppl 3): abstr 502. doi: 10.1016/S0959-8049 (16) 30304-5.
9. Postow MA, Chesney J, Pavlick AC et al. Nivolumab and ipilimumab versus ipilimumab in untreated melanoma. N Engl J Med 2015; 372 (21): 2006–2017. doi: 10.1056/NEJMoa1414428.
10. Overman MJ, Kopetz S, McDermott RS et al. Nivolumab ± ipilimumab in treatment (tx) of patients (pts) with metastatic colorectal cancer (mCRC) with and without high microsatellite instability (MSI-H): CheckMate-142 interim results. J Clin Oncol 2016; 34 (Suppl 15): abstr 3501. doi: 10.1200/JCO.2016.34.15_suppl.3501.
11. Overman MJ, McDermott R, Leach JL et al. Nivolumab in patients with metastatic DNA mismatch repair-deficient or microsatellite instability-high colorectal cancer (CheckMate 142): an open-label, multicentre, phase 2 study. Lancet Oncol 2017; 18 (9): 1182–1191. doi: 10.1016/S1470-2045 (17) 30422-9.
12. Morris VK, Salem ME, Nimeiri H et al. Nivolumab for previously treated unresectable metastatic anal cancer (NCI9673): a multicentre, single-arm, phase 2 study. Lancet Oncol 2017; 18 (4): 446–453. doi: 10.1016/S1470-2045 (17) 30104-3.
13. Ott PA, Piha-Paul SA, Munster P et al. Safety and antitumor activity of the anti-PD-1 antibody pembrolizumab in patients with recurrent carcinoma of the anal canal. Ann Oncol 2017; 28 (5): 1036–1041. doi: 10.1093/annonc/mdx 029.
14. Avelumab for MSI-H or POLE Mutated Metastatic Colorectal Cancer. ClinicalTrials.gov. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT03150706.
15. An Investigational Immuno-therapy Study of Nivolumab, and Nivolumab in Combination With Other Anti-cancer Drugs, in Colon Cancer That Has Come Back or Has Spread (CheckMate142). ClinicalTrials.gov. [online]. Available from: https: / / clinicaltrials.gov/ ct2/ show/ NCT02060188.
16. A study to investigate efficacy and safety of cobimetinib plus atezolizumab and atezolizumab monotherapy versus regorafenib in participants with metastatic colorectal adenocarcinoma. ClinicalTrials.gov. [online]. Available from: https: / / clinicaltrials.gov/ ct2/ show/ NCT02788279.
17. A Study Evaluating TAS-102 Plus Nivolumab in Patients With MSS CRC. ClinicalTrials.gov. [online]. Available from: https: / / clinicaltrials.gov/ ct2/ show/ NCT02860
546.
18. Study of Pembrolizumab in Combination With Chemotherapy for Patients With Advanced Colorectal Cancer. ClinicalTrials.gov [online]. Available from: https: / / clinicaltrials.gov/ ct2/ show/ NCT02375672.
Štítky
Detská onkológia Chirurgia všeobecná OnkológiaČlánok vyšiel v časopise
Klinická onkologie

2017 Číslo Supplementum3
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Tramadol a paracetamol v tlumení poextrakční bolesti
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
Najčítanejšie v tomto čísle
- Hodnocení zánětlivé celulizace (tumor infiltrujících lymfocytů) u solidních nádorů
- Souhrnné srovnání kritérií RECIST 1.1 a iRECIST pro hodnocení odpovědi na onkologickou léčbu solidních tumorů
- Imunoterapie nádorů dolní části trávicí trubice
- Imunoterapie v léčbě karcinomu plic
