-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Exprese a funkční charakterizace miR-34c u karcinomu děložního hrdla
Expression and Functional Characterization of miR-34c in Cervical Cancer
Background:
Cervical cancer is the fourth most common cancer in women and is usually associated with human papillomavirus infection. Viral infections are usually characterized by morphological changes of epithelial cells; however, it is difficult to determine using recently available screening methods whether the changes are caused by productive infection or by malignant disease. Thus, new efforts are required to find novel diagnostic biomarkers of cervical cancer, such as miRNAs, which are small non-coding RNAs involved in the regulation of gene expression.
Materials and Methods:
miR-34c levels in cervical cancer cell lines were determined by the droplet-digital polymerase chain reaction. Changes in miR-34c expression in vitro were achieved by transient transfection with a specific miRNA mimic and inhibitor oligonucleotides. Cell proliferation was analyzed by crystal violet staining followed by spectrophotometric measurements. The effect on migratory properties was studied using a „scratch“ assay. Western blotting analysis was used to determine the expression of selected proteins.
Results:
The downregulation of miR-34c expression was associated with a slight increase in cellular proliferation and a significant increase in cell migration. The analysis of miR-34c expression performed on a set of 39 dysplastic tissues and 35 samples of healthy controls subsequently revealed a significant difference (p < 0.01) in the level of this miRNA. Conclusion: Comparative expression analysis revealed lower expression of miR-34c in cervical precanceroses than in normal untransformed epithelium. in vitro modulation of miR-34c expression revealed its tumor suppressor role in cervical malignancies.
Key words:
cervical cancer – HPV – miRNA – HSIL – hsa-miR-34c – precancerosis
This work was supported by the projects MEYS – NPS I – LO1413, P206/12/G151 and MH CZ – DRO (MMCI, 00209805).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Accepted: 16. 7. 2018
Autori: Sommerová Lucia 1; Fraňková Hedvika 1; Anton Milan 2; Jandáková Eva 3; Vojtěšek Bořivoj 1; Hrstka Roman 1
Pôsobisko autorov: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno 1; Gynekologicko-porodnická klinika LF MU a FN Brno 3 Ústav patologie, LF MU a FN Brno 2
Vyšlo v časopise: Klin Onkol 2018; 31(Supplementum 2): 82-87
Kategória: Původní práce
doi: https://doi.org/10.14735/amko20182S82Súhrn
Východiska:
Karcinom děložního hrdla je čtvrtým nejčastějším onkologickým onemocněním u žen a v drtivé většině případů je spojen s infekcí lidskými papilomaviry. Virové infekce jsou obvykle doprovázeny morfologickými změnami epiteliálních buněk, avšak pomocí stávajících dostupných vyšetřovacích metod není lehké rozlišit, zda se jedná o projevy produktivní infekce, nebo změny vedoucí ke vzniku maligního onemocnění. Z toho důvodu stále narůstá potřeba nalézt vhodné diagnostické biomarkery karcinomu děložního hrdla, např. ve formě miRNA, tj. malých nekódujících molekul RNA regulujících genovou expresi.
Materiál a metody:
Hladina miR-34c v cervikálních nádorových liniích byla stanovena pomocí kapkové digitální polymerázové řetězové reakce. Zvýšení a inhibice exprese miR-34c in vitro bylo dosaženo pomocí transientní transfekce s využitím specifických oligonukleotidů, a to miRNA mimikujících, nebo miRNA inhibujících. Buněčná proliferace byla analyzována barvením krystalovou violetí s následným spektrofotometrickým měřením. Změny v migračních vlastnostech byly studovány pomocí „scratch“ testu. Exprese vybraných proteinů byla stanovena imunochemicky.
Výsledky:
Inhibice exprese miR-34c byla spojena s mírným zvýšením buněčné proliferace a především s výrazným zvýšením schopnosti buněk migrovat. Analýza exprese miR-34c prováděná na souboru 39 dysplastických tkání a 35 vzorků zdravých kontrol následně ukázala signifikantní rozdíl (p < 0,01) v hladině této miRNA.
Závěr:
Komparativní expresní analýza prokázala signifikantně sníženou expresi miR-34c u prekanceróz děložního hrdla v porovnání s normálním netransformovaným epitelem. Při modulaci exprese miR-34c in vitro byla potvrzena tumor supresorová úloha miR-34c u cervikálních malignit.
Klíčová slova:
karcinom děložního hrdla – HPV – miRNA – HSIL – hsa-miR-34c – prekanceróza
Úvod
Karcinogeneze děložního hrdla je vícestupňový proces, který je započat infekcí lidskými papilomaviry (human papillomavirus – HPV) s následnou epizomální perzistencí viru v hostitelské buňce a jeho začleněním do genomu. Ačkoli bylo popsáno více než 200 různých kmenů lidských HPV [1], se vznikem prekanceróz a následným nádorovým onemocněním jsou spojovány tzv. high-risk kmeny, především HPV16 a HPV18, které jsou původcem přibližně 70 % všech karcinomů děložního hrdla [2]. Samotnému vzniku karcinomu předchází vývoj přes prekancerózu, tzv. high-grade dlaždicobuněčnou intraepiteliální lézi (high-grade squamous intraepithelial lesions – HSIL). Za iniciaci maligní transformace jsou zodpovědné zejména virové onkoproteiny rané fáze E6 a E7, které inhibují tumor supresorové proteiny p53 a pRb (retinoblastomový protein). Protein p53 se aktivně podílí na celé řadě protinádorových funkcí, vč. regulace apoptózy, buněčného cyklu, genomové stability, angiogeneze a dalších procesů spojených s maligní transformací. pRb především blokuje buněčný cyklus v G1 fázi, čímž brání buňkám, aby se nekontrolovaně množily. V případě, že je buňka připravená k dělení, dochází k fosforylaci pRb a tím jeho inaktivaci [3].
Vzhledem ke skutečnosti, že stávající dostupné vyšetřovací metody nedokáží rozlišit, zda morfologické změny v epitelu děložního hrdla povedou ke vzniku nádoru či nikoli, roste akutní potřeba nalézt diagnostické biomarkery umožňující stanovit riziko vzniku karcinomu děložního hrdla. Aktuální a značně atraktivní možnost v tomto směru představují malé nekódující RNA molekuly zvané mikroRNA (miRNA). miRNA se obvykle váží na 3‘ UTR oblast (3‘ untranslated region), tedy 3‘ nepřekládanou oblast cílové mRNA, a indukují její degradaci nebo inhibují její translaci [4–6]. Mohou tudíž plnit funkci onkogenů, kdy inhibují expresi nádorových supresorů a jejich hladina je v nádorové tkáni zvýšená, nebo mohou mít naopak funkci antionkogenní a inhibovat expresi onkogenů, v tomto případě se v maligní tkáni obvykle setkáváme s jejich sníženou hladinou. Právě díky změnám exprese v nádorové tkáni mohou miRNA sloužit jako diagnostické, prediktivní a prognostické biomarkery, či dokonce i jako léčebné modality uplatnitelné při terapii nádorových onemocnění [7].
Spektrum miRNA spojených s karcinomem děložního hrdla není kompletně popsáno, stejně tak ani úloha doposud popsaných miRNA ve vzniku a rozvoji tohoto onemocnění. V naší práci jsme se zaměřili na rodinu miR-34, především miR-34c, jejíž členové se uplatňují jako nádorové supresory, neboť často zastávají úlohu prostředníků v rámci signalizace mezi proteinem p53 a jeho cílovými molekulami a podílejí se tak na regulaci buněčné proliferace, migrace, invazivity, angiogeneze a apoptózy [8,9].
Materiál a metody
Buněčné linie odvozené od karcinomu děložního hrdla C-4I, HeLa (obě HPV18+), Ca Ski a SiHa (obě HPV16+) byly kultivovány v D-MEM (HeLa), RPMI (Ca Ski, SiHa) a McCoy‘s (C-4I) médiu s přídavkem 10 % fetálního bovinního séra (fetal bovine serum – FBS) při 37 °C a 5 % CO2. Buňky byly transfekovány s využitím polyethyleniminu (PEI) specifickými oligonukleotidy (miRVana microRNA), které napodobují (miR-34c mimic, kat. číslo – 4464066) nebo inhibují endogenní miRNA (miR-34c inhibitor, kat. číslo – 4464084). V prvním kroku transfekce bylo smícháno bezsérové médium s oligonukleotidy a k nim se pak přidal PEI. Po 15min inkubaci za pokojové teploty se směs přikapala k buňkám.
Klinický materiál
V rámci studie bylo analyzováno celkem 74 vzorků – 39 pocházelo z dysplastické a 35 z přilehlé normální tkáně děložního hrdla. Jednalo se o vzorky z konizací prováděných v letech 2011–2014. Všechny pacientky podepsaly informovaný souhlas s využitím klinického materiálu k vědeckým účelům.
Kvantifikace nukleových kyselin
Celková RNA byla izolována z buněk pomocí TRIZOL reagentu (VWR). Po izolaci RNA byla stanovena její čistota a koncentrace pomocí spektrometru NanoDrop 1000. Pro určení čistoty byl stanoven poměr absorbancí A260nm/A280nm a pouze RNA, u kterých byl poměr v rozmezí hodnot 1,9–2,1, pak byly přepsané (10 ng RNA) do cDNA pomocí kitu (TaqMan miRNA Reverse Transcription Kit) s využitím specifických primerů pro miR-34c (Applied Biosystems). Kapková digitální polymerázová řetězová reakce (droplet-digital polymerase chain reaction – ddPCR) byla použita pro absolutní kvantifikaci molekul nukleových kyselin. Vzorky cDNA byly smíchány s fluorescenčními sondami (TaqMan MicroRNA Assays, Applied Biosystems), mastermixem (ddPCR Supermix for Probes, Bio-Rad) a olejem (ddPCR Droplet Generation Oil for Probes, Bio-Rad). Pomocí generátoru mikrokapek (QX200 droplet generátor, Bio-Rad) se vytvořily olejové mikrokapky, které pak byly podrobeny PCR reakci dle instrukcí výrobce. Mikrokapky byly následně analyzovány fluorescenčním detektorem (QX200 droplet reader, Bio-Rad).
Analýza buněčné proliferace
Transfekované buňky byly po 24hod inkubaci spočítány a přesný počet buněk (5 000) byl nanesen na jamku 96jamkové desky. Buňky byly kultivovány dalších 24 hod, médium následně odsáto a buňky promyty. Poté byly buňky fixovány a obarveny ve fixačně-barvicím roztoku složeném z formaldehydu, metanolu a krystalové violeti po dobu přibližně 20 min. Po odstranění zbytku barvicího roztoku byly buňky promyty vodou a vysušeny. Obarvené buňky byly rozpuštěny v 2% dodecylsíranu sodném (SDS) a modré zbarvení bylo měřeno spektrofotometricky při vlnové délce 595 nm. Měření proliferace bylo opakováno ve 3 nezávislých opakováních.
„Scratch“ test
Buňky byly 24 hod po transfekci nasazeny na 6jamkovou desku tak, aby se vytvořila konfluentní vrstva buněk, ve které byla vytvořena rýha pomocí plastové špičky. Postupné zacelování rýhy bylo pozorováno pod mikroskopem, snímáno každé 4 hod a následně vyhodnoceno pomocí Tscratch software [10] (CSElab, ETH). Byly provedeny vždy celkem 3 nezávislé experimenty.
Western blotting analýza
Buňky byly po transfekci lyzovány v lyzačním pufru, který obsahoval NP-40 detergent, proteázové a fosfatázové inhibitory. Proteiny byly separovány pomocí SDS polyakrylamidové gelové elektroforézy a poté přeneseny na nitrocelulózovou membránu. Cílové proteiny byly detekovány pomocí specifických primárních protilátek rozeznávajících – p21 (118, vlastní), p53 (DO-1, vlastní), aktin (Santa Cruz Biotechnology), MDM2 (2A9, vlastní) a následně vhodných sekundárních protilátek (Santa Cruz Biotechnology, USA) konjugovaných s peroxidázou. Signály navázané protilátky byly detekované pomocí chemiluminiscence.
Statistika
Komparativní analýza exprese miRNA pocházející z prekanceróz děložního hrdla vzhledem ke kontrolám tvořeným přilehlými netransformovanými tkáněmi byla provedena pomocí neparametrického Mann-Whitney U testu.
Výsledky
Na panelu čtyř nádorových buněčných linií odvozených od cervikálního karcinomu byla pomocí ddPCR stanovena hladina miR-34c. Nejvyšší hladina miRNA byla detekována u buněčné linie Ca Ski, a to téměř desetinásobně vyšší v porovnání s ostatními testovanými buněčnými liniemi (graf 1). Znatelně nižší hladina miR-34c byla pozorována u HPV18+ buněčných linií HeLa a C-4I. U buněčné linie SiHa se exprese miR-34c pohybovala na hranici limitu detekce. Pro další studium byla vybrána HPV16+ buněčná linie Ca Ski, vykazující nejvýraznější expresi miR-34c, a buněčná linie HeLa jako představitel HPV18+ buněk.
Graf 1. Pomocí ddPCR byl stanoven absolutní počet kopií miR-34c vzhledem k dané reakční směsi (koncentrace) na panelu cervikálních buněčných linií, které jsou k dispozici na pracovišti RECAMO. 
ddPCR – kapková digitální polymerázová řetězová reakce V rámci funkční analýzy úlohy miR-34c během maligní transformace a progrese cervikálního karcinomu byl do nádorových buněk vnesen buď specifický inhibitor miR-34c (34I) s cílem redukovat expresi endogenní miR-34c, nebo naopak specifický oligonukleotid mimikující přítomnost miR-34c (34M). Následné stanovení proliferace u buněčných linií Ca Ski a HeLa ukázalo, že v případě inhibice miR-34c lze u obou buněčných linií pozorovat obdobný trend, neboť buňky transfekované 34I vykazovaly v porovnání s kontrolními buňkami intenzivnější proliferaci (graf 2). V případě transfekce 34M nebyly výsledky konzistentní. Buněčná proliferace byla měřena také po 36 a 48 hod s podobným výsledkem.
Graf 2. Stanovení proliferace u buněčných líní Ca Ski a HeLa. Celkem 24 hod po transfekci byly buňky barveny pomocí krystalové violeti s následným spektrofotometrickým stanovením intenzity fialového zbarvení, které je přímo úměrné množství buněk. 
NEG – negativní kontrola (buňky transfekované nespecifickým oligonukleotidem) Možnost, že se miR-34c nějakým způsobem účastní mechanizmů zodpovědných za citlivost/rezistenci nádorových buněk karcinomu děložního hrdla k chemoterapeutikům, byla analyzována pomocí testu viability (MTT test). Buňky transfekované 34I nebo 34M byly vystaveny působení cytostatik běžně používaných při chemoterapii, konkrétně topotekanu, cisplatině a paklitaxelu. Bylo však zjištěno, že změna v hladině miR-34c zásadním způsobem neovlivnila citlivost buněk odvozených od cervikálního karcinomu k testovaným cytostatikům (data neuvedena).
Vliv miR-34c na buněčnou migraci byl stanoven pomocí tzv. scratch testu. Buňky transfekované 34I migrovaly výrazně rychleji než kontrolní buňky (obr. 1). Naproti tomu buňky transfekované 34M sloužícím jako umělá exogenní miRNA vykazovaly pomalejší migraci. Z těchto výsledků je patrné, že miR-34c se v epiteliálních buňkách děložního hrdla přímo podílí na inhibici buněčné migrace.
Obr. 1. Analýza buněčné migrace. Celkem 36 hod po transfekci 34I nebo 34M byla stanovena schopnost buněk Ca Ski (A) a HeLa (B) migrovat pomocí scratch testu. Jako kontrola (NEG) sloužily buňky transfekované nespecifi ckými oligonukleotidy. Experiment byl proveden 3× s podobným výsledkem. 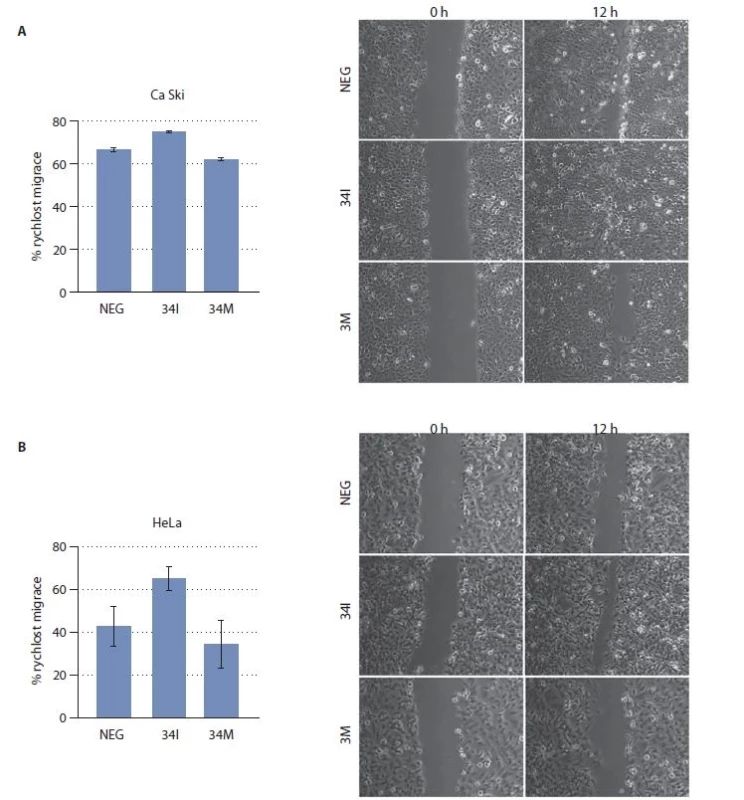
NEG – negativní kontrola (buňky transfekované nespecifi ckým oligonukleotidem) Tumor supresorovou úlohu miR-34c potvrzují i výsledky analýzy prekanceróz pocházejících z děložního hrdla. Konkrétně byla hladina miR-34c stanovena u 39 HSIL a u 35 přilehlých netransformovaných tkání. Z grafu 3 je patrné, že exprese miR-34c byla u dysplazií signifikantně snížena (p < 0,01) v porovnání s přilehlou zdravou tkání.
Graf 3. Komparativní analýza hladiny miR-34c u cervikálních prekanceróz (T) a přilehlé netransformované tkáně (N). 
S cílem nastínit mechanizmus, který by se mohl uplatňovat při regulaci exprese miR-34c, bylo použito srovnání sekvencí s on-line databází MethHC [11]. Zřetelně se ukázalo, že ve vzorcích pocházejících z nádorových tkání dochází často k hypermetylaci promotoru pro miR-34c v porovnání s kontrolními zdravými tkáněmi (obr. 2A). Na základě již publikovaných článků, které úzce propojují miR-34c a p53, jsme sledovali, zda budou mít změny v hladině miR-34c vliv na expresi p53 a jeho cílových molekul. Imunochemická detekce prokázala, že po transfekci Ca Ski buněk 34M došlo k mírné indukci exprese MDM2, p53, p21 i LC3b, zatímco transfekce 34I neměla žádný efekt (obr. 2B).
Obr. 2. A) Analýza metylací promotoru miR-34c s využitím online databáze MetHC. Intenzita metylace promotoru pro miR-34c byla porovnávána mezi vzorky pocházejícími ze souboru CESC a zdravými kontrolami (vlevo); **p < 0,005. B) Imunochemická analýza změn exprese vybraných proteinů po transfekci buněk Ca Ski a HeLa inhibitorem miR-34c (34I) a miR-34c mimikujícími oligonukleotidy (34M). 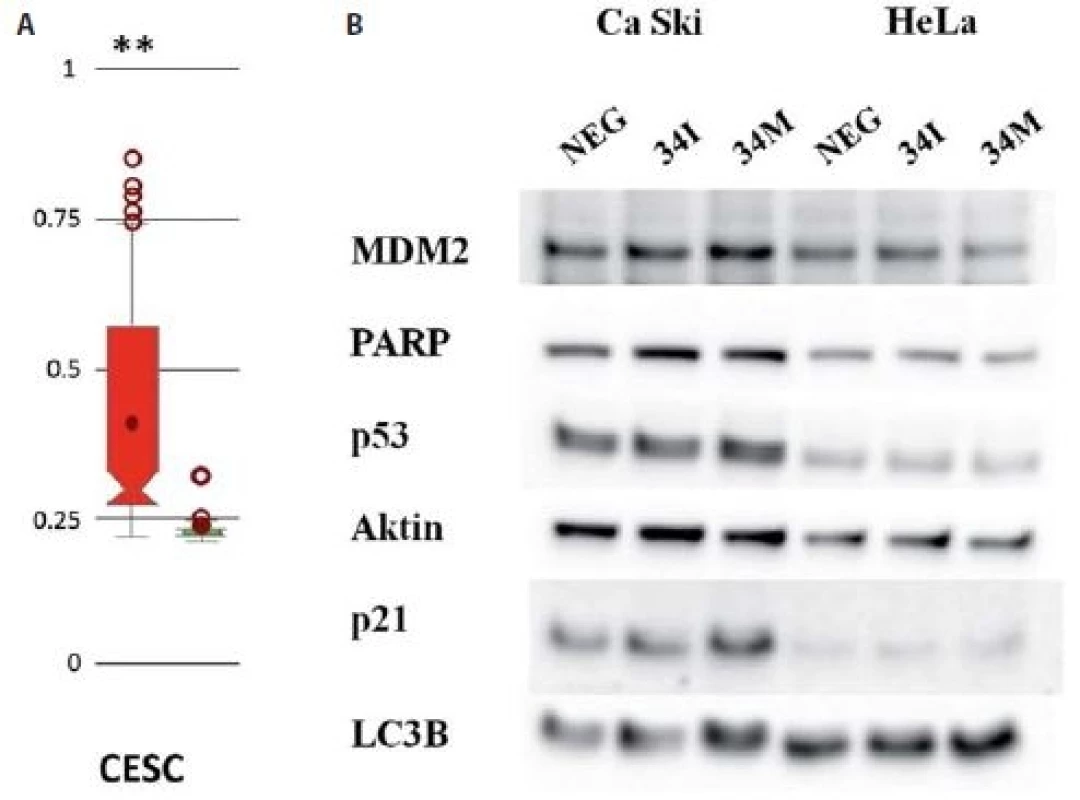
CESC – cervikální spinocelulární karcinom a endocervikální adenokarcinom Diskuze
miRNA hrají důležitou úlohu v řadě patologických procesů, vč. maligní transformace. Mnoho prací se zabývá studiem odlišné exprese miRNA v nádorových a přilehlých nenádorových tkáních se záměrem objevit miRNA, které by mohly sloužit jako biomarkery nebo konkrétní cíle využitelné při léčbě nádorových onemocnění.
Tumor supresorová úloha rodiny miR-34, jež je tvořena miR-34a/b/c, byla prokázána v řadě studií zabývajících se funkcí této miRNA u nádorových onemocnění, konkrétně se jedná o některé epiteliální nádory (karcinom plic, slinivky břišní, mléčné žlázy, prostaty, žaludku, vaječníků, střeva a konečníku), melanomy, neuroblastomy, leukemie a sarkomy [12]. Bylo zjištěno, že hladina těchto miRNA je regulována proteinem p53, který indukuje jejich expresi při genotoxickém stresu obvykle vedoucím k poškození DNA [13]. V návaznosti na zvýšenou expresi rodiny miR-34 pak obvykle dochází k indukci apoptózy a buněčné senescence. Nejznámějším zástupcem rodiny miR-34 je miR-34a, v případě této miRNA bylo popsáno snížení hladiny i u karcinomu děložního hrdla v porovnání s přilehlými netransformovanými tkáněmi, a to hned v několika nezávislých studiích [14,15]. Stran miR-34c a cervikálních malignit jsou stávající literární zdroje značně omezenější. Expresním profilováním cervikálních prekanceróz a hierarchickou klastrovou analýzou bylo identifikováno 12 odlišně regulovaných miRNA, vč. miR-34c. Studie deklaruje, že na základě identifikovaného panelu miRNA je možné rozlišit, zda se jedná o dysplastický epitel, nebo normální tkáň [16].
V naší práci jsme se zaměřili na validaci úlohy miR-34c jako nádorového supresoru a na možnosti jejího využití při detekci cervikálních dysplazií. miR-34c potvrdila svůj diskriminační potenciál při expresní analýze, která prokázala její sníženou hladinu u prekanceróz ve srovnání s kontrolní netransformovanou tkání. Současně tato miRNA vykazovala rysy nádorového supresoru, neboť se při funkčních analýzách na modelových buněčných liniích odvozených od cervikálního karcinomu podílela na inhibici buněčné proliferace a schopnosti buněk migrovat. Tyto výsledky potvrzují důležitou úlohu miR-34c v patogenezi a progresi cervikálních malignit na molekulární úrovni a naznačují možnosti jejího budoucího využití v onkogynekologické praxi.
Závěr
Funkční analýza exprese miR-34c v lidských nádorových buněčných liniích odvozených od karcinomu děložního hrdla prokázala tumor supresorovou úlohu této miRNA. Signifikantní rozdíl v hladině miR-34c mezi HSIL a normálním dlaždicobuněčným cervikálním epitelem, kde je exprese miR-34c výrazně vyšší, zřetelně dokresluje význam miR-34c při karcinogenezi děložního hrdla.
Práce byla podpořena projektem MŠMT – NPU I – LO1413, GACR P206/12/G151 a MZ ČR – RVO (MOÚ, 00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. Mgr. Roman Hrstka, Ph.D.
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7 656 53 Brno
e-mail: hrstka@mou.cz
Přijato: 16. 7. 2018
Zdroje
1. Burd EM. Human papillomavirus and cervical cancer. Clin Microbiol Rev 2013; 16 (1): 1–17.
2. Schiffman M, Castle PE, Jeronimo J et al. Human papillomavirus and cervical cancer. Lancet 2007; 370 (9590): 890–907. doi: 10.1016/S0140-6736 (07) 61416-0.
3. Hickman ES, Moroni MC, Helin K. The role of p53 and pRB in apoptosis and cancer. Curr Opin Genet Dev 2002; 12 (1): 60–66.
4. Matoulkova E, Michalova E, Vojtesek B et al. The role of the 3‘ untranslated region in post-transcriptional regulation of protein expression in mammalian cells. RNA Biol 2012; 9 (5) 563–576. doi: 10.4161/rna.20231.
5. Michalova E, Vojtesek B, Hrstka R. Impaired pre-mRNA processing and altered architecture of 3‘ untranslated regions contribute to the development of human disorders. Int J Mol Sci 2013; 14 (8): 15681–15694. doi: 10.3390/ijms140815681.
6. Pasquinelli AE. MicroRNAs and their targets: recognition, regulation and an emerging reciprocal relationship. Nat Rev Genet 2012; 13 (4): 271–282. doi: 10.1038/nrg3162.
7. Iorio MV, Croce CM. MicroRNA dysregulation in cancer: diagnostics, monitoring and therapeutics. A comprehensive review. EMBO Mol Med 2017; 9 (6) 852. doi: 10.15252/emmm.201707779.
8. Bommer GT, Gerin I, Feng Y. p53-mediated activation of miRNA34 candidate tumor-suppressor genes. Curr Biol 2007; 17 (15): 1298-1307. doi: 10.1016/j.cub.2007.06.068.
9. Siemens H, Jackstadt R, Hunten S. miR-34 and SNAIL form a double-negative feedback loop to regulate epithelial-mesenchymal transitions. Cell Cycle 2011; 10 (24): 4256–4271. doi: 10.4161/cc.10.24.18552.
10. Geback T, Schulz MM, Koumoutsakos P et al. TSscratch: a novel and simple software tool for automated analysis of monolayer wound healing assays. Biotechniques 2009; 46 (4): 265–274. doi: 10.2144/000113083.
11. Huang WY, Hsu SD, Huang HY et al. MethHC: a database of DNA methylation and gene expression in human cancer. Nucleic Acids Res 2015; 43: D856–D861. doi: 10.1093/nar/gku1151.
12. Wong MY, Yu Y, Walsh WR et al. microRNA-34 family and treatment of cancers with mutant or wild-type p53 (Review). Int J Oncol 2011; 38 (5): 1189–1195. doi: 10.3892/ijo.2011.970.
13. Hermeking H. The miR-34 family in cancer and apoptosis. Cell Death Differ 2010; 17 (2): 193–199. doi: 10.1038/cdd.2009.56.
14. Li B, Hu Y, Ye F. Reduced miR-34a expression in normal cervical tissues and cervical lesions with high-risk human papillomavirus infection. Int J Gynecol Cancer 2010; 20 (4): 597–604. doi: 10.1111/IGC.0b013e3181d63170.
15. Ribeiro J, Sousa H. MicroRNAs as biomarkers of cervical cancer development: a literature review on miR-125b and miR-34a. Mol Biol Rep 2014; 41 (3): 1525–1531. doi: 10.1007/s11033-013-2998-0.
16. Cheung TH, Man KN, Yu MY. Dysregulated microRNAs in the pathogenesis and progression of cervical neoplasm. Cell Cycle 2012; 11 (15): 2876–2884. doi: 10.4161/cc.21278.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2018 Číslo Supplementum 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Proteogenomická platforma na identifikáciu nádorovo špecifických antigénov
- Využití mitochondriálních procesů v cílené terapii nádorových onemocnění
- Ferroptóza jako nový typ buněčné smrti a její role v léčbě rakoviny
- Možnosti využití p63 v bioptické diagnostice
- Význam membránových proteinů v léčbě nádorových onemocnění a možnosti jejich dalšího studia
- Vliv metylace DNA na vznik nádorových onemocnění
- Úloha proteinu HSP70 v nádorech a jeho využití jako terapeutický cíl
- Variabilita buněčné populace solidních nádorů a její význam pro diagnostiku a terapii nádorových onemocnění
- Úloha proteínu HSF1 v nádorovej transformácii
- Proteíny HDM2 a HDMX v ľudských nádoroch
- Prima-1 a APR-246 v léčbě nádorových onemocnění
- Acetylsalicylová kyselina a její potenciál v chemoprevenci kolorektálního karcinomu
- Exprese a funkční charakterizace miR-34c u karcinomu děložního hrdla
- Subpopulace cirkulujících myeloidních supresových buněk u pacientů s kolorektálním karcinomem – explorativní analýza jejich potenciálu jako biomarkeru
- Současné metody analýzy mikroRNA
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vliv metylace DNA na vznik nádorových onemocnění
- Ferroptóza jako nový typ buněčné smrti a její role v léčbě rakoviny
- Možnosti využití p63 v bioptické diagnostice
- Současné metody analýzy mikroRNA
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



