-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Variabilita buněčné populace solidních nádorů a její význam pro diagnostiku a terapii nádorových onemocnění
Variability in the Solid Cancer Cell Population and Its Consequences for Cancer Diagnostics and Treatment
Background:
Cancer develops as a result of somatic mutations and evolutionary processes with a Darwinian character. Tumors evolve by dynamic clonal expansion and selection to form genetically diverse cell subpopulations adapted to different tumor microenvironmental conditions. Within cancer cells, the genome is shaped by various selective pressures. Cancer evolution often follows a branched trajectory with divergent subclones evolving simultaneously. Clonal diversity within the same tumor results in genetic, epigenetic and phenotypic variability in tumor mass, which represents a major obstacle for the development of efficient diagnostics and personalized treatment. Advances in sequencing techniques have enabled a better understanding of the growth, progression and response to cancer treatment in heterogeneous cancers. Concurrently, understanding the mechanisms involved and monitoring changes in cancer clones during disease progression may improve the efficiency of cancer therapy.
Aim:
In this review, we summarize available data on intratumor heterogeneity. We show how intratumor heterogeneity, arising from clonal diversity, manifests itself at various levels, including at the genetic, epigenetic, and protein levels. We describe how phylogenetics, a powerful systems biology approach, can help trace clonal evolution during cancer progression and metastasis formation. We also highlight the main problems caused by intratumor heterogeneity, which hinders the development of novel diagnostics and therapies.
Key words:
cancer evolution – intratumor heterogeneity – cancer phylogenetics – clonal evolution
The work was supported by the project MEYS – NPS I – LO1413
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Accepted: 8. 8. 2018
Autoři: Brychtová Veronika; Valík Dalibor; Vojtěšek Bořivoj
Působiště autorů: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
Vyšlo v časopise: Klin Onkol 2018; 31(Supplementum 2): 5-13
Kategorie: Přehled
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko20182S5Souhrn
Východiska:
Nádorové onemocnění se vyvíjí na základě vzniklé somatické mutace evolučním procesem podle Darwinovských pravidel. Vývoj nádoru je proces dynamické klonální expanze a následné selekce vedoucí ke vzniku geneticky odlišných subpopulací přizpůsobených odlišným podmínkám nádorového mikroprostředí konkrétního hostitele. Genom jednotlivých nádorových buněk je utvářen různými selekčními tlaky. Evoluční dráha vývoje nádoru má ve většině případů rozvětvený charakter a jednotlivé nádorové subklony se tak vyvíjejí paralelně. Diverzita klonů v rámci jediné nádorové tkáně vede ke vzniku genetické, epigenetické a fenotypové variability, což současně představuje hlavní překážku exaktní diagnostiky a účinné personalizované léčby konkrétního nádorového onemocnění u konkrétního jedince. Pokroky v sekvenačních technikách nám v současnosti umožňují odpovědět na otázky ohledně růstu a progrese heterogenních nádorů a také jejich schopnosti odpovídat na léčbu. Porozumění mechanizmu vzniku a sledování změn na úrovni nádorových klonů v průběhu progrese nádorového onemocnění může pomoci zlepšit účinnost protinádorové léčby.
Cíl:
Tento přehledový článek se zabývá nádorovou heterogenitou a ukazuje, jak klonální diverzita ovlivňuje nádorovou heterogenitu na úrovni genetické, epigenetické i proteinové. Dále popisuje, jak fylogenetika, efektivní nástroj systémové biologie, může pomoci při sledování klonální evoluce nádoru v průběhu jeho progrese a tvorbě metastáz. Na závěr také hodnotí, jakým způsobem přispívá nádorová heterogenita k problémům v diagnostice nádorových onemocnění a jejich léčbě.
Klíčová slova:
evoluce nádorů – nádorová heterogenita – nádorová fylogenetika – klonální evoluce
Úvod
Nádorové onemocnění je tradičně vnímáno jako genetické onemocnění s charakteristickou progresivní kumulací změn v klíčových genech a signálních dráhách kontrolujících proliferaci buněk. Předpokládá se, že nádor vzniká v důsledku neletální změny genomu, přičemž ve většině případů jde o změny spontánní a méně často jsou tyto změny podmíněny zárodečnou mutací. V 70. letech minulého století byla vyslovena teorie evolučního principu nádorové progrese, která popisuje nádorové onemocnění jako evoluční proces řízený postupnou kumulací somatických mutací a následnou selekcí subklonů [1,2]. Znamená to tedy, že od prvotní události, během které dochází k transformaci zdravé buňky v buňku nádorovou, se až ke stadiu diseminovaného onemocnění nádor vyvíjí procesem selekce. Evoluční teorie progrese nádorů je však lehce odlišná od evoluční teorie druhů [3]. Nádorové buňky jsou vystaveny selekčnímu tlaku mikroprostředí, jako je působení imunitního systému, změna pH, nedostatek živin, anatomické bariéry a působení protinádorové terapie. Tyto tlaky průběžně formují evoluční dráhu nádoru a vznikajících subpopulací [4]. Vzhledem k tomu, že evoluci nádoru lze jen velmi těžko studovat u pacienta – člověka, neboť z etických důvodů není možné průběžně odebírat biopsie progredujícího nádoru, většina studií zabývajících se evoluční historií nádorů je retrospektivních, a tak vychází ze „single time-point“ vzorků. Uvedený přístup je však doposud považován za dostačující, neboť vnitřní nádorová heterogenita (intratumoral heterogeneity – ITH) představuje permanentní záznam mutací vzniklých v průběhu progrese nádoru [5]. Model nádorové evoluce využívá pro studium nádorové progrese fylogenetiku – typ analýzy, která zaznamenává změny v genomu nádoru v podobě evolučního stromu.
V populaci pacientů s nádorovým onemocněním je třeba rozlišovat ITH (intratumoral) a mezinádorovou heterogenitu (intertumoral). Mezinádorová heterogenita označuje různorodost nádorů stejného histologického typu mezi různými pacienty a předpokládá se, že vychází z lokalizace tumoru v rámci orgánu a z původu buněk. Je také ovlivněna specifickými vlastnostmi hostitele, jako je věk, hormonální status, zárodečné genetické variace, komorbidity a souběžné medikace a environmentální faktory [6]. ITH charakterizuje různorodost nádorových buněk v nádorové tkáni jediného pacienta. Zahrnuje prostorovou heterogenitu, která vychází z nerovnoměrné distribuce geneticky odlišných buněčných populací v nádoru a současně i změny v čase, neboť změny v genomu nádorových buněk probíhají dynamicky [7].
Vnitřní heterogenita nádorů
Nádor jako makroskopicky heterogenní systém popsali již v 19. století Johannes Muller a Rudolf Virchow, kteří pozorovali výrazný pleomorfizmus buněk nádorové tkáně [8,9]. V 70. letech 20. století Heppner a další autoři popsali v rámci jedné nádorové tkáně přítomnost odlišných subpopulací, které se od sebe lišily odpovědí na léčbu a schopností metastazovat [10]. Odlišné histologické obrazy je možné v nádorové tkáni pozorovat poměrně často a odpovídají odlišnému stupni diferenciace a metaplastickým změnám. Morfologická heterogenita je významnou součástí prognostického skórovacího systému, např. u karcinomu prostaty [11].
Nádorová heterogenita je častý jev objevující se u množství nádorových diagnóz [12,13], avšak otázkou stále zůstává, jakým mechanizmem vzniká. ITH je formována množstvím vnějších sil působících na nádorový genom a ovlivňujících strukturu nádorové tkáně. Nádorové mikroprostředí tak vytváří tlak, na základě kterého přežívají buňky nejlépe adaptované na podmínky okolí [7].
V poslední době, kdy k významnému posunu v chápání evoluce nádorů přispěl velký pokrok ve využívání sekvenování druhé generace (next generation sequencing – NGS), se upouští od tradičního paradigmatu progrese nádoru jako jednoho klonu s postupně narůstající agresivitou. Nádorová populace je chápána jako komplexní systém tvořený obvykle mnoha jednotlivými geneticky příbuznými subklony, které se vyvíjejí paralelně [14,15] (srovnání s modelem lineární evoluce v kapitole Klonální evoluce nádorů).
Heterogenita nádorové populace se může rozvíjet v důsledku změn v genomu v rámci klonu nádorové populace, pod tlakem změn v nádorovém mikro-prostředí, nebo na pozadí kombinace uvedených faktorů [16]. Mutace vzniklé v nádorových buňkách lze rozdělit do dvou typů – 1. funkčně důležité „driver“ mutace a 2. neutrální „passenger“ mutace, které je pouze doprovázejí a nemají zásadní vliv na agresivitu nádoru. „Driver“ mutace, také označované jako kmenové mutace, představují změny vyskytující se v raných fázích nádorové transformace a je možné je identifikovat ve všech oblastech nádorové tkáně, zatímco „passenger“ mutace jsou aberace lokalizované pouze do určitých menších regionů nádorové populace [17]. Odlišnosti v nádorovém genomu mohou dát vzniknout nádorům s podobným fenotypem, které se však geneticky nepřekrývají. To je dáno především skutečností, že odchylky v buněčném metabolizmu a signalizaci mohou být v buňce navozeny prostřednictvím různých mechanizmů. Na druhou stranu i fenotyp geneticky identických buněk může být odlišný, neboť přestože jsou nádory architektonicky komplexní, liší se v míře regionální vaskulatury, infiltrace hostitelskými (nenádorovými) buňkami zánětlivými nebo buňkami imunitního systému, složkami pojivové tkáně a dalšími vlastnostmi. Tyto specifické regionální vlastnosti vedou ke vzniku rozdílných mikroprostředí a tím k rozvoji fenotypové heterogenity [18]. ITH se tedy projevuje nejednotností na mnoha úrovních, vč. genetické, epigenetické a fenotypové.
Genetická heterogenita
Genetická heterogenita označuje strukturní a kvantitativní chromozomální změny. Somatické buňky kumulují v průběhu života mutace, které jim dávají selektivní výhodu, jsou to již zmíněné „driver“ mutace, které zvyšují přežití a proliferaci buněk, dále pak mutace neutrální a nakonec mutace, které jsou pro buňky nevýhodné a vedou k jejich smrti nebo senescenci. Ačkoliv má většina mutací jen malý vliv na celkový stav buňky, i několik málo „driver“ mutací může udělit buňce evoluční výhodu, která jí umožní prosperovat více než ostatním [19]. Rozsáhlé analýzy dat exomového sekvenování ukázaly, že každý nádor dospělého věku nese přibližně 20–300 jednonukleotidových změn (single nukleotide variant – SNV) nebo krátkých inzercí či delecí [20–26]. Kromě toho nádory nesou i změny v počtu kopií genu (copy number variants – CNV) a translokací [27,28].
Epigenetická heterogenita
O epigenetické heterogenitě mluvíme v případě, že nádorová populace vykazuje variabilitu v profilu metylace DNA, acetylace histonů a změny v konformaci chromatinu. Geny kódující regulátory epigenomu patří k nejčastěji mutovaným genům v nádorech. Jejich výsledkem je snížený obsah 5-metylcytosinu, zvýšená metylace normálně nemetylovaných dinukleotidů cytosin-fosfát-guaninu (cytosin-phosphatidyl-guanin – CpG) v promotorech genů kódujících nádorové supresory, genů odpovědných za reparaci DNA a genů souvisejících s metastazováním [29–34]. I když se obecně předpokládá, že se evoluční historie nádoru odvozená z genetických a epigenetických dat může lišit (metylace DNA je reverzibilní proces a je také mnohem více náchylná k chybám než replikace DNA), studie provedené na nádorech mozku a prostaty ukazují shodné profily aberantní metylace DNA, somatických mutací i změn v počtu kopií genů [35,36].
Fenotypová heterogenita
Fenotypová heterogenita vychází z integrace genetických i negenetických vlivů. Hlavní faktory ovlivňující nádorový fenotyp je možné rozdělit na vnitřní – genetická, epigenetická variabilita a míra diferenciace nádorových buněk, a vnější, u níž je výrazným hráčem nádorové mikroprostředí (fibroblasty, buňky imunitního systému, novotvořené cévy, extracelulární matrix a hypoxie). Vnější (tj. hostitelské) faktory často formují diverzitu nádorových buněk výrazněji než faktory vnitřní [37]. Například u kolorektálního karcinomu a světlobuněčného karcinomu vaječníku není heterogenita klonů vždy navázaná na genetickou poruchu, ale často je závislá na podmínkách daného mikroprostředí [38–40].
Klonální evoluce nádorů
Nádorový klon je z definice skupina nádorových buněk, které sdílejí vysoce podobný genotyp a mutační profil, zatímco subklon je skupina buněk, které se oddělily v evoluční linii a získaly další mutace [41] (obr. 1). Populace subklonů nádorových buněk tedy dávají vzniknout heterogennímu prostředí uvnitř nádoru, přičemž jednotlivé subklony nejsou izolované entity. Z hlediska geografického se populace subklonů mohou v rámci nádoru prolínat nebo mohou být naopak prostorově odděleny [42]. Interakce mezi subklony v průběhu nádorové evoluce může být na úrovni kompetice, ale i kooperace. Jeden z klonů může vytlačit ostatní na základě přísunu kyslíku, živin a prostoru, kterých se mu dostává ve větší míře než ostatním klonům [43]. Některé studie také ukazují, že jednotlivé subklony jsou schopny vzájemně interagovat na základě parakrinní signalizace [44,45].
Obr. 1. „Trunk-branch“ model nádorové heterogenity. 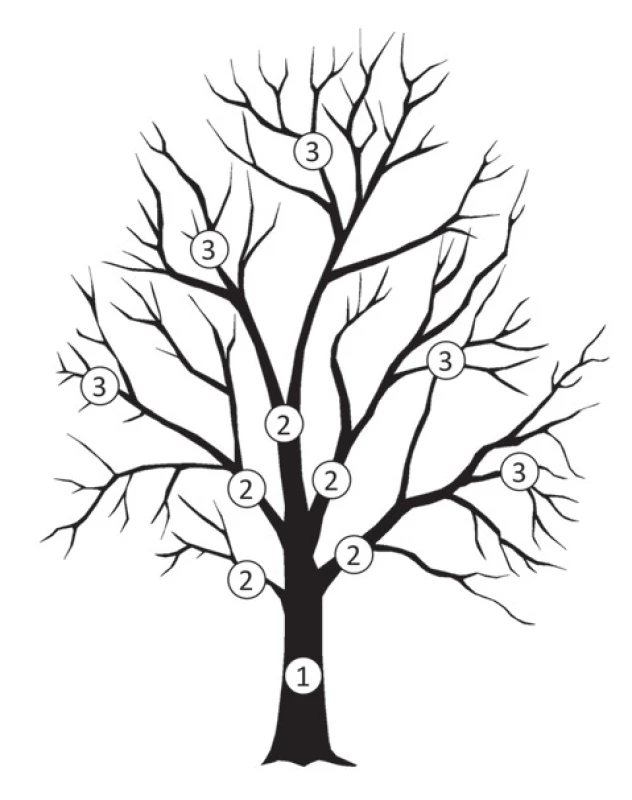
Vývoj vnitřní nádorové heterogenity se podobá rostoucímu stromu. Kmen stromu představuje „driver“ mutace 1) přítomné v každém subklon; větve 2) představují jednotlivé klony; a malé větvičky 3) subklony. Biologické vlastnosti jednotlivých oblastí nádoru (subklonů) jsou dány regionálními mutacemi, které mají za určitých podmínek selekčního tlaku potenciál stát se „driver“ mutacemi. Selekční tlak se v průběhu nádorové progrese mění, což přispívá ke změně subklonální architektury a dominance v průběhu vývoje nádoru [42]. Obrovské změny v zastoupení klonů v průběhu času lze pozorovat např. u množství hematologických malignit, jako je chronická lymfocytární, akutní myeloidní nebo akutní lymfoblastická leukemie, u nichž se diagnostické vzorky liší od vzorků získaných v pokročilém stadiu onemocnění [46–49]. Stejně tak u solidních nádorů jsou změny v organizaci nádoru pozorovány na základě srovnání diagnostických vzorků se vzorky rekurencí nebo z porovnání tkáně primárního nádoru s metastázou. Byly popsány čtyři základní mechanizmy evoluce nádorů.
Lineární model evoluce nádorů (linear evolution)
Lineární model nádorové progrese je pravděpodobně nejznámější a podle něj k mutacím dochází postupně krok za krokem v lineárním sledu. „Driver“ mutace v tomto případě poskytují buňkám tak silnou selektivní výhodu, že předčí všechny předchozí klony a v nádorové tkáni pak převládá jako dominantní klon (obr. 2a). Typickým příkladem lineárního modelu nádorové progrese je Fearon-Vogelsteinova teorie nádorové progrese karcinomu tlustého střeva. Ukazuje, jakým způsobem přispívá po sobě následující zisk „driver“ mutací k posunu onemocnění do pokročilejších stadií s vyšší malignitou [50]. Tento model podporují také histopatologická pozorování nádorové progrese vedoucí od adenomu přes vývoj karcinomu až ke vzniku metastáz u některých nádorových diagnóz.
Obr. 2. Fylogenetický strom znázorňující mechanizmy evoluce nádorů a schematické znázornění progrese vnitřní heterogenity nádoru v průběhu času. 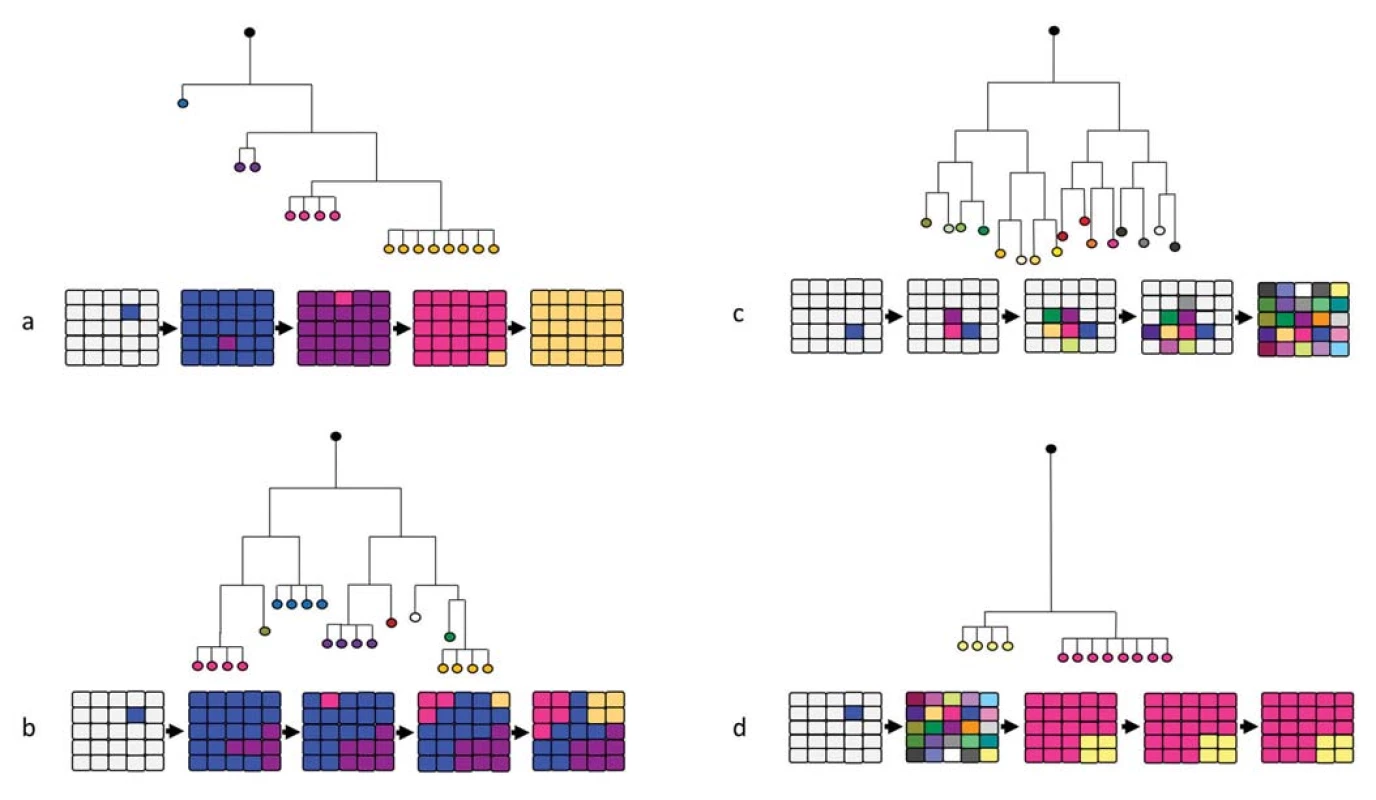
a) lineární model, b) rozvětvený model, c) neutrální model, d) přerušovaný model [71]. Rozvětvený model evoluce nádorů (branching evolution)
Model větvící se evoluce popisuje klony mající společného předka, přičemž se tyto klony vyvíjí paralelně a dávají vzniknout mnoha klonálním liniím. Nedochází zde k vytlačení submisivních klonů, jako je tomu u lineární evoluce, a všechny klony expandují současně (obr. 2b). Pomocí NGS byl typický mutační profil zahrnující kmenové mutace, mutace specifické pro jednotlivé subklony a další mutace v jednotlivých buňkách identifikován u nádorů prsu, prostaty, jater, ledvin, vaječníku, melanomu a u kolorektálního karcinomu [51–63]. Počet klonů a tvar evolučního stromu se mezi diagnózami liší, nicméně u některých diagnóz lze pozorovat společné rysy (dlouhé větve evolučního stromu u některých typů nádorů prsu) [55,57,64]. Rozvětvená evoluce nádorů byla popsána u mnoha nádorů, vč. progrese adenomu na karcinom u nádorového onemocnění tlustého střeva, karcinomu slinivky břišní a prsu [51,65–67].
Model neutrální evoluce nádorů (neutral evolution)
Hypotéza neutrální evoluce vychází z představy, že nedochází k selektivní výhodě v průběhu vývoje nádoru a jedná se spíše o kumulaci náhodných mutací vedoucí ke genetickému driftu a výrazné heterogenitě (obr. 2c). Ta je pak vedlejším efektem bez funkčního významu pro nádorový růst. Jedná se však o extrémní teorii, která má poměrně málo důkazů v klinické praxi [68].
Model přerušované evoluce nádorů (punctuated evolution)
U některých nádorů se na začátku progrese kumuluje velké množství genetických aberací způsobujících extenzivní heterogenitu nádorové tkáně s velkým počtem subklonů. Postupně pak dochází k jejich redukci díky expanzi jednoho nebo několika dominantních klonů [69,70] (obr. 2d).
Kromě celkem přesně definovaných modelů může nádorová progrese probíhat i hybridním způsobem, kdy je paralelně aplikováno více modelů (může být typické pro určité skupiny mutací), nebo tyto modely mohou následovat v průběhu času (některé převažují v raných stadiích progrese) [71].
Fylogenetika nádorů
První pokusy využít fylogenetický model stromu v onkogenezi se objevily v 90. letech 20. století [72,73]. Tento druh analýzy dal postupně vzniknout novému odvětví označovanému jako nádorová fylogenetika. V současné době využívá nádorová fylogenetika mnohem sofistikovanější analytické přístupy, než tomu bylo na jejím počátku, a tento posun je také dokumentován narůstajícím množstvím publikací využívajících fylogenetické přístupy pro studium nádorových onemocnění za poslední 4 roky.
V současnosti dominuje představa darwinovské evoluce uplatňující se jako hlavní síla formující nádorovou heterogenitu, avšak tato teorie je v určitých směrech limitovaná. Její omezení vychází z rozdílných vlastností populací nádorových buněk a populací organizmů. Nádorové buňky představují populaci s nepohlavním dělením (tzn. neprobíhá zde meiotická rekombinace, neuplatňuje se Hardy-Weinbergův zákon o frekvenci genotypů ani teorie pohlavního výběru), jejíž vývoj je ovlivňován evolučními procesy, které se projevují v normální populaci – mutace, genetický drift a přirozený výběr. Ačkoliv evoluční teorie značně pomáhá v pochopení dějů v průběhu nádorové progrese, rozdíly v evolučním procesu nádorů spočívají především v – 1. četnosti mutací; 2. míře selekce; 3. typicky vysoké heterogenitě vznikajících nádorových klonů a 4. typu vzniklé mutace [74].
Dominantním mechanizmem evoluce druhů podle Darwina je selekce přirozeným výběrem. U nádorových buněk se jedná převážně o pozitivní selekci, která probíhá ve prospěch mutací podporujících všechny znaky nádorové buňky [75], zatímco negativní selekce je v průběhu vývoje nádoru velmi slabá. Toto také vysvětluje extrémní toleranci nádorových buněk k hypermutabilitě. Typickou vlastností nádorů je hypermutabilní fenotyp spojený s typem mutací, které nejsou časté při evoluci druhů. Hypermutabilita zahrnuje chromozomální nestabilitu (chromosomal instability – CIN), mikrosatelitovou nestabilitu (microsatellite instability – MIN), vysokou četnost bodových mutací a také CNV [74]. Kvantitativní hodnocení selekce chybí – není známý počet mutací potřebný k rozvoji nádoru ani zda se liší mezi různými typy nádorového onemocnění [76]. Z hlediska evoluční teorie přirozeným výběrem je však třeba zdůraznit, že selektivní výhoda podle Darwina probíhá pouze na úrovni nádorové populace, a nikoliv na úrovni jedince – hostitele. V poslední době bylo publikováno i několik prací, které místo darwinovské evoluce nádorové heterogenity navrhují model neutrální evoluce (non-Darwinian model). Opět se tedy otevírá diskuze ohledně role selekcionizmu a neutralizmu v procesu evoluce přirozeným výběrem, tentokrát však na úrovni nádorových buněk [59, 77–79].
Původně byly k sestavení fylogenetického stromu nádoru použity variace mikrosatelitových markerů u hereditárního nepolypózního karcinomu kolorekta [72]. V současnosti jsou k analýze fylogenetických dat nádorů využívány počítačové metody, které pomáhají rekonstruovat evoluční procesy nádorů. Vstupní data pro fylogenetickou analýzu představuje genomový profil. Původně byla získaná pomocí komparativní genomové hybridizace (comparative genomic hybridization – CGH) nebo fluorescenční in situ hybridizace (fluorescence in situ hybridization – FISH) [73,77], avšak postupně byly tyto metody vytlačeny NGS. Většina dat je vyhodnocována standardními algoritmy využívanými při fylogenetické analýze druhů, jako je metoda maximální úspornosti (maximal parsimony), metoda minimální evoluce (minimal evolution), metoda nejbližšího souseda (neighbour joining) nebo bayeneiovské metody stanovení fylogenetických vztahů [74].
Přístup k analýze fylogenetických dat nádorů vychází především z typu studie, kterou může být – 1. kohortová studie zahrnující data z mnoha nádorů a popisující nejčastější dráhy progrese pro danou diagnózu (cross-cohort studies) (obr. 3a); 2. studie nádorových regionů pocházejících z odlišných lokalit jediného nádoru (regional bulk phylogenetics) (obr. 3b) nebo 3. analýza individuálních nádorových buněk získaných z jediného nádoru (single-cell tumour phylogenetics) (obr. 3c) [74]. Přehled dostupného softwaru pro analýzu fylogenetických dat členěný na základě typu studie je uveden v publikaci Schwartz et al [74].
Obr. 3. Klasifikace metod nádorové fylogenetiky na základě typu studie. 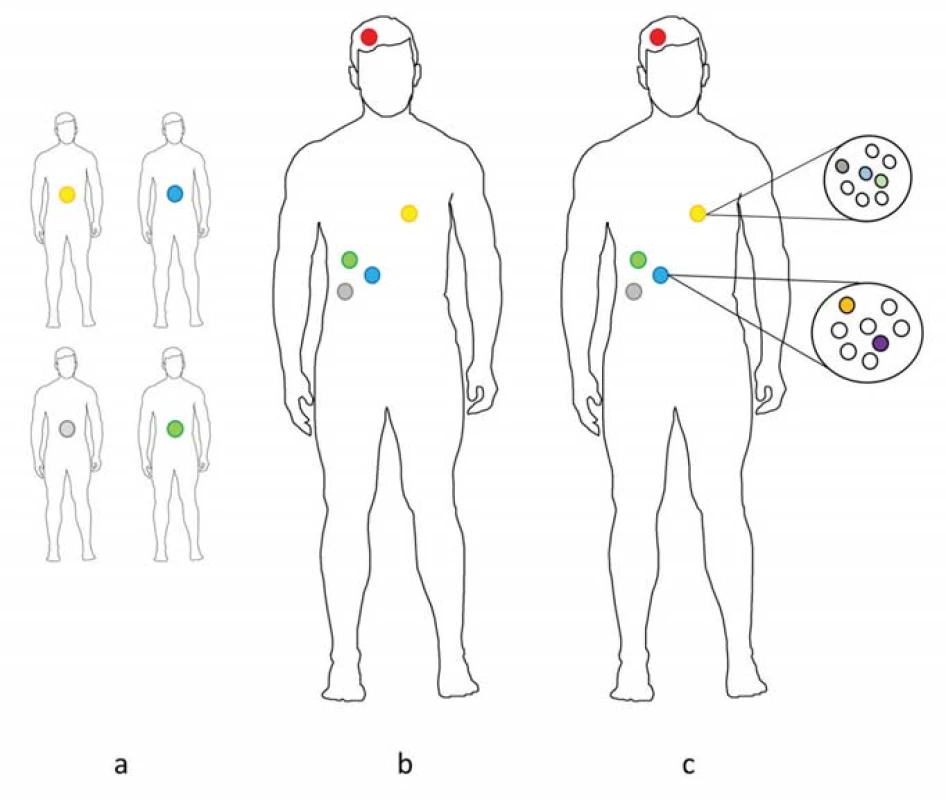
U kohortové studie (a) jsou jednotlivé nádory u odlišných jedinců (barevná kolečka) analyzovány jako by se jednalo o odlišné druhy. Studie nádorových regionů (b) vychází ze vzorků jediného pacienta, ale odlišných nádorových regionů primárního nádoru (zeleně, modře, šedě) nebo metastáz (červeně, žlutě). Analýza individuálních nádorových buněk (c) provádí fylogenetickou analýzu na základě variací mezi jednotlivými buňkami nádoru v jednom nebo více nádorových regionech (zeleně, modře, šedě (primární nádor), červeně, žlutě metastáza) [74]. Výstupní data pak představují fylogenetický strom, který odhaduje pořadí, ve kterém docházelo ke vzniku mutací v průběhu oddělování klonů v linie. Společné uzly fylogenetického stromu představují společné předky, jejichž genotyp může být vyvozen na základě společných rysů mezi jejich potomstvem [71].
Nádorová fylogenetika ukazuje minulost nádorů a pomáhá analyzovat data heterogenních nádorů. Pomocí tohoto přístupu je možné odhadnout načasování „driver“ mutací a zdůraznit tak klíčové události v iniciaci a progresi nádorového onemocnění. Velké kohortové studie mohou ukázat, které mutace v genech nebo drahách mají za následek vznik nádorového klonu (potenciálně dřívější události) nebo nádorového subklonu (pozdější události) [80].
Vnitřní nádorová heterogenita a metastazování
Metastazování je komplexní proces, při kterém jsou nádorové buňky uvolněny z primárního nádoru. Pokud přežijí transport, jsou lokalizovány na sekundárním místě, kde dochází k jejich adaptaci, proliferaci a vytvoření nádorové léze. Všechny kroky představují proces selekce, který je zdrojem heterogenity mezi primárním nádorem a metastázou [81]. Původní klasický model metastazování je jednoduchým lineárním modelem (viz kapitola Klonální evoluce nádorů), podle něhož primární nádor postupně získává vlastnosti potřebné pro diseminaci onemocnění a kolonizaci nové tkáně. Mnoho studií ukazuje vysokou genetickou podobnost mezi různými metastázami u jednoho pacienta. Tato skutečnost by tedy podporovala teorii, že k diseminaci dochází v pozdních stadiích onemocnění (pozdní diseminace) [81]. Některé novější studie však ukazují, že některé nádory prsu a slinivky břišní jsou schopné diseminovat již v preneoplastickém stadiu (raná diseminace) [82,83]. V tomto případě jsou nádorové buňky distribuovány po těle hostitele v době, kdy samotné onemocnění není ještě diagnostikováno, a po variabilní době dormance se mohou začít vyvíjet nezávisle na primárním nádoru. Takové nádory sdílejí některé původní „driver“ mutace s primárním nádorem, avšak dále rozvíjejí svoji genetickou heterogenitu nezávisle na primárním nádoru a ostatních metastatických lézích a jsou navzájem vysoce heterogenní. Zvláštní případ představuje situace, kdy metastázy pocházejí ze subklonů odvětvených v raných fázích nádorové progrese, ale diseminovaných až v pozdní fázi. V tom případě jsou metastázy vysoce heterogenní vůči sobě samotným, avšak jejich genetická výbava je blízká primárnímu nádoru. Studie zabývající se metastazováním u kolorektálního karcinomu ukázaly, že model metastazování se může u jednotlivých pacientů lišit, tzn. ve skupině pacientů se stejnou diagnózou může docházet k ranému i pozdnímu diseminovanému onemocnění [84].
Kromě již uvedeného byla u melanomu pozorována genomová variabilita mezi lokoregionálními metastázami (pocházely z jediného subklonu primárního nádoru) a vzdálenými metastázami (pocházely z odlišných subklonů primárního nádoru) [85]. Celkově lze tedy říci, že jednotlivé případy metastazování jsou unikátní a je nemožné aplikovat univerzální model na všechny případy. Situace je však ještě komplikovanější, neboť kromě uvedených klasických cest, kdy vzniklé metastázy mají původ monoklonální, existují i mechanizmy vedoucí ke vzniku polyklonálních metastáz [77].
Rozdíl v genomu primárního nádoru a metastázy představuje významný zdroj informací pro design anti-metastatické léčby. Genomová variabilita primárních nádorů kombinovaná s variabilitou vzniklou v důsledku dalších selekčních tlaků v mikroprostředí ve vzdálených orgánech hostitele vytváří obrovskou heterogenitu metastatického onemocnění, která způsobuje komplikace při nastavování vhodné léčby. Na základě mnoha studií je zjevné, že k úspěchu léčby metastatického onemocnění může přispět orgánově specifická léčba [86–89].
Heterogenita v diagnostice, terapii a lékové rezistenci
V současné době rostoucích požadavků na personalizovanou léčbu nádorového onemocnění představuje prostorová orientace a zastoupení nádorových subklonů v čase významnou výzvu pro správnou diagnostiku a léčbu nádorů [90]. Zatímco některé klony mohou být dominantními z hlediska fyzické entity nádoru, menší a často nedetekovatelné subklony mohou mít zásadní vliv na klinický průběh onemocnění, a to obzvlášť u hematologických malignit [91,92].
Vnitřní faktory (genetická nestabilita, mutační rychlost a epigenetický status), stejně tak jako vnější faktory (vliv mikroprostředí a terapie) ovlivňují heterogenitu a odpověď na léčbu. Analýza pacientských vzorků v průběhu času ukázala alterace v nádorovém genomu po aplikaci chemoterapeutik, což ukazuje, že i samotná léčba je odpovědná za výrazné změny v genomu nádorových buněk a může přímo přispívat k progresi onemocnění [20]. Většina terapeutických látek není schopna eliminovat veškeré nádorové buňky. Ty, které léčba nezasáhne, následně často vykazují ještě větší genetickou nestabilitu nebo rozvíjejí mechanizmy odpovědné za rezistenci (samotné zvýšení genetické nestability nedává nádorovým buňkám selektivní výhodu, a naopak může být fatální v případě, že překročí práh životaschopnosti). Z toho důvodu správně odhalená genotypová a fenotypová variace mezi jednotlivými nádorovými buňkami v rámci nádorové tkáně a míra heterogenity může sloužit jako vhodný diagnostický nástroj a prediktivní biomarker [93]. Experimentálně bylo prokázáno, že množství genetických změn v nádorových subpopulacích primárního karcinomu prsu koreluje s klinicko-patologickými rysy [94,95] a vyšší míra heterogenity koreluje s horší prognózou, např. u pacientů s karcinomem hlavy a krku nezávisle na proběhlé infekci lidským papilomavirem [96,97].
Nádorová heterogenita je dynamickou vlastností nádoru, která vychází z adaptace buněk na změny a z neustálé klonální selekce. Mechanizmus lékové rezistence u cílené terapie často zahrnuje vznik sekundárních mutací a aktivaci drah přežití v cílových buňkách nebo pozitivní selekci klonů, které neexprimují cílovou molekulu. Adaptace a nikoliv eliminace buněk vystavených léčivé látce může být způsobena nejen genetickými mechanizmy, ale také mechanizmy epigenetickými [98].
V poslední době se ukazuje testování metodou tzv. „tekuté biopsie“ jako velice slibný přístup monitorování dynamiky nádorového onemocnění. Tento neinvazivní přístup využívá analýzu cirkulujících nádorových buněk (circulating tumor cells – CTCs) nebo cirkulující volné nádorové DNA (circulating tumor DNA – ctDNA) k cílené detekci konkrétních změn v sekvenci DNA nebo identifikaci celého spektra nádorových mutací. Ve vztahu k nádorové heterogenitě představuje ctDNA směsný marker odlišných nádorových klonů a podává přesnější informaci o nádorovém ložisku z hlediska genomové diverzity ve srovnání s jednotlivými nádorovými vzorky. Omezení však spočívá především v nízké senzitivitě u méně objemných nádorových ložisek. Analýza CTCs a ctDNA umožňuje v reálném čase sledovat klinickou progresi a odpověď na léčbu u nádorových diagnóz, jako je karcinom prsu, kolorekta, plic a dalších [99–100].
Závěr
Nádorový genom je formován třemi základními evolučními činiteli, jako je mutace, která dává vznik nové variantě v populaci, selekce a drift, které umožní její expanzi. Analýza genomických dat nám dovoluje sledovat tyto evoluční procesy, neboť historie nádorové evoluce je vepsána do genomu nádorové buňky. Fylogenetické analýzy pomáhají odhalit mechanizmy odpovědné za vznik heterogenity, dynamiku, kterou se vyvíjejí a nové prognostické ukazatele, avšak doposud se ve většině případů jedná o retrospektivní studie. Znalosti získané těmito studiemi umožňující stanovení klonálního statusu nádorové heterogenity, její dynamiky a identifikace rizikových subklonů, které by byly cílem protinádorové léčby, je potřeba aplikovat a testovat v klinické praxi na velkých souborech vzorků.
Fenotypová diverzita přítomná u geneticky heterogenních primárních nádorů nebo příp. diseminovaného onemocnění představuje komplikaci pro komplexní terapeutické procesy. Pro kompenzaci diagnostické variability způsobené heterogenním zastoupením nádorových subklonů v jednotlivých oblastech nádoru (sampling error) je třeba analyzovat větší množství regionálních vzorků nádorové tkáně. Exaktní identifikace složek nádorové tkáně je zásadní z hlediska stanovení vhodného terapeutického přístupu, neboť jednotlivé subklony mohou mít odlišné biologické vlastnosti a ve svém důsledku i odpověď k léčbě.
Práce byla podpořena projektem MŠMT – NPU I – LO1413.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Veronika Brychtová, Ph.D.
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7 656 53 Brno
e-mail: vebrychtova@mou.cz
Přijato: 8. 8. 2018
Zdroje
1. Cairns J. Mutation selection and the natural history of cancer. Nature 1975; 255 (5505): 197–200.
2. Nowell PC. The clonal evolution of tumor cell populations. Science 1976; 194 (4260): 23–28.
3. Sottoriva A, Barnes CP, Graham TA. Catch my drift? Making sense of genomic intra-tumour heterogeneity. Biochim Biophys Acta 2017; 1867 (2): 95–100. doi: 10.1016/j.bbcan.2016.12.003.
4. Merlo LM, Pepper JW, Reid BJ et al. Cancer as an evolutionary and ecological process. Nat Rev Cancer 2006; 6 (12): 924–935. doi: 10.1038/nrc2013.
5. Navin NE, Hicks J. Tracing the tumor lineage. Mol Oncol 2010; 4 (3): 267–283. doi: 10.1016/j.molonc.2010.04.010.
6. Fisher R, Pusztai L, Swanton C. Cancer heterogeneity: implications for targeted therapeutics. Br J Cancer 2013; 108 (3): 479–485. doi: 10.1038/bjc.2012.581.
7. McGranahan N, Swanton C. Clonal heterogeneity and tumor evolution: past, present and the future. Cell 2017; 168 (4): 613–628. doi: 10.1016/j.cell.2017.01.018.
8. Cancer.org. [online]. The history of cancer. Available from: https: //www.cancer.org/cancer/cancer-basics/history-of-cancer.html.
9. Hansmann’s ideas of the nature of cancer: description and analysis. In: Bignold LP, Coghlan BL, Jersmann HPA (eds). David Paul Von Hansemann: contributions to oncology. Basel: Birkhäuser 2007 : 75–90.
10. Heppner GH. Tumor heterogeneity. Cancer Res 1984; 44 (6): 2259–2265.
11. Epstein JI, Egevad L, Amin MB et al. The 2014 International Society of Urological Pathology (ISUP) consensus conference on gleason grading of prostatic carcinoma definition of grading patterns and proposal for a new grading system. Am J Surg Pathol 2016; 40 (2): 244–252. doi: 10.1097/PAS.0000000000000530.
12. Marusyk A, Polyak K. Tumor heterogeneity: causes and consequences. Biochim Biophys Acta 2009; 1805 (1): 105–117. doi: 10.1016/j.bbcan.2009.11.002.
13. Michor F, Polyak K. The origins and implications of intratumor heterogeneity. Cancer Prev Res (Phila) 2010; 3 (11): 1361–1364. doi: 10.1158/1940-6207.CAPR-10-0234.
14. Heppner GH, Miller BE. Tumor heterogeneity: biological implications and therapeutic consequences. Cancer Metastasis Rev 1983; 2 (1): 5–23.
15. Burrell RA, McGranahan N, Bartek J et al. The causes and consequences of genetic heterogeneity in cancer evolution. Nature 2013; 501 (7467): 338–345. doi: 10.1038/nature12625.
16. Gerashchenko TS, Denisov EV, Litviakov NV et al. Intratumor heterogeneity: nature and biological significance. Biochemistry (Mosc) 2013; 78 (11): 1201–1215. doi: 10.1134/S0006297913110011.
17. Merid SK, Goranskaya D, Alexeyenko A. Distinguishing between driver and passenger mutations in individual cancer genomes by network enrichment analysis. BMC Bioinformatics 2014; 15 : 308. doi: 10.1186/1471-2105-15-308.
18. Kim YA, Cho DY, Przytycka TM. Understanding genotype-phenotype effects in cancer via network approaches. PLoS Comput Biol 2016; 12 (3): e1004747. doi: 10.1371/journal.pcbi.1004747.
19. Rosenthal R, McGranahan N, Herrero J et al. Deciphering genetic intratumor heterogeneity and its impact on cancer evolution. Annu Rev Cancer Biol 2017; 1 : 223–240. doi: 10.1146/annurev-cancerbio-042516-011348.
20. Pleasance ED, Cheetham RK, Stephens PJ et al. A comprehensive catalogue of somatic mutations from a human cancer genome. Nature 2010; 463 (7278): 191–196. doi: 10.1038/nature08658.
21. International Cancer Genome Consortium, Hudson TJ, Anderson W et al. International network of cancer genome projects. Nature 2010; 464 (7291): 993–998. doi: 10.1038/nature08987.
22. Hodis E, Watson IR, Kryukov GV et al. A landscape of driver mutations in melanoma. Cell 2012; 150 (2): 251–263. doi: 10.1016/j.cell.2012.06.024.
23. Cancer Genome Atlas Research Network, McLendon R, Friedman A et al. Comprehensive genomic characterization defines human glioblastoma genes and core pathways. Nature 2008; 455 (7216): 1061–1068. doi: 10.1038/nature07385.
24. Cancer Genome Atlas Research Network, Weinstein JN, Collisson EA et al. Cancer genome atlas research network. the cancer genome atlas pan-cancer analysis project. Nat Genet 2013; 45 (10): 1113–1120. doi: 10.1038/ng.2764.
25. Cancer Genome Atlas Research Network, Agrawal N, Akbani R et al. Integrated genomic characterization of papillary thyroid carcinoma. Cell 2014; 159 (3): 676–690. doi: 10.1016/j.cell.2014.09.050.
26. Lawrence MS, Stojanov P, Polak P et al. Mutational heterogeneity in cancer and the search for new cancer-associated genes. Nature 2013; 499 (7457): 214–218. doi: 10.1038/nature12213.
27. Vogelstein B, Papadopoulos N, Velculescu VE et al. Cancer genome landscapes. Science 2013; 339 (6127): 1546–1558. doi: 10.1126/science.1235122.
28. Solimini NL, Xu Q, Mermel CH et al. Recurrent hemizygous deletions in cancers may optimize proliferative potential. Science 2012; 337 (6090): 104–109. doi: 10.1126/science.1219580.
29. Feinberg AP, Vogelstein B. Hypomethylation distinguishes genes of some human cancers from their normal counterparts. Nature 1983; 301 (5895): 89–92.
30. Goelz SE, Vogelstein B, Hamilton SR et al. Hypomethylation of DNA from benign and malignant human colon neoplasms. Science 1985; 228 (4696): 187–190.
31. Greger V, Debus N, Lohmann D et al. Frequency and parental origin of hypermethylated RB1 alleles in retinoblastoma. Hum Genet 1994; 94 (5): 491–496.
32. Graff JR, Gabrielson E, Fujii H et al. Methylation patterns of the E-cadherin 5‘ CpG island are unstable and reflect the dynamic, heterogeneous loss of E-cadherin expression during metastatic progression. J Biol Chem 2000; 275 (4): 2727–2732.
33. Kane MF, Loda M, Gaida GM et al. Methylation of the hMLH1 promoter correlates with lack of expression of hMLH1 in sporadic colon tumors and mismatch repair-defective human tumor cell lines. Cancer Res 1997; 57 (5): 808–811.
34. Mack SC, Hubert CG, Miller TE et al. An epigenetic gateway to brain tumor cell identity. Nat Neurosci 2015; 19 (1): 10–19. doi: 10.1038/nn.4190.
35. Mazor T, Pankov A, Johnson BE et al. DNA methylation somatic mutations converge on the cell cycle and define similar evolutionary histories in brain tumors. Cancer Cell 2015; 28 (3): 307–317. doi: 10.1016/j.ccell.2015.07. 012.
36. Aryee MJ, Liu W, Engelmann JC et al. DNA methylation alterations exhibit intraindividual stability and interindividual heterogeneity in prostate cancer metastases. Sci Transl Med 2013; 5 (169): 169ra110. doi: 10.1126/scitranslmed.3005211.
37. Marusyk A, Almendro V, and Polyak K. Intra-tumour heterogeneity: a looking glass for cancer? Nat Rev Cancer 2012; 12 (5): 323–334. doi: 10.1038/nrc3261.
38. Kreso A, O’Brien CA, van Galen P et al. Variable clonal repopulation dynamics influence chemotherapy response in colorectal cancer. Science 2103; 339 (6119): 543–548. doi: 10.1126/science.1227670.
39. Katz E, Skorecki K, Tzukerman M. Niche-dependent tumorigenic capacity of malignant ovarian ascites-derived cancer cell subpopulations. Clin Cancer Res 2009; 15 (1): 70–80. doi: 10.1158/1078-0432.CCR-08-1233.
40. Abelson S, Shamai Y, Berger L et al. Intratumoral heterogeneity in the self-renewal and tumorigenic differentiation of ovarian cancer. Stem Cells 2012; 30 (3): 415–424. doi: 10.1002/stem.1029.
41. Alizadeh AA, Aranda V, Bardelli A et al. Toward understanding and exploiting tumor heterogeneity. Nat Med 2015; 21 (8): 846–853. doi: 10.1038/nm.3915.
42. Burrell RA, Swanton C. Re-evaluating clonal dominance in cancer evolution. Trends Cancer 2016; 2 (5): 263–276. doi: 10.1016/j.trecan.2016.04.002.
43. Marusyk A, Polyak K. Tumor heterogeneity: causes and consequences. Biochim Biophys Acta 2010; 1805 (1): 105–117. doi: 10.1016/j.bbcan.2009.11.002.
44. Marusyk A, Tabassum D, Altrock P. Non-cell-autonomous driving of tumour growth supports sub-clonal heterogeneity. Nature 2014; 514 (7520): 54–58. doi: 10.1038/nature13556.
45. Cleary AS, Leonard TL, Gestl SA et al. Tumour cell heterogeneity maintained by cooperating subclones in Wnt-driven mammary cancers. Nature 2014; 508 (7494): 113–117. doi: 10.1038/nature13187.
46. Keats JJ, Chesi M, Egan JB et al. Clonal competition with alternating dom-inance in multiple myeloma. Blood 2012; 120 (5): 1067–1076. doi: 10.1182/blood-2012-01-405985.
47. Kim T, Yoshida K, Kim YK et al. Clonal dynamics in a single AML case tracked for 9 years reveals the complexity of leukemia progression. Leukemia 2015; 30 (2): 295–302. doi: 10.1038/leu.2015.264.
48. Lawrence MS, Stojanov P, Polak P et al. Mutational heterogeneity in cancer and the search for new cancer-associated genes. Nature 2013; 499 (7457): 214–218. doi: 10.1038/nature12213.
49. Bolli N, Avet-Loiseau H, Wedge DC et al. Heterogeneity of genomic evolution and mutational profiles in multiple myeloma. Nat Commun 2014; 5 : 2997. doi: 10.1038/ncomms3997.
50. Fearon E, Vogelstein B. A genetic model for colorectal tumorigenesis. Cell 1990; 61 (5): 759–767.
51. Nik-Zainal S, Van Loo P, Wedge DC et al. The life history of 21 breast cancers. Cell 2012; 149 (5): 994–1007. doi: 10.1016/j.cell.2012.04.023.
52. Shah SP, Roth A, Goya R et al. The clonal and mutational evolution spectrum of primary triple-negative breast cancers. Nature 2012; 486 (7403): 395–399. doi: 10.1038/nature10933.
53. Gerlinger M, Rowan AJ, Horswell S et al. Intratumor heterogeneity and branched evolution revealed by multiregion sequencing. N Engl J Med 2012; 366 (10): 883–892. doi: 10.1056/NEJMoa1113205.
54. McPherson A, Roth A, Laks E et al. Divergent modes of clonal spread and intraperitoneal mixing in high-grade serous ovarian cancer. Nat Genet 2016; 48 (7): 758–767. doi: 10.1038/ng.3573.
55. Wang Y, Waters J, Leung ML et al. Clonal evolution in breast cancer revealed by single nucleus genome sequencing. Nature 2014; 512 (7513): 155–160. doi: 10.1038/nature13600.
56. Kim TM, Jung SH, An CH et al. Subclonal genomic architectures of primary and metastatic colorectal cancer based on intratumoral genetic heterogeneity. Clin Cancer Res 2015; 21 (19): 4461–4472. doi: 10.1158/1078-0432.CCR-14-2413.
57. Yates LR, Gerstung M, Knappskog S et al. Subclonal diversification of primary breast cancer revealed by multiregion sequencing. Nat Med 2015; 21 (7): 751–759. doi: 10.1038/nm.3886.
58. Boutros PC, Fraser M, Harding NJ et al. Spatial genomic heterogeneity within localized, multifocal prostate cancer. Nat Genet 2015; 47 (7): 736–745. doi: 10.1038/ng. 3315.
59. Ling S, Hu Z, Yang Z et al. Extremely high genetic diversity in a single tumor points to prevalence of non-Darwinian cell evolution. Proc Natl Acad Sci U S A 2015; 112 (47): E6496–E6505. doi: 10.1073/pnas.1519556 112.
60. Kang H, Salomon MP, Sottoriva A et al. Many private mutations originate from the first few divisions of a human colorectal adenoma. J Pathol 2015; 237 (3): 355–362. doi: 10.1002/path.4581.
61. Sottoriva A, Kang H, Ma Z et al. A big bang model of human colorectal tumor growth. Nat Genet 2015; 47 (3): 209–216. doi: 10.1038/ng.3214.
62. Bashashati A, Ha G, Tone A et al. Distinct evolutionary trajectories of primary high-grade serous ovarian cancers revealed through spatial mutational profiling. J Pathol 2013; 231 (1): 21–34. doi: 10.1002/path.4230.
63. Harbst K, Lauss M, Cirenajwis H et al. Multiregion whole-exome sequencing uncovers the genetic evolution and mutational heterogeneity of early-stage metastatic melanoma. Cancer Res 2016; 76 (16): 4765–4774. doi: 10.1158/0008-5472.CAN-15-3476.
64. Gerlinger M, Horswell S, Larkin J et al. Genomic architecture and evolution of clear cell renal cell carcinomas defined by multiregion sequencing. Nat Genet 2014; 46 (3): 225–233. doi: 10.1038/ng.2891.
65. Thirlwell C, Will OC, Domingo E et al. Clonality assessment and clonal ordering of individual neoplastic crypts shows polyclonality of colorectal adenomas. Gastroenterology 2010; 138 (4): 1441–1454. doi: 10.1053/j.gastro.2010.01.033.
66. Campbell PJ, Yachida S, Mudie LJ et al. The patterns and dynamics of genomic instability in metastatic pancreatic cancer. Nature 2010; 467 (7319): 1109–1113. doi: 10.1038/nature09460.
67. Shah SP, Roth A, Goya R et al. The clonal and mutational evolution spectrum of primary triple-negative breast cancers. Nature 2012; 486 (7403): 395–399. doi: 10.1038/nature10933.
68. Williams MJ, Werner B, Barnes CP et al. Identification of neutral tumor evolution across cancer types. Nat Genet 2016; 48 (3): 238–244. doi: 10.1038/ng.3489.
69. Baca SC, Prandi D, Lawrence MS. Punctuated evolution of prostate cancer genomes. Cell 2013; 153 (3): 666–677. doi: 10.1016/j.cell.2013.03.021.
70. Gao R, Davis A, McDonald TO et al. Punctuated copy number evolution and clonal stasis in triple-negative breast cancer. Nat Genet 2016; 48 (10): 1119–1130. doi: 10.1038/ng.3641.
71. Davis A, Gao R, Navin N. Tumor evolution: linear, branching, neutral or punctuated? Biochim Biophys Acta 2017; 1867 (2): 151–161. doi: 10.1016/j.bbcan.2017.01.003.
72. Tsao J, Zhang J, Salovaara R et al. Tracing cell fates in human colorectal tumors from somatic microsatellite mutations: evidence of adenomas with stem cell architecture. Am J Pathol 1998; 153 (4): 1189–1200. doi: 10.1016/S0002-9440 (10) 65663-5.
73. Desper R, Jiang F, Kallioniemi OP et al. Inferring tree models of oncogenesis from comparative genomic hybridization data. J Comput Biol 1999; 6 (1): 37–51. doi: 10.1089/cmb.1999.6.37.
74. Schwartz R, Schäffer AA. The evolution of tumour phylogenetics: principles and practice. Nat Rev Genet 2017; 18 (4): 213–229. doi: 10.1038/nrg.2016.170.
75. Hanahan D, Weinberg RA. The hallmarks of cancer: the next generation. Cell 2011; 144 (5): 646–674. doi: 10.1016/j.cell.2011.02.013.
76. Martincorena I, Raine KM, Gerstung M et al. Universal Patterns of Selection in Cancer and Somatic Tissues. Cell 2017; 171 (5): 1029–1041. doi: 10.1016/j.cell.2017.09.042.
77. Wang HY, Chen Y, Tong D et al. Is the evolution in tumors Darwinian or non-Darwinian? National Science Review 2018; 5 (1): 15–17.
78. Williams MJ, Werner B, Barnes CP et al. Identification of neutral tumor evolution across cancer types. Nat Genet 2016; 48 (3): 238–244. doi: 10.1038/ng.3489.
79. Williams MJ, Werner B, Barnes CP et al. Reply: Is the evolution of tumors Darwinian or non-Darwinian? National Science Review 2018; 5 (1): 17–19. doi: 10.1093/nsr/nwx131.
80. Pennington G, Smith CA, Shackney S et al. Reconstructing tumor phylogenies from heterogeneous single-cell data. J Bioinform Comput Biol 2007; 5 (2a): 407–427.
81. Hunter KW, Amin R, Deasy S et al. Genetic insights into the morass of metastatic heterogeneity. Nat Rev Cancer 2018; 18 (4): 211–223. doi: 10.1038/nrc.2017.126.
82. Weng D, Penzner JH, Song B et al. Metastasis is an early event in mouse mammary carcinomas and is associated with cells bearing stem cell markers. Breast Cancer Res 2012; 14 (1): R18. doi: 10.1186/bcr3102.
83. Rhim AD, Thege FI, Santana SM et al. Detection of circulating pankreas epithelial cells in patients with pancreatic cystic lesions. Gastroenterology 2014; 146 (3): 647–651. doi: 10.1053/j.gastro.2013.12.007.
84. Xie T, Cho YB, Wang K et al. Patterns of somatic alterations between matched primary and metastatic colorectal tumors characterized by whole-genome sequencing. Genomics 2014; 104 (4): 234–241. doi: 10.1016/j.ygeno.2014.07.012.
85. Sanborn JZ, Chung J, Purdom E et al. Phylogenetic analyses of melanoma reveal complex patterns of metastatic dissemination. Proc Natl Acad Sci U S A 2015; 112 (35): 10995–11000. doi: 10.1073/pnas.1508074112.
86. Naxerova K, Reiter JG, Brachtel E et al. Origins of lymphatic and distant metastases in human colorectal cancer. Science 2017; 357 (6346): 55–60. doi: 10.1126/science.aai8515.
87. Gundem G, Van Loo P, Kremeyer B et al. The evolutionary history of lethal metastatic prostate cancer. Nature 2015; 520 (7547): 353–357. doi: 10.1038/nature14347.
88. Brastianos PK, Carter SL, Santagata S et al. Genomic characterization of brain metastases reveals branched evolution and potential therapeutic targets. Cancer Discov 2015; 5 (11): 1164–1177. doi: 10.1158/2159-8290.CD-15-0369.
89. Campbell PJ, Yachida S, Mudie LJ et al. The patterns and dynamics of genomic instability in metastatic pancreatic cancer. Nature 2010; 467 (7319): 1109–1113. doi: 10.1038/nature09460.
90. McGranahan N, Swanton C. Biological and therapeutic impact of intratumor heterogeneity in cancer evolution. Cancer Cell 2015; 27 (1): 15–26. doi: 10.1016/j.ccell.2014.12.001.
91. Mullighan CG, Phillips LA, Su X et al. Genomic analysis of the clonal origins of relapsed acute lymphoblastic leukemia. Science 2008; 322 (5906): 1377–1380. doi: 10.1126/science.1164266.
92. Ding L, Ley TJ, Larson DE et al. Clonal evolution in relapsed acute myeloid leukaemia revealed by whole-genome sequencing. Nature 2012; 481 (7382): 506–510. doi: 10.1038/nature10738.
93. Almendro V, Marusyk A, Polyak K. Cellular heterogeneity and molecular evolution in cancer. Annu Rev Pathol 2013; 8 : 277–302. doi: 10.1146/annurev-pathol-020712-163923.
94. Park SY, Gönen M, KimHJ et al. Cellular and genetic diversity in the progression of in situ human breast carcinomas to an invasive phenotype. J Clin Investig 2010; 120 (2): 636–644. doi: 10.1172/JCI40724.
95. Seol H, Lee HJ, Choi Y et al. Intratumoral heterogeneity of HER2 gene amplification in breast cancer: its clinicopathological significance. Mod Pathol 2012; 25 (7): 938–948. doi: 10.1038/modpathol.2012.36.
96. Mroz EA, Tward AM, Hammon RJ et al. Intra-tumor genetic heterogeneity and mortality in head and neck cancer: analysis of data from the cancer genome atlas. PLoS Med 2015; 12 (2): e1001786. doi: 10.1371/journal.pmed.1001786.
97. Ledgerwood LG, Kumar D, Eterovic AK et al. The degree of intratumor mutational heterogeneity varies by primary tumor sub-site. Oncotarget 2016; 7 (19): 27185–27198. doi: 10.18632/oncotarget.8448.
98. Sharma SV, Lee DY, Li B et al. A chromatin-mediated reversible drug-tolerant state in cancer cell subpopulations. Cell 2010; 141 (1): 69–80. doi: 10.1016/j.cell.2010.02.027.
99. De Mattos-Arruda L, Caldas C. Cell-free circulating tumour DNA as a liquid biopsy in breast cancer. Mol Oncol 2016; 10 (3): 464–474. doi: 10.1016/j.molonc.2015.12.001.
100. Hench IB, Hench J, Tolnay M. Liquid biopsy in clinical management of breast, lung, and colorectal cancer. Front Med 2018; 5 : 9. doi: 10.3389/fmed.2018.00009.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2018 Číslo Supplementum 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Proteogenomická platforma na identifikáciu nádorovo špecifických antigénov
- Využití mitochondriálních procesů v cílené terapii nádorových onemocnění
- Ferroptóza jako nový typ buněčné smrti a její role v léčbě rakoviny
- Možnosti využití p63 v bioptické diagnostice
- Význam membránových proteinů v léčbě nádorových onemocnění a možnosti jejich dalšího studia
- Vliv metylace DNA na vznik nádorových onemocnění
- Úloha proteinu HSP70 v nádorech a jeho využití jako terapeutický cíl
- Variabilita buněčné populace solidních nádorů a její význam pro diagnostiku a terapii nádorových onemocnění
- Úloha proteínu HSF1 v nádorovej transformácii
- Proteíny HDM2 a HDMX v ľudských nádoroch
- Prima-1 a APR-246 v léčbě nádorových onemocnění
- Acetylsalicylová kyselina a její potenciál v chemoprevenci kolorektálního karcinomu
- Exprese a funkční charakterizace miR-34c u karcinomu děložního hrdla
- Subpopulace cirkulujících myeloidních supresových buněk u pacientů s kolorektálním karcinomem – explorativní analýza jejich potenciálu jako biomarkeru
- Současné metody analýzy mikroRNA
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vliv metylace DNA na vznik nádorových onemocnění
- Ferroptóza jako nový typ buněčné smrti a její role v léčbě rakoviny
- Možnosti využití p63 v bioptické diagnostice
- Současné metody analýzy mikroRNA
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



