Incidencia a rizikové faktory vzniku vzdialených metastáz u pacientov s karcinómom hlavy a krku
Incidence and Risk Factors of Distant Metastases of Head and Neck Carcinoma
Background: Head and neck carcinomas are characterized by frequent metastases to cervical lymph nodes and locoregional recurrence. By contrast, distant metastases (M1) are seldom detected. Material and methods: This study retrospectively analyzed patients with head and neck cancer who were treated at the Department of Otorhinolaryngology of F. D. Roosevelt Faculty Hospital in Banska Bystrica in 2011–2017. M1 incidence, localization, and risk factors were determined, as well as time to development of M1, methods of M1 diagnosis, and patient survival. Results: M1 was diagnosed in 50 (10.5%) of 474 patients and was significantly more frequent in patients with oropharyngeal cancer, more extensive primary tumors (T3 and T4 status), nodal disease (N2 and N3 status), and poorly differentiated carcinomas. M1 was most often detected in the lungs (59%) and skeleton (47%). M1 was detected by computed tomography (CT) scans in 84% of patients and by, positron emission tomography/CT (PET/CT) in 12%. Mean patient survival was 10.4 ± 3.5 months, with two patients being in remission. Conclusion: M1 is detected most frequently by CT scans. PET/CT screening is indicated in patients with risk factors, including metastases to ≥3 lymph nodes or bilateral lymph nodes, lymph nodes >6 cm, low jugular lymph node metastases, or regional recurrence. Curative treatment is possible for patients with good performance status, solitary M1, and locoregional remission.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted: 22. 2. 2019
Accepted: 30. 5. 2019
Keywords:
diagnosis – head and neck carcinoma – distant metastasis – surviving
Autoři:
Barbora Uhliarová; Martin Švec
Působiště autorů:
Oddelenie otorinolaryngológie, FNsP F. D. Roosevelta, Banská Bystrica, Slovensko
Vyšlo v časopise:
Klin Onkol 2019; 32(4): 294-299
Kategorie:
Původní práce
prolekare.web.journal.doi_sk:
https://doi.org/10.14735/amko2019294
Souhrn
Východiská: Karcinómy hlavy a krku sú známe častým metastázovaním do regionálnych lymfatických uzlín krku a lokoregionálnou recidívou. Na druhej strane sa vzdialené metastázy (M1) vyskytujú zriedkavo.
Materiál a metódy: Retrospektívna analýza pacientov, ktorým bol diagnostikovaný karcinóm horného aerodigestívneho traktu (orofarynx, hypofarynx, larynx) na Oddelení otorinolaryngológie Fakultnej nemocnice s poliklinikou F. D. Roosevelta v Banskej Bystrici v rokoch 2011–2017. Sledovali sme incidenciu, lokalizáciu, rizikové faktory, diagnostický postup M1 a dĺžku prežívania pacientov s diseminovaným ochorením.
Výsledky: M1 sa diagnostikovala u 50 (10,5 %) zo 474 pacientov. M1 sa signifikantne častejšie vyskytovala u pacientov s karcinómom orofaryngu, u pacientov s rozsiahlejším primárnym nádorom (T3 a T4 status), uzlinovým postihnutím (N2 a N3 status) a zle diferencovaným karcinómom. M1 sa najčastejšie detegovala v pľúcach (59 %) a v skelete (47 %). Najčastejšie (84 %) sa M1 diagnostikovala pomocou vyšetrenia počítačovou tomografiou (CT), pozitrónovou emisnou tomografiou s CT (PET/CT) sa diagnostikovala u 12 %. Prežívanie pacientov po diagnostike M1 bolo priemerne 10,4 ± 3,5 mesiaca, dvaja pacienti sú stabilizovaní, v remisii.
Záver: Najdôležitejšiu úlohu v detekcii M1 zohráva CT vyšetrenie hrudníka. Pri prítomnosti rizikových faktorov (metastázy vo viac ako troch lymfatických uzlinách, bilaterálne metastatické postihnutie lymfatických uzlín, metastáza v lymfatickej uzline väčšej ako 6 cm, lokalizácia metastáz v lymfatických uzlinách supraklavikulárne a lokoregionálna recidíva) je vhodné celotelové PET/CT vyšetrenie. U pacientov s dobrým performance statusom pri solitárnej M1 a lokoregionálnej remisii ochorenia je možná kuratívna liečba.
Klíčová slova:
diagnostika – karcinómy hlavy a krku – vzdialené metastázy – prežívanie
Úvod
Pri veľkej časti nádorov sú prvým miestom metastáz (MTS) regionálne lymfatické uzliny (LU). Nádory však môžu aj vo včasnom štádiu metastázovať hematogénnou cestou bez toho, aby vznikli klinicky zistiteľné vzdialené MTS (M1). Približne 20–40 % pacientov s rôznymi solídnymi tumormi, ktorí sa javia klinicky bez MTS, majú prítomné okultné MTS v kostnej dreni, krvi alebo LU. Tieto okultné MTS sú súčasťou tzv. mikrometastatickej choroby. Práve snaha potlačiť mikrometastatickú chorobu je príčinou, prečo sa pri niektorých typoch nádorov podáva adjuvantná liečba. Zistenie prítomnosti mikrometastatickej choroby môže mať prognostický význam a môže sa uplatniť pri individualizácii liečby onkologických pacientov.
Nádory hlavy a krku tvoria 4 % zo všetkých novodiagnostikovaných malignít ročne. Najčastejšie sa diagnostikuje spinocelulárny karcinóm horného aerodigestívneho traktu (tj. dutina ústna, orofarynx, hypofarynx a larynx). Osobitne sa vyčleňujú nádory nosohltana, nosovej dutiny a prinosových dutín a nádory slinných žliaz, ktoré tvoria histopatologicky odlišné skupiny nádorov. Svojou incidenciou sa zaraďujú medzi zriedkavé nádory tejto oblasti [1].
Pre tumory hlavy a krku je charakteristické skoré metastázovanie do regionálnych LU na krku. Až 60–70 % pacientov s malígnym nádorom hlavy a krku sa diagnostikuje v pokročilom štádiu ochorenia (III a IV). Na druhej strane v porovnaní s inými nádormi, karcinómy horného aerodigestívneho traktu zriedkavo metastázujú do vzdialených orgánov. Výskyt M1 však predstavuje jeden z hlavných faktorov prognózy choroby, a je preto dôležitý pri výbere liečebných modalít. Vzdialené MTS sa najčastejšie detegujú v pľúcach (približne 70 % prípadov), následne v kostiach a v pečeni. Prediktívne faktory vzniku M1 zahŕňajú lokalizáciu primárneho tumoru (najmä hypofarynx), pokročilé štádium choroby, histologický typ nádoru ako aj dosiahnutie lokoregionálnej remisie [2].
Materiál a metodika
Retrospektívna analýza pacientov, ktorým bol diagnostikovaný malígny nádor na Oddelení otorinolaryngológie (ORL) FNsP F. D. Roosevelta v Banskej Bystrici v rokoch 2011–2017. Do súboru boli zaradení pacienti s malígnym nádorom horného aerodigestívneho traktu (tj. orofarynx, hypofarynx, larynx). Pacienti s malígnym nádorom nosohltana, nosovej dutiny, prinosových dutín, ucha, slinných žliaz, štítnej žľazy a pacienti s MTS do LU krku pri neznámom primárnom tumore neboli zaradení do súboru. Zo súboru boli taktiež vyradení pacienti s lymfoproliferatívnym ochorením, malígnym nádorom kože, ako aj pacienti s MTS do LU pri origu mimo ORL oblasti.
Zamerali sme sa na incidenciu diseminovaného ochorenia (M1), lokalizáciu vzdialených MTS, časový faktor – prítomnosť M1 pri diagnostike alebo až po/v priebehu liečby malígneho ochorenia.
Analyzovali sme vzťah primárneho tumoru – lokalita, histopatologický nález, T a N štádium k výskytu M1. Zamerali sme sa na prítomnosť rizikových faktorov – MTS vo viac ako troch LU, bilaterálne MTS postihnutie LU, MTS v LU väčšej ako 6 cm, lokalizácia MTS v LU supraklavikulárne a lokoregionálna recidíva. Sledovali sme aj diagnostický postup M1 a dĺžku prežívania pacientov s diseminovaným ochorením.
Charakteristiku súboru pacientov a sledované dáta sme vyhodnotili pomocou frekvenčnej sumarizácie a deskriptívnej štatistiky – priemer, medián, smerodajná odchýlka, kvartil minima a maxima. Rozdiely medzi sledovanými parametrami sme vyhodnotili použitím testov – Pearsonov c2-test s Yatesovou koreláciou, Mannov-Whitneyho U test a Kruskalov-Wallisov test. Za štatisticky významné sme v rámci všetkých použitých testov považovali hodnoty hladiny významnosti p < 0,05. Na štatistickú analýzu sme použili program STATISTICA Cz 10.
Výsledky
Na ORL oddelení FNsP F. D. Roosevelta v Banskej Bystrici bol v období 1/2011–12/2017 novodiagnostikovaný malígny nádor u 627 pacientov. Malígny nádor horného aerodigestívneho traktu sa diagnostikoval u 474 pacientov (76 %). Malígny nádor orofaryngu sa zistil v 51 %, hrtana v 35 % a hypofaryngu v 14 %. Histopatologicky sa najčastejšie detegoval epidermoidný karcinóm (96 %).
Vzdialená MTS bola diagnostikovaná u 50 zo 474 pacientov s nádorom horného aerodigestívneho traktu (10,5 %), 46 mužov a 4 žien, vek 60 ± 8 rokov (37–76 rokov) (graf 1).

Charakteristika primárneho tumoru horného aerodigestívneho traktu u pacientov s M1 je uvedená v tab. 1. M1 sa signifikantne častejšie vyskytovala u pacientov s karcinómom orofaryngu (30 z 50 pacientov s M1; 60 %; p = 0,014). Vzdialená MTS sa častejšie vyskytovala u pacientov s rozsiahlejším primárnym nádorom (T3 a T4 status, p = 0,001) ako aj uzlinovým postihnutím (N2 a N3 status, p = 0,008). Histopatologicky bola M1 signifikantne častejšie spojená so zle diferencovaným karcinóm v orofaryngu a hypofaryngu (p = 0,039; resp. 0,003).
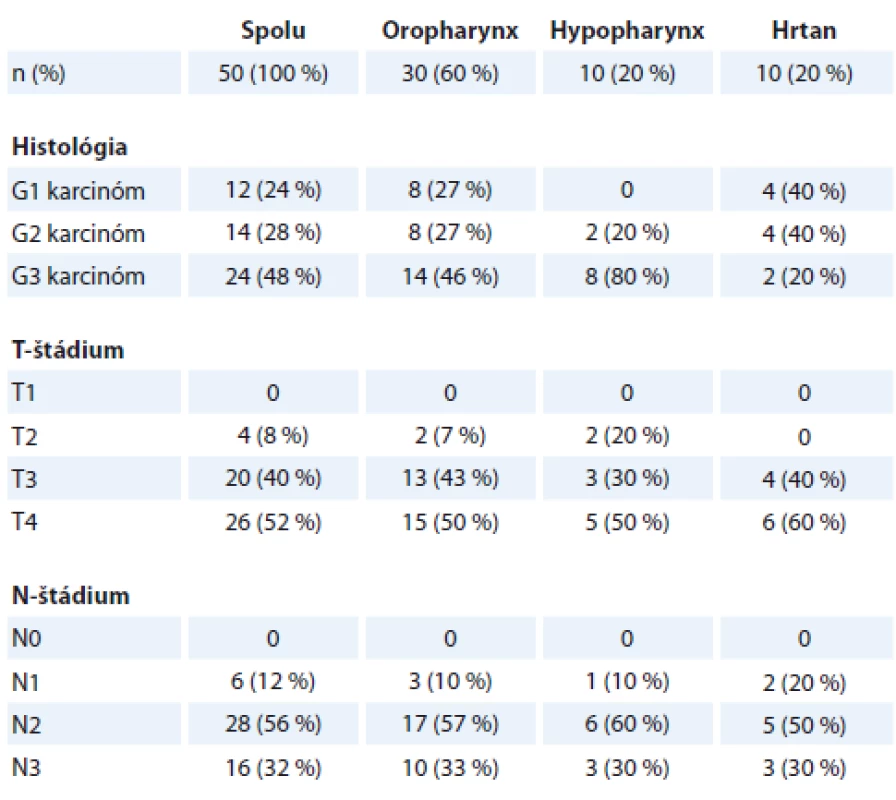
Rizikové faktory – MTS vo viac ako 3 LU, bilaterálne MTS postihnutie LU, MTS v LU väčšej ako 6 cm, lokalizácia MTS v LU supraklavikulárne, lokoregionálna recidíva a duplicitná malignita sa zistili u 74 %, u 31 % bolo prítomných viac rizikových faktorov súčasne (graf 2).
RF – rizikové faktory, MTS – metastázy, LU – lymfatické uzliny

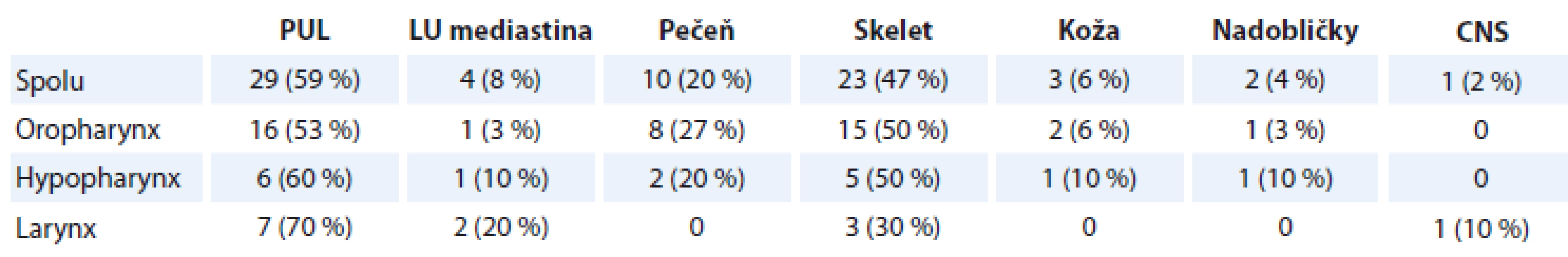
Najčastejšie sme zistili M1 v pľúcach (n = 29; 59 %; p = 0,011) a v skelete (n = 23; 47 %; p = 0,021) (tab. 2). Multiplicitné M1 sme detegovali u 33 z 50 pacientov s M1 (66 %; p = 0,012). Signifikantné rozdiely medzi lokalizáciou vzdialenej MTS a lokalizáciou primárneho tumoru sme nezaznamenali.
Vzdialené MTS sa zistili v rámci stagingu pri diagnostike malígneho ochorenia u 16 z 50 pacientov s M1 (32 %). M1 pri perzistencii/progresii ochorenia sa detegovala u 17 z 50 pacientov (34 %; p = 0,067), a to priemerne 11,2 ± 3,9 mesiaca (5–30 mesiacov) po diagnostike základného ochorenia. M1 pri lokoregionálnej recidíve sa zistila u 8 z 50 (16 %). Izolovaná M1 pri lokoregionálnej remisii bola prítomná u 9 z 50 pacientov (18 %). Najčastejšie (84 %) sa M1 diagnostikovala v rámci realizácie štandardných stagingových/restagingových vyšetrení – CT vyšetrenie krku, hrudníka, brucha. Vyšetrením pozitrónovou emisnou tomografiou s počítačovou tomografiou (PET/CT) sa diagnostikovala M1 u 12 %.
Vzťah liečby základného ochorenia a incidencie M1 je uvedený v grafe 3. V 42 % sa M1 diagnostikovala u pacientov s inoperabilným pokročilým nádorom, u ktorých celkový perfomance status nedovoľoval aplikovať onkologickú liečbu (best support care), alebo im bola podávaná paliatívna onkologická liečba. M1 po kuratívnej liečbe sa diagnostikovala u 58 %, a to u 38 % liečených rádiochemoterapiou a 20 % kombinovane chirurgicky aj onkologicky. Iba chirurgicky liečení pacienti v skupine pacientov s M1 neboli zastúpení.

Medián prežívania pacientov po diagnostike M1 bol priemerne 10,5 ± 3,5 mesiaca (0–48 mesiacov), dvaja pacienti sú stabilizovaní, v remisii. Významné rozdiely v dĺžke prežívanie vzhľadom na lokalizáciu primárneho tumoru sme nezaznamenali (graf 4).

Diskusia
Prítomnosť vzdialených MTS je vo všeobecnosti zlým prognostickým faktorom. Kým pri niektorých typoch nádorov sa M1 vyskytujú relatívne často, napr. kolorektálny karcinóm, pankreas, prostata, prsník, vzdialené MTS pri nádoroch hlavy a krku sa diagnostikujú zriedkavo. Incidencia sa udáva 4–6 % [2–4]. Avšak v prípade prítomnosti rizikových faktorov sa incidencia M1 pohybuje od 20–25 % [2]. Rizikové faktory vzniku M1 pri nádoroch horného aerodigestívneho traktu sú – lokalizácia primárneho tumoru (orofarynx, hypofarynx), histologický typ (nízkodiferencovaný a nediferencovaný karcinóm), pokročilosť ochorenia (T3, T4 a N2, N3 status) [2,5].
Senft et al [6] vo svojej štúdii vymedzili tzv. vysokorizikovú skupinu pacientov, u ktorých je pravdepodobnosť vzniku M1 až 35 %. Podobne aj v štúdii Petersa et al [7] detegovali u tejto vysokorizikovej skupiny pacientov M1 v 44 %. Do tejto vysokorizikovej skupiny pacientov s karcinómom horného aerodigestívneho traktu patria pacienti s:
- MTS vo viac ako troch LU;
- bilaterálne MTS postihnutie LU;
- MTS v LU väčšej ako 6 cm;
- lokalizácia MTS v LU v oblasti IV (supraklavikulárne);
- lokoregionálna recidíva;
- duplicitná malignita [6,7].
Najsilnejší prediktívny faktor je bilaterálne postihnutie LU, najslabší je duplicitný tumor. Veľa pacientov má viacero rizikových faktorov súčasne, čo má kumulatívny efekt a negatívny vplyv na prežívanie [7].
V našom súbore pacientov sme vzdialené MTS diagnostikovali u 10,5 % pacientov s karcinómom horného aerodigestívneho traktu. Rizikové faktory, ktoré boli spojené s vyšším výskytom M1, bola lokalizácia primárneho tumoru v orofaryngu (60 %), zle diferencovaný karcinóm (48 %), rozsiahlejší primárny nádor (T3 a T4 status, 92 %) ako aj rozsiahlejšie postihnutie LU (N2 a N3 status, 88 %). Podobné výsledky zaznamenali aj iní autori [2,4,5,8].
Rizikové faktory (MTS vo viac ako troch LU, bilaterálne MTS postihnutie LU, MTS v LU väčšej ako 6 cm, lokalizácia MTS v LU supraklavikulárne, lokoregionálna recidíva a duplicitný tumor) sa vyskytovali v 74 %. Najčastejšie išlo o faktory týkajúce sa uzlinového nálezu – MTS vo viac ako troch LU (53 %), bilaterálne MTS postihnutie LU (26 %) a MTS v LU väčšej ako 6 cm (22 %).
Väčšinou sa zistia multiplicitné vzdialené MTS ložiská (74 %). Najčastejšie sa M1 deteguje v pľúcach (60–70 %) a skelete (20–25 %). Z ostatných lokalít M1 môžu postihovať pečeň, kožu, LU mediastina, nadobličky, zriedkavo aj CNS. Vo všeobecnosti však lokalizácia ani počet M1 nemá zásadný vplyv na manažment pacientov s diseminovaným ochorením [2,5,6]. V našom súbore sme tiež častejšie diagnostikovali multiplicitný výskyt M1 (66 %). Najčastejšie boli M1 lokalizované v pľúcach (59 %) a v skelete (47 %). Lokalizácia primárneho tumoru neovplyvňovala lokalizáciu výskytu M1.
Čo sa týka časového faktora, M1 môžu byť prítomné už v čase diagnózy, kde ich detekcia výrazne ovplyvní liečebnú modalitu (zmena z kuratívnej na paliatívnu liečbu). M1 najčastejšie vznikajú pri perzistencii a progresii základného ochorenia v priebehu/po kuratívnej/paliatívnej liečbe alebo pri lokoregionálnej recidíve ochorenia po kuratívnej liečbe. Zaujímavé sú M1 pri synchrónnej lokoregionálnej remisii ochorenia. Väčšina autorov sa zhoduje, že tieto pôvodne subklinické M1 boli prítomné už v priebehu liečby, avšak v tom období neboli detekovateľné (pod hladinou rozlíšenia na zobrazovacích vyšetreniach) [6,9,10]. V našom súbore sa M1 v rámci stagingových vyšetrení diagnostikovala v 31 %. U zvyšku pacientov sa detegovala pri progresii alebo po liečbe základného ochorenia.
Diagnostika M1
Pátranie po vzdialených MTS je súčasťou stagingu pri diagnostike každého nového a recidivujúceho malígneho ochorenia. Pre karcinómy hlavy a krku je charakteristické skoré metastázovanie do regionálnych krčných LU a relatívne časté lokoregionálne recidívy. Vzdialené MTS sú u týchto pacientov zriedkavé [3]. V súčasnosti neexistujú štandardy na screening vzdialených MTS u pacientov s karcinómom horného aerodigestívneho traktu. Pre klinika je však potrebné stanoviť rizikové faktory vzniku M1 a tak identifikovať vysokorizikovú skupinu pacientov, u ktorých je následne indikovaná intenzívna onkologická liečba. Okrem toho skorá diagnostika M1 môže mať pozitívny efekt na prežívanie pacientov [2].
M1 sa pri karcinómoch hlavy a krku najčastejšie detegujú v pľúcach, preto sa, hlavne v predchádzajúcich rokoch, vyšetrenia zameriavali predovšetkým na hrudník (röntgenové vyšetrenie, CT), kým ostatným lokalitám sa nevenovala dostatočná pozornosť [3,5]. Podľa štúdií z ostatných 5 rokoch sa však relatívne často M1 deteguje aj v iných lokalitách, predovšetkým v skelete [2,4,10].
V súčasnosti v rámci stagingu/restagingu väčšina autorov indikuje CT hrudníka a brucha (príp. sonografické vyšetrenie brucha) [2,4,8]. Pri rozsiahlejších nádoroch niektorí odporúčajú aj scintigrafické vyšetrenie skeletu [4].
Senft et al [10] odporúčajú realizovať PET/CT vyšetrenie u všetkých pacientov s rizikovými faktormi (MTS vo viac ako troch LU, bilaterálne MTS postihnutie LU, MTS v LU väčšej ako 6 cm, lokalizácia MTS v LU supraklavikulárne, lokoregionálna recidíva). V skupine 46 pacientov s rizikovými faktormi detegovali na základe PET/CT vyšetrenia M1 u 16 pacientov (35 %), a to u 6 (13 %) v rámci stagingu (predliečebne) a u 10 pri restagingu. Senzitivita a špecifita PET/CT v diagnostike M1 sa udáva 80–94 %, resp. 95–100 % [10,11], senzitivita a špecifita CT hrudníka v diagnostike M1 je nižšia, a to 73 %, resp. 85 % [10,12].
Síce na niektorých pracoviskách v zahraničí sa PET/CT vykonáva u všetkých pacientov s malígnym ochorením, toto vyšetrenie vo všeobecnosti nie je štandardnou súčasťou manažmentu pacienta s karcinómom horného aerodigestívneho traktu. Je to dané viacerými faktormi – vyššia radiačná záťaž, vyššia cena ako aj dostupnosť vyšetrenia [13]. PET/CT by však malo byť realizované u vysokorizikových pacientov, a to predliečebne a rok po ukončení liečby. Dvanásť mesiacov sa zdá byť dostatočne dlhý čas, aby bolo možné diagnostikovať aj pôvodne subklinické MTS [10]. Na druhej strane Fakhry et al [8] vo svojej štúdii nepozorovali signifikantné rozdiely v detekcii lokoregionálnej recidívy ako aj M1 použitím CT vyšetrenia v porovnaní s PET/CT. V rámci restagingu preferujú CT vyšetrenie hrudníka a brucha.
Liečba a prognóza
Pacienti so vzdialenou MTS majú zlú prognózu a krátke prežívanie. Väčšinou ide o inkurabilné ochorenie a je podávaná paliatívna chemoterapia alebo best support care. Lokalizácia primárneho tumoru ani lokalizácia M1 nie sú považované za signifikantný faktor, ktorý ovplyvňuje dĺžku prežívania [2,6].
V 90. rokoch minulého storočia bolo prežívanie u väčšiny pacientov do 6 mesiacov, 90 % zomrelo v priebehu 1 roka po diagnostikovaní M1 [14]. V súčasnosti sa doba prežívania po diagnostike M1 významne predĺžila, a to ako dôsledok efektívnejšej a kombinovanej chemoterapie (ak to performance status pacienta dovoľuje). Priemerná dĺžka prežívania je 7,5 mesiaca, celkové prežívanie 1 a 2 roky po diagnóze M1 sa udáva 40,4 %, resp. 26,2 % [2].
U väčšiny pacientov s M1 je indikovaná paliatívna chemoterapia. Vzhľadom na väčšinou lokálne pokročilé ochorenie, zlý performance status pacienta, všeobecne krátke prežívanie pacientov ako aj toxicitu onkologickej liečby mnohí autori túto liečbu považujú za kontroverznú a odporúčajú best support care [2,6]. Na druhej strane, pri solitárnej vzdialenej MTS, bez známok synchrónnej lokoregionálnej recidívy ochorenia a dobrom performance statuse je možné uvažovať aj o kuratívnom prístupe v zmysle chirurgickej exstirpácie a/alebo rádiochemoterapii [2,15,16].
Aj v našom súbore bola pacientom s M1 najčastejšie podávaná paliatívna chemoterapia. Prežívanie pacientov po diagnostike M1 bolo priemerne 10,4 ± 3,5 mesiaca (0–48 mesiacov). Významné rozdiely v dĺžke prežívania vzhľadom na lokalizáciu primárneho tumoru sme nezaznamenali. Dvom pacientom s izolovanou kostnou MTS, lokoregionálnou remisiou a dobrým performance statusom bola podávaná kuratívna liečba – chirurgická resekcia a rádiochemoterapia, sú stabilizovaní, v remisii.
Aj napriek vážnej prognóze je potrebné pristupovať ku každému pacientovi individuálne. Liečba by mala byť „na mieru“, a to na základe faktorov ochorenia – solitárna/multiplicitná M1, M1 diagnostikovaná v rámci stagingu alebo restagingu pri lokoregionálnej progresii/recidíve/remisii, dôležitý je performance status pacienta, ako aj názor a želanie samotného pacienta.
Záver
Karcinómy hlavy a krku sú známe častým metastázovaním do regionálnych LU krku a lokoregionálnou recidívou. Vzdialené MTS sa vyskytujú zriedkavo, ich detekcia má výrazný vplyv na ďalší manažment pacienta. Na možnosť vzdialených MTS treba myslieť predovšetkým v prípade prítomnosti rizikových faktorov – MTS vo viac ako troch LU, bilaterálne MTS postihnutie LU, MTS v LU väčšej ako 6 cm, lokalizácia MTS v LU supraklavikulárne a lokoregionálna recidíva. M1 sa najčastejšie detegujú v pľúcach a kostiach. Najdôležitejšiu úlohu v detekcii M1 zohráva CT vyšetrenie hrudníka, pri prítomnosti rizikových faktorov je vhodné celotelové PET/CT vyšetrenie. U väčšiny pacientov s karcinómom hlavy a krku, ktorí majú diseminované ochorenie, je aplikovaná paliatívna chemoterapia, eventuálne best support care. U pacientov s dobrým performance statusom pri solitárnej M1 a lokoregionálnej remisii ochorenia je vhodné uvažovať o kuratívnej liečbe.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Barbora Uhliarová, PhD.
Oddelenie otorinolaryngológie
FNsP F. D. Roosevelta
Nám. L. Svobodu 1
975 17 Banská Bystrica, Slovensko
e-mail: b.uhliarova@gmail.com
Obdržané: 22. 2. 2019
Prijaté: 30. 5. 2019
Zdroje
1. Gočárová K, Špánik S. Zriedkavé nádory hlavy a krku. Onkológia (Bratisl.) 2013; 8 (2): 78–82.
2. Wiegand S, Zimmermann A, Wilhelm T et al. Survival after distant metastasis in head and neck cancer. Anticancer Res 2015; 35 (10): 5499–5502.
3. Andrle J, Schartinger VH, Schwentner I et al. Initial staging squamous cell carcinoma: are they appropriate? J Laryngol Otol 2009; 123 (8): 885–888. doi: 10.1017/S0022215109005258.
4. Jäckel MC, Reischl A, Huppert P. Efficacy of radiologic screening for distant metastases and second primaries in newly diagnosed patients with head and neck cancer. Laryngoscope 2007; 117 (2): 242–247. doi: 10.1097/01.mlg.0000248232.27668.57.
5. Ferlito A, Buckley JG, Rinaldo A et al. Screening tests to evaluate distant metastases in head and neck cancer. ORL J Otorhinolaryngol Relat Spec 2001; 63 (4): 208–211. doi: 10.1159/000055741.
6. Senft A, Hoekstra OS, Witte BI et al. Screening for distant metastases in head and neck cancer patients using FDG-PET and chest CT: validation of an algorithm. Eur Arch Otorhinolaryngol 2016; 273 (9): 2643–2650. doi: 10.1007/s00405-015-3773-8.
7. Peters TT, Senft A, Hoekstra OS et al. Pretreatment screening on distant metastases and head and neck cancer patients: validation of risk factors and influence on survival. Oral Oncol 2015; 51 (3): 267–271. doi: 10.1016/j.oraloncology.2014.12.006.
8. Fakhry N, Michel J, Colavolpe C et al. Screening for distant metastases before salvage surgery in patients with recurrent head and neck squamous cell carcinoma: a retrospective case series comparing thoraco-abdominal CT, positron emission tomography and abdominal ultrasound. Clin Otolaryngol 2012; 37 (3): 197–206. doi: 10.1111/j.1749-4486.2012.02481.x.
9. Orlacchio A, Schillaci O, Antonelli L et al. Solitary pulmonary nodules: morphological and metabolic characterisation by FDG-PET-MDCT. Radiol Med 2007; 112 (2): 157–173. doi: 10.1007/s11547-007-0132-x.
10. Senft A, Yildirim G, Hoekstra OS et al. The adverse impact of surveillance intervals on the sensitivity of FDG-PET/CT for the detection of distant metastases in head and neck cancer patients. Eur Arch Otorhinolaryngol 2017; 274 (2): 1113–1120. doi: 10.1007/s00405-016-4353-2.
11. Abouzied MM, Fathala A, Alsugair A et al. Role of fluorodeoxyglucose-positron emission tomography/computed tomography in the evaluation of head and neck carcinoma. World J Nucl Med 2017; 16 (4): 257–265. doi: 10.4103/wjnm.WJNM_40_17.
12. Brouwer J, de Bree R, Hoekstra OS et al. Screening for distant metastases in patients with head and neck cancer: is chest CT sufficient? Laryngoscope 2005; 115 (10): 1813–1817. doi: 10.1097/01.mlg.0000174954. 51514.b7.
13. Uhliarová B, Švec M. Využitie PET/CT v otorinolaryngológii. Slov lek 2017; 9–10: 18–24.
14. Calhoun KH, Fulmer P, Weiss R et al. Distant metastases from head and neck squamous cell carcinomas. Laryngoscope 1994; 104 (10): 1199–1205.
15. Chen F, Sonobe M, Sato K et al. Pulmonary resection for metastatic head and neck cancer. World J Surg 2008; 32 (8): 1657–1662. doi: 10.1007/s00268-008-96 31-8.
16. Winter H, Meimarakis G, Hoffmann G et al. Does surgical resection of pulmonary metastases of head and neck cancer improve survival? Ann Surg Oncol 2008; 15 (10): 2915–2926. doi: 10.1245/s10434-008-0001-4.
Štítky
Detská onkológia Chirurgia všeobecná OnkológiaČlánok vyšiel v časopise
Klinická onkologie

2019 Číslo 4
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Tramadol a paracetamol v tlumení poextrakční bolesti
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
Najčítanejšie v tomto čísle
- Současný pohled na HPV asociované karcinomy orofaryngu a roli p16 jako surogátního markeru high-risk HPV
- Vliv mikrobiomu na vznik a vývoj kolorektálního karcinomu
- Onkologická kazuistika – kdy je vhodný čas na integraci paliativní péče?
- Incidencia a rizikové faktory vzniku vzdialených metastáz u pacientov s karcinómom hlavy a krku
