-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Neurotoxicita a imunoterapie
Neurotoxicity and Immunotherapy
Background: Great progress has recently been made in immunotherapy of solid carcinomas. The advent of immunotherapy with checkpoint inhibitors has brought not only a completely different mechanism of action but also different types of adverse reactions. These adverse reactions are similar to those of autoimmune diseases and are referred to as immune-related adverse events. Most adverse reactions are due to lower grade toxic effects. Neurotoxicity is a less frequent. On the other hand, with the spread of immunotherapy, it can be assumed that adverse events with a lower incidence may occur in a relatively higher frequency due to borader usage of immunotherapeutics and thus, physicians outside of cancer centres may be presented with these events. The main therapeutic intervention is immunosuppressive therapy with corticoids. However, in some cases, or in case of delayed intervention, they may be fatal.
Purpose: Therefore, it is of great importance to increase the physician’s and patient’s knowledge of the possible complications of this promising treatment modality. It is essential to apply proper management and help patients engage positively to prevent these situations occurring.
This study was supported by the following research programme of Ministry of Health of the Czech Republic – RVO (FNHK, 00179906).
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Keywords:
nivolumab – ipilimumab – imunotherapy – neurotoxicity
Autori: J. Kopecký
Pôsobisko autorov: Klinika onkologie a radioterapie FN Hradec Králové
Vyšlo v časopise: Klin Onkol 2020; 33(1): 11-14
Kategória: Přehled
doi: https://doi.org/10.14735/amko202011Súhrn
Východiska: V poslední době bylo dosaženo velkého pokroku na poli imunoterapie napříč solidními nádory. Avšak s příchodem imunoterapie jsme vystaveni nejen odlišnému mechanizmu účinku, ale i odlišným projevům nežádoucích účinků. Jedná se o účinky podobné autoimunitním onemocněním označované jako imunitně podmíněné nežádoucí účinky. Ve většině případů se jedná o účinky nižšího stupně závažnosti. Mezi méně časté nežádoucí účinky patří i neurotoxicita. S rozšířením používání imunoterapie je nutné předpokládat, že i nežádoucí účinky s nižší incidencí se při širším použití mohou vyskytnout v relativně vyšším počtu a mohou se s nimi setkat i lékaři mimo onkologická pracoviště. Hlavní léčebnou intervencí je imunosupresivní terapie kortikoidy. V některých případech či při opožděné intervenci však nežádoucí účinky mohou mít i fatální dopad.
Cíl: Je nutné, aby s nežádoucími účinky souvisejícími s imunoterapií byli seznámeni nejen pacienti, ale i lékaři, kteří přicházejí s těmito pacienty do styku. Podstatné je, že při správném managementu a pozitivní motivaci pacientů je možné těmto situacím předcházet.
Klíčová slova:
imunoterapie – ipilimumab – nivolumab – neurotoxicita
Úvod
Imunoterapie se v posledním desetiletí stala neodmyslitelnou součástí standardní onkologické léčby. Rozšiřuje se nejen spektrum diagnóz léčených touto modalitou, ale současně narůstá i absolutní počet pacientů. Jedna z méně častých, avšak potenciálně život ohrožujících imunitně podmíněných reakcí je neurotoxicita.
Vlastní zkušenost
Případ 64letého pacienta s generalizovaným tumorem ledviny léčeného nivolumabem v 2. linii jsme již prezentovali formou kazuistiky [1]. U tohoto pacienta se 14 dní po 6. dávce (240 mg každých 14 dní) objevily nespecifické změny chování. Z fyzikálního vyšetření u pacienta dominovaly mírné choreatické pohyby horních končetin a hlavy. Dle dostupných laboratorních vyšetření nebyla nalezena žádná patologie, která by vysvětlovala změnu chování. Na kontrolním vyšetření výpočetní tomografií (computed tomography – CT) byl nález hodnocen jako regrese (skelet, plíce). Vyšetření magnetickou rezonancí (magnetic resonance imaging – MRI) mozku vyloučilo přítomnost mozkové metastázy, avšak byla popsána suspektní inflamatorní infiltrace v okolí bazálních ganglií (obr. 1). V rámci diferenciální diagnostiky byly dále provedeny odběry krevního séra k virologickému a základnímu autoimunitnímu vyšetření (negativní). V rámci širší diferenciální diagnostiky byl proveden odběr mozkomíšního moku k mikrobiologickému, virologickému, cytologickému a biochemickému vyšetření, ve všech případech bez patologie, která by vysvětlovala pacientovy příznaky. Dále bylo provedeno vyšetření likvoru průtokovým cytometrem, kde dominujícím nálezem byla přítomnost lymfocytů reprezentovaných v drtivé většině CD4+ pomocnými T lymfocyty. Mozkomíšní mok byl dále vyšetřen ve speciální laboratoři se zaměřením na neuroimunologické parametry, přičemž nález vyloučil poškození mozkové tkáně či příznaky primární infekce. Jediným nálezem byla vyšší hladina anti-paraneoplastického antigenu Ma2 imunoglobulin G třídy. Tyto nálezy spolu s výsledky MRI vyšetření a klinickým obrazem, který se u pacienta každým dnem zhoršoval, svědčily o toxicitě vyvolané nivolumabem. U pacienta byla zahájena již od začátku hospitalizace vysokodávkovaná léčba kortikoidy. I přes nasazení adekvátní léčby kortikosteroidy a následně i infliximabu došlo u pacienta k progresi stavu s rozvojem halucinatorního syndromu se suicidálními tendencemi. Ve vývoji celé situace sehrála důležitou roli rodina a pacient, kteří odmítli další setrvání v nemocnici, a po podepsání negativního reverzu byl pacient propuštěn do domácího léčení. Pacient zemřel v důsledku močové infekční komplikace. Patologicko-anatomická pitva prokázala kompletní regresi v plicích, zbytkové nekrotické tkáně ve skeletu a dále zánět mozku s predominancí v oblasti ganglií a perivaskulárně (obr. 2).
Obr. 1. Magentická rezonance mozku zobrazující oblast bazálních ganglií, šipky znázorňují oblast zánětlivě zvýšeného signálu. 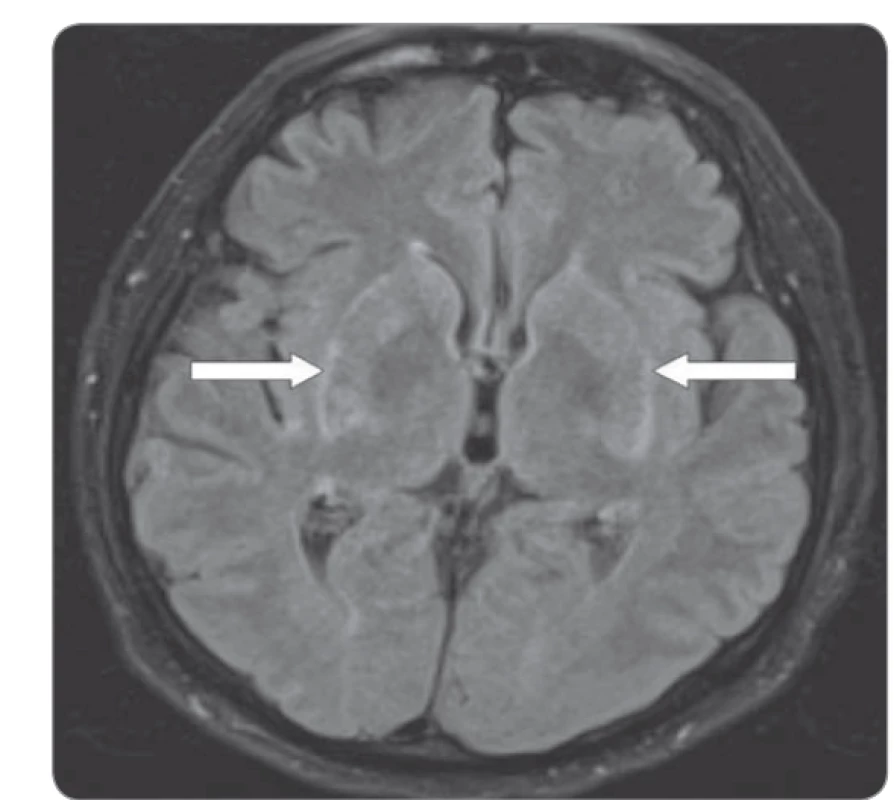
Tab. 1. Histologické vyšetření bazálních ganglií (zvětšení 100×).
A. Hematoxylin-eozinové barvení perivaskulární infi ltrace.
B. Imunohistochemické barvení perivaskulární oblasti pomocí CD4.
C. CD8 znaku.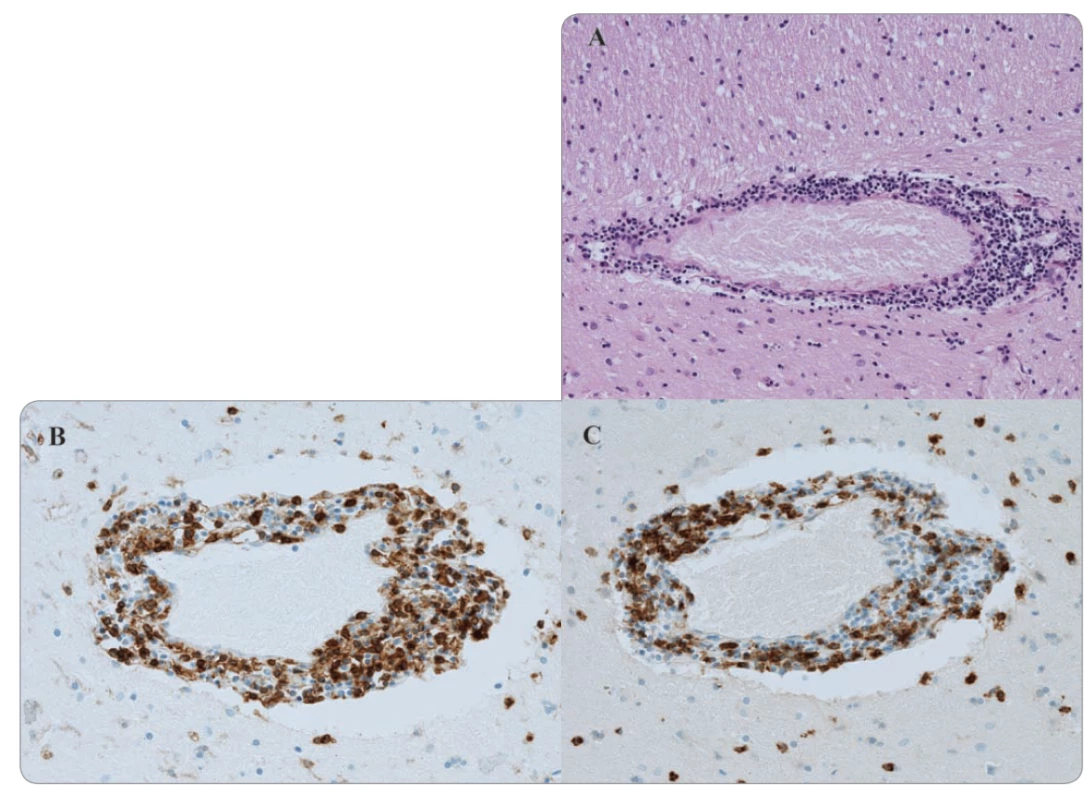
Epidemiologie
Imunitně podmíněné nežádoucí účinky (immune-related adverse events – irAE) ovlivňující centrální nervový systém (CNS) nebo periferní nervový systém (PNS) jsou vzácné. Míra výskytu závisí i na tom, co vše je pojmem neurotoxicita myšleno. Pokud se do neurologických komplikací léčby přiřadí symptomy jako bolest hlavy, dysguezie či motání, pak se výskyt jakéhokoliv stupně toxicity pohybuje kolem 3,8 % pro anti-CTLA-4 (cytotoxic T-lymphocyte antigen 4), 6,1 % pro anti-PD-1 (programed cell death 1) a 12 % při použití kombinace anti-CTLA-4 a anti-PD-1 léčby [2]. Avšak výskyt toxicity stupně 3 a 4 je vzácný – 0,7 %, 0,4 %, resp. 0,7 % [2]. Na druhou stranu víme, že neurotoxicita se podílí na celkové mortalitě spojené s imunoterapií z 6 % pro anti-CTLA-4, z 15 % pro anti-PD-1 a z 8 % pro kombinaci anti-CTLA-4 s anti-PD-1 [3], což ji řadí na přední místa příčiny úmrtí při léčbě checkpoint inhibitory.
Nebyla prokázána souvislost mezi dávkou a výskytem neurotoxicity pro anti-CTLA-4, v případě anti-PD-1 protilátek se ukázaly protichůdné výsledky pro nivolumab (míra vyšší incidence neurotoxicity s vyšší dávkou) s pembrolizumabem (opačný jev) [2].
Mezi častěji vyskytující se neurotoxicity patří rozličné fokální projevy neuropatií, meningoradikulitid [4], ale mohou se vyskytnout i případy vzácnějšího postižení podobné Guillainovu-Barrého syndromu [5]. Dále sem patří imunoterapií indukovaná či de novo vzniklá myasthenia gravis [6]. V případě CNS se nejčastěji jedná o různé projevy encefalitid [7] a aseptických meningitid [8].
Klinický obraz a diagnostika
V závislosti na místě postižení se klinicky může neurotoxicita projevit jako encefalitida, meningitida, demyelizační polyneuropatie, myastenický syndrom, senzor-motorické neuropatie a další. Imunitně podmíněná neurotoxicita je těžko odlišitelná od neurotoxicity z jiné příčiny. Může se projevovat širokou škálou příznaků, vč. bolesti hlavy, horečky, slabosti, únavy, poruchy paměti, halucinací a křečí, svalové ochablostí apod. Diagnóza se často provádí metodou per exclusionem. Vzhledem k tomu, že stěžejní intervencí pro léčbu neurologických irAE jsou kortikosteroidy, je klíčové, aby tyto diagnostické postupy nebyly příčinou opoždění iniciace léčby, a to hlavně v případech, kdy je infekční etiologie málo pravděpodobná. Nástup irAE neurotoxicity můžeme nejčastěji očekávat v počátcích imunoterapie mezi 6. a 12. týdnem, avšak výjimkou není ani pozdější výskyt a není vyloučen i výskyt po skončení samotné terapie.
Diagnostické přístupy se liší dle postižené oblasti a je vhodné do tohoto procesu přizvat neurologa, minimálně proto, aby bylo provedeno detailní fyzikální neurologické vyšetření. Definitivní stanovení diagnózy vyžaduje ve většině případů širší diagnostický algoritmus, ve kterém se provádí vyšetření séra, mozkomíšního moku a dále pak různá zobrazovací, event. funkční vyšetření. Jedním z hlavních cílů diagnostického procesu je vyloučení infekční etiologie (bakteriální či virové) a dále vyloučení metastatického postižení zasahujícího nervovou soustavu.
Základní vyšetřovací metodou pro toxicitu postihující CNS je MRI a CT vyšetření. Tato vyšetření nám pomohou při vyloučení metastatického postižení a dále k vyloučení možných kontraindikací pro lumbální punkci. Pokud je proveden odběr mozkomíšního moku, pak součástí vyšetření musí být kromě standardního mikrobiálního, virologického a biochemického vyšetření i cytologické vyšetření. Použití průtokové cytometrie může být dalším vodítkem ke stanovení konečné diagnózy. V nejednoznačných případech je vhodné provést i specifické neuroimunologické vyšetření likvoru ve specializovaných laboratořích, které je zaměřeno na imunoglobuliny vč. jejich izoelektrické fokuzace, na reaktanty akutní fáze a cytokiny.
V případě toxicity PNS je hlavním vyšetřovacím nástrojem elektromyografie, dále pak opět vyšetření mozkomíšního moku a celkové vyšetření s cílem vyloučit infekční etiologii. Pokud diagnostické úsilí nevede ke stanovení konečné diagnózy, je v jednotlivých případech indikováno i histolopatologické vyšetření, především pokud v rámci diferenciální diagnostiky pomýšlíme na myozitidu. V případě podezření na určité neurologické syndromy (např. myasthenia gravis, Guillainův-Barrého syndrom) je pak vhodné provést specifické testy k potvrzení či vyloučení těchto syndromů. Například specifické protilátky vůči acetylcholinovým receptorům či svalové specifické kináze při podezření na myasthenia gravis či taková vyšetření jako plicní funkční vyšetření při podezření na Guillainův-Barrého syndrom.
Názorný grafický a přehledný diagnostický algoritmus pro neurotoxicitu prezentovali autoři Touat et al [8] či Cuzzubo et al [2].
Management toxicity
Pro vlastní léčbu nežádoucích účinků byla vypracována podrobná doporučení, která vycházejí ze zkušeností získaných v rámci klinických studií. V současné době existují algoritmy pro jednotlivé nežádoucí účinky, které byly již mnohokrát publikovány [9,10].
Koncept managementu nežádoucích účinků stojí na pěti základních pilířích: prevence, vstupní vyšetření, detekce, léčba a monitorace [11]. Každý z těchto pilířů má v managementu irAE své nezastupitelné místo. Dalším rozhodujícím faktorem pro stanovení postupu léčby irAE je zhodnocení závažnosti příznaku toxicity pomocí tzv. kritérií obecné terminologie pro nežádoucí účinky (common terminology criteria for adverse events – CTCAE).
Použití této klasifikace je velmi užitečným nástrojem ke stanovení a hodnocení průběhu nežádoucího účinku v čase. Na druhou stranu musíme mít na paměti, že jsou CTCAE primárně koncipována pro klinická hodnocení a nemusejí vždy odrážet reálný dopad. Toto je příznačné právě pro neurotoxicitu, kdy se často může jednat o symptomy nejednoznačné, často mírné, hodnocené jako symptomy nízkého stupně toxicity, ale nevypovídající nic o potenciálu jejich závažnosti, kdy i nízký stupeň může mít fatální dopad na celkový průběh nemoci pacienta. Například počáteční parestezie nízkého stupně toxicity se mohou změnit v závažný až život ohrožující stav, jako např. Guillainův-Barrého syndrom. Z tohoto důvodu je důležité, aby v případě podezření na neurologickou toxicitu byla provedena včasná diagnostika a včasné zahájení imunosupresivní léčby bez ohledu na stupeň toxicity, a současně v případě předpokládaného závažného či nejistého vývoje by měla být zvažována i hospitalizace k pečlivé monitoraci vývoje stavu.
Hlavním pilířem léčby ke zvládnutí neurologické toxicity, snížení morbidity a případně i mortality je terapie kortikosteroidy. Dávka kortikosteroidů závisí na stupni projevů toxicity a pohybuje se v rozmezí od 0,5 do 2 mg/kg/den. Vzhledem k tomu, že odpověď na léčbu kortikosteroidy u neurologických irAE se ukazuje být obecněji pomalejší a méně účinná než u jiných irAE, je vhodné zvažovat od počátku intravenózní aplikaci a dále zvážit iniciální léčbu vyššími dávkami kortikosteroidů.
K vyhodnocení efektu léčby kortikosteroidy je nutné, aby proběhlo v průběhu 3, max. 5 dnů, a nedostaví-li se očekávané zlepšení, pak je nutné zvažovat další postup. V případě nižšího vstupního dávkování kortikosteroidů zvolit eskalaci dávky či zvážit další časné intervence. Jako efektivní metoda pro neurologické irAE se jeví použití plazmaferézy. Jde o metodu, při které dochází k odstranění patologických látek v plazmě (autoprotilátek, monoklonálních proteinů, toxinů vázaných na plazmatické bílkoviny) nebo odstranění nadměrně zmnožených fyziologických součástí plazmy (cytokinů, kininů, složek komplementu aj.). Interval, kdy je ještě možné očekávat účinek plazmaferézy, je závislý na farmakokinetických vlastnostech použitého checkpoint inhibitoru. Pro nivolumab je terminální biologický poločas kolem 25 dnů, pro ipilimumab 14 dnů, pro atezulizumab 27 dnů a pro avelumab 6 dnů, pro pembrolizumab se interval pohybuje mezi 14 až 27 dny [12].
V případě selhání plazmaferézy nebo současně s ní je možno uvažovat o použití dalších imunosupresiv jako infliximab či podání intravenózních imunoglobulinů. V rámci jednotlivých kazuistik byly podávány i preparáty jako např. tacrolimus, cyklofosfamid, rituximab a další [8], a není tedy chybou tyto látky použít, ač se jedná často o indikaci off-label.
Závěrem je však nutno poznamenat, že základní premisa bezpečné léčby checkpoint inhibitory spočívá nejen ve znalosti toxického profilu, znalosti kinetiky nežádoucích účinků daného preparátu či v časné intervenci, ale jak ukazuje i naše zkušenost, také v dobré spolupráci pacienta, resp. jeho rodiny.
Závěr
Imunoterapie představuje velký přínos pro onkologické pacienty napříč širokým spektrem nádorových onemocnění. S účinností této léčby jdou však v ruku v ruce i nežádoucí účinky vč. neurologických. Tento typ toxicity je zcela odlišný od doposud zavedené terapie a souvisí s vlastním mechanizmem účinku. Může mít projevy v různé intenzitě, od lehkých až po život ohrožující stavy. Vzhledem k rychlému rozšíření imunoterapie do klinické praxe dochází ke zvyšování počtu takto léčených pacientů. Je proto nezbytně nutné, aby s nežádoucími účinky imunoterapie byli seznámeni nejen lékaři indikující tuto léčbu, ale i lékaři, kteří s takto léčenými pacienty přicházejí do kontaktu.
Práce byla realizována za podpory Ministerstva zdravotnictví ČR v rámci programu koncepčního rozvoje výzkumné organizace – RVO (FNHK, 00179906).
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Jindřich Kopecký, Ph.D.
Klinika onkologie a radioterapie FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: kopecjin@fnhk.cz
Obdrženo: 15. 10. 2019
Přijato: 25. 10. 2019
Zdroje
1. Kopecky J, Kubecek O, Geryk T et al. Nivolumab induced encephalopathy in a man with metastatic renal cell cancer: a case report. J Med Case Rep 2018; 12 (1): 262. doi: 10.1186/s13256-018-1786-9.
2. Cuzzubbo S, Javeri F, Tissier M et al. Neurological adverse events associated with immune checkpoint inhibitors: review of the literature. Eur J Cancer 2017; 73 : 1–8. doi: 10.1016/j.ejca.2016.12.001.
3. Wang DY, Salem JE, Cohen JV et al. Fatal toxic effects associated with immune checkpoint inhibitors: a systematic review and meta-analysis. JAMA Oncol 2018; 4 (12): 1721–1728. doi: 10.1001/jamaoncol.2018.3923.
4. Gu Y, Menzies AM, Long GV et al. Immune mediated neuropathy following checkpoint immunotherapy. J Clin Neurosci 2017; 45 : 14–17. doi: 10.1016/j.jocn.2017.07.014.
5. Supakornnumporn S, Katirji B. Guillain-Barre syndrome triggered by immune checkpoint inhibitors: a case report and literature review. J Clin Neuromuscul Dis 2017; 19 (2): 80–83. doi: 10.1097/CND.0000000000000193.
6. Makarious D, Horwood K, Coward JI. Myasthenia gravis: an emerging toxicity of immune checkpoint inhibitors. Eur J Cancer 2017; 82 : 128–136. doi: 10.1016/ j.ejca.2017.05.041.
7. Larkin J, Chmielowski B, Lao CD et al. Neurologic serious adverse events associated with nivolumab plus ipilimumab or nivolumab alone in advanced melanoma, including a case series of encephalitis. Oncologist 2017; 22 (6): 709–718. doi: 10.1634/theoncologist.2016-0487.
8. Touat M, Talmasov D, Ricard D et al. Neurological toxicities associated with immune-checkpoint inhibitors. Curr Opin Neurol 2017; 30 (6): 659–668. doi: 10.1097/WCO.0000000000000503.
9. Haanen JB, Carbonnel F, Robert C et al. Management of toxicities from immunotherapy: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2018; 29 (Suppl 4): 264–266. doi: 10.1093/annonc/mdy162.
10. Lakomy R, Poprach A. Side effects of modern immunotherapy and how to solve them in the clinics. Klin Onkol 2015; 28 (Suppl 4): 4S103–4S114. doi: 10.14735/amko20154S103.
11. Kyllarová A, Kubeček O, Trojanová P et al. Toxicita imunoterapie. Onkoklogie 2017; 11 (2): 83–87.
12. Centanni M, Moes DJ, Trocóniz IF et al. Clinical pharmacokinetics and pharmacodynamics of immune checkpoint inhibitors. Clin Pharmacokinet 2019; 58 (7): 835–857. doi: 10.1007/s40262-019-00748-2.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek EditorialČlánek Aktuality z odborného tisku
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2020 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Editorial
- Nežádoucí účinky a efekt imunoterapie
- Neurotoxicita a imunoterapie
- Management imunitně podmíněné endokrinopatie při protinádorové léčbě checkpoint inhibitory
- Toxicita imunoonkologické léčby – myokarditida
- Gastrointestinální toxicita imunoterapie
- Renální toxicita imunoonkologické léčby
- The Important Role of STAT3 in Chronic Lymphocytic Leukaemia Biology
- Význam fibroblastů asociovaných s nádorem při patogenezi karcinomů v oblasti hlavy a krku
- Dlouhodobé klinické výsledky IGRT karcinomu prostaty
- Expresia ligandu receptora programovanej bunkovej smrti 1 v bio psii nemalobunkového karcinómu pľúc a jej asociácia s tumor infi ltrujúcimi lymfocytmi a stupňom dezmoplázie
- Novinky z genetiky, molekulární biologie a klinické onkologie sarkomů
- Vzpomínka na prof. MUDr. Vítězslava Kolka, DrSc.
- Prof. MUDr. Stanislav Špánik, CSc. – 60-ročný
- Aktuality z odborného tisku
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Nežádoucí účinky a efekt imunoterapie
- Neurotoxicita a imunoterapie
- The Important Role of STAT3 in Chronic Lymphocytic Leukaemia Biology
- Toxicita imunoonkologické léčby – myokarditida
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



