-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Invazívna rino-orbito-cerebrálna forma mukormykózy u detskej pacientky s akútnou leukémiou
Invasive Rhino-Orbito-Cerebral Mucormycosis in Pediatric Patient with Acute Leukemia
Background: Invasive fungal infections are a life-threatening complication of cancer treatments, especially in hemato-oncological patients. Mucormycosis is the third leading cause of invasive fungal infections after Aspergillus and Candida infections. The first clinical symptoms are usually non-specific, which can lead to a late diagnosis and delayed therapy.
Purpose: The objective of this report is to summarize data in the literature about mucormycosis and to present a case report of a patient with acute lymphoblastic leukemia, who developed this infection at our center. Risk factors for the development of mucormycosis, clinical symptoms, radiology, laboratory results, and outcome were retrospectively evaluated.
Case: We describe a 6-years-old female patient with acute lymphoblastic leukemia. During the induction phase of therapy, the patient developed febrile neutropenia and did not respond to therapy with a combination of antibiotics and supportive treatment. Pansinusitis and orbitocellulitis developed. Examination of the biological material revealed that the etiological agent was a Rhizopus sp. The patient was treated with a combination of antimycotic drugs, but the infection disseminated to the central nervous system. She underwent radical surgical resection of the affected tissue. At this time, she is still under treatment with antimycotic and oncology agents, but is in remission of the main diagnosis and in good clinical condition.
Conclusion: Mucormycosis is an invasive fungal infection with high morbidity and mortality. Early diagnosis and initiation of effective therapy using a combination of amphotericin B administration and surgery are necessary to obtain a favorable outcome.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Keywords:
mucormycosis – acute leukemia – Rhizopus
Autori: Eva Bačová 1; Filip Chovanec 1; Miroslava Makohusová 1; Stanislava Hederová 1; Martina Mikesková 1; Andrea Hrašková 1; Bruno Rudinský 2; Lukáš Plank 3; Pavlína Volfová 4; Alexandra Kolenová 1
Pôsobisko autorov: Klinika detskej hematológie a onkológie LF UK a Národný ústav detských chorôb, Bratislava, Slovenská republika 2 Neurocentrum, Klinika detskej chirurgie LF UK a Národný ústav detských chorôb, Bratislava, Slovenská republika 3 Ústav patologickej anatómie, 1
Vyšlo v časopise: Klin Onkol 2020; 33(2): 138-144
Kategória: Kazuistika
doi: https://doi.org/10.14735/amko2020138Súhrn
Východiská: Invazívne mykotické infekcie predstavujú život ohrozujúcu komplikáciu liečby imunokompromitovaných pacientov, obzvlášť u hematologických malignít. Mukormykóza je po aspergilovej a kandidovej infekcii tretia najčastejšia príčina invazívnych mykóz. Prvé symptómy sú väčšinou nešpecifické, čo môže viesť k oddialeniu diagnózy a liečby.
Cieľ: Cieľom tejto práce je súhrn literárnych údajov o mukormykóze a prezentácia kazuistiky pacientky s akútnou leukémiou, u ktorej bola diagnostikovaná táto infekcia na Klinike detskej hematológie a onkológie v Bratislave. Retrospektívne boli vyhodnotené rizikové faktory, klinické symptómy, zobrazovacie a laboratórne nálezy a výsledok liečby.
Prípad: Opisujeme kazuistiku 6-ročnej pacientky s diagnózou akútnej lymfoblastovej leukémie. Počas indukčnej liečby sa u pacientky rozvinula febrilná neutropénia nereagujúca na kombinovanú antibiotickú a podpornú liečbu. U pacientky sa objavila pansinusitída a následná orbitocelulitída. Vyšetrením biologického materiálu sa nám podarilo identifikovať pôvodcu ochorenia – Rhizopus sp. Pacientka dostávala kombinovanú antimykotickú liečbu, avšak jej stav progredoval do rozšírenia patologického procesu do centrálnej nervovej sústavy. Podstúpila radikálnu chirurgickú resekciu postihnutého tkaniva. T. č. pokračuje v antimykotickej a onkologickej terapii, pretrváva u nej remisia základného ochorenia a je v dobrom klinickom stave.
Záver: Mukormykóza je invazívna mykotická infekcia s vysokou morbiditou a mortalitou. K zvládnutiu ochorenia je nevyhnutná včasná diagnostika a skorý začiatok efektívnej terapie, ktorou je kombinácia amfotericínu B a chirurgickej liečby.
Klíčová slova:
mukormykóza – akútna leukémia – Rhizopus
Úvod
Mukormykóza je zriedkavá, život ohrozujúca infekcia s vysokou morbiditou a mortalitou. Vzhľadom na závažnosť tejto komplikácie pri jej výskyte často dochádza k oddialeniu onkologickej liečby.
Mukormycéty patria do rodu Mucorales, trieda Mucormycotina [1]. Zástupcami tohto rodu sú rozšírené plesne, ktoré môžu byť izolované zo vzduchu, z pôdy, z rozkladajúcich sa rastlín, z ovocia, z obilnín atd. [2]. Väčšina dostupných dát pochádza z publikovaných kazuistík, keďže kvôli zriedkavosti tohto ochorenia je ťažké previesť veľkú randomizovanú štúdiu.
Napriek závažnosti tejto infekcie sú prvotné príznaky obyčajne len nešpecifické, čo môže viesť k oddialeniu diagnózy, a tým aj k neskorému začatiu potrebnej liečby.
Terapia mukormykózy si vyžaduje multimodálny prístup. Liečbou voľby podľa posledných publikovaných odporúčaní zostáva lipozomálny amfotericín B s následnou chirurgickou resekciou postihnutého tkaniva. Jediné nové antimykotikum s účinnosťou proti mukormycétam je isavukonazol, ktorý ale nepreukázal signifikantne vyššiu účinnosť než amfotericín B a posakonazol [3].
K najčastejším vyvolávateľom mukormykózy u nás patrí Rhizopus spp., Mucor spp. a Lichtheimia spp. (starší názov Absidia) [4–6]. V rozvinutých krajinách je toto ochorenie zriedkavé a najčastejšie postihuje pacientov s prolongovanou neutropéniou, hematologickými malignitami a po transplantáciách kostnej drene a solídnych orgánov, naproti tomu v rozvojových krajinách sa vyskytuje pomerne často u pacientov s nekontrolovaným diabetes mellitus a po traume [5,7]. V pediatrickej populácii je za rizikový faktor mukormykózy považovaná tiež prematurita a tiež vek < 12 mesiacov je nezávislým rizikovým faktorom vyššej mortality [7].
Najčastejšia klinická prezentácia je rino-orbito-cerebrálna, pľúcna, kožná a diseminovaná. U pacientov s hematologickými malignitami je najčastejšia pľúcna forma infekcie [8–10].
Úspešná liečba mukormykózy je založená na multimodálnom prístupe, ktorý zahŕňa odstránenie predisponujúcich faktorov (ak je to možné), včasný začiatok efektívnej antimykotickej terapie v optimálnej dávke, kompletnú chirurgickú resekciu postihnutého tkaniva a podpornú liečbu [11–13]. Pre celkovú prognózu pacienta je tiež nevyhnutné zároveň pokračovať v onkologickej liečbe ihneď, ako to jeho klinický stav dovoľuje.
Kazuistika
Šesťročná pacientka s anamnézou 3 týždne trvajúcich febrilít, bolestivého opuchu ľavého zápästia a chudnutia, bola po vyšetrení obvodným pediatrom odoslaná na Kliniku detskej hematológie a onkológie pre suspektnú hemoblastózu. Pri príjme bolo dieťa febrilné s prejavmi anemického syndrómu. Vstupným vyšetrením bola potvrdená anémia, trombocytopénia a mierna hepatosplenomegália. Punkciou kostnej drene sme zistili cytomorfologicky prítomnosť 65 % POX (myeloperoxidáza) negat. blastov a imunofenotypizáciou 30,1 % blastov s fenotypom common B-ALL. Cytogenetickým vyšetrením bola u pacientky zistená hyperdiploidia.
Pacientka následne začala indukčnú chemoterapiu podľa medzinárodného protokolu AIEOP-BFM ALL 2009. Pre iniciálnu prezentáciu febrilnej neutropénie bola liečená dvojkombináciou antibiotík – piperacilín/tazobaktám + amikacín, zároveň dostávala flukonazol, ako antimykotickú profylaxiu. Na deň 15 sa znova objavila febrilita pri pretrvávajúcej neutropénii, bol ordinovaný meropeném, následne sme pre pretrvávanie febrilít pridali tiež amikacín a vankomycín. Vyšetrením hemokultúry bola zistená infekcia Rothia mucilaginosa, zároveň sme diagnostikovali z hlbokého nazofaryngeálneho výteru RS vírus, do liečby bol pridaný ribavirín. Pre zvýraznenie respiračnej symptomatológie a pretrvávanie febrilít sme realizovali HRCT (high resolution computed tomography) pľúc a CT (computed tomography) prínosových dutín, kde bol nález pansinusitídy. Do liečby bol empiricky pridaný amfotericín B v dávke 5 mg/kg/deň. Vzhľadom na nejasný otorinolaryngologický (ORL) nález a rozvoj ľavostrannej orbitocelulitídy bola realizovaná funkčná endoskopická endonazálna chirurgia (functional endoscopic sinus surgery – FESS) s nálezom nekrotickej dolnej nosovej mušle a časti etmoidálnej kosti vľavo (obr. 1). Vyšetrením získaného materiálu metódou polymerázovej reťazovej reakcie (polymerase chain reaction – PCR) s následnou HRM (high resolution melting) analýzou sa vo vyšetrovanom tkanive našiel Rhizopus sp. Výsledok bol overený metódou real-time PCR špecifickou pre tento druh s potvrdením vysokej fungálnej nálože – 8 552 212 kópií/reakciu [14]. Antimykotickú liečbu amfotericínom B sme po obdržaní výsledku posilnili posakonazolom. U dieťaťa trvala neutropenia 24 dní. Pacientka následne pokračovala v chemoterapii a s 9dňovým posunom ukončila indukciu s dosiahnutím kompletnej remisie na deň 33 (obr. 2). Na začiatku protokolu IB (včasná intenzifikácia) sme realizovali kontrolné CT vyšetrenie prínosových dutín a mozgu, na ktorom bol nález nového ložiska intrakraniálne, v.s. mykotickej infekcie. Vyšetrenie magnetickou rezonanciou (magnetic resonance imaging – MRI) mozgu potvrdilo šírenie patologického procesu cez spodinu etmoidálnej kosti do frontálneho laloka vľavo per continuitatem (obr. 3). Pre vysoko suspektnú mukormykózu centrálnej nervovej sústavy (CNS) bola posilnená dávka amfotericínu B na 10 mg/kg/deň, zároveň sme pokračovali v liečbe posakonazolom. Pacientka po ukončení protokolu IB absolvovala neurochirurgický výkon a FESS s totálnou resekciou postihnutého tkaniva (obr. 4). Po stabilizácii stavu bol začatý protokol M (konsolidačná fáza liečby), v kostnej dreni pretrvávala remisia základného ochorenia, pacientka bola stratifikovaná ako intermediate risk. Počas protokolu M pacientka prekonala kaválovú pseudomonádovú sepsu s prolongovanými triaškami a nutnosťou extrakcie PAC (Port-a-cath). Bola realizovaná kontrolná FESS s odstránením časti nekrotickej nosovej prepážky. Vyšetrením materiálu bolo potvrdené pretrvávanie mukormykózy, avšak s omnoho nižšou fungálnou náložou (1 127 kópií/reakciu). Antimykotická liečba bola posilnená kaspofungínom. Pacientka ukončila protokol M s redukovanou dávkou metotrexátu vzhľadom na jej rizikovosť. T. č. pokračuje v liečbe leukémie a v antimykotickej liečbe posakonazolom. Kontrolné CT a MRI mozgu sú bez známok recidívy, ORL lekárom je stav hodnotený ako zlepšený, po prekonanej mukormykóze. U pacientky pretrváva celková remisia základného ochorenia.
Obr. 1. Mikroskopický nález hýf mukoru vo vyšetrenom tkanive z funkčnej endoskopickej endonazálnej chirurgie. A. Grocottove farbenie 40×. B. Hematoxylín-eozín 40×. C. Periodic acid schiff 40× – hýfy medzi žliazkami sliznice. D. Hematoxylín-eozín 4×. (Ústav patologickej anatómie, JLF UK a UN Martin, 2018) 
Obr. 2. Priebeh rozvoja mukormykózy u našej pacientky počas trvania neutropénie v indukcii. 
Obr. 3. Záchyt šírenia známej mykotickej infekcie z prínosových dutín do mozgu a následné šírenie infekcie počas neutropénie, na spodnom obr. – parciálna deštrukcia skeletu etmoidálnej dutiny. 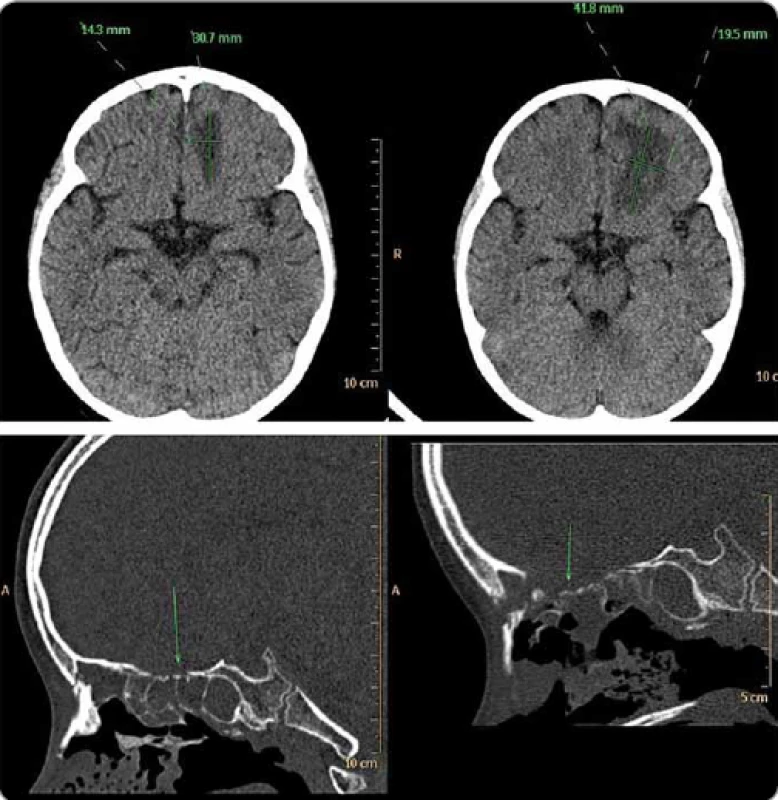
Obr. 4. Mikroskopický nález hýf mukoru vo vyšetrenom tkanive z CNS – granulomatózny, nekrotizujúci zápal CNS s mykotickými organizmami.
A. Grocottove farbenie 40×. B. Hematoxylín-eozín 40×. C. PAS 40×. D. PAS 10×. (Ústav patologickej anatómie, JLF UK a UN Martin, 2018) CNS – centrálna nervová sústava, PAS – periodic acid schiff
Diskusia
Mukormykóza je invazívna mykotická infekcia s vysokou morbiditou a mortalitou u pacientov s hematologickými malignitami, obzvlášť s akútnou leukémiou. Riziko tejto infekcie zvyšuje agresívna onkologická liečba a neutropénia v spojení s prolongovaným používaním širokospektrálnych antibiotík, imunosupresívnou liečbou a širším využívaním antimykotickej profylaxie účinnej proti iným mykotickým infekciám [15,16].
Etiológia aj incidencia ochorenia sa líšia podľa krajiny výskytu i podľa základnej diagnózy. K najčastejším vyvolávateľom mukormykózy v Európe patrí Rhizopus spp., Mucor spp. a Lichtheimia spp. (starší názov Absidia), zatiaľ čo napr. v Indii je to Rhizopus spp., Apophysomyces elegans, Apophysomyces variabilis a Rhizopus homothallicus [4–6].
U našej pacientky bol použitím PCR a mikrobiologických metód diagnostikovaný Rhizopus spp.
Prevalencia v Európe a v USA varíruje podľa rôznych zdrojov od 0,01 do 0,2/100 000 obyvateľov [4,17,18], v rozvojových krajinách je omnoho vyššia, napr. v Indii je to až 14 prípadov/ 100 000 obyvateľov [5].
Mukormykóza vykazuje i určitú sezónnosť, najviac nových prípadov sa vyskytuje v období august–november. Najčastejšia cesta prenosu je inhalácia spór zo vzduchu alebo ich priama inokulácia do poškodenej kože či sliznice gastrointestinálneho traktu [19].
Najčastejšou lokalitou, kde sa mukormykóza vyskytuje, sú pľúca, mozog, paranazálne sínusy, menej typicky je postihnutá koža a gastrointestinálny trakt. Bez ohľadu na primárny výskyt môže ochorenie vždy progredovať až do diseminovanej formy [20].
Pacientka z popisovanej kazuistiky mala postihnutie paranazálnych sínusov a došlo u nej k rozšíreniu infekcie do mozgu.
Vzhľadom na rýchlu kinetiku ochorenia (invazivita, rýchla diseminácia) je pre úspešné zvládnutie infekcie kľúčová včasná diagnostika, čo býva problematické hlavne pre problémy s extrahovaním patogénov z postihnutých tkanív [21].
Klinické známky infekcie sú veľmi nešpecifické. Podozrenie na diagnózu zvyšuje znalosť rizikových faktorov pacienta a rýchly nástup klinickej manifestácie. U neutropenického pacienta môže byť prvým symptómom pľúcnej mukormykózy pleurálna bolesť, ktorej objavenie sa by ihneď malo viesť k realizácii zobrazovacích vyšetrení a následnému odberu vzorky na vyšetrenie [3]. Na zobrazovacích vyšetreniach zvyšuje podozrenie nález viacpočetných nodulov pľúcneho parenchýmu (≥ 10), pleurálnej efúzie a nález haló na obvode nodulov na CT [22].
Priama mikroskopia, histopatológia a kultivácia sú základnými vyšetrovacími metódami pri suspekcii z mukormykózy [3]. Mikroskopicky vykazujú hýfy mukoru variabilnú šírku (6–25 µm), sú neseparované alebo len nepatrne separované a majú nepravidelný, pruhovitý vzhľad [23]. Histopatologicky dominuje v postihnutom tkanive zápal s prevahou neutrofilov, u imunokompromitovaných pacientov však nemusí byť prítomný. Naopak u neutropenických pacientov býva prítomná výrazná angioinvázia [24].
K imunohistochemickému vyšetreniu bola vyvinutá myšacia monoklonálna protilátka – anti-Rhizomucor, ktorá však pre skríženú reakciu nepreukázala dostatočnú špecificitu [25].
Pri rutinných procedúrach spracúvania získaného tkaniva môže dôjsť k poškodeniu hýf mukoru, a teda negatívne kultivačné vyšetrenie diagnózu mukormykózy nevylučuje. Nové molekulárnodiagnostické metódy, ako in situ hybridizácia a PCR, ponúkajú alternatívu, ktorá vedie k presnejšej a skoršej diagnóze, a tým k promptnejšiemu nástupu účinnej terapie [3].
U pacientky z našej kazuistiky bolo vyslovené podozrenie na túto diagnózu na základe klinického obrazu počas indukčnej liečby leukémie, prolongovanej neutropénie, výsledku CT vyšetrenia a ORL nálezu. Dieťa malo potvrdenú infekciu Rhizopus sp. histopatologickým vyšetrením materiálu získaného pri FESS a kraniektómii pomocou PCR.
Terapia ochorenia vyžaduje multimodálny prístup. Nevyhnutný je najmä včasný začiatok efektívnej antimykotickej liečby v dostatočných dávkach, ktorú by vždy mala nasledovať resekcia postihnutého tkaniva. Chamilos et al dokázali, že oddialenie antimykotickej liečby amfotericínom B u pacientov s hematologickými malignitami o > 5 dní viedlo k takmer dvojnásobne vyššej mortalite v priebehu 12 týždňov (82,9 vs. 48,6 %) [26].
Huby z rodu Mucorales sú rezistentné na väčšinu bežných antimykotík, vrátane vorikonazolu. Podľa posledných doporučení ECIL-6 z roku 2016, ako aj podľa doporučení ESCMID/ECMM, zostáva prvolíniovou liečbou voľby lipozomálny amfotericín B [11,12]. Odporúčaná dávka amfotericínu B je 5 mg/kg/deň, pri infekcii CNS je to až 10 mg/kg/deň. Vzhľadom na stále vysokú mortalitu sa v rámci štúdii tiež skúša použitie amfotericínu B v dávke 10 mg/kg/deň v úvode liečby u všetkých pacientov [27].
Odporúčania ohľadom použitia posakonazolu v liečbe mukoru sa rôznia. Zatiaľ čo podľa ECIL-6 je vhodný ako druholíniová a udržiavacia liečba, podľa ESCMID/ECMM je v dávke 4 × 200 mg vhodný aj ako prvolíniová terapia [3].
Kombinovaná antimykotická liečba sa neodporúča v 1. línii, avšak existujú dáta, kde kombinácia amfotericínu B s kaspofungínom alebo posakonazolom u pacientov s rino-orbito-cerebrálnou formou mukoru preukázala benefit v prežívaní oproti skupine pacientov s monoterapiou amfotericínom B [28,29].
Chirurgická resekcia by mala nasledovať po úvodnej antimykotickej liečbe všade tam, kde je to možné. Odstránené by malo byť nielen samotné nekrotické ložisko, ale tiež čo najväčšia časť okolitého, zdravo vyzerajúceho tkaniva, pre vysokú rýchlosť šírenia hýf mukoru [3].
Niektoré predklinické a in vitro dáta ukazujú, že faktor stimulujúci kolónie granulocytov a makrofágov a interferón-γ by mohli zvýšiť imunitnú odpoveď proti mukormykóze [30,31]. Novým testovaným liekom je VT-1161, inhibítor so selektívnou aktivitou proti fungálnemu CYP51, ktorý in vitro preukázal zlepšenie prežívania neutropenických myší s infekciou Rhizopus oryzae. K jeho schváleniu sú potrebné ďalšie štúdie [32].
U našej pacientky bola empiricky ordinovaná antimykotická liečba amfotericínom B, ktorého dávka bola po potvrdení postihnutia CNS zvýšená na 10 mg/kg/deň. Liečba bola vzhľadom na rizikovosť posilnená pridaním posakonazolu a kaspofungínu. Nasledovala kraniektómia a resekcia ložiska vo frontálnom laloku.
Pre úspešný výsledok terapie je nevyhnutné zároveň s antimykotickou liečbou aj pokračovanie v onkologickej terapii, a to obzvlášť pred dosiahnutím kompletnej remisie. Naša pacientka s nevyhnutnými prestávkami pokračuje v liečbe leukémie podľa protokolu AIEOP-BFM ALL 2009, pretrváva u nej celková remisia leukémie a je v dobrom klinickom stave.
Záver
Záverom je potrebné zdôrazniť, že k zvládnutiu mukormykózy u pacientov s hematologickými malignitami je nevyhnutná skorá diagnostika a včasný začiatok efektívnej terapie, ktorou je kombinácia amfotericínu B v dostatočnej dávke a chirurgického odstránenia postihnutého ložiska. Práve preto je potrebné na túto diagnózu myslieť a včas začať potrebné diagnostické a liečebné postupy. Pre pacienta je zároveň nevyhnutné konkomitantné podávanie antimykotickej a onkologickej liečby ihneď, ako to jeho celkový stav dovoľuje.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Eva Bačová
Klinika detskej hematológie a onkológie
Národný ústav detských chorôb a LF UK
Limbová 1
833 40 Bratislava, Slovenská republika
e-mail: bacova.e@gmail.com,
eva.bacova@nudch.eu
Obdržané: 5. 2. 2019
Prijaté: 9. 2. 2020
Zdroje
1. Hibbett DS, Binder M, Bischoff JF et al. A higher level phylogenetic classification of the Fungi Mycol Res 2007; 111 (5): 509–547. doi: 10.1016/j.mycres.2007.03.004.
2. Roden MM, Zaoutis TE, Buchanan WL et al. Epidemiology and outcome of zygomycosis: a review of 929 reported cases. Clin Infect Dis 2005; 41 (5): 634–653. doi: 10.1086/432579.
3. Skiada A, Lass-Floerl C, Klimko N et al. Challenges in the diagnosis and treatment of mucormycosis. Med Mycol 2018; 56 (Suppl1): S93–S101. doi: 10.1093/mmy/myx101.
4. Petrikkos G, Skiada A, Lortholary O et al. Epidemiology and clinical manifestations of mucormycosis. Clin Infect Dis 2012; 54 (Suppl 1): S23–S34. doi: 10.1093/cid/cir866.
5. Chakrabarti A, Singh R. Mucormycosis in India: uniquefeatures. Mycoses 2014; 57 (Suppl 3): 85–90. doi: 10.1111/myc.12243.
6. Chander J, Stchigel AM, Alastruey-Izquierdo A et al. Fungal necrotizing fasciitis, an emerging infectious disease caused by Apophysomyces (Mucorales). Rev Iberoam Micol 2015; 32 (2): 93–98. doi: 10.1016/j.riam.2014.06.005.
7. Pana ZD, Seidel D, Skiada A et al. Invasive mucormycosis in children: an epidemiologic study in European and non-European countries based on two registries. BMC Infectious Diseases 2016; 16 (1): 667. doi: 10.1186/s12879-016-2005-1.
8. Skiada A, Pagano L, Groll A et al. Zygomycosis in Europe: analysis of 230 cases accrued by the registry of the European Confederation of Medical Mycology (ECMM) Working Group on Zygomycosis between 2005 and 2007. Clin Microbiol Infect 2011; 17 (12): 1859–1867. doi: 10.1111/j.1469-0691.2010.03456.x.
9. Jeong W, Keighley C, Chen S et al. The epidemiology, management and outcomes of invasive mucormycosis in the 21st century: a systematic review. [online]. Available from: https: //www.escmid.org/escmid_publications/escmid_elibrary/material/?mid=51958.
10. Klimko N, Khostelidi S, Volkova A et al. Mucormycosis in haematological patients: case report and results of prospective study in Saint Petersburg, Russia. Mycoses 2014; 57 (Suppl 3): 91–96. doi: 10.1111/myc.12247.
11. Tissot F, Agrawal S, Pagano L et al. ECIL-6 guidelines for the treatment of invasive candidiasis, aspergillosis and mucormycosis in leukemia and hematopoietic stem cell transplant patients. Haematologica 2017; 102 (3): 433–444. doi: 10.3324/haematol.2016.152900.
12. Cornely OA, Arikan-Akdagli S, Dannaoui E et al. ESCMID and ECMM joint clinical guidelines for the diagnosis and management of mucormycosis. Clin Microbiol Infect 2014; 20 (Suppl 3): 5–26. doi: 10.1111/1469-0691.12371.
13. Katragkou A, Walsh TJ, Roilides E. Why is mucormycosis more difficult to cure than more common mycoses? Clin Microbiol Infect 2014 (Suppl 6); 20 : 74–81. doi: 10.1111/1469-0691.12466.
14. Lengerova M, Racil Z, Hrncirova K et al. Rapid detection and identification of mucormycetes in bronchoalveolar lavage samples from immunocompromised patients with pulmonary infiltrates by use of high-resolution melt analysis. J Clin Microbiol 2014; 52 (8): 2824–2828. doi: 10.1128/JCM.00637-14.
15. Funada H, Matsuda T. Pulmonary mucormycosis in a hematology ward. Intern Med 1996; 35 (7): 540–544. doi: 10.2169/internalmedicine.35.540.
16. Imhof A, Balajee SA, Fredericks DN et al. Breakthrough fungal infections in stem cell transplant recipiens receiving voriconazole. Clin Infect Dis 2004; 39 (5): 743–746. doi: 10.1086/423274.
17. Bitar D, Van Cauteren D, Lanternier F et al. Increasing incidence of zygomycosis (mucormycosis), France, 1997–2006. Emerg Infect Dis 2009; 15 (9): 1395–1401. doi: 10.3201/eid1509.090334.
18. Rees JR, Pinner RW, Hajjeh RA et al. The epidemiological features of invasive mycotic infections in the San Francisco Bay area, 1992–1993: results of population-based laboratory active surveillance. Clin Infect Dis 1998; 27 (5): 1138–1147.
19. Farmakiotis D, Kontoyiannis DP. Mucormycosis. Infect Dis Clinf North Am 2016; 30 (1): 143–163. doi: 10.1016/j.idc.2015.10.011.
20. Walsh TJ, Gamaletsou MN. Treatment of fungal disease in the settings of neutropenia. Hematology Am Soc Hematol Educ Program 2013; 2013 : 423–427. doi: 10.1182/asheducation-2013.1.423.
21. Pagano L, Offidani M, Fianchi L et al. Mucormycosis in hematologic patients. Haematologica 2004; 89 (2): 207–214.
22. Legouge C, Caillot D, Chrétien ML et al. The reversed halo sign: pathognomonic pattern of pulmonary mucormycosis in leukemic patients with neutropenia? Clin Infect Dis 2014; 58 (5): 672–678. doi: 10.1093/cid/ cit929.
23. Lass-Flörl C. Zygomycosis: conventional laboratory diagnosis. Clin Microbiol Infect 2009; 5 (Suppl 5): 60–65. doi: 10.1111/j.1469-0691.2009.02999.x.
24. Spellberg B, Edwards J Jr, Ibrahim A. Novel perspectives on mucormycosis: pathophysiology, presentation and management. Clin Microbiol Rev 2005; 18 (3): 556–569. doi: 10.1128/CMR.18.3.556-569.2005.
25. Lackner M, Caramalho R, Lass-Flörl C. Laboratory diagnosis of mucormycosis: current status and future perspectives. Future Microbiol 2014; 9 (5): 683–695. doi: 10.2217/fmb.14.23.
26. Chamilos G, Lewis RE, Kontoyiannis DP. Delaying amphotericin B-based frontline therapy significantly increases mortality among patients with hematologic malignancy who have zygomycosis. Clin Infect Dis 2008; 47 (4): 503–509. doi: 10.1086/590004.
27. Lanternier F, Poiree S, Elie C et al. Prospective pilot study of high-dose (10 mg/kg/day) liposomal amphotericin B (L-Amb) for the initial treatment of mucormycosis. J Antimicrob Chemother 2015; 70 (11): 3116–3123. doi: 10.1093/jac/dkv236.
28. Kyvernitakis A, Torres HA, Chamilos G et al. Initial use of combination treatment does not impact survival of 106 patients with hematologic malignancies and mucormycosis: a propensity score analysis. Clin Microbiol Infect 2016; 22 (9): e1–e8. doi: 10.1016/j.cmi.2016.03.029.
29. Reed C, Bryant R, Ibrahim AS et al. Combination polyene-caspofungin treatment of rhino-orbital-cerebral mucormycosis. Clin Infect Dis 2008; 47 (3): 364–371. doi: 10.1086/589857.
30. Gil-Lamaignere C, Simitsopoulou M, Roilides E et al. Interferon-gamma and granulocyte-macrophage colony-stimulating factor augment the activity of polymorphonuclear leukocytes against medically important zygomycetes. J Infect Dis 2005; 191 (7): 1180–1187. doi: 10.1086/42 8503.
31. Roilides E, Antachopoulos C, Simitsopoulou M. Pathogenesis and host defence against Mucorales: the role of cytokines and interaction with antifungal drugs. Mycoses 2014; 57 (Suppl 3): 40–47. doi: 10.1111/myc.12236.
32. Gebremariam T, Alkhazraji S, Lin Lin et al. Prophylactic treatment with VT-1161 protects immunosuppressed mice from Rhizopus arrhizus var. arrhizus infection. Antimicrob Agents Chemother 2017; 61 (9): e00390 – e0039017. doi: 10.1128/AAC.00390-17.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Karcinom děložního hrdlaČlánek Aktuality z odborného tisku
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2020 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Karcinom děložního hrdla
- Association of NAD (P) H Quinine Oxidoreductase 1 rs1800566 Polymorphism with Bladder and Prostate Cancers – a Systematic Review and Meta-Analysis
- Pohybová liečba ako prevencia a podporná liečba onkologických ochorení
- Metformin in Oncology – How Far Is Its Repurposing as an Anticancer Drug?
- Využití extrakraniální stereotaktické radioterapie při oligometastatickém postižení lymfatických uzlin
- Léčba karcinomu hrdla děložního s postižením paraaortálních uzlin – retrospektivní hodnocení vlastního souboru
- HPV 16 v patogenéze nádorov horného aerodigestívneho traktu
- Invazívna rino-orbito-cerebrálna forma mukormykózy u detskej pacientky s akútnou leukémiou
- Využití indocyaninové zeleně k peroperační diagnostice zdroje chylózního ascitu a autologního tkáňového lepidla (Vivostatu) k jeho ošetření
- Protirakovinný účinek melatoninu s radioprotektivní a radiosenzitivní vlastností
- Aktuality z odborného tisku
- Vzpomínka na prof. RNDr. M. Lokajíčka, DrSc.
- Účinek kapecitabinu v léčbě triple negativního karcinomu prsu
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Karcinom děložního hrdla
- Pohybová liečba ako prevencia a podporná liečba onkologických ochorení
- HPV 16 v patogenéze nádorov horného aerodigestívneho traktu
- Metformin in Oncology – How Far Is Its Repurposing as an Anticancer Drug?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



