-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Koherencí řízená holografická mikroskopie – nástroj pro hledání nových biomarkerů dlaždicobuněčného karcinomu hlavy a krku
Coherence controlled holographic microscopy – a tool for detection of new biomarkers of head and neck squamous cell carcinoma
Background: Squamous cell carcinoma of the head and neck is characterized by local invasiveness and metastases to regional lymph nodes. In 60% of cases, these tumours are diagnosed at an advanced stage, and the prognosis is unfavorable. One of the important factors of local, hematogenous or lymphogenic spread of the tumour in the human body is tumour cells‘ migration ability. Advanced microscopic methods provide a new perspective on cell migration. Purpose: This paper presents a coherence controlled holographic microscopy method that provides a non-invasive quantitative evaluation of morphological and dynamic properties of living tumour cells. In connection with this method, new potential biomarkers are emerging, the significance of which, however, needs to be verified by correlation with clinical data.
Keywords:
squamous cell carcinoma – Cell migration – tumor markers – epithelial-mesenchymal transition – head and neck carcinoma, coherence-controlled holographic microscopy
Autori: M. Veselý 1; B. Gál 1
; J. Rottenberg 1; M. Palenik 1; J. Hanák 1; D. Zicha 2,3
Pôsobisko autorov: Klinika otorinolaryngologie a chirurgie hlavy a krku LF MU a FN u sv. Anny v Brně 1; CEITEC – Central European Institute of Technology, Brno 2; Ústav fyzikálního inženýrství, Fakulta strojního inženýrství, VUT v Brně 3
Vyšlo v časopise: Klin Onkol 2022; 35(2): 128-131
Kategória: Přehled
doi: https://doi.org/10.48095/ccko2022128Súhrn
Východiska: Dlaždicobuněčný karcinom hlavy a krku se vyznačuje lokální invazivitou a tvorbou metastáz do regionálních lymfatických uzlin. V 60 % případů jsou tyto nádory diagnostikovány v pokročilém stadiu a prognóza je nepříznivá. Jedním z důležitých faktorů lokálního, hematogenního či lymfogenního šíření nádoru v lidském těle je migrační schopnost nádorových buněk. Pokročilé mikroskopické metody umožňují nový pohled na buněčnou migraci. Cíl: V tomto článku je prezentována metoda koherencí řízené holografické mikroskopie, která umožňuje neinvazivní kvantitativní hodnocení morfologických a dynamických vlastností živých nádorových buněk. V souvislosti s touto metodou se objevují nové potenciální biomarkery, jejichž význam je však třeba ověřit korelací s klinickými daty.
Klíčová slova:
dlaždicobuněčný karcinom – nádorové biomarkery – epiteliálně-mezenchymální tranzice – karcinom hlavy a krku – koherencí řízená holografická mikroskopie – buněčná migrace
Úvod
Dlaždicobuněčný karcinom hlavy a krku
Dlaždicobuněčný karcinom hlavy a krku (head and neck squamous cell carcinoma – HNSCC) je v 60 % diagnostikován v pokročilém stadiu (III a IV) [1]. Pětileté přežití se u pokročilých nádorů pohybuje mezi 4–32 % [2]. Nepříznivá prognóza souvisí s agresivní povahou tohoto typu nádorů. HNSCC se vyznačuje lokální invazivitou a tvorbou metastáz (typicky do regionálních lymfatických uzlin) [3,4].
Migrační aktivita nádorových buněk ve vztahu k invazivitě a metastazování
Jedním z důležitých faktorů lokálního, hematogenního či lymfogenního šíření nádoru v lidském těle je migrační schopnost nádorových buněk [5,6]. Migrace buněk je nezbytná pro rozmanité fyziologické procesy, jako je růst a vývoj tkání, hojení nebo zajištění imunity. Jedná se ale také o typický znak malignity [7]. U epiteliálních nádorů, jako je HNSCC, je klíčovým procesem malignizace epiteliálně-mezenchymální přechod (epithelial-mesenchymal transition – EMT) [8]. Tento komplexní a složitý proces je zodpovědný za zvýšení migračního potenciálu buňky, což vede k invazivitě a metastazování [9]. Pro EMT je charakteristická ztráta epiteliálních adhezivních proteinů (např. E-kadherin, a - a b - katenin) a zvýšení exprese mezenchymálních markerů (např. N-kadherin a vimentin), uplatňuje se však celá řada dalších biomarkerů (např. transkripční faktory SNAIL 1, SNAIL 2 apod.) [10,11]. Projevem EMT jsou typické změny v morfologii buněk a architektuře tkáně, které lze pozorovat při histopatologickém vyšetření a rovněž na buňkách z biopsie nádoru. Jedná se o základní znak maligního charakteru epiteliálních lézí. U polarizovaných epiteliálních buněk dochází ke ztrátě kontaktu s bazální membránou i s okolními buňkami, buňka získává mezenchymální morfologii (u HNSCC vřetenovitý tvar) a je připravena migrovat pryč z epiteliální vrstvy, ve které vznikla [9]. Pro studium buněčné migrace jsou užívány in vitro a in vivo testy, které nejčastěji využívají buněčné linie. Zpravidla jsou kombinovány metody genomiky a proteomiky se zobrazovacími metodami [12].
Koherencí řízená holografická mikroskopie
Pokročilé mikroskopické technologie nabízejí stále lepší možnosti zobrazení nádorových buněk [13,14]. Koherencí řízený digitální holografický mikroskop (coherence-controlled holographic microscope – CCHM) umožňuje neinvazivní zobrazení živých nádorových buněk in vitro bez nutnosti fixace či barvení. Metodou holografického nekoherentního fázového zobrazení CCHM umožňuje zobrazení vzorků s vertikálním rozlišením fázového zpoždění 1 nm, což umožňuje detekci změn hmotnosti odpovídající 8 femtogramům [15,16]. Díky tomu, že CCHM nevyužívá laser (jak je tomu u jiných typů holografických mikroskopů), ale běžné světlo, je eliminován nežádoucí vliv laserového záření na pozorovaný objekt.
Hodnocení dynamických buněčných procesů pomocí CCHM
Pomocí holografické mikroskopie je možné měřit v in vitro podmínkách rozložení suché hmoty buňky a její změny v čase (obr. 1) [17]. Suchá hmota buňky je tvořena jejím obsahem bez vody. Jedná se především o proteiny, nukleové kyseliny a karbohydráty [18]. Během života buňky se suchá hmota rapidně mění. Tyto změny odpovídají metabolickým i strukturálním procesům v buňce [19]. CCHM tedy neposkytuje pouze informace o morfologii buňky (velikost, tvar), ale díky měření změn suché hmoty je možné monitorovat např. průběh buněčného cyklu (obr. 2) [20]. Podobně je možné monitorovat i procesy týkající se buněčné smrti. Byly popsány změny suché hmoty v procesu buněčné smrti nádorové buňky umístěné do cytotoxického prostředí [21]. Dále byla CCHM aplikována např. pro rozlišení apoptózy a onkózy [22].
Obr. 1. Trojrozměrná rekonstrukce rozložení suché hmoty v buňce dlaždicobuněčného karcinomu. 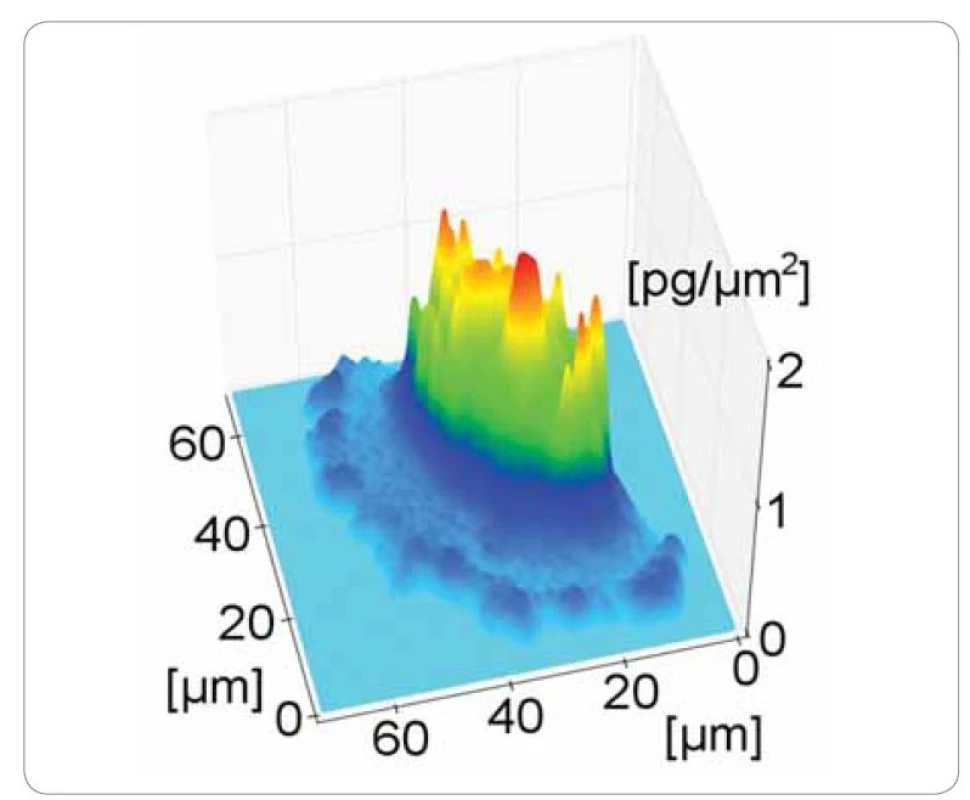
Obr. 2. Buňka dlaždicobuněčného karcinomu zobrazená pomocí koherencí řízené holografické mikroskopie. Po proběhlé mitóze byla pozorována dceřiná buňka. A) Nárůst hmoty buňky v čase během buněčného cyklu. Červená šipka odpovídá času a situaci zobrazené na obr. B. 
CCHM umožňuje zobrazovat detaily aktivity buněk v kalných médiích (např. kolagenázový gel), kde jsou jiné optické metody omezeně použitelné [21,23]. Díky tomu je možné vytvořit tzv. 3D in vitro modely, tedy prostředí imitující situaci in vivo, kde se pozorovaná buňka může pohybovat ve třech dimenzích, nikoliv pouze po povrchu nosiče [24].
Na takovém modelu byly např. identifikovány a podrobně popsány dva morfotypy ameboidního invazivního fenotypu (blebby-amoeboid a pseudopodal-amoeboid) [25].
Metoda CCHM byla použita pro hodnocení dynamických vlastností buněk primárních kultur dlaždicobuněčného karcinomu hlavy a krku vykultivovaných z bioptických vzorků (obr. 2). U jednotlivých buněk i u celých buněčných skupin byly popsány migrační procesy typické pro epiteliální nádory. Byly pozorovány morfologické změny připomínající iniciaci EMT. Kvantitativního hodnocení změn suché hmoty i měření rychlosti pohybu a délky trajektorie buněk HNSCC bylo využito k hodnocení mitotické a migrační aktivity [26].
Digitální holografická mikroskopie jako nástroj pro hledání nových biomarkerů dlaždicobuněčného karcinomu hlavy a krku
Současným trendem v onkologii je přizpůsobení léčebného protokolu pacientovi na míru. Základními léčebnými modalitami HNSCC jsou radioterapie, chemoterapie, biologická léčba a chirurgie [27]. V procesu volby optimální léčebné strategie hrají v onkologii důležitou roli prediktivní biomarkery [28]. Ačkoliv existuje velké množství molekulárních biomarkerů pro HNSCC, nejsou doposud v klinické praxi etablovány (s výjimkou proteinu p16 u orofaryngeálního karcinomu) [29–32]. Někteří autoři zmiňují potřebu hledání alternativ k molekulárním biomarkerům, u nichž jsou využívány především metody genomiky a proteomiky, a poukazují na využití pokročilých mikroskopických technologií [33,34]. Příkladem je právě CCHM. V souvislosti s holografickou mikroskopií se dokonce objevuje pojem optické biomarkery [35,36]. Tento článek poukazuje především na možnosti využití CCHM ke studiu dynamických buněčných procesů, resp. migrační aktivity ve smyslu migrace a proliferace. Migrační aktivita nádorových buněk je klíčová pro klinický průběh onemocnění a pro prognózu pacienta [12]. Porozumění mechanizmům migrace nádorových buněk a jejich ovlivnění je jedním ze stále aktuálních cílů onkologického výzkumu [37–39].
Diskuze
I přes slibné výsledky některých studií má hodnocení migrační aktivity nádorových buněk pomocí CCHM v současnosti spíše experimentální význam [26,40,41]. Roli konkrétních parametrů migrace, jako je třeba měření délky trajektorie, rychlost pohybu či změny objemu suché hmoty [17,26], je třeba ověřit a především korelovat s biologickým chováním nádoru, tedy s průběhem onemocnění a odpovědí na léčbu. Zatím není k dispozici dostatek publikací, které by se touto problematikou zabývaly.
Buňky jsou pozorovány v in vitro prostředí, což samo o sobě může mít vliv na jejich chování [42,43]. Toto může být do jisté míry eliminováno použitím 3D médií, která umožňují pohyb buněk ve třech dimenzích [24,44]. Dále je možné pracovat s buněčnými primárními kulturami, kde nejsou selektovány pouze samotné nádorové buňky, tak jak je tomu u běžných buněčných linií HNSCC [45]. Primární kultury obsahují mimo samotné nádorové buňky i např. s tumorem asociované fibroblasty [46]. Kultivace buněk z biopsie HNSCC je již etablovanou metodou, ale i zde je nutné čelit dílčím problémům. Zásadní je správný odběr vzorku, jeho rychlé zpracování a volba optimálního média. Metoda primárních kultur také částečně eliminuje fakt, že opakovaným pasážováním buněčných linií dochází k selekci a změně vlastností buněk [47].
Závěr
Hodnocení dynamických buněčných procesů pomocí CCHM nabízí specifický pohled na buněčnou migraci a mohl by vést k lepšímu porozumění této problematice a ke stanovení nových biomarkerů. Jedná se však o experimentální metodu a pro její další použití je nutná korelace s klinickými daty.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.MUDr. Miroslav Veselý
Klinika otorinolaryngologie
a chirurgie hlavy a krku
FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: miroslav.vesely@fnusa.cz
Obdrženo/Submitted: 27. 4. 2021
Přijato/Accepted: 8. 7. 2021
Zdroje
1. Gatta G, Botta L, Sánchez MJ et al. Prognoses and improvement for head and neck cancers diagnosed in Europe in early 2000s: the EUROCARE-5 population-based study. Eur J Cancer 2015; 51 (15): 2130–2143. doi: 10.1016/j.ejca.2015.07.043.
2. Linkos. O nádorech hlavy a krku. [online]. Dostupné z: https: //www.linkos.cz/pacient-a-rodina/onkologicke-diagnozy/nadory-hlavy-a-krku-c00-14-c30-32/o-nadorech-hlavy-a-krku/.
3. Nibu KI, Ebihara Y, Ebihara M et al. Quality of life after neck dissection: a multicenter longitudinal study by the Japanese Clinical Study Group on Standardization of Treatment for Lymph Node Metastasis of Head and Neck Cancer. Int J Clin Oncol 2010; 15 (1): 33–38. doi: 10.1007/s10147-009-0020-6.
4. Leemans CR, Tiwari R, Nauta JJ et al. Recurrence at the primary site in head and neck cancer and the signifi - cance of neck lymph node metastases as a prognostic factor. Cancer 1994; 73 (1): 187–190. doi: 10.1002/1097 - 0142 (19940101) 73 : 1<187:: aid-cncr2820730132>3.0. co; 2-j.
5. Valastyan S, Weinberg RA. Tumor metastasis: molecular insights and evolving paradigms. Cell 2011; 147 (2): 275–292. doi: 10.1016/j.cell.2011.09.024.
6. Patel LR, Camacho DF, Shiozawa Y et al. Mechanisms of cancer cell metastasis to the bone: a multistep process. Future Oncol 2011; 7 (11): 1285–1297. doi: 10.2217/fon.11.112.
7. Yamada KM, Sixt M. Mechanisms of 3D cell migration. Nat Rev Mol Cell Biol 2019; 20 (12): 738–752. doi: 10.1038/s41580-019-0172-9.
8. Tarin D, Thompson EW, Newgreen DF. The fallacy of epithelial mesenchymal transition in neoplasia. Cancer Res 2005; 65 (14): 5996–6001. doi: 10.1158/0008-5472.CAN-05-0699.
9. Kalluri R, Weinberg RA. The basics of epithelial-mesenchymal transition. J Clin Invest 2009; 119 (6): 1420–1428. doi: 10.1172/JCI39104.
10. Loh CY, Chai JY, Tang TF et al. The E-cadherin and N-cadherin switch in epithelial-to-mesenchymal transition: signaling, therapeutic implications, and challenges. Cells 2019; 8 (10): 1118. doi: 10.3390/cells8101118.
11. Scanlon CS, Van Tubergen EA, Inglehart RC et al. Biomarkers of epithelial-mesenchymal transition in squamous cell carcinoma. J Dent Res 2013; 92 (2): 114–121. doi: 10.1177/0022034512467352.
12. Kovaříková P, Michalova E, Knopfová L et al. Methods for studying tumor cell migration and invasiveness. Klin Onkol 2014; 27 (Suppl 1): S22–S27. doi: 10.14735/amko20141s22.
13. Le Dévédec SE, Yan K, De Bont H et al. Systems microscopy approaches to understand cancer cell migration and metastasis. Cell Mol Life Sci 2010; 67 (19): 3219–3240. doi: 10.1007/s00018-010-0419-2.
14. Deng X, Xiong F, Li X et al. Application of atomic force microscopy in cancer research. J Nanobiotechnology 2018; 16 (1): 102. doi: 10.1186/s12951-018-0428-0.
15. Slabý T, Kolman P, Dostál Z et al. Off-axis setup taking full advantage of incoherent ilumination in coherence-controlled holographic microscope. Opt Express 2013; 21 (12): 14747–14762. doi: 10.1364/OE.21.01 4747.
16. Shashni B, Ariyasu S, Takeda R et al. Size-based differentiation of cancer and normal cells by a particle size analyzer assisted by a cell-recognition PC software. Biol Pharm Bull 2018; 41 (4): 487–503. doi: 10.1248/bpb.b17-00776.
17. Kolman P, Chmelík R. Coherence-controlled holographic microscope. Opt Express 2010; 18 (21): 21990–22003. doi: 10.1364/OE.18.021990.
18. Kovářová K. Měření rozložení ekvivalentu suché hmoty buňky kvantitativním fázovým kontrastem koherencí řízeného holografického mikroskopu. Brno: VUT 2013.
19. Aknoun S, Savatier J, Bon P et al. Living cell dry mass measurement using quantitative phase imaging with quadriwave lateral shearing interferometry: an accuracy and sensitivity discussion. J Biomed Opt 2015; 20 (12): 126009. doi: 10.1117/1.JBO.20.12.126009.
20. Miniotis MF, Mukwaya A, Wingren AG. Digital holographic microscopy for non-invasive monitoring of cell cycle arrest in L929 cells. PLoS One 2014; 9 (9): 1–6. doi: 10.1371/journal.pone.0106546.
21. Collakova J, Krizova A, Kollarova et al. Coherence-controlled holographic microscopy enabled recognition of necrosis as the mechanism of cancer cells death after exposure to cytopathic turbid emulsion. J Biomed Opt 2015; 20 (11): 111213. doi: 10.1117/1.JBO.20.11.111 213.
22. Balvan J, Krizova A, Gumulec J et al. Multimodal holographic microscopy: distinction between apoptosis and oncosis. PLoS One 2015; 10 (3): e0121674. doi: 10.1371/journal.pone.0121674.
23. Kollarova V, Collakova J, Dostal Z et al. Quantitative phase imaging through scattering media by means of coherence-controlled holographic microscope. J Biomed Opt 2015; 20 (11): 111206. doi: 10.1117/1.JBO.20.11.111206.
24. Dorazilová J, Štrbková L, Ďuriš M et al. Biopolymeric scaffold for cell visualisation in 3D environment using coherence-controlled holographic microscopy. Eng Biomat 2019; 22 (153): 43.
25. Tolde O, Gandalovičová A, Křížová A et al. Quantitative phase imaging unravels new insight into dynamics of mesenchymal and amoeboid cancer cell invasion. Sci Rep 2018; 8 (1): 12020. doi: 10.1038/s41598-018-30 408-7.
26. Gál B, Veselý M, Čolláková J et al. Distinctive behaviour of live biopsy-derived carcinoma cells unveiled using coherence-controlled holographic microscopy. PLoS One 2017; 12 (8): e0183399. doi: 10.1371/journal.pone.0183399.
27. Guidi A, Codecà C, Ferrari D. Chemotherapy and immunotherapy for recurrent and metastatic head and neck cancer: a systematic review. Med Oncol 2018; 35 (3): 37. doi: 10.1007/s12032-018-1096-5.
28. Budach V, Tinhofer I. Novel prognostic clinical factors and biomarkers for outcome prediction in head and neck cancer: a systematic review. Lancet Oncol 2019; 20 (6): e313–e326. doi: 10.1016/S1470-2045 (19) 30177-9.
29. Solomon B, Young RJ, Rischin D. Head and neck squamous cell carcinoma: genomics and emerging biomarkers for immunomodulatory cancer treatments. Semin Cancer Biol 2018; 52 (2): 228–240. doi: 10.1016/j.semcancer.2018.01.008.
30. Curtarelli RB, Gonçalves JM, Dos Santos LGP et al. Expression of cancer stem cell biomarkers in human head and neck carcinomas: a systematic review. Stem Cell Rev Rep 2018; 14 (6): 769–784. doi: 10.1007/s12015-018-98 39-4.
31. Pfister DG, Spencer S, Adelstein D et al. Head and neck cancers, version 2.2020, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw 2020; 18 (7): 873–898. doi: 10.6004/jnccn.2020.0031.
32. Economopoulou P, de Bree R, Kotsantis I et al. Diagnostic tumor markers in head and neck squamous cell carcinoma (HNSCC) in the clinical setting. Front Oncol 2019; 9 : 827. doi: 10.3389/fonc.2019.00827.
33. Friedman AA, Letai A, Fisher DE et al. Precision medicine for cancer with next-generation functional diag - nostics. Nat Rev Cancer 2015; 15 (12): 747–756. doi: 10.1038/nrc4015.
34. Gerashchenko TS, Novikov NM, Krakhmal NV et al. Markers of cancer cell invasion: are they good enough? J Clin Med 2019 : 8 (8): 1092. doi: 10.3390/jcm8081 092.
35. Wang Z, Popescu G, Tangella KV et al Tissue refractive index as marker of disease. J Biomed Opt 2011; 16 (11): 116017. doi: 10.1117/1.3656732.
36. Calin VL, Mihailescu M, Scarlat EI et al. Evaluation of the metastatic potential of malignant cells by image processing of digital holographic microscopy data. FEBS Open Bio 2017; 7 (10): 1527–1538. doi: 10.1002/2211-5463.12282.
37. Hall A. The cytoskeleton and cancer. Cancer Metastasis Rev 2009; 28 (1–2): 5–14. doi: 10.1007/s10555-008-9166-3.
38. Brinkley BR, Beall PT, Wible LJ et al. Variations in cell form and cytoskeleton in human breast carcinoma cells in vitro. Cancer Res 1980; 40 (9): 3118–3129.
39. Carter SB. Principles of cell motility: the direction of cell movement and cancer invasion. Nature 1965; 208 (5016): 1183–1187. doi: 10.1038/2081183a0.
40. Kemper B, Bauwens A, Vollmer A et al. Label-free quantitative cell division monitoring of endothelial cells by digital holographic microscopy. J Biomed Opt 2010; 15 (3): 036009. doi: 10.1117/1.3431712.
41. El-Schich Z, Leida Mölder A, Gjörloff Wingren A. Quantitative phase imaging for label-free analysis of cancer cells – focus on digital holographic microscopy. Appl Sci 2018; 8 (7): 1027. doi: 10.3390/app8071027.
42. Aslantürk ÖS. In vitro cytotoxicity and cell viability assays: principles, advantages, and disadvantages. [online]. Available from: https: //cdn.intechopen.com/pdfs/57717.pdf.
43. Katt ME, Placone AL, Wong AD et al. In vitro tumor models: advantages, disadvantages, variables, and selecting the right platform. Front Bioeng Biotechnol 2016; 4 : 12. doi: 10.3389/fbioe.2016.00012.
44. Ravi M, Paramesh V, Kaviya SR et al. 3D cell culture systems: advantages and applications. J Cell Physiol 2015; 230 (1): 16–26. doi: 10.1002/jcp.24683.
45. Oppel F, Shao S, Schürmann M et al. An effective primary head and neck squamous cell carcinoma in vitro model. Cells 2019; 8 (6): 555. doi: 10.3390/cells8060555.
46. Zhou B, Chen WL, Wang YY et al. A role for cancer-associated fibroblasts in inducing the epithelial-to-mesenchymal transition in human tongue squamous cell carcinoma. J Oral Pathol Med 2014; 43 (8): 585–592. doi: 10.1111/jop.12172.
47. Gillet JP, Varma S, Gottesman MM. The clinical relevance of cancer cell lines. J Natl Cancer Inst 2013; 105 (7): 452–458. doi: 10.1093/jnci/djt007.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2022 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Předsednictví Francie a České republiky v Radě Evropské unie – informace k významným akcím v oblasti onkologie
- Akupunktura z pohledu medicíny založené na důkazech – možnosti klinického využití na podkladě doporučení National Comprehensive Cancer Network (NCCN)
- Hepatocelulární karcinom – prognostická kritéria individualizované léčby
- Rehabilitácia a pohybová aktivita pri gynekologických onkologických ochoreniach
- Radioterapie a radiosenzitivní syndromy u mutací genů reparace DNA
- Koherencí řízená holografická mikroskopie – nástroj pro hledání nových biomarkerů dlaždicobuněčného karcinomu hlavy a krku
- Metabolický syndróm u pacientov po alogénnej transplantácii kmeňových krvotvorných buniek
- Kombinovaná chemoradioterapie karcinomu hrdla děložního – retrospektivní hodnocení vlastního souboru
- Late-onset pulmonary and cardiac toxicities in a patient treated with immune checkpoint inhibitor monotherapy
- An impending rupture of the subclavian artery after chemoradiotherapy
- Aktuality z odborného tisku
- Informace z České onkologické společnosti
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Akupunktura z pohledu medicíny založené na důkazech – možnosti klinického využití na podkladě doporučení National Comprehensive Cancer Network (NCCN)
- Radioterapie a radiosenzitivní syndromy u mutací genů reparace DNA
- Hepatocelulární karcinom – prognostická kritéria individualizované léčby
- Rehabilitácia a pohybová aktivita pri gynekologických onkologických ochoreniach
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



