-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Léčba dospělých pacientů s akutní lymfoblastovou leukemií v České republice v letech 2007–2020
Treatment of adult patients with acute lymphoblastic leukemia in the Czech Republic in the period 2007–2020
Background: Pediatric-inspired protocols with prospective monitoring of minimal residual disease (MRD) are considered the standard of intensive treatment for adults with acute lymphoblastic leukemia (ALL). They have been used in the Czech Republic since 2007.
Patients and methods: Two hundred and ninety-seven patients aged 18–65 years were treated at five hematology centers between 2007–2020 according to the GMALL 07/2003 protocol. This is a retrospective analysis of their treatment outcomes.
Results: In the Ph-negative cohort, 189 (93.1%) patients achieved complete remission, 5 (2.4%) patients were refractory, and early mortality was 3.0%. Seventy (34.5%) patients experienced relapse in a median of 10.6 months. Overall survival (OS) at 3 and 5 years was 63.5% and 55.9%, disease-free survival (DFS) at 3 and 5 years was 54.5% and 49.7%, respectively. Young adults under 35 years of age (P = 0.015), patients without initial CNS infiltration (P = 0.016), with MRD negativity before consolidation treatment (P < 0.001), transplanted in the 1st complete remission (P < 0.001), and subjects treated after 2012 (P = 0.05) had significantly better overall survival. In a multivariate analysis, MRD at week 11 was the only independent factor affecting OS (HR 3.06; P = 0.006). For DFS, baseline CNS infiltration (HR 2.08; P = 0.038) and MRD at week 11 (HR 2.15; P = 0.020) were significant. In the Ph-positive cohort, 84 (89.4%) patients achieved complete remission, 1 (1.0%) patient was refractory, early mortality was 4.3%. Twenty-six (27.7%) patients relapsed in a median of 8.6 months. Survival at 3 and 5 years was 57.2% and 52.4% for OS and 50.2% and 44.9% for DFS, respectively. Transplanted patients and patients diagnosed after 2012 had statistically better overall survival (P < 0.001).
Conclusion: The introduction of pediatric-inspired protocols with treatment intensification according to MRD levels resulted in a significant improvement in the survival outcomes of adult patients with ALL.
Keywords:
acute lymphoblastic leukemia – treatment – hematopoietic stem cell transplantation – minimal residual disease – pediatric-inspired protocol
Autori: C. Šálek 1,2; Š. Hrabovský 3; F. Folber 3; J. M. Horáček 4,5; Z. Kořístek 6; T. Szotkowski 7; P. Pecherková 1; E. Froňková 8; M. Doubek 3; Česká leukemická skupina pro život (CELL)
Pôsobisko autorov: Ústav hematologie a krevní transfuze, Praha 1; Ústav klinické a experimentální hematologie 1. LF UK Praha 2; Interní hematologická a onkologická klinika LF MU a FN Brno 3; IV. interní hematologická klinika LF UK a FN Hradec Králové 4; Katedra vojenského vnitřního lékařství a vojenské hygieny, Fakulta vojenského zdravotnictví, Univerzita obrany, Hradec Králové 5; Klinika hematoonkologie LF OU a FN Ostrava 6; Hemato-onkologická klinika LF UP a FN Olomouc 7; Laboratorní centrum CLIP, Klinika dětské hematologie a onkologie 2. LF UK a FN Motol, Praha 8
Vyšlo v časopise: Klin Onkol 2023; 36(5): 382-395
Kategória: Původní práce
doi: https://doi.org/10.48095/ccko2023382Súhrn
Východiska: Za standard intenzivní léčby dospělých s akutní lymfoblastovou leukemií (ALL) jsou považovány protokoly pediatrického typu s prospektivním sledováním minimální reziduální nemoci (MRN). V ČR jsou používány od roku 2007.
Soubor pacientů a metody: Mezi lety 2007–2020 bylo v pěti hematologických centrech léčeno 297 dospělých ve věku 18–65 let podle protokolu GMALL 07/2003, resp. ALL CELL 2012 Junior. Tato práce představuje retrospektivní analýzu výsledků jejich léčby.
Výsledky: V kohortě Ph-negativní ALL dosáhlo 189 (93,1 %) pacientů kompletní remise, refrakterních bylo 5 (2,4 %) pacientů, časná mortalita byla 3,0 %. Relaps byl zaznamenán u 70 (34,5 %) nemocných v mediánu 10,6 měsíce. Celkové přežití (overall survival – OS) ve 3 a 5 letech dosahovalo 63,5 % a 55,9 % a přežití bez nemoci (disease-free survival – DFS) ve 3 a 5 letech pak 54,5 % a 49,7 %. Významně lepší OS měli mladí dospělí do 35 let (p = 0,015), pacienti bez vstupní infiltrace CNS (p = 0,016), s negativitou MRN před zahájením konsolidační léčby (p < 0,001), transplantovaní v 1. kompletní remisi (p < 0,001) a nemocní léčení po roce 2012 (p = 0,05). V multivariantní analýze byla jediným nezávislým faktorem, který ovlivňoval OS, MRN v 11. týdnu léčby (HR 3,06; p = 0,006). Pro DFS byla významná vstupní infiltrace CNS (HR 2,08; p = 0,038) a MRN v 11. týdnu (HR 2,15; p = 0,020). Ve skupině Ph-pozitivní ALL dosáhlo kompletní remise 84 (89,4 %) pacientů, refrakterní byl 1 (1,0 %) pacient, časná mortalita byla 4,3 %. Relabovalo 26 (27,7 %) nemocných v mediánu 8,6 měsíce. Přežití ve 3 a 5 letech dosahovalo 57,2 % a 52,4 % pro OS a 50,2 % a 44,9 % pro DFS. Statisticky lepší OS měli transplantovaní pacienti (p < 0,001) a nemocní diagnostikovaní po roce 2012 (p < 0,001).
Závěr: Zavedení protokolů pediatrického typu s intenzifikací léčby podle hladin MRN se odrazilo v signifikantním zlepšení výsledků přežití dospělých pacientů s ALL.
Klíčová slova:
léčba – minimální reziduální nemoc – akutní lymfoblastová leukemie – pediatrický typ protokolu – transplantace krvetvorných kmenových buněk
Úvod
Akutní lymfoblastová leukemie (ALL) je nejčastějším nádorovým onemocněním dětského věku s vrcholem incidence mezi 2. a 5. rokem života. V dospělosti představuje kolem 20 % akutních leukemií. Incidence u dospělých čítá 1,28/100 000 obyvatel [1]. Nárůst případů ve vyšším věku je pozvolný, zvyšuje se však podíl prognosticky nepříznivých cytogenetických variant, jako je Ph-pozitivní ALL.
Prognosticky se ALL dětského a dospělého věku zásadně liší. Zatímco pediatričtí pacienti docílí remise v 95 % a dlouhodobě jich přežívá více než 90 % pacientů [2,3], v dospělosti kolísá míra dosažení remise při léčbě standardními polychemoterapeutickými protokoly mezi 60–92 % a celkové přežití (OS) v neselektovaných kohortách dosahuje 30–50 % [4–6]. K příčinám horších výsledků se řadí vyšší podíl prognosticky nepříznivých cytogenetických abnormalit, horší tolerance intenzivní chemoterapie i limitace léčby komorbiditami a větší orgánovou toxicitou.
Snahy evropských národních skupin na poli léčby ALL dospělých byly v uplynulých třech dekádách formovány snahou zavést do léčby intenzivní polychemoterapeutické bloky inspirované složením i designem pediatrických protokolů. Příkladem postupné optimalizace tohoto přístupu jsou protokoly německé studijní skupiny GMALL, kde každá nová verze protokolu vedla k stupňovitému zlepšení přežití [7]. Německý přístup se stal inspirací pro Českou leukemickou skupinu – pro život (CELL), která zprvu převzala protokol GMALL 07/2003 a později jej dále samostatně rozvíjela a modifikovala (protokol ALL CELL 2012 Junior). Do klinické praxe českých pracovišť se tak dostal protokol inspirovaný pediatrickým přístupem a stratifikující riziko nemoci podle dynamiky minimální reziduální nemoci (MRN) měřené standardizovanou metodou kvantifikující klonálně specifické přestavby v genech pro imunoglobulinové řetězce a T-buněčné receptory (IG/TR) [8].
Tab. 1. Charakteristika souboru pacientů s Ph-negativní akutní lymfoblastovou leukemií. 

ALL – akutní lymfoblastová leukemie, BCP – prekurzory B buněk, CNS1 – bez záchytu leukemických blastů v mozkomíšním moku, CNS2 – do 5 leukocytů v 1 μl mozkomíšního moku, blasty přítomny, CNS3 – více než 5 leukocytů v 1 μl mozkomíšního moku, blasty přítomny (do skupiny CNS3 jsou řazeni i pacienti s ložiskem v CNS nebo periferní parézou hlavového nervu), GMALL – německá studijní skupina pro ALL dospělých, T-ALL – ALL z T buněk. Standardní riziko dle GMALL zahrnuje pacienty se vstupní leukocytózou < 30×109/l a commonB nebo preB fenotypem bez t(v;11q23.3) a pacienty s leukocytózou < 100×109/l a corticalT fenotypem. Podmínkou je dosažení kompletní remise pro prvním bloku indukční chemoterapie. Tab. 2. Charakteristika souboru pacientů s Ph-pozitivní akutní lymfoblastovou leukemií. 
ACA – přídatné chromozomální abnormality Pacienti a metodika
Publikace představuje analýzu výsledků léčby intenzivně léčených dospělých pacientů s ALL diagnostikovaných konsekutivně mezi léty 2007 a 2020 v pěti hematoonkologických centrech v ČR: Ústavu hematologie a krevní transfuze v Praze a fakultních nemocnicích v Brně, Hradci Králové, Ostravě a Olomouci. Data byla extrahována z databáze DATOOL ALL České leukemické skupiny – pro život (CELL) ke dni 5. 4. 2021. Všichni pacienti podepsali souhlas s ukládáním svých anonymizovaných dat do výše uvedené databáze, stejně jako souhlas s využitím biologického materiálu pro vědecké účely ve shodě s Helsinskou deklarací Světové lékařské asociace.
Celkem bylo léčeno 297 pacientů. Pacienti s Ph-negativní a Ph-pozitivní ALL byli analyzováni odděleně. Vstupní charakteristicky pacientů jsou shrnuty v tab. 1 a 2.
Pacienti s Ph-negativní ALL byli léčeni podle protokolu GMALL 07/2003 a z něj odvozeného protokolu ALL CELL 2012 Junior. Protokol je založen na sekvenčním podání dvou indukčních a sedmi konsolidačních chemoterapeutických bloků a prospektivním sledování MRN metodou qPCR. Nedosažení negativity MRN do 18. týdne léčby je považováno za samostatný rizikový faktor a je důvodem k intenzifikaci léčby provedením alogenní transplantace krvetvorných kmenových buněk (hematopoietic stem cell transplant – HSCT). Podrobný popis protokolu je k dispozici online (clinical.trials.gov, identifikátor NCT00198991).
Nemocní s Ph-pozitivní ALL byli léčeni chemoterapií v kombinaci s inhibitorem tyrozinové kinázy imatinibem v dávce 400–600 mg/den podávaném od prvního dne indukce I do alogenní HSCT. Sedmdesát sedm (81,9 %) pacientů dostávalo chemoterapii dle výše uvedeného protokolu GMALL 07/2003 (ALL CELL 2012 Junior), 12 pacientů (12,8 %) bylo léčeno dle protokolu hyperCVAD, 5 pacientů (5,3 %) ve věku > 55 let dostalo redukovanou chemoterapii dle protokolu ALL CELL 2012/Ph+ Elderly.
MRN byla testována v kostní dřeni metodou polymerázové řetězové reakce (polymerase chain reaction – PCR) v protokolem stanovených časech, tedy po skončení indukce I (den 26), po skončení indukce II (den 46), před zahájením konsolidace I (týden 11), před zahájením konsolidace II (týden 16), později před zahájením dalších konsolidačních cyklů nebo před provedením HSCT. Primárním cílem pro stanovení MRN byly specifické přestavby IG/TR (u Ph-negativní ALL) nebo transkript BCR:: ABL1 (u Ph-pozitivní ALL). Výsledky MRN byly kvantifikovány a interpretovány v souladu se standardy konzorcia EuroMRD [8–10]. Minimální senzitivita esejí byla 10–4.
Analýza je retrospektivní. Hodnotili jsme vliv vstupních parametrů na přežití. K testovaným parametrům patří věk, cytogenetický nález, liniová příslušnost, počet leukocytů při diagnóze, riziková skupina dle GMALL a infiltrace CNS. U Ph-pozitivní ALL byl zohledněn i typ přestavby BCR:: ABL1. Dále jsme provedli landmark analýzu v týdnu 11 pro zhodnocení vlivu negativity MRN a studovali jsme vliv provedení alogenní HSCT v první kompletní remisi (complete remission – CR). Posledně jmenovaný parametr byl hodnocen jako časově závislá proměnná. Do multivariantní analýzy byly zařazeny standardní rizikové faktory charakterizující onemocnění před zahájením léčby. Provedení HSCT v 1. CR do analýzy Ph-negativní kohorty zařazeno nebylo, neboť v protokolu indikujícím transplantační léčbu na základě hodnoty MRN nešlo o nezávislou proměnnou.
OS udává čas od diagnózy do data úmrtí nebo posledního kontaktu. Přežití bez nemoci (disease-free survival – DFS) je definováno jako čas od dosažení remise do relapsu, úmrtí nebo posledního kontaktu. Efekt MRN na přežití u pacientů podstupujících HSCT byl hodnocen od data transplantace. Vstupní data pacientů byla hodnocena metodami deskriptivní statistiky. Vliv kategorických parametrů na funkci přežití byl odhadován metodou dle Kaplana-Meiera. Pro srovnání křivek přežití mezi skupinami byl použit oboustranný log-rank test. Funkce rizik kontinuálních proměnných byly hodnoceny metodou Coxova proporcionálního regresního modelování. Rizikové faktory pro OS a DFS byly určeny za pomoci multivariantního Coxova modelu proporcionálních rizik. Všechny analýzy byly provedeny na hladině významnosti 5 % (p < 0,05). K výpočtům byl použit statistický software IBM SPSS v23 a MATLAB R2021a (The MathWorks Inc.).
Tab. 3. Analýza přežití pacientů s Ph-negativní akutní lymfoblastovou leukemií. 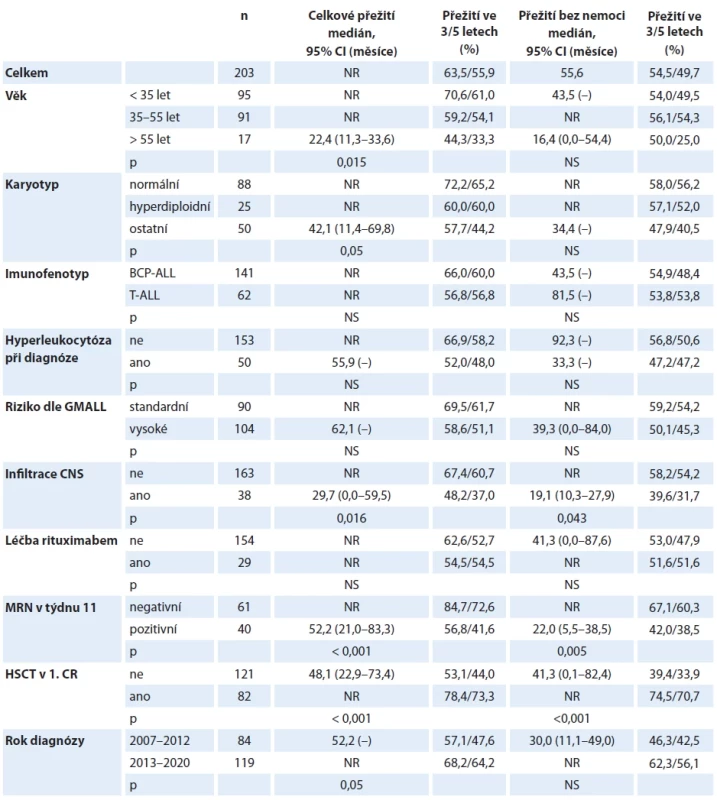
CR – kompletní remise, GMALL – německá studijní skupina pro ALL, HSCT – alogenní transplantace krvetvorných kmenových buněk, MRN – minimální reziduální nemoc; NR – nedosaženo; NS – nesignifi kantní Graf 1. Přežití pacientů s Ph-negativní akutní lymfoblastovou leukemií, celá kohorta. 
Graf 2. Přežití pacientů s Ph-negativní akutní lymfoblastovou leukemií podle věku při diagnóze. 
NS – nesignifikantní Graf 3. Přežití pacientů s Ph-negativní akutní lymfoblastovou leukemií podle minimální reziduální nemoci v týdnu 11. 
Graf 4. Multivariantní analýza faktorů ovlivňujících přežití u Ph-negativní akutní lymfoblastové leukemie. 
Tab. 4. Analýza přežití pacientů s Ph-pozitivní akutní lymfoblastovou leukemií. 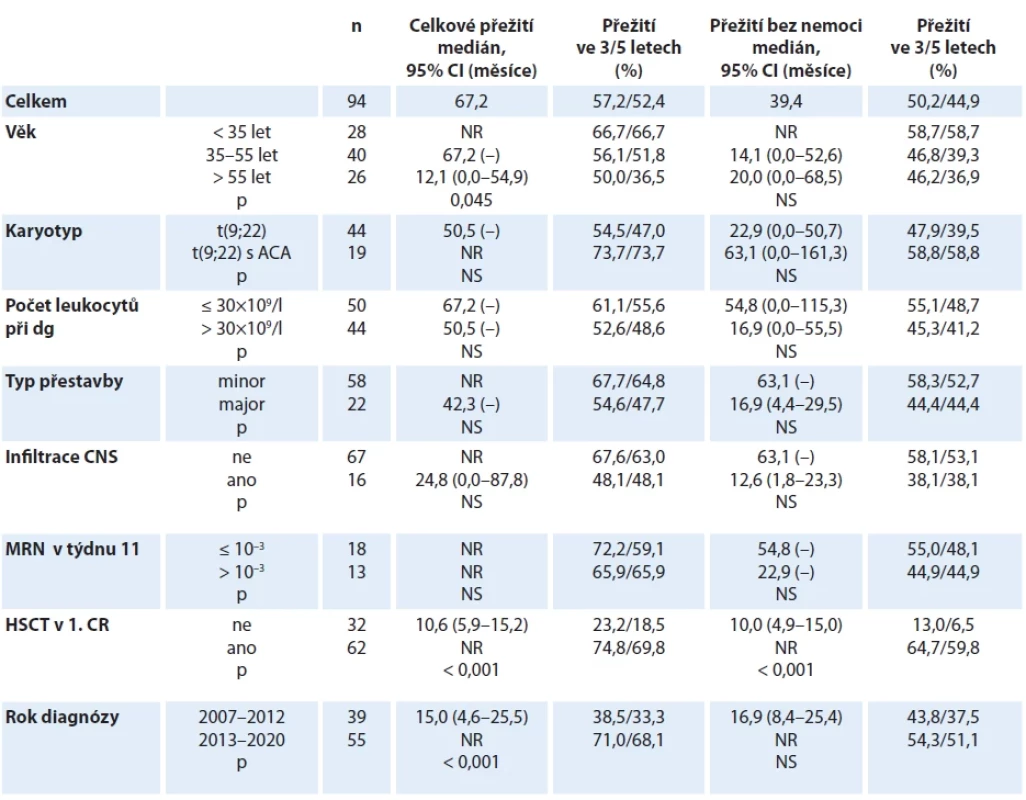
ACA – vysvětlení zkratky, CR – kompletní remise, HSCT – alogenní transplantace krvetvorných kmenových buněk, MRN – minimální reziduální nemoc, NR – nedosaženo, NS – nesignifikantní Graf 5. Přežití pacientů s Ph-pozitivní akutní lymfoblastovou leukemií, celá kohorta. 
Graf 6. Přežití pacientů s Ph-pozitivní akutní lymfoblastovou leukemií podle věku při diagnóze. 
Graf 7. Přežití pacientů s Ph-pozitivní akutní lymfoblastovou leukemií podle transplantace krvetvorných kmenových buněk v 1. kompletní remisi. 
Výsledky
Ph-negativní akutní lymfoblastová leukemie
Medián sledování v kohortě pacientů s Ph-negativní ALL činil 33,5 měsíce (rozmezí 0,6–120 měsíců). Sto osmdesát devět (93,1 %) pacientů dosáhlo kompletní remise, 5 (2,4 %) bylo primárně refrakterních. V průběhu indukční fáze léčby zemřelo 6 (3,0 %) pacientů, údaj o výsledku indukční léčby chyběl u 3 (1,5 %) pacientů. Relaps byl zaznamenán u 70 (34,5 %) pacientů; medián doby do relapsu dosahoval 10,6 měsíce (rozmezí 1,5–87,6 měsíce). V době uzávěrky dat před analýzou bylo 120 (59,1 %) pacientů naživu. Přežití ve 3 a 5 letech dosahovalo 63,5 % a 55,9 % pro OS a 54,5 % a 49,7 % pro DFS.
Výsledky párových analýz hodnotících vliv vstupních a časových parametrů na přežití jsou shrnuty v tab. 3 a graficky znázorněny křivkami přežití (graf 1–3). V multivariantní analýze byla jako jediný faktor, který samostatně ovlivňoval OS, identifikována MRN v týdnu 11 s HR 3,06 (95% CI 1,37–6,84; p = 0,006) (graf 4). Pro přežití bez progrese byla významná vstupní infiltrace CNS s HR 2,08 (95% CI 1,04–4,16; p = 0,038) a MRN v týdnu 11 s HR 2,15 (95% CI 1,13–4,10; p = 0,020).
Ph-pozitivní akutní lymfoblastová leukemie
Medián sledování skupiny pacientů s Ph-pozitivní ALL činil 24,5 měsíce (rozmezí 0,3–120 měsíců). Osmdesát čtyři (89,4 %) pacientů dosáhlo CR, 1 (1,0 %) byl primárně refrakterní. V průběhu indukční fáze léčby zemřeli 4 (4,3 %) pacienti, údaj o výsledku indukční léčby chyběl u 5 (2,3 %) pacientů. Relabovalo 26 (27,7 %) pacientů; medián doby do relapsu činil 8,6 měsíce (rozmezí 3,6–40,5 měsíce). V době uzávěrky dat před analýzou bylo 49 (52,1 %) pacientů naživu. Přežití ve 3 a 5 letech dosahovalo 57,2 % a 52,4 % pro OS a 50,2 % a 44,9 % pro DFS.
Výsledky párových analýz hodnotících přežití dle vstupních a temporálních parametrů jsou přehledně uvedeny v tab. 4 a graficky znázorněny křivkami přežití (graf 5–7). V multivariantní analýze faktorů ovlivňujících přežití nebyl žádaný z prognostických faktorů vyšetřovaných při diagnóze identifikován jako nezávislý prognostický faktor pro OS nebo DFS (graf 8). Na rozdíl od Ph-negativní ALL, ale v souladu s výsledky univariantní analýzy, nebyla jako signifikantní shledána ani hladina MRN před zahájením konsolidační fáze léčby.
Diskuze
Léčba Ph-negativní akutní lymfoblastové leukemie
Výsledky léčby pacientů s Ph-negativní ALL v českých hematologických centrech z let 2007–2020 jsou srovnatelné s výstupy velkých národních studií, které v tu dobu probíhaly na referenčních západních pracovištích [11–13]. V českých centrech se poprvé podařilo v kohortě intenzivně léčených pacientů překonat 50% hranici pro celkové přežití (graf 1). Při zohlednění data diagnózy se ukázalo, že přežití nemocných diagnostikovaných v letech 2013–2020 je signifikantně lepší než u pacientů z let 2007–2012 (OS ve 3 letech 68,2 % vs. 57,1 %; p = 0,05). Pozitivní trend je patrný i v parametru DFS. Je pravděpodobné, že výsledek odráží větší zkušenost pracovišť s intenzivním protokolem, se zvládáním specifických vedlejších účinků některých léčiv, zejména pegylované asparaginázy, úspěchy v prevenci mykotických infekcí a v léčbě infekčních komplikací, lepší výsledky transplantační léčby a samozřejmě i nové možnosti cílené léčby relapsu.
Analýzu vlivu jednotlivých rizikových faktorů na přežití tvoří série párových srovnání, která velmi často potvrzují trend ve prospěch jedné z porovnávaných skupin. Je naznačeno delší přežití u pacientů mladších věkových skupin, zejména adolescentů a mladých dospělých ve věku do 35 let (OS a DFS ve 3 letech 70,6 % a 54,0 % vs. 59,2 % a 56,1 % ve věku 35–55 let vs. 44,3 % a 50,0 % ve věku >55 let; graf 2). Právě mladí dospělí profitují z intenzivních protokolů pediatrického typu, na nichž dosahují dlouhodobého přežití 67–78 % [14,15].
Cytogenetická analýza je standardním diagnostickým vyšetřením u ALL. Především v pediatrických kohortách představuje karyotyp silný prognostický faktor používaný ke stratifikaci pacientů do ramen s různou intenzitou léčby. Naše analýza prokázala signifikantně lepší OS pacientů s normálním karyotypem oproti nemocným s cytogenetickými abnormalitami, vyjma hyperdiploidie. Horší přežití vykazovala skupina pacientů s cytogenetickými abnormalitami, mezi nimiž byli nejvíce zastoupeni nemocní s komplexním karyotypem nebo delecí genu CDKN2A (p16). Nepodařilo se naopak prokázal příznivý vliv hyperdiploidie, která definuje dobrou prognózu v dětských kohortách [16].
V naší kohortě nebyl pozorován rozdíl v přežití mezi pacienty s B prekurzorovým (BCP) a T fenotypem, ačkoliv některé studie ukazují na delší přežití nemocných s T-ALL [17]. Stírání rozdílu mezi oběma skupinami ve prospěch BCP-ALL je přisuzován novým lékům, zejména blinatumomabu, inotuzumabu ozogamicinu a anti-CD19 CAR-T lymfocytům, které přinášejí nové šance pro pacienty s relapsem BCP-ALL, zatímco poslední registrovanou novinkou pro léčbu relapsu T-ALL, jejíž efekt je poněkud rozporuplný, se stal nelarabin v roce 2005.
V křivkách přežití je patrný trend k lepšímu přežití pacientů bez vstupní hyperleukocytózy a se standardním rizikem dle klasifikačního systému GMALL (tab. 2). Rozdíly v OS činí v obou případech 10 procentních bodů, na limitovaném množství subjektů však nedosahují statistické významnosti. Význam standardních rizikových faktorů, které jsou určující pro zařazení do příslušné rizikové skupiny GMALL, je v analýze zastřen větším podílem transplantovaných pacientů ve skupině s vysokým rizikem (62 ze 104, tj. 59,6 %), zatímco ve skupině standardního rizika podstoupilo HSCT jen 18 z 90 (20,0 %) nemocných.
Byl pozorován statisticky významný rozdíl v přežití pacientů v závislosti na vstupní leukemické infiltraci CNS. Pacienti s nálezem leukemických blastů v mozkomíšním moku v čase diagnózy měli signifikantně kratší OS i DFS (p = 0,016 a 0,043). Za pozitivní nález byla považována jakákoliv přítomnost blastů v mozkomíšním moku při cytologickém vyšetření (status CNS2 + CNS3, tab. 2), tedy nikoliv pouze infiltrace blasty při lymfocytární pleocytóze v mozkomíšním moku (status CNS3). Interpretace tohoto výsledku je obtížná a vyžádá si samostatnou studii srovnávající různé metodické přístupy k vyšetření mozkomíšního moku na různých pracovištích. Ačkoliv vstupní leukemická infiltrace CNS je obecně považována za negativní prognostický faktor, s výjimkou polské (PALG) jej žádná z evropských leukemických skupin nepovažuje za parametr rozhodující o intenzifikaci léčby pomocí alogenní HSCT [18].
Řada prací poukazuje na horší prognózu pacientů s BCP-ALL a pozitivitou znaku CD20 [19]. Naši pacienti s více než 20% expresí znaku CD20+ na leukemických blastech byli v souladu s protokolem léčeni infuzí rituximabu před každým z cyklů chemoterapie. Analýza přežití neprokázala rozdíl v přežití mezi skupinami nemocných, kteří dostali a nedostali anti-CD20 protilátku.
Dynamiku vývoje MRN v průběhu indukční a časné konsolidační fáze léčby znázorňuje graf 9. Nebyl pozorován statisticky významný rozdíl v přežití podle MRN měřené před prvním a druhým blokem konsolidační léčby v týdnech 11 a 16. Ve shodě s našimi dříve publikovanými výsledky považujeme MRN měřenou v týdnu 11 za zásadní parametr pro hodnocení odpovědi na polychemoterapeutickou léčbu dle protokolu GMALL 07/2003 (ALL CELL 2012 Junior) [20]. V recentně publikované analýze jsme ukázali, že klinickou relevanci mají jakékoliv pozitivity MRN v 11. týdnu léčby a že hodnoty pacientů s pozitivní nekvantifikovatelnou MRN mají negativní prognostický význam srovnatelný s pacienty s kvantifikovatelnou náloží [21].
Potvrdili jsme silný prognostický význam časného dosažení MRN negativity měřené v 11. týdnu po skončení indukční léčby. OS a DFS ve 3 letech u pacientů s kompletní molekulární odpovědí dosahovalo 84,7 % a 67,1 %, což kontrastovalo s 56,8 % a 42,0 % u pacientů s detekovatelnou MRN (p < 0,001 a 0,005; graf 3). Klinický význam hladiny MRN v 11. týdnu byl nezávislý na standardních prognostických faktorech (věk, karyotyp, imunofenotyp, počet leukocytů při diagnóze, riziková skupina dle GMALL) (graf 4).
Silný prognostický význam pro přežití mělo provedení alogenní HSCT v 1. CR, a to jak v univariantní, tak multivariantní analýze (graf 4). Neprokázali jsme rozdíl v OS mezi pacienty v molekulární remisi (MR), kteří byli nebo nebyli transplantováni. Signifikantní rozdíl však byl vyjádřen v analýze EFS (85,4 % vs. 59,3 %, p = 0,018) (tab. 5, graf 10). Křivky naznačují, že část pacientů bez HSCT relabuje kolem 20. měsíce léčby, tedy ještě před skončením udržovací terapie. Moderní imunoterapie dává většině z nich šanci na dosažení druhé remise a následné provedení alogenní HSCT. Jak bylo možné předpokládat, je kumulativní incidence relapsu (cumulative incidence of relapse – CIR) transplantovaných pacientů nižší než netransplantovaných, avšak 36,6% CIR u pacientů v kompletní MR bez HSCT je nečekaně vyšší než ukazují výstupy velkých evropských skupin [13,22,23]. Domníváme se, že tato skutečnost je částečně ovlivněna zařazením pacientů ve věku 55–65 let, kteří často nemohou z důvodu toxických komplikací absolvovat protokolem předepsanou konsolidační léčbu v úplnosti.
Graf 8. Multivariantní analýza faktorů ovlivňujících přežití u Ph-pozitivní akutní lymfoblastové leukemie. 
Tab. 5. Analýza přežití pacientů s Ph-negativní akutní lymfoblastovou leukemií podle minimální reziduální nemoci v týdnu 11 a alogenní transplantace krvetvorných kmenových buněk v 1. kompletní remisi. 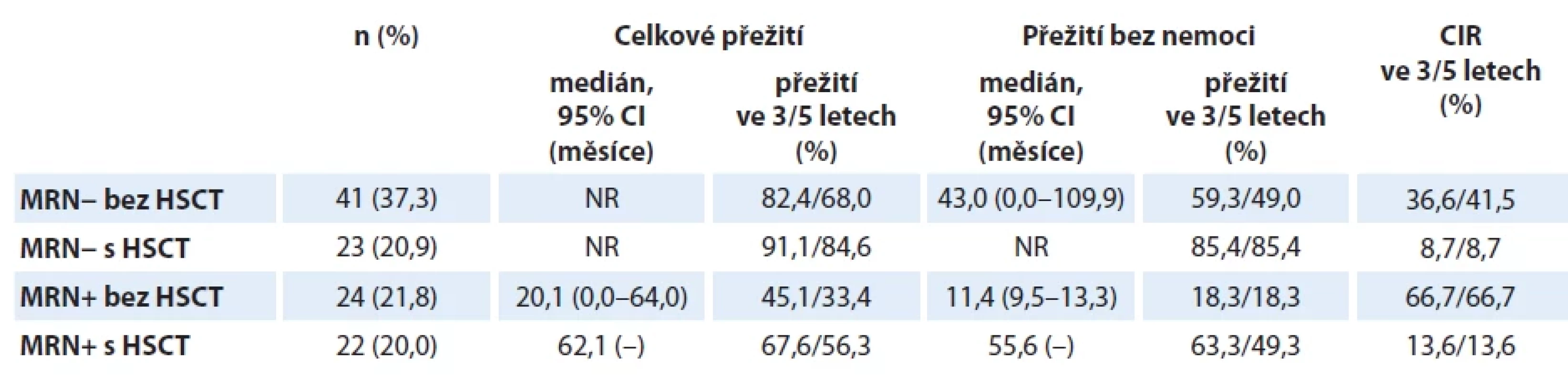
CIR – kumulativní incidence relapsu, CMR – kompletní molekulární odpověď, HSCT – alogenní transplantace krvetvorných kmenových buněk, MRN – minimální reziduální nemoc, MRN+ – přítomnost minimální reziduální nemoci (v kvantifikovatelném i nekvantifikovatelném rozmezí) Graf 9. Molekulární odpověď pacientů s Ph-negativní akutní lymfoblastovou leukemií v průběhu indukční a časné konsolidační fáze léčby dle protokolu GMALL 07/2003 (ALL CELL 2012 Junior). 
CMR – kompletní molekulární odpověď; MRNnq – minimální reziduální nemoc pozitivní s nekvantifikovatelnou náloží; MRNq – minimální reziduální nemoc pozitivní s kvantifikovatelnou náloží Graf 10. Přežití pacientů s Ph-negativní akutní lymfoblastovou leukemií podle minimální reziduální nemoci v týdnu 11 a transplantace krvetvorných kmenových buněk v 1. kompletní remisi. 
MRN – minimální reziduální nemoc Léčba Ph-pozitivní akutní lymfoblastové leukemie
Úspěšnost léčby pacientů s Ph-pozitivní ALL zaznamenala v posledních 20 letech dramatické zlepšení, v jehož základech stojí zavedení cílené léčby inhibitorem tyrozinové kinázy podávaném paralelně s chemoterapií. Výsledky studií velkých evropských národních skupin zaznamenaly až 20% nárůst v celkovém přežití, jak ukazuje srovnání studií italské skupiny GIMEMA, kde OS ve 2 letech stouplo z 25 % v éře před imatinibem na 55 % po zavedení imatinibu [24]. Naše výsledky ukazují OS ve 3 a 5 letech 57,2 % a 52,4 % (graf 5). Podtyp ALL, pro který byla historicky vyčleňována samostatná riziková skupina „very high risk“, se postupně z hlediska parametru celkového přežití stal standardně rizikovou ALL, což ukazuje srovnání s kohortou pacientů s Ph-negativní ALL, kde OS ve 3 a 5 letech činilo 63,5 % a 55,9 % (tab. 4).
Podmínkou tohoto zlepšení je schopnost absolvovat intenzivní léčbu zahrnující konsolidaci formou alogenní HSCT. V našem souboru dosahovaly OS a DFS v 5 letech ve skupině pacientů transplantovaných v 1. CR 69,8 % a 59,8 % a významně se lišily od přežití pacientů bez HSCT (18,5 % a 6,5 %, p < 0,001; graf 7). Tyto výsledky jsou zcela srovnatelné s velkými kohortami, např. s francouzskou, kde přežití transplantovaných v 5 letech bylo 62 % a peritransplantační morbidita a mortalita dosahovala 25,6 % [25].
V kohortě pacientů s Ph-pozitivní ALL byl ještě markantněji vyjádřen rozdíl ve výsledcích léčby nemocných léčených před a po roce 2012. Výsledky odrážejí nejen vývoj na poli podpůrné léčby, standardizaci transplantačních protokolů a větší možnosti v léčbě infekčních i imunologicky podmíněných potransplantačních komplikací, ale také změnu ve složení indukční terapie. V dodatku protokolu GMALL 07/2003 z roku 2012 byla v rameni pro Ph-pozitivní ALL redukována myelotoxická léčba, zejména vypuštěním antracyklinů. Při současné terapii imatinibem byla zkrácena doba neutropenie, snížena incidence infekčních komplikací, výrazně redukována časná morbidita i mortalita, a větší počet pacientů tak mohl podstoupit alogenní HSCT. Tomu nasvědčuje i statisticky významný rozdíl v podílu transplantovaných pacientů v letech 2007–2012 (20 z 39, tj. 51,3 %) a v letech 2013–2020 (42 z 55, tj. 76,4 %; p = 0,011).
Analýza skupiny pacientů s Ph-pozitivní ALL je významně limitována malým množstvím subjektů. Nebylo tak možné statisticky prokázat prognostický vliv řady parametrů, kterým byl ve větších kohortách prognostický význam přiznán. Při srovnání skupin dle věku bylo prokázáno lepší přežití skupiny adolescentů a mladých dospělých do 35 let pouze pro OS (graf 6). Nemohli jsme prokázat negativní vliv přídatných chromozomálních změn na přežití, ačkoliv literárně jsou genové delece, především delece genů CDKN2A/B, prokázány jako faktor negativně ovlivňující přežití [26]. Přítomnost CNA u Ph-pozitivní ALL měla negativní dopad na přežití i u pacientů léčených kombinovanou imunoterapií ve studii D-ALBA s blinatumomabem a dasatinibem v 1. linii léčby, kde nejhorších výsledků dosahovala právě skupina nemocných s genotypem IKZF1plus [27].
Podobně jsme nebyli schopni ukázat rozdíl v přežití mezi pacienty s přestavbou BCR:: ABL1 minor oproti přestavbě major, i když jiné studie ukázaly na horší molekulární odpověď nemocných s přestavbou major, patrně z důvodu, že major přestavba postihuje časnější hematopoetický prekurzor a je exprimována nejen v nádorově transformované lymfoidní linii [28].
Již v analýze publikované roku 2016 jsme ukázali na pomalejší průběh MRN u Ph-pozitivní ALL. Čas do dosažení MR byl 2,3× delší než u Ph-negativní ALL [20]. Ani na větším souboru se nepodařilo efekt časné MRN odpovědi prokázat. Tento výsledek koresponduje s pozorováním francouzské skupiny GRAALL ve studii GRAAPH-2005, kde osoby v kompletní remisi s MRN ≥ 10–3 před transplantací neměly horší přežití než pacienti s hlubší MR [25,29]. Zásadní prognostický význam je přisuzován sledování transkriptu BCR:: ABL1 po provedené HSCT.
Závěr
Výsledky léčby dospělých pacientů s ALL v ČR v letech 2007–2020 doznaly díky zavedení protokolů pediatrického typu a intenzifikaci léčby podle časné MR výrazného zlepšení oproti předchozím dekádám [30]. Jsou srovnatelné s daty publikovanými národními studijními skupinami v ostatních evropských zemích. Zejména v kohortě BCP-ALL se díky dostupnosti moderní cílené léčby, jejímu zavádění do 1. linie léčby a možnostem buněčné terapie relapsu úspěšnost léčby dále zlepšuje. V následující dekádě lze očekávat zavedení bezchemoterapeutických přístupů k léčbě některých typů ALL, další individualizaci terapie na základě testování citlivosti leukemických buněk k cíleným preparátům a ústup role HSCT v primární léčbě.
Dedikace
Práce byla realizována za podpory Agentury pro zdravotnický výzkum České republiky (AZV ČR) pod grantovým číslem NU22-03-00210 a s přispěním DZRO 1011 – Klinické obory II (FVZ UO).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare that they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.doc. MUDr. Mgr. Cyril Šálek, Ph.D.
Ústav hematologie a krevní transfuze
U Nemocnice 2094/1
128 00 Praha 2
e-mail: cyril.salek@uhkt.czObdrženo/Submitted: 8. 1. 2023
Přijato/Accepted: 15. 2. 2023
Zdroje
1. Hoelzer D, Bassan R, Dombret H et al. Acute lymphoblastic leukaemia in adult patients: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2016; 27 (Suppl 5): v69–v82. doi: 10.1093/annonc/mdw025.
2. Conter V, Bartram CR, Valsecchi MG et al. Molecular response to treatment redefines all prognostic factors in children and adolescents with B-cell precursor acute lymphoblastic leukemia: results in 3184 patients of the AIEOP-BFM ALL 2000 study. Blood 2010; 115 (16): 3206–3214. doi: 10.1182/blood-2009-10-248146.
3. Starý J, Zimmermann M, Campbell M et al. Intensive chemotherapy for childhood acute lymphoblastic leukemia: results of the randomized intercontinental trial ALL IC-BFM 2002. J Clin Oncol 2014; 32 (3): 174–184. doi: 10.1200/JCO.2013.48.6522.
4. Bassan R, Hoelzer D. Modern therapy of acute lymphoblastic leukemia. J Clin Oncol 2011; 29 (5): 532–543. doi: 10.1200/JCO.2010.30.1382.
5. Jabbour E, O‘Brien S, Konopleva M et al. New insights into the pathophysiology and therapy of adult acute lymphoblastic leukemia. Cancer 2015; 121 (15): 2517–2528. doi: 10.1002/cncr.29383.
6. Malard F, Mohty M. Acute lymphoblastic leukaemia. Lancet 2020; 395 (10230): 1146–1162. doi: 10.1016/S0140-6736 (19) 33018-1.
7. Gökbuget N, Kneba M, Raff T et al. Adult patients with acute lymphoblastic leukemia and molecular failure display a poor prognosis and are candidates for stem cell transplantation and targeted therapies. Blood 2010; 120 (9): 1868–1876. doi: 10.1182/blood-2011-09-377713.
8. van der Velden VH, Cazzaniga G, Schrauder A et al. Analysis of minimal residual disease by Ig/TCR gene rearrangements: guidelines for interpretation of real-time quantitative PCR data. Leukemia 2007; 21 (4): 604–611. doi: 10.1038/sj.leu.2404586.
9. Brüggemann M, Schrauder A, Raff T et al. Standardized MRD quantification in European ALL trials: proceedings of the second international symposium on MRD assessment in Kiel, Germany, 18–20 September 2008. Leukemia 2010; 24 (3): 521–535. doi: 10.1038/leu.2009.268.
10. Pfeifer H, Cazzaniga G, van der Velden VH et al. Standardisation and consensus guidelines for minimal residual disease assessment in Philadelphia-positive acute lymphoblastic leukemia (Ph+ ALL) by real-time quantitative reverse transcriptase PCR of e1a2 BCR-ABL1. Leukemia 2019; 33 (8): 1910–1922. doi: 10.1038/s41375-019-0413-0.
11. Goldstone AH, Richards SM, Lazarus HM et al. In adults with standard-risk acute lymphoblastic leukemia, the greatest benefit is achieved from a matched sibling allogeneic transplantation in first complete remission, and an autologous transplantation is less effective than conventional consolidation/maintenance chemotherapy in all patients: final results of the International ALL Trial (MRC UKALL XII/ECOG E2993). Blood 2008; 111 (4): 1827–1833. doi: 10.1182/blood-2007-10-116582.
12. Thomas DA, O‘Brien S, Faderl S et al. Chemoimmunotherapy with a modified hyper-CVAD and rituximab regimen improves outcome in de novo Philadelphia chromosome-negative precursor B-lineage acute lymphoblastic leukemia. J Clin Oncol 2010; 28 (24): 3880–3889. doi: 10.1200/JCO.2009.26.9456.
13. Huguet F, Chevret S, Leguay T et al. Intensified therapy of acute lymphoblastic leukemia in adults: report of the randomized GRAALL-2005 clinical trial. J Clin Oncol 2018; 36 (24): 2514–2523. doi: 10.1200/JCO.2017.76.8192.
14. Boissel N, Baruchel A. Acute lymphoblastic leukemia in adolescent and young adults: treat as adults or as children? Blood 2018; 132 (4): 351–361. doi: 10.1182/blood-2018-02-778530.
15. Stock W, Luger SM, Advani AS et al. A pediatric regimen for older adolescents and young adults with acute lymphoblastic leukemia: results of CALGB 10403. Blood 2019; 133 (14): 1548–1559. doi: 10.1182/blood-2018-10-881961.
16. Dastugue N, Suciu S, Plat G et al. Hyperdiploidy with 58-66 chromosomes in childhood B-acute lymphoblastic leukemia is highly curable: 58951 CLG-EORTC results. Blood 2013; 121 (13): 2415–2423. doi: 10.1182/blood-2012-06-437681.
17. Neumann M, Bastian L, Hanzelmann S et al. Molecular subgroups of T cell acute lymphoblastic leukemia in adults treated according to GMALL protocols. Blood 2020; 136 (Suppl 1): 37–38. doi: 10.1182/blood-2020-141 921.
18. Giebel S, Marks DI, Boissel N et al. Hematopoietic stem cell transplantation for adults with Philadelphia chromosome-negative acute lymphoblastic leukemia in first remission: a position statement of the European working group for adult acute lymphoblastic leukemia (EWALL) and the Acute leukemia working party of the European society for blood and marrow transplantation (EBMT). Bone Marrow Transplant 2019; 54 (6): 798–809. doi: 10.1038/s41409-018-0373-4.
19. Maury S, Chevret S, Thomas X et al. Rituximab in B-lineage adult acute lymphoblastic leukemia. N Engl J Med 2016; 375 (11): 1044–1053. doi: 10.1056/NEJMoa1605085.
20. Šálek C, Folber F, Froňková E et al. Early MRD response as a prognostic factor in adult patients with acute lymphoblastic leukemia. Europ J Haematol 2016; 96 (3): 276–284. doi: 10.1111/ejh.12587.
21. Šálek C, Folber F, Froňková E et al. Low levels of minimal residual disease after induction chemotherapy for BCR-ABL1-negative acute lymphoblastic leukaemia in adults are clinically relevant. Br J Haematol 2022; 196 (3): 706–710. doi: 10.1111/bjh.17966.
22. Patel B, Rai L, Buck G et al. Minimal residual disease is a significant predictor of treatment failure in non T-lineage adult acute lymphoblastic leukaemia: final results of the international trial UKALL XII/ECOG2993. Br J Haematol 2010; 148 (1): 80–89. doi: 10.1111/j.1365-2141.2009. 07941.x.
23. Ribera JM, Morgades M, Montesinos P et al. A pediatric regimen for adolescents and young adults with Philadelphia chromosome-negative acute lymphoblastic leukemia: results of the ALLRE08 PETHEMA trial. Cancer Med 2020; 9 (7): 2317–2329. doi: 10.1002/cam4.2814.
24. Bassan R, Rossi G, Pogliani EM et al. Chemotherapy-phased imatinib pulses improve long-term outcome of adult patients with Philadelphia chromosome-positive acute lymphoblastic leukemia: Northern Italy Leukemia Group protocol 09/00. J Clin Oncol 2010; 28 (22): 3644–3652. doi: 10.1200/JCO.2010.28.1287.
25. Chalandon Y, Thomas X, Hayette S et al. Randomized study of reduced-intensity chemotherapy combined with imatinib in adults with Ph-positive acute lymphoblastic leukemia. Blood 2015; 125 (24): 3711–3719. doi: 10.1182/blood-2015-02-627935.
26. Pfeifer H, Raum K, Markovic S et al. Genomic CDKN2A/2B deletions in adult Ph (+) ALL are adverse despite allogeneic stem cell transplantation. Blood 2018; 131 (13): 1464–1475. doi: 10.1182/blood-2017-07-796862.
27. Foà R, Bassan R, Vitale A et al. Dasatinib-blinatumomab for Ph-positive acute lymphoblastic leukemia in adults. N Engl J Med 2020; 383 (17): 1613–1623. doi: 10.1056/NEJMoa2016272.
28. Hovorková L, Žaliová M, Venn NC et al. Monitoring of childhood ALL using BCR-ABL1 genomic breakpoints identifies a subgroup with CML-like biology. Blood 2017; 129 (20): 2771–2781. doi: 10.1182/blood-2016-11-749978.
29. Dhédin N, Huynh A, Maury S et al. Role of allogeneic stem cell transplantation in adult patients with ph-negative acute lymphoblastic leukemia. Blood 2015; 125 (16): 2486–2496. doi: 10.1182/blood-2014-09-599 894.
30. Šálek C, Šponerová D, Soukupová Maaloufová J. Akutní lymfoblastická leukémie – historie a současnost. Vnitř Lék 2012; 58 (Suppl 2): 2S20–2S26.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2023 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Editorial
- Využití botulotoxinu při léčbě nežádoucích účinků radioterapie
- Transformace indolentního folikulární lymfomu v difuzní velkobuněčný B-lymfom – molekulární podstata „nádorové agresivity“
- Jak neznámý je karcinom neznámého primárního zdroje metastazující do krčních uzlin?
- Stereotaktická radioterapie v léčbě časného stadia nemalobuněčného karcinomu plic
- Cirkulární RNA hsa-circ-0006203 – hsa-circ-0004872 jako nové biomarkery detekce karcinomu dutiny ústní
- Léčba dospělých pacientů s akutní lymfoblastovou leukemií v České republice v letech 2007–2020
- Alveolárny sarkóm mäkkých tkanív u dieťaťa – opis prípadu
- Raritní případ uroteliálního karcinomu metastazujícího do stěny žlučníku s projevy akutní cholecystitidy
- Aktuality z odborného tisku
- Nová možnost kombinované léčby pro pacienty s metastatickým renální karcinomem v 1. linii léčby: lenvatinib s pembrolizumabem – výsledky studie CLEAR
- Jubilant doc. MUDr. Bohuslav Konopásek, CSc.
- Životní jubileum první dámy české onkologie
- Spomienka na akademika MUDr. Viliama Ujházyho, DrSc. (1926–2023)
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Transformace indolentního folikulární lymfomu v difuzní velkobuněčný B-lymfom – molekulární podstata „nádorové agresivity“
- Léčba dospělých pacientů s akutní lymfoblastovou leukemií v České republice v letech 2007–2020
- Stereotaktická radioterapie v léčbě časného stadia nemalobuněčného karcinomu plic
- Využití botulotoxinu při léčbě nežádoucích účinků radioterapie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



